Электрохимия, 2021, T. 57, № 7, стр. 429-436
Влияние состава электролита на параметры аккумулятора системы полиимид–литий
Г. Р. Баймуратова a, *, А. В. Мумятов a, Р. Р. Капаев a, b, П. А. Трошин a, О. В. Ярмоленко a, **
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Сколковский институт науки и технологии, Сколковский инновационный центр
143026 Москва, Сколково, здание 3, Россия
* E-mail: guzalia.rb@yandex.ru
** E-mail: oyarm@icp.ac.ru
Поступила в редакцию 03.05.2020
После доработки 11.09.2020
Принята к публикации 14.02.2021
Аннотация
Изучено влияние состава жидкого апротонного электролита на работу Li-аккумулятора с полиимидным (PI) катодом. В качестве электролитных систем использовали: 1 М LiN(CF3SO2)2 (LiTFSI) в смеси диоксолан/диметоксиэтан (2 : 1) и 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (1 : 1). Ячейки Li//PI были исследованы методами циклической вольтамперометрии (ЦВА), электрохимической импедансной спектроскопии с лестничной разверткой потенциала и гальваностатическим циклированием. Методом электрохимического импеданса в ячейках Li//Li показано, что сопротивление твердоэлектролитного слоя на границе с литиевым электродом в LiPF6-электролите на порядок больше, чем для границы с LiTFSI-электролитом. Метод сканирующей электронной микроскопии (СЭМ) подтверждает образование этого слоя и на PI-катоде. Методом ЦВА показано, что состав электролита сильно влияет на обратимость окислительно-восстановительных процессов. При циклировании прототипов Li//PI-аккумуляторов лучшие показатели по стабильности разрядной емкости у прототипа с LiTFSI-электролитом, что говорит о перспективности данного состава для Li-полиимидной системы.
ВВЕДЕНИЕ
Интерес к разработке новых органических электроактивных материалов за последнее время сильно возрос благодаря их экологичности, доступности, высокой удельной емкости и гибкости [1–3]. Полиимиды с функциональными карбонильными группами, способными обратимо присоединять ионы лития, являются перспективным классом органических электроактивных соединений вследствие сочетания высокой емкости, стабильности при циклическом заряде/разряде и достаточно высокого потенциала разряда [4]. Полиимиды получили широкое распространение как технический пластик с хорошими механическими свойствами и с высокой термостабильностью.
Их синтезируют по реакции поликонденсации диангидридов с диаминами. Полиимиды подвергаются двум обратимым окислительно-восстановительным (редокс) процессам с участием двух одноэлектронных этапов восстановления с образованием анион-радикала и дианиона, соответственно. Первое восстановление полностью обратимо, тогда как второе может приводить к сильной трансформации структуры. Поэтому в процессах хранения заряда желательно использовать только первую окислительно-восстановительную стадию. В качестве активных материалов органических аккумуляторов изучено несколько различных полиимидов, полученных методом поликонденсации из диангидрида 1,4,5,8-нафталинтетракарбоновой кислоты и соответствующих диаминов [4–10]. Среди них можно выделить полиимид PI [9–15] с “устойчивой” по отношению к редокс-превращениям структурой ввиду присутствия этиленового –C2H4-мостика между диимидными звеньями, в то время как у структуры нафталиндиимида со связью N–N в ходе литирования происходит восстановительная фрагментация основной полимерной цепи [16] с дальнейшим растворением низкомолекулярных фрагментов.
Структура полиимида PI.
Ранее было показано [17], что, несмотря на то, что данный полиимид обладает более “устойчивой” структурой, во время циклирования ячейки Li//PI в электролите состава 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (1 : 1) происходит сильное падение разрядной емкости – на 40% за 100 циклов. Введение LiPF6-электролита в матрицу на основе сополимера поливинилиденфторида с гексафторпропиленом улучшило стабильность емкости [18], но возникли диффузионные ограничения величины тока заряда–разряда. В работе [4] показаны хорошие результаты по стабильности емкости во время циклирования ячейки Li//PI в электролите состава 1 М LiN(CF3SO2)2 в смеси диоксолан/диметоксиэтан (2 : 1), но большинство работ по исследованию органических катодов проводятся в LiPF6-электролитах с карбонатными растворителями. Поэтому возникла необходимость сравнительного изучения влияния этих двух составов на работу Li//PI-ячеек. Исследование проводили методами ЦВА, СЭМ, электрохимической импедансной спектроскопии и гальваностатического циклирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Компоненты электродов и электролитов
В качестве анодов использовали прокатанную литиевую фольгу производства ОАО “Литий-элемент” (Саратов). Все работы с литием проводили в аргоновом боксе MBraun (Германия).
Компоненты катода: полиимид PI, сажа марки Timcal Super C65 (MTI Corporation); полимерное связующее поливинилидендифторид (ПВДФ) марки HSV 900 (KynarFlex).
Полиимид PI был синтезирован по методике (схема 1 ), подробно описанной в работе [18].
Схема 1 . Синтез полиимида PI.
Составы жидких электролитов: 1) 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (ЭК/ДМК) (1 : 1); 2) 1 М LiTFSI в смеси диоксолан/диметоксиэтан (ДОЛ/ДМЭ) (2 : 1).
Методика приготовления PI-катода
Состав катода PI: сажа: ПВДФ = 45 : 45 : 10 мас. %. В бюксе готовили раствор ПВДФ в N-метилпирролидоне (NMP), из расчета 1.5 мл растворителя на 0.2 г катодного материала, перемешивая смесь 24 ч при 50°С на магнитной мешалке до полного растворения полимера. Затем катодную массу наносили на алюминиевую подложку (d = 20 мкм) с помощью прибора Doctor Blade и сушили при нагревании 150°С в течение 4 ч для удаления растворителя (определяется визуально). Затем катоды прессовали на вальцах. Прессованные катоды сушили в сушильном шкафу в течение 10 ч при температуре 120°С для полного удаления остатков растворителя NMP. Загрузка полиимида составила около 0.15 мг/см2.
Оборудование
Сборку прототипов Li//PI-аккумуляторов и Li//Li-ячеек дискового типа СR2032 проводили в аргоновом перчаточном боксе MBraun (Германия).
Катод сушили в сушильном шкафу марки ТЕРМИКС СНОЛ-3,5.3,5.3,5/3,5-И5М (Россия).
Для измерения методом электрохимического импеданса в симметричных ячейках Li//Li использовали импедансметр Z-2000 фирмы Electrochemical Instruments – Elins (Россия) (интервал частот 1 Гц–2 МГц) с амплитудой сигнала 10 мВ. Результаты измерений обрабатывали по программе ZView2.
Изучение прототипов Li//PI-аккумуляторов методом электрохимического импеданса с лестничной разверткой потенциала (staircase potentio electrochemical impedance spectroscopy, SPEIS) проводили на станции BioLogic VMP3 в диапазоне частот 500 кГц–10 мГц с амплитудой сигнала 10 мВ. Первый цикл измерений импеданса прототипа аккумулятора (процесс литирования) проводили от значения напряжения разомкнутой цепи (НРЦ) 2.3 до 1.5 В с шагом 38 мВ. После первого цикла измерений каждый прототип аккумулятора выдерживали в течение 2 ч, НРЦ при этом непрерывно увеличивалось с 1.5 до 1.75 В. Второй цикл измерений (процесс делитирования) проводили от НРЦ = 1.75 до 3.5 В с шагом 35 мВ. Перед измерением каждого спектра импеданса прототипы аккумуляторов выдерживали в течение 15 мин. Спектры записывались с коррекцией дрейфа.
Циклические вольтамперограммы снимали на потенциостате Potentiostat P-2Х (Elins, Россия) при скорости развертки 0.1–1.0 мВ/с.
Тестирование прототипов литий-органических аккумуляторов проводили на приборе “Batteries Testing System” марки BTS 5V10mA (с ограничением по потенциалу 5 В и по току – 10 мА) фирмы Shenzhen Neware electronic Co., LTD (Китай) в гальваностатическом режиме при различных значениях тока. Ток заряда/разряда рассчитывали из теоретического значения удельной емкости с учетом массы полиимида на электроде (mакт):
где n – количество ионов Li+, участвующих в редокс-процессе. Стеор = 183 мА ч/г – теоретическая емкость 2-электронного перехода.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы было проведено исследование прототипов Li//PI-аккумуляторов методом ЦВА.
Каждое мономерное звено в полиимиде может теоретически подвергаться 4-электронному восстановлению, принимая 4 иона лития. При этом теоретическая удельная емкость увеличивается в 2 раза до ~366 мА ч/г, по сравнению с 2-электронным процессом. Но на практике в основном реализуется только 2-электронный окислительно-восстановительный процесс (схема 2 ), что было показано экспериментально и теоретически с помощью квантово-химических расчетов [17–21].
Схема 2 . Электрохимическое восстановление и окисление полиимида PI.
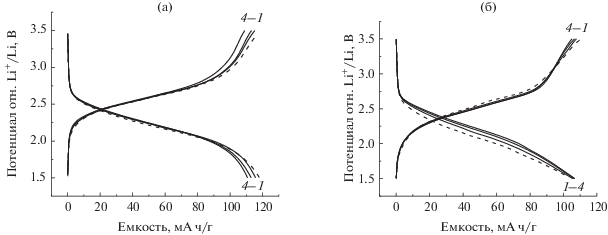
На рис. 1 представлены вольт-амперные характеристики полиимидного катода в двух составах жидкого электролита: а) 1 M LiPF6 в ЭК/ДМК (1 : 1) и б) 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) в диапазоне потенциалов 1.5–3.5 В отн. Li+/Li. Li//PI-ячейки были протестированы при разных скоростях развертки потенциала, но наилучшее разрешение пиков для полиимидного катода наблюдалось при скорости 0.1 мВ/с для ячейки с LiPF6-электролитом и 1.0 мВ/с для LiTFSI-электролита.
Рис. 1.
ЦВА полиимидного катода в электролитах: а) 1 M LiPF6 в ЭК/ДМК (1 : 1); б) 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1) в диапазоне 1.5–3.5 В отн. Li+/Li при скорости сканирования 0.1 и 1 мВ/с соответственно. Первый цикл (рис. 1а) обозначен пунктирной линией.

Из рис. 1 видно, что для ЦВА полимидного катода в LiPF6-электролите характерно смещение второго и последующего цикла, что вероятно относится к структурной перестройке активного катодного материала [18], в то время как для LiTFSI-электролита этого не наблюдается. Кроме этого, расстояние между анодными и катодными пиками 2-электронных редокс-процессов для PI (схема 2 ) в LiTFSI-электролите составляет 0.23 и 0.30 В, в то время как для LiPF6-электролита 0.70 и 0.54 В, что свидетельствует о том, что в LiTFSI-электролите обратимость редокс-процессов выше, которая проявляется даже при более высокой (на порядок) скорости развертки потенциала.
Кроме того, в LiPF6-электролите 2-электронный процесс литирования полиимида (рис. 1а) имеет 2 разрешенных пика, пики делитирования сливаются в один. В LiTFSI-электролите (рис. 1б) наблюдается обратная картина – облегчен процесс делитирования.
На рис. 2 представлены кривые заряда–разряда PI-катода с LiPF6-электролитом (а) и с LiTFSI-электролитом (б) в диапазоне 1.5–3.5 В при значении тока заряда–разряда С/5.
Рис. 2.
Кривые заряда–разряда полиимидного катода в электролитах: а) 1 M LiPF6 в ЭК/ДМК; б) 1 М LiTFSI в ДОЛ/ДМЭ в диапазоне 1.5–3.5 В при значении тока заряда–разряда С/5. Первый цикл обозначен пунктирной линией.
Из рис. 2 видно, что кривые заряда–разряда PI‑катода в разных электролитах немного отличаются друг от друга.
Следующим этапом исследования было изучение сопротивления на межфазной границе литий/электролит в симметричных ячейках с двумя литиевыми электродами. Электрохимический импеданс ячеек был измерен через сутки после сборки. Результаты представлены на рис. 3.
Рис. 3.
Годографы импеданса ячейки Li//Li, где (1) – электролит 1 М LiPF6 в ЭК/ДМК (1 : 1); (2) – 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1).

Из рис. 3 видно, что в LiPF6-электролите сопротивление поверхностного слоя составляет 880 Ом, а в LiTFSI-электролите всего 230 Ом, что в 4 раза меньше. Это свидетельствует о том, что на поверхности лития в 1 М LiPF6 в ЭК/ДМК (1 : 1) образуется твердоэлектролитный слой (solid electrolyte interphase, SEI) с большим сопротивлением, чем в 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1).
Было проведено изучение зависимости удельной емкости прототипов Li//PI-аккумуляторов с разными электролитами от значения тока заряда/разряда (С/5, С/2, 1 С, С/5) (рис. 4).
Рис. 4.
Зависимость удельной емкости от значения тока заряда–разряда прототипа аккумулятора с электролитами: (1) – 1 M LiPF6 в ЭК/ДМК (1 : 1); (2) – 1 М LiTFSI в ДОЛ/ДМЭ (2 : 1).

Из рис. 4 видно, что емкость при всех скоростях выше с LiTFSI-электролитом (среднее значение емкости при С/5, С/2 и 1 С – 125, 90 и 67 мА ч/г, соответственно). Кроме того, возврат к первоначальному значению тока С/5 показал, что прототип аккумулятора с LiPF6-электролитом полностью деградировал и не восстанавливается, а наоборот, происходит дальнейшее падение емкости до 42 мА ч/г. В LiTFSI-электролите при возвращении к значению тока С/5 емкость увеличивается до 90 мА ч/г.
Прототипы аккумуляторов после предварительных испытаний на заряд–разряд были исследованы методом электрохимического импеданса с лестничной разверткой потенциала. На рис. 5 приведены годографы SPEIS при литировании и делитировании прототипа с LiTFSI-электролитом после 200 циклов заряда–разряда и прототипа с LiPF6-электролитом после 26 циклов заряда–разряда.
Рис. 5.
Годографы SPEIS для прототипов Li//PI-аккумуляторов с 1 М LiPF6 в ЭК/ДМК (1 : 1) (а, б); c 1 M LiTFSI в ДОЛ/ДМЕ (2 : 1) (в, г), где (а, в) – процесс литирования; (б, г) – процесс делитирования.

Из рис. 5 видно, что годографы SPEIS прототипов аккумуляторов с разными составами электролитов сильно отличаются друг от друга. Из рис. 5а, 5б видно, что на границе электрод/электролит (вероятнее всего, с металлическим литием, см. рис. 3) сформировался SEI с большим сопротивлением ∼1100 Ом, в то время как для границы с LiTFSI-электролитом (рис. 5в, 5г) SEI имеет сопротивление на порядок меньше (∼100 Ом). Изменения годографов импеданса в низкочастотной области имеют аналогичный характер зависимости от внедренного лития в катод, но в случае LiTFSI-электролита (рис. 5в, 5г) эта зависимость выражена сильнее (см. масштаб по оси ReZ). Механизм этого процесса можно объяснить следующим образом. Литирование катодного материала – это вынужденный (затратный по энергии) процесс, и профиль годографа в низкочастотной области, относящийся к электродному процессу, изменяется плавно (рис. 5а, 5в). При делитировании (выгодный процесс) граница становится все более проводящей, и в области потенциалов 2.8–2.2 В прототип аккумулятора выходит на плато разряда (см. рис. 2) без диффузионных ограничений, это характеризуется исчезновением импеданса Варбурга. При дальнейшем делитировании катода (3.5 В) его материал постепенно становится “непроводящим” и снова возникают диффузионные ограничения (рис. 5б, 5г).
Было проведено исследование поверхности полиимидных катодов до и после циклирования методом СЭМ (рис. 6). Катоды после вскрытия дисковых элементов промывали этиловым спиртом и тщательно сушили.
Рис. 6.
СЭМ микрофотографии катодного материала (сканирующий автоэмиссионный электронный микроскоп ZEISS LEO SUPRA 25), где (а, б) – исходный катод; (в, г) – после циклирования в 1 М LiPF6 в ЭК/ДМК (1 : 1); (д, е) – после циклирования в 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1). Масштаб 100 и 20 нм.

Из рис. 6 видно, что катод во время циклирования в 1 М LiPF6 в ЭК/ДМК (1 : 1) также покрывается толстым слоем SEI, в отличие от электролита 1 M LiTFSI в ДОЛ/ДМЭ (2 : 1), где этот слой визуально меньше.
Были проведены ресурсные испытания прототипов Li//PI-аккумуляторов с разными электролитами в течение 120 циклов заряда–разряда. На рис. 7 приведены зависимости разрядной емкости и кулоновской эффективности прототипов аккумуляторов от номера цикла для обоих электролитов.
Рис. 7.
Зависимость разрядной емкости и кулоновской эффективности прототипов Li//PI-аккумуляторов от номера цикла для 1 M LiPF6 в ЭК/ДМК (а) и с 1 М LiTFSI в ДОЛ/ДМЭ (б) при значении тока заряда–разряда С/5. Диапазон напряжений 1.5–3.5 В отн. Li+/Li.

Из рис. 7 видно, что в течение 120 циклов заряда–разряда прототипов аккумуляторов в LiPF6-электролите происходит падение емкости с 118 мА ч/г почти на 45%, в то время как емкость ячейки с LiTFSI-электролитом стабильна и равна 110 мА ч/г.
ЗАКЛЮЧЕНИЕ
Исследовано влияние состава электролита на работу прототипа Li-аккумулятора с полиимидным катодом. Особый интерес представляет электролит 1 М LiTFSI в смеси диоксолан/диметоксиэтан (2 : 1), который предлагается для системы Li//PI взамен 1 М LiPF6 в смеси этиленкарбонат/диметилкарбонат (1 : 1).
Показано, что в LiPF6-электролите как на поверхности литиевого анода, так и на поверхности полиимидного катода образуется непроводящий, объемный слой SEI, что сильно ухудшает стабильность емкости при циклировании, в то время как для прототипа аккумулятора с LiTFSI-электролитом данных процессов не происходит.
Таким образом, показано, что состав 1 М LiTFSI в смеси диоксолан–диметоксиэтан (2 : 1) является перспективным электролитом для Li//PI-аккумуляторов, который способствует образованию тонких и проводящих слоев SEI на границе с обоими электродами, что стабилизирует процессы заряда–разряда. Эти данные подтверждаются и в других работах [4, 22] по исследованию органических катодов разного состава с LiTFSI-электролитами как в смеси растворителей диоксолан–диметоксиэтан [4], так и в смеси этиленкарбонат–диэтилкарбонат [22]. Данный эффект в первую очередь связан с преимуществами соли LiTFSI с точки зрения безопасности, ионной проводимости и термостабильности по сравнению с обычно используемой солью LiPF6 [23], а также участия анионов TFSI– в образовании более качественного и стабильного межфазного твердого электролита – SEI [24, 25].
Список литературы
Friebe, C., Lex-Balducci, A., and Schubert, U.S., Sustainable Energy Storage: Recent Trends and Developments toward Fully Organic Batteries, Chem. Sus. Chem., 2019, vol. 12, p. 4093.
Oubaha, H., Gohy, J.-F., and Melinte, S., Carbonyl-Based π-Conjugated Materials: From Synthesis to Applications in Lithium-Ion Batteries, Chem. Plus. Chem., 2019, vol. 84, p. 1179.
Haupler, B., Wild, A., and Schubert, U.S., Carbonyls: Powerful Organic Materials for Secondary Batteries, Adv. Energy Mater., 2015, vol. 5, p. 1402034.
Song, Z., Zhan, H., and Zhou, Y., Polyimides: Promising Energy-Storage Materials, Angew. Chem., Int. Ed., 2010, vol. 49, p. 8444.
Luo, J., Zhu, Y.N., Yan, C., Long, X.-Y., Lu, S., Liu, S.-P., and Ge, M.-Q., Preparation of Organic Polymer Cathode Materials for Amide Lithium-ion Battery Anode and Their Electrochemical Performance, Acta Polym. Sin., 2017, vol. 4, p. 633.
Reiner, B.R., Foxman, B.M., and Wade, C.R., Electrochemical and structural investigation of the interactions between naphthalene diimides and metal cations, Dalton T., 2017, vol. 46, iss. 29, p. 9472.
Schon, T.B., Tilley, A.J., Kynaston, E.L., and Seferos, D.S., Three-Dimensional Arylene Diimide Frameworks for Highly Stable Lithium Ion Batteries, ACS Appl. Mater. Interfaces, 2017, vol. 9, no. 18, p. 15631.
Sharma, P., Damien, D., Nagarajan, K., Shaijumon, M.M., and Hariharan, M., Perylene-polyimide-based organic electrode materials for rechargeable lithium batteries, J. Phys. Chem. Lett., 2013, vol. 4, p. 3192.
Chen, C., Zhao, X., Li, H.-B., Gan, F., Zhang, J., Dong, J., and Zhang, Q., Naphthalene-based Polyimide Derivatives as Organic Electrode Materials for Lithium-ion Batteries, Electrochim. Acta, 2017, vol. 229, p. 387.
Chen, L., Li, W., Wang, Y., Wang, C., and Xia, Y., Polyimide as anode electrode material for rechargeable sodium batteries, RSC Adv., 2014, vol. 4, p. 25369.
Dong, X., Yu, H., Ma, Y., Bao, J., Truhlar, D.G., Wang, Y., and Xia, Y., All-Organic Rechargeable Battery with Reversibility Supported by “Water-in-Salt” Electrolyte, Chem. Eur. J., 2017, vol. 23, p. 2560.
Song, Z., Xu, T., Gordin, M.L., Jiang, Y.B., Bae, I.T., Xiao, Q., Zhan, H., Liu, J., and Wang, D., Polymer-graphene nanocomposites as ultrafast-charge and -discharge cathodes for rechargeable lithium batteries, Nano Lett., 2012, vol. 12, p. 2205.
Chen, L., Bao, J.L., Dong, X., Truhlar, D.G., Wang, Y., Wang, C., and Xia, Y., Aqueous Mg-Ion Battery Based on Polyimide Anode and Prussian Blue Cathode, ACS Energy Lett., 2017, vol. 2, p. 1115.
Gheytani, S., Liang, Y., Wu, F., Jing, Y., Dong, H., Rao, K.K., Chi, X., Fang, F., and Yao, Y., An Aqueous Ca-Ion Battery, Adv. Sci., 2017, vol. 4, p. 1700465.
Huang, Y., Li, K., Liu, J., Zhong, X., Duan, X., Shakir, I., and Xu, Y., Three-dimensional graphene/polyimide composite-derived flexible high-performance organic cathode for rechargeable lithium and sodium batteries, J. Mater. Chem. A, 2017, vol. 5, p. 2710.
Shestakov, A.F., Yarmolenko, O.V., Ignatova, A.A., Mumyatov, A.V., Stevenson, K.J., and Troshin, P.A., Structural origins of the capacity fading in the lithium– polyimide battery, J. Mater. Chem. A, 2017, vol. 5, p. 6532.
Shestakov, A.F., Romanuyk, O.E., Mumyatov, A.V., Luchkin, S.Yu., Slesarenko, A.A., Yarmolenko, O.V., Stevenson, K.J., and Troshin, P.A., Theoretical and experimental evidence for irreversible lithiation of conformationally flexible polyimide: impact on the battery performance, J. Electroanal. Chem., 2019, vol. 836, p. 143.
Ярмоленко, О.В., Романюк, О.Е., Слесаренко, А.А., Баймуратова, Г.Р., Шувалова, Н.И., Мумятов, А.В., Трошин, П.А., Шестаков, А.Ф. Особенности работы Li-полиимидного аккумулятора с различными типами электролитов. Электрохимия. 2019. Т. 55. С. 394. [Yarmolenko, O.V., Romanyuk, O.E., Slesarenko, A.A., Baymuratova, G.R., Shuvalova, N.I., Mumyatov, A.V., Troshin, P.A., and Shestakov, A.F., Performance of a Li–Polyimide Battery with Electrolytes of Various Types, Russ. J. Electrochem., 2019, vol. 55, p. 254.]
Liang, Y., Zhang, P., and Chen, J., Function-oriented design of conjugated carbonyl compound electrodes for high energy lithium batteries, Chem. Sci., 2013, vol. 4, p. 1330.
Lv, M., Zhang, F., Wu, Y., Chen, M., Yao, C., Nan, J., Shu, D., Zeng, R., Zeng, H., and Chou, S.-L., Heteroaromatic organic compound with conjugated multi-carbonyl as cathode material for rechargeable lithium batteries, Sci. Rep., 2016, vol. 6, p. 23515.
Hernández, G., Casado, N., Coste, R., Shanmukaraj, D., Rubatat, L., Armand, M., and Mecerreyes, D., Redox-active polyimide–polyether block copolymers as electrode materials for lithium batteries, RSC Adv., 2015, vol. 5, p. 17096.
Xu, Z., Ye, H., Li, H., Xu, Y., Wang, C., Yin, J., and Zhu, H., Enhanced Lithium-Ion Storage Performance of Tannic Acid in LiTFSI Electrolyte, ACS Omega, 2017, vol. 2, p. 1273.
Kalhoff, J., Bresser, D., Bolloli, M., Alloin, F., Sanchez, J.-Y., and Passerini, S., Enabling LiTFSI-based electrolytes for safer lithium-ion batteries by using linear fluorinated carbonates as (Co) solvent, ChemSusChem, 2014, vol.7, p. 2939.
Lewandowski, A. and Świderska-Mocek, A., Ionic liquids as electrolytes for Li-ion batteries—An overview of electrochemical studies, J. Power Sources, 2009, vol.194, p.601.
Lahiri, A., Borisenko, N., Borodin, A., Olschewski, M., and Endres, F., Characterisation of the solid electrolyte interface during lithiation/delithiation of germanium in an ionic liquid, Phys. Chem. Chem. Phys., 2016, vol. 18, p. 5630.
Дополнительные материалы отсутствуют.





