Электрохимия, 2021, T. 57, № 8, стр. 507-516
Изучение электропроводности литий-проводящих мембран Нафион, пластифицированных бинарными и тройными смесями системы сульфолан–этиленкарбонат–диглим
Р. Р. Каюмов a, *, Л. В. Шмыглева a, Е. Ю. Евщик a, Е. А. Сангинов a, Н. А. Попов b, О. В. Бушкова b, **, Ю. А. Добровольский a
a Институт проблем химической физики РАН
Черноголовка, Россия
b Институт химии твердого тела УрО РАН
Екатеринбург, Россия
* E-mail: kayumov@icp.ac.ru
** E-mail: ovbushkova@mail.ru
Поступила в редакцию 19.11.2020
После доработки 22.01.2021
Принята к публикации 01.02.2021
Аннотация
В широком интервале температур (–60…+80°C) исследованы электротранспортные характеристики полимерных электролитов на основе мембраны Нафион-115 в форме литиевой соли, пластифицированной высококипящими диполярными апротонными растворителями – сульфоланом (SL), этиленкарбонатом (EC) и диглимом (G2), а также их двух- и трехкомпонентными смесями. Наилучшие транспортные свойства (проводимость 10–5–10–4 См см–1 в интервале –20…+70°C) продемонстрировали образцы, пластифицированные бинарными смесями EC/G2 и EC/SL некоторых составов. Использование трехкомпонентного пластификатора обеспечивает пониженные значения энергии активации (10–20 кДж моль–1) и довольно высокую проводимость в области температур не ниже –10°C.
ВВЕДЕНИЕ
Разработка нового поколения литий-ионных аккумуляторов (ЛИА) с повышенной безопасностью, расширенным интервалом рабочих температур и улучшенными энергетическими характеристиками во многом зависит от успехов в создании новых электролитических материалов. Одним из перспективных направлений является использование в ЛИА полиэлектролитных мембран, пластифицированных малолетучими высококипящими диполярными апротонными растворителями (ДАР). Присутствие ковалентно связанных с макромолекулой анионов обеспечивает униполярный катионный характер проводимости, что снимает проблему концентрационной поляризации электролита и ограничения по мощности. Кроме того, в электрохимических ячейках такие мембраны могут одновременно выполнять функции электролита и сепаратора.
Среди множества вариантов катион-проводящих полиэлектролитов особый интерес представляют полимеры с привитыми перфторированными ионгенерирующими центрами ($--{\text{C}}{{{\text{F}}}_{{\text{2}}}}{\text{SO}}_{3}^{ - },$ ‒SO2N–SO2CF3 и т.п.), так как их низкая координирующая способность обеспечивает высокую степень электролитической диссоциации при введении пластификатора [1, 2]). К числу наиболее известных полиэлектролитов, нашедших широкое практическое применение в низкотемпературных топливных элементах, сенсорах, ванадиевых редокс-батареях, ионисторах и электроорганических синтезах относятся перфторированные сульфокатионитные мембраны Нафион (“DuPont”), которые довольно легко переводятся посредством реакций ионного обмена из своей исходной кислотной формы в солевые с различными катионами (в т.ч., Li+), не теряя при этом прочности, термической и химической устойчивости [3]. Для получения хороших транспортных характеристик мембраны Нафион в форме литиевой соли (Нафион-Li+) (рис. 1а) пластифицируют различными ДАР. С этой целью используют как индивидуальные растворители, так и их смеси, что позволяет целенаправленно варьировать физико-химические свойства мембран [2–16]. Попытки использовать в качестве пластификатора Нафион-Li+ базовые смеси карбонатных растворителей циклического и линейного строения, широко применяемые в электролитных системах ЛИА массового выпуска, не дали выдающихся результатов: проводимость таких мембран составляла всего ~10–6–10–4 См см–1 при комнатной температуре [4, 5, 8, 9, 11]; при этом сохранялись присущие жидким неводным электролитам проблемы с безопасностью, обусловленные высокой летучестью и горючестью алкилкарбонатов. Более высокие значения проводимости (~10–3 См см–1 при комнатной температуре) были достигнуты при насыщении мембран диметилсульфоксидом, амидными растворителями (N,N-диметилформамид, N-метилформамид, N,N-диметилацетамид, N-метилпирролидон) и амидсодержащими смесями растворителей [4, 6, 7, 18, 20]. К сожалению, несмотря на хорошие транспортные свойства, практическое использование таких мембран в ЛИА проблематично из-за низкой электрохимической устойчивости амидов. Что касается диметилсульфоксида, то этот сильнополярный нелетучий растворитель растворяет саму мембрану уже при небольшом повышении температуры (≥60°С). В связи с этим, в макетах химических источников тока на основе перфторированных сульфокатионитных мембран обычно используют пропиленкарбонат, индивидуальный или в смеси с этиленкарбонатом [12–15]; проводимость таких мембран при комнатной температуре составляет ~10–5 и 10–4 См см–1, соответственно [4, 7, 12, 18]. Таким образом, проблема получения электрохимически устойчивых и работоспособных в широком интервале температур полимерных электролитов на основе мембран Нафион-Li+ до сих пор остается актуальной. (В этой связи важно отметить, что для полиэлектролитов с униполярным переносом ионов лития приемлемой является проводимость ≥10–5 См см–1, тогда как для биполярных проводников – не менее 10–4 См см–1 [1, 17]). К сожалению, в литературе крайне мало сведений о температурных зависимостях проводимости Нафион-Li+, пластифицированных ДАР [6, 7, 13, 14], и особенно об их транспортных свойствах в области отрицательных значений (исключения составляют работы [6, 7]); мало таких данных и для их аналогов [15, 18].
В качестве пластификаторов были выбраны электрохимически устойчивые растворители с высокими температурами кипения и низким давлением паров, традиционно используемые в электролитных системах литиевых ХИТ – этиленкарбонат (EC), сульфолан (SL) и диметиловый эфир диэтиленгликоля, или, как его часто называют, диглим (G2). EC является обязательным компонентом электролитных растворов для ЛИА массового производства, так как обеспечивает устойчивое циклирование углеродного электрода за счет формирования на нем защитного слоя из нерастворимых продуктов электровосстановления при первой катодной поляризации; SL обладает повышенной устойчивостью к окислению на аноде, тогда как G2 часто используют в качестве сорастворителя с низкой вязкостью [19]. Для насыщения мембран Нафион-Li+ использовали как индивидуальные растворители, так и их двух- и трехкомпонентные смеси различного состава.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Мембрана Нафион-115 (“DuPont”) толщиной 125 мкм была предварительно очищена от примесей, переведена в литиевую форму Нафион-Li+ и высушена по методике, описанной в работе [7].
Безводные SL (99%, “Sigma-Aldrich”), EC (99%, “Sigma-Aldrich”) и G2 (99%, “Sigma-Aldrich”) использовали без дополнительной очистки. Перед использованием все растворители выдерживали над активированными молекулярными ситами с размером пор 3 Å. Двойные и тройные смеси растворителей с различным массовым соотношением компонентов готовили путем взвешивания; EC и SL предварительно нагревали чуть выше их температур плавления (до 40 и 30°C, соответственно) и использовали в виде переохлажденных жидкостей. После 30 мин перемешивания на магнитной мешалке готовые смеси растворителей перед их использованием выдерживали не менее 24 ч при комнатной температуре. Для получения пластифицированных полиэлектролитов высушенные образцы мембран Нафион-Li+ выдерживали в индивидуальных или смешанных растворителях в течение 2 сут при 30°C; насыщение EC производили при 40°C. Все указанные операции, а также подготовку образцов к исследованиям проводили в сухом боксе в атмосфере аргона, содержание O2 и H2O составляло менее 1 ppm.
Набухание мембраны Нафион-Li+ в индивидуальных и смешанных растворителях исследовали весовым методом; измерения вели в трех параллелях. Степень набухания (W) определяли согласно формуле:
(1)
$W = \frac{{{{m}_{{{\text{sw}}}}} - {{m}_{{{\text{dry}}}}}}}{{{{m}_{{{\text{dry}}}}}}} \times 100\% ,$Молярное поглощение пластификатора λ, численно равное числу его молекул в расчете на один катион лития, рассчитывали из величины W по следующей формуле:
здесь EW – эквивалентная масса Нафиона в форме литиевой соли (равная 1106 для мембраны Нафион-115); Mrsolv – молярная масса индивидуального растворителя или усредненная молярная масса смеси растворителей.Методы
Электропроводность измеряли в поперечном направлении мембраны методом импедансной спектроскопии в интервале температур от –60…–40 до +70…+80°C в режиме охлаждения с шагом 10°C с использованием термостата-криостата Huber CC-805 (точность поддержания температуры ±0.1°C). (Температурный интервал определялся свойствами мембраны). Измерения проводили в симметричных ячейках c блокированными электродами Ti/образец/Ti; исследуемые образцы представляли собой диски диаметром 5 мм. Подготовку электродов и сборку измерительных ячеек проводили в сухом боксе в атмосфере аргона. Для измерений импеданса использовали прибор Z-3000 (ООО “Элинс”, Россия); спектры записывали в диапазоне частот 1 Гц–3 МГц при постоянной температуре после достижения термического равновесия, о чем судили по неизменности спектров. Амплитуда внешнего переменного сигнала составляла от 20 до 100 мВ. Для расчета ионной проводимости спектры экспериментальной ячейки были аппроксимированы по эквивалентной схеме, описанной в работе [20]. Удельную ионную проводимость мембран σ рассчитывали из соотношения:
где d – толщина образца, Re – сопротивление образца, S – площадь электрического контакта. Общая ошибка определения проводимости составляла не более 10%.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Молекулярные структуры растворителей, выбранных для насыщения, приведены на рис. 1; их основные физико-химические свойства представлены в табл. 1.
Рис. 1.
Структурные формулы мембраны Нафион-Li+ (а) и растворителей, используемых в качестве пластификаторов: SL (б); EC (в); G2 (г).

Таблица 1.
Свойства ДАР, выбранных в качестве пластификаторов для мембран Нафион-Li+
Как установлено в результате ряда экспериментальных и теоретических исследований [29‒34], при температурах вблизи комнатной в первую сольватную оболочку катиона Li+ входят 3–4 молекулы EC. Ее полному заполнению отвечают четыре молекулы EC, координированные к Li+ через атом кислорода карбонильной группы и образующие тетраэдрическое окружение. Вследствие эффективного экранирования заряда в таком сольватном комплексе образование второй сольватной оболочки маловероятно; в нее могут входить не более 1–2 молекул EC [29].
В отличие от монодентатного EC, молекула SL может служить бидентатным лигандом благодаря наличию группы –SO2 с двумя электронодонорными атомами кислорода (рис. 1в). К сожалению, к настоящему времени сольватация Li+ молекулами SL далеко не так хорошо изучена, как EC. В частности, существуют две прямо противоположные точки зрения о способе координации молекулы SL к Li+ [35, 36]. Согласно одной из них, SL координирован монодентатно [35], тогда как авторы [36] не исключают возможности бидентатной координации этого растворителя. Оценки кажущегося числа сольватации лития n в SL, полученные методами колебательной спектроскопии, дают величины 3.7 [36] и 3.4 [37] для растворов литиевых солей с концентрациями ≤1 m. Однако точность полученных значений n вызывает вопросы. Как справедливо отмечают авторы [36], обычные спектроскопические методы определения n для SL с двумя электронодонорными атомами O могут вносить значительную погрешность из-за склонности к формированию многоядерных ионных агрегатов с участием бидентатно координированных мостиковым литием молекул растворителя.
В отличие от EC и SL, G2 при сольватации катионов Li+ ведет себя как полидентатный лиганд за счет одновременной координации всех трех эфирных атомов кислорода, образующих 5-членные кольца [19, 37]. Такие сольватные комплексы очень устойчивы благодаря ярко выраженному хелатному эффекту. Сольватация катиона лития глимами довольно хорошо изучена (см., например, [38–43]). Установлено, что трифлат лития LiCF3SO3 (близкий к литиевой форме Нафиона по своей химической природе) в концентрированных растворах в G2 находится преимущественно в виде сольватированных контактных ионных пар, где катион лития координирован тремя атомами кислорода молекулы G2 и одним атомом кислорода аниона ${\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{SO}}_{3}^{ - },$ а также в виде ионных ассоциатов более высокого порядка [38, 39, 43]. При этом добавление второго растворителя, например пропиленкарбоната, не оказывает существенного влияния на координацию G2 с LiCF3SO3 [43].
На рис. 2 в координатах треугольника Гиббса представлены выбранные в данной работе составы пластификаторов. Можно видеть, что они обеспечивают получение достаточно полных данных для тройной системы SL/EC/G2. В табл. 2 суммированы основные характеристики мембран Нафион-Li+, пластифицированных индивидуальными растворителями и их бинарными и тройными смесями (нумерация образцов в табл. 2 и на рис. 1 совпадает; она же использована на всех остальных рисунках).
Рис. 2.
Выбранные составы пластификаторов системы SL–EC–G2 в координатах треугольника Гиббса (номера в кружочках – нумерация исследуемых образцов в соответствии с табл. 2).

Таблица 2.
Характеристика исследуемых образцов пластифицированной мембраны Нафион
| № образца | Состав пластификатора (масс. доли) | W30 °C, мас. % | λ30°C | σ30°C, См см–1 | σ–40°C, См см–1 | Рабочий интервал температур*, °C |
|---|---|---|---|---|---|---|
| Индивидуальные растворители | ||||||
| 1 | SL | 82.2 | 7.6 | 4.1 × 10–5 | 7.2 × 10–7 | –10…+80 |
| 2 | EC | 132.5* | 16.6** | 1.9 × 10–4 | – | +10…+70 |
| 3 | G2 | 24.1 | 2.0 | 2.1 × 10–6 | 9.0 × 10–9 | +60…+70 |
| Смеси EC/G2 | ||||||
| 4 | 0.2/0.8 | 40.8 | 3.6 | 1.2 × 10–4 | 4.3 × 10–6 | –20…+70 |
| 5 | 0.4/0.6 | 57.7 | 5.5 | 2.0 × 10–4 | 1.1 × 10–9 | –10…+70 |
| 6 | 0.6/0.4 | 66.0 | 6.9 | 2.6 × 10–4 | 4.7 × 10–8 | +10…+70 |
| 7 | 0.8/0.2 | 77.1 | 8.8 | 4.7 × 10–4 | 5.9 × 10–7 | 0…+70 |
| Смеси SL/G2 | ||||||
| 8 | 0.2/0.8 | 30.4 | 2.6 | 6.0 × 10–6 | 7.4 × 10–8 | +40…+70 |
| 9 | 0.4/0.6 | 29.5 | 2.5 | 1.4 × 10–5 | 2.1 × 10–7 | +30…+70 |
| 10 | 0.6/0.4 | 41.9 | 3.7 | 2.6 × 10–5 | 4.1 × 10–7 | 0…+70 |
| 11 | 0.8/0.2 | 41.2 | 3.7 | 2.4 × 10–5 | 1.7 × 10–7 | 0…+70 |
| Смеси EC/SL | ||||||
| 12 | 0.2/0.8 | 65.9 | 6.4 | |||
| 13 | 0.4/0.6 | 70.5 | 7.3 | 1.1 × 10–4 | 3.3 × 10–6 | –20…+80 |
| 14 | 0.6/0.4 | 71.4 | 7.8 | 1.5 × 10–4 | 6.3 × 10–4 | –20 (–30)…+80 |
| 15 | 0.8/0.2 | 74.5 | 8.7 | 2.4 × 10–4 | – | +10…+80 |
| Смеси SL/EC/G2 | ||||||
| 16 | 0.2/0.6/0.2 | 55.8 | 6.0 | 1.71 × 10–4 | 2.9 × 10–9 | 0…+70 |
| 17 | 0.4/0.4/0.2 | 50.9 | 5.1 | 1.49 × 10–4 | 1.3 × 10–7 | –10…+70 |
| 18 | 0.6/0.2/0.2 | 45.0 | 4.3 | 7.69 × 10–5 | 8.2 × 10–7 | 0…+70 |
| 19 | 0.4/0.2/0.4 | 48.1 | 4.5 | 1.09 × 10–4 | 2.1 × 10–6 | –10…+70 |
| 20 | 0.2/0.4/0.4 | 57.2 | 5.6 | 1.48 × 10–4 | 3.1 × 10–7 | –10…+70 |
| 21 | 0.2/0.2/0.6 | 46.5 | 4.2 | 4.78 × 10–5 | 1.9 × 10–6 | –10…+70 |
Как видно из табл. 2, степень набухания мембран в индивидуальных растворителях увеличивается в ряду G2 < SL < EC от 24 до 132.5 мас. %. Эти величины соответствуют значениям молярного поглощения пластификатора λ от 2.0 (для G2) до 16.6 (для EC). На основании приведенных выше литературных данных [29–43] можно заключить, что во всех случаях значения λ выше, чем числа сольватации лития в соответствующих растворителях. Таким образом, имеет место некоторая избыточная по отношению к сольватации Li+ сорбция растворителя мембраной Нафион-Li+; это дает основания предполагать, что поглощенного растворителя достаточно для формирования каналов проводимости в структуре пленки.
Самое высокое значение W отвечает насыщению Нафион-Li+ этиленкарбонатом при 40°C, тогда как насыщение другими растворителями производилось при 30°С. Повышенная температура смешения была использована из-за невоспроизводимости значений W, полученных при насыщении мембраны переохлажденным EC при 30°C (температура плавления EC составляет 36.4°C, см. табл. 1). Ионная проводимость образцов 1–3 (рис. 3) коррелирует со степенью набухания: если для мембраны Нафион-Li+/EC (образец 2) она достигает значений порядка 10–4 См см–1, то для Нафион-Li+/SL (образец 1) значения σ заметно ниже, а для Нафион-Li+/G2 (образец 3) они не превышают 10–5 См см–1. Однако, несмотря на достаточно высокие транспортные характеристики, мембраны Нафион-Li+/EC не представляют большого практического интереса из-за очень узкого рабочего интервала температур (выше +10°C). (За рабочий принимали такой интервал температур, в котором проводимость исследуемого образца составляла ≥1 × 10–5 См см–1). Он несколько шире у Нафион-Li+/SL (до –10°C), однако проводимость такого электролита заметно ниже (рис. 3). Значения энергии активации для мембран, пластифицированных EC, SL и G2, составляют 21.3, 33.2 и 46.3 кДж моль–1 соответственно. Таким образом, использование индивидуальных растворителей EC, SL и G2 в качестве пластификаторов для Нафион-Li+ не позволяет получить электролиты с высокой проводимостью в широком интервале температур.
Применение бинарных смесей EC/G2 для насыщения мембран Нафион-Li+ заметно улучшает их транспортные характеристики (рис. 4). При положительных температурах проводимость образцов 5–7 оказалась даже выше, чем у мембраны, пластифицированной индивидуальным EC (образец 2), при близких значениях Ea, хотя степень набухания мембраны в смесях EC/G2 намного меньше, чем в EC (табл. 2). В отрицательной области температур смеси EC/G2, за исключением состава 0.8/0.2 (образец 5), также оказались более эффективны, чем индивидуальные компоненты (рис. 4 и табл. 2). В целом, наилучшие транспортные свойства и самый широкий интервал рабочих температур (от –20 до +70°C) продемонстрировал образец 4, пластифицированный смесью EC/G2 c наименьшим содержанием EC (0.2/0.8). Как видно из рис. 4, на температурной зависимости проводимости этого образца наблюдается излом в области 0°C, тогда как кривые для всех остальных смесей имеют разрывы при –20…+20°C (рис. 4).
Рис. 4.
Температурные зависимости проводимости мембран Нафион-Li+, пластифицированных EC (2), G2 (3) и их бинарными смесями различного состава: EC/G2 = 0.2/0.8 (4), EC/G2 = 0.4/0.6 (5), EC/G2 = 0.6/0.4 (6), EC/G2 = 0.8/0.2 (7) (нумерация кривых соответствует нумерации образцов в табл. 2 и на рис. 2).

Степень набухания мембран Нафион-Li+ в бинарной смеси EC/SL слабо зависит от соотношения компонентов и укладывается в узкий интервал 65–75 мас. %. Температурные зависимости проводимости этих образцов приведены на рис. 5; все они имеют аррениусовский характер. Энергии активации проводимости мембран, насыщенных бинарными смесями EC/SL, закономерно растут с увеличением содержания SL, укладываясь при этом в интервал значений между Ea образцов 1 и 2, пластифицированных индивидуальными EC и SL (21.3–33.2 кДж моль–1). Как и в случае бинарных смесей EC/G2, один из апробированных составов пластификатора EC/SL = 0.8/0.2 (образец 15) позволил получить мембрану с проводимостью выше, чем у образца 2, пластифицированного индивидуальным EC. Однако этот эффект наблюдался только в области положительных температур. Чуть более низкую проводимость продемонстрировал образец 14 (EC/SL = 0.6/0.4) с довольно широким рабочим интервалом температур –20 (–30)…+80°C.
Наименьшие значения степени набухания (30–42 мас. %, табл. 2) и самая низкая проводимость были получены при использовании в качестве пластификаторов смесей SL/G2 (рис. 6). Как видно из рисунка, все кривые температурных зависимостей проводимости для мембран, пластифицированных такими бинарными смесями, лежат между кривыми для индивидуальных SL и G2. Если для образца 8 зависимость прямолинейная, то для образцов 9 и 10 с более высоким содержанием SL на кривых появляется небольшой излом в области 0…–10°С, а для образца 11 наблюдается разрыв при –20…–30°C (рис. 6). Все электролиты этой серии характеризуются низкими значениями проводимости и очень узкими рабочими интервалами температур, поэтому не представляют практического интереса.
Рис. 6.
Температурные зависимости проводимости мембран Нафион-Li+, пластифицированных SL (1), G2 (3) и их бинарными смесями различного состава: SL/G2 = 0.2/0.8 (8), SL/G2 = 0.4/0.6 (9), SL/G2 = = 0.6/0.4 (10), SL/G2 = 0.8/0.2 (11) (нумерация кривых соответствует нумерации образцов в табл. 2 и на рис. 2).

Изотермы проводимости при 30°C для мембран Нафион-Li+, пластифицированных бинарными смесями растворителей, приведены на рис. 7. Можно видеть, что смеси, содержащие EC, обеспечивают более высокие значения проводимости. Максимальные значения достигаются при добавлении к EC небольших количеств сорастворителя (G2 или SL), однако такие образцы обладают высокой проводимостью только при положительных температурах.
Рис. 7.
Изотермы ионной проводимости при 30°С для мембран Нафион-Li+, пластифицированных бинарными смесями растворителей S1/S2, где S1 и S2 – EC, SL и G2.

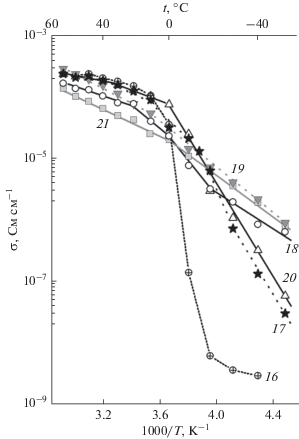
В трехкомпонентных смесях растворителей степень набухания несколько меньше, чем в оптимальных бинарных смесях EC/SL и EC/G2, и варьируется в узком интервале 45–57 мас. % (табл. 2). Тем не менее тройные составы SL/EC/G2, за исключением самого обогащенного G2 0.2/0.2/0.6 (образец 21), дают мембраны с достаточно высокими транспортными характеристиками в области положительных температур (рис. 8). Энергия активации проводимости в этих условиях составляет всего ~10–20 кДж моль–1, что существенно ниже величин для мембран, пластифицированных индивидуальными компонентами (~20–46 кДж моль–1). По-видимому, это обусловлено отмеченной в работе [43] преимущественной сольватацией катионов лития полидентатными молекулами G2 с образованием более компактной сольватной оболочки, состоящей только из одной молекулы этого растворителя, “обернутой” вокруг Li+. Вероятно, такая конфигурация существенно облегчает перенос сольватированных катионов Li+ в структуре мембраны Нафион-Li+. Однако рабочая область температур для образцов 16–21 не простирается ниже –10°C, а температурные зависимости проводимости имеют сложную форму (за исключением образцов 19 и 20, для которых они прямолинейны, с небольшим изломом вблизи 0°C). Среди этой серии оптимальными транспортными свойствами в широком температурном интервале –10…+70°C обладает образец 19, насыщенный смесью состава 0.4/0.2/0.4.
Рис. 8.
Температурные зависимости проводимости мембран Нафион-Li+, пластифицированных тройными смесями SL/EC/G2 следующих составов: 0.2/0.6/0.2 (16); 0.4/0.4/0.2 (17); 0.6/0.2/0.2 (18); 0.4/0.2/0.4 (19); 0.2/0.4/0.4 (20); 0.2/0.2/0.6 (21) (нумерация кривых соответствует нумерации образцов в табл. 2 и на рис. 2).
Ограничения рабочих температур мембран, пластифицированных бинарными и тройными смесями высококипящих растворителей (EC, SL, G2) в низкотемпературной области вызваны, по-видимому, фазовыми переходами первого рода (разрывы на температурных зависимостях проводимости) или неустановленными структурными перестройками без фазового разделения, вызывающими изменения механизмов переноса ионов (изломы на кривых). Фазовые переходы первого рода, скорее всего, связаны с выделением избыточного пластификатора из пленки при охлаждении до температуры кристаллизации. Этот процесс легко наблюдать для мембран Нафион-Li+, насыщенных EC, уже при температуре вблизи комнатной.
ЗАКЛЮЧЕНИЕ
Среди изученных растворителей наилучшими пластификаторами для мембраны Нафион в форме литиевой соли оказались бинарные смеси EC/G2 с отношением компонентов 0.2/0.8 и EC/SL с отношением компонентов 0.6/0.4; они позволили получить полимерные электролиты с рабочим интервалом температур от –20 до +70 (+80)°C. Трехкомпонентные пластификаторы состава SL/EC/G2 значительно снижают энергию активации проводимости в области положительных температур и обеспечивают достаточно высокие значения проводимости в этих условиях, однако хорошие транспортные свойства у таких мембран сохраняются только до –10°C.
Список литературы
Zhang, H., Li, C., Piszcz, M., Coya, E., Rojo, T., Rodriguez-Martinez, L.M., Armand, M., and Zhou, Z., Single lithium-ion conducting solid polymer electrolytes: advances and perspectives, Chem. Soc. Rev., 2017, vol. 46, p. 797.
Воропаева, Д.Ю., Новикова, С.А., Ярославцев, А.Б. Полимерные электролиты для металл-ионных аккумуляторов. Успехи химии. 2020. Т. 89. № 10. С. 1132. [Voropaeva, D.Y., Novikova, S.A., and Yaroslavtsev, A.B., Polymer electrolytes for metal-ion batteries, Russ. Chem. Rev., 2020, vol. 89. Iss. 10, p. 1132.]
Kusoglu, A. and Weber, A.Z., New insights into perfluorinated sulfonic-acid ionomers, Chem. Rev., 2017, vol. 117, p. 987.
Doyle, M., Lewittes, M.E., Roelofs, M.G., Perusich, S.A., and Lowrey, R.E., Relationship between ionic conductivity of perfluorinated ionomeric membranes and nonaqueous solvent properties, J. Membr. Sci., 2001, vol. 184, p. 257.
Sachan, S., Ray, C.A., and Perusich, S.A., Lithium ion transport through nonaqueous perfluoroionomeric membranes, Polym. Eng. Sci., 2002, vol. 42, p. 1469.
Sanginov, E.A., Kayumov, R.R., Shmygleva, L.V., Lesnichaya, V.A., Karelin, A.I., and Dobrovolsky, Yu.A., Study of the transport of alkali metal ions in a nonaqueous polymer electrolyte based on Nafion, Solid State Ionics, 2017, vol. 300, p. 26.
Сангинов, Е.А., Евщик, Е.Ю., Каюмов, Р.Р., Добровольский, Ю.А. Литий-ионная проводимость мембраны Нафион, набухшей в ряде органических растворителей. Электрохимия. 2015. Т. 51. С. 1115. [Sanginov, E.A., Evshchik, E.Yu., Kayumov, R.R., and Dobrovol’skii, Yu.A., Lithium-ion conductivity of the Nafion membrane swollen in organic solvents, Russ. J. Electrochem., 2015, vol. 51, p. 986.]
Liu, Y., Cai, Z., Tan, L., and Li, L., Ion exchange membranes as electrolyte for high performance Li-ion batteries, Energy Environ. Sci., 2012, vol. 5, p. 9007.
Doyle, M., Lewittes, M.E., Roelofs, M.G., and Perusich, S.A., Ionic conductivity of nonaqueous solvent-swollen ionomer membranes based on fluorosulfonate, fluorocarboxylate, and sulfonate fixed ion groups, J. Phys. Chem. B, 2001, vol. 105, p. 9387.
Su, L., Darling, R.M., Gallagher, K.G., Xie, W., Thelen, J.L., Badel, A.F., Barton, J.L., Cheng, K.J., Balsara, N.P., Moore, J.S., and Brushett, F.R., An investigation of the ionic conductivity and species crossover of lithiated Nafion 117 in nonaqueous electrolytes, J. Electrochem. Soc., 2016, vol. 163, p. A5253.
Voropaeva, D.Y., Novikova, S.A., Kulova, T.L., and Yaroslavtsev, A.B., Conductivity of Nafion-117 membranes intercalated by polar aprotonic solvents, Ionics, 2018, vol. 24, p. 1685.
Gao, J., Sun, C., Xu, L., Chen, J., Wang, C., Guo, D., and Chen, H., Lithiated Nafion as polymer electrolyte for solid-state lithium sulfur batteries using carbon-sulfur composite cathode, J. Power Sources, 2018, vol. 382, p. 179.
Gao, J., Shao, Q., and Chen, J., Lithiated Nafion-garnet ceramic composite electrolyte membrane for solid-state lithium metal battery, J. Energy Chem., 2020, vol. 46, p. 237.
Liang, H.-Y., Qiu, X.-P., Zhang, S.-C., Zhu, W.-T., and Chen, L.-Q., Study of lithiated Nafion ionomer for lithium batteries, J. Appl. Electrochem., 2004, vol. 34, p. 1211.
Cai, Z., Liu, Y., Liu, S., Li, L., and Zhang, Y., High performance of lithium-ion polymer battery based on non-aqueous lithiated perfluorinated sulfonic ion-exchange membranes, Energy Environ. Sci., 2012, vol. 5, p. 5690.
Navarrini, W., Scrosati, B., Panero, S., Ghielmi, A., Sanguineti, A., and Geniram, G., Lithiated short side chain perfluorinated sulfonic ionomeric membranes: Water content and conductivity, J. Power Sources, 2008, vol. 178, p. 783.
Doyle, M., Fuller, T.F., and Newman, J., The importance of the lithium ion transference number in lithium/polymer cells, Electrochim. Acta, 1994, vol. 39, p. 2073.
Voropaeva, D.Y., Novikova, S.A., Xu, T., and Yaroslavtsev, A.B., Polymer electrolytes for LIBs based on perfluorinated sulfocationic Nepem-117 membrane and aprotic solvents, J. Phys. Chem. B, 2019, vol. 123, p. 10217.
Henderson, W.A., Brooks, N.R., Brennessel, W.W., and Young, V.G., Jr., LiClO4 electrolyte solvate structures, J. Phys. Chem. A, 2004, vol. 108, p. 225.
Kayumov, R.R., Sanginov, E.A., Shmygleva, L.V., Radaeva, A.P., Karelin, A.I., Zyubin, A.S., Zyubina, T.S., Anokhin, D.V., Ivanov, D.A., and Dobrovolsky, Yu.A., Ammonium form of Nafion plasticized by dimethyl sulfoxide, J. Electrochem. Soc., 2019, vol. 166, p. F3216.
Гордон, А., Форд, Р. Спутник химика, М.: Мир, 1976. 541 c. [Gordon, A.J. and Ford, R.A., The Chemist’s Companion: A Handbook of Practical Data, Techniques, and References, N.Y.: Wiley, 1972. 537 p.]
Hess, S., Wohlfahrt-Mehrens, M., and Wachtler, M., Flammability of Li-ion battery electrolytes: flash point and self-extinguishing time measurements, J. Electrochem. Soc., 2015, vol. 162, p. A3084.
Watanabe, Y., Kinoshita, S.-I., Wada, S., Hoshino, K., Morimoto, H., and Tobishima S.-I., Electrochemical properties and lithium ion solvation behavior of sulfone-ester mixed electrolytes for high-voltage rechargeable lithium cells, J. Power Sources, 2008, vol. 179, p. 770.
Maca, J., Frk, M., and Sedlarikova, M., Properties of electrolytes for Li–ion batteries with higher fire safety, Renewable Energy Power. Qual. J., 2013, vol. 1, no. 11, p. 218.
Демахин, А.Г., Овсянников, В.М., Пономаренко, С.М. Электролитные системы литиевых ХИТ, Саратов: Изд-во Сарат. ун-та, 1993. 220 с. [Demakhin, A.G., Ovsyannikov, V.M., and Ponomarenko, S.M., Electrolyte systems of lithium chemical power sources (in Russian), Saratov: Izd-vo Sarat. un-ta, 1993. 220 p.]
Huang, Y., Zhao, L., Li, L., Xie, M., Wu, F., and Chen, R., Electrolytes and electrolyte/electrode interfaces in sodium-ion batteries: from scientific research to practical application, Adv. Mater., 2019, vol. 31, p. 1808393.
Johnson, P.H., The properties of ethylene carbonate and its use in electrochemical applications: A Literature Review, Lawrence Berkeley Lab., CA (USA), 1985. 126 p.
Tang, S. and Zhao, H., Glymes as versatile solvents for chemical reactions and processes: from the laboratory to industry, RSC Adv., 2014, vol. 4, p. 11251.
Bogle, X., Vazquez, R., Greenbaum, S., Cresce, A.V.W., and Xu, K., Understanding Li+–solvent interaction in nonaqueous carbonate electrolytes with 17O-NMR, J. Phys. Chem. Lett., 2013, vol. 4, p. 1664.
Allen, J.L., Borodin, O., Seo, D.M., and Henderson, W.A., Combined quantum chemical/Raman spectroscopic analyses of Li+ cation solvation: Cyclic carbonate solvents – Ethylene carbonate and propylene carbonate, J. Power Sources, 2014, vol. 267, p. 821.
Allen, J.L., Seo, D.M., Ly, Q.D., Boyle, P.D., and Henderson, W.A., Solvent-LiBF4 phase diagrams, ionic association and solubility – cyclic carbonates and lactones, ECS Trans., 2012, vol. 41, p. 41.
Seo, D.M., Afroz, T., Ly, Q., O’Connell, M., Boyle, P.D., and Henderson, W.A., A “looking glass” into electrolyte properties: cyclic carbonate and ester–LiClO4 mixtures, ECS Trans., 2012, vol. 41, p. 11.
Hyodo, S. and Okabayashi, K., Raman intensity study of local structure in non-aqueous electrolyte solutiopns. – I. Cation-solvent interaction in LiClO4 – ethylene carbonate, Electrochim. Acta, 1989, vol. 34, p. 1551.
Masia, M., Probst, M., and Rey, R., Ethylene carbonate–Li+: A theoretical study of structural and vibrational properties in gas and liquid phases, J. Phys. Chem. B, 2004, vol. 108, p. 2016.
Xuan, X., Wang, J., Lu, J., Pei, N., and Mo, Y., Ion solvation and association in LiClO4/sulfolane solution: avibrational spectroscopic and molecular orbital study, Spectrochim. Acta A, 2001, vol. 57, p. 1555.
Alvarado, J., Schroeder, M.A., Zhang, M., Borodin, O., Gobrogge, E., Olguin, M., Ding, M.S., Gobet, M., Greenbaum, S., and Xu, K., A carbonate-free, sulfone-based electrolyte for high-voltage Li-ion batteries, Mater. Today, 2018, vol. 21, p. 341.
Watanabe, M., Thomas, M.L., Zhang, S., Ueno, K., Yasuda, T., and Dokko, K., Application of ionic liquids to energy storage and conversion materials and devices, Chem. Rev., 2017, vol. 117, p. 7190.
Rhodes, C.P. and Frech, R., Local structures in crystalline and amorphous phases of diglyme–LiCF3SO3 and poly(ethylene oxide)–LiCF3SO3 systems: Implications for the mechanism of ionic transport, Macromolecules, 2001, vol. 34, p. 2660.
Huang, W. and Frech, R. Dependence of ionic association on polymer chain length in poly(ethylene oxide)-lithium triflate complexes, Polymer, 1994, vol. 35(2), p. 235.
Peng, J., Carbone, L., Gobet, M., Hassoun, J., Devany, M., and Greenbaum, S., Natural abundance oxygen-17 NMR investigation of lithium ion solvation in glyme-based electrolytes, Electrochim. Acta, 2016, vol. 213, 606.
Ueno, K., Tatara, R., Tsuzuki, S., Saito, S., Doi, H., Yoshida, K., Mandai, T., Matsugami, M., Umebayashi, Y., Dokko, K., and Watanabe, M., Li+ solvation in glyme–Li salt solvate ionic liquids, Phys. Chem. Chem. Phys., 2015, vol. 17, p. 8248.
Morales, D., Ruther, R.E., Nanda, J., and Greenbaum, S., Ion transport and association study of glyme-based electrolytes with lithium and sodium salts, Electrochim. Acta, 2019, vol. 304, p. 239.
Huang, W., Frech, R., Johansson, P., and Lindgren, J., Cation–polymer interaction and ionic association in diglyme–LiCF3SO3 and diglyme–propylene carbonate–LiCF3SO3 complexes, Electrochim. Acta, 1995, vol. 40, p. 2147.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




