Электрохимия, 2021, T. 57, № 8, стр. 492-506
Композиционные Pt/(SnO2/C)- и PtSnNi/C-катализаторы в реакциях электровосстановления кислорода и электроокисления спиртов
Д. К. Мауэр a, *, С. В. Беленов a, Л. М. Скибина a, В. Е. Гутерман a
a Южный Федеральный университет
Ростов-на-Дону, Россия
* E-mail: mauer@sfedu.ru
Поступила в редакцию 01.10.2020
После доработки 10.01.2021
Принята к публикации 21.01.2021
Аннотация
Электроосаждением олова и олова–никеля на высокодисперсный углеродный материал получены композитные носители, на которые методом химического восстановления Pt(IV) из раствора ее соли были нанесены наночастицы Pt(0). Проведено изучение состава, структуры и активности полученных Pt(SnO2/C)- и PtSnNi/C-катализаторов в реакциях электровосстановления кислорода и электроокисления спиртов. Установлено, что Pt(SnO2/C)- и PtSnNi/C-катализаторы проявляют более высокую активность в реакции электроокисления этанола, по сравнению с коммерческим PtRu/C-аналогом. В реакции окисления метанола PtSnNi/C продемонстрировал активность, близкую к таковой у PtRu/C. Показано, что среди исследованных материалов наиболее перспективными для электроокисления спиртов являются триметаллические PtSnNi/C-катализаторы.
ВВЕДЕНИЕ
В основе работы низкотемпературных топливных элементов (НТЭ) лежат электрохимические реакции окисления восстановителя, например водорода или метанола, и восстановления окислителя (O2), происходящие на высокоразвитой поверхности катализатора. Активность и стабильность таких катализаторов зависят, в первую очередь, от их состава и структуры [1].
Наиболее эффективными катализаторами в НТЭ являются материалы, содержащие наночастицы (НЧ) платины или ее сплавов с некоторыми d-металлами, осажденные на поверхность углеродных или оксидных носителей [2–6]. Нанесение платины в виде наноразмерных частиц способствует повышению активной поверхности в расчете на единицу массы драгоценного металла, хотя процессы агрегации и деградации наночастиц приводят к постепенному снижению каталитической активности [6, 7]. Носитель играет большую роль с точки зрения равномерности распределения НЧ платины, прочности их адгезии и способности противостоять деградации, приводящей к агломерации или отрыву НЧ от поверхности носителя. Возможность управления составом и микроструктурой платиносодержащих катализаторов важна для обеспечения их высокой активности и устойчивости к процессам деградации [8–12].
Расширение сфер использования топливных элементов ставит перед исследователями проблемы, связанные с необходимостью сохранения активности электрокатализаторов при снижении количества используемых в них драгоценных металлов. Применение в качестве носителя композитных материалов, состоящих из оксидов металла и углерода, является одним из перспективных направлений, позволяющих получить катализаторы с коррозионной стабильностью и активностью, повышенными по сравнению с коммерческими Pt/C-катализаторами [13, 14]. В числе возможных преимуществ таких материалов по сравнению с углеродом следует отметить упрочнение адгезии и более равномерное распределение наночастиц по поверхности носителя. Следствием этого является повышение площади электрохимически активной поверхности (ЭХАП), каталитической активности в реакции окисления спиртов и стабильности платиносодержащих катализаторов [15].
Одним из простых и технологичных методов синтеза композитных носителей оксид металла/углерод является метод электролитического осаждения металлов из растворов их солей на углеродный носитель [16]. Данный метод разработан на основе предложенного ранее способа электролитического формирования наночастиц платины на частицах дисперсного углеродного носителя [17]. Для получения композиционных носителей платиновых катализаторов целесообразно использовать такие способы нанесения оксидной компоненты на углерод, которые обеспечили бы впоследствии возможность подвода/отвода электронов к/от нанесенных НЧ платины. Другой подход к синтезу композитных носителей оксид металла/углерод – импульсное электрохимическое диспергирование металлического электрода в углеродной суспензии [18], где полученные частицы металла самопроизвольно окисляются до оксида, который затем осаждается на углеродный носитель.
Особый интерес представляет система SnO2/C, обладающая достаточной электронной проводимостью. Наноразмерная структура кристаллов SnO2, определяющая высокую удельную площадь поверхности оксида, влияет на свойства и производительность разнообразных материалов и устройств, созданных с использованием этого материала: газовых датчиков, фотодатчиков, фотокатализаторов, антистатических покрытий, сенсибилизированных красителей, солнечных батарей и др. [19]. Различные виды частиц и пленок SnO2 могут быть приготовлены с использованием пиролиза [20, 21], лазерной абляции [22, 23], системы золь–гель [24, 25] и гомогенных методов осаждения [26, 27]. При этом контроль морфологии материалов, содержащих SnO2, остается сложной задачей. Данная задача могла бы быть решена при использовании электрохимических методов получения нанодисперсного SnO2. Известно, что для катализаторов на основе композитных SnO2/С-носителей отмечается повышенная активность в реакциях окисления этанола (РОЭ) и метанола (РОМ). Так, исследование электрохимического поведения Pt/(SnO2/C)-катализаторов в сравнении с Pt/C-аналогом указало на снижение потенциала электроокисления метанола и этанола при одновременном увеличении скорости процесса [18]. Pt/(SnO2/C)-катализатор, синтезированный авторами [28], показал отличную каталитическую активность, превосходную долговечность и повышенную толерантность к промежуточным продуктам окисления метанола по сравнению с коммерческим Pt/C-материалом. По мнению авторов, его повышенная каталитическая эффективность может быть связана с эффектами электронного взаимодействия между Pt и SnO2, а также с высокой долей граней Pt (111) в нанокристаллах этого металла. Авторы считают, что эффективному переносу электронов и повышению стабильности наночастиц платины способствует их (наночастиц) взаимодействие c SnO2 и углеродом [28]. Композитные Pt/(SnO2/C)-материалы также рассматриваются в качестве катализаторов в реакции окисления этанола [29, 30], активность которых сопоставима с наиболее эффективными на сегодняшний день для РОМ и РОЭ PtRu/С-катализаторами [31–33]. Однако, на основе анализа литературных данных можно сделать выводы о том, что следующим этапом развития катализаторов РОЭ являются триметаллические платиносодержащие материалы [34–36]. Так, например, авторами [34] описывается синтез и использование PtSnNi/С-катализаторов для реакции окисления этанола. Авторы [35] утверждают, что из ряда многокомпонентных систем, таких как PtRuNi/С, PtSnRh/C, PtSn/C, PtSnNi/С, наибольшую активность в реакции окисления этанола проявляет именно PtSnNi/С-катализатор. Отметим, что все материалы в работе [35] были синтезированы полиольным методом (в жидкой фазе), в качестве стабилизатора использовали поливинилпирролидон, и средний размер металлических кристаллитов в полученных катализаторах составил около 4 нм. В ряде работ, например в [36], PtSnNi/С-катализаторы с суммарной массовой долей металлов 20% и соотношением масс Pt : Sn : Ni, равным 60 : 40 : 40, получали на различных носителях: на углероде марки Vulcan XC-72 и функционализированных многостенных углеродных нанотрубках. Авторы [36] показали, что использование в качестве носителя Vulcan XC-72 позволяет получить более высокие электрохимические характеристики, но пониженную стабильность, по сравнению с Pt:Sn:Ni-катализатором, нанесенным на углеродные нанотрубки. Вместе с тем, тройные металлические системы, в частности Pt–Sn–Ni, нанесенные на углеродный носитель, пока еще мало исследованы в качестве катализаторов РВК и реакций окисления спиртов. Изучение механизма электроокисления спиртов на различных по составу катализаторах и поиск наиболее эффективных материалов для прямых метанольных и этанольных топливных элементов также являются достаточно быстро развивающимися направлениями в наши дни [37, 38].
Таким образом, как легирование платины некоторыми d-металлами, так и совместное присутствие наночастиц платины и диоксида олова на поверхности углеродного носителя могут повышать активность катализаторов, особенно в реакциях электроокисления спиртов. Мы полагаем, что композит SnO2/С, полученный электролитическим нанесением олова с последующим самопроизвольным окислением металлических наночастиц, может оказаться перспективным носителем для платиносодержащих электрокатализаторов, при условии формирования оксида в виде наноразмерных частиц, прочно закрепленных на поверхности диспергированного углерода. В то же время возможность соединения в одном катализаторе позитивного влияния компонента, легирующего платину, и наночастиц диоксида олова до сих пор мало изучена.
С учетом вышеизложенного, целью настоящей работы являлось получение наноструктурных композитных носителей “оксид металла/углерод”, двух- и трехкомпонентных платиносодержащих катализаторов на их основе, а также исследование характеристик таких катализаторов в РВК, РОМ и РОЭ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для электроосаждения металлов на дисперсный углеродный носитель, находящийся в суспензии, использовали стеклоуглеродный анод площадью 19.5 см2 и медный катод площадью 1.5 см2, погруженные в диспергированную ультразвуком непосредственно перед электроосаждением суспензию, содержащую 0.5 г углеродного порошка Vulcan XC-72 в 50 мл электролита. Для осаждения олова использовали описанный в [39] электролит оловянирования, состава: SnSO4 – 0.25 М; H2SO4 – 0.1 М. Для одновременного осаждения олова и никеля использовали смешанный электролит, применяемый для осаждения сплава SnNi на стационарный электрод [40], состава: SnCl2, NiCl2 – по 0.25 М NH4F – 0.14 М. Электроосаждение проводили при комнатной температуре при постоянном перемешивании для сохранения однородности системы. По результатам предварительного исследования различных токовых режимов электроосаждения металлов были выбраны два режима: 9 A в течение 3.7 мин и 1.6 А в течение 21 мин.
После электроосаждения металла(ов) суспензию отфильтровывали на воронке Бюхнера (фильтр “синяя лента”), промывали дистиллированной водой. Затем полученный носитель высушивали на фильтре в течение 4 ч при температуре 80°С. Материалы, полученные электроосаждением Sn и Sn–Ni на дисперсный углеродный носитель, далее обозначены, соответственно, как SC и NSC.
Для осаждения платины на полученные композитные носители SC и NSC использовали методику боргидридного синтеза [6]. Композитный носитель массой 0.10–0.30 г помещали в смесь 30 мл этиленгликоля и 30 мл бидистиллированной воды, затем при перемешивании добавляли расчетное количество водного раствора H2[PtCl6]·6H2O. Полученную суспензию гомогенизировали ультразвуком в течение 5 мин, после чего 0.1 М раствором NaOH доводили pH раствора до 11. Далее при перемешивании добавляли трехкратный избыток свежеприготовленного 0.5 М водного раствора NaBH4. Выдерживали суспензию при перемешивании 40 мин, после чего отделяли полученный катализатор фильтрованием с многократным промыванием бидистиллированной водой и этиловым спиртом. Образцы сушили при температуре 80°С в течение 2 ч.
Мольное соотношение металлов Pt : Ni : Sn в многокомпонентных катализаторах определяли методом рентгенофлуоресцентного анализа (РФлА) на спектрометре с полным внешним отражением рентгеновского излучения РФС-001 (НИИ физики ЮФУ). Время экспозиции образцов – 300 с. Регистрацию и обработку рентгеновских флуоресцентных спектров проводили с использованием программного обеспечения UniveRS (ЮФУ). Для определения суммарного количества металлов (олова, никеля и платины) в синтезированных материалах использовали метод термического анализа: определяли массу веществ, остающихся в тигле после полного окисления углерода в результате 30-минутного нагревания при 800°С в воздушной атмосфере 5–10 мг каждого образца. При расчете массовой доли металлов учитывали, что после прокаливания в тигле остаются оксиды никеля, олова и металлическая платина.
Для определения фазового состава образцов и размера наночастиц (кристаллитов) использовали метод рентгенофазового анализа (РФА). Рентгенограммы регистрировали на дифрактометре ARL X’TRA с геометрией по Бреггу–Брентано. Типичные установки: 40 кВ, 35 мА, шаг сканирования 0.02 град в координатах 2θ, скорость съемки 2 град/мин. Фазовый анализ проводили на основе данных, полученных из открытых источников, в том числе с использованием Crystallography Open Database (COD) [41, 42].
Анализ рентгенограмм проводили с использованием пакета обработки данных SciDavIs, определяя методом аппроксимации функцией Лоренца положение пиков, их ширину на половине высоты (FWHM) и площадь. По дифрактограммам определяли средний размер кристаллитов платины или ее сплавов, используя отражение (111), и диоксида олова, используя пик (101). Определение среднего диаметра кристаллитов проводили по формуле (1) Шеррера [43], в которую подставляли соответствующее значение ширины пика на половине его высоты (FWHM):
(1)
${{D}_{{hkl}}} = {{K\lambda } \mathord{\left/ {\vphantom {{K\lambda } {\left[ {{\text{FWHM}}\cos \theta } \right]}}} \right. \kern-0em} {\left[ {{\text{FWHM}}\cos \theta } \right]}},$Для определения площади электрохимически активной поверхности платины использовали метод циклической вольтамперометрии. Тонкий (около 4 мкм) слой исследуемого материала наносили на торец вращающегося дискового электрода. Для этого 6 мкл суспензии катализатора в смеси вода–изопропанол, содержащей добавку полимера Nafion и 0.6 мкг катализатора, наносили на торец стеклографитового вращающегося дискового электрода (ВДЭ). После сушки для закрепления слоя наносили еще 7 мкл 0.05% раствора Nafion, после чего электрод высушивали 5 мин при комнатной температуре. С помощью потенциостата VersaSTAT 3 (AMETEK Scientific Instruments, USA) задавали развертку потенциала и фиксировали значения тока. Первоначально для стандартизации поверхности Pt и полного удаления примесей проводили 100 циклов развертки потенциала со скоростью 200 мВ с–1 в диапазоне потенциалов от 0.05 до 1.2 В (относительно ОВЭ). Далее регистрировали 2 циклических вольтамперограммы (ЦВА) в диапазоне потенциалов 0.05–1.2 В при скорости развертки 20 мВ с–1. Расчет количества электричества проводили интегрированием “водородной” области ЦВА на кривой в координатах “ток–время” с использованием программного обеспечения VersaStudio. Для этого усредняли значения количества электричества, затраченные на электрохимическую адсорбцию и десорбцию водорода на платине, вычитая вклад количества электричества, затраченного на заряжение двойного электрического слоя. Все измерения были проведены при комнатной температуре. Расчет величины площади электрохимически активной поверхности поверхности проводили по формуле:
(2)
${\text{ЭХАП}} = \frac{Q}{{m \cdot 210}},\,\,{{{\text{с}}{{{\text{м}}}^{2}}} \mathord{\left/ {\vphantom {{{\text{с}}{{{\text{м}}}^{2}}} {{\text{г}}\,{\text{(Pt}})}}} \right. \kern-0em} {{\text{г}}\,{\text{(Pt}})}},$Для определения активной площади поверхности металлов по количеству электрохимически окисленного хемосорбированного СО, поддерживая постоянный потенциал электрода 0.1 В, через электролит продували СО в течение 30 мин, а затем аргон в течение 30 мин. После этого регистрировали циклическую вольтамперограмму (3 цикла) в диапазоне потенциалов от 0.05 до 1.20 В со скоростью развертки потенциала 20 мВ/с. Величину ЭХАП рассчитывали по количеству электричества, затраченному на окисление СО, хемосорбированного на поверхности металлов. Для этого в формуле (2) вместо 210 мкКл/см2 использовали 420 мкКл/см2, поскольку на окисление 1 моля СО требуется в 2 раза большее количества электричества, чем для окисления моля Hадс.
После определения ЭХАП материалов проводили исследование их активности в РВК при скоростях вращения дискового электрода: 400, 900, 1600 и 2500 об/мин. Предварительно регистрировали линейные вольтамперограммы в атмосфере аргона для дальнейшего их “вычитания” из линейных вольтамперограмм, полученных в атмосфере кислорода: I = ${{I}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ – IAr. Это позволило учесть влияние фоновых токов. Измерения проводили в стандартной трехэлектродной ячейке с использованием 0.1 М HClO4 в качестве фонового электролита. Перед началом измерений через рабочий раствор продували О2 в течение 40 мин при атмосферном давлении. Вольтамперограммы регистрировали в направлении от 0.02 до 1.20 В при скорости развертки потенциала 20 мВ с–1. Далее проводили анализ зависимости величины тока от скорости вращения дискового электрода с использованием уравнения Коутецкого–Левича. Результаты измерений корректировали с учетом омического сопротивления системы (R = 26 Ом), как это описано в [44].
При изменении активности катализаторов в реакциях электроокисления метанола и этанола в качестве электролита использовали растворы 0.1 М HClO4 и 0.5 М метанола или этанола. Количество электричества, затраченное на окисление спиртов в единичном цикле развертки потенциала, рассчитывали по пику окисления на прямом ходе развертки. Хроноамперограммы измеряли при потенциале 0.6 В. Все измерения проводили на неподвижном дисковом электроде в атмосфере аргона.
Поскольку абсолютные значения ЭХАП и активности катализатора в электрохимических реакциях весьма чувствительны к структуре каталитического слоя и чистоте электролита, в качестве стандартного образца сравнения использовали коммерческий Pt/C-катализатор HiSPEC3000 (Johnson Matthey), содержащий 20 мас. % платины. При изучении активности полученных катализаторов в реакциях окисления спиртов в качестве образца сравнения был использован также коммерческий PtRu/C-электрокатализатор (Pt–Ru – 1 : 1, 40 мас. % Pt, 20 мас. % Ru, Alfa Aesar). Состав каталитических чернил и методика нанесения каталитического слоя для HiSPEC3000 и PtRu/C были такими же, как и для исследуемых катализаторов.
В качестве электрода сравнения использовали хлоридсеребряный электрод. Все значения потенциалов в работе приведены относительно потенциала обратимого водородного электрода (ОВЭ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Синтез и структура композитных носителей SC и NSC и платиносодержащих катализаторов на их основе
С использованием двух различных токовых режимов (см. раздел “Экспериментальная часть”) были получены материалы, содержащие около 15% металлов (SC-1 и NSC-1 при токе 9 A) и около 35% металлов (SC-2 и NSC-2 при токе 1.6 А) (табл. 1). Результаты термогравиметрии подтвердили осаждение металлов на углеродный носитель, а результаты элементного анализа полученных материалов методом РФлА показали наличие в образцах серии NSC атомов обоих металлов: олова и никеля (табл. 1). При этом с ростом массовой доли металлов атомное соотношение Sn–Ni в образцах серии NSC изменяется в сторону увеличения доли атомов никеля.
Таблица 1.
Характеристики материалов, полученных электроосаждением Sn (SC) и одновременным электроосаждением Ni и Sn (NSC) на углеродный носитель Vulcan XC-72
| Образец | Фазовый состав образцов по данным РФА | Массовая доля металлов, мас. % | Состав металлической компоненты (РФлА) | Средний размер кристаллитов Ni(SnOH)6, нм | Средний размер кристаллитов SnO2, нм |
|---|---|---|---|---|---|
| SC-1 | SnO2, Sn | 16 ± 1.5 | Sn | – | 2.7 ± 0.2 |
| SC-2 | SnO2, Sn | 35 ± 3.5 | Sn | – | 1.8 ± 0.2 |
| NSC-1 | Ni(SnOH)6, Ni, NiO | 14 ± 1.5 | Ni3.7Sn | 60 ± 5 | – |
| NSC-2 | Ni(SnOH)6, Ni, NiO | 32 ± 3.5 | Ni4.7Sn | 150 ± 5 | – |
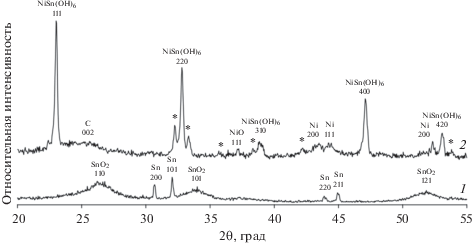
Для определения фазового состава образцов и размера кристаллитов полученные материалы были исследованы методом РФА. Образец, полученный электроосаждением олова на углеродный носитель, характеризуется наличием на рентгенограмме отражений двух фаз SnO2 и Sn (рис. 1, кривая 1). Отражения, соответствующие фазе оксида олова, сильно уширенны. Расчет среднего размера кристаллитов SnO2 по формуле Шеррера в материалах SC-1 и SC-2 дает значения около 2.7 и 1.8 нм, соответственно (табл. 2). Отражения на рентгенограмме, соответствующие фазе металлического олова, характеризуются малым уширением, по сравнению с отражениями фазы SnO2, поэтому оценка среднего размера кристаллитов в этом случае не может быть проведена с достаточной точностью.
Таблица 2.
Состав и структурные характеристики образцов PSC- и PNSC-катализаторов, а также коммерческого Pt/C-материала
| Образец | Массовая доля Pt, ω(Pt), % | Соотношение компонентов (РФлА) | Состав PtNix после электрохимических измерений (РФлА) |
Средний размер кристаллитов SnO2, нм | Средний размер кристаллитов Pt, нм |
|---|---|---|---|---|---|
| PSC-1 | 17 | PtSn1.5 | – | 2.7 ± 0.2 | 3.3 ± 0.2 |
| PSC-2 | 19 | PtSn1.7 | – | 1.8 ± 0.2 | 3.8 ± 0.2 |
| PNSC-1 | 21 | PtNi1.0Sn0.32 (Pt3.1Ni3.1Sn) |
PtNi0.29 | – | 3.9 ± 0.2 |
| PNSC-2 | 23 | PtNi1.2Sn0.25 (Pt4Ni4.8Sn) |
PtNi0.45 | – | 2.2 ± 0.2 |
| JM20 | 20 | Pt | Pt | – | 2.2 ± 0.2 |
| PtRu | 40 | Pt1Ru1 | – | – | 3.2 ± 0.2 |
На рентгеновских дифрактрограммах композиционных материалов NSC, полученных из электролита, содержащего хлориды олова и никеля, присутствуют ярко выраженные пики, которые могут быть отнесены к фазам NiSn(OH)6, NiO и Ni (рис. 1, кривая 2). Дополнительные отражения на рентгенограмме, отмеченные (*), могут быть связаны с фазой NiSnO3·xH2O переменного состава. При этом на рентгенограмме материала NSC-2 отражений, соответствующих фазам Sn или SnO2, не обнаружено.
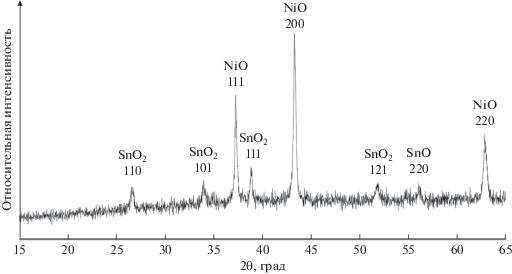
Для материала NSC-2 по ширине отражений на половине высоты (FWHM) был рассчитан средний размер кристаллитов фазы NiSn(OH)6, который составил примерно 150 нм (табл. 1). Для отражений, соответствующих фазам NiO и Ni, расчет среднего размера кристаллитов не проводили из-за их малой интенсивности. Методом РФА также были изучены продукты окисления, образовавшиеся после длительной выдержки образцов при 800°С в атмосфере воздуха. На дифрактограммах остатка, полученного после прокаливания материала NSC-2 (рис. 2), обнаружены отражения двух фаз – SnO2 и NiO, что хорошо согласуется с данными о первоначальном составе этих материалов в состоянии “как получено”.
Рис. 2.
Рентгеновская дифрактограмма остатка материала NSC-2 после проведения высокотемпературного окисления.
Таким образом, методом электроосаждения металлов на углеродный материал Vulcan XC-72 были получены композитные носители, содержащие в случае образцов серии SC кроме высокодисперсного углерода наноразмерные частицы SnO2 и металлическое олово, а для образцов серии NSC частицы металлического никеля, оксида никеля и достаточно крупные частицы фазы NiSn(OH)6.
Для получения на основе полученных композитных носителей SC и NSC платиносодержащих катализаторов, на композитные материалы методом химического восстановления была нанесена платина. Количество прекурсора платины (H2PtCl6) рассчитывали таким образом, чтобы получить материалы с содержанием платины 20 мас. %. Полученные образцы были маркированы как PSC и PNSC. По данным термогравиметрии с учетом образования соответствующих оксидов и результатов анализа состава материалов методом РФлА, было рассчитано содержание платины в полученных материалах (табл. 2). Оно составило от 17 до 23 мас. %, что близко к расчетному значению 20 мас. %. Отметим, что более высокое относительное содержание никеля в материале NSC-2, по сравнению с NSC-1, сохраняется и после осаждения платины (табл. 2).
На рентгенограммах образцов PSC-1 и PSC-2, полученных после осаждения платины на материалы серии SC, наблюдаются отражения фаз платины и SnO2 (рис. 3, кривые 1, 2). Средний размер кристаллитов платины в полученных материалах составил 3.3 и 3.8 нм (табл. 2). При сравнении рентгенограмм образцов SC-2 (рис. 1, кривая 1) и PSC-2 (рис. 3, кривая 2) заметно, что отражения фазы SnO2 до и после нанесения платины практически не изменились, а отражений фазы металлического олова после осаждения платины не наблюдается. Скорее всего фаза металлического олова, присутствовавшая в материалах серии SC в небольшом количестве, растворилась при добавлении гексахлорплатиновой кислоты в процессе синтеза.
Рис. 3.
Рентгеновские дифрактограммы PSC- и PNSC-материалов: 1 – PSC-1; 2 –PSC-2; 3 –PNSC-1; 4 – PNSC-2; 5 – коммерческий образец Pt/C (JM20); 6 – коммерческий образец PtRu/C.
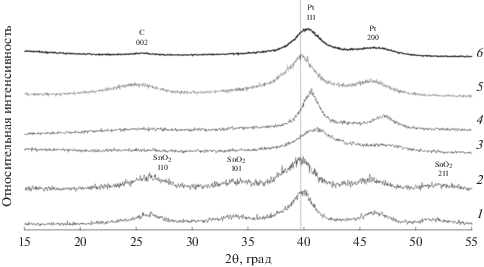
Максимумы рентгенограммы коммерческого PtRu/C-катализатора сдвинуты в область больших углов 2θ, по сравнению с Pt/C-материалом, что характерно для твердого раствора Pt–Ru.
Для рентгеновских дифрактограмм PNSC-материалов (рис. 3, кривые 3, 4), полученных с использованием NSC-носителей (рис. 1, кривая 2), характерно отсутствие отражений, соответствующих фазам: Ni(SnOH)6, Ni, NiO. Это может быть связано с растворением Ni(SnOH)6, Ni, NiO в кислой среде (после добавления H2PtCl6) и с последующим соосаждением части растворенных металлов вместе с платиной при взаимодействии с восстановителем в процессе синтеза. Действительно, на рентгенограммах образцов PNSC наблюдается значительное смещение положений максимумов отражений платины в область больших значений углов 2θ по сравнению с фазой Pt – от 39.7 до 41 град, что свидетельствует об образовании твердого раствора PtNi или PtSnNi. Следствием формирования разупорядоченного твердого раствора на основе платины с гранецентрированной кубической решеткой является уменьшение параметра решетки наночастиц в образцах PNSC-1 (3.859 Å) и PNSC-2 (3.838 Å) по сравнению с чистой платиной (3.923 Å).
Известно [45, 46], что добавление атомов олова в твердый раствор на основе платины приводит к увеличению параметра кристаллической решетки и сдвигает максимумы отражений на рентгеновской дифрактограмме в область меньших углов 2θ по сравнению с отражениями платины, в то время как при легировании платины никелем имеет место обратная тенденция [47]. Например, авторы работы [48] получили PtSnNi/С-материалы состава Pt75Sn15Ni10 и Pt55Sn17Ni28 с параметрами решетки соответственно 3.923 и 3.913 Å, близкими к чистой платине, что и было объяснено разнонаправленным влиянием легирования атомами никеля и олова. Аналогичное влияние легирования платины атомами никеля и олова для Pt80Sn10Ni10-материала с параметром решетки 3.906 Å отметили авторы [49].
В полученных нами материалах PNSC-1 и PNSC-2 атомная доля Ni, соответственно, в 3.1 и в 4.8 раз больше, чем Sn (табл. 2). Данные о составе материалов согласуются с величиной параметра кристаллической решетки: для образца PNSC-2, содержащего большую долю никеля, величина параметра кристаллической решетки (3.838 Å) меньше, по сравнению с образцом PNSC-1 (3.859 Å). Отмеченный факт важен с точки зрения прогнозирования активности катализаторов, поскольку результаты ряда работ [50, 51] свидетельствуют о позитивном влиянии высокой концентрации атомов никеля в твердом растворе Pt–Ni на активность катализаторов в РВК, что обусловлено уменьшением величины параметра кристаллической решетки сплава по сравнению с Pt.
Расчет среднего размера кристаллитов платины показал их значительно меньший размер в материале PNSC-2 (2.2 нм), по сравнению с материалом PNSC-1 (3.9 нм). Отметим, что средний размер кристаллитов твердого раствора на основе платины в материале PNSC-2 близок к таковым для коммерческого Pt/C-катализатора (табл. 2) и PtSnNi/С-катализатора, полученного в [49]. В то же время он значительно меньше, чем размер кристаллитов PtSnNi, полученных в [36] – 5.14 нм и в [48] – 3.8 нм.
Завершая анализ результатов рентгеновской дифрактометрии, отметим, что оценка состава материалов PNSC-1 и PNSC-2 по закону Вегарда (линейная зависимость параметра решетки от содержания легирующего компонента в твердом растворе) [52, 53], сделанная исходя из предположения о вхождении в состав твердого раствора только атомов никеля, дает составы PtNi0.18 и PtNi0.26, что не соответствует результатам элементного анализа (табл. 2). Это может быть связано с образованием трехкомпонентного сплава PtNiSn, неравномерностью твердого раствора или с неполным вхождением атомов никеля в его состав. Нельзя исключить также возможность присутствия рентгеноаморфных оксидов олова и никеля в материалах серии PNSC. К сожалению, в данном случае метод рентгеновской дифракции не может дать однозначной интерпретации составов полученных твердых растворов на основе платины.
2. Изучение активности платиносодержащих катализаторов, полученных на основе композитных носителей SC и NSC
Циклические вольтамперограммы стандартизированных электродов (рис. 4) имеют вид, типичный для платиносодержащих электрокатализаторов, и включают область адсорбции–десорбции водорода, “двойнослойную” и “кислородную” области. Величины удельных токов PSC- и PNSC-материалов в области адсорбции–десорбции водорода характеризуются меньшими значениями по сравнению с токами для коммерческого Pt/C. Наибольшей величиной ЭХАП обладает коммерческий Pt/C, в то время как значения ЭХАП полученных нами катализаторов меньше на 13–36% (табл. 3). Данный факт может быть связан как с большим размером кристаллитов для полученных материалов, так и с большей степенью агломерации наночастиц, например, в материале PNCS-2. Определение площади активной поверхности методом окисления монослоя хемосорбированного CO (рис. 4б) показало близкие величины ЭХАП (45–48 м2/г (Pt)) для материалов PSC-1, PSC-2, PNSC-1 и более высокое значение – 63 м2/г (Pt) для PNSC-2 (табл. 3), содержащего кристаллиты меньшего размера (табл. 2). Отметим, что для PtRu-катализатора определение величины ЭХАП (97 м2/г (Pt)) проводили только методом окисления СО, поскольку применение метода адсорбции–десорбции водорода для платинорутениевых катализаторов не вполне корректно [32]. Анализ положения пиков окисления СО на ЦВА дает дополнительную информацию о свойствах изучаемых катализаторов. Потенциалы начала окисления и максимума окисления CO для PtRu-катализатора значительно меньше, по сравнению с соответствующими потенциалами Pt/C-катализатора (рис. 4б), что свидетельствует об облегчении окисления CO на поверхности PtRu-наночастиц [37, 54]. На вольтамперограммах всех PSC- и PNSC-материалов наблюдается широкий пик окисления CO с двумя более или менее выраженными максимумами в диапазоне потенциалов 0.44–0.45 и 0.74–0.75 В. Широкий диапазон потенциалов окисления СО и наличие двух максимумов может быть связанно с неоднородностью состава и структуры многокомпонентных катализаторов, содержащих наночастицы, существенно различающиеся по активности в реакции электроокисления СО. Отметим, что окисление СО при потенциалах около 0.45 В, зафиксированное на полученных нами катализаторах, может быть фактором обеспечения высокой активности в реакциях окисления спиртов [55].
Рис. 4.
Циклические вольтамперограммы (2-й цикл) (а) и фрагменты циклических вольтамперограмм, включающие пики электрохимической десорбции СО с поверхности наночастиц исследуемых катализаторов (б). Электролит 1 М HClO4, атмосфера аргона. Скорость развертки потенциала 40 мВ/с: 1 – PSC-1; 2 –PSC-2; 3 – PNSC-1; 4 – PNSC-2; 5 – коммерческий образец Pt/C (JM20); 6 – коммерческий образец PtRu/C.
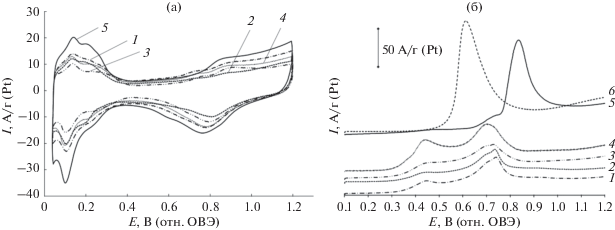
Таблица 3.
Некоторые параметры, характеризующие электрохимическое поведение PSC-, PNSC- и коммерческого Pt/C-катализаторов
| Образец | ЭХАП | Масс-активность, А/г (Pt) (E = 0.90 В) | Удельная активность, А/м2 (Pt) (E = 0.90 В) | E1/2 (РВК), В (1600 об/мин) | Число электронов в РВК при Е = 0.90 В | |
|---|---|---|---|---|---|---|
| Hадс/дес м2/г (Pt) | CO м2/г (Pt) | |||||
| PSC-1 | 52 ± 5 | 45 ± 5 | 69 ± 3 | 1.3 ± 0.1 | 0.89 | 4.0 |
| PSC-2 | 56 ± 5 | 48 ± 5 | 64 ± 3 | 1.6 ± 0.1 | 0.87 | 3.8 |
| PNSC-1 | 58 ± 6 | 45 ± 5 | 162 ± 8 | 2.7 ± 0.1 | 0.92 | 3.9 |
| PNSC-2 | 63 ± 6 | 63 ± 6 | 179 ± 9 | 2.8 ± 0.1 | 0.92 | 4.1 |
| JM20 | 79 ± 8 | 78 ± 8 | 178 ± 9 | 2.2 ± 0.1 | 0.91 | 4.1 |
Оценка состава материалов серии PNSC после вольтамперометрических измерений (соотношения Pt : Ni около 3 : 1) показывает, что для образцов характерно частичное растворение никеля (табл. 2) до стабилизации состава, примерно соответствующего мольному соотношению Pt : Ni, равному 3 : 1. К сожалению, вследствие небольшого количества катализатора, нанесенного на торец дискового электрода, после завершения вольтамперометрических измерений определить содержание Sn в образцах не представляется возможным.
Материалы серии PNSC демонстрируют наиболее высокую удельную активность в РВК в расчете на площадь поверхности – 2.7–2.8 А/м2 (Pt). Это может быть обусловлено позитивным влиянием легирования на активность платины. К сожалению, меньшая по сравнению с коммерческим Pt/C-катализатором величина ЭХАП PNSC-материалов нивелирует данный эффект при сравнении масс-активности катализаторов: при потенциале 0.90 В масс-активность оказалась близка для образцов PNSC-1, PNSC-2, JM20 (табл. 3, рис. 5) и составила 162–179 А/г (Pt). Образцы, полученные на основе SC композитного носителя, продемонстрировали более низкую масс-активность в РВК – 64–69 А/г (Pt). Расчет числа электронов (n), участвующих в токогенерирующей реакции, для всех исследованных катализаторов находится в диапазоне 3.8–4.1 (табл. 3), что свидетельствует о преимущественном протекании реакции электровосстановления кислорода по 4-электронному механизму.
Рис. 5.
Зависимость скорости электровосстановления кислорода от потенциала электрода. Катализаторы: 1 – PSC-1; 2 –PSC-2; 3 – PNSC-1; 4 – PNSC-2; 5 – коммерческий образец Pt/C (JM20). Скорости развертки потенциала – 20 мВ/с, вращения диска – 1600 об/мин. 0.1 М HClO4, атмосфера O2.
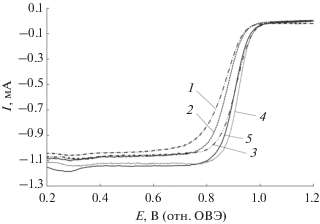
В литературе отсутствует информация о каталитической активности Pt–Ni–Sn-материалов в РВК, поэтому сопоставление с литературными данными проведено только для Pt/(SnO2/C)-материалов. В работе [39] для Pt/(SnO2/C)-катализатора удалось получить более высокие значения потенциала полуволны и масс-активности (0.90 В и 153 А/г) по сравнению с аналогичными параметрами катализаторов серии PSC, полученных в данной работе. В то же время описанный в [39] носитель характеризуется значительно меньшим содержанием SnO2, а нанесение на него наночастиц платины осуществлялось методом синтеза, отличающимся от описанного в данной работе. Авторами [56] рассматриваются композитные системы Pt/SnO2, нанесенные на углеродные нанотрубки и углеродную бумагу. Несмотря на то, что в статье [56] показано позитивное влияние добавки SnO2 на активность композитных катализаторов, полученные материалы характеризуются довольно низкими показателями активности в РВК, из-за чего авторам пришлось проводить сравнение их активности при потенциале 0.85 В. В работе [57] был получен ряд катализаторов на различных оксидных носителях, среди которых наибольшую удельную активность 1.43 А/м2 (Pt) при 0.90 В продемонстрировал Pt/SnO2/C-материал. Это значение примерно соответствует активности полученных нами PSC-материалов (табл. 3).
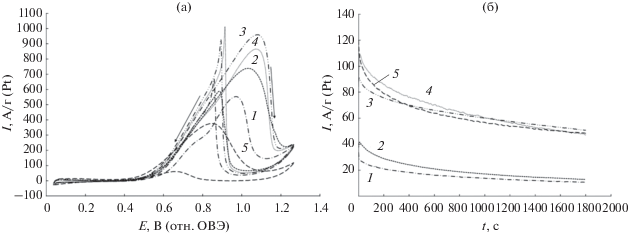
Для сравнения активности платиносодержащих катализаторов в реакциях окисления спиртов по результатам ЦВА используют несколько параметров: потенциал начала окисления (Eн) [15, 34, 35, 46], максимальный удельный ток окисления (Imax) на прямом ходе развертки потенциала [34, 45, 48, 58] и количество электричества, затраченное на окисление спиртов (Q), которое рассчитывают по пику окисления на ЦВА на прямом ходе развертки потенциала [59]. Судя по количеству электричества $\left( {{{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}}} \right),$ затраченному на окисление метанола при прямом ходе развертки потенциала (табл. 4), и максимальному току (Imax) окисления метанола (рис. 6a), исследованные катализаторы можно расположить в ряд по увеличению активности: PtRu/C < PSC-1 < PSC-2 < < PNSC-2 ≤ PNSC-1. Этот результат хорошо коррелирует с данными работы [58], где было показано, что PtNiSn/C-катализатор по величине максимального тока окисления метанола показал в 1.8 раз большую активность по сравнению с PtSn/C и в 1.24 раза большую активность по сравнению с PtNi/C-материалами. В то же время наименьшее значение потенциала (Eн) начала электроокисления метанола (табл. 4), а следовательно, и наибольшую активность при относительно низких потенциалах демонстрирует PtRu/C-катализатор. На наш взгляд, активность катализаторов в реакции окисления спиртов целесообразно сравнивать методом хроноамперометрии при потенциалах, близких к потенциалу начала окисления метанола, в данном случае – 0.60 В. Величины токов окисления метанола в начале измерения (Iнач) для материалов серии PNSC несколько выше (табл. 4, рис. 6б), по сравнению с PtRu/C-катализатором, а для серии PSC – значительно ниже. Для всех изученных образцов наблюдается значительное уменьшение величины тока окисления метанола в процессе измерения хроноамперограммы (30 мин), однако наибольшей величиной токов в конце измерения (Iконеч) также характеризуются материалы серии PNSC и PtRu/C-катализатор (рис. 6б, табл. 4). Таким образом, по совокупности параметров масс-активность полученных PtSnNi/С-материалов в РОМ несколько превосходит активность коммерческого PtRu/C-катализатора.
Таблица 4.
Некоторые параметры, характеризующие электрохимическое поведение катализаторов в реакциях окисления спиртов
| Образец | Метанол | Этанол | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Eн, В | Imax, А/г (Pt) | ${{Q}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}}$×102, Кл/г (Pt) | ${{I}_{{{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}}}}}$, А/г (Pt) | Eн, В | Imax, А/г (Pt) | ${{Q}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}}$ × 102, Кл/г (Pt) | ${{I}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}}$, А/г (Pt) | |||
| Iнач | Iконеч | Iнач | Iконеч | |||||||
| PSC-1 | 0.58 | 554 ± 28 | 46 ± 2 | 40 ± 2 | 13 ± 0.6 | 0.58 | 575 ± 29 | 139 ± 7 | 168 ± 8 | 47 ± 2 |
| PSC-2 | 0.55 | 739 ± 37 | 73 ± 4 | 30 ± 1 | 10 ± 0.5 | 0.58 | 515 ± 26 | 137 ± 7 | 166 ± 8 | 44 ± 2 |
| PNSC-1 | 0.54 | 958 ± 48 | 105 ± 5 | 107 ± 5 | 47 ± 2.3 | 0.29 | 848 ± 42 | 199 ± 10 | 281 ± 14 | 55 ± 3 |
| PNSC-2 | 0.56 | 864 ± 43 | 94 ± 5 | 91 ± 5 | 51 ± 2.6 | 0.31 | 923 ± 46 | 259 ± 13 | 244 ± 12 | 66 ± 3 |
| PtRu/C | 0.47 | 376 ± 19 | 41 ± 2 | 89 ± 4 | 48 ± 2.4 | 0.58 | 508 ± 25 | 204 ± 10 | 136 ± 7 | 44 ± 2 |
Рис. 6.
Циклические вольтамперограммы (а) и хроноамперограммы при потенциале 0.6 В (б) для: 1 – PSC-1; 2 – PSC-2; 3 – PNSC-1; 4 – PNSC-2; 5 – коммерческий образец PtRu/C. Токи нормированы на массу Pt. Электролит 0.1 М раствор HClO4 с добавкой 0.5 M CH3OH. Атмосфера Ar.
При сравнении электрохимического поведения исследуемых материалов в РОЭ, по результатам циклической вольтамперометрии, наиболее значительные различия наблюдаются в величинах потенциалов начала электроокисления этанола (Eн) (рис. 7а, табл. 4). Для триметаллических PtSnNi/C-материалов серии PNSC величины Eн примерно на 0.30 В меньше по сравнению с PSC- и PtRu/C-катализаторами. При сравнении величин количества электричества, затраченного на окисление этанола при прямом ходе развертки потенциала $\left( {{{Q}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}}} \right),$ и максимального тока окисления этанола (Imax) (табл. 4, рис. 7a), катализаторы серии PNSC демонстрируют наибольшую масс-активность в РОЭ. Таким образом, по увеличению каталитической активности в РОЭ исследованные материалы располагаются в ряд: PSC-2 ≤ PSC-1 ≤ PtRu/C < PNSC-1 ≤ PNSC-2, несколько отличающийся от ряда активности катализаторов в РОМ. Такое отличие может быть связано с различным механизмом реакций окисления метанола и этанола, в том числе с возможным наличием стадии разрыва связи –С–С– в случае окисления этанола.
Рис. 7.
Циклические вольтамперограммы (а) и хроноамперограммы при потенциале 0.6 В (б) для: 1 – PSC-1; 2 – PSC-2; 3 – PNSC-1; 4 –PNSC-2; 5 – коммерческий образец PtRu/C. Токи нормированы на массу Pt. Электролит – 0.1 М раствор HClO4 с добавкой 0.5 M C2H5OH. Атмосфера Ar.
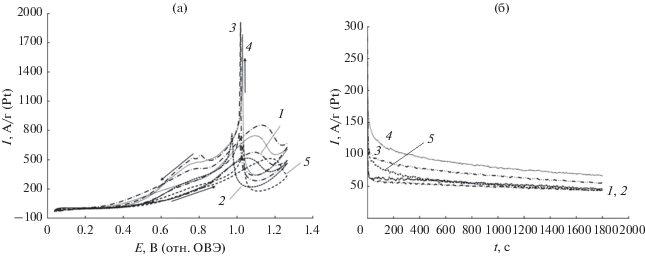
По результатам хроноамперометрии триметаллические PtSnNi/C-материалы демонстрируют большую активность как по величинам начальных токов, так и после 30 мин выдержки при потенциале 0.6 В (рис. 7б, табл. 4). Отметим, что коммерческий PtRu/С-катализатор по результатам хроноамперометрии проявил наименьшую активность в РОЭ.
Таким образом, триметаллические PtSnNi/C-материалы демонстрируют наибольшую каталитическую активность в РОЭ по результатам как ЦВА, так хроноамперометрии при E = 0.6 В. Этот вывод хорошо соответствует результатам работы [49], в которой Pt80Sn10Ni10/C-катализатор продемонстрировал наименьший потенциал начала окисления этанола и наибольшую каталитическую активность во всем диапазоне потенциалов, по сравнению с Pt90Sn10/C-, Pt90Ni10/C- и Pt/C-материалами. Преимущества Pt80Sn10Ni10/C были подтверждены авторами [49], также и результатами тестирования катализаторов в МЭБ: Pt80Sn10Ni10/C-катализатор позволил получить в 3.9 и в 7.8 раз большую максимальную мощность по сравнению, соответственно, с Pt90Sn10/C- и Pt/C-катализаторами. PtSnNi/C-материал, полученный в работе [48], также показал значительно большую активность в РОЭ по сравнению с Pt/C. Повышенная активность PtSnNi/C-катализаторов в РОЭ может быть обусловлена облегчением разрыва связи С–С в молекуле этанола на легированной никелем поверхности платины [49] и наличием частиц диоксида олова, которые легко адсорбируют гидроксильные группы, что облегчает окисление адсорбированных молекул СО при более низких потенциалах.
ВЫВОДЫ
Использование метода электроосаждения Sn и одновременного электроосаждения Sn и Ni на высокодисперсный углеродный материал Vulcan XC-72 позволило получить композитные носители сложного состава, содержащие от 14 до 35% олова и никеля. Методом химического восстановления платины в жидкой фазе на основе полученных композитных носителей были синтезированы катализаторы, содержащие около 20 мас. % Pt при среднем размере кристаллитов от 2.2 до 3.8 нм. В отличие от рентгенограмм носителей, на рентгенограммах платиносодержащих катализаторов PSC и PNSC не наблюдалось отражений фаз Sn, Ni, NiO, Ni(SnOH)6, что может быть обусловлено растворением или превращением этих фаз в процессе химического осаждения платины. Для рентгеновских дифрактограмм PNSC-катализаторов характерно значительное смещение максимумов отражений платины в область больших значений углов 2θ по сравнению с чистой фазой платины, что свидетельствует об образовании в ходе синтеза наночастиц твердого раствора PtNi или PtSnNi.
Установлено, что масс-активность триметаллических материалов серии PNSC в РВК близка к активности коммерческого Pt/C-катализатора, несмотря на меньшую величину ЭХАП, и значительно превышает масс-активность Pt(SnO2/C)-материалов.
Поведение полученных PSC- и PNSC-катализаторов в реакции электроокисления спиртов значительно отличается для окисления метанола и этанола, по-видимому, вследствие различий в механизме окисления этих спиртов. Коммерческий PtRu- и полученные PtSnNi/С-катализаторы серии PNSC обладают большей активностью в реакции окисления метанола, по сравнению с Pt(SnO2/C)-материалами. В то же время PtRu/С-катализатор демонстрирует на 70–90 мВ меньший потенциал начала окисления метанола, по сравнению с триметаллическими катализаторами серии PNSC. С другой стороны, полученные PtSnNi/С-катализаторы по всем параметрам проявляют значительно большую активность, по сравнению с коммерческим PtRu/С-катализатором в РОЭ.
Высокая активность трехкомпонентных PtNiSn/C-катализаторов в реакциях электроокисления спиртов может быть обусловлена сочетанием промотирующего влияния добавки никеля на каталитическую активность платины и облегчением адсорбции гидроксильных групп на включениях олова или наночастицах оксида олова. Таким образом триметаллические катализаторы весьма перспективны для использования в спиртовых топливных элементах. Дальнейшие исследования по оптимизации состава и структуры таких материалов представляют большой интерес.
Список литературы
Ioroi, T., Siroma, Z., Yamazaki, S., and Yasuda, K., Electrocatalysts for PEM Fuel Cells, Advanced Energy Materials, 2018, vol. 9, no. 23, p. 1801284.
Thompsett, D., Catalysts for the Proton Exchange Membrane Fuel Cell, Eds: Vielstich, W., N.Y.: Wiley & Sons, 2003, vol. 3, no. 6, p. 1.
Zhang, J., Wang, X., Wu, C. Wang, H, Yiand, B., and Zhang, H., Preparation and characterization of Pt/C catalysts for PEMFC cathode: effect of different reduction methods, React. Kinet. Catal. Lett, 2004, vol. 83, no. 2, p. 229.
Chen, J., Jiang, C., Yang, X. Feng, L., B. Gallogly, E., and Wang, R., Studies on how to obtain the best catalytic activity of Pt/C catalyst by three reduction routes for methanol electrooxidation, Electrochem. Comm., 2011, vol. 13, no. 4, p. 314.
Prabhuram, J., Zhao, T.S., Wong, C.W., and Guo, J.W., Synthesis and physical/electrochemical characterization of Pt/C nanocatalyst for polymer electrolyte fuel cells, J. Power Sources, 2004, vol. 134, p. 1.
Guterman, V.E., Lastovina, T.A., Belenov, S.V., Tabachkova, N.Yu., Vlasenko, V.G., Khodos, I.I., and Balakshina, E.N., PtM/C (M = Ni, Cu, or Ag) electrocatalysts: Effects of alloying components on morphology and electrochemically active surface areas, J. Solid State Electrochem., 2014, vol. l18, no. 5, p. 1307.
Гутерман, В.Е., Беленов, С.В., Ластовина, Т.А., Фокина, Е.П., Пруцакова, Н.В., Константинова, Я.Б. Микроструктура и электрохимически активная площадь поверхности PtM/C-электрокатализаторов. Электрохимия. 2011. Т. 47. С. 997. [Guterman, V.E., Belenov, S.V., Lastovina, T.A., Fokina, E.P., Prutsakova, N.V., and Konstantinova, Ya.B., Microstructure and electrochemically active surface area of PtM/C electrocatalysts, Russ. J. Electrochem., 2011, vol. 47, p. 933.]
Петрий, О.А. Электросинтез наноструктур и наноматериалов. Успехи химии. 2015. Т. 84. С. 159. [Petriy, O.A., Electrosynthesis of nanostructures and nanomaterials, Uspekhi khimii, 2015, vol. 84, p.159.]
Yohannes, W., Belenov, S.V., Guterman, V.E., Skibina, L.M., Volotchaev, V.A., and Lyanguzov, N.V., Effect of ethylene glycol on electrochemical and morphological features of platinum electrodeposits from chloroplatinic acid, J. Appl. Electrochem., 2015, vol. 45, p. 623.
Leontyev, I.N., Kuriganova, A.B., Kudryavtsev, Y., Dkhil, B., and Smirnova, N.V., New life of a forgotten method: Electrochemical route toward highly efficient Pt/C catalysts for low-temperature fuel cells, Appl. Catal. A, 2012, vol. 431–432, p. 120.
Moffat, T.P., Mallett, J.J., and Hwang, Sun-Mi., Oxygen Reduction Kinetics on Electrodeposited Pt, Pt100 – xNix, and Pt100 – xCox, J. Electrochem. Soc., 2009. vol. 156, p. 238.
Gasteiger, H.A., Kocha, S.S., Sompalli, B., and Wagner, F.T., Progress in the synthesis of carbon nanotube- and nanofiber-supported Pt electrocatalysts for PEM fuel cell catalysis, Appl. Catal. B: Environmental, 2005, vol. 56, p. 9.
Sharma, S. and Pollet, B.G., Support materials for PEMFC and DMFC electrocatalysts–A review, J. Power Sources, 2012, vol. 208, p. 96.
Zhang, M., Yan, Z., Li, Y., Jing, J., and Xie, J., Preparation of cobalt silicide on graphene as Pt electrocatalyst supports for highly efficient and stable methanol oxidation in acidic media, Electrochim. Acta, 2015, vol. 161, p. 48.
Zhao, R., Fu, G., Chen, Z., Tang, Y., Wang, Y., and Huang, S., Novel strategy for the synthesis of hollow Pt–Cu tetradecahedrons as an efficient electrocatalyst toward methanol oxidation, Cryst. Eng. Comm., 2019. vol. 21, p. 1903.
Гутерман, В.Е., Новомлинский, И.Н., Скибина, Л.М., Мауэр, Д.К. Способ получения наноструктурного материала оксида олова на углеродном носителе. Пат. 2656914 (Россия). 2017. [Guterman, V.E., Novomlinsky, I.N., Skibina, L.M., and Mauer, D.K., A method of obtaining a nanostructured material of tin oxide on a carbon carrier. Pat. 2656914 (Russia), 2017.]
Гутерман, В.Е., Новомлинский, И.Н., Алексеенко, А.А., Беленов, С.В., Цветкова, Г.Г., Балакшина, Е.Н. Способ получения катализатора с наноразмерными частицами платины. Пат. 2616190 (Россия). 2017. [Guterman, V.E., Novomlinsky, I.N., Alekseenko, A.A., Belenov, S.V., Tsvetkova, G.G., and Balakshina, E.N., Method for preparing a catalyst with nanosized platinum particles, RF patent for invention, Pat. 2616190 (Russia), 2017.]
Kuriganova, A.B., Leontyeva, D.V., Ivanov, S., Bund, A., and Smirnova, N.V., Electrochemical dispersion technique for preparation of hybrid MOx–C supports and Pt/MOx–C electrocatalysts for low temperature fuel cells, J. Appl. Electrochem, 2016, vol. 46, no. 12, p. 1245.
Saha, M.S., Li, R., Cai, M., and Suna, X., High Electrocatalytic Activity of Platinum Nanoparticles on SnO2 Nanowire-Based Electrodes, Electrochem. and Solid-State Letters, 2007, vol. 10, no. 8, p. 130.
Lee, J.H. and Park, S.J.J., Nanoscaled oxide thin films for energy conversion, Am. Ceram. Soc., 1993, vol. 76, p. 777.
Williams, G. and Coles, G.S.V., Gas sensing properties of nanocrystalline metal oxide powders produced by a laser evaporation technique, J. Mater. Chem., 1998, vol. 8, p. 1657.
Willett, M.J., Burganos, V.N., Tsakiroglou, C.D., and Payatakes, A.C., Gas sensing and structural properties of variously pretreated nanopowder tin(IV) oxide samples, Sens. Actuators B, 1998, vol. 53, p. 76.
Zhang, J. and Gao, L., Synthesis of SnO2 Nanoparticles by the Sol-gel Method From Granulated Tin, Chem. Lett., 2003, vol. 32, p. 458.
De Monredon, S., Cellot, A., Ribot, F., Sanchez, C., Armelao, L., Gueneau, L., and Delattre, L., Synthesis and characterization of crystalline tin oxide nanoparticles, J. Mater. Chem., 2002, vol. 12, p. 2396.
Kumar, P., Khadtare, S., Park, J., and Yadav, B.C., Fabrication of leaf shaped SnO2 nanoparticles via sol–gel route and its application for the optoelectronic humidity sensor, Mater. Lett., 2020, vol. 278, p. 128451.
Song, K.C. and Kang, Y., Preparation of high surface area tin oxide powders by a homogeneous precipitation method, Mater. Lett., 2000, vol. 42, p. 283.
Meiling, Dou, Ming, Hou, Dong, Liang, Wangting, Lu, Zhigang, Shao, and Baolian, Yi, SnO2 nanocluster supported Pt catalyst with high stability for proton exchange membrane fuel cells, Electrochim. Acta, 2013, vol. 92, p. 468.
Zhang, K., Feng, C., He, B., Dong, H., Dai, W., Lu H., and Zhang, X., An advanced electrocatalyst of Pt decorated SnO2/C nanofibers for oxygen reduction reaction, J. Electroanalyt. Chem., 2016, vol. 781, p. 198.
Jiang, L. Colmenares, L. Jusys, Z., Sun, G., and Behm, R., Ethanol electrooxidation on novel carbon supported Pt/SnOx/C catalysts with varied Pt : Sn ratio, Electrochim. Acta, 2007, vol. 53, p. 377.
Gharibi, H., Sadeghi, S., and Golmohammadi, F., Electrooxidation of Ethanol on highly active and stable carbon supported PtSnO2 and its application in passive direct ethanol fuel cell: Effect of tin oxide synthesis method, Electrochim. Acta, 2016, vol. 190, p. 1100.
Li, H., Sun, G., Cao, L., Jiang, L., and Xin, Q., Comparison of different promotion effect of PtRu/C and PtSn/C electrocatalysts for ethanol electro-oxidation, Electrochim. Acta, 2007, vol. 52, no. 24, p. 6622.
Kim, I., Bong, S., Woo, S., Mahajan, R. K., and Kim, H., Highly active 40 wt % PtRu/C anode electrocatalysts for PEMFCs prepared by an improved impregnation method, Intern. J. Hydrogen Energy, 2011, vol. 36, no. 2, p. 1803.
Shi, Y., Zhu, W., Shi, H., Liao F., Fan, Z., and Shao, M., Mesocrystal PtRu supported on reduced graphene oxide as catalysts for methanol oxidation reaction, J. Colloid and Interface Science, 2019, vol. 557, p. 729.
Parreira, L.S., da Silva, J.C.M., D’Villa-Silva, M., Simões, F.C., Garcia, S., Gaubeur, I., Cordeiro, M.A.L., Leite, E.R., and dos Santos, M.C., PtSnNi/C nanoparticle electrocatalysts for the ethanol oxidation reaction: Ni stability study, Electrochim. Acta., 2013, vol. 96, p. 243.
Bonesi, A., Garaventa, G., Triaca, W., and Castroluna, A., Synthesis and characterization of new electrocatalysts for ethanol oxidation Intern. J. Hydrogen Energy, 2008, vol. 33, № 13, p. 3499.
Parreira, L.S., Antoniassi, R.M., Freitas, I.C., de Oliveira, D.C., Spinacé, E.V., Camargo, P.H.C., and dos Santos, M.C., MWCNT–COOH supported PtSnNi electrocatalysts for direct ethanol fuel cells: Low Pt content, selectivity and chemical stability, Renewable Energy, 2019, vol. 143, p. 1397.
Flórez-Montaño, J., García, G., Guillén-Villafuerte, O., Rodríguez, J.L., Planes, G.A., and Pastor, E., Mechanism of ethanol electrooxidation on mesoporous Pt electrode in acidic medium studied by a novel electrochemical mass spectrometry set-up, Electrochim. Acta, 2016, vol. 209, p. 121.
Петрий, О.А. Прогресс в понимании механизмов электроокисления метанола и муравьиной кислоты на платиновых металлах (обзор). Электрохимия. 2019. Т. 55. С. 3. [Petrii, O.A., The progress in understanding the mechanisms of methanol and formic acid electrooxidation on platinum group metals (a review), Russ. J. Electrochem., 2019, vol. 55, p. 1.]
Новомлинский, И.Н., Гутерман, В.Е., Даниленко, М.В., Волочаев, В.А. Платиновые электрокатализаторы, нанесенные на композиционный оксидно-углеродный носитель. Электрохимия. 2019. Т. 55. С. 885. [Novomlinskiy, I. N., Guterman, V.E., Danilenko, M.V., and Volochaev, V.A., Platinum Electrocatalysts Deposited onto Composite Carbon Black–Metal Oxide Support, Russ. J. Electrochem., 2019, vol. 55, p. 690.]
Зенин, В.В., Спиридонов, Б.А., Березина, Н.Н., Кочергин, А.В. Исследование процесса электро- осаждения и структуры покрытий сплавом олово-никель. Технологии в электрон. промышленности. 2007. Т. 7. С. 32.
Suryanarayana, C. and Norton, M.G., X-ray diffraction: a practical approach Suryanarayana C, Springer Science & Business Media, 2013, p. 273.
Gražulis, S., Daškevič, A., Merkys, A., Chateigner, D., Lutterotti, L., Quirós, M., Serebryanaya, N.R., Moeck, P., Downs, R.T., and Le Bail, A., Crystallography Open Database (COD): an open-access collection of crystal structures and platform for world-wide collaboration, Nucleic Acids Res., 2012, vol. 40, no. D1, p. 420.
Киракосян, С.А., Алексеенко, А.А., Гутерман, В.Е., Волочаев, В.А., Табачкова, Н.Ю. Влияние атмосферы со на морфологию и электрохимически активную площадь поверхности в ходе синтеза Pt/C и Pt–Ag/C электрокатализаторов, Российские нанотехнологии. 2016. Т. 11. № 5–6. С. 23. [Kirakosyan, S.A., Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Tabachkova, N.Y., Effect of CO atmosphere on morphology and electrochemically active surface area in the synthesis of Pt/C and PtAg/C electrocatalysts., Nanotechnologies in Russia, 2016, vol. 11, p. 287.]
Shinozaki, K., Zack, J.W., Pylypenko, S., Pivovar, B.S., and Kocha, S.S., Oxygen Reduction Reaction Measurements on Platinum Electrocatalysts Utilizing Rotating Disk Electrode Technique: II. Influence of Ink Formulation, Catalyst Layer Uniformity and Thickness, J. Electrochem. Soc., 2015, vol. 162, p. 1384.
Kim, J.H., Choi, S.M., Nam, S.H., Seo, M.H., Choi, S.H., and Kim, W.B., Influence of Sn content on PtSn/C catalysts for electrooxidation of C1–C3 alcohols: synthesis, characterization, and electrocatalytic activity, Appl Catal B, 2008, vol. 82, p. 89.
Colmati, F., Antolini, E., and Gonzalez, E.R., Ethanol oxidation on a carbon-supported Pt75Sn25 electrocatalyst prepared by reduction with formic acid: effect of thermal treatment, Appl Catal B, 2007, vol. 73, p. 106.
Antolini, E., Salgado, J.R.C., and Gonzalez, E.R., Carbon supported Pt75M25 (M 1/4 Co, Ni) alloys as anode and cathode electrocatalysts for direct methanol fuel cells, J. Electroanal. Chem., 2005, vol. 580, p. 145.
Correa, P.S., da Silva, E.L., da Silva, R.F., Radtke, C., Moreno, B., Chinarro, E., and Malfatti, C.F., Effect of decreasing platinum amount in Pt–Sn–Ni alloys supported on carbon as electrocatalysts for ethanol electrooxidation, Intern. J. Hydrogen Energy, 2012, vol. 37, no. 11, p. 9314.
Beyhan, S., Léger, J.-M., and Kadırgan, F., Pronounced synergetic effect of the nano-sized PtSnNi/C catalyst for ethanol oxidation in direct ethanol fuel cell, Appl. Catal. B: Environmental, 2013, vol. 130, p. 305.
Kumeda, T., Otsuka, N., Tajiri, H., Sakata, O., Hoshi, N., and Nakamura, M., Interfacial structure of PtNi surface alloy on Pt(111) electrode for oxygen reduction reaction, ACS Omega, 2017, vol. 2, p. 1858.
Stamenković, V., Schmidt, T.J., Ross, P.N., and Marković, N.M., Surface composition effects in electrocatalysis: kinetics of oxygen reduction on well-defined Pt3Ni and Pt3Co alloy surfaces, J. Phys. Chem., 2002, vol. 106, p. 11970.
Jenkins, R. and Snyder, R.L., Introduction to X-Ray Powder Diffractometry, John Wiley & Sons, 1996.
Travitsky, N., Ripenbein, T., Golodnitsky, D., Rosenberg, Y., Burshtein, L., and Peled, E., Pt-, PtNi- and PtCo-supported catalysts for oxygen reduction in PEM fuel cells, J. Power Sources, 2006, vol. 161, p. 782.
Wiltshire, R.J.K., King, C.R., Rose, A., Wells, P.P., Davies, H., Hogarth, M.P., Thompsett, D., Theobald, B., Mosselmans, F.W., Roberts, M., and Russell, A.E., Effects of composition on structure and activity of PtRu/C catalysts, Phys. Chemistry Chem. Physics, 2009, vol. 11, no. 13, p. 2305.
Petrii, O.A., Pt–Ru electrocatalysts for fuel cells: a representative review, J. Solid State Electrochem., 2008, vol. 12, p. 609.
Chen, Y. and Wang, J., Atomic layer deposition assisted Pt–SnO2 hybrid catalysts on nitrogen-doped CNTs with enhanced electrocatalytic activities for low temperature fuel cells, Intern. J. Hydrogen Energy, 2011, vol. 36, no. 17, p. 11085.
Ruiz Camacho, B., Morais, C., Valenzuela, M.A., and Alonso-Vante, N., Enhancing oxygen reduction reaction activity and stability of platinum via oxide-carbon composites, Catal. Today, 2013, vol. 202, p. 36.
Khorasani-Motlagh, M., Noroozifar, M., and Ekrami-Kakhki, M.-S., Investigation of the nanometals (Ni and Sn) in platinum binary and ternary electrocatalysts for methanol electrooxidation, Intern. J. Hydrogen Energy, 2011, vol. 36, p. 11554.
Menshchikov, V., Alekseenko, A., Guterman, V., Nechitailov, A., Glebova, N., Tomasov, A., Spiridonova, O., Belenov, S., Zelenina, N., and Safronenko, O., Effective platinum–copper catalysts for methanol oxidation and oxygen reduction in proton-exchange membrane fuel cell, Nanomaterials, 2020, vol. 10, no. 4, p. 742.
Дополнительные материалы отсутствуют.