Электрохимия, 2021, T. 57, № 8, стр. 449-456
Электропроводность In2(MoO4)3 и композитов состава (1 – х)In2(MoO4)3–хMoO3
Н. Н. Пестерева a, *, А. Ф. Гусева a, Я. А. Дале a
a Уральский федеральный университет им. первого президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: Natalie.Pestereva@urfu.ru
Поступила в редакцию 16.10.2020
После доработки 11.01.2021
Принята к публикации 14.02.2021
Аннотация
Синтезирован молибдат индия и эвтектические композиты на его основе состава (1 ‒ х)In2(MoO4)3–хMoO3 (где х = 0; 0.1; 0.3; 0.5 мол. доли), исследована их проводимость в зависимости от температуры и давления кислорода в газовой фазе. Числа переноса носителей заряда определены методом Тубандта. Установлено, что In2(MoO4)3 является ионным проводником, одним из основных носителей заряда в котором является молибдат-ион ${\text{MoO}}_{4}^{{2 - }}.$ Обнаружено, что в системе In2(MoO4)3–MoO3 композитный эффект проводимости отсутствует: при 600°С электропроводность композитов (1 – х)In2(MoO4)3–хMoO3 не зависит от содержания MoO3. Отсутствие композитного эффекта, вероятно, связано с отрицательным коэффициентом термического расширения In2(MoO4)3, что препятствует образованию сплошной высокопроводящей пленки на межфазной границе In2(MoO4)3|MoO3.
ВВЕДЕНИЕ
Исследуемые в настоящей работе объекты относятся к простым и сложным оксидам и являются функциональными материалами, и при определенной доработке, могут использоваться как полупроводниковые, магнитные, оптические, конструкционные материалы с определенными термическими, механическими или химическими свойствами. Физико-химические свойства, структура и применение оксидов молибдена и индия хорошо известны [1–5]. MoO3, In2O3, а также In2(MoO4)3, образующийся в результате реакции между первыми двумя оксидами, являются компонентами активных и селективных катализаторов различных процессов окисления органических соединений,
Согласно данным работы [6], в системе In2O3–MoO3 существует только одно соединение – In2(MoO4)3. Данное вещество в воздушной атмосфере разлагается при температуре 935оС на простые оксиды, в результате чего образуется эвтектическая смесь In2(MoO4)3 + In2O3 (MoO3 сублимирует). Система In2(MoO4)3–MoO3 – простая эвтектическая. Эвтектический состав содержит 2.5 мол. % In2(MoO4)3 и 97.5 мол. % MoO3, температура эвтектической горизонтали составляет 780 ± 5°С. Ниже температуры плавления система представляет собой смесь In2(MoO4)3 + MoO3.
Как и многие вещества состава A2(MO4)3, где A – трехвалентный металл, а M – Mo или W, молибдат индия принадлежит к структурному типу вольфрамата скандия Sc2(WO4)3. Фазы со структурой типа Sc2(WO4)3 обладают орторомбической симметрией (пространственная группа Pcna [7]). Данная структура описывается как трехмерный каркас, построенный из изолированных тетраэдров MO4, которые связаны вершинами с октаэдрами AO6 [7]. Как и многие вещества с подобной структурой, молибдат индия обладает отрицательным коэффициентом термического расширения [8].
На сегодняшний день в литературе представлен ряд сведений о характере проводимости в соединениях типа A2(MO4)3 (A = Al, In, Sc и др, M = = W, Mo), но эти данные весьма противоречивы. В работах, опубликованных до 2008 г. утверждается, что доминирующая ионная проводимость A2(MO4)3 связана с миграцией катиона A3+. После 2008 г. появились работы, в которых на основании совокупности экспериментальных результатов и расчетных методов авторы приходят к выводу, что основными носителями заряда в подобных фазах являются ионы O2– и ${\text{MO}}_{4}^{{2 - }}.$ В частности, такой результат получен при моделировании ионного переноса в Sc2(WO4)3 методом молекулярной статики [9].
В последнее десятилетие появился ряд работ, в которых было показано, что гетерогенное допирование вольфраматов и молибдатов двух- и трехвалентных металлов электронным проводником – оксидом вольфрама, оксидом молибдена либо оксидом ванадия, приводит к резкому росту ионной проводимости [10–14]. Авторы [10–16] исследовали транспортные свойства полученных в результате гетерогенного допирования композитов AWO4–WO3 (А – Ca, Sr, Ba) и A2(WO4)3–WO3 (А – Sm, Al, In, Sc) и пришли к заключению, что основным носителем заряда в них являются ионы кислорода, О2–. Таким образом, полученные материалы имеют перспективу использования в качестве кислород-ионных твердых электролитов.
Поскольку электрические и транспортные свойства In2(MoO4)3 изучены недостаточно, в настоящей работе была поставлена задача исследовать природу проводимости In2(MoO4)3 и проанализировать изменение транспортных свойств при его гетерогенном допирование оксидом молибдена MoO3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы для исследования
В работе использовали порошки оксида молибдена и молибдата индия In2(MoO4)3, синтезированного по керамической технологии из MoO3 “ос. ч.” и In2O3 “ос. ч.”.
Синтез проводили на воздухе согласно уравнению:
при ступенчатом повышении температуры (550–800°С) с промежуточными перетираниями; время отжига на каждой стадии от 10 до 30 ч.Для приготовления композитов использовали синтезированный в настоящей работе In2(MoO4)3, а также порошки MoO3 в микроскопическом и наноразмерном состояниях. Нанопорошок MoO3 был получен лазерным испарением мишени оксида молибдена и предоставлен Институтом электрофизики УрО РАН. Средний размер зерен MoO3 – 34 нм. Размер зерен оксида молибдена в микросостоянии составлял приблизительно 5 мкм.
Композиты (1 – х)In2(MoO4)3–хMoO3, где х = = 0–0.5 мол. доли, получены механическим смешением исходных компонентов In2(MoO4)3 и MoO3, взятых в соответствующих пропорциях в среде этилового спирта. Брикетирование порошков проводили на ручном гидравличeскoм прессе в стальной прессформе. Брикеты композитов (1 – х)In2(MoO4)3–хMoO3 спекали при 600°С в течение 5 ч. Выбор температуры спекания обусловлен чрезвычайно высокой летучестью оксида молибдена. При температуре 600°С давление его паров в газовой фазе составляет 2.2 × 10–6 атм, при 650°С – 3.3 × 10–5 атм [17]. Поэтому с твердым оксидом молибдена, как правило, работают при температуре не выше 600°C. После спекания брикеты шлифовали до получения ровных плоскопараллельных поверхностей. Для электрических измерений на торцевые поверхности брикетов наносили мелкодисперсную платину, которую припекали при 600°С в течение 3 ч.
Относительную плотность брикетов определяли исходя из их геометрических параметров и массы. Относительная плотность брикетов вольфрамата индия и композитов составила 80–85%.
Экспериментальные методики
Электропроводность молибдата индия и композитов на его основе измеряли методом импедансной спектроскопии с помощью прибора Immittance Parameters Meter IPI1 (Институт проблем управления им. Трапезникова, Москва) в частотном диапазоне 500 Гц–1 МГц (амплитуда тестового сигнала автоматически изменяется в диапазоне 3–300 мВ) в интервале температур 440–800°С для In2(MoO4)3 и 400–600°С для (1 – х)In2(MoO4)3–хMoO3. Зависимость проводимости от парциального давления кислорода измеряли в изотермических условиях. Давление кислорода задавали с помощью прибора ZirconiaM и контролировали кислородным насосом и датчиком из твердого электролита на основе ZrO2(Y2O3).
Измерения чисел переноса методом Тубандта проводили по методике, подробно описанной в [18]. Подготовленные брикеты молибдата индия собирали в двухсекционную ячейку:
(2)
$\left( - \right)Pt\left| {I{{n}_{2}}{{{\left( {Mo{{O}_{4}}} \right)}}_{3}}} \right|I{{n}_{2}}{{\left( {Mo{{O}_{4}}} \right)}_{3}}|Pt\left( + \right).$Эксперимент проводили при температуре 750°C, на ячейку накладывали напряжение U = = 300 В, сила тока I не превышала 1–2 мА. Количество электричества Q, пропускаемое через ячейку, варьировали от 18 до 75 Кл.
Для изучения процессов на межфазной границе были проведены контактные отжиги брикетов MoO3 и In2(MoO4)3 при 600°C в симметричной ячейке:
(3)
$Pt\left| {Mo{{O}_{3}}} \right|I{{n}_{2}}{{\left( {Mo{{O}_{4}}} \right)}_{3}}\left| {Mo{{O}_{3}}} \right|Pt.~$Времена отжигов составили от 3 до 70 ч. Вся система помещалась в холодную печь и разогревалась до необходимой температуры. Температуру задавали с помощью терморегулятора Варта ТП703. Время выхода на изотермический режим составляло около 2 ч. Контроль развития процесса осуществляли взвешиванием контактирующих брикетов до и после отжига (определяли Δm в результате опыта).
Рентгенофазовый анализ молибдата индия и композитов проводили с помощью дифрактометра Bruker D8 ADVANCE с CuKα-излучением.
Электронно-микроскопическое исследование сколов брикетов образцов проводили на микроскопе Hitachi Tabletop Microscope TM-1000 с системой X-ray elemental analysis systems (EDS).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Результаты рентгенофазового анализа
Согласно РФА, молибдат индия был получен однофазным, композиты были получены двухфазными и содержали только исходные компоненты – In2(MoO4)3 и MoO3. Таким образом, химического взаимодействия исходных компонентов не происходило, что находится в соответствии с фазовой диаграммой [6], согласно которой в системе In2O3–MoO3 образуется единственное соединение – In2(MoO4)3.
Исследование природы проводимости In2(MoO4)3
Поскольку в литературе отсутствуют однозначные данные по характеру проводимости молибдата индия, то в работе проведено исследование зависимости электропроводности In2(MoO4)3 от температуры и определен тип носителей заряда в данном веществе.
Температурная зависимость проводимости молибдата индия представлена на рис. 1.
Эффективная энергия активации проводимости составляет 0.6 эВ во всем исследованном температурном интервале. Это значение близко к энергии активации вольфраматов индия, скандия и алюминия, изоструктурных In2(MoO4)3, которая, по данным [9, 19], лежит в пределах от 0.6 до 0.8 эВ.
Зависимость проводимости In2(MoO4)3 от парциального давления кислорода при разных температурах представлена на рис. 2. Как видно из рис. 2, проводимость молибдата индия не зависит от ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ что указывает на ее ионный характер. Величина проводимости и факт отсутствия ее зависимости от давления кислорода хорошо согласуются с результатами работы [20]. Для уточнения типа носителя заряда в In2(MoO4)3 была проведена серия опытов по Тубандту в ячейке (2).
Рис. 2.
Зависимость проводимости In2(MoO4)3 от парциального давления кислорода в газовой фазе: (1) 550, (2) 600, (3) 700, (4) 700°С (по данным работы [20]).

Типичная картина изменения масс секций ячейки (2) представлена на рис. 3. Уменьшение массы катодной секции и увеличение массы анодной свидетельствует о том, что основной поток массопереноса направлен от катода к аноду, т.е. частица, переносящая массу, заряжена отрицательно. Так как перенос O2– не может привести к изменению массы, вероятно, что этой отрицательной частицей является ${\text{МоО}}_{4}^{{2 - }}.$
Рис. 3.
Зависимость изменения масс секций ячейки (2) от количества пропущенного электричества (Т = = 750°С, τ = 74 ч, Q = 75 Кл).

Возможные электродные реакции:
(4)
$\begin{gathered} \left( - \right)2I{{n}_{2}}{{(Мо{{O}_{4}})}_{3}} + 3{{O}_{2}} + 12e \to \,~ \\ \to 2I{{n}_{2}}{{O}_{3}} + 6МоO_{4}^{{2 - }}, \\ \end{gathered} $Ион [MoO4]2– двигается от катода к аноду, при этом масса католита уменьшается. На аноде [МоO4]2– окисляется до оксида молибдена, увеличивая массу анодной секции. Оксид молибдена, как было упомянуто выше, весьма летуч и при температуре эксперимента (750°С) сильно возгоняется [17], поэтому прирост массы анолита существенно меньше, чем убыль массы католита.
В результате электродных реакций (4), (5) на катоде должен образоваться In2O3, а на аноде – МоO3. Присутствие In2O3 в месте контакта катодного брикета In2(MoO4)3 с платиновым электродом обнаружено как методом РФА, так и визуально: поверхность брикета In2(MoO4)3 приобрела желтоватый оттенок, характерный для In2O3. Присутствия же оксида молибдена в анодной секции методом РФА и визуально обнаружено не было, по-видимому, из-за его малого количества вследствие возгонки.
Используя закон Фарадея и учитывая, что величина Δm(–) равна массе MoO3, перенесенного током из катодной в анодную секцию, рассчитали число переноса ионов ${\text{MoO}}_{4}^{{2 - }}$ по формуле:
(6)
${{t}_{{{\text{MoO}}_{4}^{{2 - }}}}} = \frac{{\Delta {{m}^{{( - )}}}}}{{{{M}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{z}_{{{\text{MoO}}_{{\text{4}}}^{{{\text{2}} - }}}}}\frac{F}{Q},$Расчет по (6) дал значение ${{t}_{{{\text{MoO}}_{4}^{{2 - }}}}}$ ≈ 0.1.
Далее, поскольку для In2(MoO4)3 Σtион = 1, то сравнение значений ${{t}_{{{\text{MoO}}_{4}^{{2 - }}}}}$ и Σtион указывает на наличие еще одного ионного носителя, перенос которого не дает вклада в изменение массы. Очевидно, что этим ионным носителем является ион кислорода, число переноса которого ${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ = 0.9.
Полученный результат хорошо согласуется с результатами исследований характера проводимости вольфраматов A2(WO4)3 с такой же структурой [18]. Так, для Al2(WO4)3${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ = 0.85, ${{t}_{{{\text{WO}}_{4}^{{2 - }}}}}$ = 0.15; для Sc2(WO4)3${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ = 0.7, ${{t}_{{{\text{WO}}_{4}^{{2 - }}}}}$ = 0.3 и для In2(WO4)3${{t}_{{{{{\text{O}}}^{{2 - }}}}}}$ = 0.65, ${{t}_{{{\text{WO}}_{4}^{{2 - }}}}}$ = 0.35. Таким образом, было показано, что ионная проводимость в вольфраматах A2(WO4)3 осуществляется ионами кислорода и вольфрамат-ионами [18].
Предположительно, кислородная проводимость в молибдате индия осуществляется по вакансионному механизму, как и в других изоструктурных ему молибдатах и вольфраматах [9, 15]. Механизм миграции ${\text{MoO}}_{4}^{{2 - }}$ $\left( {{\text{WO}}_{4}^{{2 - }}} \right)$ в молибдатах и вольфраматах описан ранее в работах Неймана [15, 18] и обоснован расчетами методами молекулярной статистики и динамики с параллельными рентгенографическими исследованиями в работе Адамса [9]. Микромеханизм такого транспорта заключается в последовательном “переползании” комплексов MoO3 (WO3) при переключении (не разрыве) связей Mo–O (W–O), т.е. перенос многовалентного металла осуществляется совместно с кислородом. При этом состав простейшей подвижной формы, в которой переносится многовалентный атом, отвечает формуле MoO3 (WO3). Данные группировки могут образовываться по реакции:
что с формальной точки зрения эквивалентно:Проводимость композитов (1 – х)In2(MoO4)3–хMoO3
С целью выяснить, как степень дисперсности MoO3 влияет на проводимость композитов, были проведены измерения электропроводности композитов 0.9In2(MoO4)3–0.1MoO3, содержащих микро и нано-MoO3 (рис. 4).
Рис. 4.
Политермы проводимости композитов состава 0.9In2(MoO4)3–0.1MoO3, содержащих нано (1) и микро (2) MoO3.

Как видно из рисунка, в области низких температур проводимость композита, содержащего нано-MoO3, приблизительно на 0.2 порядка выше проводимости композита с добавкой микро-MoO3. Однако с повышением температуры это небольшое различие полностью нивелируется, и при 600°С проводимость композитов c нано-MoO3 и микро-MoO3 одинакова. Последнее связано с процессами рекристаллизации оксида молибдена, который переходит из нано- в микросостояние. Этот факт был установлен методом электронной микроскопии. На рис. 5 представлено СЭМ-изображение скола брикета композита 0.5In2(MoO4)3–0.5MoO3, в котором в качестве дисперсной добавки был использован нано-MoO3. Размер зерен оксида молибдена в композите, спеченном при 600°С (рис. 5), составляет 5–7 мкм, что на порядки больше первоначального размера зерен MoO3 (34 нм).
Таким образом, из-за сильной рекристаллизации зерен MoO3 при нагревании использование нанооксида молибдена для получения композитов нецелесообразно, поэтому далее исследовали композиты с добавками микро-MoO3.
На рис. 6 представлены политермы проводимости In2(MoO4)3, MoO3 и композитов (1 – х)In2(MoO4)3–хMoO3. Для большей части составов зависимость логарифма электропроводности от обратной температуры имеет линейный характер.
Рис. 6.
Температурные зависимости общей проводимости композитов (1 – х)In2(MoO4)3–хMoO3 и исходных компонентов.
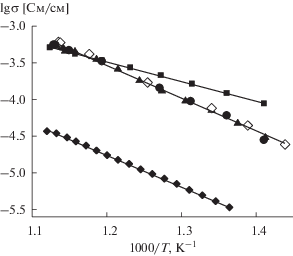
На рис. 6 видно, что добавка оксида молибдена к молибдату индия приводит к уменьшению проводимости в области низких температур (менее 500°С). При температуре ниже 500°С электропроводность композитов является промежуточной между проводимостью исходных компонентов (выше, чем у MoO3, но ниже, чем у In2(MoO4)3). Энергия активации проводимости композитов (0.9 эВ) совпадает с энергией активации MoO3, но существенно выше, чем энергия активации проводимости In2(MoO4)3 (0.6 эВ). Вследствие этого, при повышении температуры проводимость композитов приближается к проводимости In2(MoO4)3, и в области температур 500–600°С значения электропроводности In2(MoO4)3 и композитов близки.
Концентрационная зависимость проводимости (1 – х)In2(MoO4)3–хMoO3 при 600°С имеет вид горизонтали, что демонстрирует отсутствие зависимости электропроводности композитов от содержания MoO3. Более того, при низких температурах добавка MоO3 приводит к уменьшению проводимости композитов по сравнению с In2(MoO4)3, рис. 7.
Рис. 7.
Концентрационная зависимость проводимости композитов (1 – х)In2(MoO4)3–хMoO3 при 500 (1) и 600°С (2).

Таким образом, композитный эффект проводимости в системе In2(MoO4)3–MoO3 отсутствует.
Для того, чтобы установить характер проводимости композитов, были измерены зависимости электропроводности композитов 0.9In2(MoO4)3–0.1MoO3 от парциального давления кислорода в газовой фазе при температурах 500 и 600°С, представленные на рис. 8.
Рис. 8.
Зависимость проводимости композита 0.9In2(MoO4)3–0.1MoO3 от давления кислорода в газовой фазе при 500 (1) и 600°С (2).

На рис. 8 можно видеть, что проводимость композитов в исследуемом интервале PO2 не зависит от давления кислорода, что указывает на ее ионный характер. Таким образом в композитах 0.9In2(MoO4)3–0.1MoO3, как и в матрице In2(MoO4)3, электроперенос осуществляется преимущественно ионами, предположительно О2– и ${\text{MoO}}_{4}^{{2 - }}.$
Твердофазное растекание МoO3 по поверхности In2(MoO4)3
Ранее было показано [10–14], что для всех систем AWO4–WO3 и A2(WO4)3–WO3, в которых был обнаружен композитный эффект проводимости, характерно явление твердофазного растекания оксида вольфрама(VI) по внутренней поверхности керамики вольфраматов со структурой шеелита или дефектного шеелита. В связи с этим, представляет интерес прояснить, имеется ли связь между наличием в системе композитного эффекта проводимости и явлением самопроизвольного твердофазного растекания гетерогенной добавки по поверхности зерен матрицы?
С этой целью в настоящей работе предпринято исследование процесса самопроизвольного распространения оксида молибдена по внутренней поверхности керамики In2(MoO4)3.
Для изучения самопроизвольных процессов, происходящих на границе In2(MoO4)3|MoO3, были проведены контактные отжиги в ячейке (3). В результате отжигов происходило увеличение массы брикета In2(MoO4)3 и уменьшение массы брикетов MoO3, причем суммарная убыль масс брикетов MoO3 превышала прибыль массы брикета In2(MoO4)3 во всех опытах, что связано с частичной возгонкой МоО3. Прирост массы брикета In2(MoO4)3 был прямо пропорционален времени отжига, рис. 9.
Рис. 9.
Зависимость изменения массы брикета In2(MoO4)3 от времени отжига в контакте с MoO3 (Т = 600°С).

In2(MoO4)3 с обеих контактных сторон приобретал желтоватый оттенок и блеск (свойства, характерные для MoO3). Методом РФА контактных поверхностей брикета In2(MoO4)3 был обнаружен оксид молибдена. Брикеты MoO3 внешне не изменялись, на их поверхности методом РФА молибдат индия не был обнаружен.
СЭМ-ЭДА исследование поперечного сечения брикета In2(MoO4)3 после отжига в контакте с MoO3 в спонтанных условиях (Т = 600°С, τ = 70 ч), показало, что брикет молибдата индия значительно обогащен по молибдену вдоль всей его толщины. Среднее соотношение Mo/In по сколу таблетки равно 2.8, в то время как в стехиометрическом молибдате оно 1.5. Логично предположить, что такой результат – следствие переноса оксида молибдена в брикет молибдата индия. Таким образом, в результате контактных отжигов МоО3 распространяется по внутренней поверхности In2(MoO4)3, и брикет молибдата индия превращается в двухфазный композит.
ЗАКЛЮЧЕНИЕ
Отсутствие композитного эффекта в исследуемой системе свидетельствует о том, что композит In2(MoO4)3–MoO3 имеет статистическую распределенную структуру. Это структура, при которой зерна обеих фаз, составляющих композит, равномерно распределены по объему. Ни одна из фаз не образует сплошной пленки на поверхности другой, вследствие чего на межфазной границе матрица/дисперсная добавка не образуется высокопроводящей поверхностной фазы или аморфизованного слоя, которые, как правило, являются причиной возникновения композитного эффекта в композитах максвелловского типа (с матричной распределенной структурой) [10, 11]. Причина того, что поверхностная микрофаза или аморфизованный слой не образуются, может быть связана с тем, что сопрягаемые фазы имеют противоположные коэффициенты термического расширения: у молибдата индия он отрицательный [8], а у оксида молибдена – положительный [21]. Это, по-видимому, препятствует образованию сплошной пленки оксида молибдена на поверхности зерен молибдата, и, как следствие, на межфазной границе In2(MoO4)3|MoO3 не может быть образована поверхностная высокопроводящая микрофаза.
Аналогичная ситуация описана в литературе для композитов, в которых роль матрицы выполняли вольфраматы трехвалентных металлов (A2(WO4)3, A – In, Sc), а в качестве дисперсионной добавки выступал электронный полупроводник оксид вольфрама [15]. При добавлении дисперсной добавки до 30 об. % проводимость не изменялась и носила ионный характер, при больших содержаниях (>30 об. %) происходил рост проводимости за счет электронной составляющей. Во всех исследованных системах матрица имела структуру вольфрамата скандия и отрицательный КТР. Напротив, в системе Sm2(WO4)3–WO3, в которой в качестве матрицы использовался вольфрамат самария со структурой дефектного шеелита и обе сопрягаемые фазы имели положительный КТР, наблюдали резкий рост ионной проводимости при добавлении к вольфрамату самария 2–15% электронного проводника WO3 [22], что авторы связывают с образованием высокопроводящей поверхностной неавтономной фазы на межфазной границе Sm2(WO4)3|WO3. На основе вышеизложенных фактов можно предположить, что противоположные значения КТР матрицы и наполнителя являются причиной отсутствия композитного эффекта проводимости в исследуемой системе.
Список литературы
He, T. and Yao, J., Photochromism of molybdenum oxide, J. Photochem. Photobiol. C: Photochem. Rev., 2003, vol. 4, p. 125.
Gurlo, A., Bârsan, N., Ivanovskaya, M., Weimar, U., and Göpel, W., In2O3 and MoO3–In2O3 thin film semiconductor sensors: interaction with NO2 and O3, Sens. Actuators B., 1998, vol. 47, p. 92.
Epifani, M., Siciliano, P., Gurlo, A., Barsan, N., and Weimar, U., Ambient pressure synthesis of corundum – type In2O3, J. Am. Chem. Soc., 2004, vol. 126, p. 4078.
Solov’eva, A.E., Phase transformations in polycrystalline indium oxide, Refract. Ind. Ceram., 1987, vol. 28, p. 380.
Yu, D., Wang, D., and Qian, Y., Synthesis of metastable hexagonal In2O3 nanocrystals by a precursor – dehydratation route under ambient pressure, J. Solid State Chem., 2004, vol. 177, p. 1230.
Filipek, E., Rychlowska-Himmel, I., and Paczesna, A., Thermal stability of In2(MoO4)3 and phase equilibria in the MoO3–In2O3 system, J. Therm. Anal. Calorim., 2012, vol. 109, p. 711.
Порай-Кошиц, М.А., Атовмян, Л.О. Кристаллохимия и стехиометрия координационных соединений молибдена, М: Наука, 1974, 232 с. [Poray-Koshyts, M.A. and Atovmyan, L.O., Crystal chemistry and stoichiometry of coordination compounds of molybdenum (in Russian), Moscow: Nauka, 1974. 232 p.]
Fisher, D.J., Negative Thermal Expansion Materials, Materials Research Foundations, 2018, vol. 22, p. 178.
Zhou, Y., Adams, S., Rao, P.R., Edwards, D.D., Neiman, A., and Pestereva, N., Charge Transport by Polyatomic Anion Diffusion in Sc2(WO4)3, Chem. Mater., 2008, vol. 20, p. 6335.
Нейман, А.Я., Пестерева, Н.Н., Шарафутдинов, А.Р. и др. Проводимость и числа переноса метакомпозитов MeWO4–WO3 (Me – Ca, Sr, Ba). Электрохимия. 2005. Т. 41. С. 680. [Neiman, A.Ya., Pestereva, N.N., Sharafutdinov, A.R., et al., Conduction and transport numbers in metacomposites MeWO4–WO3 (Me – Ca, Sr, Ba), Russ. J. Electrochem., 2005, vol. 41, p. 598.]
Пестерева, Н.Н., Жукова, А.Ю., Нейман, А.Я. Числа переноса носителей и ионная проводимость эвтектических метакомпозитов {MеWO4·хWO3} (Mе – Sr, Ba). Электрохимия. 2007. Т. 43. С. 1379. [Pestereva, N.N., Zhukova, A.Yu., and Neiman, A.Ya., Transport numbers and ionic conduction of eutectic methacomposites {MeWO4·xWO3} (Me – Sr, Ba), Russ. J. Electrochem., 2007, vol. 43, p. 1305.]
Партин, Г.С., Пестерева, Н.Н., Корона, Д.В., Нейман, А.Я. Влияние состава композитов {(100 – x)CaWO4–xV2O5} и {(100 – x)LaVO4–xV2O5} на их электропроводность. Электрохимия. 2015. Т. 51. С. 1071. [Partin, G.S., Pestereva, N.N., Korona, D.V., and Neiman, A.Y., Effect of composition of {(100 – x)CaWO4–xV2O5} and {(100 – x)LaVO4–xV2O5} composites on their conductivity, Russ. J. Electrochem., 2015, vol. 51, p. 945.]
Котенёвa, Е.А., Пестеревa, Н.Н., Анимицa, И.Е., Уваров, Н.Ф. Транспортные свойства метакомпозитов в эвтектических системах MAO4–V2O5 (M = = Ca, Sr; A = W, Mo). Электрохимия. 2017. Т. 53. С. 833. [Koteneva, E.A., Pestereva, N.N., Animitsa, I.E., and Uvarov, N.F., Transport properties of metacomposites in eutectic systems MAO4–V2O5 (M = Ca, Sr; A = W, Mo), Russ. J. Electrochem., 2017, vol. 53, p. 739.]
Котенева, Е.А., Пестерева, Н.Н., Астапова, Д.В., Нейман, А.Я., Анимица, И.Е. Транспортные свойства на границе SrMoO4|MoO3 и свойства композитных фаз на их основе. Электрохимия. 2017. Т. 53. С. 208. [Koteneva, E.A., Pestereva, N.N., Astapova, D.V., Neiman, A.Y., and Animitsa, I.E., Transport properties of SrMoO4|MoO3 composites, Russ. J. Electrochem., 2017, vol. 53, p. 187.]
Нейман, А.Я., Карапетян, А.В., Пестерева, Н.Н. Проводимость композитных материалов на основе Me2(WO4)3 и WO3 (Me = Sc, In). Электрохимия. 2014. Т. 50. С. 66. [Neiman, A.Ya., Karapetyan, A.V., and Pestereva, N.N., Conductivity of composite materials based on Me2(WO4)3 and WO3 (Me = Sc, In), Russ. J. Electrochem., 2014, vol. 50. p. 58.]
Гусевa, А.Ф., Пестерева, Н.Н., Отческих, Д.Д., Востротина, Е.Л. Электропроводность композитов Al2(WO4)3–WO3 и Al2(WO4)3–Al2O3. Электрохимия. 2019. Т. 55. С. 718. [Guseva, A.F., Pestereva, N.N., Otcheskikh, D.D., and Vostrotina, E.L., Conductivity of Al2(WO4)3–WO3 and Al2(WO4)3–Al2O3 composites, Russ. J. Electrochem., 2019, vol. 55. p. 544.]
Казенас, Е.К., Чижиков, Д.М. Давление и состав пара над окислами химических элементов, М.: Наука, 1976. 342 с. [Kazenas, E.K. and Chizhikov, D.M., Pressure and composition of steam over oxides of chemical elements (in Russian), Moscow: Nauka, 1976. 342 p.]
Нейман, А.Я., Пестерева, Н.Н., Чжоу, Ю., Нечаев, Д.О., Котенёва, Е.А., Ванек, К., Хиггинс, Б., Волкова, Н.А., Корчуганова, И.Г. Природа и механизм ионного переноса в вольфраматах Me2+{WO4} (Ca, Sr, Ba) и M3+{WO4}3 (Al, Sc, In) по данным метода Tубандта. Электрохимия. 2013. Т. 49. С. 999. [Neiman, A.Ya., Pestereva, N.N., Zhou Y., Nechaev, D.O., Koteneva, E.A., Vanec, K., Higgins, B., Volkova, N.A., and Korchuganova, I.G., The nature and the mechanism of ion transfer in tungstates Me2+{WO4} (Ca, Sr, Ba) and M3+{WO4}3 (Al, Sc, In) according to the data acquired by the Tubandt method, Russ. J. Electrochem., 2013, vol. 49. p. 895.]
Higgins, B., Graeve, O.A., and Edwards, D.D., New methods for preparing submicrometer powders of the tungstate-ion conductor Sc2(WO4)3 and its Al and In analogs, J. Am. Ceram. Soc., 2013, vol. 96, p. 2402.
Adachi, G., Imanaka, N., and Tamura, S., Rare earth ion conduction in solids, J. Alloys Compd, 2001, vols. 323–324, p. 534.
Alfonso, J.E., Garzón, R., and Moreno, L.C., Behavior of the thermal expansion coefficient of α-MoO3 as a function of the concentration of the Nd3+ ion, Physica B: Condensed Matter, 2012, vol. 407, p. 4001.
Гусева, А.Ф., Пестерева, Н.Н., Востротина, Е.Л., Отческих, Д.Д., Лопатин, Д.А. Ионная проводимость твердых растворов и композитов на основе Sm2W3O12. Электрохимия. 2020. Т. 56. С. 475. [Guseva, A.F., Pestereva, N.N., Vostrotina, E.L., Otcheskikh, D.D., and Lopatin, D.A., Ionic conductivity of solid solutions and composites based on Sm2W3O12, Russ. J. Electrochem., 2020, vol. 56. p. 447.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




