Электрохимия, 2022, T. 58, № 1, стр. 28-37
Наночастицы соединений гексацианоферратов никеля, как составляющие материалов электродов электрохимических конденсаторов
В. В. Чернявина a, *, А. Г. Бережная a, А. В. Панченко a
a Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: vchernyavina@yandex.ru
Поступила в редакцию 25.06.2020
После доработки 26.01.2021
Принята к публикации 11.05.2021
- EDN: IPNDLZ
- DOI: 10.31857/S0424857021120033
Аннотация
Химическим соосаждением получены гексацианоферрат никеля–калия (KNiHCF) и его аналоги (NaKNiHCF) c разным массовым процентным соотношением Na : K. Структурные характеристики солей изучены методами рентгенофазового анализа, энергодисперсионного микроанализа, просвечивающей электронной микроскопии. Электрохимические характеристики композитных электродов с содержанием соли 20 мас. % исследованы методами циклической вольтамперометрии, гальваностатического заряда–разряда и импедансной спектроскопии. Установлено, что композитные электроды имеют большую удельную емкость (Суд) по сравнению с угольным электродом. Внедрение натрия в структуру KNiHCF увеличивает Суд при высоких скоростях заряда–разряда. Показано, что электроды, содержащие аналог NaKNiHCF с соотношением Na и K 0.92 : 0.24 имеют высокую электронную и ионную проводимость, малое эквивалентное последовательное сопротивление и сопротивление переноса заряда. Его можно использовать в качестве катодного материала в гибридных электрохимических конденсаторах. Простота синтеза исследуемых солей и способа изготовления электродов делает возможным их крупномасштабное применение в электрохимических устройствах накопления энергии.
Разработка крупномасштабных систем накопления электрической энергии остается актуальной задачей в современном мире [1–5]. Для аккумулирования энергии требуются компактные устройства с высоким уровнем безопасности, длительным сроком службы, простотой обслуживания, низкой стоимостью и способностью работать в широком интервале температур. Водно-натриевые батареи, электрохимические конденсаторы с водным натриевым электролитом привлекают внимание в связи с низкой стоимостью и доступностью соединений натрия. По сравнению с органическими водные нейтральные электролиты имеют высокую ионную проводимость, рабочее окно напряжения до 1.5–2.0 В, экологически безопасны, не вызывают коррозию устройства и позволяют проводить сборку в обычных условиях [6, 7]. Применение таких систем может заменить литиево-ионные батареи и свинцово-кислотные аккумуляторы, которые имеют ряд недостатков, таких как низкая пожаробезопасность и мощность, высокая стоимость и токсичность, а также ограниченная циклическая стабильность.
Гексацианоферраты переходных металлов (МHCF) используют в качестве катодного материала. Данные соединения имеют открытую и цеолитоподобную структуру, которая составляет кубический каркас и способствует интеркаляции/деинтеркаляции щелочных катионов (Na+, Li+, K+) [8–10]. Поскольку размер иона натрия большой (0.98 Å), материал должен иметь относительно невысокую плотность и каналы для накопления и диффузии ионов Na+ [11, 12]. Повысить удельную емкость и плотность энергии материала можно также за счет увеличения содержания натрия в структуре MHCF [13, 14].
В связи с этим, целью данной работы являлось получение наночастиц гексацианоферрата(III) никеля–калия и содержащих натрий его аналогов, а также установление влияния внедренного натрия на электрохимические характеристики композитных электродов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гексацианоферрат(III) никеля(II)–калия KNi[Fe(CN)6] (KNiHCF) и другие малорастворимые комплексы получали методом соосаждения при комнатной температуре. Для приготовления растворов использовали бидистиллированную воду и соли (CH3COO)2Ni⋅4Н2О, K3Fe(CN)6, Na2SO4 квалификации “х. ч.” (АО “Вектон” г. Санкт-Петербург). Равные объемы 0.1 М (CH3COO)2Ni и 0.05 М K3Fe(CN)6 добавляли по каплям в 40 мл бидистиллированной воды при интенсивном перемешивании. Полученную суспензию непрерывно перемешивали в течение 2 ч, образовавшийся осадок отфильтровывали, промывали бидистиллированной водой и сушили в вакууме при комнатной температуре.
Для введения катионов натрия в структуру KNiHCF при синтезе использовали не дистиллированную воду, а 0.1, 0.5 и 1 М растворы Na2SO4. В результате получили три соли состава NaxKyNi[Fe(CN)6]z, с различным содержанием натрия и калия в структуре соединения.
Для изготовления угольных и композитных электродов использовали активированный уголь марки Norit A. Композитные электроды получали путем смешивания соли, активированного угля, поливинилиденфторида (PVDF), N-метилпирролидона в ультразвуковой ванне в течение 15 мин до образования суспензии. Массовая доля соли в композите изменялась от 5 до 40%. Основная часть измерений проведена на композитных электродах с массовой долей соли 20%. Полученную смесь равномерно распыляли с помощью специальной автоматической напыляющей установки на предварительно зачищенную и обезжиренную этанолом никелевую фольгу. Электроды сушили при 60°С до постоянного веса. Удельная масса активного материала на электроде составляла 7–8 мг/см2.
Дифрактограммы полученных соединений MHCF регистрировали в интервале углов 2θ = = 5°–60° на дифрактометре “Дрон-7” (Россия, 2008) с использованием отфильтрованного CuKα‑излучения (λ = 0.154056 нм) при комнатной температуре. Расчет размера частиц D проводили для характерного отражения 111 по формуле Шеррера [15]:
где D – размер частицы [Å], K = 0.9 – константа Шеррера, λ = 1.5406 – длина волны [Å], FWHM – ширина пика на полувысоте [град], θ – угол дифракции [град].Исследование элементного состава образцов выполнено на растровом электронном микроскопе VEGA II LMU (фирмы Tescan) с системой энергодисперсионного микроанализа INCA ENERGY 450/XT (детектор Silicon Drift).
Структуру образцов изучали с помощью просвечивающего электронного микроскопа марки Tecnai G2 Bio Twin (США).
Электрохимические измерения проводили на потенциостате-гальваностате “Р-30J” (ООО “Элинс”, Черноголовка, Россия) в стандартной трехэлектродной ячейке в 1 М водном растворе сульфата натрия. В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод, противоэлектродом служил стеклоуглерод.
По результатам циклической вольтамперометрии рассчитывали удельную емкость по формуле
(2)
${{C}_{{{\text{уд}}}}} = \frac{1}{{mv({{E}_{{\text{к}}}} - {{E}_{{\text{н}}}})}}\int\limits_{{{E}_{{\text{н}}}}}^{{{E}_{{\text{к}}}}} {I(E)dE,} $Расчет удельной емкости по гальваностатическому методу заряда–разряда проводили по формуле
где I, ΔЕ, Δτ – ток, интервал напряжений и время заряда или разряда соответственно.Импедансные измерения проводили на импедансметре (ООО “Элинс”, Черноголовка, Россия) в двухэлектродной ячейке с одинаковыми электродами при потенциале 0 В в интервале частот от 10 мГц до 500 кГц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены рентгенограммы для полученных веществ, где наблюдается соответствие наиболее выраженных пиков интенсивности их аналогам, описанными ранее [8, 13]. Синтезированные соединения имеют гранецентрированную кубическую структуру. При внедрении натрия в структуру KNiHCF происходит смещение пиков в сторону меньших углов дифракции, что свидетельствует об увеличении параметров кристаллической решетки [8]. Размер наночастиц соединений, рассчитанный по уравнению (1), также увеличивается. В случае KNiHCF D = 22 нм, а для соединений NaKNiHCF (I), NaKNiHCF (II), NaKNiHCF (III) равен 40, 46 и 45 нм соответственно. Для уточнения химического состава и однородности распределения соответствующих элементов проводили СЭМ-EDX исследование в разных точках поверхности (рис. 2).
Рис. 1.
Дифрактограммы синтезированных соединений KNiHCF(а), NaKNiHCF(I) (б), NaKNiHCF(II) (в), NaKNiHCF(III) (г).

Рис. 2
СЭМ-микрофотографии и спектры EDX для полученных соединений KNiHCF (а), NaKNiHCF(I) (б) и NaKNiHCF(II) (в), NaKNiHCF(III) (г).

Спектры EDX показывают наличие элементов N, O, K, Na, Fe, Ni и подтверждают внедрение натрия в структуру гексацианоферрата никеля (рис. 2б–2г). В среднем процентное соотношение (по массе) Na : K в полученных соединениях составляет 0.09 : 0.22 NaKNiHCF (I), 0.92 : 0.24 NaKNiHCF (II) и 1.07 : 0.15 NaKNiHCF (III). Очевидно, что содержание натрия в структуре материала увеличилось по мере роста концентрации сульфата натрия в процессе синтеза. В дальнейшем в обсуждении результатов данные соединения будут пронумерованы как I, II, III.
ТЕМ-микрофотографии позволяют получить дополнительную информацию о структуре полученных соединений. На рис. 3 показано, что КNiHCF и его аналог II состоят из пористых полидисперсных наночастиц разного размера. Агломерации наночастиц образуют сплошную пористую сеть. Для KNiHCF размер частиц изменяется в пределах от 20 до 45 нм, наибольшая доля 50% приходится на частицы размером 30–35 нм (рис. 3б). При внедрении натрия в структуру KNiHCF размер наночастиц увеличивается. Для соединения II основная доля 70% приходится на наночастицы размером 40–50 нм (рис. 3г).
Рис. 3.
Электронные микрофотографии и гистограмма распределения НЧ по размерам для KNiHCF (а, б) и II (в, г).

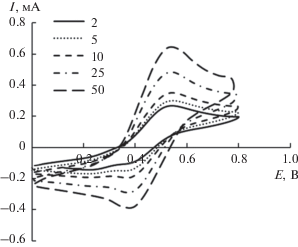
Возможность использования синтезированного порошка KNiHCF как материала электродов в электрохимическом конденсаторе оценивали с помощью метода циклической вольтамперометрии. На рис. 4 показаны циклические кривые электрода KNiHCF в 1 М Na2SO4 со скоростью сканирования 2–50 мВ/с.
Рис. 4.
Циклические вольтамперограммы, полученные для KNiHCF, в 1 М водном растворе Na2SO4 при разных скоростях развертки потенциала.
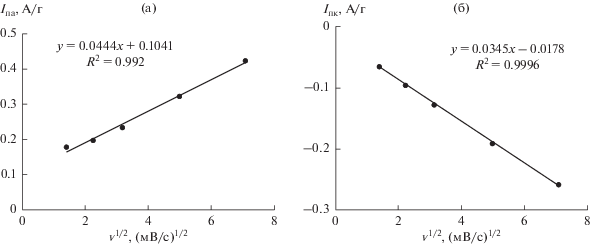
Обратимые пики связаны с протеканием окислительно-восстановительной реакции FeIII/FeII, а также интеркаляцией/деинтеркаляцией ионов Na+ в материал электрода по механизму [16]:
Катодный пик наблюдается при 0.38 В, а анодный пик при 0.54 В соответственно. Разница потенциалов анодного и катодного пика при всех скоростях развертки составляет 0.14–0.16 В, что указывает на медленный перенос электронов из одного окислительно-восстановительного центра в другой внутри частиц KNiHCF или на замедленный перенос катионов Na+ между раствором и KNiHCF [17, 18].
Известно, что связь между плотностью тока пиков и квадратом скорости развертки потенциала показывает две электрохимические характеристики, которые могут быть лимитирующими в данных условиях и определять скорость всего электрохимического процесса. Это диффузионная стадия в материале электрода и стадия переноса заряда [11].
В нашем случае электрохимический процесс протекает со смешанным диффузионно-кинетическим контролем. Однако, процесс твердофазной диффузии в результате интеркаляции/деинтеркаляции ионов натрия остается доминирующим для электрохимических процессов в материалах (рис. 5а, 5б) [11, 19].
Исследовано влияние содержания KNiHCF (массовая доля 5, 10, 20, 30 и 40%) в композитном материале на удельные характеристики электродов. Методом циклической вольтамперометрии установлено, что при скорости развертки 2 мВ/с удельная емкость электрода растет от 68 до 108 Ф/г при увеличении содержания соли от 5 до 20%. Повышение содержания соли в композите до 40% не приводит к росту удельной емкости, а при большей массовой доле добавки нарушается форма ЦВА.
Для сравнения электрохимических свойств использовали композитные электроды, содержащие 20% соли. Данный состав позволяет повысить общую емкость за счет протекания фарадеевских процессов (псевдоемкость), не потерять проводимость и удельную площадь поверхности из-за уменьшения доли активированного угля в материале.
На рис. 6 показаны циклические вольтамперограммы композитных электродов разного состава при $v$ = 2 мВ/с.
Рис. 6.
Циклические вольт-амперные кривые угольного и композитных электродов с содержанием 20% солей при $v$ = 2 мВ/с.

Введение катионов натрия в структуру меняет значения потенциалов и токов в катодных и анодных пиках (табл. 1).
Таблица 1.
Зависимость потенциала Е и тока I анодного и катодного пика от состава композитных электродов при $v$ = 2 мВ/c
| С/KNiHCF | С/I | С/II | С/III | |
|---|---|---|---|---|
| Епк, В | 0.251 | 0.312 | 0.306 | 0.238 |
| –Iк, А/г | 0.373 | 0.330 | 0.420 | 0.253 |
| Епа, В | 0.539 | 0.452 | 0.463 | 0.531 |
| Iпа, А/г | 0.400 | 0.358 | 0.486 | 0.299 |
Потенциалы анодных и катодных пиков у материалов с разным соотношением Na+ : K+ отличаются. Практически одинаковые значения Епк и Епа попарно наблюдаются для С/I и С/II, С/KNiHCF и С/III. Соответственно, разность указанных потенциалов ΔЕ для первой пары материалов составляет 0.14–0.16 В, а для второй – 0.29 В. Меньшее значение ΔЕ свидетельствует о лучшей обратимости окислительно-восстановительного процесса. Материалы С/I и С/II отличаются по соотношению Na+/K+ и достаточно близки по размерам частиц, равными 0.09/0.22 и 0.92/0.24; 40 и 46 нм соответственно. Напротив, материалы С/KNiHCF и С/III весьма разнятся по химическому составу и размеру, составляющему 22 и 45 нм. Более существенное влияние на Iпк и Iпа оказывает материал с соотношением катионов натрия и калия, равным 0.92/0.24. Электродные материалы с другим соотношением Na+ : K+ или при отсутствии натрия в соли характеризуются меньшими значениями тока в пиках. Следовательно, внедрение в структуру соли достаточно большого количества натрия не ведет к улучшению электрохимических свойств электродного материала и росту обратимости процесса.
Окислительно-восстановительный процесс с интеркаляцией/деинтеркаляцией катионов натрия из раствора для материалов с разным соотношением катионов натрия и калия можно описать схемой:
Соотношение Na и K 0.92/0.24 в структуре соединения II является оптимальным и дает максимальное значение Суд. Удельная емкость композитного электрода по сравнению с угольным электродом при $v$ = 2 мВ/c увеличивается почти в 3 раза, а при скорости 25 мВ/с – в 2 раза (табл. 2).
Таблица 2.
Изменение удельной емкости Суд угольного и композитных электродов, содержащих 20% соли при увеличении скорости развертки
| Материал электрода | Удельная емкость Суд (Ф/г) при скорости развертки потенциала $v{\text{,}}$ мВ/с | |||
|---|---|---|---|---|
| 2 | 5 | 10 | 25 | |
| С | 44 | 44 | 43 | 35 |
| С/KNiHCF | 108 | 78 | 79 | 35 |
| С/I | 90 | 83 | 65 | 59 |
| С/II | 125 | 100 | 85 | 68 |
| С/III | 86 | 76 | 70 | 51 |
При скоростях развертки 2–10 мВ/с материалы С/KNiHCF, С/I и С/III имеют близкие значения Суд, а при скорости развертки $v$ = 25 мВ/с характеристики материалов, содержащих натрий, выше. Это согласуется с большим размером частиц и пористостью данных материалов.
Введение натрия в структуру способствует протеканию фарадеевских процессов во всем объеме материала, а также снижает диффузионные ограничения, связанные с замедленным переносом катионов Na+ в порах.
Материал С/I с минимальным содержанием катионов натрия в структуре, несмотря на улучшение обратимости окислительно-восстановительного процесса, имеет меньшее значение Суд по сравнению с С/KNiHCF и С/II. При большем соотношении Na : K в материале С/III и равном 1.07/0.15 возможно возникают диффузионные ограничения в объеме материала, Суд уменьшается по сравнению с С/II при всех скоростях развертки потенциала (табл. 2).
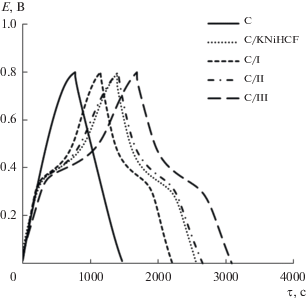
На рис. 7 показаны гальваностатические кривые заряда–разряда для угольного и композитных электродов при Iуд = 0.05 А/г. Форма кривых для угольного и композитных электродов отличается. В случае угольного электрода происходит только заряжение двойного электрического слоя. Для композитных электродов наблюдается ярко выраженное потенциальное плато, соответствующее интеркаляции/деинтеркаляции катионов Na+, а симметричные формы подтверждают высокую электрохимическую обратимость [12, 20].
В случае всех композитных электродов наблюдается увеличение Суд по сравнению с угольным электродом. При Iуд = 0.05 А/г удельная емкость угольного электрода Суд равна 59 Ф/г, для композитных электродов она имеет близкое значение и составляет 95–100 Ф/г. С ростом тока Iуд ≥ 0.3 А/г значение Суд уменьшается для всех композитных электродов на 23–24%, возникают диффузионные затруднения в материале электрода.
По гальваностатическим кривым определили скачок и падение потенциала ΔЕ при заряде и разряде соответственно. Они имеют практически одинаковые значения и представлены в табл. 3.
Таблица 3.
Падение напряжения ΔЕ, мВ для композитных электродов, рассчитанное по результатам гальваностатических исследований при токах заряда–разряда 0.1 А/г и 0.2 А/г
| Материал электрода | Δ Е, мВ (при Iз/р = 0.1 А/г) |
Δ Е, мВ (при Iз/р = 0.2 А/г) |
|---|---|---|
| С | 41 | 80 |
| С/KNiHCF | 50 | 99 |
| С/I | 19 | 37 |
| С/II | 25 | 49 |
| С/III | 50 | 98 |
Результаты, представленные в табл. 3, показывают, что с ростом тока заряда–разряда падение потенциала увеличивается для всех электродов. Наименьшее ΔЕ наблюдается для С/I и С/II, что согласуется с результатами, полученными методом циклической вольтамперометрии.
На рис. 8 показаны диаграммы Найквиста для композитных электродов с разными материалами, в которых полукруг и скачок появляются в области высоких и низких частот соответственно.
Рис. 8.
Диаграммы Найквиста для композитных электродов, содержащих 20% соли (а) и высокочастотная область диаграммы (б).
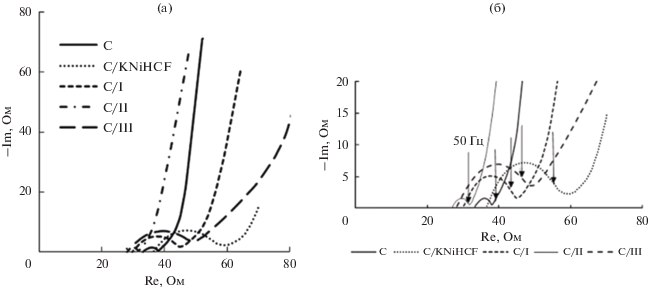
Пересечение реальной оси и графиков Найквиста представляет собой эквивалентное последовательное сопротивление R1, которое включает сопротивление электролита, сопротивление подложки и контактное сопротивление на границе раздела материал/токоподвод [21]. Для угольного электрода и композита С/KNiHCF оно составляет R1 = 33.1–36.0 Ом и немного уменьшается R1 = = 27.0–29.9 Ом для материалов, содержащих в структуре ионы Na+.
Диаметр полукруга соответствует сопротивлению переноса заряда R2 на границе раздела электрод/раствор.
Для угольного и композитного С/II электродов R2 составляет 4.8 и 4.6 Ом. В случае композитных электродов С/KNiHCF, С/III, С/I сопротивление переноса заряда R2 = 20.3–23.3 Ом. Увеличение cопротивления может быть связано как с уменьшением эффективной площади контакта электролита с материалом электрода, так и с меньшей электрохимической доступностью этой поверхности вследствие большего объема, приходящегося на узкие длинные поры. Наклонную линию в области низких частот можно описать обобщенным разомкнутым ограниченным импедансом Варбурга, в области средних частот соответствующим диффузии ионов в порах (рис. 8а, 8б). При низких частотах (больших временах заряжения) определяющую роль играет заряжение емкости двойного слоя с заряжением по всей длине поры. При переходе к низким частотам угол увеличивается, приближаясь к 90°, что свидетельствует о хорошем емкостном поведении при достаточно быстрых процессах. Характерное время начала емкостного поведения соответствует 0.1 с (10 Гц), что для распределенных электродов электрохимических конденсаторов является очень хорошим результатом. Разные емкости в высокочастотной области, до проникновения заряда в узкие поры, могут обусловливаться как неодинаковым распределением пор по размерам, так и разной эффективной площадью поверхности. Доступность электролита в поры большего размера выше.
Композитный электрод С/II с наименьшим сопротивлением и высокой скоростью диффузии ионов имеет наилучшую проводимость по сравнению с другими материалами.
ЗАКЛЮЧЕНИЕ
В настоящей работе методом химического соосаждения синтезированы наночастицы гексацианоферрата никеля–калия и его аналогов, содержащих катионы натрия в структуре. Показано, что введение катионов натрия в структуру гексацианоферрата никеля–натрия приводит к увеличению размера наночастиц.
Исследованы электрохимические свойства композитных электродов, содержащих 20% соли. Установлена возможность интеркаляции–деинтеркаляции катионов натрия в структуру KNiHCF в водном растворе сульфата натрия. Процесс твердофазной диффузии в результате интеркаляции/деинтеркаляции ионов натрия является доминирующим для электрохимических процессов в KNiHCF. Удельная емкость материалов, содержащих соединения KNiHCF и его аналогов I, II, III, увеличивается по сравнению с угольным электродом в 2–3 раза в зависимости от скорости развертки потенциала. Введение катиона натрия в структуру KNiHCF приводит к увеличению Суд при высоких скоростях развертки. Композитные электроды, содержащие 20% аналога гексацианоферрата никеля–калия с процентным соотношением (по массе) Na : K 0.92 : 0.24 имеют высокие удельные характеристики по результатам всех электрохимических исследований. Оптимальная пористая структура данного материала обеспечивает высокую электронную и ионную проводимость по сравнению с другими электродами. Это позволяет использовать композит С/II как катодный материал для гибридных электрохимических конденсаторов.
Список литературы
Han, P., Yue, Y., Zhang, L., Xu, H., Liu, Z., Zhang, K., Zhang, C., Dong, S., Ma, W., and Cui, G., Nitrogen-doping of chemically reduced mesocarbon microbead oxide for the improved performance of lithium ion batteries, Carbon, 2012, vol. 50, p. 1355.
Wang, Y., Yu, X., Xu, S., Bai, J., Xiao, R., Hu, Y.-S., Li, H., Yang, X.-Q., Chen, L., and Huang, X., A zero-strain layered metal oxide as the negative electrode for long-life sodium-ion batteries, Nat. Commun, 2013, vol. 4, p. 2365.
Соляникова, А.С., Чайка, М.Ю., Боряк, А.В., Кравченко, Т.А., Глотов, А.В., Пономаренко, И.В., Кирик, С.Д. Композитные электроды электрохимических конденсаторов на основе углеродных материалов различной структуры. Электрохимия. 2014. Т. 50. С. 470. [Solyanikova, A.S., Chayka, M.Yu., Boryak, A.V., Kravchenko, T.A., Glotov, A.V., Ponomarenko, I.V., and Kirik, S.D., Composite electrodes of electrochemical capacitors based on carbon materials with different structure, Russ. J. Electrochem., 2014, vol. 50, p. 419.]
Рычагов, А.Ю., Вольфкович, Ю.М., Воротынцев, М.А., Квачева, Л.Д., Конев, Д.В., Крестинин, А.В., Кряжев, Ю.Г., Кузнецов, В.Л., Кукушкина, Ю.А., Мухин, В.М., Соколов, В.В., Червонобродов, С.П. Перспективные электродные материалы для суперконденсаторов. Электрохим. энергетика. 2012. № 4. С. 167. [Rychagov, A.Yu., Volfkovich, Yu.M., Vorotyntsev, M. A., Kvacheva, L.D., Konev, D.V., Krestinin, N.V., Kryazhev, Yu.G., Kuznetsov, V.L., Kukushkina, Yu.A., Mukhin, V.M., Sokolov, V.V., and Chernobrodov, S.P., Prospective Electrode Materials for Supercapacitors, J. Electrochem. Energetics (in Russian), 2012, no. 4, p. 167.]
Ярославцев, А.Б., Кулова, Т.Л., Скундин, А.М. Натрий-ионные аккумуляторы. Электрохимия. 2018. Т. 54. С. 131. [Skundin, A.M., Kulova, T.L., and Yaroslavtsev, A.B., Sodium-Ion Batteries, Russ. J. Electrochem., 2018, vol. 54, p. 113.]
Атаманюк, И.Н., Вервикишко, Д.Е., Григоренко, А.В., Саметов, А.А., Школьников, Е.И., Янилкин, И.В. Влияние технологических особенностей изготовления электродов на электрохимические характеристики суперконденсаторов с водным электролитом. Электрохим. энергетика. 2014. № 1. С. 3. [Atamanyuk, I.N., Vervikishko, D.E., Grigorenko, A.V., Sametov, A.A., Shkolnikov, E.I., and Yanilkin, I.V., Study of the influence of the electrodes production technological features on the electrochemical characteristics of super-capacitor with the aqueous electrolyte, J. Electrochem. Energetics (in Russian), 2014, no. 1, p. 3.]
Tsay, K.-C., Zhang, L., and Zhang, J., Effects of electrode layer composition/thickness and electrolyte concentration on both specific capacitance and energy density of supercapacitor, Electrochim. Acta, 2012, vol. 60, p. 428.
Lu, Y., Wang, L., Cheng, J., and Goodenough, J.B., Prussian blue: A new framework of electrode materials for sodium batteries, Chem. Commun, 2012, vol. 48, p. 6544.
Colin, D.W., Sandeep, V.P., Matthew, T.M., Robert, A.H., and Cui, Y., The effect of insertion species on nanostructured open framework hexacyanoferrate battery electrodes, J. Electrochem. Soc., 2012, vol. 159, p. 98.
Sun, H., Sun, H., Wang, W., Jiao, H., and Jiao, S., Fe4[Fe(CN)6]3: a cathode material for sodium-ion batteries, Royal Soc. Chem., 2014, vol. 4, p. 42991.
Jia, Z., Wangab, J., and Wang, Y., Electrochemical sodium storage of copper hexacyanoferrate with a well-defined open framework for sodium-ion batteries, RSC Advances, 2014, vol. 4, p. 22768.
Wessells, C.D., Huggins, R.A., and Cui, Y., Copper hexacyanoferrate battery electrodes with long cycle life and high power, Nature Commun., 2011, vol. 2, no. 550.
You, Y., Yu, X.-Q., Yin, Y.-X., Nam, K.-W., and Guo, Y.-G., Sodium iron hexacyanoferrate with high Na content as a Na-rich cathode material for Na-ion batteries, Nano Research, 2015, vol. 8, p. 117.
Okubo, M., Asakura, D., Mizuno, Y., Kim, J.D., Mizokawa, T., Kudo, T., and Honma, I., Switching redox-active sites by valence tautomerism in Prussian blue analogues AxMny[Fe(CN)6]·nH2O (A: K, Rb): robust frameworks for reversible Li storage, J. Phys. Chem. Lett, 2010, vol. 1, p. 2063.
Pabst, W. and Gregorová, E., Characterization of Particles and Particle Systems, ICT Prague, 2007. 122 p.
Kim, H., Hong, J., Park, K.Y., Kim, H., Kim, S.W., and Kang, K., Aqueous rechargeable Li and Na ion batteries, Chem. Rev., 2014, vol. 114, no. 23, p. 11788.
You, Y., Wu, X.L., Yin, Y.X., and Guo, Y.G., High-quality Prussian blue crystals as superior cathode materials for room-temperature sodium-ion batteries, J. Energy and Environmental Science, 2014, vol. 7, no. 5, p. 1643.
Wu, X., Deng, W., Qian, J., Cao, Y., Ai, X., and Yang, H., Single-Crystal FeFe(CN)6 Nanoparticles: A High Capacity and High Rate Cathode for Na-Ion Batteries, J. Mater. Chem., 2013, vol. 1, no. 35, p. 10130.
Lu, K., Song, B., Gao, X., Dai, H., Zhang, J., and Ma, H., High-energy cobalt hexacyanoferrate and carbon micro-spheres aqueous sodium-ion capacitors, J. Power Sources, 2016, vol. 303, p. 347.
Yun, J., Pfisterer, J., and Bandarenka, A.S., How simple are the models of Na intercalation in aqueous media? Energy Environ. Sci, 2016, vol. 9, p. 955.
Xu, K., Huang, X., Liu, Q., Zou, R., Li, W., Liu, X., Li, S., Yang, J., and Hu, J., Understanding the effect of polypyrrole and poly(3,4-ethylenedioxythiophene) on enhancing the supercapacitor performance of NiCo2O4 electrodes, J. Mater. Chem., 2014, vol. 2, p. 16731.
Дополнительные материалы отсутствуют.