Электрохимия, 2022, T. 58, № 1, стр. 13-27
Катодное восстановление оксида цинка в щелочном электролите
Ю. Л. Гунько a, *, В. А. Козырин a, О. Л. Козина a, Е. Ю. Ананьева a, **, М. Г. Михаленко a
a Нижегородский государственный технический университет им. Р.Е. Алексеева,
Институт физико-химических технологий и материаловедения
603950 Нижний Новгород, ул. Минина, 24, Россия
* E-mail: cn-gunko2008@yandex.ru
** E-mail: ananieva.elena@yandex.ru
Поступила в редакцию 03.02.2021
После доработки 22.04.2021
Принята к публикации 08.06.2021
- EDN: RMYINU
- DOI: 10.31857/S0424857022010054
Аннотация
Проведены исследования восстановления оксида цинка в условиях ограниченного объема щелочного электролита. Методами хронопотенциометрии, хроноамперометрии и хроновольтамперометрии показано, что восстановление оксида цинка в условиях минимального объема электролита представляет довольно сложный процесс, не подчиняющийся известным в литературе математическим зависимостям для различных лимитирующих стадий электрохимических процессов. Предложена математическая модель восстановления оксидно-цинкового слоя в условиях минимального объема щелочного электролита, учитывающая процессы переноса цинкатных и гидроксильных ионов в щелочном электролите, растворение оксида цинка, изменение структурных характеристик поверхностного оксидного слоя. Показано, что процесс восстановления оксида цинка в ограниченном объеме щелочного электролита в значительной степени определяется скоростью химической реакции растворения оксида цинка. Показана применимость выявленных закономерностей восстановления оксида цинка в цинкатных растворах для описания процесса заряда цинковых электродов щелочных источников тока.
ВВЕДЕНИЕ
Среди источников тока с водным электролитом высокой удельной емкостью и разрядным напряжением обладают серебряно-цинковые и никель-цинковые аккумуляторы, воздушно-цинковые источники тока [1]. Такие источники тока имеют давнюю историю. Батарею системы серебро–цинк впервые собрал, около 1800 г., Алессандро Вольта. В 1898 г. Вальдмар Юнгнер высказал идею превратить данную систему в перезаряжаемую, однако только в 1952 г. Анри Андре предложил способ изготовления серебряно-цинкового аккумулятора с полурастворимыми цинковыми электродами.
Значительное количество исследований посвящены никель-цинковым источникам тока. Последние, хотя и имеют несколько меньшие удельные энергетические характеристики по сравнению с серебряно-цинковыми, более дешевы, так как изготавливаются без применения серебра, что обусловило значительный интерес к данной электрохимической системе. Патент на перезаряжаемую батарею системы никель–цинк впервые получил в 1901 г. Томас Эдисон [2]. Позже она была усовершенствована ирландским химиком Джеймсом Драммом [3] и использовалась в автомотрисах на линии Дублин–Брей с 1932 по 1948 гг. В 60–70 гг. XX в. в Советском Союзе и за рубежом проводились многочисленные исследования с целью улучшения емкостных и эксплуатационных характеристик системы Ni–Zn для использования в электромобилях, военных целях и замены серебряно-цинковых и никель-кадмиевых аккумуляторов в ряде областей применения [4].
Воздушно-цинковые элементы также промышленно применяются с 30-х годов прошлого века. Удельные энергетические характеристики таких источников тока значительно выше не только по сравнению с серебряно-цинковыми, никель-цинковыми, никель-кадмиевыми аккумуляторами, но и вполне могли бы конкурировать с литиевыми источниками тока, например, в качестве источников энергии для электромобилей [1]. Особый интерес представляет создание перезаряжаемых воздушно-цинковых источников тока, что позволило бы значительно расширить область их применения. Создание таких воздушно-цинковых элементов возможно или периодической механической заменой цинкового электрода и электролита или путем восстановления первоначальных свойств порошкового цинкового электрода [1] за счет пропускания катодного тока через окисленный цинковый электрод.
Однако после массового появления на рынке литиевых аккумуляторов интерес к источникам тока с цинковым электродом несколько снизился. Тем не менее, исследования в области источников тока с цинковым анодом до конца не были свернуты. Альтернативу литиевым аккумуляторам составили, например, пальчиковые источники тока Acmepower 2500 mW h Ni–Zn 1.6 V [5] и BPI Ni–Zn AA 2500 mW h Rechargeable Battery 1.6 V [6], таблеточные VARTA ZR Button Cells 33–130 mA h 1.65V [7].
Продолжаются работы и по совершенствованию воздушно-цинковых элементов как с целью повышения удельных электрических характеристик [8], так и созданию перезаряжаемых воздушно-цинковых источников тока [9].
ОБЗОР ЛИТЕРАТУРЫ
Работоспособность серебряно-цинковых, никель-цинковых аккумуляторов и электрически перезаряжаемых воздушно-цинковых элементов в большой степени зависит от характеристик отрицательного цинкового электрода. В то же время известно, что заряд цинковых электродов может сопровождаться образованием дендритных осадков [10] и массопереносом активного вещества цинкового электрода [11], что приводит к сокращению срока службы источника тока. Работоспособность цинкового электрода и срок службы щелочных источников тока с цинковым анодом существенным образом зависят от структуры активного материала отрицательного электрода, образующейся в результате заряда аккумуляторов. Однако восстановление цинкатных ионов и оксида цинка, образование губчатых осадков при постоянном наличии оксидной фазы и минимальном объеме электролита, возникновение внутренних коротких замыканий при заряде источника тока остаются до сих пор неясными.
При катодной поляризации на цинковом электроде в цинкатных электролитах могут протекать параллельно два процесса: осаждение цинка и выделение водорода. Первый процесс может сопровождаться образованием губчатого цинка и способствует поддержанию высокодисперсного состояния активного вещества электрода. Второй процесс снижает отдачу по току, а в период бездействия аккумулятора ионизация цинка, сопровождающаяся выделением водорода, является одной из основных причин саморазряда отрицательного электрода.
Изучению механизма катодного выделения цинка из цинкатных растворов и образованию губчатых осадков цинка посвящено значительное количество исследований.
Полярографическим методом в работе [12] показано, что процесс катодного восстановления цинката является необратимым и лимитируется диффузией цинката, однако непосредственному разряду на катоде подвергаются не ионы ${\text{Zn(OH}})_{4}^{{2 - }},$ а частицы Zn(OH)2.
Согласно Фарру и Хэмпсону [13, 14], процесс восстановления цинкат-ионов представляет собой ряд последовательных стадий, которые можно представить следующей системой уравнений:
(1)
${\text{Zn(OH)}}_{4}^{{2 - }} \Leftrightarrow {\text{Zn(OH}}{{{\text{)}}}_{2}} + 2{\text{O}}{{{\text{H}}}^{ - }},$(2)
${\text{Zn(OH}}{{)}_{2}} + {\text{e}} \Leftrightarrow {\text{Zn(OH}}{{{\text{)}}}_{{{\text{ads}}}}} + {\text{O}}{{{\text{H}}}^{ - }},$(3)
${\text{Zn(OH}}{{{\text{)}}}_{{{\text{ads}}}}} + {\text{e}} \Leftrightarrow {\text{Zn(OH}})_{{{\text{ads}}}}^{ - },$(4)
${\text{Zn(OH}})_{{{\text{ads}}}}^{ - } \to {\text{Z}}{{{\text{n}}}_{{{\text{ad}}{\text{.atom}}}}} + {\text{O}}{{{\text{H}}}^{ - }}.$Скорость всего процесса лимитируется диффузией ад-атома цинка по поверхности электрода.
Геришер [15], исследуя посредством импедансного метода систему цинкат-амальгама цинка, так же пришел к выводу, что электрохимически активной при восстановлении цинката является частица Zn(OH)2.
Де Вит с соавторами [16] показали, что восстановление цинката на амальгаме цинка в 0.18–4.0 М растворах КОН протекает по механизму СЕСЕ-типа (химическая–электрохимическая–химическая–электрохимическая стадии).
Согласно А.Л. Ротиняну с сотрудниками [17], на монолитном цинковом электроде в цинкатных растворах КОН общей концентрации до 12 М восстановлению подвергаются частицы Zn(OH)2 с лимитирующей стадией переноса первого электрона (уравнения (5)–(7)):
(5)
${\text{Zn(OH}})_{4}^{{2 - }} \Leftrightarrow {\text{Zn(OH}}{{)}_{2}} + 2{\text{O}}{{{\text{H}}}^{ - }},$О.М. Бокрис с соавторами [18] исследовали катодный процесс на цинковом электроде в более разбавленных растворах КОН (с общей концентрацией от 0.1 до 3.0 М). Авторы показали, что поляризация при восстановлении цинката имеет в основном электрохимическую природу. Скорость всего процесса лимитируется стадией переноса первого электрона.
Эппельбойн с соавторами [19], использовав импедансные и поляризационные измерения на вращающемся дисковом электроде, установили, что процесс восстановления цинката включает в себя автокаталитическую стадию, при которой образуется промежуточный одновалентный ион цинката. Механизм процесса, по мнению авторов, включает в себя также и несколько гетерогенных реакций, в которых участвует адсорбированный водород.
При циклировании щелочных источников тока катодный процесс на цинковом электроде при заряде аккумуляторов протекает в условиях весьма ограниченного объема электролита (около 2.5 мл на 1 А ч емкости) [1], находящегося преимущественно в порах электрода. Количество растворенного цинка в этих системах не превышает нескольких процентов от всей активной массы цинкового электрода; поэтому катодному превращению подвергается в основном твердая оксидно-цинковая фаза электрода, которая может реагировать как через промежуточную стадию образования растворимого цинката, так и путем твердофазного восстановления оксида цинка, обладающего свойствами n-полупроводимости [20]. Возможность последнего механизма показана в работах ряда исследователей.
Хладек и Швабе [21] установили, что восстановление оксида цинка на поверхности индифферентного электрода может протекать с большими скоростями (до 2 мА/см2) без появления площадки предельного тока. При этом форма поляризационных кривых практически не зависит от концентрации КОН в растворе.
Возможность прямого электрохимического восстановления оксида цинка в водных растворах до металлического состояния обсуждалась Геришером [15], однако без указания кинетических возможностей процесса.
А.И. Оше и В.С. Багоцкий [22] исследовали процесс катодного восстановления оксида цинка в абсолютном этиловом спирте, насыщенным азотнокислым литием, в котором оксид цинка практически нерастворим. Твердофазное восстановление ZnO сопровождается появлением предельного тока, величина которого зависит от количества сформированной на электроде оксидной пленки. По мнению авторов, восстановление оксида цинка по такому механизму проявляется в случае затрудненности процесса растворения оксида цинка.
При заряде источника тока, по мнению ряда авторов работ [22, 23], более вероятно, что восстановление оксида цинка происходит через раствор по механизму “растворение–осаждение”, так как оксид цинка хорошо растворим в щелочах.
Дражич и Наги [24] считают, что прямое восстановление оксида цинка по твердофазному механизму в растворах КОН составляет не более 2%. Основная часть оксида цинка восстанавливается по ионному механизму.
Согласно Ландсбергу с соавторами [25], кинетика растворения оксида цинка в растворах щелочей зависит только от концентрации щелочи, но не зависит от потенциала электрода, т.е. определяется скоростью его химического взаимодействия с ионами гидроксила.
Одной из важных особенностей катодного процесса в цинкатных электролитах является выделение цинка в виде губчатых или дендритных осадков. Существует несколько точек зрения относительно образования таких осадков.
Н.Т. Кудрявцевым [26] была выдвинута гипотеза, что причиной возникновения цинковой губки в цинкатных электролитах при низких плотностях тока является наличие в них коллоидной фазы металлического цинка, выкрашивающегося при анодном растворении цинка. В работе [27], однако, было показано, что губчатые катодные осадки образуются с меньшей интенсивностью и в химически приготовленных цинкатных электролитах при использовании нерастворимых анодов. Катодное образование цинковой губки не устраняется при электролизе цинкатных растворов, из которых удалена возможная коллоидная фаза [28].
Согласно В.В. Стендеру [29], цинковая губка возникает в результате неоднородности катодной поверхности и недостаточности диффузионной подачи из объема раствора разряжающихся ионов цинка. Авторами работы отмечается, что губчатые осадки цинка более быстро образуются при понижении температуры процесса, повышении концентрации свободной щелочи и уменьшении содержания цинката.
Аналогичных взглядов придерживается и В.В. Романов [28], который полагает причиной образования губчатых осадков цинка обеднение прикатодного пространства по ионам ${\text{Zn(OH}})_{3}^{ - }$ и ${\text{Zn(OH}})_{4}^{{2 - }},$ в результате чего начинают реагировать ионы вида ${\text{Zn(OH}})_{6}^{{4 - }}$ и ${\text{Zn(OH}})_{8}^{{6 - }}.$
В.Н. Флёров [27] признал наиболее вероятной первопричиной появления цинковой губки, осаждающиеся на катоде коллоидные частицы оксида цинка, которые обладают полупроводниковыми свойствами и способствуют вследствие этого появлению на них больших количеств зародышей металла. В работе также отмечено значительное влияние процесса старения пересыщенных цинкатных растворов на начало появления цинковой губки. Для растворов, в процессе старения которых в осадок выпадает оксид цинка и которые перед опытом были доведены до ненасыщенного по оксиду цинка состояния, губкообразование было более характерно, чем для растворов, из которых в осадок выпадала ромбическая фаза гидроксида цинка.
М.Г. Михаленко с соавторами [30, 31] при изучении влияния концентрации свободной щелочи на механизм катодного выделения цинка было установлено, что в стадии разряда, в зависимости от содержания свободной щелочи, могут участвовать частицы Zn(OH)2 или ${\text{Zn(OH}})_{4}^{{2 - }},$ которые ступенчато восстанавливаются до цинка с наиболее медленной стадией – присоединения первого электрона.
Структурные характеристики гальванических осадков в значительной степени зависят от условий и режима осаждения.
Анализ литературных данных показывает, что катодное восстановление цинка из щелочно-цинкатных растворов и образование губчатых осадков изучено довольно подробно.
Однако наряду с выявлением внешних закономерностей системы оксид цинка–щелочной электролит сведения о поведении такой системы остаются на уровне предположений. Кроме того следует отметить, что авторами исследовалось образование металлического цинка в большом объеме электролита при свободном поступлении ионов цинката в зону роста металлического осадка. В источниках тока с цинковым электродом восстановление цинка происходит при минимальном количестве щелочного электролита, а восполнение цинкатных ионов в электролите может происходить, в основном, за счет растворения оксида цинка и в меньшей степени за счет диффузии цинката из пространства положительного электрода через гидратцеллюлозный сепаратор. Все это значительно осложняет изучение процесса образования металлического цинка при заряде отрицательного электрода щелочного источника тока.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электрические характеристики и срок службы щелочных аккумуляторов с цинковым электродом в значительной степени определяются структурой материала отрицательного электрода, образующегося при восстановлении оксида цинка. Кроме того, выход аккумуляторов из строя из-за возникновения внутренних коротких замыканий также зависит от образования дендритных осадков металла в конце зарядного процесса. Поэтому выявление закономерностей зарядного процесса пористых цинковых электродов позволит увеличить срок службы и время разряда источников тока с цинковым анодом.
По мнению ряда авторов [24–27], наиболее вероятно, что восстановление оксида цинка притекает по ионному механизму “растворение–осаждение”, т.к. оксид цинка довольно хорошо растворим в щелочи.
В окисленных порошковых цинковых электродах, где объем электролита ограничен, на кинетику восстановления оксида цинка сильное влияние могут оказать концентрационные изменения по ионам гидроксила и цинката в реакционной зоне как вследствие затрудненности их диффузии в порах материала отрицательного электрода, так и за счет протекающих химических и электрохимических реакций.
Одной из особенностей процесса катодного восстановления оксидно-цинкового электрода в щелочно-цинкатных растворах является выделение цинка в виде губчатых или дендритных осадков, обладающих большой истинной поверхностью. Поэтому необходимо проведение дополнительных исследований, позволяющих учесть влияние перечисленных факторов на процесс катодного восстановления пористого оксидно-цинкового слоя.
В щелочно-цинковых аккумуляторах катодный процесс начинается в условиях значительного пересыщения (насыщения) раствора цинкатом, находящегося в порах электрода и отделенного от общего объема электролита сепаратором. Условия, приближенные к реальному электроду в аккумуляторе, нами моделировались путем использования специальной электродной ячейки с ограниченным объемом электролита у поверхности исследуемого электрода (рис. 1), отделенного от основного объема электролита двумя слоями гидратцеллюлозной пленки 100 с толщиной каждого слоя в набухшем состоянии около 50–60 мкм. Наличие такого сепаратора значительно затрудняет диффузию щелочи и цинката в зону реакции и максимально приближает условия протекания электрохимического процесса на отдельных зернах активного материала в глубинных участках пористого электрода и на модельном электроде. При этом количество электролита на единицу поверхности цинка составляет, по данным гальваностатических измерений при катодном восстановлении цинката с концентрацией 56 г/л (в пересчете на Zn2+), около (0.48–0.5) × 10–4 см3/см2 металлического цинка) и близко к количеству электролита в пористых цинковых электродах серебряно-цинковых и никель-цинковых аккумуляторов.
Рис. 1.
Конструкция электрода, применяемого для моделирования работы монолитного цинкового электрода в ограниченном объеме электролита: 1 – цинковый электрод; 2 – стеклянный фильтр; 3 – гидратцеллюлозный сепаратор; 4 – крышка из органического стекла; 5 – цинковый электрод сравнения; 6 – эпоксидный изолятор; 7 – тефлоновый корпус; 8 – медный токоотвод.

Предложенная конструкция цинкового электрода позволяет использовать закономерности, справедливые для плоской полубесконечной диффузии. Однако следует иметь в виду, что перенос компонентов электролита в данном случае осуществляется в нескольких областях, отличающихся по своим физическим свойствам: это гидратцеллюлозный сепаратор, моделирующий затрудненность диффузионного переноса компонентов электролита в глубинные зоны пористого цинкового электрода, и оксидно-цинковый слой, который моделирует процессы на отдельном участке пористого активного материала при заряде электрода.
В качестве исследуемого модельного электрода применялся монолитный цинковый электрод торцевого типа рабочей поверхностью 1 см2. Подготовка поверхности осуществлялась обработкой наждачной бумагой Р1200 с последующей полировкой на войлочном круге и промывкой этиловым спиртом и водой.
Все исследования проводились в электролите состава: 7 М раствор КОН + 56 г/л Zn2+.
Катодному восстановлению подвергались пленки оксида цинка расчетной толщины 2.4 × × 10–2 мм, анодно сформированные на гладком цинковом электроде в ограниченном объеме щелочно-цинкатного электролита при поляризации +200 мВ в течение 5 мин. (Количество электричества, пошедшего на образование оксида цинка в этих условиях, соответствует ~13 Кл).
При скоростях потенциодинамической развертки потенциала от 0.5 до 20 мВ/с происходит практически полное восстановление оксидного слоя (количество электричества, пошедшее на катодный процесс, составляет 12.5–12.4 Кл, что соответствует количеству оксида, наработанного при анодном окислении цинка ~13 Кл) (рис. 2). Зависимость тока максимума на катодной потенциодинамической кривой от корня квадратного из скорости развертки потенциала, аналогично данным работы [22], близка к линейной, однако не экстраполируется в начало координат. Рассчитанные по углу наклона прямой коэффициенты диффузии участвующих в электрохимической реакции ионов имеют значения (10–6–10–5) см2/с. Резкий спад тока после медленного достижения максимума связан с практически полным расходованием оксида цинка.
Рис. 2.
Катодные потенциодинамические кривые восстановления оксидно-цинкового слоя. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Скорость развертки потенциала, мВ/с: 1 – 2; 2 – 4; 3 – 10; 4 – 20.

В процессе потенциостатического восстановления оксидного слоя (рис. 3) в 7 М растворе КОН, химически насыщенном цинкатом, в начальный момент происходит увеличение плотности катодного тока с последующим снижением его во времени. Форма кривой в данном случае существенно отличается от катодных кривых процесса с диффузионным контролем, приводимых в работе [22] для восстановления ионов цинката из 5–7 М раствора КОН, насыщенного цинкатом.
Рис. 3.
Изменение тока при восстановлении оксидно-цинкового слоя в потенциостатическом режиме в щелочно-цинкатном электролите при поляризации, В: 1 – 0.5; 2 – 0.3; 3 – 0.2.

Нетрадиционную форму имеют и кривые изменения катодного потенциала оксидного электрода в гальваностатическом режиме процесса (рис. 4). При включении катодного тока первоначально наблюдается “скачок” потенциала в отрицательную сторону от равновесного значения. Затем поляризация плавно уменьшается до некоторой постоянной величины и в конце процесса поляризация снова возрастает.
Рис. 4.
Хронопотенциометрические кривые катодного восстановления оксидно-цинкового слоя в ограниченном объеме электролита. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Плотность тока восстановления, мА/см2: 1 – 150; 2 – 200; 3 – 250; 4 – 300; 5 – 400; 6 – 500.

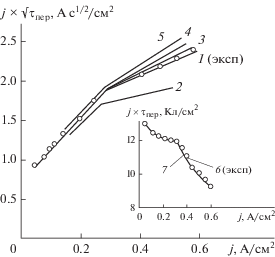
Рассчитанные из хронопотенциометрических кривых переходные времена процесса восстановления и построенные по ним зависимости $j \cdot {{\tau }_{{{\text{пер}}}}}$ от j ּи $j \cdot \sqrt {{{\tau }_{{{\text{пер}}}}}} $ от j (рис. 5) свидетельствуют о том, что при плотности тока до 280–300 мА/см2 происходит практически полное восстановление оксидного слоя (величина емкости $j \cdot {{\tau }_{{{\text{пер}}}}}$ постоянна и лежит в пределах 12.2–12.4 Кл). Некоторое увеличение катодной емкости при низкой плотности тока, вероятно, связано с дополнительной доставкой цинкат-ионов из объема раствора через сепаратор [33]. При больших плотностях тока свыше 300 мА/см2 количество восстанавливающегося оксида цинка с ростом плотности тока уменьшается. Величина $j \cdot \sqrt {{{\tau }_{{{\text{пер}}}}}} $ линейно возрастает с увеличением плотности тока, но с изломом зависимости при плотности катодного тока 280–300 мА/см2. Увеличение значений $j \cdot \sqrt {{{\tau }_{{{\text{пер}}}}}} $ во всем интервале исследованных плотностей тока позволяет заключить, что процесс восстановления не имеет чисто диффузионного контроля и не контролируется химической стадией, предшествующей разряду ионов цинката.
Рис. 5.
Зависимость $j \cdot {{\tau }_{{{\text{пер}}}}}$ от j (1) и $j \cdot \sqrt {{{\tau }_{{{\text{пер}}}}}} $ от jּ (2) для катодного восстановления оксидно-цинкового слоя в ограниченном объеме электролита. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+ (по данным рис. 4).

Такой характер хода выявленных зависимостей катодного восстановления оксидно-цинковых пленок может быть обусловлен образованием в ходе процесса металлической цинковой губки и связанной с этим развитием во времени истинной катодной поверхности. Авторам предыдущих работ не удалось произвести хотя бы оценочной прикидки влияния скорости химической реакции растворения оксида цинка, зависящей от концентрации щелочи, цинката и общего количества оксида цинка, на кинетику катодного процесса.
Оценка вклада каждого из этих факторов на электродную поляризацию, время и глубину восстановления оксида цинка с целью целенаправленного выбора мероприятий по улучшению характеристик цинкового электрода щелочных источников тока связана с большими трудностями из-за сложности постановки эксперимента и большого объема исследовательских работ. Поэтому для уточнения механизма катодного восстановления активного материала оксидного слоя, анализа особенностей процесса заряда реального порошкового оксидно-цинкового электрода, сокращения объема исследовательских работ по улучшению характеристик отрицательного электрода необходимо разработать математическую модель процесса катодного восстановления оксида цинка в ограниченном объеме электролита, учитывающую все его особенности.
Моделирование процесса катодного восстановления оксидно-цинкового слоя в щелочных растворах
Как было показано хроновольтамперометрическими, хроноамперометрическими и хронопотенциометрическими измерениями, восстановление оксида цинка в условиях минимального объема электролита представляет довольно сложный процесс, не подчиняющийся известным в литературе математическим зависимостям. Это может быть связано с постоянным изменением химически и электрохимически активной поверхности оксида цинка и металлического цинка, возникновением значительных концентрационных изменений, неравномерным распределением тока в оксидно-цинковом слое. Нет единого мнения о механизме восстановления оксида цинка в таких условиях.
Математическое моделирование восстановления оксида цинка важно с двух точек зрения:
– во-первых, составленные математические модели дадут возможность уточнить механизм катодного восстановления оксида цинка в условиях, максимально приближенных к реальному пористому электроду, и определить кинетические возможности отдельных стадий этого процесса;
– во-вторых, знание особенностей восстановления оксида цинка позволяет описать заряд пористого цинкового электрода, выявить причины возникновения межэлектродных замыканий и ухудшения работоспособности отрицательного электрода при циклировании аккумуляторов.
При составлении модели применялись следующие допущения:
1. Не учитывались различия в конфигурации пор активной массы и форме активных частиц оксида цинка и образующегося металлического цинка. Все поры принимались цилиндрическими. Для приближения модельных представлений о структуре электрода к реальному пористому электроду в расчеты вводился коэффициент извилистости пор.
2. Считалось, что ток в электролите переносится ионами K$^{ + }$, OH$^{ - }$ и ${\text{Zn}}\left( {{\text{OH}}} \right)_{4}^{{2 - }}.$
3. Принималось, что числа переноса отдельных ионов не зависят от концентрации электролита и температуры.
4. Не рассматривались температурные градиенты при разряде пористого электрода.
5. Движение ионов в электролите происходит независимо друг от друга.
Анализ литературных данных и проведенные исследования позволяют предположить, что катодное восстановление слоя оксида цинка протекает по жидкофазному механизму “растворение–осаждение”, по реакциям (11), (12):
Катодный процесс начинается с образованием губки металлического цинка и избытка ОН–-ионов, которые участвуют в химической реакции образования ионов цинката при растворении оксида цинка в порах электрода
(12)
${\text{ZnO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2O}}{{{\text{H}}}^{ - }} \to {\text{Zn(OH)}}_{4}^{{2 - }}.$Эти образовавшиеся ионы цинката опять катодно восстанавливаются в порах на металлической поверхности до губки металлического цинка, по реакции (11).
Так как слой оксида цинка пористый, а сам оксид обладает заметной электропроводностью, то для математического описания распределения тока восстановления оксида цинка может быть использовано описание зарядного процесса пористого кадмиевого электрода [32]. Согласно этой модели, пористый оксидно-цинковый слой можно представить в виде системы параллельных цилиндрических пор постоянного радиуса, пронизывающих слой на всю его толщину. Электрохимический процесс происходит на поверхности этих пор.
Модельная пора такого оксидно-цинкового слоя в этом случае может быть представлена эквивалентной электрической схемой (рис. 6).
Рис. 6.
Эквивалентная электрическая схема слоя оксида цинка: Rэ – сопротивление электролита; RФ – сопротивление электрохимической реакции; Rт – сопротивление твердой фазы; E – диффузионный потенциал; U – внутренние источники ЭДС (отклонение потенциала), вызванные изменением концентрации электролита вследствие протекания электрохимического и химического процессов; iФ – фарадеевский ток; iр-р – ток по раствору электролита; iтв – ток по активной массе; Iзар – плотность тока восстановления.
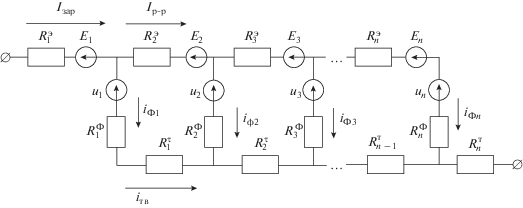
Определение фарадеевских токов в ветвях эквивалентной электрической схемы, осуществлялось решением системы уравнений, составленных на основе законов Кирхгофа, методом Гаусса, с учетом изменения проводимости электролита и твердой фазы, электрохимически активной поверхности, диффузионных потенциалов, отклонения потенциала от равновесного значения, возникающих вследствие концентрационных изменений при заранее определенных численных значениях элементов эквивалентной схемы.
Сопротивление электролита Rэ для каждой j‑й зоны оксидно-цинкового слоя может быть рассчитано согласно уравнению (13):
(13)
$R_{j}^{{\text{э}}} = \frac{{\beta _{j}^{2} \cdot L}}{{{{\chi }_{{{\text{p}}j}}}{{\Pi }_{j}} \cdot N}}.$Величина коэффициента извилистости пор βj определялась обработкой данных, представленных в работе [34].
Проводимость электролита при различных концентрациях щелочи и цинката определялась экспериментально и далее представлялась в виде полинома 3-го порядка.
Сопротивление твердой фазы, состоящей из оксида цинка и образующегося металлического цинка, равно:
где $\chi _{j}^{{{\text{эфф}}}}$ – эффективная проводимость твердой фазы, зависящая от объемного удельного содержания оксида цинка и металлического цинка и их электрических проводимостей.Эффективная проводимость твердой фазы может быть рассчитана по уравнению (15) [35]:
(15)
$\chi _{j}^{{{\text{эфф}}}} = {{\chi }_{{{\text{ZnO}}}}} \cdot \Pi _{{{\text{ZnO}}}}^{{{{t}_{1}}}} + {{\chi }_{{{\text{Zn}}}}} \cdot \Pi _{{{\text{Zn}}}}^{{{{t}_{2}}}},$Сопротивление протеканию электрохимического процесса (фарадеевское сопротивление $R_{j}^{\Phi }$) может быть приближенно рассчитано по уравнению:
(16)
$R_{j}^{{\text{Ф}}} = \frac{{RT}}{{nF}} \cdot \frac{1}{{{{j}_{{\text{o}}}}}} \cdot \frac{N}{{L \cdot S_{{{\text{Zn}}}}^{{{\text{уд}}}}}}.$Величина токов обмена для процесса катодного восстановления ионов цинката на цинковом электроде при различных концентрациях щелочи и цинката определялась традиционно экстраполяцией зависимостей lg i–η на нулевое перенапряжение, полученных на вращающемся цинковом электроде и представленных в виде полинома 4-го порядка.
Концентрационная поляризация цинка для любой зоны оксидного слоя рассчитывалась исходя из токообразующей реакции (11) по уравнению Нернста:
(17)
${{U}_{j}} = \frac{{RT}}{{zF}}\ln \left( {\frac{{\left[ {{\text{Zn(OH}})_{4}^{{2 - }}} \right]_{j}^{{{\text{тек}}}}\left( {a_{{{\text{O}}{{{\text{H}}}^{ - }}}}^{0}} \right)_{j}^{4}}}{{\left( {a_{{{\text{O}}{{{\text{H}}}^{ - }}}}^{{{\text{тек}}}}} \right)_{j}^{4}\left[ {{\text{Zn(OH}})_{4}^{{2 - }}} \right]_{j}^{{\text{0}}}}}} \right),$Диффузионный потенциал между отдельными зонами оксидного слоя может быть рассчитан по уравнению:
(18)
$\frac{{d{{E}_{j}}}}{{dx}} = - \frac{{RT}}{F}\sum {\frac{{{{n}_{i}}}}{{{{z}_{i}}}}} \,{\text{grad}}\ln {{c}_{i}},$Концентрация ионов K+ может быть найдена из условия электронейтральности раствора Σci ⋅ zi = 0.
Концентрационные изменения в порах оксидно-цинкового слоя могут быть рассчитаны с учетом переноса компонентов электролита за счет диффузии, миграции, конвекции и их образования или потребления в результате протекания электрохимических и химических реакций аналогично описанию, приводимому в [32] для заряда пористого кадмиевого электрода. В этом случае уравнения материального баланса по ионам гидроксила и цинката примут вид:
для щелочи
(19)
$\begin{gathered} \frac{{{{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{\partial \tau }} = \frac{{{{\partial }^{2}}{{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{\partial {{x}^{2}}}} \cdot \frac{{{{D}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}\Pi }}{{{{\beta }^{2}}}} + \\ + \,\,\frac{{{{n}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{{{z}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}F\Pi }} \cdot \frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}} - \frac{V}{\Pi } \cdot \frac{{\partial {{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}}}{{\partial x}} + {{g}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}, \\ \end{gathered} $для цинкатных ионов
(20)
$\begin{gathered} \frac{{\partial {{c}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}}}{{\partial \tau }} = \frac{{{{\partial }^{2}}{{c}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}}}{{\partial {{x}^{2}}}} \cdot \frac{{{{D}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}\Pi }}{{{{\beta }^{2}}}} + \\ + \,\,\frac{{{{n}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}}}{{{{z}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}F\Pi }} \cdot \frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}} - \frac{V}{\Pi } \cdot \frac{{\partial {{c}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}}}{{\partial x}} + {{g}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}. \\ \end{gathered} $(21)
${{g}_{{{\text{O}}{{{\text{H}}}^{ - }}}}} = - 2 \cdot S_{{{\text{ZnO}}}}^{{{\text{уд}}}} \cdot k \cdot {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \cdot {{\left( {a_{{{\text{KOH}}}}^{{{\text{св}}}}} \right)}^{2}} + \frac{2}{{F\Pi }} \cdot \frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}},$(22)
${{g}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}} = S_{{{\text{ZnO}}}}^{{{\text{уд}}}} \cdot k \cdot {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \cdot {{\left( {a_{{{\text{KOH}}}}^{{{\text{св}}}}} \right)}^{2}} - \frac{1}{{2F\Pi }} \cdot \frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}},$В уравнениях (21) и (22) первое слагаемое позволяет рассчитать концентрационные изменения за счет химических превращений, второе – электрохимических.
Пористость восстанавливающегося оксидно-цинкового слоя, по уравнению (23), равна:
где ΠZnO и ΠZn – удельные объемные содержания оксида цинка и металлического цинка.Изменение удельного объемного содержания металлического цинка ПZn происходит за счет его электрохимического образования по реакции (11) и может быть определено по уравнению (24):
(24)
$\frac{{\partial {{\Pi }_{{{\text{Zn}}}}}}}{{\partial \tau }} = \frac{{{{\upsilon }_{{{\text{Zn}}}}}}}{{nF}} \cdot \frac{{\partial {{i}_{{{\text{тв}}}}}}}{{\partial x}},$Изменение удельного объемного содержания оксида цинка во времени протекания процесса происходит за счет химического растворения оксида цинка в щелочи, по реакции (10), с образованием цинката калия:
(25)
$\frac{{\partial {{\Pi }_{{{\text{ZnO}}}}}}}{{\partial \tau }} = - S_{{{\text{ZnO}}}}^{{{\text{уд}}}} \cdot k \cdot {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \cdot {{\left( {a_{{{\text{KOH}}}}^{{{\text{св}}}}} \right)}^{2}} \cdot {{\upsilon }_{{{\text{ZnO}}}}},$Следует отметить, что $S_{{{\text{ZnO}}}}^{{{\text{уд}}}}$ (удельная поверхность оксида цинка) в уравнениях (21), (22), (25), относится не к поверхности единичного объема оксида цинка, а к единичному объему пористого электрода. Полагая, что (SZnO)уд пропорциональна удельному объемному содержанию оксида цинка ПZnO, можно записать $S_{{{\text{ZnO}}}}^{{{\text{уд}}}}$= S 'ПZnO, где S ' – удельная поверхность единичного объема оксида цинка.
За счет изменения пористости в процессе восстановления оксида цинка возникает поток щелочного электролита, величина которого может быть рассчитана согласно уравнению (26):
В уравнениях (19)–(22), (24) при рассмотрении пористого оксидно-цинкового слоя в виде эквивалентной электрической схемы (рис. 6) изменение тока в твердой фазе ∂iтв соответствует iф (фарадеевский ток восстановления цинкатных ионов по реакции (11)) в отдельных зонах слоя. Величина ∂x в данном случае приблизительно может быть представлена как $\frac{L}{N}$ (здесь L – толщина оксидноцинкового слоя, N – число зон).
Концентрация свободной (несвязанной в цинкатный комплекс) щелочи определялась исходя из следующего положения: в исходном состоянии до включения катодного тока щелочной электролит химически насыщен цинкатом, скорость химической реакции растворения оксида цинка в щелочи равна нулю. Дополнительная свободная щелочь образуется при протекании электрохимической реакции восстановления цинката при включении катодного тока и рассчитывается по уравнению (27):
(27)
$c_{{{\text{KOH}}}}^{{{\text{св}}}} = 4\left( {c_{{{\text{Zn(OH}})_{4}^{{2 - }}}}^{{{\text{нас}}}} - {{c}_{{{\text{Zn(OH}})_{4}^{{2 - }}}}}} \right),$Определение поля концентраций щелочи и цинката для определенных моментов времени осуществлялось методом прогонки при известных начальных и граничных условиях.
Граничные условия для решения дифференциальных уравнений (19), (20) по изменению концентраций щелочи и цинката принимались следующие: Х = 0 (граница оксидный слой/цинковый токоподвод), $\frac{{d{{c}_{i}}}}{{dx}} = 0$ (указывает на отсутствие переноса компонентов электролита через границу оксидный слой/цинковый токоподвод);
X = L (граница оксидный слой/сепаратор). Концентрация компонентов электролита определялась из условия равенства их потоков через сепаратор и границу раздела сепаратор/оксидный слой $N_{i}^{{{\text{вэп - 0}}}}$ = $N_{j}^{{{\text{0}} - {\text{1}}}}.$ $N_{i}^{{{\text{вэп - 0}}}}$ и $N_{j}^{{{\text{0}} - {\text{1}}}}$ – потоки щелочи и цинката из внеэлектродного пространства (вэп) с концентрацией $c_{i}^{{{\text{вэп}}}},$ соответственно, через сепаратор к границе сепаратор/оксидно-цинковый слой с концентрацией $c_{i}^{{\text{0}}}$ и от границы сепаратор/оксидно-цинковый слой во внешнюю зону оксидно-цинкового слоя с концентрацей $c_{i}^{{\text{1}}},$ определяемые по 1-му закону Фика.
(28)
$\left\{ \begin{gathered} N_{i}^{{{\text{вэп - 0}}}} = D_{i}^{{{\text{сеп}}}}\frac{{c_{i}^{{{\text{вэп}}}} - c_{i}^{0}}}{{{{\delta }_{{{\text{сеп}}}}}}} \hfill \\ N_{i}^{{0 - 1}} = D_{i}^{{{\text{ZnO}}}}\frac{{\left( {c_{i}^{0} - c_{i}^{1}} \right) \cdot N}}{L} \hfill \\ \end{gathered} \right..$Проверка адекватности предложенной модели восстановления оксидно-цинкового слоя в гальваностатическом режиме с реальным электродом в ячейке с ограниченным объемом электролита осуществлялась сравнением экспериментальных и теоретически рассчитанных катодных поляризационных кривых.
Наибольшее влияние на ход поляризационных зависимостей оказывает величина константы скорости гетерогенной химической реакции растворения оксида цинка в щелочном растворе. При постоянной плотности тока увеличение константы скорости химической реакции в расчетных формулах с 500 до 2000 моль/(с см3 ZnO) вызывает уменьшение электродной поляризации, возрастает степень превращения активного вещества. Расчетные и экспериментальные поляризационные зависимости для восстановления оксидно-цинкового слоя в ограниченном объеме щелочно-цинкатного электролита с общей концентрацией калиевой щелочи 7 М, построенные в координатах $j\sqrt \tau $ от j и j ∙ τ от j в наибольшей степени совпадают при константе скорости гетерогенной химической реакции (900–1000) моль/(с см3 ZnO) (рис. 7).
Рис. 7.
Зависимости $j \cdot {{\tau }_{{{\text{пер}}}}}$ от j и $j \cdot \sqrt {{{\tau }_{{{\text{пер}}}}}} $ от j: 1, 6 – экспериментальные, 2–5, 7 – расчетные для процесса катодного восстановления слоя ZnO. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Расчетное значение константы скорости k, моль/(с см3 ZnO): 2 – 500; 3, 7 – 1000; 4 – 1500; 5 – 2000.
Как для расчетных, так и экспериментально полученных поляризационных зависимостей наблюдается значительное смещение катодного потенциала в отрицательном направлении, связанное с большим фарадеевским сопротивлением процесса восстановления (рис. 8). Расхождение расчетных и экспериментальных зависимостей в начальный период процесса связано, по нашему мнению, с большими истинными плотностями тока, когда отсутствует линейная зависимость между потенциалом и током, как было принято при составлении математической модели исследуемого процесса. При дальнейшем прохождении тока происходит увеличение поверхности металла в результате образования губчатого осадка с соответствующим уменьшением истинной плотности тока. С этим, вероятно, и связано последующее снижение электродной поляризации. После израсходования 60–80% оксида цинка (в зависимости от величины плотности тока) наблюдается сначала медленное, а в конце восстановления более быстрое возрастание катодной поляризации.
Рис. 8.
Поляризационные кривые экспериментальные (1–5) и математически расcчитанные (1 '–5 ') при k = 1000 моль/(c см3 ZnO) для катодного восстановления оксидно-цинкового слоя. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Плотность тока, мА/см2: 1, 1 ′ – 150; 2, 2 ′ – 200; 3, 3 ′ – 300; 4, 4 ′ – 400; 5, 5 ′ – 500.

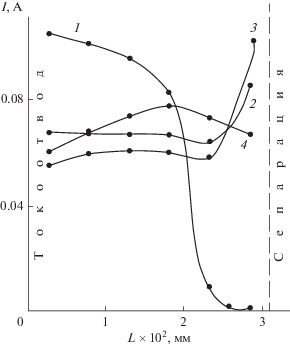
Такой характер изменения потенциала электрода связан, согласно расчетам, с действием целого ряда факторов. Процесс реагирования ионов цинката начинается, в основном, на открытой металлической поверхности цинкового токоотвода, вблизи которой из-за сравнительно малой проводимости твердой оксидной фазы сосредоточен практически весь катодный ток (рис. 9). С большой истинной плотностью тока связана и начальная высокая поляризация процесса. Из-за развития поверхности металла, осаждающегося в виде губки, происходит уменьшение поляризации во времени.
Рис. 9.
Расчетное распределение тока восстановления по толщине оксидно-цинкового слоя: k = = 1000 моль/(c см3 ZnO); jк = 400 мА/см2. Время восстановления, с: 1 – 2; 2 – 8; 3 – 16; 4 – 28. Исходный электролит: 7 М раствор КОН + 56 г/л Zn2+.
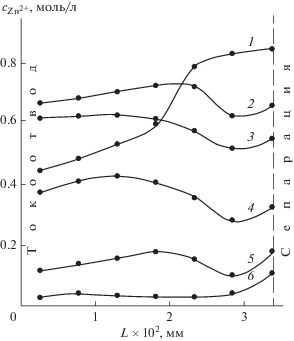
Одновременно происходит уменьшение концентрации цинката у токоотвода (рис. 10), что повышает фарадеевское сопротивление процесса. Уменьшение концентрации цинката у токоотвода и наработка металлического цинка в глубинных зонах оксидного слоя с высоким содержанием цинката приводят к перераспределению тока по объему оксидного слоя. В этом слое увеличивается концентрация ОН-ионов, которые переходят к следующим зонам электрода, богатыми ZnO, и химически насыщают объем пор электрода ионами цинката. При этом снижается истинная плотность тока с соответствующим уменьшением электродной поляризации.
Рис. 10.
Расчетное распределение концентрации цинката по толщине оксидно-цинкового слоя: k = = 1000 моль/(c см3 ZnO); jк = 400 мА/см2. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Время восстановления, с: 1 – 2; 2 – 8; 3 – 16; 4 – 24; 5 – 28; 6 – конец заряда.
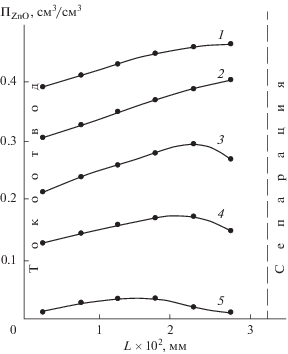
В соответствии с распределением тока до внешней поверхности оксидного слоя идет и объемная наработка металлической фазы (рис. 11).
Рис. 11.
Расчетное распределение содержания металлического цинка по толщине оксидно-цинкового слоя при его катодном восстановлении: jк = 400 мА/см2; k = 1000 моль/(c см3 ZnO). Время восстановления, с: 1 – 2; 2 – 8; 3 – 16; 4 – 28.
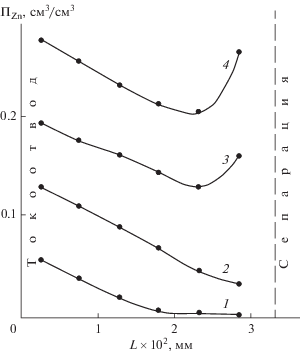
В ходе электрохимического процесса расходование цинката сопровождается высвобождением соответствующего количества ионов гидроксила в зоне токоотвода, где на начальном этапе в основном реализуется электрохимический процесс (рис. 12). Это приводит к усилению реагирования в глубинных зонах остающегося оксида цинка со щелочью с образованием новых порций цинката. Это способствует распространению катодной реакции по объему оксидного слоя. Таким образом, через некоторое время процесс восстановления распространяется по всему объему оксидного слоя, идет выравнивание величин катодных токов, концентраций щелочи и цинката по зонам электрода, способствуя стабилизации электродной поляризации.
Рис. 12.
Расчетное распределение концентрации общей щелочи по толщине оксидно-цинкового слоя при его катодном восстановлении: jк = 400 мА/см2; k = 1000 моль/(c см3 ZnO). Время восстановления, с: 1 – 2; 2 – 8; 3 – 16; 4 – 28.

Постепенное накопление металлической фазы в зонах оксидного слоя, выравнивание концентраций щелочи и уменьшение концентрации цинката по мере расходования оксида цинка создают условия для перераспределения тока по глубине электродного вещества. Из-за сохранения повышенной концентрации цинката в поверхностных слоях и большого различия в проводимостях металла и раствора току более выгодно протекать по металлической фазе. Это вызывает перераспределение тока в поверхностные зоны к сепарации, способствуя переходу реакционного процесса во внешние зоны оксида (на вершинах дендритов цинка) (рис. 13).
Рис. 13.
Расчетная кинетика роста дендрита цинка в процессе восстановления слоя оксида цинка: jк = = 0.15 А/см2. Исходный электролит: 7 М раствор KОН + 56 г/л Zn2+. Время с начала восстановления, с: а – 2; б – 16; в – 28; г – конец восстановления.

Аналогичное явление экспериментально наблюдали авторы исследований, представленных в работах [36, 37], названное ими образованием “скорлупы”. По мнению авторов, уплотнение осадка во фронте его роста связано с доставкой ионов металла из объема электролита, в то время как возможности осаждения металла внутри пористого слоя оказываются уже практически исчерпанными из-за значительного снижения концентрации восстанавливающихся ионов. Однако в случае восстановления оксида цинка из-за незначительного подвода цинкатных ионов через слой гидратцеллюлозного сепаратора такое поверхностное распределение процесса сохраняется только до тех пор, пока в этой зоне остается достаточное количество оксида цинка, служащего источником ионов цинката за счет химического взаимодействия со свободной щелочью. После израсходования основной массы оксида цинка во внешней зоне (рис. 14) скорость гетерогенного химического взаимодействия оксида цинка со щелочью начинает отставать от скорости расходования цинкатных ионов на катодное превращение. Это приводит к росту поляризации фарадеевского процесса в этой зоне. Ток восстановления перераспределяется в глубинные зоны с бόльшим содержанием оксида цинка и соответственно с более высокой концентрацией цинката. Такой характер роста дендрита цинка существенно отличается от закономерностей осаждения дендритного осадка цинка, наблюдаемых авторами работ [33, 38]. При свободном доступе цинкатных ионов к фронту роста рыхлого осадка и значительном обеднении электролита по цинкату во внутренних зонах осадка осаждение металла практически не происходит на боковых гранях дендритов, а сосредотачивается на их вершинах.
Рис. 14.
Расчетное распределение содержания оксида цинка по толщине оксидно-цинкового слоя при его катодном восстановлении: jк = 400 мА/см2; k = = 1000 моль/(с см3 ZnO). Время, с: 1 – 2; 2 – 8; 3 – 16; 4 – 24; 5 – 28.
После израсходования 70–80% общего оксида цинка наблюдается значительное снижение скорости подрастворения оксида с соответствующим уменьшением концентрации цинката во всех зонах оксидного слоя и ростом электродной поляризации. Особенно это проявляется после израсходования 85–90% оксида цинка (в зависимости от плотности тока восстановления), когда концентрация цинката в порах активного вещества уменьшается до 10–2–5 × 10–3 М. Одновременно происходит возрастание электродной поляризации до 0.6–0.7 В и выше.
Хорошее совпадение рассчитанных по математической модели и экспериментальных поляризационных зависимостей также подтверждает, что катодное восстановление оксида цинка в концентрированных щелочно-цинкатных растворах протекает через промежуточное образование растворимого цинкатного комплекса.
Полученные данные об особенностях восстановления оксида цинка в условиях, максимально приближенных к работе реальных пористых электродов щелочно-цинковых источников тока, позволяют с достаточной точностью описать поведение пористых цинковых электродов при заряде источника тока. Для этого в предложенную модель восстановления слоя оксида цинка необходимо внести ряд изменений и уточнений: указать реальные толщины цинковых электродов и их структурные и фазовые характеристики в разряженном состоянии, плотности зарядного тока, наличие многослойного гидратцеллюлозного сепаратора.
Рассчитанные поляризационные зависимости таких электродов хорошо согласуются с зарядными кривыми порошковых цинковых электродов щелочных аккумуляторов при различных плотностях тока (рис. 15). Следует отметить, что при заряде реального цинкового электрода не наблюдается значительного начального повышения катодной поляризации, как в случае модельного электрода, что связано с наличием в разряженной активной массе отрицательного электрода металлического цинка, всегда остающегося после разряда источника тока. Поляризации пористых цинковых электродов при их заряде, полученные расчетным и экспериментальным путем, составляют несколько десятков милливольт, что связано со значительно большей электрохимически активной поверхностью реального электрода по сравнению с модельным (рис. 1) и низкими плотностями тока, применяемыми для заряда щелочно-цинкового аккумулятора.
Рис. 15.
Расчетные и экспериментальные поляризационные кривые катодного восстановления оксидно-цинкового электрода. Исходный электролит: 7 М раствор KОН + ZnOнас. Кривые: 1 ′, 2 ′ – расчетная; 1, 2 – экспериментальная. Плотность зарядного тока, мА/см2: 1,1 ′ – 6; 2, 2 ′ – 15.

Таким образом, предложенная математическая модель катодного процесса на монолитном цинковом электроде, покрытом пористым слоем оксида, подтверждает катодное восстановление оксида цинка по механизму “растворение–осаждение” и позволяет определить константу скорости химической реакции растворения цинка в щелочно-цинкатном электролите. Разработанная математическая модель восстановления оксидно-цинкового слоя в условиях минимального объема щелочного электролита дает возможность с достаточной точностью описать процессы в порошковых цинковых электродах при заряде щелочных аккумуляторов с цинковым электродом, с учетом характеристик реального пористого электрода: его толщины, степени разряженности, пористости, плотности тока, применяемой при заряде, концентрационных изменений в зоне противоэлектрода.
Список литературы
Коровин, Н.В., Скундин, А.М. Химические источники тока: Справ. М.: Изд-во МЭИ, 2003. 740 с. [Korovin, N.V. and Skundin, A.M., Chemical current sources. Handbook (in Russian), M.: Izdatelstvo MEI, 2003, 740 p.]
Thomas, A. Edison. Reversible galvanic battery. Patent US684204 A (USA.), 1901.
James, J. Drumm. Storage battery. Patent US1955115 A (USA), 1934.
Архангельская, З.П., Флёров, В.Н., Решетова Г.Н. Тенденции перспективы развития производства и научных исследований в области никель-цинковых аккумуляторов. М.: Информэлектро, 1978. 47 с. [Arhangel’skaya, Z.P., Flerov, V.N., and Reshetova, G.N., Tendencii perspektivy razvitiya proizvodstva i nauchnyh issledovanij v oblasti nikel’-cinkovyh akkumulyatorov (in Russian), M.: Informelektro, 1978, 47 p.]
Acmepower. URL: http://acmepower.ru/
Shenzhen BetterPower Battery Co., LTD. http://en.betterpower.com.cn/.
VARTA Microbattery – Website. http://www.varta-microbattery.com/en.html.
Бычковский, С.К., Бахарев, С.А., Никифоров, В.И. Воздушно-цинковый элемент большой емкости. Пат. 2349991 (Россия). 2009. [Bychkovskij, S.K., Baharev, S.A., and Nikiforov, V.I., Vozdushno-cinkovyj element bol’shoj emkosti, Pat. 2349991 (Russia), 2009.]
Шкарупо, С.П. Кислородно-цинковый источник тока. Пат. 128783 (Россия). 2012. [Shkarupo, S.P., Kislorodno-cinkovyj istochnik toka, Pat. 128783 (Russia), 2012.]
Diggle, J.W., Despic, A.R., and Bockris, J.O., The mechanism of the dendritic crystallization of zinc, Int. J. Electrochem. Sci., 1969, vol. 116, no. 11, p. 1503.
Базаров, С.П., Бачаев, А.А., Элькинд, К.М., Флёров, В.Н., Архангельская, З.П., Решетова, Г.Н. Перераспределение активной массы в цинковых электродах при циклировании никель-цинковых аккумуляторов. Сборник научных трудов по ХИТ ВНИАИ. Ленинград: Энергоатомиздат, 1983. С. 68. [Bazarov, S.P., Bachaev, A.A., Elkind, K.M., Flerov, V.N., Arkhangelskaya, Z.P., and Reshetova, G.N., Pereraspredelenie aktivnoj massy v cinkovyh elektrodah pri ciklirovanii nikel’-cinkovyh akkumulyatorov, Collection of scientific papers on HIT VNIAI (in Russian), Leningrad: Energoatomizdat, 1983, 68 p.]
Butler, J.N., Ionic Equilibrium: a mathematical approach, Reading, MA: Addiction. Wesley, 1964, 547 p.
Farr, G.P.G. and Hampson, M.A., Evolution of characteristics of exchange reactions. 1. Exchange reactions at a solid zinc electrode in alkaline, J. Electroanal. Chem., 1967, vol. 13, no. 4, p. 433.
Dirkse, T.P. and Hampson, N.A., The Zn(II)/Zn exchange reactions in KOH solution. III. Exchange current measurements using the potentiostatic method, Electrochim. Acta, 1972, vol. 17, no. 6, p. 1113.
Gerischer, H., Kinetik der Entladung einfacher und komplexer Zinc Ionen, Z. Physik. Chem., 1953, Bd 202, p. 302.
Witt, Payne H. and Bard, Allen J., The mechanism of the zinc(II)-zinc amalgam electrode reaction in alkaline media as studied by chronocoulometric and voltametric techniques, J. Electrochem. Soc., 1972, vol. 119, no. 12, p. 1665.
Ревина, Е.М., Ротинян, А.Л., Шошина, И.А. Поведение активного цинкового электрода в щелочных и цинкатных растворах. Журн. прикладной химии. 1973. Т. 46. № 12. С. 2654. [Revina, E.M., Rotinyan, A.L., and Shoshina, I.A., Behavior of an active zinc electrode in alkaline and zincate solutions, J. Appl. Chem. (in Russian), 1973, vol. 46, no. 12, p. 2654.
Bockris, J.O.M., Nagy, Z., and Damjanovic, A., On the deposition and dissolution of zinc in alkaline solutions, J. Electrochem. Soc., 1972, vol. 119, no. 3, p. 285.
Epelboin, J., Ksouri, M., Wiart, E., and Lejay, R., The mechanism of the zinc electrode reaction in alkali, Electrochim. Acta, 1975, vol. 20, no. 8, p. 603.
Иоффе, А.Ф. Полупроводники. М.–Л.: Академкнига, 1955. 96 с. [Ioffe, A.F., Poluprovodniki. (in Russian), M.–L.: Akademkniga, 1955. 96 p.]
Hladik, O. and Schwabe, K., Untersuchungen zum nachweise der direkten Reduktion von Zincoxide in der festen Phase, Electrochim. Acta, 1970, vol. 15, no. 4, p. 635.
Оше, А.И., Багоцкий, В.С. О механизме катодного восстановления фазовых слоев окиси на цинковом электроде. Журн. физ. химии. 1961. Т. 35. № 7. С. 1641. [Osche, A.I. and Bagotsky, V.S., On the mechanism of cathodic reduction of oxide phase layers on a zinc electrode, R J. Phys. Chem. A (in Russian), 1961, vol. 35, no. 7, p. 1641.]
Dirkse, T.P., Composition and properties of saturated solutions of ZnO in KOH, J. Electrochem. Soc., 1959, vol. 106, no. 2, p. 154.
Drazic, D. and Nagy, Z., Investigation of direct reduction of zinc oxide alkaline electrolytes, J. Electrochem. Soc., 1971, vol. 118, no. 2, p. 255.
Landsberg, H., Fürtig, H., and Müller, M., Zum anodischen Verhalten des Zink und Zinkoksid in Natronlange, Z. Phys. Chem., 1961, Bd 216, no. 3/4, p. 199.
Кудрявцев, Т.Н., Бек, Р.Ю., Кушевич, И.Ф. К вопросу о причинах местных губчатых образований на катоде в цинкатных электролитах. Журн. прикладной химии. 1957. Т. 30. № 7. С. 1093. [Kudryav-tsev, T.N., Beck, R.Yu., and Kushevich, I.F., On the causes of local spongy formations at the cathode in zinc electrolytes, J. Appl. Chem. (in Russian), 1957, vol. 30, no. 7, p. 1093.]
Флёров, В.Н. Влияние старения на катодный процесс в цинкатных электролитах. Труды ГПИ им. А.А. Жданова. Химия и химическая технология веществ. 1961. № 13. Т. 5. С. 56. [Flerov, V.N., The effect of aging on the cathode process in zinc electrolytes. Proceedings of the State Research Institute named after A.A. Zhdanov. Chemistry and chemical technology of substances (in Russian), 1961, no. 13, vol. 5, p. 56.]
Романов, В.В. Исследование причин образования цинкатной губки при электролизе цинкатных растворов. Журн. прикладной химии. 1963. Т. 36. № 5. С. 1057. [Romanov, V.V., Investigation of the causes of zincate sponge formation during the electrolysis of zincate solutions, J. Appl. Chem. (in Russian), 1963, vol. 36, no. 5, p. 1057.]
Стендер, Р.В., Жолудев, М.Д. Электролиз растворов цинката натрия. Журн. прикл. химии. 1959. Т. 32. № 6. С. 1296. [Stender, R.V. and Zholudev, M.D., Electrolysis of sodium zincate solutions, J. Appl. Chem. (in Russian), 1959, vol. 32, no. 6, p. 1296.]
Элькинд, К.М., Наумов, В.И., Михаленко, М.Г. О механизме катодного выделения цинка из калий-цинкатных электролитов. Известия вузов СССР. Серия: Химия и хим. технология. 1977. Т. 20. № 6. С. 870. [Elkind, K.M., Naumov, V.I., and Mikhalenko, M.G., On the mechanism of cathodic isolation of zinc from potassium-zincate electrolytes, Izvestiya VUZov SSSR. Series: Chemistry and chemical technology (in Russian), 1977, vol. 20, no. 6, p. 870.]
Элькинд, К.М., Михаленко, М.Г., Флёров, В.Н. Механизм образования катодной губки при осаждении цинка из цинкатных электролитов. Известия вузов. Серия: Химия и хим. технология. 1982. Т. 25. № 7. С. 862. [Elkind, K.M., Mikhalenko, M.G., and Flerov, V.N., Mechanism of cathode sponge formation during zinc deposition from zinc electrolytes, Izvestiya VUZov. Series: Chemistry and Chemical Technology (in Russian), 1982, vol. 25, no. 7, p. 862.]
Москвичёв, А.А., Козина, О.Л., Гунько, Ю.Л., Михаленко, М.Г., Москвичёв, А.Н. Математическое моделирование процесса заряда пористого кадмиевого электрода щелочных источников тока. Электрохимия. 2011. Т. 47. С. 880. [Moskvichev, A.A., Kozina, O.L., Gunko, Yu.L., Mikhalenko, M.G., and Moskvichev, A.N., Mathematical simulation of charging of process for porous cadmium electrode in alkaline batteries, Russ. J. Electrochem., 2011, vol. 47, p. 825.]
Михаленко, М.Г., Флёров, В.Н. Электрохимическое определение скорости диффузии цинката через гидратцеллюлозную сепарацию. Электрохимия. 1972. Т. 8. С. 81. [Mikhalenko, M.G. and Flerov, V.N., Electrochemical determination of the diffusion rate of zincate through hydrate-cellulose separation, Sov. Electrochem., 1972, vol. 8, no. 1, p. 81.]
Решетова, Г.Н., Архангельская, З.П. Макрокинетика процессов на цинковом электроде щелочных источников тока. Сборник работ по ХИТ. 1975. № 10. С. 268. [Reshetova, G.N. and Arkhangelskaya, Z.P., Makrokinetika protsessov na zinkovom elektrode alkaline sources of current, Collection works on HIT (in Russian), 1975, no. 10, 268 p.]
Sunni, W.G. and Bennion, D.N., Transient and failure analyses of the porous zinc electrode, J. Electrochem. Soc., 1980, vol. 127, p. 2007.
Мурашова, И.Б., Помосов, А.В., Тишкина, А.В. Динамическая модель развития дисперсного осадка в гальваностатических условиях. Влияние природы разряжающегося металла на динамику роста дендритов. Электрохимия. 1982. Т. 18. С. 449. [Murashova, I.B., Pomosov, A.V., and Tishkina, A.V., Dynamic model of dispersed sediment development under galvanostatic conditions. Influence of the nature of the discharged metal on the dynamics of dendrite growth, Sov. Electrochem., 1982, vol. 18, p. 449.]
Ostanina, T.N., Rudoi, V.M., Patrushev, A.V., Darin-tseva, A.B., and Farlenkov, A.S., Modelling the dynamic growth of copper and Zink dendritic deposits under the galvanostatic electrolysis conditions, J. Electroanal. Chem., 2015, vol. 750, p. 9.
Мурашова, И.Б., Помосов, А.В., Эделева, Н.А. Динамическая модель развития дисперсного осадка в гальваностатических условиях. Влияние кислотности электролита на кинетику роста дендритов. Электрохимия. 1979. Т. 15. С. 182. [Murashova, I.B., Pomosov, A.V., and Edeleva, N.A., Dynamic model of dispersed sediment development under galvanostatic conditions, Effect of electrolyte acidity on the kinetics of dendrite growth, Sov. Electrochem., 1979, vol. 15, no. 2, p. 182.]
Дополнительные материалы отсутствуют.


