Электрохимия, 2022, T. 58, № 1, стр. 40-45
Электрохимический синтез метаниловой кислоты
А. А. Конарев *
Федеральное государственное унитарное предприятие “Государственный научный центр “НИОПИК”
123995 Москва, ГСП-5, ул. Большая Садовая, 1, корп. 4, Россия
* E-mail: konarev.niopik@gmail.com
Поступила в редакцию 01.11.2020
После доработки 25.05.2021
Принята к публикации 25.05.2021
- EDN: RWVBQW
- DOI: 10.31857/S042485702201008X
Аннотация
Исследован препаративный электросинтез м-аминосульфокислоты бензола (метаниловой кислоты) из м-нитросульфокислоты бензола в гальваностатическом режиме на никелевом катоде в аммиачном буферном растворе. Определены технологические параметры электросинтеза метаниловой кислоты на укрупненной лабораторной установке в аммиачном буферном растворе (0.4 М NH4Cl + + NH4OH) с рН 7.5, обеспечивающие выход продукта по веществу 93.8–94.0%, выход по току 54.5–60.2%, выход по выделению метаниловой кислоты из раствора 78.0–80.0%, энергоемкость процесса 10.2–11.3 кВт ч/кг и удельную производительность электролизера 0.36–0.40 кг/(м2 ч) при плотности тока 10 А/дм2 и температуре 55–60°С.
ВВЕДЕНИЕ
м-Аминосульфокислота бензола (м-АСКБ) используется в производстве азокрасителей [1]. Исходным продуктом для промышленного синтеза м-АСКБ является нитробензол, который сульфируют олеумом, а полученная соответствующая м‑нитросульфокислота бензола (м-НСКБ) подвергается нейтрализации молотым мелом в присутствии карбоната натрия, а затем восстанавливается в виде натриевой соли с концентрацией 140–180 г/л чугунной стружкой в аммиачно-щелочном растворе при температуре кипения [2]. После восстановления реакционную массу нейтрализуют кальцинированной содой до рН 7.5–8.0, фильтруют и упаривают до концентрации м‑АСКБ 225–250 г/л. Выделение целевого продукта осуществляют подкислением раствора, содержащего м-АСКБ, концентрированной серной кислотой до рН 1.5–2.0. Общий выход м-АСКБ по стадиям восстановления и выделения продукта из раствора составляет 76.0%. Недостатком химического способа получения м-АСКБ является многостадийность и трудоемкость процесса, большое количество твердых отходов в виде неутилизируемого железного шлама, невысокая чистота целевого продукта.
Для усовершенствования и упрощения стадии восстановления ароматических нитросульфокислот ведутся работы в двух направлениях: использование методов каталитического гидрирования и электрохимического восстановления. В патентной литературе [3] описан способ получения ароматических аминосульфокислот каталитическим гидрированием щелочных солей соответствующих ароматических нитросульфокислот в воде или водно-спиртовом растворе при температуре 50–100°С и повышенном давлении, предпочтительно 50–200 ат. В качестве катализатора гидрирования применяют сульфиды вольфрама и молибдена, нанесенные на инертный носитель – Al2O3. При гидрировании этим способом натриевой соли м-НСКБ выход м-АСКБ составляет 94%. Кроме того, в качестве катализатора для восстановления м-НСКБ (Na-соль) могут быть использованы сульфиды платины, палладия и рутения [4]. В патенте [5] м-АСКБ получают каталитическим восстановлением м-НСКБ на скелетном никелевом катализаторе с выходом 85%.
Данные по электрохимическому восстановлению м-НСКБ немногочисленны и не дают полного представления об оптимальных условиях проведения процесса с целью достижения высоких выходов конечных продуктов по веществу и по току. В работе [6] исследован процесс электросинтеза метаниловой кислоты на медном катоде в кислой среде. Однако, как отмечается в работе [7], препаративный электросинтез изомерной смеси 1,6- и 1,7-нафталинаминосульфокислот (Клеве-кислот) из соответствующих нитросульфокислот нафталина успешно осуществляется в аммиачно-буферной среде на катоде из никеля или из нержавеющей стали с выходом по веществу 88–93% и по току 58–60%. Поэтому настоящее исследование посвящено разработке препаративного электросинтеза м-АСКБ из соответствующего нитросоединения в аммиачно-буферных растворах, результаты которого могут быть использованы в промышленном масштабе.
МЕТОДИКА ЭКСПЕРИМЕНТА
Циклические вольт-амперные кривые на стеклоуглероде (СУ) марки СУ-2000 регистрировали с помощью полярографа ПУ-1 в дифференциальном режиме. Применявшийся в работе стационарный электрод представлял собой торец стеклоуглеродного стержня диаметром 2 мм [8].
Ячейка представляла собой конический стеклянный сосуд объемом 20 см3 с термостатируемой рубашкой. Электродом сравнения служил насыщенный каломельный полуэлемент, относительно которого и приведены значения потенциалов. В качестве вспомогательного электрода использовали также насыщенный каломельный полуэлемент.
Для получения воспроизводимых результатов СУ шлифовали наждачной бумагой № 0, полировали до зеркального блеска фетром, пропитанным глицерином с порошком оксида алюминия. После промывки дистиллированной водой электрод выдерживали в концентрированной серной кислоте и снова тщательно промывали. Непосредственно перед записью каждой циклической вольт-амперной кривой электрод промывали дистиллированной водой и высушивали фильтровальной бумагой. Электролит, в который погружали электрод, продували инертным газом в течение 3–4 мин для удаления растворенного кислорода.
Фоновыми электролитами служили растворы NaOH с концентрацией 0.1–1.0 М и аммиачно-буферные растворы с рН 7.5, а также растворы хлорида аммония с концентрацией 0.1–0.4 М.
Электросинтез метаниловой кислоты в гальваностатическом режиме проводили в лабораторном электролизере, выполненном из стекла, с разделением катодного и анодного пространств катионообменной мембраной МК-40. Термостатируемая с помощью рубашки ячейка имела пришлифованную крышку, в которой предусмотрены штуцера для термометра, отбора проб, отвода газов из катодного и анодного пространств, а также для токоподводов к электродам.
В анодное пространство помещали змеевик для охлаждения анолита. Для электролиза применяли катод из никеля марки Н3 в виде перфорированного цилиндра с площадью поверхности 0.30 дм2. Анодом служила платиновая пластинка. Рабочий объем электролизера составлял 60–80 см3. Необходимую температуру католита поддерживали с помощью термостата U-15. Перемешивание электролита осуществляли магнитной мешалкой ММ-3М.
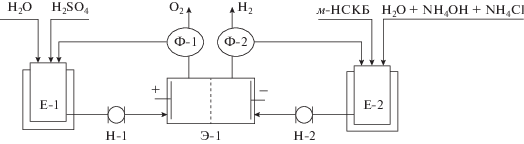
Для масштабирования и уточнения условий электросинтеза м-АСКБ электролиз в гальваностатическом режиме проводили на укрупненной лабораторной установке, состоящей из электролизера, позиция Э-1, промежуточных стеклянных емкостей с рубашкой для анолита, позиция Е-1 и католита, позиция Е-2, двух шестеренчатых насосов, позиции Н-1 и Н-2, фазоразделителей, позиции Ф-1 и Ф-2, выпрямителя тока, амперметра, вольтметра и трубопроводов с арматурой (рис. 1).
Лабораторный электролизер, позиция Э-1, представлял собой двухкамерный аппарат фильтр-прессной конструкции с разделением анодного и катодного пространств катионообменной мембраной МК-40. Катод применяли в виде перфорированной пластины из никеля марки Н3 с рабочей поверхностью 1.0 дм2, анодом служила пластина из свинцово-серебряного сплава (~1.0% Ag) с такой же поверхностью. Анолитом использовали 10%-ный раствор серной кислоты. Подачу и циркуляцию анолита и католита через соответствующие электродные камеры электролизера осуществляли шестеренчатыми насосами, позиции Н-1 и Н-2, производительностью 150–180 л/ч из промежуточных стеклянных термостатируемых емкостей, позиции Е-1 и Е-2 соответственно. Объем католита составлял 250–300 см3, а объем анолита – 150–200 см3. Образующиеся в ходе электролиза газообразные продукты: водород отделяется от католита в фазоразделителе, позиция Ф-2, а кислород – в фазоразделителе, позиция Ф-1.
В качестве источника тока использовали выпрямитель марки ВСА-5А-К. Силу тока в цепи и напряжение на ячейке и фильтр-прессном электролизере измеряли вольтмиллиамперметрами М2018.
Электросинтез метаниловой кислоты проводили следующим образом. В промежуточную стеклянную емкость Е-1 заливали предварительно приготовленный 10%-ный раствор серной кислоты, который насосом Н-1 подавали в анодную камеру электролизера Э-1 по замкнутому контуру. В промежуточную стеклянную емкость Е-2 заливали дистиллированную воду, а затем в нее загружали расчетные количества м-НСКБ, хлорида аммония и аммиачной воды до требуемой величины рН. Полученный исходный раствор м-НСКБ подавали насосом Н-2 в катодную камеру электролизера Э-1 по замкнутому контуру. Обеспечив циркуляцию растворов через электролизер Э-1, на последний подавали напряжение от выпрямителя тока и устанавливали силу тока, соответствующую требуемой плотности тока. Процесс электровосстановления м-НСКБ прекращали при полной конверсии исходного нитросоединения и промежуточно образующегося соответствующего гидроксиламинопроизводного, по результатам их анализа.
В ходе электролиза полярографически и вольтамперометрически контролировали изменение концентрации исходного нитросоединения и продуктов реакции [8].
Концентрацию промежуточно образующейся гидроксиламиносульфокислоты бензола определяли вольтамперометрически на фоне 1 М раствора NaOH в дифференциальном режиме [8], а концентрацию м-АСКБ – методом диазотирования, считая на диазотирующиеся продукты с молекулярной массой 173 [1].
Выделение целевой м-АСКБ из раствора, полученного после электролиза, проводили его подкислением серной кислотой до рН реакционной массы 1.5–2.0 при температуре 75–80°С в термостатируемом аппарате, изготовленным из стекла, с рамной мешалкой. По окончании подкисления реакционную массу постепенно охлаждали до 50°С, а затем до температуры 20–22°С. При этой температуре и работающей мешалке давали выдержку в течение 2–2.5 ч до постоянной концентрации метаниловой кислоты в маточнике не более 40 г/л. После фильтрации осадок метаниловой кислоты промывали дистиллированной водой, тщательно отжимали и анализировали методом диазотирования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате предварительных исследований электрохимического поведения м-НСКБ методами полярографии, вольтамперометрии на СУ и электролиза при контролируемом потенциале, а также электролиза разбавленных растворов м‑НСКБ в гальваностатическом режиме нами установлено, что электровосстановление м-НСКБ в м‑АСКБ можно проводить как в слабокислой, так и в слабощелочной среде на фоне аммиачных буферных растворов на никелевом катоде с выходом метаниловой кислоты по веществу 92.8% и выходом по току 82.0%. В то же время в [6] показано, что высокие выходы м-аминосульфокислоты бензола по веществу и по току в сернокислых растворах на медном катоде достигаются лишь при низких плотностях тока (0.25 А/дм2) и малых концентрациях исходного нитросоединения (0.02–0.2 М). Причем с увеличением плотности тока, концентраций нитросульфокислоты бензола и серной кислоты эффективность восстановления резко снижается. Такой процесс не может представлять интерес для промышленного использования из-за низкой его производительности и больших энергозатрат, связанных с упаркой аминораствора на стадии выделения целевого продукта. В связи с этим было исследовано влияние концентрации м-НСКБ на выход метаниловой кислоты по веществу и по току в хлоридоаммонийной и аммиачной буферной средах на никелевом катоде (рис. 2).
Рис. 2.
Зависимость выхода м-АСКБ по веществу (1) и по току (2) от концентрации м-НСКБ в хлоридоаммонийном (0.35 М NH4Cl) (а) и аммиачном буферном растворах (0.4 М NH4Cl + NH4OH) с рН 7.5 (б). Плотность тока –10 А/дм2, температура 55–60°С, катод – никель марки Н3.
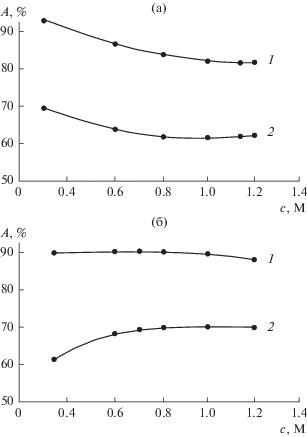
Из рис. 2 видно, что электровосстановление м‑НСКБ на никелевом катоде в аммиачной буферной среде (0.4 М NH4Cl + NH4OH) с рН 7.5 с увеличением концентрации исходного нитросоединения от 0.2 до 1.2 М выход метаниловой кислоты по веществу уменьшается с 91.0 до 88.4%, а в хлоридоаммонийном растворе (0.35 М NH4Cl) наблюдается при этом более резкое снижение выхода по веществу, составляющее от 97.3 до 71.4%. Уменьшение выхода метаниловой кислоты по веществу в слабокислом растворе с увеличением концентрации м-НСКБ, вероятно, связано с затруднением дальнейшей конверсии гидроксиламинопроизводного в м-АСКБ, вызванным побочным выделением водорода, на что, в частности, указывает более низкий выход по току в этих растворах. Так, при концентрации м-НСКБ 1.2 М выход метаниловой кислоты по току в аммиачном буферном растворе составляет 67.6%, а в хлоридоаммонийном растворе – 40.0%.
В аммиачной буферной среде (0.4 М NH4Cl + + NH4OH) с рН 7.5 при восстановлении м-НСКБ с концентрацией 1.2 М исследовано изменение концентраций исходных, промежуточных и конечных продуктов в ходе электролиза (рис. 3 и 4).
Рис. 3.
Циклические дифференциальные вольтамперограммы восстановления м-НСКБ, снятые на СУ на фоне 0.1 М NH4Cl в процессе электролиза. Время от начала электролиза: 1, 11, 12 – 50 мин; 2, 21, 22 – 100 мин; 3, 31, 32 – 220 мин. Регистрация пика В осуществляется с чувствительностью прибора, в 10 раз меньшей, чем пиков А и Б. Концентрация м-НСКБ –1.2 М, плотность тока –10.0 А/дм2, температура 55–60°С, катод – никель марки Н3, фон – аммиачный буферный раствор (0.4 М NH4Cl + NH4OH) с рН 7.5.

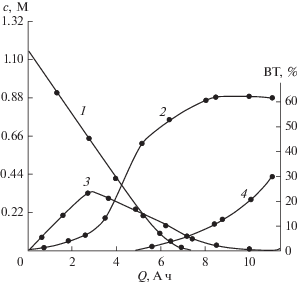
Рис. 4.
Зависимость концентраций м-НСКБ (1), м‑АСКБ (2) и м-гидроксиламиносуль-фокислоты бензола (3), а также выхода водорода по току (ВТ) (4) от количества пропущенного электричества. Концентрация м-НСКБ – 1.2 М, температура 55–60°С, плотность тока –10 А/дм2, катод – никель марки Н3, фон – аммиачный буферный раствор (0.4 М NH4Cl + + NH4OH) с рН 7.5.
На рис. 3 приведены типичные циклические вольтамперограммы раствора, содержащего м‑АСКБ, полученного в ходе электролиза в аммиачной буферной среде. При катодной развертке потенциала наблюдается пик восстановления исходной м-НСКБ (пик А с Ер = –0.60 В), а при анодной развертке потенциала от 0.0 В регистрируются соответствующие пики окисления м-гидроксиламиносульфокислоты бензола (пик Б с Ер = +0.40 В) и метаниловой кислоты (пик В с Ер = +0.90 В), образующихся в условиях препаративного электролиза.
Из рис. 4 видно, что концентрация исходной м-НСКБ до высокой степени превращения (около 80%) снижается линейно от количества пропущенного электричества, близкого к теоретическому (5.0 А ч). При этом на вольтамперограмме наблюдается уменьшение высоты пика А (рис. 3). Промежуточным продуктом реакции является соответствующая м-гидроксиламиносульфокислота бензола, концентрация которой сначала увеличивается, достигает максимума, а затем медленно снижается (пик Б на вольтамперограмме сначала увеличивается, а затем исчезает) в результате протекания побочной реакции – выделения водорода (кривая 4 рис. 4). Соответствующая м‑нитрозосульфокислота бензола присутствует в реакционной смеси в следовых количествах [7, 8].
Конечный продукт реакции – м-АСКБ образуется с самого начала электролиза, но ее концентрация невелика. При дальнейшем протекании процесса, как видно из рис. 4, наблюдается резкое увеличение концентрации метаниловой кислоты в реакционной смеси, обусловленное дальнейшим восстановлением исходных и промежуточных продуктов (пик В на вольтамперограмме увеличивается в ходе электролиза, а пики А и Б – уменьшаются рис. 3). При пропускании количества электричества, близкого к теоретическому (~5.0 А ч), повышение концентрации метаниловой кислоты в католите замедляется вследствие увеличения доли тока на выделение водорода. При этом выход водорода по току увеличивается с 8 до 30% (кривая 4 рис. 4).
Таким образом, в аммиачной буферной среде на никелевом катоде при плотности тока 10 А/дм2 и температуре 55–60°С удается получать метаниловую кислоту с выходом по веществу около 90% и по току около 70%, подвергая восстановлению раствор м-НСКБ с концентрацией 0.8–1.2 М. Эти условия электросинтеза метаниловой кислоты, определенные с использованием электролизера, изготовленного из стекла, были апробированы на укрупненной лабораторной установке с фильтр-прессным электролизером. Результаты этих исследований приведены в табл. 1.
Таблица 1.
Результаты масштабирования электросинтеза м-АСКБ в аммиачном буферном растворе (0.4 М NH4Cl + + NH4OH) с рН 7.5 на укрупненной лабораторной установке: температура 55–60°С, плотность тока –10 А/дм2, катод – никель марки Н3
| Концентрация м-НСКБ, М | Выход по веществу, % | Выход по току, % | Выход по выделению, % | Энергоемкость процесса, кВт ч/кг | Удельная производи-тельность, кг/(м2 ч) |
|---|---|---|---|---|---|
| 0.7* | 89.4 | 46.6 | 74.0 | 16.0 | 0.30 |
| 0.7 | 94.0 | 54.5 | 78.0 | 11.3 | 0.36 |
| 1.0 | 94.0 | 58.0 | 80.0 | 10.6 | 0.38 |
| 1.2 | 93.8 | 60.2 | 79.5 | 10.2 | 0.40 |
Из данных табл. 1 следует, что на укрупненной лабораторной установке достигаются результаты, близкие к данным, полученным в электролизере, изготовленным из стекла: выход по веществу натриевой соли метаниловой кислоты 93.8–94.0%, выход по току 54.5–60.2%, выход по выделению метаниловой кислоты из раствора 78.0–80.0%, энергоемкость процесса 10.2–11.3 кВт ч/кг и удельная производительность электролизера 0.36–0.40 кг/(м2 ч) при плотности тока 10 А/дм2 и температуре 60°С. Меньший выход по току на укрупненной лабораторной установке по сравнению со электролизером, изготовленным из стекла, 69.7–70.0%, вероятно, связан с низкой линейной скоростью католита – 0.06 м/с.
Разработанный препаративный электросинтез метаниловой кислоты позволяет исключить твердые отходы в виде железного шлама, сократить количество сточных вод и стадии осаждения железных и кальциевых солей и фильтрации раствора, содержащего м-АСКБ, от железного шлама, а также стадию упарки раствора, содержащего м‑АСКБ, и реагенты на эти стадии. К тому же, аммиачный буферный раствор (0.4 М NH4Cl + + NH4OH) с рН 7.5 более предпочтителен по сравнению с кислой средой [6], так как он менее коррозионно-активный, что упрощает выбор электродного и конструкционного материалов для электролизера, а также циркуляционных насосов и коммуникаций с арматурой. Электрохимически полученная метаниловая кислота в виде пасты соответствует требованиям ТУ 6-14-445-70.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно сделать следующие основные выводы:
1. Показано, что в хлоридноаммонийной и аммиачной буферной средах электросинтез м-АСКБ на никелевом катоде марки Н3 при плотности тока 10 А/дм2 может осуществляться с концентрацией исходного нитросоединения 0.8–1.2 М с выходом метаниловой кислоты по веществу и по току около 90 и 70% соответственно.
2. В аммиачном буферном растворе (0.4 М NH4Cl + NH4OH) с рН 7.5 на никелевом катоде марки Н3 в ходе электролиза исследована кинетика процесса электровосстановления исходного нитросоединения, промежуточного продукта – гидроксиламинопроизводного и образования целевой м-АСКБ.
3. Определены технологические параметры препаративного электросинтеза метаниловой кислоты на укрупненной лабораторной установке в аммиачном буферном растворе (0.4 М NH4Cl + + NH4OH) с рН 7.5, обеспечивающие выход метаниловой кислоты по веществу 93.8–94.0%, выход по току 54.5–60.2%, выход по выделению метаниловой кислоты из раствора 78.0–80.0%, энергоемкость процесса 10.2–11.3 кВт ч/кг и удельную производительность электролизера 0.36–0.40 кг/(м2 ч), при плотности тока –10 А/дм2 и температуре 55–60°С.
4. Показано, что хлоридноаммонийные и аммиачные буферные среды для электросинтеза м‑АСКБ более предпочтительны по сравнению с кислыми растворами, так как обеспечивают не только более высокие технико-экономические показатели процесса, но и могут использоваться для разработки промышленной технологии электросинтеза метаниловой кислоты.
Список литературы
Ворожцов, Н.Н. Основы синтеза промежуточных продуктов и красителей, М.: Госхимиздат, 1955. 839 с. [Vorozhtsov, N.N., The fundamentals of synthesis of intermediate products and dyes (in Russian), M.: Goskhimizdat, 1955. 839 p.]
Венкатараман, К. Химия синтетических красителей, Л.: Госхимиздат, 1956. 803 с. [Venkataraman, K., Chemistry of synthetic dyes (in Russian), Leningrad: Goskhimizdat, 1956, 803 p.]
Ehrmann, K., Verfahrenzur Herstellung von aromatischen Aminosulfonsӓuren, Pat. 1233408 (BRD), 1967.
Свидченко, В.Ф., Николаев, Ю.Т., Сокольский, Д.В. Сульфиды платиновых металлов как катализаторы восстановления нитросоединений. Журн. физ. химии. 1973. Т. 47. С. 725. [Svidchenko, V.F., Nikolaev, Yu.T., and Sokolsky, D.V., Sulfides of platinum metals as catalysts forreduction of nitrocompounds, Russ. J. Phys. Chem., 1973, vol. 47, p. 725.]
Gait, R.J., Catalytic reduction of nitrobenzene sulphonic Acids. Pat. 1499589 (England), 1978.
Хомутов, Н.Е., Касатонова, И.В. Изучение электровосстановления натриевой соли нитробензол-м-сульфокислоты на медном катоде. Журн. прикладной химии. 1961. Т. 34. С. 860. [Khomutov, N.E. and Kasatonova, I.V., Studies of electrical reduction of sodium salt of nitrobenzene-m-sulfonic acid on the copper cathode. Russ. J. Appl. Chem., 1961, vol. 34, p. 860.]
Конарев, А.А. Электрохимический синтез Клеве-кислот. Электрохимия. 1998. Т. 34. С. 1166. [Konarev, A.A., Electrochemical synthesis of Cleves-acids, Russ. J. Electrochem., 1998, vol. 34, p. 1160.]
Конарев, А.А. Способ определения ароматических нитросоединений и продуктов их восстановления. Пат. 2159424 (Россия). 2000. [Konarev, A.A., Methodfor detection of aromatic nitrocompounds and products of their reduction, Pat. 2159424 (Russia), 2000.]
Дополнительные материалы отсутствуют.