Электрохимия, 2022, T. 58, № 10, стр. 644-654
Использование гальванического вытеснения для синтеза катализаторов Pt/карбид (Mo2C, ZrC, NbC), высокоактивных в реакции выделения водорода
В. В. Кузнецов a, b, d, *, Б. И. Подловченко c, К. В. Фролов a, М. А. Волков b, Д. А. Ханин d
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
c Московский государственный университет имени М.В. Ломоносова
Москва, Россия
d Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
* E-mail: vitkuzn1@mail.ru
Поступила в редакцию 15.02.2022
После доработки 21.03.2022
Принята к публикации 04.04.2022
- EDN: DHHCDF
- DOI: 10.31857/S0424857022100097
Аннотация
Композитные материалы, содержащие наночастицы платины на поверхности карбидов Mo, Zr и Nb, были получены по бестоковой редокс-реакции между тетрахлороплатинатом(II) калия и карбидом (фон – 0.5 М H2SO4). Наибольшее количество платины было осаждено при восстановлении тетрахлороплатинат(II) карбидом молибдена Mo2C, а наименьшее – в реакции с ZrC. Полученные материалы были исследованы методами сканирующей электронной микроскопии (СЭМ), рентгеновской фотоэлектронной спектроскопии (РФЭС), рентгенофазового анализа (РФА) и циклической вольтамперометрии (ЦВА). Удельная площадь поверхности осажденной платины составила 28 м2/г для Pt/Mo2C, 26 м2/г для Pt/ZrC и 10 м2/г для Pt/NbC при концентрации соли платины в растворе 0.05 M и времени осаждения 20 мин. Полученные материалы проявили высокую каталитическую активность в реакции электрохимического выделения водорода в кислых растворах.
ВВЕДЕНИЕ
Электролитический способ получения водорода представляет несомненный интерес, поскольку он приводит к получению газа высокой чистоты [1], необходимого для работы низкотемпературных водородно-воздушных топливных элементов и других приложений [2, 3]. Однако в настоящее время применение электролиза для получения особо чистого водорода сдерживается высокими расходами электроэнергии на разложение воды [4]. По этой причине лишь около 4% получаемого в мире водорода было произведено электролитическим методом [5]. Снижение затрат энергии в процессе получения электролитического водорода – одна из основных задач водородной энергетики.
Наилучшим катализатором реакции электрохимического выделения водорода (РВВ) является дорогая и дефицитная платина [6]. В настоящее время можно отметить две тенденции снижения ее потребления: 1) применение неплатиновых катализаторов РВВ, представляющих собой сплавы металлов [7, 8], фосфиды [9, 10], сульфиды [11, 12], карбиды [13, 14], бориды [15] и т.д., каталитические свойства которых в РВВ достаточно высоки, 2) использование катализаторов, содержащих микроколичества платины. Отметим, что в 80-е годы прошлого столетия среди очень широкого круга направлений научных исследований О.А. Петрия видное место заняли работы по электрохимии карбидов [13].
В качестве носителя для наночастиц платины традиционно используются углеродные материалы [16, 17]. В настоящее время возник интерес к применению карбидов переходных металлов в качестве каталитически активных подложек для нанодисперсной платины [18, 19]. Для композитов карбид–микроколичества платины можно ожидать высокую каталитическую активность в РВВ в связи с подобием электронной структуры карбидов (в частности, плотности d-электронных состояний) электронной структуре платины [20, 21]. Практический опыт использования композитных материалов, содержащих наночастицы платины и карбид молибдена, обобщен в [21]. В цитируемой работе отмечается высокая каталитическая активность таких электродов в практически важных реакциях: РВВ, электровосстановлении кислорода, электровосстановлении CO2 и др.
Для нанесения платины на поверхность карбидов обычно используется химическое восстановление соединений платины в растворе. В качестве восстановителя были применены, например, боргидрид натрия [22] и хлорид фениламмония [23]. Допирование карбида молибдена лишь 2% платины привело к увеличению тока обмена водородной реакции в 40 раз: от 1.1 × 10–5 до 4.4 × × 10–4 А/см2 [23]. В работе [24] было проведено бестоковое осаждение платины на поверхность композита Mo/Mo2C в растворе гексахлороплатиновой кислоты. По мнению авторов, осаждение Pt произошло за счет реакции Mo c ионами ${\text{PtCl}}_{6}^{{2 - }}.$ Синтезированный в [24] материал Pt/Mo2C проявил высокую каталитическую активность в отношении РВВ в щелочной среде.
Для включения наноколичеств платиновых металлов в неблагородные металлы часто используется метод гальванического вытеснения [25, 26]. Представляло интерес исследовать возможность прямого вытеснения неблагородного металла, входящего в карбид, платиной в растворе ее соли в условиях отсутствия внешней поляризации.
Целью данной работы было оценить перспективность использования гальванического вытеснения для синтеза катализаторов РВВ, содержащих карбиды переходных металлов и наночастицы платины. В качестве представителей карбидов были выбраны Mo2C, ZrC и NbC. Важное значение для материалов, используемых в качестве потенциальных носителей для катализаторов, имеет их электропроводность. Согласно литературным данным [27, 28], для использованных карбидов она достаточно велика и составляет, См см–1: 1.02 × 102 для Mo2C, 2.32 × 104 для ZrC и 2.52 × 104 для NbC.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные реактивы и материалы
Исследуемые порошки карбидов были приобретены в компании Sky Spring Nanomaterials, чистота материала составляла выше 99.5%. Удельная поверхность карбидов была определена методом Брунауэра–Эммета–Теллера (БЭТ) по низкотемпературной адсорбции азота и составила, м2/г: 2.4 для Mo2C, 0.72 для ZrC и 0.79 для NbC. Таким образом, исходные образцы карбидов не обладали высокой дисперсностью.
Для проведения гальванического вытеснения, как и в наших предыдущих работах [25, 26, 29–31], был использован тетрахлороплатинат(II) калия K2PtCl4. Предпочтительность использования соединений Pt(II) для проведения окислительно-восстановительной реакции с карбидами вызвана их большей кинетической активностью по сравнению с солями Pt(IV) [32]. Кроме того, при проведении реакции с соединениями Pt(IV) возможно накопление соединений Pt(II) в растворе, что увеличивает нецелесообразный расход соли платины. Тетрахлороплатинат(II) калия был получен при восстановлении K2PtCl6 хлоридом гидразиния по методике, описанной в [33]. Полученное вещество не подвергали дополнительной очистке.
Для приготовления растворов использовали концентрированную серную кислоту марки “ос. ч.” и деионизированную воду (Milli-Q, R > 18.2 MΩ cm, TOC < 3 ppb). Перед проведением экспериментов раствор деаэрировали пропусканием аргона (ос. ч.) в течение 30 мин.
Приготовление электродов-катализаторов
∼0.5 г карбида диспергировали с 1 мл 5%-ного раствора Nafion® в этаноле. 2.5 мг полученной смеси равномерно наносили на поверхность предварительно подготовленного стеклоуглеродного электрода (Sгеом = 0.25 см2), после чего электрод сушили в течение суток. Средняя толщина нанесенного слоя катализатора была равна ∼100 мкм. Электрод со слоем карбида приводили в контакт с предварительно деаэрированным раствором тетрахлороплатината(II) калия в 0.5 M H2SO4 (t = 60°C) при разомкнутой цепи. Концентрация K2PtCl4 варьировалась в пределах 5 × 10–6–0.05 М. Использование большого интервала концентраций тетрахлороплатината(II) связано с поисковым характером работы. Для сокращения расхода платины важна информация о каталитических свойствах катализаторов, получаемых при низких концентрациях K2PtCl4 в растворах для осаждения.
Нанесение платины проводили в стандартной трехэлектродной термостатируемой стеклянной ячейке. Потенциал рабочего электрода измеряли относительно обратимого водородного электрода в растворе серной кислоты той же концентрации. В процессе нанесения платины фиксировали зависимости потенциала от времени при разомкнутой цепи (транзиенты бестокового потенциала). В работе, если нет иных указаний, значения потенциалов приведены относительно обратимого водородного электрода в том же растворе (о. в. э.). Время осаждения платины (τос) составляло 20 мин, если не оговорено иное.
Определение дисперсности платины, химического состава поверхностных слоев, морфологии и структуры полученных материалов
Количество осажденной платины определяли растворением полученного электродного материала в “царской водке” с последующим анализом раствора методом ICP–MS (Agilent 7800 ICP-MS, US). Электрохимически активную площадь поверхности платины определяли по заряду, затрачиваемому на десорбцию монослоя монооксида углерода [34, 35], который накапливали при потенциале 0.1 В в течение 10 мин при пропускании СО (ос. ч.) через 0.5 М раствор серной кислоты. Затем раствор 20 мин продували аргоном, после чего снимали анодную вольт-амперную кривую с линейной разверткой потенциала со скоростью v = 5 мВ/с. Заряд, расходующийся на десорбцию монослоя монооксида углерода с 1 см2 электрохимически активной поверхности платины принимался равным 420 мкКл.
Морфологию полученных электродов исследовали методом сканирующей электронной микроскопии (СЭМ) с использованием микроскопов FEI Tecnai G2 (Holland) и FEI Helios NanoLab 660 (Canada), оснащенных приставкой для проведения рентгеновского микроанализа. В работе также были получены карты распределения элементов по поверхности электрода.
Фазовый состав полученных систем был исследован на дифрактометре Bruker D8 Advance laboratory в геометрии Брэгга–Брентано с использованием CuKα-излучения. Прибор был оснащен германиевым монохроматором и детектором LYNXEYE XE.
Химический состав поверхностных слоев электродов и степени окисления элементов в них были определены методом рентгеновской фотоэлектронной спектроскопии (РФЭС). При проведении исследований использовали спектрометр HB100 (Vacuum Generation, GB) с AlKα-излучением. Информация о химическом составе собиралась с участка поверхности электрода диаметром ∼0.6 мкм, аналитическая глубина – 2–3 нм.
Определение каталитической активности электродов в РВВ
Каталитическая активность композитных электродов, полученных осаждением платины на поверхность карбидов в условиях разомкнутой цепи, определяли в деаэрированном 0.5 М растворе H2SO4 при температуре 22 ± 2°С. Медленные (1 мВ/с) потенциодинамические поляризационные кривые были записаны от равновесного потенциала водородной реакции при линейной развертке потенциала в катодную сторону.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электрохимическая характеристика карбидов
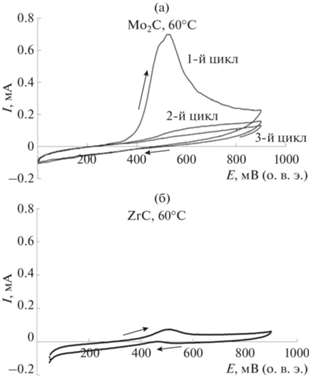
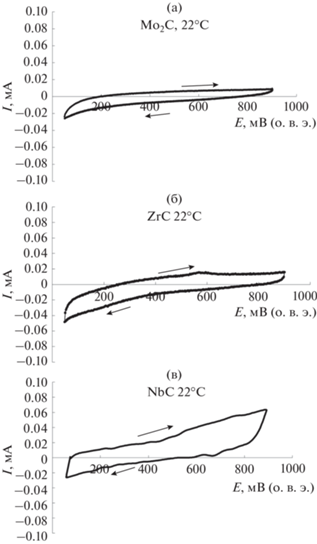
Окислительно-восстановительные реакции карбидов с тетрахлороплатинат(II)-ионами при комнатной температуре протекают медленно, что затрудняет осаждение платины на их поверхность в условиях разомкнутой цепи. При комнатной температуре поверхность карбидов покрыта слоем оксидов и, по этой причине, запассивирована [36]. На циклических вольтамперограммах изученных карбидов, записанных при комнатной температуре, отсутствуют пики, соответствующие окислительно-восстановительным переходам (рис. 1).
Рис. 1.
Циклические вольтамперограммы Mo2C/СУ (а), ZrC/СУ (б) и NbC/СУ (в) электродов в 0.5 М H2SO4. t = 22°C. v = 5 мВ/с.
Катодные токи, фиксируемые на циклических вольтамперограммах при E < 0.2 В, связаны с интеркаляцией водорода в слой оксидов на поверхности карбидов и реакцией, описываемой уравнением [37]
(1)
${\text{M}} = {{{\text{O}}}_{x}} + 0.5x{{{\text{H}}}^{ + }} + 0.5x{\text{e}} \to {\text{M--}}{{{\text{O}}}_{{0.5x}}}{{\left( {{\text{OH}}} \right)}_{{0.5x}}}.$При повышении температуры поверхность карбида активируется, что делает возможным осаждение платины на его поверхность. Особенно заметна активация поверхности карбида в случае карбида молибдена Mo2C (рис. 2а). На циклических вольтамперограммах, записанных в нагретом до 60°С растворе, фиксируется пик окисления поверхности карбида в области потенциалов 0.4–0.6 В. Этот окислительно-восстановительный переход свидетельствует о возможности осаждения платины на карбид в условиях отсутствия внешней поляризации. Заряд, соответствующий окислению поверхности Mo2C/СУ-электрода, уменьшается от цикла к циклу, что соответствует формированию оксидного слоя на поверхности электрода. Аналогичным образом происходит активация поверхности карбидов и в случае ZrC и NbC, однако заряды, соответствующие окислению их поверхности, в этом случае ниже, чем для карбида молибдена. Это позволяет предположить меньшую активность карбидов циркония и ниобия в процессе осаждения платины.
Нанесение платины на поверхность карбидов
Высокое положительное значение стандартного электродного потенциала полуреакции [38]
(2)
$\begin{gathered} {{[{\text{PtC}}{{{\text{l}}}_{4}}]}^{{2--}}} + 2{\text{e}} \rightleftarrows {\text{Pt}} + 4{\text{C}}{{{\text{l}}}^{--}},\, \\ E^\circ = {\text{ }}0.758\,\,{\text{В}}\,\,{\text{(с}}{\text{.}}\,\,{\text{в}}{\text{.}}\,\,{\text{э}}{\text{.),}} \\ \end{gathered} $(3)
$\begin{gathered} 2{\text{Mo}}{{{\text{O}}}_{3}} + {\text{C}} + {\text{ }}12{{{\text{H}}}^{ + }} + 12{\text{e}} \rightleftarrows {\text{M}}{{{\text{o}}}_{{\text{2}}}}{\text{C}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}},\, \\ E^\circ = {\text{ }}0.048{\text{ В }}\left( {{\text{с}}{\text{. в}}{\text{. э}}{\text{.}}} \right), \\ \end{gathered} $(4)
$\begin{gathered} {\text{N}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 2{\text{C}} + 10{{{\text{H}}}^{ + }} + 10{\text{e}} \rightleftarrows 2{\text{NbC}} + 5{{{\text{H}}}_{{\text{2}}}}{\text{O}},\, \\ E^\circ = --0.462{\text{ В }}\left( {{\text{с}}{\text{. в}}{\text{. э}}{\text{.}}} \right), \\ \end{gathered} $(5)
$\begin{gathered} {\text{Zr}}{{{\text{O}}}_{2}} + {\text{C}} + 4{{{\text{H}}}^{ + }} + 4{\text{e}} \rightleftarrows {\text{ZrC}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},\, \\ E^\circ = --0.96{\text{ В }}\left( {{\text{с}}{\text{. в}}{\text{. э}}{\text{.}}} \right){{.}^{2}} \\ \end{gathered} $В реальных условиях 22равновесный потенциал редокс-пары [PtCl4]2–/Pt должен быть существенно выше стандартного по той причине, что активность хлорид-ионов в растворе, применявшемся для осаждения платины, очень мала.
При комнатной температуре реакция между тетрахлороплатинат(II) ионами и карбидами практически не протекает: платина не обнаруживается даже после их длительной (2 ч) выдержки в растворах, содержащих K2PtCl4. Повышение температуры раствора позволило осуществить осаждение платины по редокс-реакции в условиях разомкнутой цепи. При приведении электрода с нанесенным слоем карбида в контакт с раствором, содержащим соль платины(II), происходит рост его потенциала (на рис. 3 в качестве примера представлены транзиенты бестокового потенциала для карбида молибдена), что свидетельствует об окислении поверхности карбида, сопровождающемся осаждением платины (фиксируется визуально). Результаты химического анализа как электрода, так и раствора после нанесения платины свидетельствуют о продолжающемся во времени осаждении платины, сопровождающемся переходом металлов, входящих в состав карбидов, в раствор (табл. 1).
Рис. 3.
Транзиенты бестокового потенциала при осаждении платины на поверхность Mo2C/СУ-электрода. Концентрация соли Pt(II) в растворе, M: 1 – 0.05, 2 – 0.001. Температура раствора 60°С.

Таблица 1.
Количества осажденной платины и Mo, Zr и Nb, перешедших в раствор при взаимодействии x K2PtCl4 + + 0.5 M H2SO4 и карбидов при 60°C
| Нанесение платины на поверхность карбида молибдена | ||||||
|---|---|---|---|---|---|---|
| τос, мин | m(Pt), мг | n(Pt), ммоль | m(Mo), мг | n(Mo), ммоль | Содержание Pt, мас. % | Масса платины на 1 см2 поверхности электрода, мг |
| c(Pt(II)) = 0.05 M | ||||||
| 5 | 0.07 | 0.36 | 0.037 ± 0.011 | 0.39 | 0.014 | 0.28 |
| 20 | 1.01 | 5.18 | 0.47 ± 0.070 | 4.88 | 0.20 | 4.04 |
| 30 | 1.50 | 7.69 | 0.64 ± 0.096 | 6.66 | 0.30 | 6.0 |
| c(Pt(II)) = 0.01 M | ||||||
| 20 | 0.29 | 1.51 | – | – | 0.058 | 1.16 |
| c(Pt(II)) = 0.001 M | ||||||
| 20 | 0.06 | 0.32 | – | – | 0.012 | 0.24 |
| c(Pt(II)) = 10–4 M | ||||||
| 20 | ∼0.01 | ∼0.05 | – | – | ∼2 × 10–3 | ∼0.04 |
| Нанесение платины на поверхность карбида циркония (τос = 20 мин) | ||||||
| c(Pt(II)), M | m(Pt), мкг | n(Pt), мкмоль | m(Zr), мкг | n(Zr), мкмоль | Содержание Pt, мас. % | Масса платины на 1 см2 поверхности электрода, мкг |
| 0.05 | 4.4 | 0.022 | 1.1 ± 0.2 | 0.012 | 8.8 × 10–4 | 17.6 |
| 0.01 | 2.8 | 0.014 | – | – | 5.6 × 10–4 | 11.2 |
| 0.001 | ∼0.5 | ∼0.025 | – | – | ~1 × 10–4 | ∼2.0 |
| Нанесение платины на поверхность карбида ниобия (τос = 20 мин) | ||||||
| c(Pt(II)), M | m(Pt), мкг | n(Pt), мкмоль | m(Nb), мкг | n(Nb), мкмоль | Содержание Pt, мас. % | Масса платины на 1 см2 поверхности электрода, мкг |
| 0.05 | 113 | 0.579 | 0.5 ± 0.1 | 0.005 | 0.023 | 452 |
| 0.01 | 39 | 0.200 | – | – | 7.8 × 10–3 | 156 |
| 0.001 | 7.7 | 0.039 | – | – | 1.5 × 10–3 | 30.8 |
Наибольшее количество платины может быть осаждено на поверхность карбида молибдена, в то время как на поверхность карбида циркония осаждаются лишь микроколичества платины. Как в случае нанесения платины на поверхность Mo2C, так и в случае ее осаждения на карбид циркония восстановление соединений Pt(II) до металлического состояния сопровождается переходом соединений молибдена и циркония в раствор.
Сопоставление количеств выделившейся платины с количествами молибдена и циркония, перешедшими в раствор, позволяет записать формальные уравнения процессов вытеснения следующим образом:
(6)
${\text{PtCl}}_{4}^{{2 - }} + {\text{M}}{{{\text{o}}}^{0}}\left( {{\text{в карбиде}}} \right) \to {\text{Pt}} + {\text{M}}{{{\text{o}}}^{{2 + }}}~ + {\text{ }}4{\text{C}}{{{\text{l}}}^{--}},$(7)
$2{\text{PtCl}}_{4}^{{2 - }} + {\text{Z}}{{{\text{r}}}^{0}}\left( {{\text{в карбиде}}} \right) \to {\text{Pt}} + {\text{Z}}{{{\text{r}}}^{{4 + }}}~ + \,\,8{\text{C}}{{{\text{l}}}^{--}}.$Таким образом, основным восстановителем соли платины выступает металл, присутствующий в форме карбида. Исследование рассматриваемых карбидов методом РФЭС показало, что в их поверхностных слоях в достаточном количестве присутствуют атомы металла в нулевой степени окисления (на рис. 4 в качестве примера приведен спектр РФЭС карбида молибдена). Согласно [40], РФЭС-спектр ZrC (Zr 3d) показывает присутствие в карбиде в основном Zr0. Есть основания полагать, что в работе [24] при контакте соли платины с композитом Mo/Mo2C имело место не только замещение Mo, но и его частичное вытеснение платиной из Mo2C.
Рис. 4.
Спектр РФЭС Мо 3d высокого разрешение поверхности Mo2C/СУ-электрода до контакта с раствором, содержащим тетрахлороплатинат(II)-ионы.

В случае осаждения платины на поверхность карбида ниобия соединения Nb также появляются в растворе, но в очень малых количествах по сравнению с количеством выделившейся платины (табл. 1). Следует полагать, что при осаждении платины по окислительно-восстановительной реакции с карбидом ниобия на его поверхности образуются нерастворимые оксиды, а соединения Nb переходят в раствор в небольшой степени (табл. 1). Согласно литературным данным, растворимость Nb2O5 (lg[Nb] ≈ –8.5 при рН 0, T = = 298 K) [41]) более чем на 2 порядка меньше растворимости ZrO2 (lg[Zr] ≈ –6, рН 0, T = 298 K [42]).
Морфология поверхности модифицированных платиной карбидов, форма и дисперсность осажденной платины
Согласно результатам сканирующей электронной микроскопии (СЭМ) во всех случаях платина образует частицы, расположенные на поверхности карбидов достаточно далеко друг от друга (рис. 5). Размер платиновых частиц, согласно данным СЭМ, равен от ∼40 до ∼150 нм в случае осаждения платины на карбид молибдена, от ∼20 до ∼100 нм в случае их нанесении на карбид циркония.
Рис. 5.
Изображение поверхностей Pt/Mo2C (вверху) и Pt/ZrC (внизу) электродов (подложка – СУ), полученных методом гальванического вытеснения.

Карты распределения элементов по поверхности образца, полученные на электронном микроскопе FEI Helios NanoLab 660 (Canada) (не приводятся), подтвердили, что относительно маленькие частицы платины достаточно равномерно распределены по поверхности больших агломератов карбидов.
В процессе гальванического вытеснения во всех случаях происходит восстановление платины до нулевой степени окисления, что подтверждается данными РФЭС (рис. 6).
Рис. 6.
Спектры РФЭС на поверхности композита Pt/Mo2C, полученного гальваническим вытеснением: обзорный (а), Pt 4f (б).

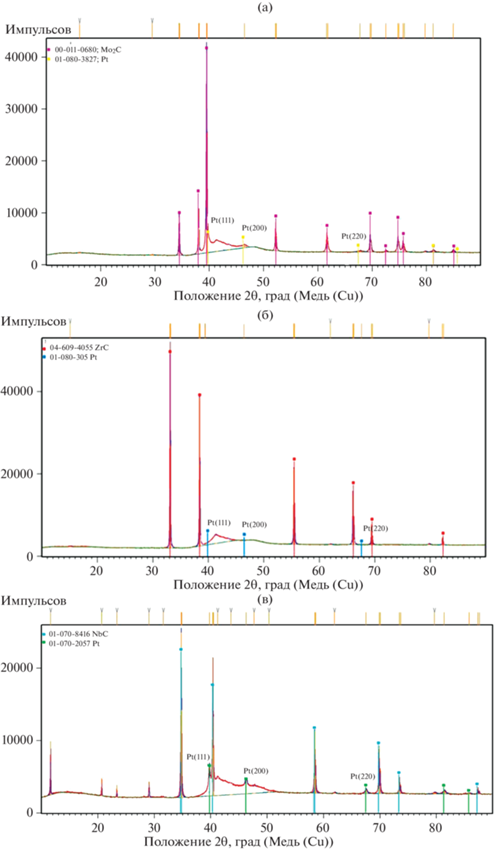
Согласно результатам рентгенофазового анализа (РФА) рефлексы платины фиксируются на дифрактограммах всех полученных композитов (рис. 7). Отсутствие рефлексов платины для композита Pt/ZrC, очевидно, связано с ее малым содержанием в составе полученного материала (табл. 1).
Существенное уширение рефлексов на дифрактограммах вызвано малым размером частиц платины. Количественная оценка размера области когерентного рассеяния (ОКР) платиновых наночастиц для композитов Pt/Mo2C и Pt/NbC была проведена по уравнению Шеррера. Для расчета использовали рефлекс Pt (200). Согласно полученным результатам, средний размер платиновых частиц составил ∼11 нм для композита Pt/Mo2C и ∼24 нм для композита Pt/NbC. Полученные значения удовлетворительно согласуются со средними размерами частиц платины, определенными по данным об их удельной поверхности (табл. 2, см. ниже). С другой стороны, размеры платиновых кластеров, определенные по данным СЭМ, существенно выше. По-видимому, это связано с коалесценцией наночастиц платины в процессе ее осаждения.
Таблица 2.
Удельная поверхность платины и средний размер платиновых частиц в полученных композитах
| Композит | с(K2PtCl4), M | Sуд(Pt), м2/г | d(Pt), нм (из удельной поверхности Pt по десорбции СО) | d(Pt), нм (из данных рентгеновской дифрактометрии) | Размер платиновых кластеров по данным СЭМ, нм |
|---|---|---|---|---|---|
| Mo2C | 0.05 | 28.0 | 10 | 11 | 40–150 |
| 0.01 | 10.2 | 27.4 | – | – | |
| 0.001 | 7.7 | 36 | – | – | |
| ZrC | 0.05 | 26.4 | 10.6 | – | 20–100 |
| NbC | 0.05 | 9.8 | 28 | 24 | 20–150 |
Удельная поверхность платины и средний размер частиц в предположении их сферической формы были рассчитаны на основе данных о массе выделившейся платины и истинной площади поверхности, определенной по десорбции CO (рис. 8), и приведены в табл. 2.
Рис. 8.
Десорбция монослоя CO с поверхности полученных композитных материалов. Платина нанесена из раствора, содержащего 0.05 М K2PtCl4 в 0.5 М H2SO4. v = 5 мВ/с.

Средний размер платиновых частиц, фиксируемых на изображениях СЭМ, значительно выше по сравнению с рассчитанными по удельной поверхности платины. По-видимому, в процессе осаждения происходит коалесценция малых частиц платины.
Каталитическая активность композитов в РВВ
Каталитическая активность карбидов молибдена, циркония и ниобия в реакции электрохимического выделения водорода невелика (кривые 1 на рис. 9), однако нанесение даже небольших количеств платины приводит к увеличению тока обмена водородной реакции на несколько порядков [23], а следовательно, к снижению перенапряжения РВВ (кривые 2–5, рис. 8). В случае использования метода гальванического вытеснения даже контакт с раствором, содержащим 5 × 10–6 M K2PtCl4, в течение 20 мин приводит к снижению перенапряжения РВВ на 200–400 мВ. Каталитическая активность карбида молибдена, модифицированного платиной из раствора, содержащего 10–3–10–2 тетрахлороплатината(II) калия, нормированная на массу платины, приближается к активности коммерческого Pt/C-катализатора, содержащего 20 мас. % платины (рис. 9).
Рис. 9.
Потенциодинамические (v = 1 мВ/с) поляризационные кривые выделения водорода в 0.5 М H2SO4 на Pt/Mo2C-, Pt/ZrC- и Pt/NbC-электродах. Кривые 1 относятся к немодифицированным карбидам. Платина осаждена в отсутствие внешней поляризации из раствора, содержащего, М: 2 – 0.01, 3 – 0001, 4 – 10–4, 5 – 5 × 10–6 K2PtCl4 при t = 60°C в течение 20 мин. 6, 7 – литературные данные для Pt/C из [43, 44].

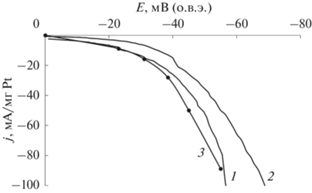
Меньшая общая активность синтезированных катализаторов Pt/ZrC и Pt/NbC по сравнению с Pt/Mo2C (рис. 9) в основном обусловлена осаждением в существенно меньших количествах платины на этих карбидах при использованных условиях проведения редокс-реакции. Так, например, сопоставление удельной массовой активности платины в Pt/NbC (оценка по кривой 2 рис. 10) с удельной активностью Pt в Pt/Mo2C (кривая 2 на рис. 9) при 70 мВ дает ~65 и ~100 мА/г соответственно, т.е. показывает сравнительно небольшое различие.
Рис. 10.
Потенциодинамические (v = 1 мВ/с) поляризационные кривые выделения водорода на Pt/Mo2C-катализаторе, нормализованные на массу платины. Концентрация K2PtCl4 в растворе для нанесения платины, М: 1 – 0.01, 2 – 0.001. 3 – литературные данные для Pt/C из [43].
Оптимизируя условия синтеза, очевидно, можно приблизить активность карбидов, модифицированных платиной методом гальванического вытеснения, к активности Pt/C. Дальнейший поиск в этом направлении, безусловно, представляет интерес как для снижения загрузок платины, так и для получения новых каталитически активных систем.
ВЫВОДЫ
1. На примере Mo2C, ZrC и NbC впервые показана возможность прямого бестокового вытеснения переходного металла из карбида платиной в растворе ее соли.
2. При гальваническом вытеснении металлов из карбидов при их контакте с раствором тетрахлорплатината(II) формируются наночастицы платины, достаточно равномерно распределенные по поверхности карбида.
3. Осаждение платины происходит за счет окислительно-восстановительной реакции между карбидом переходного металла и тетрахлороплатинат(II)-ионами. Источником электронов для восстановления платины служат атомы металла в нулевой степени окисления, входящие в состав карбидов.
4. Из исследованных карбидов Mo2C проявил наиболее высокую активность в реакции с тетрахлорплатинатом(II).
5. Синтезированные композиты показали высокую активность в РВВ при малых загрузках Pt.
Список литературы
Naimi, Y. and Antar, A., Hydrogen generation by water electrolysis, in Advances in hydrogen Generation Technologies, Eyvaz, M., Ed., IntechOpen, 2018.https://doi.org/10.5772/intechopen.76814
Багоцкий, В.С., Осетрова, Н.В., Скундин, А.М. Топливные элементы. Современное состояние и основные научно-технические проблемы. Электрохимия. 2003. Т. 39. С.1027. [Bagotzky, V.S., Osetrova, N.V., and Skundin, A.M., Fuel Cells: State-of-the-Art and Major Scientific and Engineering Problems, Russ. J. Electrochem., 2003, vol. 39, p. 919.]
Cornaglia, L.M. and Lombardo, E.A., Pure hydrogen production for low temperature fuel cells, Catal. Lett., 2018, vol. 148, p. 1015.
Архангельский, И.В., Добровольский, Ю.А., Смирнова, Т.Н., Саввин, С.Н., Лысков, Н.В., Дунаев, А.В., Рогачева, А.Е., Авдеев, В.В. Низкотемпературные топливные элементы с протонпроводящей полимерной мембраной: теоретические основы, материалы и конструкции. М., 2007. 84 с.
Sources for hydrogen. International energy agency. Technology roadmap – Hydrogen and fuel cells, Hoeven, M. van der, Ed, 2015.
Trasatti, S., Electrochemical theory. Hydrogen evolution, in Reference module in chemistry, Molecular Sciences and Chemical Engineering. Encyclopedia of Electrochemical Power Sources, Reedijk, J., Eds., Amsterdam: Elsevier Science Ltd., 2009, p. 41.
Jeremiasse, A., Bergsma, J., Kleijn, M., Saakes, M., Buisman, C., Stuart, M.C., and Hamelers, H.V.M., Performance of metal alloys as hydrogen evolution reaction catalysts in a microbial electrolysis cell, Int. J. Hydrog. Energy, 2011, vol. 36, p. 10482.
Kuznetsov, V.V., Gamburg, Yu. D., Zhulikov, V.V., Krutskikh, V.M., Filatova, E.A., Trigub, A.L., and Belyakova, O.A., Electrodeposited NiMo, CoMo, ReNi, and electroless NiReP alloys as cathode materials for hydrogen evolution reaction, Electrochim. Acta, 2020, vol. 354, article no. 136610.
Feng, L., Vrubel, H., Bensimon, M., and Hu, X., Easily-prepared dinickel phosphide (Ni2P) nanoparticles as an efficient and robust electrocatalyst for hydrogen evolution, Phys. Chem. Chem. Phys., 2014, vol. 16, p. 5917.
Lva, Y. and Wang, X., Nonprecious metal phosphides as catalysts for hydrogen evolution, oxygen reduction and evolution reactions, Catalysis Sci – Technol., 2017, vol. 7, p. 3676.
Benck, J.D., Hellstern, Th.R, Kibsgaard, J., Chakthranont, P., and Jaramillo, Th.F., Catalyzing the Hydrogen Evolution Reaction (HER) with Molybdenum Sulfide Nanomaterials, ACS Catal., 2014, vol. 4, p. 3957.
Heift, D., Iron sulfide materials, catalysts for electrochemical hydrogen evolution, Inorganics, 2019, vol. 7, p. 75.
Tsirlina, G.A. and Petrii, O.A., Hydrogen evolution on smooth stoichiometric tungsten and chromium carbides, Electrochim. Acta, 1987, vol. 32, p. 649.
Zhang, H., Yang, X., Zhang, H., Ma, J., Huang, Zh., Li, J., and Wang, Y., Transition-Metal Carbides as Hydrogen Evolution Reduction Electrocatalysts: Synthetic Methods and Optimization Strategies, Chem.Eur. J., 2021, vol. 27, p. 5074.
Lee, E. and Fokwa, B.P.T., Nonprecious Metal Borides: Emerging Electrocatalysts for Hydrogen Production, Acc. Chem. Res., 2022, vol. 55, p. 56.
Devadas, B., Hydrogen evolution reaction efficiency by low loading of platinum nanoparticles protected by dendrimers on carbon materials, Electrochem. Commun., 2016, vol. 72, p. 135.
Ji, Zh., Perez-Page, M., Chen J., Rodriguez, R.G., Cai, R., Haigh, S.J., and Holmes, S.M., A structured catalyst support combining electrochemically exfoliated graphene oxide and carbon black for enhanced performance and durability in low-temperature hydrogen fuel cells, Energy, 2021, vol. 226, article no. 120318.
Michalsky, R., Zhang, Y.-L., and Peterson, A.A., Trends in the hydrogen evolution. Activity of metal carbide catalysts, ACS Catal., 2014, vol. 4, p. 1274.
Zhang, H., Yang, X., Zhang, H., Ma, J., Huang, Zh., Li, J., and Wang, Y., Transition-Metal carbides as hydrogen evolution reaction electrocatalysts: synthetic methods and optimization strategies, Chem. Eur. J., 2021, vol. 27, p. 5074.
Gao, Q., Zhang, W., Shi, Zh., Yang, L., and Tang, Y., Structural design and electronic modulation of transition-metal-carbide electrocatalysts toward efficient hydrogen evolution, Adv. Mater., 2019, vol. 31, article no. 1802880.
Li, Y., Yin, Z., Liu, X., Cui, M., Chen, S., and Ma, T., Current progress of molybdenum carbide-based materials for electrocatalysis: potential electrocatalysts with diverse applications, Mater. Today Chem., 2021, vol. 19, article no. 100411.
Bayati, M., Liu, X., Abellan, P., Pocock, D., Dixon, M., and Scott, K., Synergistic coupling of a molybdenum carbide nanosphere with Pt nanoparticles for enhanced ammonia electro-oxidation activity in alkaline media, Appl. Energy Materials, 2020, vol. 3, p. 843.
Chen, M., Ma, Y., Zhou, Y., Liu, Ch., Qin, Y., Fang, Y., Guan, G., Li, X., Zhang, Zh., and Wang, T., Influence of transition metal on the hydrogen evolution reaction over nano-molybdenum-carbide catalyst, Catalysts, 2018, vol. 8, p. 294.
Liu, Z., Li, J., Xue, Sh., Zhou, Sh., Qu, K., Li, Y., and Cai, W., Pt/Mo2C heteronanosheets for superior hydrogen evolution reaction, J. Energy Chem., 2020, vol. 47, p. 317.
Подловченко, Б.И., Гладышева, Т.Д., Филатов, А.Н., Яшина, Л.В. Oсобенности формирования Pt(Cu)/C-катализатора гальваническим вытеснением меди в растворах H2PtCl6. Электрохимия. 2012. Т. 48. С. 192. [Podlovchenko, B.I., Gladysheva, T.D., Filatov, A.Yu, and Yashina, L.V., Peculiarities of the Pt(Cu)/C Catalyst Formation by Galvanic Displacement of Copper in H2PtCl4, Russ. J. Electrochem., 2012, vol. 48, p. 173.]
Podlovchenko, B.I., Krivchenko, V.A., Maksimov, Yu.M., Gladysheva, T.D., Yashina, L.V., Evlashin, S.A., and Pilevsky, A.A., Specific Features of the Formation of Pt(Cu) Catalysts by Galvanic Displacement with Carbon Nanowalls used as Support, Electrochim. Acta, 2012, vol. 76, p. 137.
Allison, C. and Modin, F.A., Optical and electrical properties of niobium carbide, Phys. Rev. B, 1987, vol. 35, p. 2573.
Ihsan, M., Wang, H., Majid, S., Yang, J., Kennedy, Sh.J., Guo, Z., and Liu, H.K., MoO2/Mo2C/C spheres as anode materials for lithium ion batteries, Carbon, 2016, vol. 96, p. 1200.
Kuznetsov, V.V., Podlovchenko, B.I., Batalov, R.S., and Filatova, E.A., nRu⋅mPt⋅(Hx– 3n– 2mMoO3) composite prepared by surface redox reaction as a highly active electrocatalyst for carbon monoxide and methanol oxidation, Electrochim. Acta, 2019, vol. 300, p. 274.
Podlovchenko, B.I., Kuznetsov, V.V., and Batalov, R.S., Palladium catalyst modified with molybdenum bronze as a possible alternative to platinum in the methanol oxidation reaction, J. Solid State Electrochem., 2016, vol. 20, p. 589.
Кузнецов, В.В., Баталов, Р.С., Подловченко, Б.И. Композиты nPd0(Hx –2nMoO3) как катализаторы электроокисления метанола и муравьиной кислоты. Электрохимия. 2016. Т. 52. С. 463. [Kuznetsov, V.V., Batalov, R.S., and Podlovchenko, B.I., nPd0(Hx –2nMoO3) composites as catalysts of methanol and formic acid electrooxidation, Russ. J. Electrochem., 2016, vol. 52, p. 408.]
Hall, M.D., Daly, H.L., Zhang, J.Z., Zhang, M., Alderden, R.A., Pursche, D., Foranc, G.J., and Hambley, T.W., Quantitative measurement of the reduction of platinum(IV) complexes using X-ray absorption near-edge spectroscopy (XANES), Metallomics, 2012, vol. 4, p. 568.
Руководство по неорганическому синтезу / Под ред. Г. Брауэра. М.: Мир, 1985. С. 1814.
Trasatti, S. and Petrii, O.A., Real surface area measurements in electrochemistry, Pure and Appl. Chem., 1991, vol. 63, p. 711.
Łukaszewski, M., Soszko, M., and Czerwiński, A., Electrochemical methods of real surface frea determination of noble metal electrodes – an overview, Int. J. Electrochem. Sci., 2016, vol. 11, p. 4442.
Wyvratt, B.M., Gaudet, J.R., and Thompson, L.T., Effects of passivation on synthesis, structure and composition of molybdenum carbide supported platinum water–gas shift catalysts, J. Catal., 2015, vol. 330, p. 280.
Li, J., Wang, H., and Xiao, X., Intercalation in two-dimensional transition metal carbides and nitrides (MXenes) toward electrochemical capacitor and beyond, Energy&Environment Mater., 2020, vol. 3, p. 306.
Bard, A.J., Parsons, R., and Jordan, J., Standard potentials in aqueous solution (1st ed.). Routledge. 1985, 848 p.
Термические константы веществ. Справочник, под ред. В.П. Глушко. Выпуск VII М.: ВИНИТИ, 1974. Ч. I. Таблицы принятых значений. 341 с.
Greczynski, G., Primetzhofer, D., and Hultman, L., Reference binding energies of transition metal carbides by core-level X-ray photoelectron spectroscopy free from Ar+ etching artefacts, Appl. Surf. Sci., 2018, vol. 436, p. 102.
Peiffert, C., Nguyen-Trung, C., Palmer, D.A., Laval, J.P., and Giffaut, E., Solubility of β-Nb2O5 and the hydrolysis of niobium(V) in aqueous solution as a function of temperature and ionic strength, J. Solution Chem., 2010, vol. 39, p. 197.
Kobayashi, T., Sasaki, T., Takagi, I., and Moriyama, H., Solubility of Zirconium(IV) Hydrous Oxides, J. Nucl. Sci. Technol., 2007, vol. 44, p. 90.
Davodi, F., Cilpa-Karhu, G., Sainio, J., Tavakkoli, M., Jiang, H., Mühlhausen, E., Marzun, G., Gökce, B., Laasonen, K., and Kallio, T., Designing of low Pt electrocatalyst through immobilization on metal@C support for efficient hydrogen evolution reaction in acidic media, J. Electroanal. Chem., 2021, vol. 896, article no. 115076.
Chen, W.-F., Iyer, Sh., Iyer, Shw., Sasaki, K., Wang, Ch.-H., Zhu, Y., Muckerman, J.T., and Fujita, E., Biomass-derived electrocatalytic composites for hydrogen evolution, Energy Environ Sci., 2013, vol. 6, p. 1818.
Дополнительные материалы отсутствуют.