Электрохимия, 2022, T. 58, № 10, стр. 655-663
Моделирование характеристик пленки полианилин–ДНК по вольтамперометрическому отклику продукта электрополимеризации
Т. Н. Куликова a, А. Н. Иванов a, Г. А. Евтюгин a, *
a Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: gevtugyn@gmail.com
Поступила в редакцию 27.12.2021
После доработки 04.04.2022
Принята к публикации 12.04.2022
- EDN: QPTWNY
- DOI: 10.31857/S0424857022100073
Аннотация
В работе изучен анодный вольтамперометрический отклик полианилина, полученного электрополимеризацией анилина из раствора 3.7 М серной кислоты в присутствии двух образцов ДНК, отличающихся источником и молекулярной массой. Электрополимеризацию осуществляли в режиме циклической вольтамперометрии с варьированием количества циклов развертки потенциала и концентраций образцов ДНК. Данные вольтамперометрического отклика полианилина, полученные в режиме вольтамперометрии с линейной разверткой потенциала в анодную область, были проанализированы с использованием теоретической модели, учитывающей емкостные токи, электрохимически обратимые фарадеевские токи и взаимодействие между редокс-центрами полианилина. Анализ полученных данных показал существенное нелинейное влияние количества циклов полимеризации, концентрации и природы использованных образцов ДНК на энергии взаимодействия между редокс-центрами полианилина.
ВВЕДЕНИЕ
Сочетание полианилина (ПАНИ) и ДНК успешно используют в составе чувствительных электрохимических сенсоров и биосенсоров. Так, применение ПАНИ, полученного путем электрополимеризации анилина в щавелевой кислоте в присутствии нативной ДНК, позволило создать сенсор для определения интеркаляторов ДНК антрациклинового ряда [1]. В сходном сенсоре для определения доксорубицина на основе электрохимических параметров слоя ПАНИ–ДНК предложено проводить обновление слоя ДНК, что позволило осуществлять многократное определение аналита [2]. Включение ДНК между двумя слоями электрополимеризованного ПАНИ в сенсоре с импедиметрической регистрацией сигнала снизило предел обнаружения доксорубицина до 0.6 пМ [3]. В указанных биосенсорах ПАНИ служил одновременно сигналобразующим компонентом и матрицей для физической иммобилизации ДНК, основанной на нековалентном связывании нативной ДНК благодаря электростатическим взаимодействиям между отрицательно заряженными фосфатными группами остова ДНК и положительно заряженными цепями ПАНИ. Аналогичные взаимодействия использовали для экстракции ДНК из водных растворов с помощью магнитных частиц, покрытых ПАНИ [4].
Одноцепочечные молекулы ДНК агрегируют с ПАНИ благодаря π–π-взаимодействиям между нуклеиновыми основаниями и ПАНИ [5]. При гибридизации одноцепочечной ДНК, расположенной на поверхности ПАНИ, с комплементарной последовательностью происходит десорбция продукта гибридизации. При этом меняются свойства ПАНИ, в частности его реакция с флуоресцентным красителем [6, 7]. Агрегация ДНК может быть также осуществлена с использованием мостиковых ионов металлов и производного ПАНИ, несущего сульфатные группы [8]. Сорбция биомолекул на поверхности ПАНИ может быть использована для разделения и выделения однонитевых и двунитевых молекул ДНК из сложных биологических матриц [9]. Детальное изучение процессов сорбции ДНК на поверхности ПАНИ методами спектрально-корреляционной интерферометрии и хроматографии с использованием спин-колонок было проведено в работах [10, 11].
Образование комплексов ДНК–ПАНИ меняет как конформацию биополимера [12], так и свойства ПАНИ. Это нашло применение в формировании наноструктурных материалов, содержащих оба компонента [13–16]. В них ДНК пространственно ориентирует полимерные цепи ПАНИ, одновременно допируя их. Последний процесс увеличивает верхнюю границу рН проявления электропроводности полимера.
Для характеристики комплексов ДНК–ПАНИ используют большой набор физико-химических методов анализа, среди которых можно выделить спектрофотометрию в видимой и УФ-области света, ИК-фурье-спектроскопию, спектроскопию кругового дихроизма, атомно-силовую микроскопию [17], МАЛДИ масс-спектрометрию и сканирующую электронную микроскопию [18]. Благодаря электрохимической активности ПАНИ эффективными методами анализа комплексов ДНК–ПАНИ являются спектроскопия электрохимического импеданса [19] и циклическая вольтамперометрия [20]. Последний является наиболее доступным. Анализ данных, полученных этим методом, дает важную информацию о свойствах полимера и характере воздействий на него различных факторов.
Ранее была предложена теоретическая модель электрохимического окисления пленки ПАНИ, которая может быть использована для анализа вольтамперограмм и получения информации о параметрах продукта электрополимеризации [21]. Это было продемонстрировано на примере вольтамперометрической оценки старения ПАНИ [22, 23], изучения влияния на него рН [24] и природы анионов [25], а также при изучении природы электрической проводимости и емкости ПАНИ [26, 27].
В данной работе указанный подход расширен для описания влияния концентрации и природы ДНК в растворе при электрополимеризации анилина на термодинамические характеристики образующегося ПАНИ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали ДНК с низкой молекулярной массой из молок лосося (ДНК1, “Sigma”, США, Cat. No. 31149, средняя молекулярная масса 4.6 кДа) и ДНК из молок рыбы (ДНК2, “Sigma”, США, Cat. No. 74782, молекулярная масса 40–1000 кДа). Остальные реактивы имели квалификацию “х. ч.”
Вольтамперометрические измерения проводили в нетермостатированной ячейке объемом 5 мл при комнатной температуре. Вольтамперограммы регистрировали с помощью потенциостата-гальваностата AUTOLAB PGSTAT 302N с модулем линейной развертки потенциала SCAN250 и программным обеспечением NOVА 1.11 (Metrohm Autolab B.V., Нидерланды). В качестве рабочих были использованы стеклоуглеродные электроды (СУЭ), представляющие собой стержни из стеклоуглерода СУ 2000 (НИИГрафит, г. Москва) длиной 20 мм и площадью поперечного сечения 2.8 мм2, вставленные в изолирующие трубки из политетрафторэтилена. Электрический контакт обеспечивали токосъемником из нержавеющей стали, присоединенным к стеклоуглеродному стержню с противоположной от рабочей поверхности стороны посредством электропроводящего клея на основе эпоксидной смолы и углеродной сажи. В качестве электрода сравнения использовали хлоридсеребряный электрод (Ag/AgCl/3 М KCl) (Metrohm Autolab B.V., Нидерланды). Вспомогательным электродом служил платиновый стержень диаметром 2 мм.
Непосредственно перед использованием СУЭ механически полировали порошком оксида алюминия и промывали этиловым спиртом и дистиллированной водой. После этого проводили электрохимическую очистку электрода в 0.2 М растворе Н2SО4 путем 10-кратного циклирования потенциала в интервале от –0.2 до 1.0 В со скоростью сканирования 0.1 В/с.
ПАНИ на поверхности СУЭ получали при комнатной температуре в режиме многократного циклирования потенциала в диапазоне от –0.15 до 0.85 В со скоростью сканирования 0.1 В/с в водном растворе, содержащем 0.5 М анилина, 3.7 М Н2SО4 и требуемую концентрацию ДНК. Следует отметить, что в растворе с такой концентрацией кислоты молекулы ДНК частично подвергаются процессу апуринизации, в результате которого в реакционной смеси при полимеризации анилина могут находиться поврежденные молекулы ДНК [28]. Пример вольтамперограмм, регистрируемых в процессе электрополимеризации анилина, представлен на рис. 1. После электрополимеризации электрод извлекали из реакционной смеси при разомкнутой цепи, промывали 3.7 М раствором Н2SО4 и помещали в ячейку с 3.7 М раствором Н2SО4 для вольтамперометрической характеристики ПАНИ.
Рис. 1.
Пример вольтамперограмм, регистрируемых в процессе электрополимеризации 0.5 М раствора анилина в 3.7 М Н2SО4, содержащем 1 мг/мл ДНК1. Приведены вольтамперограммы, зарегистрированные на 1, 10, 20-м и 40-м цикле развертки потенциала.

Вольтамперометрическую характеристику электрополимеризованного ПАНИ проводили в режиме линейной развертки потенциала от 0 до 0.85 В со скоростью развертки 0.1 В/с в 3.7 М растворе Н2SО4, при этом перед началом регистрации вольтамперограммы электрод выдерживали при потенциале 0 В в течение 5 с. На полученной вольтамперограмме определяли ток (jp) и потенциал пика (Ep) окисления ПАНИ. Пример регистрируемых вольтамперограмм представлен на рис. 2. Зависимость количества электричества, затраченного при окислении ПАНИ, от потенциала электрода вычисляли интегрированием зависимости плотности тока от потенциала в интервале от 0 до 0.85 В.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние ДНК на электрохимическую полимеризацию анилина было охарактеризовано с помощью формального представления электрохимического окисления ПАНИ, описанного в [21]. Для этого по экспериментальным данным, полученным в обратимом электрохимическом окислении пленок ПАНИ, строили математическую модель, описывающую взаимодействия между редокс-центрами ПАНИ с учетом емкостной и фарадеевской составляющей тока на вольтамперограмме.
Теоретическая модель электрохимического окисления пленки ПАНИ. Процесс с участием пленки ПАНИ на поверхности электрода может быть представлен в общем виде:
Перенос заряда внутри пленки сопровождается встречным потоком ионов для сохранения общей электронейтральности полимерного слоя. Для упрощения анализа было сделано допущение, что указанные процессы достаточно быстры и состояние полимера при каждом значении потенциала электрода можно считать равновесным. Полное количество электричества QT, затрачиваемого при электрохимическом окислении ПАНИ и являющегося функцией от потенциала электрода E, может быть представлено в виде суммы емкостного заряда QC пленки ПАНИ и заряда QF, соответствующего фарадеевскому току при переносе заряда от полимера на электрод:
(2)
${{Q}_{{\text{T}}}}\left( E \right) = {{Q}_{{\text{C}}}}\left( E \right){\text{ }} + {{Q}_{{\text{F}}}}\left( E \right).$Предполагается, что интегральная электрическая емкость пленки полимера пропорциональна фарадеевскому заряду, возникающему в процессе окисления ПАНИ, и определяется произведением аQF, где a – коэффициент пропорциональности, который является характеристикой конкретной пленки ПАНИ.
Когда ПАНИ полностью переходит в окисленную форму при больших потенциалах (E > EL), фарадеевский ток стремится к 0. В этом случае регистрируемый ток определяется только емкостной составляющей. При этом QF перестает меняться, достигая асимптотического значения Q0, являющегося максимальным количеством электричества фарадеевского процесса, затраченного на окисление всех редокс-центров ПАНИ.
Таким образом, произведение аQ0 служит характеристикой конкретной пленки ПАНИ, является константой и не зависит от приложенного потенциала и скорости развертки. Выполняя математические преобразования, представленные в [21], можно получить уравнение (3), в котором Ez – потенциал нулевого заряда полимера:
(3)
${{Q}_{{\text{T}}}}\left( {E > {{E}_{{\text{L}}}}} \right) = {{Q}^{0}}\left( {1 - a{{E}_{{\text{z}}}}} \right) + a{{Q}^{0}}E.$При достаточно больших потенциалах (E > EL) зависимость QT от Е приобретает линейный вид (рис. 3). В области линейности зависимости методом наименьших квадратов строится линейная регрессия, параметры которой являются коэффициентами прямой, определяемой уравнением (3). Тангенс угла наклона этой прямой представляет собой значение aQ0, а пересечение с осью ординат (E = 0) позволяет получить значение ${{Q}^{0}}\left( {1 - a{{E}_{{\text{z}}}}} \right),$ частное которых дает значение (Ez– a–1).
Рис. 3.
Пример зависимости измеренного количества электричества при окислении ПАНИ от приложенного потенциала; пунктиром также представлена прямая, полученная линейной регрессией в указанной области зависимости с использованием метода наименьших квадратов. EL – потенциал, при котором фарадеевский ток становится равным 0.

Таким образом, для каждого образца пленки ПАНИ, полученного с определенной комбинацией концентрации ДНК и количества циклов полимеризации анилина, был зарегистрирован вольтамперометрический отклик ПАНИ, представленный в виде исходной вольтамперограммы (рис. 2) и в ее интегральном виде (рис. 3), по которым определялись значения параметров jp, Ep, aQ0, (Ez– a–1), используемые в дальнейших расчетах. Следует отметить, что ни одно из значений параметров (a, Q0) не может быть получено из данных вольтамперограмм по отдельности.
Вольтамперометрический отклик при наличии взаимодействий между редокс-центрами ПАНИ. Пусть полимерная пленка содержит NRed восстановленных и NOx окисленных редокс-центров, сумма которых N = NRed + NOx является постоянной величиной. Взаимный переход указанных центров происходит в соответствии с уравнением (1), представленным выше. Предполагается, что каждый из редокс-центров может взаимодействовать с определенным числом соседних редокс-центров полимера, равным сneighb. При рассмотрении взаимодействий попарно соседних центров можно выделить три типа: когда взаимодействует пара окисленных центров со средней энергией εOO, взаимодействует пара восстановленных центров со средней энергией εRR и взаимодействуют окисленный и восстановленный центры со средней энергией εRO.
Используя метод самосогласованного поля [21], можно получить уравнения (4)–(8), в которых: ξR и ξO – безразмерные параметры взаимодействий, NAv – число Авогадро, R – универсальная газовая постоянная, F – постоянная Фарадея, T – абсолютная температура, xp – доля окисленных центров при потенциале пика, E0 – стандартный редокс-потенциал ПАНИ.
(4)
${{\xi }_{{\text{R}}}} = - \frac{{{{с}_{{{\text{neighb}}}}}{{N}_{{{\text{Av}}}}}({{\varepsilon }_{{{\text{RR}}}}} - {{\varepsilon }_{{{\text{RO}}}}})}}{{RT}}$(5)
${{\xi }_{{\text{O}}}} = - \frac{{{{с}_{{{\text{neighb}}}}}{{N}_{{{\text{Av}}}}}({{\varepsilon }_{{{\text{OO}}}}} - {{\varepsilon }_{{{\text{RO}}}}})}}{{RT}},$(6)
${{E}_{{\text{p}}}} = {{E}^{0}} - \frac{{RT}}{{nF}}[({{\xi }_{{\text{R}}}} + {{\xi }_{{\text{O}}}}){{x}_{{\text{p}}}} - {{\xi }_{{\text{R}}}}] - \frac{{RT}}{{nF}}\ln \left( {\frac{{1 - {{x}_{{\text{p}}}}}}{{{{x}_{{\text{p}}}}}}} \right),$(7)
$\frac{{{{j}_{{\text{p}}}}}}{{av{{Q}^{0}}}} = \frac{{nF}}{{RT}}\frac{{({{E}_{{\text{p}}}} - {{E}_{z}} + {{a}^{{ - 1}}})(1 - {{x}_{{\text{p}}}}){{x}_{{\text{p}}}}}}{{[1 - ({{\xi }_{{\text{R}}}} + {{\xi }_{{\text{O}}}})(1 - {{x}_{{\text{p}}}}){{x}_{{\text{p}}}}]}} + {{x}_{{\text{p}}}},$(8)
${{x}_{{\text{p}}}} = \frac{1}{2} + \frac{{RT}}{{nF}}\frac{{{{{[1 - ({{\xi }_{{\text{R}}}} + {{\xi }_{{\text{O}}}})(1 - {{x}_{p}}){{x}_{{\text{p}}}}]}}^{2}}}}{{({{E}_{{\text{p}}}} - {{E}_{z}} + {{a}^{{ - 1}}})}}.$Используя численные методы решения системы нелинейных уравнений (7) и (8) при T = 298 К, n = 2, с начальным приближением xp = 0.5 и остальными параметрами, определенными по экспериментальным данным, можно получить значения xp и (ξO + ξR). Получив значение (ξR + ξO) и используя уравнение (6) при E0 = 0.225 В [21], рассчитываются отдельные значения ξR и ξO.
Определение параметров вольтамперометрического отклика окисления ПАНИ. По линейному участку зависимости количества электричества, затраченного на окисление ПАНИ, от потенциала электрода (см. рис. 3), методом наименьших квадратов получали параметры прямой, из которых рассчитывали aQ0 и (Ez – a–1) для каждой пленки ПАНИ.
Полученные параметры были использованы для решения системы нелинейных уравнений (7) и (8) в программном комплексе для статистических вычислений R версии 3.6.2. Решение системы уравнений позволяет получить значения xp и (ξR + ξO), а решение уравнения (6) – отдельные значения ξR и ξO. В частности, представляют собой интерес показатели (ξR – ξO) и (ξR + ξO). Разность (ξR – ξO) в соответствии с уравнениями (4) и (5) прямо пропорциональна разности εOO и εRR ((ξR – ξO) ~ (εOO – εRR)), что позволяет оценить влияние внешних факторов на изменение свободной энергии Гельмгольца окисленной и восстановленной формы ПАНИ. Сумма (ξR + ξO) пропорциональна результату выражения (2εRO – – εOO – εRR), что при отрицательных значениях (ξR + ξO) подразумевает (εOO + εRR > 2εRO). Уменьшение этой суммы говорит, что при частично окисленном полимере и фиксированной степени окисления равновесие между существованием системы пар структурных элементов “восстановленный–окисленный”, а также эквивалентной системы, состоящей из пар “восстановленный–восстановленный” и “окисленный–окисленный”, смещается в сторону системы с элементами “восстановленный–окисленный”.
Влияние концентрации и типа ДНК на термодинамические параметры ПАНИ. Полимеризацию ПАНИ проводили в отсутствие ДНК, а также в присутствии образцов ДНK1 и ДНК2 с концентрациями 0.2, 0.5 и 1.0 мг/мл. Параметры взаимодействия редокс-центров ПАНИ были определены для 10, 20, 30-го и 40-го цикла полимеризации. Для получения статистически значимых результатов в одних и тех же условиях эксперимент повторяли с использованием различных электродов от 3 до 6 раз.
Для оценки влияния числа циклов полимеризации и концентрации ДНК в растворе на ξR, ξO, (ξR – ξO) и (ξR + ξO) для двух образцов ДНК были построены обобщенные аддитивные модели (GAM), представляющие собой модели регрессии с нелинейным преобразованием исходных признаков [29]. Модели строили в программном комплексе R версии 3.6.2 с использованием пакета mgcv версии 1.8-31. Модели имели вид (9):
где y – один из параметров Ep, xp, ξR, ξO, (ξR – ξO), (ξR + ξO), Ncycl – число циклов полимеризации, CДНК – концентрация ДНК (моль/л) в растворе при полимеризации, b – свободный член, ε – член, содержащий случайные ошибки, не учитываемые моделью (остатки), f1 и f2 – нелинейные гладкие сплайн-функции (thin plate regression splines).
В табл. 1 приведены характеристики полученных моделей. Влияние источника ДНК на параметры Ep и xp является статистически незначимым, поэтому моделирование данных параметров осуществлялось по обобщенным данным для ДНК1 и ДНК2. Для остальных параметров в случае ДНК1 во всех полученных моделях как число циклов полимеризации, так и концентрация ДНК1 являются значимыми факторами, при этом функции соответствующих зависимостей нелинейны (эффективное число степеней свободы больше единицы). При использовании ДНК2 число циклов полимеризации также остается значимым фактором, а его функции зависимости моделируемых параметров нелинейны. Для концентрации ДНК2 все зависимости носят линейный характер (число степеней свободы равно 1). Следует отметить, что уровень значимости параметра концентрации ДНК2 для ξo равен 0.96, что свидетельствует об отсутствии зависимости между концентрацией ДНК2 и ξo.
Таблица 1.
Характеристики обобщенных аддитивных моделей зависимостей xp, ξR, ξO, (ξR – ξO), (ξR + ξO) от количества циклов полимеризации и концентрации ДНК
| Модель | Эффективное число степеней свободы (p – уровень значимости) | Доля объясненной вариативности данных, % | ||
|---|---|---|---|---|
| f1(Ncycl) | f2(CДНК) | |||
| ДНК | Ep | 2.78 (<2 × 10–16) | 1.88 (1.9 × 10–5) | 66.8 |
| ДНК | xp | 1.96 (8.8 × 10–11) | 1.74 (7.4 × 10–7) | 43.3 |
| ДНК1 | ξR | 2.94 (<2 × 10–16) | 2.38 (4.8 × 10–7) | 85.5 |
| ξO | 2.79 (<2 × 10–16) | 2.54 (6.2 × 10–6) | 84.8 | |
| (ξR – ξO) | 2.80 (<2 × 10–16) | 2.70 (8.8 × 10–9) | 84.8 | |
| (ξR + ξO) | 2.91 (<2 × 10–16) | 1.38 (1.7 × 10–4) | 85.2 | |
| ДНК2 | ξR | 2.86 (<2 × 10–16) | 1.00 (1.3 × 10–7) | 81.1 |
| ξO | 2.88 (<2 × 10–16) | 1.00 (0.96) | 88.2 | |
| (ξR – ξO) | 2.73 (<2 × 10–16) | 1.00 (7.3 × 10–5) | 78.3 | |
| (ξR + ξO) | 2.93 (<2 × 10–16) | 1.00 (3.6 × 10–5) | 89.1 | |
На рис. 4–6 полученные модели представлены в графическом виде. На рис. 4 видно, что потенциал пика нелинейно зависит от количества циклов полимеризации с минимумом в районе 25 циклов, при этом изменение потенциала происходит в пределах 15 мВ. Увеличение концентрации ДНК незначительно увеличивает потенциал пика. Доля окисленных центров при потенциале пика с увеличением количества циклов полимеризации также изменяется нелинейно, незначительно убывая в диапазоне до 20 циклов и возрастая при дальнейшем увеличении количества циклов в пределах 0.015 единиц. Повышение концентрации ДНК незначительно увеличивает xp на 0.010 единиц. Положительные значения (ξR – ξO) свидетельствуют о том, что энергия взаимодействий между окисленными центрами больше, чем между восстановленными. Уменьшение (ξR – ξO) свидетельствует об уменьшении свободной энергии окисленной формы или о возрастании свободной энергии восстановленной формы ПАНИ. Минимальные значения (ξR – ξO) при варьировании числа циклов полимеризации как в случае ДНК1, так и в случае ДНК2 наблюдаются в районе 25 циклов. Добавление в раствор для полимеризации любого из использованных образцов ДНК приводит к увеличению (ξR – ξO). Это говорит о том, что увеличение концентрации ДНК приводит к возрастанию свободной энергии для окисленной формы ПАНИ или ее снижению для восстановленной формы полимера. Причем в случае ДНК1 эффект нивелируется при концентрации ДНК1 больше 0.5 мг/мл. При использовании ДНК2 увеличение ее концентрации статистически значимого влияния на параметр ξO не оказывает. Таким образом, все изменения в (ξR – ξO) всецело связаны с ξR, что свидетельствует о существенно большем воздействии ДНК2 на восстановленную форму полимера, выражающемся в снижении энергии взаимодействия между восстановленными центрами.
Рис. 4.
Графическое представление моделей зависимости (Ep – E0) и xp от количества циклов полимеризации ПАНИ и концентрации ДНК.

Рис. 5.
Графическое представление моделей зависимостей ξR, ξO, (ξR – ξO), (ξR + ξO) от количества циклов полимеризации ПАНИ и концентрации ДНК1.

Рис. 6.
Графическое представление моделей зависимостей ξR, ξO, (ξR – ξO), (ξR + ξO) от количества циклов полимеризации ПАНИ и концентрации ДНК2.
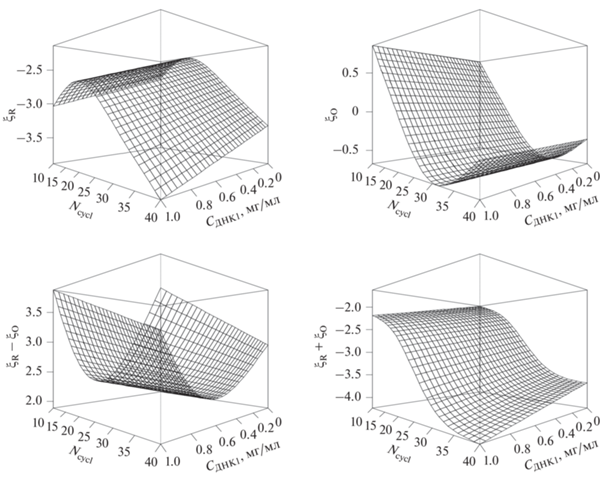
Увеличение числа циклов полимеризации уменьшает (ξR + ξO) для обоих образцов ДНК, что говорит о смещении равновесия в сторону существования структурных элементов “восстановленный–окисленный” по сравнению с раздельным существованием пар “восстановленный–восстановленный” и “окисленный–окисленный”. Это может свидетельствовать о предпочтительности распределенной решетки поляронов по сравнению с биполяронными структурами [26, 30]. Структурные элементы распределенной решетки поляронов, по выводам авторов [26], отвечают за перенос зарядов в ПАНИ. Влияние концентрации ДНК на (ξR + ξO) имеет линейный характер, однако действие разных образцов ДНК разнонаправленно. Если низкомолекулярная ДНК1 увеличивает данный параметр, стабилизируя биполяронные структуры, то ДНК2 уменьшает его, способствуя существованию распределенной решетки поляронов. Учитывая независимость ξO от концентрации ДНК2, изменения (ξR + ξO) определяются ξR и свидетельствуют о большем воздействии образца ДНК2 на восстановленную форму полимера.
ЗАКЛЮЧЕНИЕ
Анализ вольтамперометрического отклика ПАНИ, полученного электрополимеризацией из 3.7 М серной кислоты в присутствии ДНК из молок лосося и рыбы с разной молекулярной массой, с использованием теоретической модели электрохимического окисления ПАНИ позволил оценить параметры взаимодействия между редокс-центрами ПАНИ. Получены оценки изменений энергий взаимодействия между редокс-центрами ПАНИ при варьировании числа циклов электрополимеризации от 10 до 40 и концентрации ДНК от 0 до 1.0 мг/мл. С использованием полученных данных построены модели регрессии с нелинейным преобразованием исходных признаков. Наблюдаемые положительные значения (ξR – ξO) позволяют сделать вывод, что энергия взаимодействий между окисленными центрами ПАНИ больше, чем между восстановленными. Минимальные значения (ξR – ξO) при варьировании числа циклов полимеризации наблюдаются в районе 25 циклов полимеризации. Добавление в раствор для полимеризации любого из использованных образцов ДНК приводит к возрастанию свободной энергии для окисленной формы ПАНИ или ее снижению для восстановленной формы полимера. Однако если в случае ДНК2 зависимость изменений от концентрации ДНК носит линейный характер, то в случае ДНК1 наблюдается максимум в области концентрации ДНК1 0.5 мг/мл. При увеличении числа циклов полимеризации изменение параметров ПАНИ (ξR + ξO) свидетельствует о смещении равновесия в сторону существования структурных элементов “восстановленный–окисленный” по сравнению с раздельным существованием пар “восстановленный–восстановленный” и “окисленный–окисленный”. Это указывает на предпочтительность распределенной решетки поляронов по сравнению с биполяронными структурами. Влияние концентрации ДНК на (ξR + ξO) имеет линейный характер, однако действие разных образцов ДНК разнонаправленно. Низкомолекулярная ДНК1 увеличивает данный параметр, стабилизируя биполяронные структуры, ДНК2 уменьшает его, способствуя существованию распределенной решетки поляронов, при этом можно отметить, что большее воздействие ДНК2 оказывает на восстановленную форму полимера.
Список литературы
Shamagsumova, R., Porfireva, A., Stepanova, V., Osin, Y., Evtugyn, G., and Hianik, T., Polyaniline–DNA based sensor for the detection of anthracycline drugs, Sens. Actuators, B, 2015, vol. 220, p. 573.
Kulikova, T.N., Porfireva, A.V., Shamagsumova, R.V., and Evtugyn, G.A., Voltammetric Sensor with Replaceable Polyaniline-DNA Layer for Doxorubicin Determination, Electroanalysis, 2018, vol. 30, no. 10, p. 2284.
Kulikova, T., Porfireva, A., Evtugyn, G., and Hianik, T., Electrochemical DNA sensors with layered polyaniline–DNA coating for detection of specific DNA interactions, Sensors, 2019, vol. 19, no. 3, p. 469.
Medina-Llamas, J.C., Chávez-Guajardo, A.E., Andrade, C.A.S., Alves, K.G.B., and de Melo, C.P., Use of magnetic polyaniline/maghemite nanocomposite for DNA retrieval from aqueous solutions, J. Colloid Interface Sci., 2014, vol. 434, p. 167.
Liu, S., Wang, L., Luo, Y., Tian, J., Li, H., and Sun, X., Polyaniline nanofibres for fluorescent nucleic acid detection, Nanoscale, 2011, vol. 3, no. 3, p. 967.
Sengupta, P.P., Gloria, J.N., Amato, D.N., Amato, D.V., Patton, D.L., Murali, B., and Flynt, A.S., Utilizing intrinsic properties of polyaniline to detect nucleic acid hybridization through UV-enhanced electrostatic interaction, Biomacromolecules, 2015, vol. 16, no. 10, p. 3217.
Sengupta, P.P., Gloria, J.N., Parker, M.K., and Flynt, A.S., A Polyaniline-based Sensor of Nucleic Acids, J. Visualized Exp., 2016, vol. 117, p. e54590.
Hu, Y., Yang, T., Li, Q., Guan, Q., and Jiao, K., Conjugated self-doped polyaniline–DNA hybrid as trigger for highly sensitive reagentless and electrochemical self-signal amplifying DNA hybridization sensing, Analyst, 2013, vol. 138, no. 4, p. 1067.
Kapustin, D., Prostyakova, A., Bryk, Ya., Yagudaeva, E., and Zubov, V., New composite materials modified with nano-layers of functionalized polymers for bioanalysis and medical diagnostics, p. 83–106, in: Nanocomposites and polymers with analytical methods. Ed. Cuppoletti, J. Croatia: Intech, 2011.
Yagudaeva, E., Zybin, D., Vikhrov, A., Prostyakova, A., Ischenko, A., Zubov, V., and Kapustin, D., Sorption of nucleic acids and proteins on polyaniline and polyaramide nano-coatings as studied by spectral-correlation interferometry in a real time mode, Colloid Surface B, 2018, vol. 163, p. 83.
Льяо, Д.-Дж., Зыбин, Д.И., Простякова, А.И., Ягудаева, Е.Ю., Вихров, А.А., Ищенко, А.А., Зубов, В.П., Капустин, Д.В. Статическая и динамическая сорбция нуклеиновых кислот и белков на поверхности сорбентов, модифицированных нанотолщинными слоями полимеров. Изв. вузов. Химия и хим. технология. 2018. Т. 61. № 1. С. 4.
Nagarajan, R., Liu, W., Kumar, J., Tripathy, S.K., Bruno, F.F., and Samuelson, L.A., Manipulating DNA conformation using intertwined conducting polymer chains, Macromolecules, 2001, vol. 34, no. 12, p. 3921.
Ma, Y., Zhang, J., Zhang, G., and He, H., Polyaniline nanowires on Si surfaces fabricated with DNA templates, J. Am. Chem. Soc., 2004, vol. 126, no. 22, p. 7097.
Nickels, P., Dittmer, W.U., Beyer, S., Kotthaus, J.P., and Simmel, F.C., Polyaniline nanowire synthesis templated by DNA, Nanotechnology, 2004, vol. 15, no. 11, p. 1524.
Bardavid, Y., Ghabboun, J., Porath, D., Kotylar, A.B., and Yitzchaik, S., Formation of polyaniline layer on DNA by electrochemical polymerization, Polymer, 2008, vol. 49, no. 9, p. 2217.
Bardavid, Y., Kotlyar, A.B., and Yitzchaik, S., Conducting polymer coated DNA, Macromol. Symp., 2006, vol. 240, no. 1, p. 102
Zeifman, Y.S., Maiboroda, I.O., Grishchenko, Y.V., Morozova, O.V., Vasil’eva, I.S., Shumakovich, G.P., and Yaropolov, A.I., Enzymatic synthesis of electroconductive biocomposites based on DNA and optically active polyaniline, Appl. Biochem. Microbiol., 2012, vol. 48, no. 2, p. 145.
Giacobbe, S., Pezzella, C., Della Ventura, B., Giacobelli, V.G., Rossi, M., Fontanarosa, C., and Piscitelli, A., Green synthesis of conductive polyaniline by Trametes versicolor laccase using a DNA template, Eng. Life Sci., 2019, vol. 19, no. 9, p. 631.
Абдуллин, Т.И., Никитина, И.И., Евтюгин, Г.А., Будников, Г.К., Манапова, Л.З. Электрохимические свойства двухкомпонентной пленки ДНК–полианилин на поверхности стеклоуглеродного электрода. Электрохимия. 2007. Т. 43. С. 1355. [Abdullin, T.I., Nikitina, I.I., Evtugin, G.A., Budnikov, G.K., and Manapova, L.Z., Electrochemical properties of a two-component DNA-polyaniline film at the surface of glassy carbon electrode, Russ. J. Electrochem., 2007, vol. 43, p. 1284.]
Yano, J., Kohno, T., and Kitani, A., Electrochemical preparation of polyaniline microspheres incorporated with DNA, J. Appl. Electrochem., 2009, vol. 39, no. 5, p. 747.
Marmisollé, W.A., Florit, M.I., and Posadas, D., A formal representation of the anodic voltammetric response of polyaniline, J. Electroanal. Chem., 2011, vol. 655, no. 1, p. 17.
Marmisollé, W.A., Florit, M.I., and Posadas, D., Electrochemically induced ageing of polyaniline monitored by the changes in its voltammetric response, J. Electroanal. Chem., 2011, vol. 660, no. 1, p. 26.
Marmisollé, W.A., Florit, M.I., and Posadas, D., Effect of the potential on the electrochemically induced ageing of polyaniline films, J. Electroanal. Chem., 2012, vol. 669, p. 42.
Scotto, J., Florit, M.I., and Posadas, D., pH dependence of the voltammetric response of Polyaniline, J. Electroanal. Chem., 2017, vol. 785, p. 14.
Scotto, J., Florit, M.I., and Posadas, D., Redox commuting properties of polyaniline in hydrochloric, sulphuric and perchloric acid solutions, J. Electroanal. Chem., 2018, vol. 817, p. 160.
Scotto, J., Florit, M.I., and Posadas, D., About the species formed during the electrochemical half oxidation of polyaniline: Polaron–bipolaron equilibrium, Electrochim. Acta, 2018, vol. 268, p. 187.
Scotto, J., Marmisollé, W.A., and Posadas, D., About the capacitive currents in conducting polymers: the case of polyaniline, J. Solid State Electrochem., 2019, vol. 23, no. 7, p. 1947.
An, R., Jia, Y., Wan, B., Zhang, Y., Dong, P., Li, J., and Liang, X., Non-enzymatic depurination of nucleic acids: factors and mechanisms, PloS one, vol. 9, no. 12, p. e115950.
Wood, S.N., Generalized additive models: an introduction with R. CRC press, 2017. 496 p.
Stafström, S., Bredas, J.L., Epstein, A.J., Woo, H.S., Tanner, D.B., Huang, W.S., and MacDiarmid, A.G., Polaron lattice in highly conducting polyaniline: theoretical and optical studies, Phys. Rev. Lett., 1987, vol. 59, no. 13, p. 1464.
Дополнительные материалы отсутствуют.



