Электрохимия, 2022, T. 58, № 2, стр. 95-100
Биметаллические алкоксокомплексы рения, кобальта и никеля как прекурсоры для получения сплавов
Е. С. Куликова a, *, О. В. Чернышова b, Д. В. Иордан b, И. А. Михеев c, Д. В. Дробот c
a Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
b МИРЭА – Российский технологический университет
Москва, Россия
c Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
* E-mail: lizchkakul@mail.ru
Поступила в редакцию 16.11.2020
После доработки 02.08.2021
Принята к публикации 31.08.2021
- EDN: MZGHVP
- DOI: 10.31857/S0424857022020062
Аннотация
Анодным растворением рения получены алкоксокомплексы рения (Re4O6(OMe)12) и Re4O6(OPri)10). Комплексы исследованы с помощью ИК-спектрометрии и энергодисперсионного анализа. Биметаллические алкоксокомплексы рений–никель (Re4 –xNixO6(OMe)12, Re4 –xNixO6(OPri)10) и рений–кобальт (Re4 –xCoxO6(OMe)12, Re4 –xCoxO6(OPri)10) синтезированы из монометаллических алкоксокомплексов и охарактеризованы ИК-спектрометрией. Показана возможность получения гомогенных биметаллических порошков сплавов Re0.79Ni0.21 из метилата и изопропилата рений–никель и Re0.67Co0.33 из метилата рения–кобальт восстановлением в атмосфере водорода при температуре в 650°С и давлении в 5 атм.
ВВЕДЕНИЕ
Функциональные материалы на основе рения имеют широкое применение в современной промышленности. Рений выступает легирующим элементом в сплавах никеля и кобальта, его добавка позволяет увеличить температурный интервал применения материалов, что особенно важно в таких отраслях, как авиакосмическое, ядерное и энергетическое машиностроение [1–4]. Легирование рением позволяет повысить износостойкость сплавов, увеличить прочностные характеристики и устойчивость к воздействию агрессивных сред [5–7]. Кроме того, такие материалы находят применение для катализаторов и электродов электрохимических устройств. На сегодня широко распространено применение сплавов рений–никель, рений–кобальт, рений–рутений, однако процессы получения подобных сплавов являются энергозатратными и ресурсоемкими [1–4, 8–13]. Метод алкоксотехнологии является промежуточной стадией, позволяющей получать сплавы с заданным составом при минимально низких температурах. Суть метода заключается в анодном растворении металлов c образованием координационных соединений, содержащих алкоксо- и оксолиганды, способные образовывать связи с двумя и более атомами металлов, выступая в качестве мостиков, и дальнейшем использовании синтезированных комплексов в качестве прекурсоров для получения широкого спектра материалов с заданной структурой и свойствами [14–18]. Ранее ряд авторов описывали процессы получения моно-, би- и триметаллических алкоксокомплесков рения с переходными металлами [19–27]. Таким образом, известно, что алкоксотехнология является апробированным методом получения прекурсоров для получения металлических материалов [28, 29]. Соответственно, это открывает путь к получению гетерометаллических сплавов, содержащих рутений, методом алкоксотехнологии. Данная работа описывает процесс получения гетерометаллических алкоксокомлпексов рения-никеля и рения–кобальта, с последующим применением их в качестве прекурсоров при получении соответствующих порошков сплавов низкотемпературным восстановлением.
МЕТОДИКА ЭКСПЕРИМЕНТА
Материалы
Для исследования использовали металлические пластины рения, никеля, кобальта платины (чистота 99.9%), металлический натрий, магний (чистота 99.9%), метиловый спирт (ТУ-2636-018-29483781-201, х. ч.) изопропиловый спирт (ТУ 2632-011-29483781-2009, ос. ч.), алюмогидрид лития (Merck KgaA, ч.), тетрабутиламмоний бромид (ТВАВ) (ТУ 6-09-1859-77, ч.).
Электрохимический синтез алкоксокомплексов
Алкоксопрозводные чувствительны к влаге, поэтому предварительно перед синтезами проводили осушение метилового и изопропилового спирта, так чтобы конечное содержание воды составляло менее 0.01% [20, 23–27]. В качестве электропроводящей добавки использовали ТВАВ, обезвоживание которого проводили в запаянной с одной стороны ампуле при постоянном вакууме (P ~ 1.3 Па) и нагревании до 100 ± 1°С в течение 3 ч.
Электрохимический синтез алкоксокомплексов метилатов и изопропилатов рения–никеля и рения–кобальта проводили в электрохимической ячейке без разделения анодного и катодного пространства с водоохлаждаемой рубашкой [22]. Синтез алкоксокомплексов проводили в две стадии:
На первой стадии получали метилат (Re4O6(OMe)12) или изопропилат (Re4O6(OPri)10) рения по методикам, описанным в работах [15‒17, 21–24]. В качестве анода использовали металлический штабик рения, катодом выступала платина. В каждом синтезе объем спирта составлял 200 мл (cТВАВ = 2.5% от массы спирта). Комплекс метилата рения получали при силе тока 0.15–0.16 А, напряжении 0.20–0.27 В, время синтеза составило 34 ч. Для синтеза изопропилата рения потребовалось 37 ч, при этом напряжение составило 100 В, а сила тока 0.06–0.09 А.
На второй стадии осуществляли непосредственный синтез биметаллических комплексов рения [23], для этого вместо штабика рения анодом стали металлические полосы никеля или кобальта, катод остался неизменным. Объемы исходных комплексов и теоретическая масса соответствующего металла (кобальта или никеля) рассчитаны, исходя из мольных соотношений Re : Со и Re : Ni, как 1 : 1. В экспериментах по получению метилатов рения–никеля/кобальта напряжение задавали в диапазоне 0.10–0.19 В, сила тока при этом варьировалась от 0.06 до 0.15 А. Время синтеза метилата рений–никель (Re4 ‒ xNixO6(OMe)12 составило 7 ч, метилата рений–кобальт (Re4 –xCoxO6(OMe)12 – 6 ч. При получении изопропилатов рений–никель (Re4 ‒ xNixO6(OPri)10), рений–кобальт (Re4 ‒ xCoxO6(OPri)10) напряжение устанавливали 0.23–0.59 В, сила тока 0.06–0.12 А, а время синтезов составило 25 и 22 ч соответственно.
Низкотемпературное получение порошков сплавов
Полученные алкоксокомплексы рения–никеля и рения–кобальта использовали в качестве предшественников при получении соответствующих порошков сплавов в атмосфере водорода в автоклавном реакторе закрытого типа. Для этого предварительно проводили отгонку спиртов при пониженном давлении (140–190 мм водяного столба). Полученные образцы загружали в автоклав. До начала процесса восстановления систему продували в течение 10 мин, создавая избыток водорода. По окончанию установили конечное давление в 5 атм. Затем подключали нагрев печи до температуры в 650°С и выдерживали систему в течение 90 мин.
Методы характеризации
Растворы моно- и биметаллических алкоксопроизводных рения исследовали с помощью инфракрасной спектрометрии. Исследования проводили в области 4000−500 см–1, которые регистрировали на приборе EQUINOX 55 (Bruker, Germany). Разрешение прибора составляет 2 см–1, точность определения волнового числа – 0.1 см–1. Анализ распределения элементов в моноалкоксопроизводных рения проводили методом эненергодисперсионного микроанализа. Дифрактограммы сплавов получены на дифрактометре D8 Advance (Bruker, Germany, излучение CuKα, вращение образца, непрерывный (1 град/мин), пошаговый (шаг 0.02°, экспозиция 10 с) режимы в интервале углов 2θ 5°−100°).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ИК-спектрах растворов монометаллических алкоксокомплексов рения обнаружены собственные полосы алкоксопроизводных ν(С–О) при 1161–1114 см–1 и несколько пиков в области металл–кислород: ν(Re=O) 949–906 см–1, ν(Re–O(R)–Re) 670 см–1 для метилового комплекса и 817 см–1 для изопропилового, а также ν(Re–O(R)) 519 и 618 см–1 соответственно. Существуют пики при 3400 см–1, относящиеся к ν(О–Н) абсорбированного метанола или изопропанола. Другие пики, относящиеся к органической составляющей комплекса приведены в табл. 1. Согласно ИК-спектрам, Re4O6(OMe)12 (I) и Re4O6(OPri)10 (II) имеют сплошную структуру с мостиками Re–O(R)–Re.
Таблица 1.
Интерпретация полос поглощения ИК-спектров алкоксокомплексов
| Волновое число см–1 | Отнесение полос | |||||
|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | |
| 3340 | 3340 | 3310 | 3340 | 3303 | 3342 | ν(О–Н) |
| 2946 | 2970–2928 | 2942 | 2970–2923 | 2942 | 2970–2931 | ν(С–Н)str.ass |
| 2834 | 2884 | 2830 | 2884 | 2830 | 2883 | ν(С–Н)str.ss |
| 1456 | 1465 | 1452 | 1464 | 1450 | 1465 | ν(С–С)ass |
| – | 1375–1306 | – | 1374–1306 | – | 1374–1307 | ν(C–С) |
| 1114 | 1120 | 1114 | 1114 | 1114 | 1158–1126 | ν(С–О) |
| 1031 | – | 1021 | 1022 | 1021 | – | ν(C–O) + δ(C–H) |
| 906 | 949 | 911 | 911 | 950 | 950 | ν(Re=O) |
| 670 | 817 | – | 817 | – | 816 | ν(Re–O(R)–Re) мостик |
| – | – | – | – | 620 | 633 | ν(Co–OR) |
| – | – | 647 | 638 | – | – | ν(Ni–OR) |
| 519 | 618 | 602 | 606 | – | – | ν(Re–O(R)) |
| – | – | 575 | 587–511 | 557 | 580 | ν(Ni/Co–O) |
Для биметаллических алкоксокомплексов рения–никеля Re4 –xNixO6(OMe)12 (III) и Re4 –xNixO6(OPri)10 (IV) в ИК-спектрах сохраняются полосы поглощения, характерные для I и II, но в то же время в диапазоне 511–587 см–1 обнаружены полосы, характерные для связи ν(Ni–O) и ν(Ni–OR), 638‒647 см–1. Что же касается алкоксокомплексов рения – кобальта Re4 –xCoxO6(OMe)12 (V) и Re4 – xCoxO6(OPri)10 (VI), полосы поглощения ν(Co–OR) находятся в диапазоне 620–633 см–1 и ν(Co–O) 580–557 см–1. Полное соотнесение пиков ИК-спектров всех алкоксокомплексов представлено в табл. 1 [23, 26, 30–39].
Энергодисперсионный анализ показал, что в упаренных образцах монопроизводных рения присутствуют примеси меди (≤1 атм %). Это связано с тем, что при проведении электрохимического синтеза медную проволоку использовали в качестве токоподвода к аноду. В изопропилатном комплексе обнаружено незначительное количество алюминия (менее 0.5 атм %). Присутствие алюминия обусловлено тем, что для обезвоживания изопропилового спирта использовался Li[AlH4] и непрореагировавший алюминий остался в растворе электролита.
Упаренные образцы гетерометаллических алкоксопроизводных рения восстанавливают при низкой температуре; при восстановлении в токе водорода в большинстве случаев получены однофазные образцы, которые являются ультрадисперсными металлическими твердыми растворами замещения на основе гексагональной плотноупакованной решетки рения (рис. 1).
Рис. 1.
Результаты рентгенофазового анализа порошков сплавов: 1 – рений–никель, полученный из метилата; 2 – рений–никель, полученный из изопропилата; 3 – рений–кобальт, полученный из метилата.
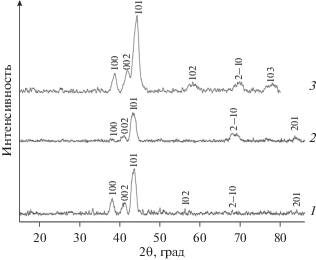
Размер кристаллитов, определенный по формуле Шеррера, составил 10–30 нм. Порошки сплавов рений–никель, полученные из метилата и изoпропилата рений–никель, являлись однофазными и соответствуют составу Re0.79Ni0.21 [40] со следующими параметрами решетки: а = = 2.7504(3), с = 4.4021(4) для метилата и а = = 2.7501(5), с = 4.4435(7) для изопропилата. Из метилата рения–кобальта получили однофазный образец Re0.67Co0.33 [41] с параметрами решетки: а = 2.6846(5), с = 4.3276(6). Из изопропилата рения–кобальта получить однофазный твердый раствор не удалось. При изучении продукта восстановления биметаллического изопропилатного комплекса рений–кобальт обнаружены: фаза, для которой значения параметров близки к значениям параметров решетки ReCo, и гексагональная фаза, для которой значения параметров характерны для чистого рения, т.е. не удалось получить однофазный продукт.
Полученные результаты не противоречат имеющимся литературным данным, в части соответствия фазовых диаграмм бинарных систем металл–рений фазовым диаграммам с непрерывным рядом твердых растворов.
ЗАКЛЮЧЕНИЕ
В присутствии электропроводящей добавки ТВАВ анодным растворением металлов получены монометаллические алкоксокомплексы рения (Re4O6(OMe)12, Re4O6(OPri)10) и биметаллические алкоксокомплексы рений–никель (Re4 –xNixO6(OMe)12, Re4 – xNixO6(OPri)10) и рений–кобальт (Re4 ‒ xCoxO6(OMe)12, Re4 –xCoxO6(OPri)10).
Показана возможность получения гомогенных ультрадисперсных биметаллических порошков сплавов Re0.79Ni0.21 из метилата и изопропилата рений–никель и Re0.67Co0.33 из метилата рения–кобальт восстановлением в атмосфере водорода при температуре в 650°С.
Список литературы
Палант, А.А., Трошкина, И.Д., Чекмарев, А.М., Костылев, А.И. Технология рения Л.: “Галлея-Принт”, 2015. 329 с. [Palant, A.A., Troshkina, I.D., Chekmarev, A.M., and Kostylev, A.I. Rhenium technology (in Russian), L: Galley-Print, 2015. 329 p.]
Коровин, С.С., Букин, В.И., Федоров, П.И., Резник, А.М. Редкие и рассеянные элементы. Химия и технология. Учебник для вузов, в 3 кн. М.: МИСИС, 2003. Т. 3. 440 с. [Korovin, S.S., Bukin, V.I., Fedorov, P.I., and Reznik, A.M., Rare and dispersed elements. Chemistry and technology. Textbook for universities. In 3 books. (in Russian), M.: MISIS, 2003. Т. 3. 440 p.]
Wrona, A., Staszewski, M., Czepelak, M., Woch, M., Kamińska, M., Osadnik, M., and Kołacz, D., Properties of rhenium-based master alloys prepared by powder metallurgy techniques, Arch. Mater. Sci. and Engineering, 2010, vol. 45, no. 2, p. 95.
James, E., Rhenium: Properties, uses and occurrence. Nova Sci. Publ., Incorporated, 2017. 122 p.
Maisel, S.B., Schindzielorz, N., Mottura, A., Reed, R.C., and Muller, S., Nickel-rhenium compound sheds light on the potency of rhenium as a strengthener in high-temperature nickel alloys, Phys. rev. B, 2014, vol. 90, 094110. https://doi.org/10.1103/PhysRevB.90.094110
Mottura, A. and Reed, R.C., What is the role of rhenium in single crystal superalloys? MATEC Web of Conferences, New York, 2014, vol. 14, p. 1–6. https://doi.org/10.1051/matecconf/20141401001
Huang, M. and Zhu, J., An overview of rhenium effect in single-crystal superalloys, Rare Met., 2016, vol. 35, p. 127. https://doi.org/10.1007/s12598-015-0597-z
John, D.A., Seal, R.R., II, and Polyak, D.E., 2017, Rhenium, chap. P eds, Schulz, K.J., DeYoung, J.H., Jr., Seal, R.R., II, and Bradley, D.C., Critical mineral resources of the United States–Economic and environmental geology and prospects for future supply, US Geolog. Survey Professional Paper, 2017, vol. 1802, p. P1–P49. https://doi.org/10.3133/p.p1802P
Schulz, K.J., DeYoung, J.H., Jr., Seal, R.R., II, and Bradley, D.C., Critical mineral resources of the United States–An introduction, chap, eds, Schulz, K.J., DeYoung, J.H., Jr., Seal, R.R., II, and Bradley, D.C., Critical mineral resources of the United States–Economic and environmental geology and prospects for future supply, US Geolog. Survey Professional Paper, 2017, vol. 1802, p. A1–A14, https://doi.org/10.3133/pp1802A
Дробот, Д.В., Куликова, Е.С. Дви-марганец – рении: самый “молодой” стабильный элемент Периодической системы элементов. Тонкие хим. технологии. 2019. Т. 14. № 6. С. 17. [Drobot, D.V. and Kulikova, E.S., Dvi-manganese – Rhenium is the youngest stable element of the Periodic Table. Fine Chem. Technol., 2019, vol. 14, no. 6, p. 17.]. https://doi.org/10.32362/2410-6593-2019-14-6-17-21
Ефанова, Е.П. Рений – металл индустрии высоких технологий. Бюллетень иностранной коммерческой информации (БИКИ). 2016. № 1. С. 35. [Efanova, E.P., Rhenium – metal of the high-tech industry, Foreign Commercial Information Bulletin (BIKI), 2016, no. 1, p. 35.]
Zientek, M.L., Loferski, P.J., Parks, H.L., Schulte, R.F., and Seal, R.R., II. Platinum-group elements, chap. N, eds, Schulz, K.J., DeYoung, J.H., Jr., Seal, R.R., II, and Bradley, D.C., Eds., Critical mineral resources of the United States–Economic and environmental geology and prospects for future supply, US Geolog. Survey Professional Paper, 2017, vol. 1802, p. N1–N91. https://doi.org/10.3133/pp1802N
John, David, Rhenium–A rare metal critical to modern transportation, US Geolog. Survey Fact Sheet, 2014–3101, 2 p. https://doi.org/10.3133/fs20143101
Mehrotra, R.C., Transition-Metal Alkoxides. Advances in Inorganic Chemistry, 1983, p. 269–335.https://doi.org/10.1016/s0898-8838(08)60096-3
Kessler, V.G. 2.16–Alkoxides and Alkoxosynthesis, eds, Jan Reedijk, Kenneth Poeppelmeier, Comprehensive Inorganic Chemistry II (Second Edition), Elsevier, 2013, vol. 2 p. 455. https://doi.org/10.1016/B978-0-08-097774-4.00220-5
Zhao, J., Liu, Y., Fan, M., Long, Y., and Zou, X., ChemInform Abstract: From Solid-State Metal Alkoxides to Nanostructured Oxides: A Precursor-Directed Synthetic Route to Functional Inorganic Nanomaterials, ChemInform., vol. 46, no. 18. https://doi.org/10.1002/chin.201518261
Kessler, V.G., The Synthesis and Solution Stability of Alkoxide Precursors, Eds., Klein, L., Aparicio, M., and Jitianu, A., Handbook of Sol-Gel Science and Technology. Springer, Cham., p. 31. https://doi.org/10.1007/978-3-319-32101-1_1
Mishra, S. and Daniele, S., Molecular engineering of metal alkoxides for solution phase synthesis of high-tech metal oxide nanomaterials, J. Chem. Eur., 2020, vol. 26, p. 9292. https://doi.org/10.1002/chem.202000534
Xie, S., Gou, J., Liu, B., and Liu, C. Facile preparation of hexagonal cobalt alkoxide for supercapacitor application, Mater. Sci., Energy Technology and Power Engineering III (Mep 2019), 2019, vol. 2154, no. 1. 020066. https://doi.org/10.1063/1.5125394
Прямилова, Е.Н., Чернышова, О.В., Дробот, Д.В. Анодное растворение рения в обезвоженном метиловом спирте. Тонкие хим. технологии. 2012. Т. 7. № 4. С. 75. [Pryamilova, E.N., Chernyshova, O.V., and Drobot, D.V., Rhenium anodic dissolution in water-free methanol at different electrochemical parameters, Fine Chem. Technologies, 2012, vol. 7, no. 4, p. 75 (in Russian).]
Щеглов, П.А., Дробот, Д.В. Алкоксопроизводные рения. Изв. Академии наук. Сер. хим. 2005. № 10. С. 2177. [Shcheglov, P.A. and Drobot, D.V., Rhenium alkoxides, Russ. Chem. Bull., vol. 54, no. 10, p. 2247.] https://doi.org/10.1007/s11172-006-0106-5
Петракова, О.В., Дробот, Д.В., Щеглов, П.А. Синтез и свойства комплекса рения c n-бутанолом и i-бутанолом. Тонкие хим. технологии. 2009. Т. 4. № 5. С. 97. [Petrakova, O.V., Drobot, D.V., and Scheglov, P.A., Synthesis and properties rhenium complex with nbutanol and i-butanol (in Russian), Fine Chem. Technologies, 2009, vol. 4, no. 5, p. 97.]
Mazilin, I.V. and Drobot, D.V., Properties of rhenium, nickel, cobalt alkoxides and their decomposition products, Fine Chem. Technologies, 2013, vol. 8, no. 3, p. 29.
Shcheglov, P.A., Drobot, D.V., Seisenbaeva, G.A., and Kessler, V.G., The electrochemical synthesis and X-ray single crystal of Re4O6(OiPr)10 – a new Rhenium(V,VI) cluster with an unprecendented arrangement of metal – metal bonds, Inorganic Chem. Commun., 2001, vol. 4, no. 5, p. 227. https://doi.org/10.1016/s1387-7003(01)00154-x
Seisenbaeva, G.A., Shevelkov, A.V., Tegenfeldt, J., Kloo, L., Drobot, D.V., and Kessler, V.G., Homo- and hetero-metallic rhenium oxomethoxide complexes with a M4(μ-O)2(μ-OMe)4 planar core – a new family of metal alkoxides displaying a peculiar structural disorder. Preparation and X-ray single crystal study, J. Chem. Soc., Dalton Trans., 2001, no. 19. p. 2762. https://doi.org/10.1039/b103287a
Nikonova, O.A., Kessler, V.G., and Seisenbaeva, G.A., Substitution features in the isomorphous replacement series for metal-organic compounds (NbxTa1 ‒ x)4O2(OMe)14(ReO4)2, x = 0.7, 0.5, 0.3 – Single-source precursors of complex oxides with organized porosity, J. Solid State Chem., 2008, vol. 181, p. 3294. https://doi.org/10.1016/j.jssc.2008.09.003
Kessler, V.G., Seisenbaeva, G.A., Shevelkov, A.V., and Khvorykh, G.V., Synthesis, crystal, molecular and electronic structure of a novel heterobinuclear alkoxide cluster [(MeO)2ReO(μ-OMe)3MoO(OMe)2], J. Chem. Soc., Chem. Commun., 1995, no. 17, p. 1779. https://doi.org/10.1039/C39950001779
Patnaik, P., A Comprehensive Guide to the Hazardous Properties of Chemical Substances, Third Edition, Canada: John Wiley & Sons, Inc., 2007, p. 598. https://doi.org/10.1002/9780470134955.ch31
Rossetti, M.N., Dutta, P.S., Lewis, S.L., Litz, E., Jordan, M., and Vreeland, J.L., Metal alkoxides, apparatus for manufacturing metal alkoxides, related methods and uses thereof US9028768B2 (USA), 2015.
Накамото, К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с. [Nakamoto, K., IR and Raman spectra of inorganic and coordination compounds (in Russian), M.: Mir, 1991, p. 536.]
Hajba, L., Mink, J., KuËhn, F.E., and Goncëalves, I.S., Raman and infrared spectroscopic and theoretical studies ofdinuclear rhenium and osmium complexes, M2(O2CCH3)4X2 (M = Re, Os; X = Cl, Br), Inorgan. Chim. Acta, 2006, vol. 359, p. 4741.
Юхневич, Г.В. Инфракрасная спектроскопия воды, М.: Наука, 1973. 208 с. [Yxhevich, G.V., Infrared spectroscopy of water, M.: Sciense, 1973. 208 p.]
Козлова, Н.И., Кесслер, В.Г., Турова, Н.Я., Белоконь, А.И. Масс-спектрометрическое и ИК спектральное исследование алкоголятов молибдена(VI). Полимерия алкоголятов. Координац. химия. 1989. Т. 15. № 11. С. 1524. [Kozlova, N.I., et al., Mass spectrometric and IR spectral study of molybdenum(VI) alcoholates. Polymer of alcoholates (in Russian), Coordinat. chem., 1989, vol. 15, no. 11, p. 1524.]
Edwards, P.G., Wilkinson, G., Hursthouse, M.B., and Malik, K.M.A., Improved syntheses of tetrachloro-oxorhenium(VI) and chlorotrioxorhenium(VII). Synthesis of alkoxo- and dialkylamido-rhenium compounds. The crystal and molecular structures of di-μ-methoxo-tetramethoxo-μ-oxo-dioxorhenium(VI) (Re–Re), bis[lithium pentaisopropoxo-oxorhenate(VI)–lithiumchloride–tetrahydrofuran(1/1/2)], and trans-tetraphenoxobis(trimethylphosphine)rhenium(IV), J. Chem. Soc., Dalton Trans, 1980, no. 12. p. 2467. https://doi.org/10.1039/DT9800002467
Кесслер, В.Г., Шевельков, А.В., Хворых, Г.В., Сейсенбаева, Г.А., Турова, Н.Я., Дробот, Д.В. Электрохимический синтез и физико-химические свойства оксометилата рения(V) Re4O2(OMe)16. Журн. неорган. химии. 1995. Т. 40. № 9. С. 1477. [Electrochemical synthesis and physicochemical properties of rhenium (V) oxomethylate Re4O2(OMe)16. (in Russian), J. Inorgan. Chem., 1995, vol. 40, no. 9, p. 1477.]
Chadha, S.L. and Sharma, V., Alcoholysis of Nickel(II)methoxide: Synthesis and Characterization of Ni(OCH3)(OCH2CC13), Inorgan. Chim. Acta, 1986, vol. 118, no. 2, p. 43.
Слабженников, C.Н., Рябченко, О.Б., Куартон, Л.А. Особенности и закономерности ИК-спектров трис(ацетилацетонатов) переходных металлов. Координац. химия. 2006. Т. 34. № 7. С. 558. [Slabzhennikov, S.N., Ryabchenko, O.B., and Kuarton, L.A., Distincite and Regular Features of the IR Spectra of Transition Metal Tris(acetylacetonates), Russ. J. Coordinat. Chem., 2008, vol. 34, no. 7, p. 551.] https://doi.org/10.1134/s1070328408070130
Nakamoto, K., McCarthy, P.J., and Martell, A.E., Infrared Spectra of Metal Chelate Compounds. III Infrared Spectra of Acetylacetonates of Divalent Metals, J. Am. Chem. Soc., 1961, vol. 83, no. 6, p. 1272.
Yiase, S.G., Adejo, S.O., and Iningev, S.T., Manganese(II) and Cobalt(II) Acetylacetonates as Antimicrobial Agents, Nigerian Annals Pure and Appl. Sci., 2018, vol. 1, p. 176. https://doi.org/10.46912/napas.43
Prigent, J. and Joubert, J.-M., The phase diagrams of the ternary systems La–Ni–M (M = Re, Ru, Os, Rh, Ir, Pd, Ag, Au) in the La-poor region, Intermetallics, 2011, vol. 19 no. 3, p. 295. https://doi.org/10.1016/j.intermet.2010.10.016
Шубин, Ю.В., Филатов, Е.Ю., Байдина, И., Юсенко, К.В., Задесенец, А.В., Коренев, С.В. Синтез [M(NH3)5Cl](ReO4)2 (M = Cr, Co, Ru, Rh, Ir), изучение продуктов термолиза. Кристаллическая структура [Rh(NH3)5Cl](ReO4). Журн. cтруктур. химии. 2006. Т. 47. № 6. С. 1114. [Shubin, Y.V., Filatov, E.Y., Baidina, I.A., Yusenko, K.V., Zadesenetz, A.V., and Korenev, S.V., Synthesis of [M(NH3)5Cl](ReO4)2 (M = Cr, Co, Ru, Rh, Ir) and investigation of thermolysis products. Crystal structure of [Rh(NH3)5Cl](ReO4)2, J. Structur. Chem., 2006, vol.47, no. 6, p. 1103.] https://doi.org/10.1007/s10947-006-0432-3
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия


