Электрохимия, 2022, T. 58, № 2, стр. 85-94
Смешанная ионно-электронная проводимость флюоритоподобных твердых растворов Ce1 – x – yLaxPryO2 – δ в восстановительных условиях
А. И. Иванов a, *, С. И. Бредихин a, В. В. Хартон a
a Федеральное государственное бюджетное учреждение науки Институт физики твердого тела им. Ю.А. Осипьяна РАН
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 2, Россия
* E-mail: aliv@issp.ac.ru
Поступила в редакцию 15.10.2020
После доработки 02.04.2021
Принята к публикации 31.08.2021
- EDN: XOSJGU
- DOI: 10.31857/S0424857022020050
Аннотация
Исследованы зависимости удельной электропроводности флюоритоподобных твердых растворов Ce1 –x – yLaxPryO2 – δ (x = 0.29–0.40, y = 0–0.14) от парциального давления кислорода (p(O2)) в интервале 10–20–0.5 атм при 973–1223 K. Показано, что твердые растворы (Сe,La)O2 – δ в окислительной области являются анионными проводниками с числами ионного переноса свыше 0.99 во всем температурном интервале. Снижение парциального давления кислорода приводит к росту электронной проводимости n-типа. С помощью регрессионного анализа изотерм проводимости в восстановительной области, при p(O2) = 10–20–10–8 атм, оценены процессы образования и переноса электронных и ионных дефектов, рассчитаны параметры электропереноса и концентрации точечных дефектов. Установлено, что увеличение степени допирования приводит к уменьшению концентрации электронов, локализованных на катионах церия, их подвижности и, соответственно, парциальной электронной проводимости n-типа. Отмечено, что ионная проводимость и подвижность кислородных вакансий уменьшаются с ростом суммарной концентрации La3+, Pr3+ и Ce3+. Это может быть связано с образованием кластеров точечных дефектов, включающих Ln3+ и анионные вакансии, вероятность которого с увеличением содержания Ln3+ растет.
ВВЕДЕНИЕ
Флюоритоподобные твердые растворы на основе (Ce,Ln)O2 – δ, где Ln – катион трехвалентного редкоземельного металла, являются перспективными материалами для применения в качестве компонентов твердооксидных топливных элементов (ТОТЭ), мембран для генераторов кислорода, электрохимических датчиков и катализаторов окисления [1–8]. Среди данного семейства материалов особый интерес представляет состав Ce0.6La0.4O2 – δ, вследствие его использования для защитных подслоев среднетемпературных ТОТЭ с твердым электролитом на основе галлата лантана, обладающим высокой величиной анионной проводимости. Экспериментально было установлено, что замещение церия лантаном (40 ат. %) вблизи предела растворимости в CeO2 [9] обеспечивает высокую химическую стабильность оксида по отношению к галлату [10–12]. Недостатком Ce0.6La0.4O2 – δ и его производных является низкая электронная проводимость p-типа в окислительных (катодных) условиях функционирования ТОТЭ [2, 13–19]. Было показано, что умеренное со-легирование Ce0.6La0.4O2 – δ празеодимом может улучшить транспортные свойства в окислительной среде [20, 21]. В таких условиях наличие редокс-пары Pr4+/Pr3+ обеспечивает электронную проводимость p-типа и каталитическую активность в реакции восстановления молекулярного кислорода [8, 13, 19–24].
Согласно литературным данным, дырочная проводимость Pr-замещенных CeO2 – δ реализуется по прыжковому механизму. Дефектная структура, коэффициент Зеебека и химическое расширение Pr-содержащих твердых растворов на основе CeO2 – δ успешно описываются в рамках модели поляронов малого радиуса [8, 13, 19–26]. Переход в область низких парциальных давлений кислорода (p(O2)) приводит к появлению электронной проводимости n-типа вследствие частичного восстановления Ce4+ до Ce3+ [1–3]. В умеренно восстановительной атмосфере зависимость электронной проводимости для материалов (Ce,Ln)O2 – δ пропорциональна p(O2)–1/n, где n – целое число, принимающее заничения 4 или 6 в зависимости от доминирующего процесса дефектообразования [13–18, 23, 24, 27]. При высоких температурах в сильновосстановительной среде наблюдается изменение характера зависимости электропроводности от p(O2), приводящее к отклонению от степенного закона [24].
Настоящая работа является продолжением предыдущих исследований [12, 20, 21] и направлена на анализ удельной электропроводности Ce1 –x–yLaxPryO2 – δ (x = 0.29–0.40, y = 0–0.14) и оценку процесса образования и переноса точечных дефектов в восстановительных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез однофазных высокодисперсных порошков Ce1 –x–yLaxPryO2 – δ проводили с использованием глицин-нитратного метода; условия синтеза подробно описаны ранее [20]. Затем из полученных порошков сложных оксидов методом одноосного гидравлического прессования (~100 МПа) формировали образцы в виде дисков диаметром 27 мм и толщиной до 2–3 мм, которые спекали на воздухе при 1723 K в течение 10 ч со средней скоростью нагрева/охлаждения не более 2.5 К/мин. Из спеченной керамики вырезали образцы в форме прямоугольного параллелепипеда (10 × 1.5 × 1.5 мм3) для измерений удельной электропроводности и в форме дисков (диаметр 11 мм, толщина 1 мм) для оценки чисел ионного переноса. С помощью рентгенофазового анализа было установлено, что все исследуемые образцы являлись полностью однофазными и имели флюоритоподобную кристаллическую структуру; примеры дифрактограмм, а также микроструктуры порошков и керамики Ce1 –x–yLaxPryO2 – δ опубликованы ранее [12, 20, 21]. Относительная плотность керамики составляла 90–96%.
Удельную электропроводность измеряли стандартным 4-зондовым методом на постоянном токе в интервале p(O2) от 10–20 до 0.5 атм при T = = 973–1223 K (шаг 50 К). Для изготовления токовых и потенциальных зондов на образцах использовали платиновую проволоку диаметром 0.3 мм. На участки соединения зондов с образцом для улучшения контакта наносили мелкодисперсную платиновую пасту, которую припекали при 1173 К в течение 1 ч. В процессе измерений образцы находились в изолированной электрохимической ячейке, оснащенной датчиком давления кислорода и кислородным насосом на основе стабилизированного диоксида циркония с платиновыми электродами [28]. Перед началом измерения ячейку вакуумировали, а затем заполняли газовой смесью 50% CO2–50% O2. Далее с помощью электрохимического насоса производили откачивание/накачивание кислорода из/в установки. Кислородный датчик использовался для независимого контроля p(O2) в системе. Измерения проводились в режиме полного уравновешивания образца с газовой фазой; в качестве критерия равновесия принимали изменение производной логарифма полной проводимости ∂(lgσt)/∂t < 0.0001 мин–1. В зависимости от температуры и p(O2) время уравновешивания составляло 1–7 ч. Достоверность полученных значений оценивали с помощью воспроизводимости данных при термо- и редокс-циклировании. Ток на образец и кислородный насос подавали, используя программируемый источник Yokogawa GS200; напряжение на образце и ЭДС датчика измеряли с помощью вольтметра Fluke 45.
Числа ионного переноса оценивали модифицированным методом ЭДС [19]. Эксперименты проводили используя электрохимическую ячейку, содержащую трубчатый датчик p(O2) на основе YSZ. С помощью высокотемпературного стеклокерамического клея цилиндрические образцы с нанесенными платиновыми электродами герметично приклеивались на торец YSZ-трубки. В процессе измерения образцы находились под перепадом p(O2) 1/0.21 атм при 1023–1223 К, который создавали при подаче потоков кислорода и воздуха на платиновые электроды. Экспериментальная методика определения чисел переноса была описана в работах [19, 29].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Зависимости удельной электропроводности от парциального давления кислорода для (Ce,La) O2 – δ показаны на рис. 1а и 1б. Такой характер зависимости является типичным для большинства оксидов церия, допированных акцепторными примесями [3, 27, 30–32]. В окислительной области электропороводность практически не зависит от p(O2). Числа ионного переноса, полученные в этих условиях, принимают значения свыше 0.99 (вставка на рис. 1а). Это означает, что в этой области электропроводность носит практически ионный характер. Затем в восстановительной среде с уменьшением p(O2) наблюдается рост проводимости вследствие появления электронных носителей заряда n-типа за счет частичного восстановления ионов Ce4+ до Ce3+. Так как доминирующим процессом дефектообразования для Pr-содержащих оксидов в интервале низких p(O2) также является восстановление ионов Ce4+ до Ce3+, зависимости проводимости от p(O2) для Pr-замещенных материалов носят идентичный характер (рис. 1в и 1г).
Рис. 1.
Зависимости удельной электропроводности Ce1– x–yLaxPryO2 – δ от парциального давления кислорода; точки – экспериментальные данные, линии – расчет по модели II. Вставкой на графике 1а показаны числа кислород-ионного переноса для Ce0.60La0.40O2 – δ.

Для анализа изотерм проводимости использовались две модели, описанные ниже. В соответствии с литературными источниками [3, 20–27, 33, 34] в восстановительной области основной вклад в формирование дефектов вносит реакция обмена оксида с газовой фазой с образованием электронов (Ce3+) и кислородных вакансий (VO):
(1)
$2{\text{C}}{{{\text{e}}}^{{4 + }}} + {{{\text{O}}}^{{2--}}} \leftrightarrow {\text{ }}2{\text{C}}{{{\text{e}}}^{{3 + }}} + {{{\text{V}}}_{{\text{O}}}} + 1{\text{/}}2{{{\text{O}}}_{2}}.$Константа равновесия данной реакции, Keq, может быть записана как:
(2)
${{K}_{{{\text{eq}}}}} = \frac{{p{{{{\text{(}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}[{{{\text{V}}}_{{\text{O}}}}]{{{\left[ {C{{e}^{{3 + }}}} \right]}}^{2}}}}{{\left[ {{{O}^{{2 - }}}} \right]{{{\left[ {C{{e}^{{4 + }}}} \right]}}^{2}}}}.$Полагая, что проводимость p-типа (Ce,La)O2 – δ является пренебрежимо малой, общая проводимость σt состоит из вкладов электронной проводимости n-типа σn и ионной проводимости σv:
Аналогичное предположение принимается для Pr-содержащих оксидов, так как в данных условиях доля Pr4+ близка к нулю и, соответственно, концентрация восстановленной формы – Pr3+ является практически постоянной. Тогда в рамках стандартной степенной модели [14–18, 24, 27, 35] выражение зависимости σt от p(O2) будет иметь следующий вид (модель I):
(4)
${{\sigma }_{{\text{t}}}} = \sigma _{{\text{n}}}^{{\text{o}}}p{{({{{\text{O}}}_{2}})}^{{ - {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}}}} + {{\sigma }_{{\text{v}}}},$В модели II используются уравнения для прыжкового механизма электронного переноса и вакансионного механизма миграции ионов [20, 22, 24, 35]:
(5)
${{\sigma }_{{\text{n}}}} = {{k}_{{\text{n}}}}\left[ {{\text{C}}{{{\text{e}}}^{{3 + }}}} \right]\left[ {{\text{C}}{{{\text{e}}}^{{4 + }}}} \right],$(6)
${{\sigma }_{{\text{v}}}} = {{k}_{{\text{v}}}}\left[ {{{{\text{V}}}_{{\text{O}}}}} \right]\left[ {{{{\text{O}}}^{{2 - }}}} \right],$(8)
${{K}_{{{\text{eq}}}}} = \frac{{p{{{{\text{(}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}(0.5x + 0.5y + 0.5n){{n}^{2}}}}{{(2 - 0.5x - 0.5y - 0.5n){{{(1 - x - y - n)}}^{2}}}},$(9)
$\begin{gathered} {{\sigma }_{{\text{t}}}} = {{k}_{{\text{n}}}}n\left( {1 - x - y - n} \right) + {{k}_{{\text{v}}}}\left( {0.5x + 0.5y + 0.5n} \right)\,\, \times \\ \times \,\,\left( {2 - 0.5x - 0.5y - 0.5n} \right). \\ \end{gathered} $Комбинируя формулы (8) и (9), можно получить теоретические зависимости модели II в виде функций lg p(O2) = f(σt), которые использовались для нелинейного регрессионного анализа с параметрами Keq, kn и kv. Необходимо отдельно отметить, что в модели II используется приближение идеального раствора. Это означает, что энтальпия и энтропия реакции (1) являются постоянными, а активности всех точечных дефектов приравниваются к их равновесным концентрациям. В модели II также не учитываются процессы образования кластеров дефектов в кристаллической решетке, возникающие вследствие взаимодействия положительно заряженных кислородных вакансий и катионов акцепторного типа с эффективным отрицательным зарядом [35].
На рис. 2 приведены примеры теоретических кривых, полученных с помощью регрессионного анализа изотерм проводимости для материала Ce0.60La0.40O2 – δ. Видно, что степенная модель удовлетворительно описывает экспериментальные значения только при пониженных температурах. Наиболее хорошо массив экспериментальных данных был описан моделью II (рис. 1, 2). В дальнейшем модель II была использована для расчета параметров электропереноса и равновесных концентраций точечных дефектов.
Парциальные ионная и электронная проводимости при 1223 К, рассчитанные с помощью модели II, показаны на рис. 3a и 3б. С уменьшением p(O2) наблюдается небольшой рост ионной проводимости, так как происходит увеличение концентрации ионных носителей заряда – кислородных вакансий (рис. 4а, 4б). При этом, одновременно с ростом [VO] снижается число позиций, доступных для миграции VO, т.е. ионов кислорода, что приводит к уменьшению подвижности вакансий (рис. 5а). Согласно с степенной моделью, в умеренно восстановительной среде равновесная концентрация Ce3+ (рис. 4в, 4г) и, соответственно, электронная проводимость пропорциональны p(O2)–1/4. В сильно восстановительных условиях при бóльших концентрациях Ce3+ наблюдается отклонение от степенного закона, при этом электронная проводимость начинает доминировать над ионной (рис. 3a, 3б). Следует отметить, что, как и в случае с подвижностью кислородных вакансий, с увеличением [Ce3+] снижается количество позиций, доступных для прыжка электронов – [Ce4+] (рис. 4в, 4г), что также приводит к падению подвижности электронных носителей (рис. 5б).
Рис. 3.
Зависимости полной (σt), n-типа (σn) и ионной (σv) проводимостей от парциального давления кислорода для Ce0.60La0.40O2 – δ и Ce0.50La0.40Pr0.10O2 – δ (расчет по модели II).

Рис. 4.
Рассчитанные по модели II равновесные концентрации кислородных вакансий и ионов церия в Ce1 –x–yLaxPryO2 – δ.
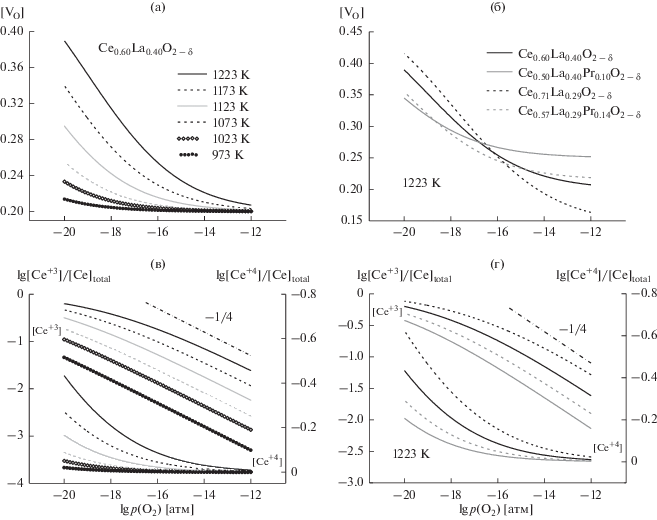
Рис. 5.
Зависимости подвижностей кислородных вакансий (μv) и электронов (μn) Ce1 –x–yLaxPryO2 – δ от парциального давления кислорода.
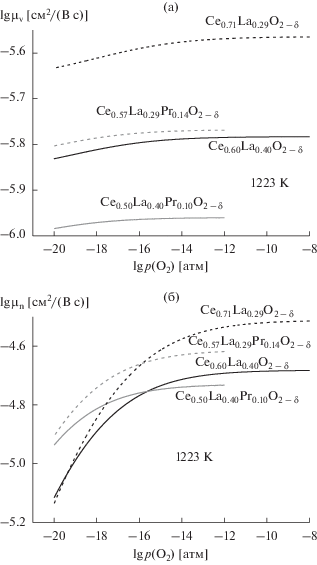
Температурные зависимости полной, электронной и ионной проводимостей при p(O2) = 10–16 атм показаны на рис. 6а–6в. Как общая, так и парциальные проводимости хорошо описываются в рамках стандартной модели Аррениуса, применимой и для поляронного механизма электронного переноса, и для миграции вакансий. Необходимо подчеркнуть, что параметры регрессионного анализа – коэффициенты kn и kv и константа равновесия Keq, также хорошо линеаризуются в координатах Аррениуса и Вант-Гоффа соответственно (рис. 7а–7в).
Рис. 6.
Температурные зависимости полной (σt), n‑типа (σn) и ионной (σv) проводимостей для Ce1 ‒ x–yLaxPryO2 – δ при p(O2) = 10–16 атм.

Рис. 7.
Температурные зависимости коэффициентов kn и kv и константы равновесия Keq для Ce1 –x–yLaxPryO2 – δ.

Вклад электронной проводимости закономерно снижается с ростом суммарного содержания La и Pr, вследствие уменьшения подвижности и концентрации электронных носителей Сe3+ (рис. 4г и 5б). Полученные результаты качественно согласуются с выводами работ [33, 36], в которых наблюдалось уменьшение склонности к восстановлению оксидов (Ce,Ln)O2 – δ при увеличении уровня допирования. Энергия активации электронной проводимости находится в диапазоне 187–236 кДж/моль (табл. 1), что в пределах погрешности хорошо совпадает с Ea, полученной для большинства (Ce,Ln)O2 – δ [16].
Таблица 1.
Энергия активации удельной электропроводности (σt) и парциальных электронной n-типа (σn) и ионной (σv) проводимостей Ce1 –x–yLaxPryO2 – δ при p(O2) = 10–16 атм
| Материал | T, K | Ea(σt), кДж/моль | Ea(σn), кДж/моль | Ea(σv), кДж/моль |
|---|---|---|---|---|
| Ce0.60La0.40O2 – δ | 973–1223 | 150 ± 17 | 219 ± 16 | 109 ± 7 |
| Ce0.50La0.40Pr0.10O2 – δ | 1073–1223 | 156 ± 16 | 236 ± 9 | 112 ± 4 |
| Ce0.71La0.29O2 – δ | 973–1223 | 157 ± 15 | 187 ± 41 | 123 ± 23 |
| Ce0.57La0.29Pr0.14O2 – δ | 1073–1223 | 160 ± 11 | 219 ± 24 | 115 ± 13 |
Аналогичное влияние степени допирования наблюдается для ионной проводимости (рис. 6в и 7в). Ионный вклад и подвижность вакансий уменьшаются с ростом суммарной концентрации La3+, Pr3+ и Ce3+ (рис. 8), в результате, как было отмечено выше, снижения числа позиций, доступных для миграции вакансий, а также возможного образования кластеров точечных дефектов [35]. Данный вывод согласуется с тем, что подвижности электронных и ионных носителей Ce1 –x–yLaxPryO2 – δ на 2–4 порядка меньше, чем подвижности, полученные для материалов Ce1 –xLnxO2 – δ с уровнем допирования x = 0.1–0.2 [30, 37]. Стоит отметить, что энергии активации, рассчитанные для общей электропроводности, ионной проводимости и параметра kv практически не зависят от катионного состава Ce1 –x–yLaxPryO2 – δ (табл. 1, 2). Это может означать, что ионная проводимость Ce1 –x–yLaxPryO2 – δ реализуется по единому механизму, который не зависит от концентрации акцепторной примеси. Энтальпия квазихимической реакции (1) составляет 304–390 кДж/моль (табл. 2), что характерно для большинства замещенных оксидов церия [3, 33].
Таблица 2.
Энергия активации kv и kn (модель II), и энтальпия и энтропия квазихимической реакции (1) для Ce1 ‒ x–yLaxPryO2 – δ
| Материал | T, K | Ea(kn), кДж/моль | Ea(kv), кДж/моль | ΔH, кДж/моль | ΔS, Дж/(моль K) |
|---|---|---|---|---|---|
| Ce0.60La0.40O2 – δ | 973–1223 | 86 ± 11 | 102 ± 4 | 304 ± 33 | 53 ± 30 |
| Ce0.50La0.40Pr0.10O2 – δ | 1073–1223 | 73 ± 24* | 107 ± 3 | 390 ± 81 | 109 ± 71 |
| Ce0.71La0.29O2 – δ | 973–1223 | 57 ± 8 | 104 ± 14 | 339 ± 42 | 95 ± 39 |
| Ce0.57La0.29Pr0.14O2 – δ | 1073–1223 | 74 ± 13 | 107 ± 24 | 333 ± 51 | 69 ± 45 |
Поведение рассчитанных чисел ионного переноса (рис. 9) качественно соответствует общей картине зависимостей концентраций носителей зарядов и парциальных p- и n-типа и ионной проводимостей от p(O2). В сильно окислительных условиях значения to для (Ce,La)O2 – δ близки 1, как и у большинства CeO2, допированных катионами акцепторного типа [2, 14, 15, 18, 19, 32]. С понижением p(O2) наблюдается уменьшение доли ионной проводимости, вследствие роста проводимости n-типа. В окислительной области Pr-содержащие оксиды являются смешанными проводниками с преобладающим вкладом ионной проводимости, при этом снижение p(O2) приводит к увеличению ее доли, вследствие уменьшения дырочной проводимости [20, 21, 23]. Затем в умеренно окислительной среде наблюдается максимум для to и дальнейшее снижение to с уменьшением p(O2). В области низких p(O2) чем больше концентрация церия (т.е. меньше содержание допирующих катионов), тем выше вклад электронной проводимости n-типа, что согласуется с большей концентрацией Ce3+ и, соответственно, повышенной склонностью к восстановлению материалов (рис. 4г). Следует также подчеркнуть, что увеличение степени допирования приводит к смещению критического p(O2), при котором to = 0.5, в сторону более низких p(O2).
ЗАКЛЮЧЕНИЕ
Исследованы зависимости удельной электропроводности флюоритоподобных твердых растворов Ce1 –x–yLaxPryO2 – δ (x = 0.29–0.40, y = 0–0.14) от парциального давления кислорода в интервале 10–20–0.5 атм при 973–1223 K. Показано, что твердые растворы (Сe,La)O2 – δ в окислительной области являются анионными проводниками с числами ионного переноса свыше 0.99 во всем температурном интервале. Снижение парциального давления кислорода приводит к росту электронной проводимости n-типа. Установлено, что наиболее адекватно описывает экспериментальные данные модель, включающая прыжковый механизм переноса электронов и вакансионный механизм миграции ионов. На основе этой модели оценены процессы образования и переноса электронных и ионных дефектов, рассчитаны парциальные ионная и электронная n-типа проводимости, подвижности носителей заряда, числа ионного переноса и концентрации точечных дефектов. Установлено, что увеличение степени допирования приводит к уменьшению концентрации электронов, локализованных на катионах Сe3+, их подвижности и, соответственно, проводимости n-типа. Также установлено, что ионная проводимость и подвижность вакансий уменьшаются с ростом суммарной концентрации La3+, Pr3+ и Ce3+, что может быть связано с образованием кластеров точечных дефектов, вероятность которых с увеличением содержания Ln3+ растет.
Список литературы
Kharton, V.V., Figueiredo, F.M., Navarro, L., Naumovich, E.N., Kovalevsky, A.V., Yaremchenko, A.A., Viskup, A.P., Carneiro, A., Marques, F.M.B., and Frade, J.R., Ceria-based materials for solid oxide fuel cells, J. Mater. Sci., 2001, vol. 36, p. 1105.
Tsipis, E.V. and Kharton, V.V., Electrode materials and reaction mechanisms in solid oxide fuel cells: a brief review, J. Solid State Electrochem., 2008, vol. 12, p. 1039.
Mogensen, M., Sammes, N.M., and Tompsett, G.A., Physical, chemical and electrochemical properties of pure and doped ceria, Solid State Ion., 2000, vol. 129, p. 63.
Elyassi, B., Rajabbeigi, N., Khodadadi, A., Mohajerzadeh, S.S., and Sahimi, M., An yttria-doped ceria-based oxygen sensor with solid-state reference, Sens. Actuators B Chem., 2004, vol. 103, p. 178.
Trovarelli, A., Catalytic Properties of Ceria and CeO2-Containing Materials, Catal. Rev., 2006, vol. 38, p. 439.
Bernal, S., Blanco, G., Cauqui, M.A., Corchado, M.P., Larese, C., Pintado, J.M., and Rodrıguez-Izquierdo, J.M., Cerium–terbium mixed oxides as alternative components for three-way catalysts: a comparative study of Pt/CeTbOx and Pt/CeO2 model systems, Catal. Today, 1999, vol. 53, p. 607.
Zhao, S. and Gorte, R.J., A comparison of ceria and Sm-doped ceria for hydrocarbon oxidation reactions, Appl. Catal. A: Gen., 2004, vol. 277, p 129.
Shuk, P. and Greenblatt, M., Hydrothermal synthesis and properties of mixed conductors based on Ce1 ‒ xPrxO2 – δ solid solutions, Solid State Ion., 1999, vol. 116, p. 217.
Wei-ping, G., Rui, Z., and Zhong-sheng, C., Thermodynamic modelling and applications of Ce–La–O phase diagram, Trans. Nonferrous Met. Soc. China, 2011, vol. 21, p. 2671.
Huang, K., Wan, J.-H., and Goodenough, J.B., Increasing Power Density of LSGM-Based Solid Oxide FuelCells Using New Anode Materials, J. Electrochem. Soc., 2001, vol. 148, p. A788.
Kuritsyna, I., Sinitsyn, V., Melnikov, A., Fedotov, Yu., Tsipis, E., Viskup, A., Bredikhin, S., and Kharton, V., Oxygen exchange, thermochemical expansion and cathodic behavior of perovskite-like Sr0.7Ce0.3MnO3 – δ, Solid State Ion., 2014, vol. 262, p. 349.
Иванов, А.И., Зверькова, И.И., Ципис, Е.В., Бредихин, С.И., Хартон, В.В. Стабильность и функциональные свойства флюоритоподобных Ce0.6 ‒ xLa0.4PrxO2 – δ как компонентов электродов твердооксидных топливных элементов.Электрохимия. 2020.Т. 56. С. 149. [Ivanov, A.I., Zver’kova, I.I., Tsipis, E.V., Bredikhin, S.I., and Kharton, V.V., Stability and Functional Properties of Fluorite-Like Ce0.6 –xLa0.4PrxO2 – δ as Electrode Components for Solid Oxide Fuel Cells, Russ. J. Electrochem., 2020, vol. 56, p. 139.]
Cheng, Sh., Chatzichristodoulou, Ch., Søgaard, M., Kaiser, A., and Hendriksen, P.V., Ionic/Electronic Conductivity, Thermal/Chemical Expansion and Oxygen Permeation in Pr and Gd Co-Doped Ceria PrxGd0.1Ce0.9 –xO1.95 – δ, J. Electrochem. Soc., 2017, vol. 164, p. F1354.
Shimonosono, T., Hirata, Y., Ehira, Yu., Sameshima, S., Horita, T., and Yokokawa, H., Electronic conductivity measurement of Sm- and La-doped ceria ceramics by Hebb–Wagner method, Solid State Ion., 2004, vol. 174, p. 27.
Shimonosono, T., Hirata, Y., and Sameshima, S., Electronic Conductivity of La-Doped Ceria Ceramics, J. Am. Ceram. Soc., 2005, vol. 88, p. 2114.
Xiong, Yu., Yamaji, K., Horita, T., Sakai, N., and Yokokawa, H., Hole and Electron Conductivities of 20 mol %-REO1.5 Doped CeO2 (RE = Yb, Y, Gd, Sm, Nd, La), J. Electrochem. Soc., 2004, vol. 151, p. A407.
Perez-Coll, D., Aguadero, A., Nunez, P., and Frade, J.R., Mixed transport properties of Ce1 –xSmxO2 –x/2 system under fuel cell operating conditions, Int. J. Hydrog. Energy, 2010, vol. 35, p. 11448.
Perez-Coll, D., Nunez, P., and Frade, J.R., Effect of samarium content on onset of minor p-type conductivity in ceria-based electrolytes, Int. J. Hydrog. Energy, 2013, vol. 227, p. 145.
Kharton, V.V., Viskup, A.P., Figueiredo, F.M., Naumovich, E.N., Yaremchenko, A.A., and Marques, F.M.B., Electron-hole conduction in Pr-doped Ce(Gd)O2 – δ by faradaic efficiency and emf measurements, Electrochim. Acta, 2001, vol. 46, p. 2879.
Иванов, А.И., Загитова, А.А., Бредихин, С.И., Хартон, В.В. Синтез и смешанная проводимость Ce1 –x–yLaxPryO2 – δ для каталитически активных защитных подслоев твердооксидных топливных элементов. Альтернат. энергетика и экология. 2014. № 20(160). С. 15. [Ivanov, A.I., Zagitova, А.А., Bredikhin, S.I., and Kharton, V.V., Synthesis and mixed conductivity of Ce1 –x–yLaxPryO2 – δ for catalytically active interlayers of solid oxide fuel cells, Al’ternativnaya Energetika I Ekologiya (in Russian), 2014, no. 20(160), p. 15.]
Иванов, А.И., Колотыгин, В.А., Патракеев, М.В., Марков, А.А., Бредихин, С.И., Хартон, В.В. Кислородная нестехиометрия и транспортные свойства смешанных проводников Ce0.6 –xLa0.4PrxO2 – δ. Электрохимия. 2018. Т. 54. С. 561. [Ivanov, A.I., Kolotygin, V.A., Patrakeev, M.V., Markov, A.A., Bredi-khin, S.I., and Kharton, V.V., Electrical Conductivity, Oxygen Nonstoichiometry and Transport Properties of Mixed-Conducting Ce0.6 –xLa0.4PrxO2 – δ, Russ. J. Electrochem., 2018, vol. 54, p. 486.]
Lenser, Ch., Gunkel, F., Sohn, Y.J., and Menzler, N.H., Impact of defect chemistry on cathode performance: A case study of Pr-doped ceria, Solid State Ion., 2018, vol. 314, p. 204.
Bishop, S.R., Stefanik, T.S, and Tuller, H.L., Defects and transport in PrxCe1 –xO2 – δ: Composition trends, J. Mater. Res., 2012, vol. 27, p. 2009.
Fagg, D.P., Frade, J.R., Kharton, V.V., and Marozau, I.P., The defect chemistry of Ce(Pr, Zr)O2 – δ, J. Solid State Chem., 2006, vol. 179, p. 1469.
Chatzichristodoulou, C. and Hendriksen, P.V., Oxygen Nonstoichiometry and Defect Chemistry Modeling of Ce0.8Pr0.2O2 – δ, J. Electrochem. Soc., 2010, vol. 157, p. B481.
Bishop, S.R., Marrocchelli, D., Chatzichristodoulou, C., Perry, N.H., Mogensen, M.B., Tuller, H.L., and Wachsman, E.D., Chemical Expansion: Implications for Electrochemical Energy Storage and Conversion Devices, Annu. Rev. Mater. Res., 2014, vol. 44, p. 205.
Zamudio-García, J., Porras-Vázquez, J.M., Canales-Vázquez, J., Cabeza, A., Losilla, E.R., and Marrero-López, D., Relationship between the Structure and Transport Properties in the Ce1 –xLaxO2 –x/2 System, Inorg. Chem., 2019, vol. 58, p. 9368.
Patrakeev, M.V., Mitberg, E.B., Lakhtin, A.A., Leonidov, I.A., Kozhevnikov, V.L., Kharton, V.V., Avdeev, M., and Marques, F.M.B., Oxygen Nonstoichiometry, Conductivity, and Seebeck Coefficient of La0.3Sr0.7Fe1 –xGaxO2.65 + δ Perovskites, J. Solid State Chem., 2002, vol. 167, p. 203.
Kharton, V.V. and Marques, F.M.B., Interfacial effects in electrochemical cells for oxygen ionic conduction measurements I. The e. m. f. method, Solid State Ion., 2001, vol. 140, p. 381.
Wang, Sh., Kobayashi, T., Dokiya, M., and Hashimoto, T., Electrical and Ionic Conductivity of Gd-Doped Ceria, J. Electrochem. Soc., 2000, vol. 147, p. 3606.
Mogensen, M., Lindegaard, Th., and Hansen, U.R., Physical Properties of Mixed Conductor Solid Oxide Fuel Cell Anodes of Doped CeO2, J. Electrochem. Soc., 1994, vol. 141, p. 2122.
Yahiro, H., Eguchi, Y., Eguchi, K., and Arai, H., Oxygen ion conductivity of the ceria-samarium oxide system with fluorite structure, J. Appl. Electrochem., 1988, vol. 18, p. 527.
Pérez-Coll, D., Marrero-López, D., Ruiz-Morales, J.C., Núnez, P., Abrantes, J.C.C., and Frade, J.R., Reducibility of Ce1 –xGdxO2 – δ in prospective working conditions, J. Power Sources, 2007, vol. 173, p. 291.
Schneider, D., Godickemeier, M., and Gauckler, L.J., Nonstoichiometry and Defect Chemistry of Ceria Solid Solutions, J. Electroceram., 1997, vol. 2, p. 165.
Чеботин, В.Н. Физическая химия твердого тела. М.: Химия, 1982. 320 с. [Chebotin, V.N., Fizicheskaya khimiya tverdogo tela, M.: Khimiya(in Russian), 1982. 320 с.]
Kharton, V.V., Yaremchenko, A.Ya., Naumovich, E.N., and Marques, F.M.B., Research on the electrochemistry of oxygen ion conductors in the former Soviet Union, III. HfO2-, CeO2- and ThO2-based oxides, J. Solid State Electrochem., 2000, vol. 4, p. 243.
Steele, B.C.H., Appraisal of Ce1– yGdyO2 –y/2 electrolytes for IT-SOFC operation at 500°C, Solid State Ion., 2000, vol. 129, p. 95.
Дополнительные материалы отсутствуют.





