Электрохимия, 2022, T. 58, № 3, стр. 129-139
Особенности электромембранной рекуперации кислот и щелочей из водорастворимых отходов АЭС
Т. А. Седнева a, *, В. И. Иваненко a, М. Л. Беликов a, **
a Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева –
обособленное подразделение Федерального государственного бюджетного учреждения науки
Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Апатиты, Академгородок, 26а, Россия
* E-mail: sedneva.ta@gmail.com
** E-mail: m.belikov@ksc.ru
Поступила в редакцию 01.02.2021
После доработки 06.07.2021
Принята к публикации 02.08.2021
- EDN: FHYPUQ
- DOI: 10.31857/S042485702201011X
Аннотация
Представлены результаты изучения процесса рекуперации азотной кислоты и смеси щелочей NaOH и KOH из концентрированных растворов в электродиализаторах фильтр-прессного типа с анионо-, катионо- и биполярными мембранами. Установлена необходимость предварительной очистки технологических растворов от соединений кальция и бора с получением кристаллической борной кислоты (H3BO3) и гипса (CaSO4·2H2O). Показана возможность получения из очищенных концентрированных солевых растворов кислоты и щелочей, с концентрацией ~300–600 г/л, пригодных к повторному использованию, что обеспечивает только электродиализ с анионо- и катионообменными мембранами, тогда как электродиализ с биполярными мембранами осложняется заметным загрязнением солями как кислых, так и щелочных растворов.
ВВЕДЕНИЕ
В настоящее время в Европейских странах активно развиваются электродиализные проекты [1, 2] по утилизации отходов. Растут и развиваются области применения электромембранных процессов в различных сферах деятельности: химический синтез органических и неорганических соединений; преобразование органических и неорганических солей в высокочистые кислоты и основания; восстановление кислот и оснований из реакционных смесей; очистка сточных вод и отходящих газов; модификация существующих технологий, ведущая к снижению отходов и энергопотребления [3–16]. Так, в работах [4–6] с помощью электродиализа предложено синтезировать [4] ионные жидкости, извлекать их из сточных вод [5], а также очищать и разделять [6] их с эффективностью 92–95%. В работе [8], методом электродиализа с биполярными мембранами отделяют итаконовую кислоту от загрязняющих ее глюкозы и яблочной кислоты, коэффициент извлечения итаконовой кислоты составил 97–98.5%. Многие авторы [10–15] сообщают об эффективном извлечении фосфора из слабо концентрированных сточных вод и физиологических жидкостей. Показана [9] возможность расщепления воды в электромембранной системе с двухслойной ионообменной мембраной, выявлена воможность регулирования потоков ионов соли и продуктов расщепления воды (водорода и гидроксильных ионов) путем изменения плотности тока.
Одной из важных проблем является отсутствие эффективных технических решений переработки различных солевых растворов в ценные продукты, что исключает возможность их дальнейшего использования. Так, например, из жидких радиоактивных отходов, образующихся на атомных электростанциях (АЭС), самыми сложными для переработки являются концентрированные нитратные растворы Na и K, содержащие различные примеси, а также борная кислота. После дезактивации их выпаривают и переводят в твердый продукт – плав. Полная переработка таких отходов отсутствует.
Известная многостадийная разработка утилизации подобных отходов [17] включает ряд операций: упаривание, кристаллизацию образовавшегося борсодержащего концентрата, его отделение от маточного раствора, растворение, ультрафильтрацию полученного раствора, пропускание его через ионселективный фильтр, упаривание до 80–250 г/л H3BO3 и кристаллизацию кислоты. Выход H3BO3 составляет не более 84%. Способ предусматривает регенерацию только H3BO3 с недостаточной степенью извлечения и не избавляет от значительного количества отходов, подлежащих захоронению. В способе, описанном в работе [18], после сложной обработки кислых и щелочных борсодержащих отходов, раствор, содержащий 20–25 г/л Na3BO3, подвергают электродиализу в трехкамерном электродиализаторе с катионо- (МК) и анионообменными (МА) мембранами с получением растворов 0.1–60 г/л H3BO3 и 150 г/л NaOH. При этом происходит частичная регенерация только H3BO3 и NaOH, а концентрированный маточный раствор требует утилизации. Невысокая концентрация получаемых продуктов ограничивает возможность их повторного использования.
Авторы, имеющие опыт использования электродиализного метода в химических технологиях [19–22], предположили возможность его использования в утилизации нитратных водорастворимых отходов АЭС.
Цель работы: определение особенностей электродиализной рекуперации кислот и щелочей из водорастворимых отходов АЭС, разработка технологии их переработки с получением пригодных для повторного использования продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение закономерностей электродиализного процесса утилизации концентрированных растворов из отходов АЭС осуществляли в трехкамерных электродиализаторах (ЭД) фильтр-прессного типа с повторяющимися секциями (анодная (АК), солевая (СК) и катодная (КК) камеры). Секции аналогичны представленным на рис. 1, оснащенны платиновыми анодами, титановыми или стальными катодами и ионообменными мембранами, зажатыми между рамками из оргстекла толщиной 1 см и открывающими поверхность электродов и мембран площадью 0.2 дм2. В работе использовали доступные отечественные мембраны: анионообменные МА-41 или МА-40, катионообменные МК-40 производства ОАО “Щекиноазот” и МФ-4СК завода “Пластполимер”, а также анионообменные АМН и катионообменные СМН фирмы MEGA (Чехия). Предварительная выдержка (48 ч) используемых мембран в концентрированных растворах азотной кислоты или гидроксида натрия (c = = 500–800 г/л) не влияла на их прочность.
При изучении возможности использования биполярных мембран, в ряде случаев промежуточные электроды электродиализатора заменяли биполярными мембранами (БЭД) производства ОАО “Щекиноазот”. Характеристики используемых мембран представлены в табл. 1. Источником постоянного тока служил АТН-1161 (6 А, 60 В).
Таблица 1.
| Показатель | Норма для марок | |||||||
|---|---|---|---|---|---|---|---|---|
| МА-40 | МА-41 | МК-40 | АМН-PAD | AМН-PES | СМН-PAD | МФ-4СК | МБ-2 | |
| Ионообменная группа | –SO3H | –N+(CH3)3 | –SO3H | –N+(CH3)3 | –N+(CH3)3 | –SO3H | –SO3H | –SO3H; –N+(CH3)3 |
| Ионная форма – противоион | Na+ | Cl– | Na+ | Cl– | Cl– | Na+ | Na+ | Na+; Cl– |
| Инертное связующее | Полиэтилен | Полиэтилен | Полиэтилен | Полиэтилен | Полиэтилен | Полиэтилен | Полиэтилен | Полиэтилен |
| Армирующая ткань | Полиамидная | Полиамидная | Полиамидная | Полипропилен | Полиэстер | Полипропилен | – | Полиамид |
| Толщина, мм | 0.3–0.5 | 0.3–0.5 | 0.3–0.5 | <0.45 | <0.45 | <0.45 | 0.05–0.3 | 0.9 |
| Изменение размеров при набухании, %: по длине по толщине |
6 ± 3 28 ± 7 |
7 ± 3 28 ± 7 |
8 ± 2 30 ± 5 |
<7 <50 |
<3 <60 |
<7 <50 |
4–10 20 |
8 ± 4 28 ± 2 |
| Прочность при разрыве, МПа, не менее | 10 | 11.0 | 11.9 | – | – | – | 9.8 | |
| Поверхностное электросопротивление, Ом см2, не более | 13 | 11 | 10 | 8 | 7.5 | 8 | 8 | 18 |
| Число переноса, доли, не менее | 0.8 | 0.94 | 0.8 | 0.95 | 0.95 | 0.95 | – | – |
| Ионообменная емкость, мг-экв/г, по 0.1 н. НС1 (или NaОН) | 3.8 ± 0.4 | 2.0 ± 0.3 | 2.6 ± 0.3 | – | – | – | 0.8–0.9 | – |
Предварительно исследован процесс электродиализа и установлены особенности поведения компонентов типичных борсодержащих нитратных растворов, преимущественно натрия и калия, примерного содержания, г/л: 50–180 Na+, 20–90 K+, 0.03–0.05 Co2+, <0.01 Fe2+, 0.1–3 Ca2+, 140–530 ${\text{NO}}_{3}^{ - },$ 2–25 Cl–, ${\text{SO}}_{4}^{{2 - }},$ 1–60 H3BO3. Полагали, что примесные элементы не могли оказать существенного влияния на основные процессы переноса подавляющего количества катионов Na+, K+ и анионов ${\text{NO}}_{3}^{ - }.$ В каждой секции предполагалась следующая схема электродиализа:
Исходный раствор подавали в среднюю солевую камеру (СК). В процессе электродиализа солевой раствор, анолит (кислота) и католит (щелочь) циркулировали по изолированным схемам в непрерывном режиме, последовательно проходя все секции. Для стартового повышения электропроводности электролитов в АК первоначально вводили раствор азотной кислоты с содержанием ~5 г/л HNO3, а в КК – раствор щелочи ~5 г/л NaOH. Процесс вели при плотностях тока от 1 до 15 А/дм2. В течение электродиализа контролировали силу тока (I, A), напряжение (U, В), концентрацию щелочи в католите в пересчете на едкий натр (NaOH, г/л) и кислотность в пересчете на азотную кислоту (HNO3, г/л) по результатам кислотно-щелочного титрования, а также исходные и конечные объемы электролитов.
Методы определения состава растворов
Все растворы анализировали на содержание катионов масс-спектрометрическим методом с индуктивно связанной плазмой (масс-спектрометр “ELAN 9000 DRC-e”, Perkin Elmer, США) и атомно-эмиссионным методом с индуктивно связанной плазмой (спектрометр Optima 8300, Perkin Elmer, США). Хлорид- и нитрат-ионы определяли обратным титрованием, сульфат-ион – гравиметрическим методом. Погрешность определений не превышала 3%.
Методики расчета параметров электродиализа
На основании полученных данных были рассчитаны основные параметры процессов в пересчете на кислоту HNO3 или щелочь NaOH: Q – удельная производительность, кг/(м2 ч); N – число переноса воды (моль H2O/моль HNO3 или моль H2O/моль NaOH); W – удельный расход электроэнергии, кВт ч/кг; ВТ – выход по току, %; С — извлечение компонента из солевого раствора, %.
Уравнения, используемые для расчета параметров электродиализа:
(1)
$C = {{c}^{i}}{{V}^{i}}{{100} \mathord{\left/ {\vphantom {{100} {{{c}^{0}}{{V}^{0}}}}} \right. \kern-0em} {{{c}^{0}}{{V}^{0}}}},$(2)
${\text{ВТ}} = {{c}^{i}}{{V}^{i}}{{100} \mathord{\left/ {\vphantom {{100} {qI\tau }}} \right. \kern-0em} {qI\tau }},$(3)
$W = UI{\tau \mathord{\left/ {\vphantom {\tau {{{c}^{i}}{{V}^{i}}}}} \right. \kern-0em} {{{c}^{i}}{{V}^{i}}}},$(4)
$Q = {{c}^{i}}{{{{V}^{i}}} \mathord{\left/ {\vphantom {{{{V}^{i}}} {{{S}_{{\text{m}}}}\tau }}} \right. \kern-0em} {{{S}_{{\text{m}}}}\tau }},$При электродиализе варьируемыми параметрами были мембранные пары, сила тока (I, А) и соотношение объемов электролитов в камерах электродиализатора – средней, анодной и катодной (VCK, VA и VK, мл), а также продолжительность процесса (τ, ч).
Исследование процессов массопереноса в электродиализаторах с моно- и биполярными мембранами
Работа связана с разработкой опытно-промышленного трехкамерного многосекционного электродиализатора с чередующимися в секциях камерами анолита, солевого раствора и католита, разделенными мембранами. Все аналогичные электролиты в секциях должны быть объединены в отдельные системы циркуляции. Секции должны быть заключены между широко применяемыми в аналогичных средах платинированными анодами и титановыми катодами с индивидуальными системами отвода электродных газов – кислорода и водорода. Например, проектирование электродиализного участка существующего производства с использованием стандартных листов ионообменных мембран МА-41 и МК-40 предполагает создание каскада электродиализаторов с общим числом до трехсот 3-камерных ячеек с оснащением каждой электродными парами для реализации реакции:
Очевидная сложность как технологического решения в поддержании регламентированной работы каждой из многочисленных секций, так и конструкционного, где основным является дороговизна большого количества анодного материала и большие объемы электродных газов, возможно, могла быть снята заменой части промежуточных электродных пар биполярными мембранами, например МБ-2 для генерации OH– и Н+ для образования в примембранных камерах, соответственно, щелочи и кислоты. Это одновременно привело бы к сокращению электродных материалов и объемов электродных газов О2 и Н2.
В работе проведено сравнение эффективности рекуперации кислоты и щелочей из модельного солевого раствора, содержащего 500 г/л NaNO3, в процессе электродиализа с биполярными отечественными мембранами МБ-2 – БЭД (рис. 2) и классического электродиализа – ЭД (рис. 3).
Для предотвращения смешивания электродных газов в камерах биполярных мембран потоки анолитов и католитов разделялись на приэлектродные (1, 6) и примембранные (3, 4) по схеме, представленной на рис. 2. Соответственно, приэлектродные Va-1 и примембранные Vа-2 анолиты циркулировали по отдельным контурам, как и приэлектродные Vк-1 и примембранные Vк-2 католиты.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Техника электродиализа позволяет преимущественно извлекать из солевого раствора одновалентные ионы сильных электролитов Na+, K+, ${\text{NO}}_{3}^{ - },$ Cl– c получением смесей однокислотных щелочей (NaOH, KOH) и одноосновных кислот (HNO3, HCl). Предполагали, что в обессоливаемом растворе СК должны концентрироваться ионы более высоких валентностей и слабые электролиты, например борная кислота.
Однако, установлено, что при электродиализе, на фоне подавляющего количества одновалентных ионов (Na+, K+, ${\text{NO}}_{3}^{ - }$), в анолит и католит мигрируют и присутствующие в солевом растворе поливалентные ионы (Co2+, Fe2+, Ca2+, ${\text{SO}}_{4}^{{2 - }}$), также накапливается бор как в анолите, до 17%, так и в католите, до 9% от исходного содержания в СК.
Оригинальное технологическое решение одновременной очистки от бора и кальция, в основе которого лежит предварительное извлечение бора в отделяемый осадок бората кальция с последующим его переводом в раствор в виде борной кислоты, отделяемой от осадка сульфата кальция с получением товарных продуктов: чистой кристаллической H3BO3 (ГОСТ 18704-78, марка “А”) и гипса CaSO4·2H2O, защищено международным патентом [27]. Извлечение бора и кальция из технологических растворов составляет более 99.6%.
Электродиализная рекуперация кислот и щелочей из предварительно очищенных технологических растворов
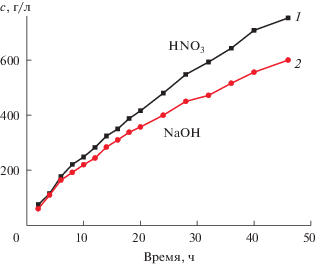
Очищенный маточный раствор примерного состава, г/л: 146.2 Na+, 13.6 K+, 0.03 Co2+, <0.01 Fe2+, 0.087 Ca2+, 305.5 ${\text{NO}}_{3}^{ - },$ 2 Cl–, 0.5 ${\text{SO}}_{4}^{{2 - }},$ 1 ${\text{BО}}_{3}^{ - },$ подвергают электродиализу в трехкамерном электродиализаторе с анионо- и катионообменными мембранами. Представленные кинетические изменения концентраций рекуперированных HNO3 и NaOH (рис. 4) показывают возможность концентрирования электродиализным методом кислоты до 750 г/л HNO3, а щелочи – 600 г/л NaOH. Быстрейшему достижению наибольшего концентрирования рекуперируемых реагентов способствует сокращение скорости потоков анолита Va и католита Vк относительно солевого раствора средней камеры Vск, выраженное в объемах циркулирующих растворов: Vск : Va = = 1 : 0.5–1.0 и Vск : Vк = 1 : 0.4–0.6 и т.п.
В табл. 2 представлены характеристики обессоленного раствора и рекуперированных реагентов. Предварительное снижение примесных элементов в солевом растворе приближает составы рекуперированных растворов кислоты и щелочи к составу закупаемых реагентов: 57% HNO3 (ГОСТ Р 53789–2010) и натрия едкого технического NaOH (ГОСТ 2263–79), а обессоленный раствор – к технической воде.
Таблица 2.
Состав очищенного технологического раствора и продуктов его электродиализной переработки: обессоленного раствора и рекуперированных растворов HNO3 и NaOH с KOH
| Компоненты | Содержание, г/л, в продуктах электродиализа | |||
|---|---|---|---|---|
| исходный раствор | обессоленный | анолит (HNO3) | католит (NaOH с KOH) | |
| Na+ | 146.2 | 0.093 | – | 270 (469.6 г/л NaOH) |
| K+ | 13.6 | 0.0034 | – | 26 (37 г/л KOH) |
| Ca2+ | 0.087 | 0.031 | – | 0.032 |
| Fe2+ | 0.01 | 0.002 | 0.001 | 0.0008 |
| ${\text{NO}}_{3}^{ - }$ | 305.5 | 4.93 | 653 (664 г/л HNO3) | – |
| ${\text{SO}}_{4}^{{2 - }}$ | 0.5 | 0.04 | 1.3 | – |
| Cl– | 2 | 0 | 0 | – |
Проведение электродиализа при плотностях тока 5–15 А/дм2 и напряжении 4–10 В обеспечивает извлечение из солевого раствора более 99% целевых ионов (Na+, K+, ${\text{NO}}_{3}^{ - }$) с выходом по току около 50–70% при удельном расходе электроэнергии до 7.5 кВт ч/кг.
Однако концентрирование рекуперируемых реагентов в периодическом процессе протекает на фоне истощения солевого раствора СК, что сопровождается понижением эффективности электродиализа в течение процесса. Так, извлечение в анолит С = 96% нитрат-ионов с образованием кислоты и 90% катионов натрия и калия с образованием в католите щелочного раствора протекает с постепенным снижением скорости миграции, например нитрат-ионов от Q = 1.25 до 0.63 кг/(м2 ч) и с соответствующим снижением ВТ (рис. 5). При этом ВТ по HNO3 падает от 100 до 53%.
Исследуемый процесс электродиализной рекуперации кислот и щелочей подчиняется общим закономерностям электродиализа. Эффективности электродиализа способствуют повышение в солевом растворе концентрации целевых компонентов (Na+, K+, ${\text{NO}}_{3}^{ - }$) и снижение остальных, примесных. Повышение плотности тока способствует увеличению производительности процесса, но, как известно, сопровождается снижением ВТ вследствие развития побочных процессов.
Поэтому для поддержания приемлемого выхода по току работа с истощаемыми солевыми растворами требует снижения, например, плотности тока, а также повышения массообмена путем ускорения циркуляции потоков. Рациональным является поэтапное осуществление электродиализного процесса в каскаде электродиализаторов, работающих с солевыми растворами понижающейся, но поддерживаемой на каждом каскаде постоянной концентрации, например: 500, 250, 50 г/л NaNO3 и т.д.
Поскольку мигрирующие через мембраны ионы переносятся с гидратной оболочкой, в которой количество воды обусловлено рядом факторов от свойств мембраны до типа ионов, состава электролитов и силы тока, то процесс электродиализа при этом сопровождается убылью объема обессоливаемого раствора средней камеры. При этом объемы анолита и католита повышаются, но с учетом разряда воды на электродах при образовании газообразных кислорода на аноде и водорода на катоде. Средний перенос воды в исследуемом процессе с нитрат-ионами через МА-40 составляет 0.25 моль H2O/моль HNO3, а с катионами натрия и калия через мембрану МК-40 – до 2.5 моль H2O/моль NaOH.
В табл. 3 представлены сравнительные результаты электродиализа модельного раствора 500 г/л NaNO3 с плотностью тока 15 А/дм2 при использовании различных мембранных пар. Сочетание отечественных мембран МА-40 с МК-40 при прочих равных условиях обеспечивает высокое концентрирование как кислоты (840 г/л HNO3), так и щелочи (более 360 г/л NaOH) с производительностью 1.1 и 0.96 кг/(м2 ч) соответственно. Аналогичным образом проявляет себя в паре с МК-40 и мембрана МА-41, разработанная для окислительных сред, какой и является азотнокислый анолит: концентрированная азотная кислота в смеси с выделяющимся на аноде кислородом.
Таблица 3.
Концентрирование HNO3 и NaOH и производительность их рекуперации от типа пар ионообменных мембран при плотности тока 15 А/дм2. [NaNO3]0 = 500 г/л, Vск : Va = 1 : 0.5, Vск : Vк = 1 : 0.8
| Мембранная пара | U, В | Анолит – HNO3 | Католит – NaOH | ||
|---|---|---|---|---|---|
| [HNO3], г/л | Q, кг/(м2 ч) | [NaOH], г/л | Q, кг/(м2 ч) | ||
| МА-40, МК-40 | 7.8 | 840 | 1.10 | 360 | 0.96 |
| МА-40, МФ-4СК | 7.6 | 858 | 1.23 | 292 | 0.95 |
| МА-40, СМН-PAD | 5.9 | 513 | 1.15 | 292 | 0.93 |
| МА-41, МК-40 | 8.1 | 832 | 1.28 | 348 | 1.00 |
| МА-41, МФ-4СК | 8.5 | 760 | 1.12 | 264 | 1.00 |
| AМН-PAD, МК-40 | 7.5 | 620 | 1.09 | 280 | 0.87 |
| AМН-PES, МК-40 | 6.1 | 787 | 1.09 | 308 | 0.88 |
Транспортные свойства мембран фирмы MEGA соизмеримы с отечественными. Их использование может обеспечить несколько меньшее падение напряжения на электродиализаторах. Однако в работе предпочтения отданы использованию доступных отечественных мембран.
Исследование массообменных процессов в электродиализаторе с биполярными мембранами
Провели рекуперацию кислоты и щелочей из модельного солевого раствора, содержащего 500 г/л NaNO3, в процессе электродиализа с биполярными мембранами (МБ-2), по схеме, приведенной на рис. 2.
Вследствие высокого сопротивления биполярной мембраны в рамках экспериментальных возможностей удалось развить невысокую плотность тока 1.7 А/дм2 при значительном напряжении на электродиализаторе 40 В. При этом протекание БЭД сопровождалось ростом воздушной подушки в верхней части примембранных камер, что закончилось разрывом МБ-2 в верхней ее части (рис. 6), перетеканием и смешиванием анолита (HNO3) с католитом (NaOH), вследствие чего процесс рекуперации из-за нейтрализации потоков прекращался. Разрыв МБ-2, произошел вследствие повышенной плотности тока, подаваемой в ячейку.
При снижении плотности тока от 1.7 до 1.3 А/дм2 удалось избежать разрыва биполярных мембран в пределах опытов и достигнуть концентрирования реагентов несколько большего в приэлектродных и меньшего в примембранных потоках (табл. 4). Пониженная плотность тока (1.3 А/дм2) при повышенном падении напряжения на БЭД (22 В) обуславливает низкую производительность процесса 0.11 кг/(м2 ч) при значительном расходе электроэнергии – 30 кВт ч/кг с выходом по току 23.9%. При этом как анолиты, так и католиты в значительной мере оказываются загрязнены, особенно в примембранных камерах. Причем загрязнение нарастает с самого начала процесса. Так, раствор 79.6 г/л HNO3 в приэлектродной камере может содержать 3% Na3+, а раствор 54.3 г/л HNO3 в примембранной камере содержит 12.3% Na3+. Аналогичным образом и щелочные растворы могут содержать от 12.9 до 99.4% нитрат-ионов. Подобные продукты не удовлетворяют задачам переработки отходов ни по составу, ни по концентрации целевого компонента.
Таблица 4.
Сравнительные характеристики процессов БЭД и ЭД рекуперации HNO3 и NaOH из растворов NaNO3 различной исходной концентрации
| i, А/дм2 | U, В | [NaNO3]0, г/л | Анолит HNO3, | Католит NaOH, | Q, кг/(м2 ч) | W, кВт ч/кг | ВТ, % | ||
|---|---|---|---|---|---|---|---|---|---|
| г/л | Na+, % | г/л | ${\text{NO}}_{3}^{ - }$, % | ||||||
| БЭД | |||||||||
| Va-1 | Vк-2 | ||||||||
| 1.7 | 46 | 500 | 123.8 | 2.0 | 16 | 99.4 | 0.30 | 24.7 | 81.7 |
| Va-2 | Vк-1 | ||||||||
| 17.7 | 82.5 | 104 | 12.9 | ||||||
| Va-1 | Vк-2 | ||||||||
| 1.3 | 22 | 250 | 79.6 | 3.0 | 36 | 55.1 | 0.11 | 30 | 23.9 |
| Va-2 | Vк-1 | ||||||||
| 54.3 | 12.3 | 60 | 15.4 | ||||||
| ЭД | |||||||||
| 11.5 | 5.2 | 500 | 433 | 0.18 | 386 | 0.73 | 0.45 | 4.0 | 50.8 |
| 17.2 | 5.6 | 250 | 469 | 0.07 | 244 | 0.22 | 0.48 | 6.3 | 41.5 |
| 11.5 | 7.9 | 50 | 106 | 0.17 | 58 | 0.41 | 0.60 | 4.5 | 67.1 |
Результаты электродиализа с биполярной мембраной подтверждают известные ограниченные возможности БЭД. Это невысокие скорости процесса из-за повышенного сопротивления МБ-2.
Исследование массообменных процессов в электродиализаторе с монополярными мембранами
Провели рекуперацию кислоты и щелочей из модельного солевого раствора, содержащего 500 г/л NaNO3, в процессе электродиализа с монополярными мембранами, по схеме, приведенной на рис. 3.
ЭД протекал по регламенту и приводил к значительному концентрированию рекуперируемых кислоты и щелочи (табл. 4). Представленные данные по рекуперации показывают возможность концентрирования кислоты до 433 г/л HNO3, а щелочи – до 386 г/л NaOH, что не является пределом. Показано, что электродиализ при плотности тока 11.5 А/дм2 и напряжении 5.2 В обеспечивает извлечение из солевого раствора более 99% нитрат-ионов с выходом по току около 51%. При этом проточная диффузия через мембрану МА-41 катионов Na+ в анолит не превышает 0.18% относительно концентрации в нем HNO3, а ${\text{NO}}_{3}^{ - }$ через МК-40 в католит – не превышает 0.73% относительно содержания в нем NaOH.
Более высокая концентрация как кислоты, так и щелочи может быть получена при проведении процесса электродиализа ЭД в режиме циркуляции растворов при пропускании солевого раствора через набор мембран с регулированием потоков анолита и католита относительно объема солевого раствора. Не исключается также вывод и упаривание растворов кислоты и щелочи в выпарных аппаратах. На лабораторной установке опробован непрерывный процесс получения из раствора 500 г/л NaNO3 реагентов HNO3 и NaOH с концентрацией около 440 г/л (рис. 7) за счет непрерывного слива реагентов и подпитки солевого раствора расчетным количеством соли, эквивалентным мигрирующему количеству ионов. Расчетное количество соли подавали аликвотами более концентрированного раствора с концентрацией 600 г/л NaNO3.
Рис. 7.
Кинетика изменения концентрации HNO3 (1, 3, 5) и NaOH (2, 4, 6) при ЭД раствора NaNO3 с плотностью тока, А/дм2: 5 (1, 2); 10 (3, 4) в периодическом и 15 (5, 6) в проточном режиме, начиная от 16 ч.

Характер кривых (рис. 7, кривые 5, 6) указывает на возможность стабильного получения реагентов заданной концентрации при подпитке солевого раствора либо солью, либо солевым раствором. При плотности тока 15 А/дм2 выход по току при этом составлял 64%, расход электроэнергии – 9 кВт ч/кг в электродиализаторе с единичной мембранной поверхностью 0.2 дм2 и объемом камер 0.02 дм3.
Таким образом, для получения высококонцентрированных кислот и щелочей использованию ЭД нет альтернативы. Отягощающими факторами остаются объемы платиносодержащих анодов и электродных газов, подлежащих раздельному удалению для избегания взрывоопасности.
Использование БЭД может быть оправдано пониженными требованиями к концентрированию реагентов, где это возможно. Встречающиеся в литературе концентрации рекуперированных реагентов менее 0.5 моля нуждаются в оптимизации для конкретных технологий и использовании ассиметричных биполярных мембран для снижения физической миграции коионов.
ЗАКЛЮЧЕНИЕ
Исследован процесс рекуперации азотной кислоты и смеси щелочей NaOH и KOH из концентрированных солевых растворов от водорастворимых отходов атомной электростанции методом электродиализа.
Установлена необходимость предварительной очистки технологических растворов от соединений кальция и бора, которая решается получением кристаллической борной кислоты H3BO3 и гипса CaSO4·2H2O [27].
Показано, что в пределах одной и той же геометрии электрохимической ячейки и возможностей источника питания плотность тока, а следовательно, скорость процесса при электродиализе с монополярными мембранами можно было установить на порядок выше, чем при электродиализе с биполярными мембранами с меньшим напряжением на каскаде: 11.5 А/дм2 против 1.7 и 5.2 В против 46. Кинетика концентрирования реагентов при электродиализе с биполярными мембранами значительно отстает от электродиализа с монополярными мембранами, особенно в примембранных камерах, в которых наблюдается нарастающее во времени значительное загрязнение электролитов.
Показана возможность получения из очищенных концентрированных солевых растворов кислоты и щелочей с концентрациями более 300–600 г/л, пригодных для повторного использования в технологическом цикле атомной электростанции. При этом обессоленный раствор, содержащий около 1% примесей, близок к составу технической воды и может быть использован в производственном цикле.
Действительными отходами технологии являются кислород и водород, удаляемые в атмосферу через систему раздельной вентиляции.
Список литературы
Niftaliev, S.I., Kozaderova, O.A., and Kim, K.B., Electroconductance of heterogeneous ion-exchange membranes in aqueous salt solutions, J. Electroanal. Chem., 2017, vol. 794, p.58.
Ferella, F., Michelis, I.De., and Veglio, F., Process for the recycling of alkaline and zinc-carbon spent batteries, J. Power Sourses, 2008, № 1, p. 78.
Jaroszek, H. and Dydo, P., Ion-exchange membranes in chemical synthesis—a review, Open Chem., 2016, vol. 14(1), p. 1.
Meng, H., Li, H., Li, Ch., and Li, L., Synthesis of ionic liquid using a four-compartment configuration electrodialyzer, J. Membr. Sci., 2008, vol. 318, p. 1.
Bai, L., Wang, X.L., Nie, Y., Dong, H.F., Zhang, X.P., and Zhang, S.J., Study on the recovery of ionic liquids from dilute effluent by electrodialysis method and the fouling of cation-exchange membrane, Sci. China Chem., 2013, vol. 56, p. 1811.
Li, H., Meng, H., Li, C., and Li, L., Competitive transport of ionic liquids and impurity ions during the electrodialysis process, Desalination, 2009, vol. 245, p. 349.
Forquet, V., Sabaté, C.M., Jacob, G., Guelou, Y., Delalu, H., and Darwich, C., Energetic 2, 2-Dimethyltriazanium Salts: A New Family of Nitrogen-Rich Hydrazine Derivatives, Chem. Asian J., 2015, vol. 10, p. 1668.
Rózsenberszki, T., Komáromy, P., Kőrösi, E., Bakonyi, P., Nemestóthy, N., and Bélafi-Bakó, K., Investigation of Itaconic Acid Separation by Operating a Commercialized Electrodialysis Unit with Bipolar Membranes, Processes, 2020, vol. 8(9), p. 1031.
Melnikov, S., Bondarev, D., Nosova, E., Melnikova, E., and Zabolotskiy, V., Water Splitting and Transport of Ions in Electromembrane System with Bilayer Ion-Exchange Membrane, Membranes, 2020, vol. 10(11), p. 346.
Nir, O., Sengpiel, R.G., and Wessling, M., Closing the cycle: Phosphorus removal and recovery from diluted effluents using acid resistive membranes, Chem. Eng. J., 2018, vol. 346, p. 640.
Gurreri, L., Tamburini, A., Cipollina, A., and Micale, G., Electrodialysis, Applications in Wastewater Treatment for Environmental Protection and Resources Recovery: A Systematic Review on Progress and Perspectives, Membranes, 2020, no. 10, p. 146.
Shi, L., Hu, Y., Xie, S., Wu, G., Hu, Z., and Zhan, X., Recovery of nutrients and volatile fatty acids from pig manure hydrolysate using two-stage bipolar membrane electrodialysis, Chem. Eng. J., 2018, vol. 334, p. 134.
Patel, A., Mungray, A.A.K., and Mungray, A.A.K., Technologies for the recovery of nutrients, water and energy from human urine: A review, Chemosphere, 2020, vol. 259, p. 127372.
Melnikova, E.D., Pismenskaya, N.D., Bazinet, L., Mikhaylin, S., and Nikonenko, V.V., Effect of ampholyte nature on current–voltage characteristic of anion-exchange membrane, Electrochim. Acta, 2018, vol. 285, p. 185.
Rybalkina, O., Tsygurina, K., Melnikova, E., Mareev, S., Moroz, I., Nikonenko, V., and Pismenskaya, N., Partial fluxes of phosphoric acid anions through anion-exchange membranes in the course of NaH2PO4 solution electrodialysis, Int. J. Mol. Sci., 2019, vol. 20, p. 593.
Melnikov, S., Kolot, D., Nosova, E., and Zabolotskiy, V., Peculiarities of transport-structural parameters of ion-exchange membranes in solutions containing anions of carboxylic acids, J. Memb. Sci., 2018, 557, p. 1.
Чечельницкий, Г.М., Рабинович, С.М., Синявский, П.Н., Ким, В.В., Терещенко, Л.И., Бессонов, О.В. Способ обработки жидких радиоактивных отходов АЭС с борным регулированием. Пат. 2012076 (Россия), 1994. [Chechelnitskiy, G.M., Rabinovich, S.M., Sinyavskiy, P.N., Kim, V.V., Tereshchenko, L.I., and Bessonov, O.V., Method for processing liquid radioactive waste from nuclear power plants with boron regulation, Pat. 2012076 (Russia), 1994.]
Vladimirov, V.A., Method and installation for the treatment of a radioactive wastes, Pat. 7323613 (USA), 2004.
Седнева, Т.А., Тихомирова, И.А. Электромембранное концентрирование фтористоводородной кислоты. Критические технологии. Мембраны. 2004. № 1. С. 35. [Sedneva, T.A. and Tikhomirova, I.A., Electromembrane concentration of hydrofluoric acid. Critical Technologies, Membranes (in Russia), 2004, no. 1, p. 35.]
Sedneva, T.A. and Lokshin, E.P., Electromembrane Hydrolysis of Cerium and Lanthanum Nitrates, Petroleum Chem., 2012, vol. 52, no. 7, p. 533.
Локшин, Э.П., Тареева, О.А., Седнева, Т.А. Способ переработки фторсодержащего апатитового концентрата, Пат. 2650923 (Россия), 2018. [Lokshin, E.P., Tareeva, O.A., and Sedneva, T.A., Method for processing fluorine-containing apatite concentrate, Pat. 2650923 (Russia), 2018.]
Седнева, Т.А., Локшин, Э.П. Электромембранный гидролиз нитратов церия и лантана. Мембраны и мембранные технологии. 2012. Т. 2. № 2. С. 105. [Sedneva, T.A. and Lokshin, E.P., Electromembrane hydrolysis of cerium and lanthanum nitrates, Membranes and membrane technologies, 2012, vol. 2, no. 2, p. 105.]
OOO “Innovacionnoe Predprijatie Shhekinoazot” http://www.azotom.ru/bipolyarnye-membrany/ (in Russian).
AO “MEGA”, http://www.mpline.ru/oborudovanie/membrany (in Russian).
Березина, Н.П., Тимофеев, С.В., Ролле, А.Л., Федорович, Н.В., Дюран-Видаль, С. Электротранспортные и структурные свойства перфторированных мембран Нафион-117 и МФ-4СК. Электрохимия. 2002. Т. 38. С. 1009. [Berezina, N.P., Timofeev, S.V., Rolle, A.L., Fedorovich, N.V., and Durand-Vidal, S., Electrical transport and structural properties of perfluorinated membranes Nafion-117 and MF-4SK, Russ. J. Electrochem., 2002, vol. 38, p. 1009.]
Березина, Н.П., Кононенко, Н.А., Лоза, Н.В., Сычева, А.А.-Р. Исследование электрохимического поведения композитов на основе МФ-4СК и полианилина методом мембранной вольтамперометрии. Электрохимия. 2007. Т. 43. С. 1417. [Berezina, N.P., Kononenko, N.A., Loza, N.V., and Sycheva, A.A.-R., Investigation of the electrochemical behavior of composites based on MF-4SK and polyaniline by the method of membrane voltammetry, Russ. J. Electrochem., 2007, vol. 43, p. 1417.]
Ivanenko, V.I., Sedneva, T.A., Lokshin, E.P., and Korneikov, R.I. / Int. Appl. WO 2018/190751, Int. Cl. G21F 9/06, G21F 9/20 (2006.01). Method for treating liquid waste from a nuclear power plant with boron control / Joint Stock Company “Rosenergoatom”, Joint Stock Company “Science and Innovations”. – № PCT/RU2018/000179; appl. 22.03.18; publ. 18.10.18; prior. 12.04.17, № 2017112521/07 (RU).
Дополнительные материалы отсутствуют.