Электрохимия, 2022, T. 58, № 4, стр. 153-159
Влияние морфологии углеродного материала на кислородную реакцию в неводном электролите, содержащем ионы лития
А. В. Кузов a, *, В. А. Богдановская a, **, В. В. Емец a, В. Н. Андреев a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: scourge@mail.ru
** E-mail: bogd@elchem.ac.ru
Поступила в редакцию 20.04.2021
После доработки 08.07.2021
Принята к публикации 16.09.2021
- EDN: ZGJVRE
- DOI: 10.31857/S0424857022040077
Аннотация
Методом циклической вольтамперометрии (ЦВА) определены характеристики углеродных материалов, различающихся величиной удельной поверхности и пористостью, при исследовании в электролите 0.25 М LiClO4/ДМСО в инертной атмосфере и в атмосфере кислорода. Показано, что величина электрохимически активной поверхности, за оценку которой принимали поляризационную емкость на ЦВА в инертной атмосфере, растет с увеличением удельной поверхности по БЭТ. Эффективность в кислородной реакции, измеренная в атмосфере кислорода, выражающаяся в виде количества электричества, пошедшего на образование Li2O2 (QК) в реакции восстановления кислорода (катодный участок), и обратимость процесса, как отношение количества электричества пошедшего на выделение кислорода (QА) (анодный участок) к QК, в значительной степени определяется величиной электрохимически активной поверхности и пористостью углеродного материала.
ВВЕДЕНИЕ
При разработке положительных электродов Li–O2-источников тока рассматриваются различные виды углеродных материалов (УМ): сажи, углеродные нанотрубки, волокна, графены и другие, характеризующиеся различной величиной удельной поверхности и пористой структурой [1, 2]. Для обеспечения наибольшей площади электрохимически активной поверхности катода предпочтительно использование высокодисперсных материалов. Углеродные материалы наиболее близки к оптимуму благодаря доступности, низкой стоимости и возможности формирования заданной структуры.
При восстановлении кислорода на положительном электроде литий-кислородного источника тока, в данном случае функционирующего как катод, происходит накопление твердого Li2O2, который блокирует активную поверхность электрода и снижает свободный объем и поверхность пор. В конечном счете, это приводит к закупорке пор и нарушению транспорта кислорода, осложняет перенос ионов лития и электронов, понижая в значительной степени емкость источника тока в целом. Для достижения характеристик Li–O2-источников тока, близких к теоретическим значениям, необходимо поддержание оптимальных транспортных режимов. Именно поэтому понимание влияния структуры используемых углеродных материалов на характеристики положительного электрода является одним из ключевых вопросов.
Взаимосвязь разрядной емкости и структуры положительного электрода была исследована в ряде апротонных растворителей (ДМЭ, тетраглим, ДМСО и др.) [2–6]. Мэйни с коллегами [4] установили взаимосвязь удельной разрядной емкости с величиной поверхности углеродных материалов. В противовес им, Червин с коллегами [5] показали, что макропористые нанопены (диаметр пор 50–200 нм), несмотря на их меньшую удельную поверхность, показывают вдвое большую емкость по сравнению с мезопористыми (5–50 нм). Динг с коллегами установили [2], что разрядная емкость не имеет существенной зависимости от удельной поверхности углеродных материалов или объема пор, а определяется лишь размером этих пор. Тан с коллегами [8] представили результаты испытания композитного катода, состоящего из сажи и нанотрубок. Показано, что такая система обладает большей емкостью по сравнению с катодами на основе одной лишь сажи, несмотря на то, что в случае смеси величина удельной поверхности снижается. Этот эффект авторы объясняют улучшением транспорта кислорода в случае материала с порами большего размера. Как видно, в вопросе о влиянии величины поверхности и пористости углеродных материалов на характеристики Li–O2-источников тока пока нет единого мнения.
Помимо размера пор и занимаемого ими объема, по-видимому, значительное влияние на характеристики источника тока также оказывает распределение размеров пор по толщине активного слоя положительного электрода. Реакция восстановления кислорода в электролите, содержащем Li+, в самом общем виде может быть записана как:
В процессе разряда концентрация кислорода в объеме пористого катода снижается от области подачи газа к области контакта катода с электролитом. Более высокая концентрация кислорода обеспечивает образование большего количества Li2O2. Таким образом, количество образующегося твердого пероксида лития в катодном слое будет выше со стороны подачи O2, снижаясь к месту контакта с электролитом. Это подтверждено экспериментально [7] и при теоретическом моделировании [8–10]. При таком ходе накопления твердого продукта, очевидно, что большая часть пор со стороны подачи кислорода окажется заблокированной, что неизменно скажется на снижении разрядной емкости аккумулятора в целом. Тонкие катоды при этом не будут решением проблемы, так как они не обеспечат высокой величины электрохимически активной поверхности, а следовательно, и значительного количества Li2O2. Рассмотренный сценарий позволяет предполагать целесообразным формирование толстых катодных слоев с размерами пор, снижающимися от стороны подачи кислорода к электролиту. Это возможно, например, при послойном изготовлении с использованием углеродных материалов разной пористости, а также их смесей. Вероятно, что такой подход обеспечит более равномерное и стабильное распределение кислорода, что благоприятно отразится на разрядной емкости источника тока.
Повышение скорости токообразующих реакций и снижение их перенапряжения имеет существенное значение для успешного осуществления полного цикла разряд/заряд Li–O2-аккумуляторов. По сравнению, например, с Н2–О2-топливным элементом, выбор катализаторов для Li–O2-источников тока является более сложной задачей, так как электродные материалы положительного электрода должны обеспечивать электрокатализ как восстановления кислорода в присутствии Li+, так и реакции выделения кислорода. Различными исследователями предлагаются как бифункциональные системы [11], так и комбинированные электроды, состоящие из двух независимых электродов [12, 13]. Далее рассматриваются углеродные материалы, модифицированные металлами. Здесь же важно отметить, что вопрос стабильности материалов положительного электрода имеет первостепенное значение для Li–O2-источников тока, особенно при их циклировании – разряд/заряд.
В качестве бифункциональных катализаторов положительного электрода в неводных электролитах предложено модифицирование УМ различными металлами, такими как Pt [14], Au [15], Pd [16], Co [17] и другие. Рассматриваются оригинальные идеи структурного исполнения пары металл–углеродный носитель. Например, Хуанг с коллегами [18] разработали систему, где в торцы углеродных нанотрубок (УНТ) помещали наночастицы Pt, Pd, Ru и Au. Такие катодные материалы демонстрировали существенное снижение перенапряжения при заряде литий-кислородного аккумулятора (ЛКА) по сравнению с их аналогами, представляющими металлы, нанесенные на поверхность УНТ. В работе [19], посвященной дисперсным катодным системам типа M1/С, М1М2/С (где М1 и М2 – металлы, а С – углеродный материал), а также оксидам и различным комбинированным катализаторам, показано, что по сравнению с использованием только УМ каталитический эффект таких систем проявляется в некоторой степени преимущественно при заряде и мало выражен или отсутствует для электровосстановления кислорода в присутствии Li+.
Несмотря на большое количество работ, посвященных рассматриваемой теме, механизмы токообразующих процессов заряда и разряда в Li–O2-источниках тока изучены еще недостаточно полно и не всегда интерпретация получаемых данных представляется однозначной. Использование только поляризационных кривых, очевидно, является важным, но недостаточным инструментом для понимания путей реакций и характера протекающих процессов. Так в работе [20] использовали дифференциальную электрохимическую масс-спектрометрию (ДЭМС) для изучения процессов заряда. Было показано, что модифицирование драгоценными металлами (такими, как Pt, Ru и др.) не приводит к ожидаемому ускорению процесса. Вместо повышения эффективности реакции выделения кислорода, они способствуют выделению СО2 в результате деградации углеродного материала, снижая тем самым обратимость. Это однозначно указывает на необходимость исследования более широкого круга каталитических систем для объективной оценки их влияния на процессы, протекающие на положительном электроде ЛКА.
Преимуществами углеродных материалов в Li–O2-источниках тока являются высокая удельная поверхность, пористая структура, активность и несомненная экономическая привлекательность. При этом необходимо учитывать, что они находятся в агрессивной окислительной среде и подвержены влиянию продуктов разряда Li2O2, что может привести к их разрушению [21]. В работе [22] показано, что углеродные материалы стабильны при потенциалах ниже 3.5 В, и их деградация наблюдается на стадии заряда при более высоких потенциалах (~4.0 В).
Целью настоящей работы является исследование эффективности УМ в качестве материалов активного слоя (АС) положительного электрода различной морфологии в 0.25 М LiClO4/ДМСО-электролите, а также установление взаимосвязи их структурных характеристик с активностью при восстановлении/выделении кислорода.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследования выполнены в электролите на основе растворителя ДМСО и соли лития LiClO4 при ее концентрации 0.25 М. Безводную соль LiClO4 перед приготовлением электролита дополнительно сушили в вакуумном шкафу при 80°С. Измерения проводили при 20°С, в герметичной стеклянной трехэлектродной ячейке на стационарном дисковом электроде из стеклоуглерода с диаметром рабочей поверхности 4.0 мм (0.126 см2). Перед проведением измерений ячейку тщательно сушили, продували аргоном и заполняли электролитом в сухом боксе, после чего проводили измерения на воздухе. Содержание воды в электролитах, определенное методом Фишера, не превышало 100 ppm. В качестве электрода сравнения использовали серебряную проволоку, погруженную в раствор 0.01 М AgNO3. Для определения потенциала рабочего электрода относительно пары Li/Li+, Ag/Ag+ электрод сравнения калибровали в ДМСО относительно литиевого электрода. Калибровку электрода проводили, используя серебряную проволоку, помещенную в раствор 0.01 М AgNO3, и литий, находящийся в ДМСО, содержащем 0.25 М LiClO4. Электроды соединяли при помощи электролитического мостика, заполненного раствором, содержащим соль лития. Измерения проводили в сухом боксе. В выбранных условиях потенциал серебряного электрода составляет: ЕAg/Ag+ = 3.58 В (Li/Li+). Это значение использовали для пересчета измеренного относительно Ag/AgNO3 потенциала рабочего электрода в шкалу Li/Li+-электрода сравнения.
Исследование выполнено на коммерческих углеродных материалах (УМ): сажи (Super P, ХС72, EC600JD), углеродные нанотрубки (УНТ, Тамбов, “Таунит-М”) и углеродные наночешуйки (УНЧе). Подробное описание синтеза и структуры УНЧе приведено в [23]. Перечисленные углеродные материалы отличаются как размерами пор, так и величиной удельной поверхности, которые оценивали по методу БЭТ для новых материалов (УНТ и УНЧе), для коммерческих образцов использовали сведения, представленные в литературе [24].
Для нанесения на электрод исследуемых дисперсных материалов готовили “чернила” – суспензию порошка УМ 2 мг в изопропиловом спирте (500 мкл во всех случаях). Равномерности нанесения суспензии на электрод способствует введение 0.03 мл разбавленного в 10 раз 5%-ного раствора Nafion в смеси низкомолекулярных алифатических спиртов (Aldrich). Суспензию обрабатывали ультразвуком в ваннах в течение 30–40 мин. Нанесение на электрод осуществляли микропипеткой (4 мкг образца УМ в 1 мкл). Сушили электроды на воздухе. Количество образца на электроде при таком методе нанесения составляет 100 мкг/см2.
Измерения проводили при температуре 20°С в электролите 0.25 М LiClO4/ДМСО. ЦВА записывали в растворе, деаэрированном аргоном в течение 30 мин со скоростью наложения потенциала 50 мВ/с. По количеству электричества, характеризующего поляризационную емкость, определенного интегрированием анодной области ЦВА, оценивали величину электрохимически активной поверхности углеродных материалов (SЭАП, мКл/см2). Затем раствор насыщали кислородом в течение 30 мин и записывали вольт-амперные кривые в интервале 2.0–4.0 В (Li/Li+) со скоростью наложения потенциала 5 мВ/с. Для расчета количества электричества, пошедшего на восстановление и окисление, участки под кривыми (прямой и обратный ход) интегрировали отдельно, а затем суммировали Q и получали величины ΣQК, ΣQА. Степень обратимости кислородной реакции оценивали по отношению величин ΣQА/ΣQК. Более подробно схема расчетов и их описание приведены в работе [24].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
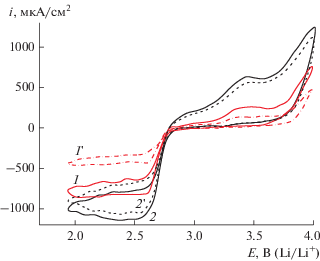
Величину электрохимически активной поверхности углеродных материалов (SЭАП) оценивали из ЦВА для саж Super P, ХС72, EC600JD, а также для УНТ и УНЧе. На рис. 1 приведен пример ЦВА, а на рис. 2 величины электрохимически активной поверхности и данных БЭТ для всех рассматриваемых УМ.
Рис. 1.
ЦВА на различных углеродных материалах, 50 мВ/с, 20°С, 0.25 М LiClO4/ДМСО, атмосфера Ar. Количество УМ на электроде 100 мкг/см2.
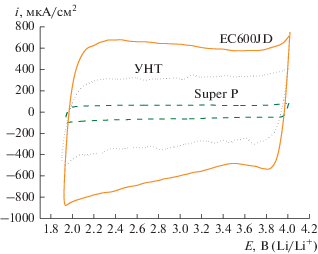
Рис. 2.
Количество электричества, определенное из ЦВА, относительно величины поверхности по БЭТ. 20°С, 0.25 М LiClO4/ДМСО, атмосфера Ar. Количество УМ на электроде 100 мкг/см2.
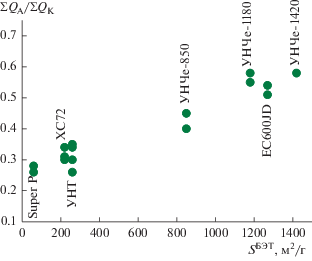
Величина удельной поверхности по БЭТ исследованных образцов сопоставлена с количеством электричества, определенным путем интегрирования ЦВА. С ростом величины поверхности по БЭТ в ~20 раз (от 60 до 1270 м2/г) при переходе от сажи Super P к EC600JD наблюдается повышение SЭАП ~10 раз, это свидетельствует о неполном использовании величины удельной поверхности УМ. Не вся удельная поверхность УМ проявляет электрохимическую активность в силу неоднородности лиофильно-лиофобных свойств внутренней поверхности пористых образцов. Вероятно, не все участки равноценно смачиваются электролитом, что и приводит к неравнозначному росту SЭАП с ростом SБЭТ. Кроме того, из-за различий в плотности углеродных материалов толщины нанесенного слоя (100 мкг/см2) отличаются, что вносит свой вклад в величину электрохимически активной поверхности при измерениях со скоростью развертки потенциала в 50 мВ/с.
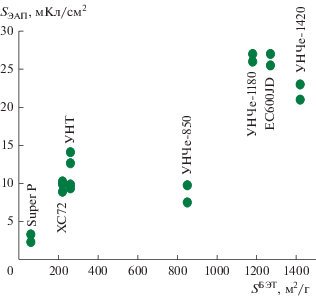
Поляризационные кривые кислородной реакции, полученные в атмосфере кислорода на УМ, представлены на рис. 3. В табл. 1 приведены сводные результаты проведенных исследований. Сажа Super P состоит из цепочек сфероидов размерами ~40 нм, объемный слой которых образует открытые структуры с размерами макропор до 500 нм. Удельная поверхность Super P при этом наименьшая среди рассматриваемых УМ и составляет 60 м2/г [25]. Для УНЧе с удельной поверхностью по БЭТ выше 1200 м2/г возрастает доля объема, представленного микропорами, что также отмечено в [23], поэтому далее в качестве основного образца использовали УНЧе с поверхностью 1180 м2/г.
Рис. 3.
Восстановление кислорода на различных УМ, 5 мВ/с, 20°С, 0.25 М LiClO4/ДМСО, атмосфера О2. Количество УМ на электроде 100 мкг/см2.
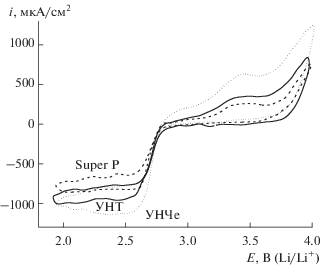
Таблица 1.
Характеристики УМ в 0.25 М LiClO4/ДМСО
| Углеродный материал | Поверхность по БЭТ, м2/г | Размер пор, нм | SЭАП,* мКл/см2 | ΣQК, мКл/см2 | ΣQА, мКл/см2 | ΣQА/ΣQК |
|---|---|---|---|---|---|---|
| Super P | 60 | >40 | 2.5 | 175 | 50 | 0.26 |
| ХС72 | 220 | <10 | 10 | 250 | 85 | 0.34 |
| УНТ-Т | 260 | 30–80 | 9 | 280 | 84 | 0.30 |
| УНЧе | 850 | 10–35 | 9 | 228 | 90 | 0.42 |
| 1180 | 8–35 | 27 | 301 | 178 | 0.59 | |
| 1420 | 4–20 | 21 | 229 | 132 | 0.58 | |
| ЕС600JD | 1270 | 4–12 | 27 | 250 | 130 | 0.54 |
Величина обратимости (ΣQА/ΣQК) представлена на рис. 4 в зависимости от величины удельной поверхности углеродных материалов. С возрастанием удельной поверхности УМ по БЭТ в 6 раз наблюдается рост обратимости в среднем в 2 раза. Повышение обратимости с ростом величины удельной поверхности связано, по-видимому, только с экстенсивным ростом площади электрохимически активной поверхности и не связано с каким-либо каталитическим эффектом. Образование Li2O2 на УМ с развитой поверхностью происходит разрозненными островками, которые окисляются на анодном ходе с меньшим перенапряжением, по сравнению с УМ с низкой удельной поверхностью, где образование Li2O2 может приводить к формированию нескольких монослоев пероксида лития и блокированию поверхности. Окисление такого слоя на анодном ходе затруднено или невозможно.
Рис. 4.
Обратимость (ΣQA/ΣQK) кислородной реакции на различных УМ; 20°С, 0.25 М LiClO4/ДМСО, атмосфера О2. Количество УМ на электроде 100 мкг/см2.
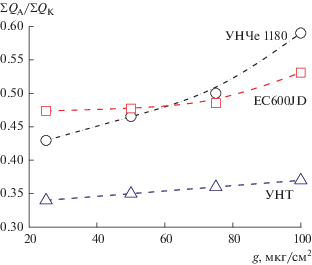
Подтверждением этого предположения может служить зависимость величины ΣQA/ΣQK от количества УМ на электроде в диапазоне 25–100 мкг (рис. 5). При сопоставлении мезопористого образца средней поверхности (УНТ) с микро- и мезопористыми материалами с большой поверхностью (УНЧе и EC600JD), при увеличении загрузки характер роста ΣQA/ΣQK различен. Повышение загрузки УНТ в 4 раза приводит к незначительному росту обратимости. Аналогичный эффект наблюдается и для EC600JD, не вся удельная поверхность которого, представленная объемом микропор, является электрохимически активной. В случае УНЧе повышение загрузки в 4 раза приводит к росту обратимости на 60–70%. Согласно результатам БЭТ и [23], более 50% объема пор УНЧе отвечает размерам 10–35 нм, что, по-видимому, и позволяет внутреннему объему более полно участвовать в электрохимической реакции. С другой стороны, для рассматриваемых углеродных материалов величина QК различается не столь существенно, как показатель ΣQA/ΣQK, который ощутимо увеличивается именно с ростом SЭАП. Вероятно, в тех случаях, когда не вся SЭАП закрыта Li2O2 и имеются участки для переноса электрона, создаются более благоприятные условия для снижения перенапряжения реакции окисления пероксида лития.
Рис. 5.
Зависимость обратимости реакции ΣQA/ΣQK с увеличением количества УМ на электроде. 20°С, 0.25 М LiClO4/ДМСО, атмосфера О2.
Применение катодов с повышенными загрузками углеродных материалов оправдано целью достижения больших габаритных токовых показателей. Однако, в силу образования побочных продуктов (Li2O2, LiO2, Li2CO3), использование толстых катодных слоев с микропористой структурой чревато быстрым исключением микропор из работы из-за их закупорки Li2O2. На рис. 6 сопоставлены первые и пятые циклы поляризационных кривых на УНЧе и Super P. При многократном циклировании в рассматриваемом диапазоне потенциалов сажа Super P (материал с низкой величиной SЭАП) демонстрирует падение показателя обратимости ниже 0.2, в то время как для УНЧе (мезопористый материал с повышенной SЭАП) ΣQA/ΣQK сохраняет показатель выше 0.5. Очевидно, что повышенная газопроницаемость слоя в случае использования УМ с высокой удельной поверхностью и SЭАП способствует более устойчивой работе положительного электрода. Таким образом, мезопористая структура является фактором, обеспечивающим эффективный транспорт участников электрохимических реакций к активным центрам на поверхности положительного электрода (УНТ и УНЧе). При этом большая величина поверхности способствует накоплению пероксида лития в виде островков и свободных от Li2O2 участков. Благодаря этому облегчается перенос электрона в зону, где пероксид лития отсутствует, и возможно его окисление на соседних участках. В результате наблюдается уменьшение перенапряжения при заряде.
ЗАКЛЮЧЕНИЕ
Исследована активность и обратимость кислородной реакции в апротонном электролите LiClO4/ДМСО на углеродных материалах с различной величиной удельной поверхности и пористости. Среди рассмотренных материалов наиболее перспективны для дальнейших исследований углеродные нанотрубки и углеродные наночешуйки, материалы, структура которых обеспечивает более эффективное использование величины удельной поверхности.
Список литературы
Kraytsberg, A. and Ein-Eli, Y., Review on Li–air batteries – Opportunities, limitations and perspective, J. Power Sources, 2011, vol. 196, p. 886.
Ding, N., Chien, S.W., Hor, T.S.A., Lum, R., Zong, Y., and Liu, Z., Influence of carbon pore size on the discharge capacity of Li–O2 batteries, J. Mater. Chem. A., 2014, vol. 2, p. 12433.
Kim, M., Yoo, E., Ahn, W.-S., and Shim, S.E., Controlling porosity of porous carbon cathode for lithium oxygen batteries: Influence of micro and meso porosity, J. Power Sources, 2018, vol. 389, p. 20.
Meini, S., Piana, M., Beyer, H., Schwaemmlein, J., and Gasteiger, H.A., Effect of carbon surface area on first discharge capacity of Li–O2 cathodes and cycle-life behavior in ether-based electrolytes, J. Electrochem. Soc., 2012, vol. 159, p. A2135.
Chervin, C.N., Wattendorf, M.J., Long, J.W., Kucko, N.W., and Rolison, D.R., Carbon nanofoam-based cathodes for Li–O2 batteries: correlation of pore solid architecture and electrochemical performance, J. Electrochem. Soc., 2013, vol. 160, p. A1510.
Tan, P., Shyy, W., Wei, Z.H., An, L., and Zhao, T.S., A carbon powder-nanotube composite cathode for non-aqueous lithium-air batteries, Electrochim. Acta, 2014, vol. 147, p. 1.
Zhang, G.Q., Zheng, J.P., Liang, R., Zhang, C., Wang, B., Hendrickson, M., and Plichta, E.J., Lithiumair batteries using SWNT/CNF buckypapers as air electrodes, J. Electrochem. Soc., 2010, vol. 157, p. A953.
Sahapatsombut, U., Cheng, H., and Scott, K., Modelling the micro–macro homogeneous cycling behaviour of a lithium–air battery, J. Power Sources, 2013, vol. 227, p. 243.
Yoo, K., Banerjee, S., and Dutta, P., Modeling of volume change phenomena in a Li–air battery, J. Power Sources, 2014, vol. 258, p. 340.
Jung, C.Y., Zhao, T.S., and An, L., Modeling of lithium–oxygen batteries with the discharge product treated as a discontinuous deposit layer, J. Power Sources, 2015, vol. 273, p.440.
Wang, L., Zhao, X., Lu, Y., Xu, M., Zhang, D., Ruoff, R.S., Stevenson, K.J., and Goodenough, J.B., CoMn2O4 spinel nanoparticles grown on graphene as bifunctional catalyst for lithium–air batteries, J. Electrochem. Soc., 2011, vol. 158, p. A1379.
Li, L. and Manthiram, A., Decoupled bifunctional air electrodes for highperformance hybrid lithium–air batteries, Nano Energy, 2014, vol. 9, p. 94.
Li, L., Liu, C., He, G., Fan, D., and Manthiram, A., Hierarchical pore-in-pore and wire-inwire catalysts for rechargeable Zn- and Li-air batteries with ultra-long cycle life and high cell efficiency, Energy Environ Sci., 2015, vol. 8, p. 3274.
Lim, H.D., Song, H., Gwon, H., Park, K.-Y., Kim, J., Bae, Y., Kim, H., Jung, S.-K., Kim, T., Kim, Y.H., Lepró, X., Ovalle-Robles, R., Baughmand, R.H., and Kang, K., A new catalyst-embedded hierarchical air electrode for high-performance Li–O2 batteries, Energy Environ. Sci., 2013, vol. 6, p. 3570.
Marinaro, M., Riek, U., Moorthy, S.K.E., Bernhard, J., Kaiser, U., Wohlfahrt-Mehrens, M., and Jörissen, L., Au-coated carbon cathodes for improved oxygen reduction and evolution kinetics in aprotic Li–O2 batteries, Electrochem. Commun., 2013, vol.37, p. 53.
Zhu, D., Zhang, L., Song, M., Wang, X., and Chen, Y., An in situ formed Pd nanolayer as a bifunctional catalyst for Li–air batteries in ambient or simulated air, Electrochem. Commun., 2013, vol. 49, p. 9573.
Zhang, Z., Su, L., Yang, M., Hu, M., Bao, J., Wei, J., and Zhou, Z., A composite of Co nanoparticles highly dispersed on N-rich carbon substrates: an efficient electrocatalyst for Li–O2 battery cathodes, Chem. Commun., 2014, vol. 50, p. 776.
Huang, X., Yu, H., Tan, H., Zhu, J., Zhang, W., Wang, C., Zhang, J., Wang, Y., Lv, Y., Zeng, Z., Liu, D., Ding, J., Zhang, Q., Srinivasan, M., Ajayan, P.M., Hoon, H., and Yan, Q., Carbon nanotube encapsulated noble metal nanoparticle hybrid as a cathode material for Li‒oxygen batteries, Adv. Funct. Mater., 2014, vol. 24, p. 6516.
Tan, P., Jiang, H.R., Zhu, X.B., An, L., Jung, C.Y., Wu, M.C., Shi, L., Shyy, W., and Zhao, T.S., Advances and challenges in lithium-air batteries, Applied Energy, 2017, vol. 204, p. 780.
Ma, S., Wu, Y., Wang, J., Zhang, Y., Zhang, Y., Yan, X., Wei, Y., Liu, P., Wang, J., Jiang, K., Fan, S., Xu, Y., and Peng, Z., Reversibility of noble metal-catalyzed aprotic Li–O2 batteries, Nano Lett., 2015, vol. 15, p. 8084.
McCloskey, B.D., Speidel, A., Scheffler, R., Miller, D.C., Viswanathan, V., Hummelshoj, J.S., Nørskov, J.K., and Luntz, A.C., Twin problems of interfacial carbonate formation in nonaqueous Li–O2 batteries, J. Phys. Chem. Lett., 2012, vol. 3, p. 997.
Itkis, D.M., Semenenko, D.A., Kataev, E.Yu., Belova, A.I., Neudachina, V.S., Sirotina, A.P., Hävecker, M., Teschner, D., Knop-Gericke, A., Dudin, P., Barinov, A., Goodilin, E.A., Shao-Horn, Y., and Yashina, L.V., Reactivity of carbon in lithium–oxygen battery positive electrodes, Nano Lett., 2013, vol. 13, p. 4697.
Arkhipova, E.A., Ivanov, A.S., Maslakov, K.I., Egorov, A.V., Savilov, S.V., and Lunin, V.V., Mesoporous graphene nanoflakes for high performance supercapacitors with ionic liquid electrolyte, Microporous and Mesoporous Materials, 2020, vol. 294, p. 109851.
Богдановская, В.А., Панченко, Н.В., Радина, М.В., Андреев, В.Н., Корчагин, О.В., Трипачев, О.В., Новиков, В.Т. Кислородная реакция на углеродных материалах различной структуры в электролитах на основе перхлората лития и апротонных растворителей. Электрохимия. 2019. Т. 55. С. 1099. [Bogdanovskaya, V.A., Panchenko, N.V., Radina, M.V., Andreev, V.N., Korchagin, O.V., Tripachev, O.V., and Novikov, V.T., Oxygen reaction at carbonaceous materials with different structure in electrolytes based on lithium perchlorate and aprotic solvents, Russ. J. Electrochem., 2019, vol. 55, p. 878.]
Olivares-Marín, M., Aklalouch M., and Tonti, D., Combined influence of meso- and macroporosity of soft-hard templated carbon electrodes on the performance of Li–O2 cells with different configurations, Nanomaterials, 2019, vol. 9, p. 810.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия