Электрохимия, 2022, T. 58, № 5, стр. 242-250
Погрешность приближенных расчетов степени диссоциации слабых бинарных электролитов
А. В. Гребенник a, *, О. А. Райтман a, b, **
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: physchem@muctr.ru
** E-mail: rightman@muctr.ru
Поступила в редакцию 30.06.2021
После доработки 22.09.2021
Принята к публикации 18.10.2021
- EDN: VZIIVS
- DOI: 10.31857/S0424857022040065
Аннотация
Выполнен анализ погрешности расчета степени диссоциации слабых бинарных электролитов по приближенной формуле $\alpha = \sqrt {{{{{K}_{c}}} \mathord{\left/ {\vphantom {{{{K}_{c}}} c}} \right. \kern-0em} c}} $ и по закону разведения Оствальда. Даны выражения для относительной ошибки и пределы применимости названных приближений, в том числе при необходимости учета собственной диссоциации растворителя.
ВВЕДЕНИЕ
При анализе процессов в растворах слабых электролитов существенной является информация о равновесных концентрациях ионов, которые связаны с равновесной степенью диссоциации электролита. Расчет равновесных концентраций ионов в растворах слабых электролитов выполняется на основе материального и электрического балансов и выражения для константы диссоциации по закону действующих масс. Задачи такого рода являются типовыми во всех вузовских курсах общей и физической химии. Чаще всего они рассматриваются на примерах слабых бинарных электролитов валентного типа 1-1 и решаются на основе допущения о том, что степень диссоциации слабого электролита априори мала.
Для решения подобных задач применительно к разбавленным растворам слабого электролита без добавок сильных электролитов используют практическую константу диссоциации ${{K}_{c}},$ выражаемую через равновесные концентрации (моль/дм3) сольватированных ионов (${{c}_{ + }},$ ${{c}_{ - }}$) и нераспавшихся молекул электролита AB (${{c}_{{{\text{AB}}}}}$):
Если равновесные концентрации ионов (${{c}_{ + }},$ ${{c}_{ - }}$) при диссоциации электролита существенно выше концентраций ионов при собственной диссоциации растворителя, последние можно не учитывать в электрическом балансе раствора: ${{c}_{ + }} = {{c}_{ - }}.$ В соответствии с материальным и электрическим балансами диссоциации бинарного электролита AB концентрации ионов ${{c}_{ + }},$ ${{c}_{ - }}$ и нераспавшихся молекул ${{c}_{{{\text{AB}}}}}$ связаны с начальной концентрацией электролита c и его степенью диссоциации α:
Подставляя эти выражения в (1), получаем уравнение, называемое законом разведения Оствальда:
(2)
${{K}_{c}} = \frac{{\alpha c\alpha c}}{{c - \alpha c}} = \frac{{{{\alpha }^{2}}c}}{{1 - \alpha }}.$В курсах общей и физической химии всегда демонстрируется типовая задача расчета степени диссоциации α слабого электролита в водном растворе с концентрацией c. При этом без подробного анализа ошибки в выражении (2) обычно рекомендуют пренебречь α в знаменателе (см., например, [1, c. 292], а также [2, с. 410] и [3, с. 8]) и решать упрощенное уравнение относительно α:
В соответствии с уравнением (3) степень диссоциации электролита при уменьшении концентрации неограниченно возрастает и формально может превысить 1, что в реальности, конечно, невозможно.
Точное решение (2) относительно α есть положительный корень квадратного уравнения
который можно найти по общеизвестной формуле [4]:В соответствии с уравнением (4) степень диссоциации слабых бинарных электролитов с уменьшением концентрации стремится к 1. Следовательно, должно существовать ограничение применимости приближенного выражения (3) применительно к растворам малых концентраций. Однако строгие критерии применимости (3) в учебных изданиях отсутствуют. В учебнике по электрохимии [4] без подробного анализа ошибки указано, что формула (3) – она же (1.2.4) в [4, с. 21] – может применяться “при малых константах диссоциации и при не очень низких концентрациях, когда ${{K}_{c}} \ll 4c$“. Но, как будет показано ниже, практическое применение условия ${{K}_{c}} \ll 4c$ по тексту учебника затруднительно, поскольку неясен смысл знака “много меньше” в этом неравенстве, т.е. неясно, насколько произведение 4c должно численно превышать константу диссоциации для достижения приемлемой точности расчета степени диссоциации α.
С целью получения упрощенных приближенных формул выражение (4) может быть преобразовано с последующим разложением в степенной ряд. Если в (4) вынести за скобки множитель $\sqrt {{{{{K}_{c}}} \mathord{\left/ {\vphantom {{{{K}_{c}}} c}} \right. \kern-0em} c}} ,$ то получим уравнение
Умножая и деля записанную в скобках разность радикалов на сумму тех же радикалов, придем к выражению
(5)
$\alpha = \frac{{\sqrt {\frac{{{{K}_{c}}}}{c}} }}{{\sqrt {\frac{{{{K}_{c}}}}{{4c}} + 1} + \sqrt {\frac{{{{K}_{c}}}}{{4c}}} }},$Подстановка этого разложения в знаменатель (5) приводит к приближенному равенству
(6)
$\alpha \approx \sqrt {\frac{{{{K}_{c}}}}{c}} \cdot {{\left[ {1 + \sqrt {\frac{{{{K}_{c}}}}{{4c}}} + \frac{1}{2} \cdot \frac{{{{K}_{c}}}}{{4c}} - \frac{1}{8} \cdot {{{\left( {\frac{{{{K}_{c}}}}{{4c}}} \right)}}^{2}}} \right]}^{{ - 1}}}.$Выражение (6) позволяет пояснить смысл упомянутого выше условия ${{K}_{c}} \ll 4c$ из [4, с. 21], при котором справедливо уравнение (3). Видно, что это условие по существу является предельным, и знак “много меньше” без дополнительных уточнений надо понимать как “бесконечно меньше”. Если $4c \gg {{K}_{c}},$ то значение ${{{{K}_{c}}} \mathord{\left/ {\vphantom {{{{K}_{c}}} {(4c)}}} \right. \kern-0em} {(4c)}}$ мало, с увеличением концентрации c оно стремится к нулю. При этом выражение в квадратных скобках в (6) стремится к единице и в пределе (6) переходит в уравнение (3).
В данной работе поставлена задача анализа погрешности выражения (3) и точного решения (2) – уравнения (4), а также выяснения пределов их применимости, в том числе с учетом влияния ион-ионного взаимодействия и диссоциации молекул растворителя.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Слабый бинарный электролит в разбавленном растворе
Простейший случай применения уравнения (2) соответствует ситуации, когда единственным источником ионов в разбавленном растворе является слабый бинарный электролит и взаимодействием между ионами можно пренебречь.
Приближенное значение степени диссоциации ${{\alpha }_{{{\text{пр}}}}},$ найденное по уравнению (3), всегда завышено по сравнению с результатом (4). Найдем относительную ошибку выражения (3) по сравнению с более точным решением (4). Обозначим ее буквой δ и выразим в долях:
(7)
$\delta = \frac{{{{\alpha }_{{{\text{пр}}}}} - \alpha }}{\alpha } = \frac{{{{\alpha }_{{{\text{пр}}}}}}}{\alpha } - 1.$Подставим (3) и (4) в (7) и после преобразований получим выражение, однозначно определяющее искомую ошибку относительно соотношения $\tfrac{c}{{{{K}_{c}}}}{\text{:}}$
(8)
$\delta = \frac{2}{{\sqrt {\frac{1}{{\left( {\frac{c}{{{{K}_{c}}}}} \right)}} + 4} - \sqrt {\frac{1}{{\left( {\frac{c}{{{{K}_{c}}}}} \right)}}} }} - 1.$Из выражения (6) можно получить более простое приближенное уравнение, ограничившись первыми двумя членами в квадратных скобках:
(9)
$\alpha \approx \sqrt {\frac{{{{K}_{c}}}}{c}} \cdot {{\left[ {1 + \sqrt {\frac{{{{K}_{c}}}}{{4c}}} } \right]}^{{ - 1}}} = \frac{{\sqrt {\frac{{{{K}_{c}}}}{c}} }}{{\frac{1}{2}\sqrt {\frac{{{{K}_{c}}}}{c}} + 1}} = \frac{1}{{\frac{1}{2} + \sqrt {\frac{c}{{{{K}_{c}}}}} }}.$Если при выводе формулы для ошибки δ в уравнение (7) мы подставим приближенное выражение степени диссоциации α по (9), то в результате получим
(10)
${{\delta }_{{{\text{пр}}}}} \approx \sqrt {\frac{{{{K}_{c}}}}{{4c}}} = \frac{1}{2}{{\left( {\frac{c}{{{{K}_{c}}}}} \right)}^{{ - \tfrac{1}{2}}}}.$Результаты расчета по уравнениям (8) и (10) представлены на рис. 1, ошибка в процентах дана как функция от $z = \tfrac{c}{{{{K}_{c}}}}.$ Данный расчет и все последующие расчеты выполнены в среде Mathcad 2000, с ее помощью построены графики на рис. 1–3.
Рис. 1.
Относительная ошибка (100% · δ) расчета степени диссоциации по уравнению (3) как функция от $z = \tfrac{c}{{{{K}_{c}}}}$ в соответствии с уравнениями (8) – сплошная линия и (10) – пунктир. Вертикальными пунктирными линиями отмечены значения z = 0.25 и z = 100.
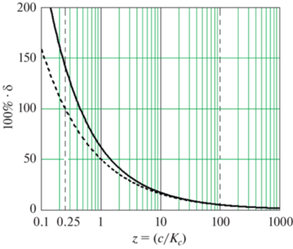
Рис. 2.
Зависимость равновесной степени диссоциации слабых одноосновных кислот от концентрации при 298 К, рассчитано по (19). Варианты значений ${{K}_{c}}{\text{:}}$ (1) ${{K}_{c}} = 1.7 \times {{10}^{{ - 5}}},$ ${{\alpha }_{\infty }} = 0.994$ (CH3COOH); (2) ${{K}_{c}} = 2.0 \times {{10}^{{ - 6}}},$ ${{\alpha }_{\infty }} = 0.952;$ (3) ${{K}_{c}} = 4.0 \times {{10}^{{ - 7}}},$ ${{\alpha }_{\infty }} = 0.800;$ (4) ${{K}_{c}} = 1.0 \times {{10}^{{ - 7}}},$ ${{\alpha }_{\infty }} = 0.500;$ (5) ${{K}_{c}} = 2.0 \times {{10}^{{ - 8}}},$ ${{\alpha }_{\infty }} = 0.167.$
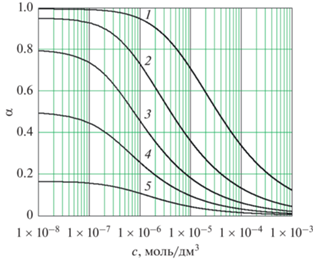
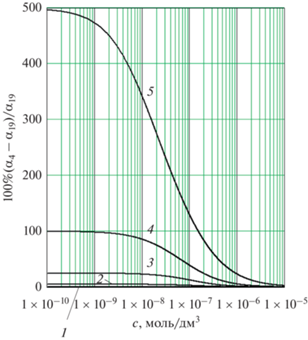
Рис. 3.
Относительная погрешность (%) расчета степени диссоциации ${{\alpha }_{4}}$ по уравнению (4) по сравнению с результатом ${{\alpha }_{{19}}}$ выражения (19) для слабых одноосновных кислот в водных растворах при 298 К: (1) ${{K}_{c}} = 1.7 \times {{10}^{{ - 5}}},$ ${{\alpha }_{\infty }} = 0.994$ (CH3COOH); (2) ${{K}_{c}} = 2.0 \times {{10}^{{ - 6}}},$ ${{\alpha }_{\infty }} = 0.952;$ (3) ${{K}_{c}} = 4.0 \times {{10}^{{ - 7}}},$ ${{\alpha }_{\infty }} = 0.800;$ (4) ${{K}_{c}} = 1.0 \times {{10}^{{ - 7}}},$ ${{\alpha }_{\infty }} = 0.500;$ (5) ${{K}_{c}} = 2.0 \times {{10}^{{ - 8}}},$ ${{\alpha }_{\infty }} = 0.167.$
Видно, что при $\tfrac{c}{{{{K}_{c}}}} < 100$ ошибка расчета степени диссоциации электролита по уравнению (3) превышает 5% и резко возрастает с уменьшением соотношения $\tfrac{c}{{{{K}_{c}}}}.$
Видно также, что критерий применимости уравнения (3), приведенный в [4] ($4c \gg {{K}_{c}},$ т.е. $\tfrac{c}{{{{K}_{c}}}} \gg \tfrac{1}{4}$), не позволяет оценить погрешность расчета по (3), так как предельному значению $\tfrac{c}{{{{K}_{c}}}} = \tfrac{1}{4}$ соответствует ошибка уравнения (3), равная 141%, и большая часть диапазона значений абсциссы на рис. 1 соответствует условию $\tfrac{c}{{{{K}_{c}}}} > \tfrac{1}{4}.$
Для решения обратной задачи – нахождения соотношения $\tfrac{c}{{{{K}_{c}}}},$ отвечающего заданной относительной погрешности δ, уравнение (8) надо решить относительно $\tfrac{c}{{{{K}_{c}}}}.$ Соответствующее точное выражение, получающееся в результате ряда последовательных преобразований уравнения (8), имеет следующий вид:
(11)
$\frac{c}{{{{K}_{c}}}} = {{\left( {\frac{{1 + \delta }}{{1 - {{{(1 + \delta )}}^{2}}}}} \right)}^{2}}.$Подобное выражение можно получить и с использованием приближения (10):
Результаты расчета по уравнениям (8) и (10)–(12) приведены в табл. 1.
Таблица 1.
Относительная ошибка $100\% \cdot \delta $ приближенного расчета α по уравнению (3)
| $\frac{c}{{{{K}_{c}}}}$ | $100\% \cdot \delta $ по (8) | $100\% \cdot \delta $ по (10) | $100\% \cdot \delta $ | $\frac{c}{{{{K}_{c}}}}$ по (11) | $\frac{c}{{{{K}_{c}}}}$ по (12) |
|---|---|---|---|---|---|
| 1000 | 1.6 | 1.6 | 1 | 2525 | 2500 |
| 500 | 2.2 | 2.2 | 3 | 286 | 278 |
| 100 | 5.1 | 5.0 | 5 | 105 | 100 |
| 50 | 7.3 | 7.1 | 10 | 27.4 | 25 |
| 10 | 17.0 | 15.8 | 50 | 1.44 | 1 |
| 1 | 61.8 | 50.0 | 100 | 0.444 | 0.25 |
| 0.1 | 245 | 158 | 200 | 0.141 | 0.0625 |
Проведенные расчеты показывают, что для конкретного слабого бинарного электролита погрешность приближенной формулы (3) растет с уменьшением начальной концентрации c. В качестве нижней границы применимости выражения (3) можно рекомендовать такую концентрацию c, при которой соотношение $\tfrac{c}{{{{K}_{c}}}}$ превышает 100. Ошибка уравнения (3) при этом будет не более 5%. К примеру, для уксусной кислоты при температуре 298 К в водном растворе (${{K}_{c}} = 1.7 \times {{10}^{{ - 5}}}$) нижняя граница применимости выражения (3) соответствует $c = 1.7 \times {{10}^{{ - 3}}}$ моль/дм3 ($c = 100{{K}_{c}}$). При тех же условиях для хлорноватистой (гипохлорной) кислоты HClO с константой диссоциации $3.0 \times {{10}^{{ - 8}}}$ нижний предел применимости (3) снизится до $3.0 \times {{10}^{{ - 6}}}$ моль/дм3.
Для расчета погрешности уравнения (3) можно также использовать приближенную формулу (10), которая правильно характеризует ошибку формулы (3) при не очень малых значениях отношения $\tfrac{c}{{{{K}_{c}}}}.$ При $\tfrac{c}{{{{K}_{c}}}} \geqslant 10$ разность значений δ, полученных по (8) и по (10), не превышает 0.02 (т.е., 2%). Это хорошо заметно на рис. 1, где в указанной области сплошная и пунктирная кривые практически совпадают. Но на рис. 1 видно также, что при $\tfrac{c}{{{{K}_{c}}}} < 10$ расхождение точного значения δ, полученного по (8), и приближенного по (10) быстро увеличивается, при $\tfrac{c}{{{{K}_{c}}}} = 0.25$ разность этих значений составляет 0.41 (т.е., 41%).
Стоит заметить также, что относительная ошибка уравнения (3), приближенно представленная уравнением (10), равна половине приближенного значения степени диссоциации по (3):
Это простое соотношение легко запомнить, оно применимо при том же условии $\tfrac{c}{{{{K}_{c}}}} \geqslant 10,$ что и уравнение (10). Связанное с ним приближенное уравнение (9) можно рассматривать как второе приближение степени диссоциации α, не требующее решения квадратного уравнения. Анализ погрешности показывает, что уравнение (9) применимо при $\tfrac{c}{{{{K}_{c}}}} \geqslant 1$ с относительной ошибкой не более 8% по сравнению с результатом (4).
Учет ион-ионного взаимодействия
При малых концентрациях электролита в водном растворе количество ионов невелико, ион-ионным взаимодействием можно пренебречь. В этих условиях практическая константа диссоциации ${{K}_{c}}$ не зависит от концентрации электролита c и численно равна термодинамической константе диссоциации электролита ${{K}_{a}}.$ С повышением исходной концентрации электролита c концентрации ионов (${{c}_{ + }},$ ${{c}_{ - }}$) в растворе возрастают. При этом может быть достигнут такой уровень концентрации ионов, при котором ион-ионным взаимодействием в растворе пренебречь уже нельзя. Вследствие этого константа диссоциации ${{K}_{c}}$ начинает заметно изменяться с ростом концентрации. Максимальную концентрацию однозарядных ионов (${{c}_{ + }},$ ${{c}_{ - }}$) в водном растворе, при которой допущение ${{K}_{c}} \approx {{K}_{a}}$ не приводит к большой ошибке, можно принять равной 0.001 моль/дм3 (при 298 К для этой концентрации ионов средний ионный коэффициент активности по теории Дебая–Хюккеля ${{\gamma }_{ \pm }} = 0.96,$ и ошибка расчета α при допущении ${{\gamma }_{ \pm }} = 1$ составит около 4%). По этой предельной концентрации ионов можно оценить максимальную концентрацию водного раствора электролита (${{c}_{{\max }}},$ моль/дм3), при которой еще могут быть применимы выражение (4), а также приближенные формулы (3) и (9), с константой диссоциации ${{K}_{c}}.$ Для концентрации ионов (${{c}_{ + }} = {{c}_{ - }}$) с подстановкой α в соответствии с (4) запишем:
(13)
$\begin{gathered} {{c}_{{\max }}} = \frac{{4 \times {{{10}}^{{ - 6}}} + 0.004{{K}_{c}}}}{{4{{K}_{c}}}} = \\ = \frac{{1 \times {{{10}}^{{ - 6}}}}}{{{{K}_{c}}}} + 0.001\,\,\frac{{{\text{моль}}}}{{{\text{д}}{{{\text{м}}}^{{\text{3}}}}}}. \\ \end{gathered} $Видно, что максимальная концентрация электролита ${{c}_{{\max }}}$ зависит от значения константы диссоциации ${{K}_{c}}.$ Результаты расчетов ${{c}_{{\max }}}$ по уравнению (13) для бинарных электролитов в зависимости от константы диссоциации ${{K}_{c}}$ приведены в табл. 2.
Таблица 2.
Верхний предел применимости (4) в зависимости от значения ${{K}_{c}}$ (водные растворы, 298 К)
| ${{K}_{c}}$ | ${{c}_{{\max }}}$, моль/дм3 | ${{K}_{c}}$ | ${{c}_{{\max }}}$, моль/дм3 |
|---|---|---|---|
| 5 × 10–7 | 2 | 5 × 10–5 | 0.021 |
| 1 × 10–6 | 1 | 1 × 10–4 | 0.011 |
| 5 × 10–6 | 0.201 | 5 × 10–4 | 0.003 |
| 1 × 10–5 | 0.101 | 1 × 10–3 | 0.002 |
По данным табл. 2 можно отметить, что при 298 К для водных растворов бинарных электролитов с константами диссоциации ниже 1 × 10–4 хорошим приближением для верхнего предела применимости уравнения (4) будет выражение
Для описания диссоциации слабых бинарных электролитов при концентрациях, больших ${{c}_{{\max }}},$ или в присутствии избытка сильного фонового электролита, ионные компоненты которого отличаются от ионов слабого электролита, используют термодинамическую константу диссоциации электролита ${{K}_{a}}{\text{:}}$
В этих случаях задача расчета степени диссоциации также может быть сведена к приближенному решению уравнения вида (2), если для электролита известно значение ${{K}_{a}},$ а также если есть возможность оценить значение ${{K}_{\gamma }}$ и считать его постоянным:
Постоянство значения ${{K}_{\gamma }}$ для слабого электролита достигается в присутствии большого избытка сильного фонового электролита (метод постоянной ионной среды). При этом в уравнениях (3), (4) и (9) вместо ${{K}_{c}}$ следует использовать отношение $\tfrac{{{{K}_{a}}}}{{{{K}_{\gamma }}}} = {\text{const}},$ ограничение применимости данных уравнений при концентрациях, больших ${{c}_{{\max }}},$ при этом снимается (но сохраняются нижние пределы применимости (3) и (9), указанные выше).
Используя выражение (13), можно найти значение константы диссоциации ${{K}_{c}},$ при котором концентрационная область применения уравнения (3) стягивается в точку. Это значение легко получить из сочетания условий $c \leqslant {{c}_{{\max }}}$ и $c \geqslant 100{{K}_{c}},$ которое дает единственную точку при ${{c}_{{\max }}} = 100{{K}_{c}}{\text{:}}$
откуда наибольшее значение ${{K}_{c}},$ при котором возможно применение (3) для бинарных электролитов при 298 К в водных растворах, $1.051 \times {{10}^{{ - 4}}} \approx 1 \times {{10}^{{ - 4}}}.$ Для бинарных электролитов, константы диссоциации ${{K}_{c}}$ которых больше указанного значения, использование уравнений (3), (4), (9) при концентрациях, больших ${{c}_{{\max }}},$ предполагает замену ${{K}_{c}}$ отношением ${{{{K}_{a}}} \mathord{\left/ {\vphantom {{{{K}_{a}}} {{{K}_{\gamma }}}}} \right. \kern-0em} {{{K}_{\gamma }}}}.$Учет диссоциации растворителя
Выражения (2), (4), а также их приближения (3), (6) и (9), имеют ограничения применимости для разбавленных растворов слабых кислот или слабых оснований в условиях, когда концентрации ионов, полученных при диссоциации растворенного электролита, соизмеримы с концентрациями ионов при собственной диссоциации чистого растворителя. В учебной литературе эти ограничения и возможности уточнения расчета в большинстве случаев не рассмотрены. В частности, в учебном пособии [5], целиком посвященном анализу ионных равновесий в растворах, указано лишь, что в сильно разбавленных водных растворах кислот и оснований уравнение (4) может приводить к некорректным значениям pH, но описание уточненного расчета отсутствует.
Рассмотрим расчет концентраций ионов в разбавленном водном растворе слабой одноосновной кислоты HA с учетом собственной диссоциации воды. В данном случае в растворе имеют место равновесия
| HA ⇄ H+ + A– | ${{K}_{c}} = \frac{{{{c}_{{{{{\text{H}}}^{ + }}}}}{{c}_{{{{{\text{A}}}^{ - }}}}}}}{{{{c}_{{{\text{HA}}}}}}} = {{c}_{{{{{\text{H}}}^{ + }}}}}\frac{{\alpha c}}{{c - \alpha c}} = {{c}_{{{{{\text{H}}}^{ + }}}}}\frac{\alpha }{{1 - \alpha }}$ |
|---|---|
| H2O ⇄ H+ + OH– | ${{K}_{W}} = {{c}_{{{{{\text{H}}}^{ + }}}}}{{c}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}$ |
Выражение баланса электрических зарядов в растворе включает концентрации ионов всех видов:
после несложных преобразований получим уравнение, которое можно назвать расширенным законом разведения Оствальда, учитывающим диссоциацию растворителя:
В случаях, когда концентрация ${{c}_{{{{{\text{H}}}^{ + }}}}},$ предполагаемая по значению степени диссоциации α из (4), оказывается меньше наблюдаемой при собственной диссоциации воды ($\sqrt {{{K}_{W}}} $), именно диссоциация воды создает буферное равновесие, поддерживающее ${{c}_{{{{{\text{H}}}^{ + }}}}}$ на более высоком уровне. В этих условиях в уравнении (14) преобладает второе слагаемое. При бесконечном разведении раствора первое слагаемое в (14) стремится к нулю, а по значению второго слагаемого можно найти предельную степень диссоциации электролита ${{\alpha }_{\infty }}{\text{:}}$
(15)
${{K}_{c}} = \frac{{{{K}_{W}}}}{{{{K}_{c}}}}\frac{{\alpha _{\infty }^{2}}}{{{{{(1 - {{\alpha }_{\infty }})}}^{2}}}},\,\,\,\,\frac{{{{\alpha }_{\infty }}}}{{1 - {{\alpha }_{\infty }}}} = \frac{{{{K}_{c}}}}{{\sqrt {{{K}_{W}}} }},$Уравнение (14) может быть получено и для слабого бинарного основания.
Для аналитического решения уравнение (14) можно свести к кубическому относительно α. Введем обозначения: $z = \tfrac{c}{{{{K}_{c}}}},$ $y = \tfrac{{\sqrt {{{K}_{W}}} }}{{{{K}_{c}}}}$ и разделим почленно (14) на ${{K}_{c}}{\text{:}}$
(17)
$1 = \frac{{{{\alpha }^{2}}z}}{{1 - \alpha }} + \frac{{{{\alpha }^{2}}{{y}^{2}}}}{{{{{(1 - \alpha )}}^{2}}}}.$Полученное уравнение (17) несложно преобразуется в кубическое:
гдеУравнение (18) в данном случае имеет три различных действительных корня, методы расчета которых известны. Первый его корень всегда больше единицы, второй – всегда меньше нуля. Третий корень имеет значения в интервале (0, ${{\alpha }_{\infty }}$), и, следовательно, только он имеет физический смысл. Для упрощения вида математических выражений расчет корня α кубического уравнения (18) целесообразно разделить на несколько шагов.
Введем дополнительные обозначения:
Выполнив расчеты p, q, ρ, $\varphi $ (определяется в радианах), можем вычислить интересующий нас корень кубического уравнения:
(19)
$\alpha = \left[ {2\sqrt[3]{\rho }\cos \left( {\frac{\varphi }{3} + \frac{{4\pi }}{3}} \right)} \right] - \frac{r}{3}.$Результаты расчета по уравнению (19) степени диссоциации α для слабых одноосновных кислот с различными значениями ${{K}_{c}}$ в водных растворах в зависимости от концентрации при температуре 298 К представлены на рис. 2.
Относительная ошибка расчета степени диссоциации ${{\alpha }_{4}}$ по уравнению (4) по сравнению с результатом ${{\alpha }_{{19}}}$ наиболее точного выражения (19) возрастает с уменьшением концентрации раствора (рис. 3).
Наибольшая относительная ошибка значения ${{\alpha }_{4}}$ по сравнению с ${{\alpha }_{{19}}}$ будет наблюдаться при бесконечном разведении и составит
К примеру, для уксусной кислоты при 298 К в водном растворе ${{\alpha }_{\infty }} = 0.994$ и во всем интервале концентраций ошибка уравнения (4) не превышает 1% (линия 1 на рис. 3). При концентрации кислоты 0.01 М первое слагаемое в уравнении (14) составляет 99.5%, второе слагаемое – только 0.5%, ошибка уравнения (4) около 0.3%.
При тех же условиях для хлорноватистой (гипохлорной) кислоты HClO с константой диссоциации $3.0 \times {{10}^{{ - 8}}}$ предельная степень диссоциации составит 0.23, ошибка уравнения (4) достигает 5% при концентрации $3.4 \times {{10}^{{ - 6}}}$ моль/дм3. При этой концентрации степень диссоциации, рассчитанная по уравнению (19), равна 0.085 (8.5%), первое слагаемое в (14) составляет 90%, а второе слагаемое – около 10%. При концентрациях раствора HClO, бóльших указанной, для расчета степени диссоциации можно применять как уравнение (4), так и уравнение (3), поскольку в этом случае $c > 100{{K}_{c}}.$
Погрешность уравнения (4) в области разбавленных растворов не превысит 1% для слабых кислот или оснований, константа диссоциации которых ${{K}_{c}} \geqslant 100\sqrt {{{K}_{W}}} .$ При 298 К это условие соответствует ${{K}_{c}} \geqslant 1 \times {{10}^{{ - 5}}}.$
Погрешность уравнения (4) будет не более 5% для слабых кислот или оснований с константой диссоциации ${{K}_{c}} \geqslant 20\sqrt {{{K}_{W}}} .$ При 298 К это условие дает ${{K}_{c}} \geqslant 2 \times {{10}^{{ - 6}}}.$ Электролит, для которого ${{K}_{c}} = 2 \times {{10}^{{ - 6}}},$ представляют линии 2 на рис. 2 и на рис. 3.
Для слабой кислоты, у которой в данных условиях ${{K}_{c}} = 1 \times {{10}^{{ - 6}}},$ ошибка расчета по уравнению (4) более 5% наблюдается при концентрациях, меньших $1.2 \times {{10}^{{ - 7}}}$ моль/дм3, при бесконечном разведении эта ошибка составит 10%.
Если при тех же условиях ${{K}_{c}} = 1 \times {{10}^{{ - 7}}},$ т.е. ${{K}_{c}} = \sqrt {{{K}_{W}}} $ (линии 4 на рис. 2 и на рис. 3), предельная степень диссоциации при бесконечном разведении ${{\alpha }_{\infty }} = 0.5,$ и 5-процентная ошибка уравнения (4) достигается уже при концентрации $1.2 \times {{10}^{{ - 6}}}$ моль/дм3, а предельная ошибка при бесконечном разведении составляет 100%.
Для слабой кислоты с константой диссоциации $6 \times {{10}^{{ - 10}}}$ (HCN) в работе [6] уравнение (4) считается в принципе не применимым. Ошибка расчета степени диссоциации по (4) по сравнению с (19) более 5% в этом случае наблюдается при концентрациях, меньших $1.6 \times {{10}^{{ - 4}}}$ моль/дм3. При концентрациях, бóльших указанной, отношение ${c \mathord{\left/ {\vphantom {c {{{K}_{c}}}}} \right. \kern-0em} {{{K}_{c}}}}$ значительно более 100, и вместо (4) можно использовать уравнение (3).
Для слабой кислоты или слабого основания в водном растворе с помощью уравнения (19) можно найти нижний предел концентрации (${{c}_{{\min }}},$ моль/дм3) при 298 К, при котором ошибка уравнения (4) по сравнению с (19) достигает 5% (табл. 3). Логарифм ${{c}_{{\min }}}$ линейно зависит от логарифма константы диссоциации, уравнение этой зависимости для электролитов с константой диссоциации ${{K}_{c}} < 2 \times {{10}^{{ - 6}}}$ найдено в виде
Таблица 3.
Нижний предел ${{c}_{{\min }}}$ применимости (4) для слабых бинарных кислот или оснований в зависимости от значения ${{K}_{c}}$ (водные растворы, 298 К)
| ${{K}_{c}}$ | ${{c}_{{\min }}}$, моль/дм3 | ${c \mathord{\left/ {\vphantom {c {{{K}_{c}}}}} \right. \kern-0em} {{{K}_{c}}}}$ | ${{K}_{c}}$ | ${{c}_{{\min }}}$, моль/дм3 | ${c \mathord{\left/ {\vphantom {c {{{K}_{c}}}}} \right. \kern-0em} {{{K}_{c}}}}$ |
|---|---|---|---|---|---|
| 1 × 10–6 | 1.2 × 10–7 | 0.123 | 5 × 10–8 | 2.1 × 10–6 | 42.0 |
| 8 × 10–7 | 1.7 × 10–7 | 0.207 | 2 × 10–8 | 5.1 × 10–6 | 253 |
| 5 × 10–7 | 2.7 × 10–7 | 0.540 | 1 × 10–8 | 1.0 × 10–5 | 996 |
| 2 × 10–7 | 6.0 × 10–7 | 3.01 | 5 × 10–9 | 2.0 × 10–5 | 3960 |
| 1 × 10–7 | 1.1 × 10–6 | 11.1 | 6 × 10–10 | 1.6 × 10–4 | 2.73 × 105 |
Ограничения применимости уравнения (2) в области малых концентраций могут объяснить дополнительную ошибку при определении предельной электропроводности растворов слабых кислот или оснований по методу Брея–Крауса (примеры использования данного метода в учебной лаборатории приведены в [7]).
ЗАКЛЮЧЕНИЕ
Таким образом, сформулированы критерии применимости уравнений (3) и (4), полученных по закону разведения Оствальда (2) для расчета степени диссоциации слабых бинарных электролитов в разбавленных растворах. Получено выражение второго приближения для степени диссоциации слабых бинарных электролитов (9), применимое при $\tfrac{c}{{{{K}_{c}}}} \geqslant 1.$ Для слабых кислот и оснований рассмотрены выражение расширенного закона разведения Оствальда (14) с учетом собственной диссоциации растворителя и его точное решение (19) относительно степени диссоциации электролита.
1. Получено выражение (8) для относительной ошибки приближенного расчета степени диссоциации электролита по уравнению (3) по сравнению с (4). Уравнение (3) является приближением уравнения (4) с ошибкой не более 5.1% при условии $\tfrac{c}{{{{K}_{c}}}} > 100$ или $c > 100{{K}_{c}}.$ В области концентраций $c < 100{{K}_{c}}$ ошибка приближенного расчета степени диссоциации по уравнению (3) будет больше 5% и быстро увеличивается с уменьшением концентрации электролита.
2. Для расчета погрешности уравнения (3) возможно использование приближенной формулы (10), которая правильно характеризует ошибку формулы (3) при не очень малых значениях отношения $\tfrac{c}{{{{K}_{c}}}}.$ При $\tfrac{c}{{{{K}_{c}}}} \geqslant 10$ разность значений, полученных по (8) и (10), не превышает 0.02 (т.е., 2%).
3. Для практических расчетов удобно простое следствие уравнения (10): относительная ошибка уравнения (3) равна половине приближенного значения степени диссоциации по (3). Связанное с ним уравнение (9) можно рассматривать как второе приближение для степени диссоциации слабых бинарных электролитов, которое применимо при $\tfrac{c}{{{{K}_{c}}}} \geqslant 1$ с ошибкой, не превышающей 8% по сравнению с результатом (4).
4. Для водных растворов слабых бинарных электролитов при температуре 298 К верхний предел области концентраций (${{c}_{{\max }}},$ моль/дм3), в которой могут быть применимы уравнения (3), (4) и (9) в приближении ${{K}_{c}} = {\text{const}},$ определяется выражением (13). При ${{K}_{c}} < 1 \times {{10}^{{ - 4}}}$ значение ${{c}_{{\max }}}$ с достаточной точностью равно ${{1 \times {{{10}}^{{ - 6}}}} \mathord{\left/ {\vphantom {{1 \times {{{10}}^{{ - 6}}}} {{{K}_{c}}}}} \right. \kern-0em} {{{K}_{c}}}}.$ При концентрациях, больших ${{c}_{{\max }}},$ использование уравнений (3), (4) и (9) возможно после замены ${{K}_{c}}$ отношением ${{{{K}_{a}}} \mathord{\left/ {\vphantom {{{{K}_{a}}} {{{K}_{\gamma }}}}} \right. \kern-0em} {{{K}_{\gamma }}}}$ с учетом ограничений применимости (3), (9) и зависимости ${{K}_{\gamma }}$ от концентрации. В присутствии избытка сильного фонового электролита ${{K}_{\gamma }} = {\text{const}}$ и, следовательно, ${{{{K}_{a}}} \mathord{\left/ {\vphantom {{{{K}_{a}}} {{{K}_{\gamma }}}}} \right. \kern-0em} {{{K}_{\gamma }}}} = {\text{const}}.$
5. Для слабых кислот или слабых оснований применимость уравнения (4), а также его приближений (3), (6), (9), в области разбавленных растворов ограничена необходимостью учета собственной диссоциации растворителя. В случае водных растворов учет диссоциации воды – расчет по уравнению (19) – необходим для бинарных электролитов с константой диссоциации ${{K}_{c}} < 20\sqrt {{{K}_{W}}} $ (что соответствует ${{K}_{c}} < 2 \times {{10}^{{ - 6}}}$ при 298 К). Максимальная ошибка значения степени диссоциации, найденного по уравнению (4), по сравнению с результатом более точного расчета по (19) наблюдается при бесконечном разведении, при ${{K}_{c}} = 20\sqrt {{{K}_{W}}} $ она составляет 5%.
6. Для слабых кислот или слабых оснований с константой диссоциации ${{K}_{c}} < 20\sqrt {{{K}_{W}}} $ в водных растворах интервал применимости уравнения (4) ограничен нижним пределом концентрации (${{c}_{{\min }}},$ моль/дм3), при котором ошибка (4) по сравнению с (19) достигает 5%. Логарифм ${{c}_{{\min }}}$ в зависимости от логарифма константы диссоциации при 298 К с достаточной точностью описывается уравнением
Список литературы
Кудряшов, И.В., Каретников, Г.С. Сборник примеров и задач по физической химии. М.: Высшая школа, 1991.
Вишняков, А.В., Кизим, Н.Ф. Физическая химия. Учебник для вузов. М.: Химия, 2012.
Под ред. Краснова, К.С. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ: учебник для вузов. М.: Высшая школа, 1995.
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия. Учеб. пособие, 3-е изд., испр. Санкт-Петербург: Лань, 2021.
Нарышкин, Д.Г., Осина, М.А., Очков, В.Ф. Равновесия в растворах электролитов. Расчеты с Mathcad: Учеб. пособие. Санкт-Петербург: Лань, 2021.
Michalowska-Kaczmarczyk, A. and Michalowski, T., Ostwald’s dilution law challenge, Anal. Bioanal. Chem., 2014, vol. 406, p. 2741.
Martinez, L., Measuring the conductivity of very dilute electrolyte solutions, drop by drop, Quim. Nova, 2018, vol. 41, no. 7, p. 814.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия


