Электрохимия, 2022, T. 58, № 5, стр. 203-210
Возможные причины деградации литий-серных аккумуляторов
Т. Л. Кулова a, С. А. Ли b, Е. В. Рыжикова b, А. М. Скундин a, *
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
b Национальный исследовательский университет (МЭИ)
111250 Москва, Россия
* E-mail: askundin@mail.ru
Поступила в редакцию 15.05.2021
После доработки 29.06.2021
Принята к публикации 10.08.2021
- EDN: JFNNKG
- DOI: 10.31857/S0424857022050085
Аннотация
Для оценки возможных механизмов деградации литий-серных аккумуляторов при циклировании проведен анализ циклических вольтамперограмм серного электрода в нормализованных координатах. Показано, что снижение емкости на низковольтной площадке при циклировании соответствует уменьшению количества активного вещества, участвующего в процессе восстановления, а сокращение высоковольтной площадки характеризуется уменьшением глубины восстановления. Измерена растворимость серы в смеси диоксолана с диметоксиэтаном (1 : 1), которая при комнатной температуре составляет около 0.2 М, и сделан вывод, что процесс челночного переноса полисульфидов является не единственной причиной деградации, а существенный вклад вносит также и перенос растворенной серы.
ВВЕДЕНИЕ
Литий-серные аккумуляторы в последнее время привлекают к себе особое внимание, как возможная замена современным литий-ионным аккумуляторам [1–3]. Электрохимическая система литий-серного аккумулятора очень проста (активный материал положительного электрода – это элементарная сера, а отрицательным электродом служит металлический литий), токообразующая реакция разряда сводится к образованию сульфида лития Li2S, но детальный механизм реакций разряда и заряда необычайно сложен и до сих пор представляет предмет исследований. С определенным приближением можно считать, что первичная стадия разряда сводится к восстановлению серы, существующей в виде октетов S8, до анионов ${\text{S}}_{8}^{{2 - }}.$ Затем следует цепочка восстановительных стадий с образованием анионов ${\text{S}}_{6}^{{2 - }}$ и ${\text{S}}_{4}^{{2 - }}.$ Эти процессы протекают при почти неизменяющемся потенциале в интервале 2.1–2.4 В (в зависимости от тока разряда). При последующем восстановлении ионов таких длинноцепочечных полисульфидов образуются ионы ${\text{S}}_{2}^{{2 - }}$ и нерастворимые короткоцепочечные полисульфиды Li2S2. Образование Li2S2 происходит в интервале потенциалов 1.7–2.1 В, а при дальнейшем смещении потенциала в отрицательную сторону образуется конечный продукт разряда – нерастворимый Li2S. На катодных гальваностатических кривых отмечаются наклонный участок, соответствующий образованию Li2S8, Li2S6 и, возможно, Li2S4, и почти горизонтальный участок, соответствующий дальнейшему восстановлению короткоцепочечных полисульфидов лития с образованием твердых продуктов. На катодных ветвях циклических вольтамперограмм отмечаются два хорошо выраженных экстремума. Процесс заряда (окисления сульфида и полисульфидов) также происходит ступенчато: на гальваностатических кривых отмечаются две площадки, потенциалы которых различаются не более чем на 0.2 В, а на анодных ветвях циклических вольтамперограмм часто отмечается один широкий экстремум, представляющий собой суперпозицию нескольких пиков.
Важнейшим процессом, протекающим в литий-серных аккумуляторах, является челночный перенос серы между разноименными электродами. Подходящие к отрицательному электроду растворенные полисульфиды лития способны химически восстанавливаться элементарным литием с образованием более короткоцепочечных полисульфидов (например, по уравнению 2Li + Li2S8 → 2Li2S4) или просто сульфида лития (6Li + Li2S4 → 4Li2S). Такое химическое восстановление не связано с расходованием катодного электричества. Продукты химического восстановления могут подходить к положительному электроду, где могут окисляться в обычном анодном процессе, или химически окисляться при взаимодействии с серой (например, Li2S4 + 2S → Li2S6). Челночный перенос полисульфидов приводит к саморазряду, а также к различию в анодном и катодном количестве электричества (как правило, анодное количество электричества превышает катодное количество электричества в одном и том же цикле).
В настоящей работе процессы заряда и разряда серного электрода исследованы методами гальваностатического циклирования и циклической вольтамперометрии, причем второй метод позволил получить более интересные результаты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изготовления рабочих электродов использовали порошок серы (Sigma-Aldrich, reagent grade, powder), сажу Ketjen Black EC300J (Akzo Nobel Chemical Inc.) в качестве электропроводной добавки и Kynar LBG-2 (Arkema) в качестве связующего. Для приготовления активной массы смешивали 70% серы, 20% сажи и 10% связующего, предварительно растворенного в N-метилпирролидоне (Sigma-Aldrich). Активную массу намазывали на подложки из нержавеющей стали11 размером 15 × 15 мм, подсушивали при температуре 50°С для испарения N-метилпирролидона и прессовали давлением 1000 кг/см2. Затем электроды сушили под вакуумом при температуре 50°С в течение 16 ч для удаления следов влаги. Содержание серы на электродах составляло 8–10 мг/см2. Для изготовления литиевых электродов на такие же подложки с помощью вальцов накатывали металлический литий ЛЭ-1 слоем толщиной около 0.1 мм.
Электрохимические исследования проводили с использованием трехэлектродных ячеек, содержащих рабочий электрод и два литиевых электрода – один в качестве противоэлектрода, другой как электрод сравнения. Ячейки состояли из тефлонового цилиндрического корпуса с фланцем и тефлоновой крышки с ответным фланцем. Во фланце корпуса имелась кольцевая канавка для резинового уплотнения (o-ring). Крышка и корпус соединялись с помощью трех болтов, такая конструкция обеспечивала надежную герметизацию даже при выводе токоотводов в виде никелевых полосок толщиной 50 мкм между фланцами. В корпус ячейки вставлялся цилиндрический вкладыш с прорезью шириной 6 мм, в которую плотно вставлялась электродная сборка. В середине этой сборки располагался рабочий электрод, а по краям – противоэлектрод и электрод сравнения. Между всеми электродами располагался сепаратор из нетканого полипропилена производства НПО “Уфим” (Москва, Россия) в виде ленты, ширина которой на 10 мм превышала высоту электродов. Толщина сепаратора между рабочим электродом и противоэлектродом составляла около 50 мкм. Ячейки собирали и заливали электролитом в герметичном перчаточном боксе производства ЗАО “Спектроскопические системы” (Россия). В атмосфере бокса содержание кислорода и паров воды не превышало 1 ppm. В качестве электролита использовали 1 М раствор Li[N(CF3SO2)2] (3 M) в эквиобъемной смеси диоксолана с диметоксиэтаном. Содержание воды в электролите, измеренное титрованием по Фишеру (917 Coulometer, Metrohm) не превышало 30 ppm. Такой электролит довольно часто используется при исследовании литий-серных аккумуляторов [5, 6]. Общий объем электролита в ячейке составлял 1 мл, причем большая доля электролита находилась в придонном пространстве над электродной сборкой. Весь сепаратор и пористый активный слой положительного электрода всегда были полностью пропитаны электролитом. Для регистрации вольтамперограмм использовался потенциостат Р-20Х (Элинс, Россия). Скорость развертки потенциала составляла 0.1 мВ/с. Гальваностатическое циклирование проводили с использованием многоканального зарядно-разрядного комплекса АЗРИВК-50-10В (Бустер, Россия). При расчетах емкости из вольтамперограмм проводили интегрирование анодной или катодной ветви вольтамперограммы во всем интервале развертки потенциала и емкость Q рассчитывали по обычному уравнению
где Енач и Екон – начальный и конечный потенциалы развертки, v – скорость развертки потенциала, I – ток. Удельную емкость нормировали на массу серы в электроде. Для оценки растворимости серы в смеси диоксолана с диметоксиэтаном навески серы помещались в бюксы, заливались определенным количеством растворителя и выдерживались при комнатной температуре в течение недели. Предполагалось, что при этом образовывался насыщенный раствор серы. Затем этот раствор отбирался шприцем из бюкса, и влажный остаток серы подсушивался и вновь взвешивался. По убыли массы серы с учетом объема добавленного растворителя рассчитывали ее растворимость в смеси диоксолана с диметоксиэтаном.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
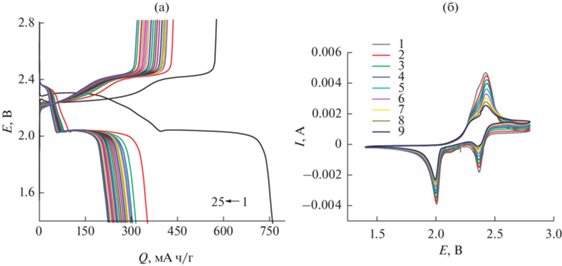
На рис. 1 приведены типичные результаты гальваностатических (рис. 1а) и циклических вольтамперометрических (рис. 1б) измерений. Вид гальваностатических кривых с двумя хорошо выраженными катодными площадками, в общем, соответствует большинству литературных данных [1, 3]. Общий вид вольтамперограмм также, в основном, соответствует опубликованным данным.
Рис. 1.
Типичные гальваностатические кривые первых двадцати пяти циклов при токе 208 мА/г (а) и циклические вольтамперограммы девяти циклов при скорости развертки потенциала 0.1 мВ/с (б). Числа на рисунках – номера циклов.
При циклировании как в гальваностатическом, так и в потенциодинамическом режимах происходит снижение разрядной и зарядной емкости (деградация электрода), причем темп этого снижения сильно зависит от экспериментальных условий. На рис. 2 приведены зависимости разрядной (катодной) и зарядной (анодной) емкости при потенциодинамических измерениях со скоростью развертки потенциала 0.1 мВ/с.
Рис. 2.
Изменение зарядной (1) и разрядной (2) емкости при циклировании в потенциодинамическом режиме.
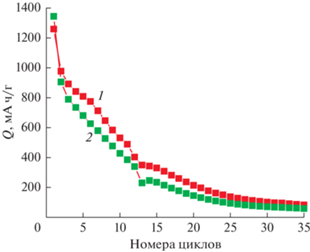
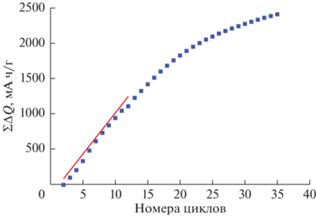
Как видно, по мере циклирования скорость снижения емкости уменьшается. Этот факт зафиксирован во многих работах (см., например, [7]), хотя иногда отмечают некоторый рост емкости по мере циклирования в начальной фазе измерений. Характерно, что анодная емкость во всех циклах, кроме первого, превышает катодную емкость, и кумулятивно это превышение оказывается довольно значительным (за 35 циклов превысило теоретическую емкость серного электрода, рис. 3).
Рис. 3.
Кумулятивное превышение зарядной емкости над разрядной при циклировании в потенциодинамическом режиме.
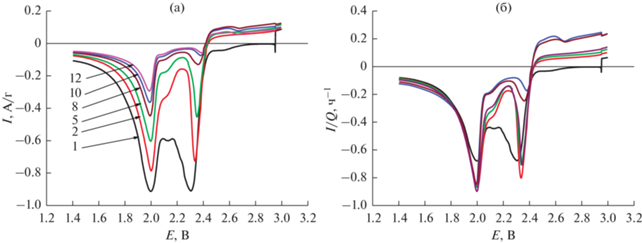
Для выяснения механизма деградации серного электрода полезно более подробно рассмотреть результаты циклической вольтамперометрии. Учитывая значительную деградацию, целесообразно анализировать циклические вольтамперограммы с разным масштабом по оси тока на разных этапах циклирования. На рис. 4 приведены катодные ветви вольтамперограмм начального этапа (1–12 циклы). Кривые на рис. 4а приведены в натуральных координатах (ток в расчете на массу серы), а на рис. 4б – в нормированных координатах (отношение тока к катодной емкости в каждом цикле). Как видно, в нормированных координатах все кривые (кроме кривой 1-го цикла) в максимуме в области около 2.0 В практически сливаются, т.е. снижение емкости соответствует уменьшению количества активного вещества, участвующего в процессе, соответствующем данному максимуму. Для максимума в области 2.3–2.4 В эта закономерность не выполняется.
Рис. 4.
Катодные участки вольтамперограмм на начальном этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа на рис. 4а – номера циклов.
Аналогичные данные для среднего (14–19 циклы) и конечного (15–35 циклы) этапов циклирования приведены на рис. 5 и 6. Видно, что здесь все кривые в максимуме в области около 2.0 В в нормированных координатах абсолютно совпадают. Характерно, что по мере циклирования уменьшается доля заряда, затрачиваемого в области потенциалов 2.3–2.4 В. На гальваностатических разрядных кривых это выражается в сокращении более высоковольтовой площадки.
Рис. 5.
Катодные участки вольтамперограмм на среднем этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа на рис. 5а – номера циклов.
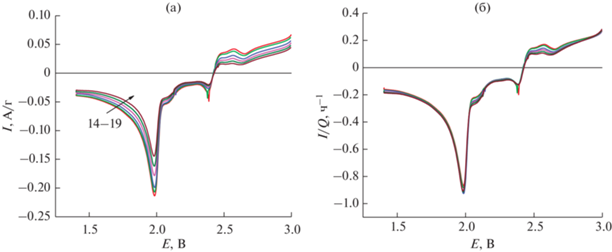
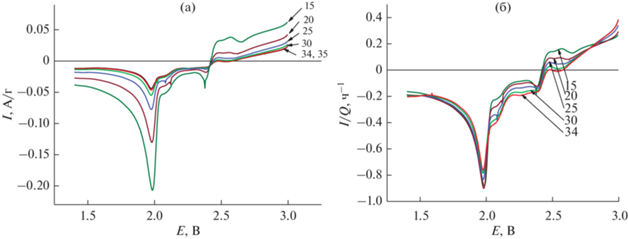
Рис. 6.
Катодные участки вольтамперограмм на конечном этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа на рисунках – номера циклов.
Такой же подход для анализа анодных ветвей вольтамперограмм приведен на рис. 7–9. На анодных участках вольтамперограмм можно различить 2, 3 или даже 4 максимума, потенциалы которых заметно изменяются по мере циклирования. Так, на 1-м и 2-м циклах проявляется только один довольно острый анодный максимум при потенциале около 2.40 В. Уже на 8–12-м циклах можно выделить четкие максимумы при потенциалах 2.26–2.30 и около 2.42 В. Начиная с 12‑го цикла проявляется максимум при потенциале около 2.80 В.
Рис. 7.
Анодные участки вольтамперограмм на начальном этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа у кривых – номера циклов.
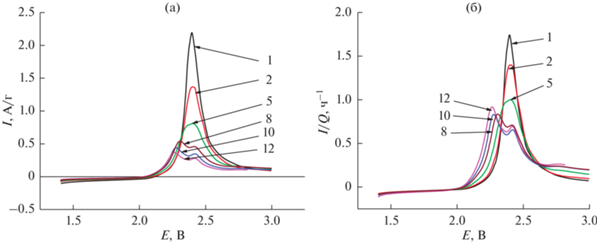
Рис. 8.
Анодные участки вольтамперограмм на среднем этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа у кривых – номера циклов.
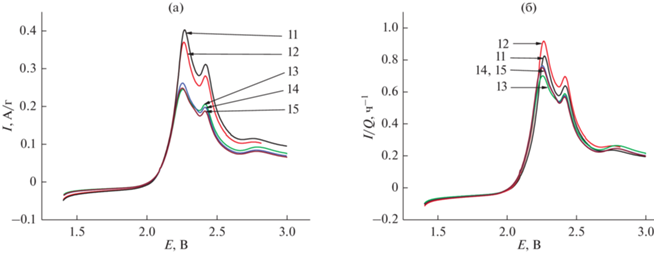
Рис. 9.
Анодные участки вольтамперограмм на конечном этапе циклирования в натуральных координатах (а) и в нормированных координатах (б). Числа у кривых – номера циклов.
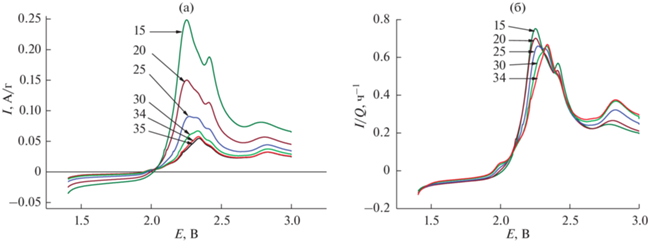
Нормировка анодной ветви на начальном этапе циклирования, как видно, не приводит к слиянию кривых разных циклов (см. рис. 7а и 7б). В дальнейшем, и особенно, на последней стадии циклирования, анодные кривые в нормированных координатах почти сливаются, что свидетельствует об общности природы деградации как в процессе разряда, так и в процессе заряда. Изменение формы вольтамперограмм по мере циклирования свидетельствует об изменении соотношения скоростей отдельных стадий превращений полисульфидов лития.
С учетом ступенчатого характера восстановления серы и полисульфидов, и обратного процесса окисления сульфида лития было бы логично приписать разные экстремумы на циклических вольтамперограммах разным стадиям, упомянутым во введении. В работе [8] методом измерения ЭДС и квантово-химическими расчетами были получены значения равновесных потенциалов для систем S8 + 2Li+ + 2е → Li2S8; Li2S8 + 2Li+ + 2е → → Li2S6 + Li2S2; Li2S6 + 2Li+ + 2е → Li2S4 + Li2S2; Li2S8 + 2Li+ + 2e → 2Li2S4; Li2S4 + 2Li+ + 2e → → Li2S3 + Li2S; Li2S3 + 2Li+ + 2e → Li2S2 + Li2S и Li2S2 + 2Li+ + 2е → 2Li2S, которые оказались равными, соответственно, 2.33, 2.30, 2.32, 2.29, 2.15, 1.41 и 1.23 В относительно литиевого электрода. (Следует подчеркнуть, что перечень возможных равновесий с участием различных полисульфидов не исчерпывается приведенным выше набором). Как видно, равновесные потенциалы первых четырех систем (образование Li2S8, Li2S6 и Li2S4) очень близки, а образование Li2S термодинамически возможно только при потенциалах отрицательнее 1.4 В.
С большей или меньшей вероятностью катодный экстремум при потенциале около 2.0 В можно отнести к процессу восстановления Li2S4, хотя при сравнении абсолютных значений потенциала экстремума с теоретическим значением равновесного потенциала следует учитывать поляризацию, оценить которую очень трудно. Отнесение других экстремумов к каким-либо определенным редокс-процессам с участием полисульфидов лития невозможно из-за многообразия этих процессов и уже отмеченной близости их равновесных потенциалов.
Заслуживает внимания факт эволюции катодных экстремумов в диапазоне потенциалов от 2.0 до 2.4 В по мере циклирования на начальном этапе (с 1-го по 12-й цикл, рис. 4б), и дальнейшая практическая неизменность этих участков (по крайней мере, при представлении в нормированных координатах).
Отдельными опытами было показано, что при регистрации циклических вольтамперограмм в расширенном диапазоне потенциалов (от 1.4 до 3.6 В) в области потенциалов положительнее 3.0 В не обнаруживалось никакого анодного процесса, связанного, например, с окислением электролита.
В настоящее время большинство исследователей признает, что именно челночный перенос полисульфидов является основным механизмом деградации литий-серных аккумуляторов (см., напр., обзоры [1, 2, 9, 10]). Однако следует учитывать и возможность челночного переноса собственно серы, что обычно не принимается во внимание. Растворимость серы в электролите может быть вполне заметна (она сильно зависит от природы растворителя). Растворенная сера может подходить к литиевому электроду и расходоваться там на чисто химическое взаимодействие, например, по реакции S + 2Li → Li2S, а при достаточно высокой концентрации растворенной серы и по реакциям с образованием полисульфидов. Образовавшийся твердый сульфид может частично осаждаться на поверхности лития, приводя к его пассивации, а частично взаимодействовать с длинноцепочечными полисульфидами (а также и с растворенной в электролите серой), переходя в растворимые полисульфиды с более короткой цепью (например, 2Li2S + Li2S8 → 2Li2S2 + Li2S6), способные переноситься к положительному электроду. Для оценки возможного влияния такого процесса на эффективность циклирования в настоящей работе была оценена растворимость серы в смеси диоксолана с диметоксиэтаном (измерить растворимость серы в электролите методически гораздо сложнее, а кроме того, растворенная сера взаимодействует с растворенными полисульфидами, что приводит к кажущемуся увеличению ее растворимости). Было установлено, что при комнатной температуре растворимость серы составляет около 0.2 М, что делает вклад переноса растворенной серы довольно заметным.
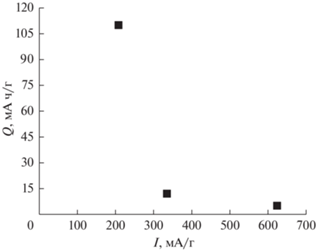
Очевидно, что перенос растворенной серы будет тем больше, чем дольше длится цикл разряда–заряда, то есть чем меньше будет ток циклирования. Были проведены эксперименты с гальваностатическим циклированием с токами 208, 335 и 624 мА/г. Среднее превышение зарядной емкости над разрядной составило в этих опытах 110, 12 и 5 мА ч/г (рис. 10), что подтверждает предположение об участии растворенной серы в процессе челночного переноса.
ЗАКЛЮЧЕНИЕ
В настоящей работе методами гальваностатического цилирования и циклической вольтамперометрии исследована система литий–сера для определения механизма электрохимических и химических процессов, а также для выявления причин деградации разрядной и зарядной емкостей. Анализ вольтамперограмм в нормализированных координатах позволил сделать следующие выводы: для литий-серных аккумуляторов присуща общая природа деградации разрядного и зарядного процессов, причем снижение емкости на низковольтной площадке соответствует убыли активного вещества, а сокращение высоковольтной площадки характеризуется уменьшением доли заряда. Была измерена растворимость серы в смеси диоксолана с диметоксиэтаном (1 : 1), которая при комнатной температуре составляет около 0.2 М. Таким образом, процесс челночного переноса полисульфидов является не единственной причиной деградации, а существенный вклад вносит также и перенос растворенной серы.
Список литературы
Manthiram, A., Fu, Y., Chung, S.-H., Zu, C., and Su, Y.-S., Rechargeable Lithium–Sulfur Batteries, Chem. Rev., 2014, vol. 114, p. 11751.
Kang, W., Deng, N., Ju, J., Li, Q., Wu, D., Ma, X., Li, L., Naebe, M., and Cheng, B., A review of recent developments in rechargeable lithium–sulfur batteries, Nanoscale, 2016, vol. 8, p.16541.
Колосницын, В.С., Карасева, Е.В. Литий-серные аккумуляторы: проблемы и решения. Электрохимия. 2008. Т. 44. С. 548. [Kolosnitsyn, V.S. and Karaseva, E.V., Lithium–sulfur batteries: problems and solutions, Russ. J. Electrochem., 2008, vol. 44, p. 506.]
Ryu, H.S., Ahn, H.J., Kim, K.W., Ahn, J.H., Cho, K.K., and Nam, T.H., Self-discharge characteristics of lithium/sulfur batteries using TEGDME liquid electrolyte, Electrochim. Acta, 2006, vol. 52, p. 1563.
Mikhaylik, Y., Electrolytes for lithium sulfur cells. US Pat. no. 7354680. 08.04.2008.
Zhao, M.-Q., Peng, H.-J., Tian, G.-L., Zhang, Q., Huang, J.-Q., Cheng, X.-B., Tang, C., and Wei, F., Hierarchical Vine-Tree-Like Carbon Nanotube Architectures: In-Situ CVD Self-Assembly and Their Use as Robust Scaffolds for Lithium–Sulfur Batteries, Adv. Mater., 2014, vol. 26, p. 7051.
Wang, J., Wu, Y., Shi, Z., and Wu, C., Mesoporous carbon with large pore volume and high surface area prepared by a co-assembling route for Lithium–Sulfur Batteries, Electrochim. Acta, 2014, vol. 144, p. 307.
Кузьмина, Е.В., Карасева, Е.В., Чудова, Н.В., Мельникова, А.А., Колосницын, В.С. О возможности определения термодинамических функций электрохимической системы Li–S методом ЭДС. Электрохимия. 2019. Т. 55. С. 1215. [Kuz’mina, E.V., Karaseva, E.V., Chudova, N.V., Mel’nikova, A.A., and Kolosnitsyn, V.S., On the Possibility of Determination of Thermodynamic Functions of the Li–S Electrochemical System Using the EMF Method, Russ. J. Electrochem., 2019, vol. 55, p. 978.]
Song, M.-K., Cairns, E.J., and Zhang, Y., Lithium/sulfur batteries with high specific energy: old challenges and new opportunities, Nanoscale, 2013, vol. 5, p. 2186.
Ji, X. and Nazar, L.F., Advances in Li–S batteries, J. Mater. Chem., 2010, vol. 20, p. 9821.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия