Электрохимия, 2022, T. 58, № 5, стр. 211-225
Электрохимический синтез покрытий на основе полидифениламин-2-карбоновой кислоты на анодированной графитовой фольге, модифицированных графеновыми нанолистами и оксидами марганца
В. В. Абаляева a, *, Н. Н. Дремова a, Ю. В. Баскакова a, Е. Н. Кабачков a, С. А. Баскаков a, О. Н. Ефимов a
a Учреждение Российской академии наук Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. Академика Н.Н. Семенова, 1, Россия
* E-mail: avva@icp.ac.ru
Поступила в редакцию 02.07.2021
После доработки 08.09.2021
Принята к публикации 21.09.2021
- EDN: FGFAUJ
- DOI: 10.31857/S0424857022050036
Аннотация
Изучены особенности электрохимической полимеризации дифениламин-2-карбоновой кислоты (ДФАК) в щелочном электролите на анодированной графитовой фольге (АГФ) с использованием модификаторов электросинтеза (ЭС): нанолистов восстановленного оксида графена (НЛОГ) и двуокиси марганца. Исследованы физико-химические свойства и электрохимические характеристики полученных электроактивных полимерных покрытий (ПДФАК) в 1 М растворе H2SO4 в интервале потенциалов –1…+1.5 В. Результаты электрохимических, электронномикроскопических и рентгенофотоэлектронных исследований позволили предположить особенности электрополимеризации дифениламин-2-карбоновой кислоты на поверхностях АГФ. Рассчитанные значения электрохимической емкости, устойчивости полимерных покрытий при многоцикличных и зарядно-разрядных исследованиях показали хорошие характеристики исследованных материалов для разработки на их основе электродных материалов для суперконденсаторов.
1. ВВЕДЕНИЕ
Развитие зеленой энергетики (солнечные батареи, ветро- и приливные электростанции) с прерывистым циклом эксплуатации требует промежуточного запасания энергии. Для решения этой задачи одним из перспективных направлений является разработка, исследование и использование электрохимических суперконденсаторов (ЭСК).
По механизму запасания энергии в электрохимическом процессе ЭСК делятся на два типа [1]: 1) электрохимические двойнослойные конденсаторы (ЭДСК), в которых преимущественно используются углеродные материалы (такие, как активированные угли, графеноподобные материалы, углеродные нанотрубки (УНТ) и т.д.), имеющие высокую площадь поверхности. Процесс накопления энергии в ЭДСК основан на образовании двойного электрического слоя на границе раздела электролита и электрода системы; 2) псевдоконденсаторы основаны на материалах, подвергающихся окислительно-восстановительным реакциям [2, 3]. В качестве перспективного направления для сочетания достоинств этих двух типов суперконденсаторов и приближения к аккумуляторам рассматриваются нанокомпозитные материалы с использованием высокопористых углеродных материалов, проводящих полимеров и оксидов переходных металлов с различными степенями окисления. Одним из наиболее изученных и высоко активных окислов для суперконденсаторов долгое время оставался RuO2. Недорогой альтернативой RuO2 является оксид марганца (MnO2), полученный химическим и электрохимическим путями. Введение оксидов Mn в состав композитного материала позволяло увеличить удельную емкость нового материала от 40 до 80% [4, 5] по сравнению с исходным. Достоинствами MnO2 также являются его низкая стоимость и высокая теоретическая емкость (около 1370 Ф г–1) [6]. Также MnO2 обладает широким потенциальным окном в нейтральных водных электролитах, бóльшим, чем другие оксиды переходных металлов (NiO и Co3O4), которые также изучаются в кислотных или щелочных электролитах [6]. Рентгеноструктурный анализ комплексов полианилина и оксида Mn указывает на существование взаимодействий между интеркалированными слоями ПАни и оксида марганца [7]. Включение MnO2 в состав электродного материала позволяет достигать значений плотности энергии 34.56 Вт ч кг–1 с отличной циклической стабильностью (87.2% емкости сохраняется после 5000 циклов) [8].
Ранее нами было предложено создавать высокопористый слой на поверхности графитовой фольги путем анодного травления [9]. При этом на поверхности образуются полярные кислородсодержащие группы, что улучшает смачиваемость электрода электролитом. Электрохимическая полимеризация и синтез проводящего полимера на таком электроде приводят к заполнению пор полимером с образованием поверхностного композитного слоя. Тесный контакт графитовой фазы и полимера, содержащего электролит, в этом слое обеспечивает оптимальный электронный и ионный транспорт при протекании фарадеевских окислительно-восстановительных реакций. Развитая поверхность раздела электрод/электролит в поверхностном нанокомпозитном слое позволяет обеспечивать достойный вклад заряжения двойного слоя в значение электрохимической емкости. Важным достоинством такого подхода являются формирование гибкого электрода без использования металлического токоотвода, токопроводящих добавок и инертного полимерного связующего.
В настоящей работе в качестве мономера продолжено исследование электрохимической полимеризации дифениламин-2-карбоновой кислоты (ДФАК), химическая окислительная полимеризация которой была исследована в [10, 11], а электрохимическая полимеризация впервые в нашей предыдущей работе [12]. Интерес к полимерам и композитам на основе этого мономера вызван возможностью включения в состав композита наноразмерных оксидов металлов, благодаря присутствию хелатирующих карбоксильной и аминогрупп [13]. Композитные покрытия, на основе ПДФАК, кроме использования в суперконденсаторах, могут иметь потенциал использования в качестве электромагнитных экранов, сенсоров, сорбентов, электрокатализаторов и др. Литературные данные об электрополимеризации ДФАК ограничены всего одной статьей [14], в которой представлены результаты электросинтеза полимера ДФАК на гладкой стеклоуглеродной подложке. Задачей настоящей работы является продолжение исследования электрохимической полимеризации ДФАК на высокопористой поверхности анодированной графитовой фольги с модифицирующими добавками нанолистов оксида графена (НЛОГ) и оксида марганца, которые могут улучшать условия электросинтеза и электрохимические характеристики электрода. Из литературных данных известно, что координация донорных анилиновых мономеров с акцепторной графеновой поверхностью способствует эффективному катализу электрохимической окислительной полимеризации анилина [15]. Оксиды Mn, помимо увеличения фарадеевской псевдоемкости, также могут инициировать электрополимеризацию анилина [8].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Исходные реактивы и материалы
Исходные реактивы дифениламин-2-карбоновая кислота (ДФАК), гидроокись калия марки ч. д. а. дополнительной очистке не подвергались. Для электрохимического синтеза (ЭС) и электрохимических исследований были приготовлены 1 × 10–3 М раствор ДФАК в 0.2 М КОН, 1 М раствор H2SO4 и 0.2 М раствор MnSO4 в дистиллированной воде. Концентрация оксида графена (ОГ) в воде составила 13 мг ОГ в 1 мл суспензии. Пластину графитовой фольги (ГФ) размером 50 × 10 × × 0.6 мм активировали по описанной методике [16] в 0.1% (NH4)2SO4 при 3 В в течение 1 мин. В этом процессе рабочим анодом являлась пластина анодируемой графитовой фольги, катодом служила пластина из нержавеющей стали. После анодирования пластину анодированной ГФ (АГФ) осторожно вынимали из раствора, промывали дистиллированной водой, высушивали при 60°С до постоянного веса, после чего использовали в качестве рабочего электрода в ЭС. Разрыхление (разрыв поверхностных слоев графеновых листов) поверхности ГФ начинается с 1-й мин анодирования, а после 5 мин наблюдается разрушение (отслоение) элементов поверхностных слоев. Все промежуточные времена определяют степень разрыхления. В данной работе использовали минимально разрыхленную АГФ, полученную после 1 мин разрыхления. Она имеет плотно упакованную чешуйчатую структуру. По сравнению с ГФ (содержание О2 1.6%) поверхность разрыхленной АГФ характеризуется возросшей концентрацией кислородсодержащих групп (содержание О2 до 9.6%) и повышенной гидрофильностью поверхности, что приводит к улучшению смачивания электрода электролитом [16].
Оксид графита получали из природного графита марки ГК-1 (содержание золы ≤1 мас. %, ГОСТ 4404–78) по модифицированному методу Хаммерса, описанному в [17].
Суспензию нанолистов оксида графена (НЛОГ) получали диспергированием оксида графита в деионизованной воде с помощью ультразвука с последующим центрифугированием суспензии по описанной методике [18]. Для этого 300 мг ОГ смешивали с 400 мл дистиллированной воды, и полученную смесь обрабатывали в ультразвуковой ванне в течение 1 ч. Далее образовавшуюся суспензию центрифугировали 15 мин при ускорении 3000 g для удаления крупных частиц. Концентрация НЛОГ в конечной суспензии составляла 13 мг сухого вещества на 1 мл суспензии.
2.2. Условия электрохимического синтеза (ЭС) и электрохимических исследований
ЭС полимера ДФАК проводили в потенциодинамическом режиме из 1 × 10–3 М раствора ДФАК в 0.2 М КОН. Электрохимические исследования проводили в потенциодинамическом или гальваностатическом режимах в интервале потенциалов –1…+1.5 В (относительно Ag/AgCl) в трехкамерной стеклянной электрохимической ячейке (используемый объем электролита 15 мл) при комнатной температуре в 1 М H2SO4 на потенциостате PS-7 (фирма Элинс, Россия) с программным обеспечением. Все потенциалы приведены относительно указанного электрода сравнения. Пространства рабочего и вспомогательного электродов были разделены пористой стеклянной перегородкой. В качестве рабочей поверхности использовали 1 см2 пластины из АГФ (размером 1 × 5 см), вспомогательным электродом служила чистая СУ-2000 пластина (размером 1 × 5 см). Удельную электрохимическую емкость (мФ/см2) рассчитывали по формуле CS = jt/ΔV, где j – удельная плотность тока (мА/см2), рассчитанная из площади композитной пленки на электроде; t – время разряда (с); ΔV – область потенциалов (В), в которой происходит разряд.
2.3. Физико-химические исследования
Электронномикроскопические исследования осуществляли на растровом электронном автоэмиссионном микроскопе Supra 25 производства Zeiss с рентгеноспектральной энергодисперсионной приставкой INCA Energy производства Oxford Instruments. Разрешение на получаемых изображениях составляет величину 1–2 нм.
Рентгеновские фотоэлектронные спектры (РФЭС) высокого разрешения С1s, O1s и N1s регистрировали на электронном спектрометре для химического анализа Specs PHOIBOS 150 MCD, рентгеновская трубка с магниевым анодом (MgKα-излучение 1253.6 эВ). При съемке спектров вакуум в камере спектрометра не превышал 3 × 10–9 мбар. Мощность источника составляла 225 Вт. Спектры регистрировались в режиме постоянной энергии пропускания (40 эВ для обзорного спектра и 10 эВ для отдельных линий). Обзорный спектр записывался с шагом 1 эВ, спектры отдельных линий – с шагом 0.05 эВ. ИК-спектры регистрировали с помощью инфракрасного фурье-спектрометра Perkin Elmer Spectrum Two, оснащенного приставкой многократного нарушенного полного внутреннего отражения с алмазной призмой, в диапазоне 4000–450 см–1.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
3.1. Электросинтез (ЭС) полимера дифенил- 2-карбоновой кислоты (ДФАК) на активированной графитовой фольге (АГФ). (Образец 1)
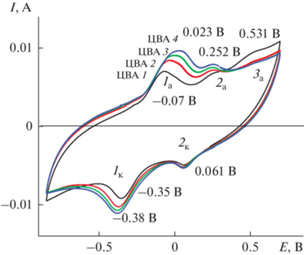
На рис. 1 показан ЭС ПДФАК на АГФ-электроде (как описано в 2.2) из 1 × 10–3 М ДФАК в 0.2 М КОН. ЭС начинали при потенциале разомкнутой цепи 0.48 В и проводили в интервале потенциалов –0.8…+0.8 В в течение 40 циклов, при которых происходит рост полимерного покрытия. 40 циклов ЭС в интервале потенциалов ‒0.8…+0.8 В (рис. 1) были разделены на 4 серии по 10 циклов и, соответственно, на рис. 1 обозначены как ЦВА 1, 2, 3, 4. При электрохимическом циклировании наблюдался постоянный рост тока для редокс-пары 1a = –0.07 В и 1к = –0.38 В. Эти анодный и катодный пики, по-видимому, являются членами редокс-пары, соответствующей окислению и восстановлению ПДФАК, поскольку в каждой серии ЦВА интенсивности катодного и анодного пиков увеличиваются с ростом числа циклов. Более слабая пара пиков 2а и 2к может соответствовать катион-радикалу мономера, который расходуется в процессе ЭС. Также о присутствии дополнительных окисляемых фрагментов, которые расходуются при строительстве полимерной цепочки, свидетельствует широкий и слабый анодный пик 3а, обозначенный только на первых циклах ЭС, впоследствии практически исчезнувший. По окончании ЭС тщательно промытый электрод исследовался в 1 М H2SO4.
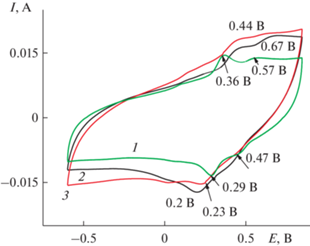
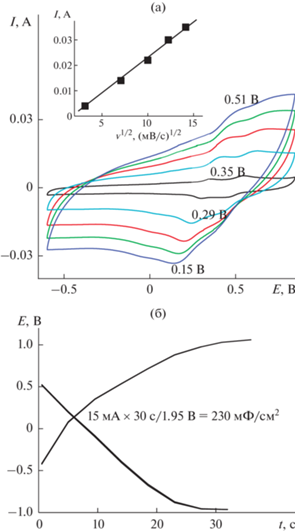
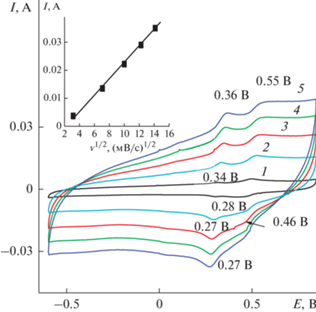
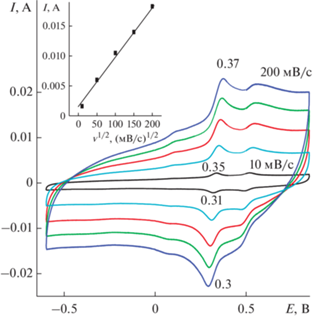
Первая ЦВА 1 на рис. 2 показала, так же как и при ЭС, две пары пиков: ЕА 0.36 и 0.57 В и ЕК 0.29 и 0.47 В. В кислом растворе ΔА–К составляла 0.07 и 0.1 В (рис. 2, ЦВА 1) против 0.45 и 0.19 В (рис. 1, ЦВА 4) во время ЭС. Значительно увеличивается ΔEA–K c увеличением скорости циклирования (рис. 3а) от 0.05 В при 10 мВ/с до 0.35 В при 200 мВ/с. Этот факт свидетельствует о трудностях свободной диффузии ионов в материале. После разноскоростных циклирований ΔА–К между основными пиками на ЦВА 2 (рис. 2) увеличилась до 0.2 В и, соответственно, изменилось их расположение. После 500 циклов окончательная ЦВА 3 (рис. 2) имела квазипрямоугольную форму, характерную для двойнослойных суперконденсаторов с двумя слабо выраженными фарадеевскими пиками ЕА = 0.44 В и ЕК = 0.23 В, которые могли внести незначительный вклад фарадеевской емкости в общее значение электрохимической емкости. На ЦВА 3 ΔА–К и само расположение катодного и анодного пиков практически не изменилось. Можно сделать вывод о том, что проведенного количества циклирований было достаточно для стабилизации композитного электрода. Зависимость величины анодного тока (вкладка к рис. 3а) имеет прямолинейную зависимость от корня квадратного из скорости циклирования. Изменения характеристик ЦВА в процессе проведенных исследований свидетельствуют о трудностях [19, 20] в полученном покрытии с прохождением окислительно-восстановительных процессов. Финальное значение Суд (рис. 3б) составило 230 мФ/см2 с интервалом рабочих потенциалов 1.9 В. Характеристики этого исходного материала послужат ориентиром для оценки получаемых результатов в условиях модификации ЭС ДФАК.
3.2. Электросинтез (ЭС) полимера дифениламин- 2-карбоновой кислоты (ДФАК) на активированной графитовой фольге (АГФ), предварительно покрытой нанолистами оксида графена (НЛОГ). (Образец 2)
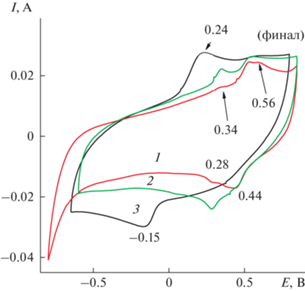
Исходную (пункт 2.1) суспензию НЛОГ, содержащую 13 мг сухого вещества в 1 мл суспензии, разбавляли 5 раз и наносили суспензии на 1 см2 поверхности электрода АГФ. Суспензия достаточно хорошо впитывалась в материал электрода. Образец выдерживали 24 ч в условиях вакуума при комнатной температуре, после чего проводили ЭС в потенциодинамическом режиме из 1 × 10–3 М раствора ДФАК в 0.2 М КОН в интервале потенциалов –1…+0.85 В. Увеличить проводимость нанесенной поверхностной пленки НЛОГ на АГФ можно электрохимическим восстановлением кислородных функциональных групп, входящих в состав НЛОГ. Такое восстановление проходит в разных электролитах, согласно нашим и литературным данным, в интервале от 0.9 до 1.2 В [21, 22]. Поэтому интервал ЭС установили –1…+0.85 B. Всего было проведено 40 циклов ЭС, разбитых на 4 серии по 10 циклов, для возможности контролировать прохождение ЭС. Визуальное сравнение (рис. 4) площадей ЦВА 1, 2, 3 и 4 демонстрирует увеличение скорости ЭС от ЦВА 1 до ЦВА 4. На ЦВА 1 и ЦВА 2, т.е. первые 20 циклов, площадь ЦВА увеличивается незначительно. Первые циклы ЭС проходят на плохо проводящей (невосстановленной) поверхности НЛОГ, и потому накопление ПДФАК (от ЦВА 1 к ЦВА 2) проходит очень медленно. Начало процесса электровосстановления поверхностных кислородных групп НЛОГ приводит к увеличению проводимости активной поверхности и, как следствие, к увеличению скорости ЭС (от ЦВА 2 к ЦВА 3 и ЦВА 4). Сразу после перевода исследований в 1 М H2SO4 первая ЦВА 1 (рис. 5) имеет пару достаточно широких пиков с ЕА = 0.56 и 0.34 В и ЕК = 0.28 и 0.44 В.
Рис. 4.
ЭС ПДФАК на АГФ, покрытой НЛОГ. 1 × 10–3 М ДФАК в 0.2 М КОН, 100 мВ/с. Цифры – обозначение серий по 10 циклов.
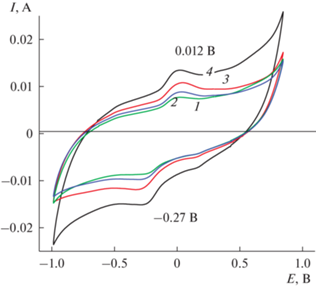
Следующее разноскоростное циклирование (рис. 6) показало изменение соотношения активности указанной пары пиков после ЦВА 1 (v = = 10 мВ/с) уже на ЦВА 2 (v = 50 мВ/с). Слабая пара пиков ЕА = 0.34 В и ЕК = 0.28 В стала расти активнее и на следующих этапах циклирования (ЦВА 3, 4, 5 на рис. 6) эта пара пиков стала основной с сильным катодным пиком 0.27 В и очень слабым 0.46 В. Зависимость анодного тока (вкладка к рис. 6) носит прямолинейный характер в координатах I/V1/2, что свидетельствует о том, что имеются диффузионные ограничения для прохождения окислительно-восстановительных процессов при электрохимических превращениях. После разноскоростных исследований (ЦВА 2) и после 500 циклирований окончательный вид ЦВА 3 показан на рис. 5. Интересной особенностью данного композитного материала (рис. 7) оказалась незначительная зависимость СУД при зарядно-разрядных циклированиях от плотностей тока. Расчет СУД при плотностях тока 15, 20 и 25 мВ/с показывает, что в данном интервале плотностей тока СУД составляет в среднем 800 мФ/см2. При этом обращает на себя внимание факт значительного увеличения СУД от 230 для образца 1 до 800 мФ/см2 для образца 2 и интервала потенциалов зарядно-разрядного процесса от 1.9 В для образца 1 (рис. 3б) до 2.5 В для образца 2 (рис. 7, кривая 1).
3.3. Электросинтез (ЭС) полимера дифениламин- 2-карбоновой кислоты (ДФАК) с добавками модификатора в состав электролита
3.3.1. Модификатор – суспензия нанолистов оксида графена (НЛОГ) (Образец 3). Исходную (пункт 2.1) суспензию НЛОГ, содержащую 13 мг сухого вещества в 1 мл суспензии, разбавляли 5 раз и добавляли 1 мл полученной суспензии к 15 мл стандартного реакционного раствора (1 × × 10–3 моля ДФАК в 0.2 М КОН). Соотношение ДФАК/НЛОГ получилось 1 : 6. Суспензии НЛОГ достаточно устойчивы для проведения ЭС [23]. ЭС ПДФАК из 1 × 10–3 М раствора ДФАК в 0.2 М КОН в смеси с суспензией НЛОГ (ЦВА 1 и 2, рис. 8) начинался очень медленно. Вероятно, плохо проводящие невосстановленные частицы НЛОГ, адсорбирующиеся на поверхности АГФ, не способствовали окислению ДФАК с образованием катион-радикалов ДФАК и дальнейшему ходу ЭС. Для ускорения процесса восстановления кислородных функциональных групп, входящих в состав НЛОГ, и увеличения проводимости поверхности пленки АГФ в данных обстоятельствах интервал потенциалов постепенно расширяли в катодном направлении. Увеличение катодного потенциала до 1.2, затем 1.3 и далее1.4 В (рис. 8) инициировало начало ЭС (ЦВА 3, 4, 5 на рис. 8). По окончании ЭС дальнейшее исследование полученного покрытия проводилось в 1 М H2SO4 (рис. 9, ЦВА 1). На ЦВА 1 четко видны две пары фарадеевских пиков с ЕА 0.1 и 0.54 В и соответствующие им катодные пики с ЕК –0.17 и 0.33 В. ∆ЕА–К для этих двух пар пиков составляли соответственно 0.27 и 0.21 В. После разноскоростных циклирований (рис. 10), 500 циклирований (100 мВ/с) наблюдалось увеличение площади ЦВА (соответственно, ЦВА 2 и ЦВА 3 на рис. 9). График зависимости величины анодного тока от скорости циклирования (верхняя вкладка на рис. 10) носит прямолинейный характер в координатах IА/√v, что подтверждает наличие диффузионных ограничений при окислительно-восстановительном допировании–дедопировании. На нижней вкладке (рис. 10) показана ЦВА 1, которая снята при скорости циклирования потенциала 10 мВ/с. На ЦВА четко видно значительное увеличение тока при катодном потенциале –0.85 В. Это может быть результатом дополнительного восстановления кислородных функциональных групп НЛОГ в составе полимерного покрытия. Невосстановленные или частично восстановленные частицы НЛОГ могут размещаться между цепями образующегося полимера, образуя таким образом новый композитный материал.
Рис. 8.
ЭС ПДФАК из АГФ, из 1 × 10–3 М ДФАК в 0.2 М КОН с суспензией НЛОГ; ДФАК : НЛОГ = 1 : 2, 100 мВ/с. Цифры – обозначение серий по 10 циклов.
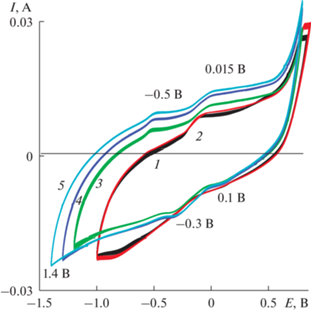
Рис. 9.
ЦВА ПДФАК/АГФ с НЛОГ в электролите в 1 М H2SO4 после: ЭС (1), разноскоростных циклирований (2), 500 циклирований (3).
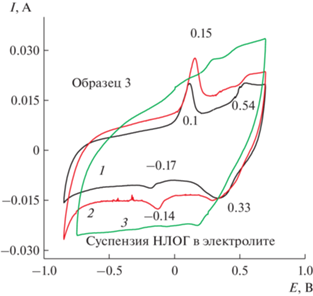
Рис. 10.
Разноскоростное циклирование ПДФАК-АГФ с НЛОГ в электролите; верхняя вкладка – зависимость IA/v; нижняя вкладка – ЦВА 1 (10 мВ/с).
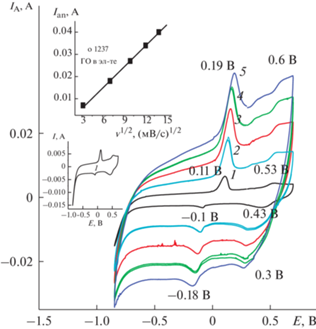
После разноскоростного циклирования ЦВА 2 (рис. 9) практически не изменила свой вид, показывая в данном случае высокую устойчивость при данном циклировании полученного покрытия. Это же подтверждает и минимальный сдвиг (рис. 9, ЦВА 1 и 2) потенциалов анодного и катодного пиков в анодную область соответственно на 10 и 20 мВ. Значительные изменения претерпела ЦВА 3 (рис. 9) после циклирования на протяжении 500 циклов с v = 100 мВ/с.
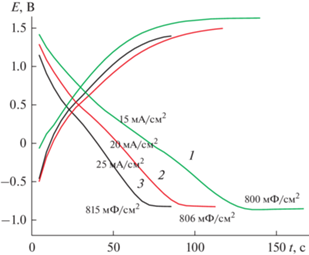
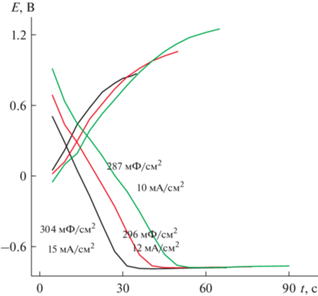
При зарядно-разрядном циклировании разными токами от 10 до 15 мА/см2 замечено, что для данного покрытия величина тока заряда значительно определяет анодный потенциал заряда (рис. 11) и, следовательно, рабочий интервал возможностей данного материала. Катодный потенциал разряда при всех плотностях токов остается постоянным. СУД для измеренных токов составляет 287–304 мФ/см2.
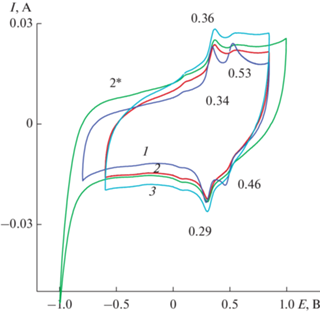
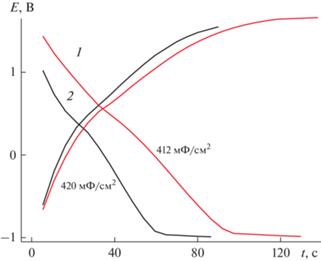
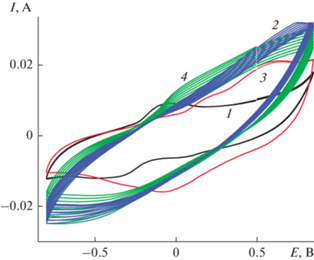
3.3.2. Модификатор – 0.2 М MnSO4 в воде (Образец 4). Активация ЭС ПДФАК включением в структуру полимера оксидов Mn проводилась в два этапа. На первом этапе осуществлялось 10 циклов ЭС из 1 × 10–3 М раствора ДФАК в 0.2 М КОН (рис. 12, ЦВА 1). Затем электрод удалялся из этого первого рабочего раствора, промывался водой и помещался во второй рабочий раствор: 0.2 М раствор сульфата Mn, где также проводили 10 циклирований со стандартной скоростью 100 мВ/с (рис. 12, ЦВА 2). Далее электрод возвращался в первый рабочий раствор для 10 циклирований (рис. 12, ЦВА 3) и последним было циклирование в Mn-электролите (рис. 12, ЦВА 4). Исследование полученного образца проводилось в 1 М H2SO4 (рис. 13). Первая ЦВА (рис. 13, ЦВА 1) содержит две пары равноценных пиков с ЕА = 0.34 и 0.53 В и ЕК = 0.29 и 0.46 В. Для этих двух пар пиков ∆А–К составляет соответственно 50 и 70 мВ. Разноскоростное циклирование (рис. 14) подтверждает равновесную систему, которую демонстрирует данное покрытие. Это выражается в прямолинейной зависимости анодного тока первого из пиков на ЦВА 1 от скорости циклирования. Такая зависимость позволяет утверждать об отсутствии диффузионных ограничений при окислительно-восстановительных процессах в данной системе. Это факт подтверждается и сдвигом значений анодного и катодного потенциалов первых пиков в пределах 20 мВ при увеличении скорости циклирования от 20 до 200 мВ/с. Соотношение интенсивностей двух исходных пиков изменилось. Первый пик 0.34 В сохранил свою интенсивность на протяжении всего исследования, второй 0.53 В при разноскоростных циклированиях, при высоких скоростях циклирования, особенно в катодной своей части, превратился в широкий пик, которого практически не стало видно при последующем многоцикличном испытании (ЦВА 2 на рис. 13). Изменение интервала циклирования (ЦВА 2′ на рис. 13) показало устойчивость этого состояния композита. Конечная ЦВА после 500 циклирований значительно приблизилась к квазипрямоугольной форме (ЦВА 3 на рис. 13), с парой пиков 0.36 и 0.29 В, которая продолжила вносить вклад фарадеевских токов в значение СУД. Расчет СУД по зарядно-разрядным кривым (рис. 15) показал значение около 412–420 мФ/см2 при разных плотностях токов и интервале циклирования 2.5 В.
Рис. 12.
ЭС ПДФАК из АГФ, из 1 × 10–3 М ДФАК в 0.2 М КОН (ЦВА 1 и 3) и из 0.2 М MnSO4 (ЦВА 2 и 4), 100 мВ/с. Цифры – обозначение серии по 10 циклов.
4. ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПОЛУЧЕННЫХ ОБРАЗЦОВ
4.1. СЭМ-изображение
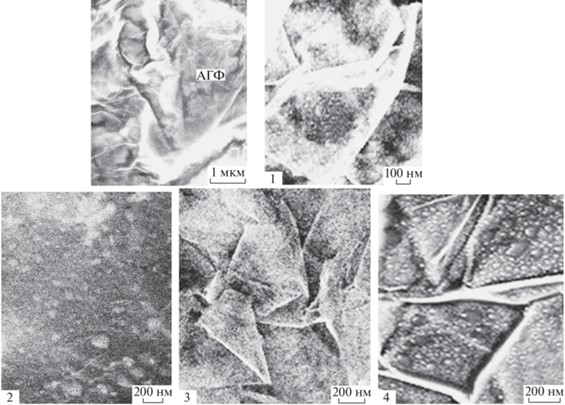
На рис. 16 фото (АГФ) показывает изображение поверхности чистой анодированной фольги, на которой проходили все ЭС. При анодировании графеновые листы разрываются и представляют собой отдельные смятые фрагменты, расположенные в беспорядке на поверхности, как это представлено на фото (АГФ). Перед ЭС их поверхность, как это видно из фото (АГФ), ничем не покрыта. Следующие четыре фото изображают поверхности АГФ с синтезированными покрытиями. На фото поверхностей (1), (3) и (4) сохраняется первоначальная структура, на которой осаждены синтезируемые продукты. На фото (2) исходная разрыхленная при анодировании поверхность просматривается очень слабо, отдельные разорванные фрагменты покрыты слоем, сглаживающим первоначальную картину. На поверхность этого образца перед ЭС был осажден НЛОГ, который покрыл и практически сравнял сложную поверхность АГФ, на которой впоследствии проходил ЭС ПДФАК. Из данного фото можно заключить, что образованное таким образом покрытие сохранило исходную рыхлую поверхность с внедренными в его состав отдельными глобулами полимера размером до нескольких сотен нм. На образце (3) ЭС проходил из электролита, в котором присутствовала суспензия НЛОГ. Поверхность этого образца представляется затемненной по сравнению с образцами (1) и (4). Можно допустить, что во время ЭС частицы суспензии НЛОГ из электролита адсорбировались на АГФ. В случаях (2) и (3) образующийся полимер либо синтезировался на активной восстановленной во время ЭС поверхности НЛОГ (2), либо включал в свои цепи невосстановленные частицы НЛОГ (3). Но в первом случае осажденные частицы НЛОГ были хорошо проводящим слоем, так как успевали восстановиться во время адсорбции (при потенциалах +0.85…–1 В). Во втором случае осаждаемый полимер был окружен плохо проводящим слоем невосстановленного НЛОГ. Это может объяснить самое высокое значение СУД для образца, полученного на поверхности АГФ, предварительно обработанной НЛОГ с восстановлением при циклировании до катодного потенциала –1 В. На образцах (1) и (4) хорошо видны осажденные продукты полимеризации. Можно отметить, что в образце (4) наблюдаются достаточно равномерно распределенные по поверхности АГФ укрупненные гранулы, и такое расположение создает благоприятные условия для беспрепятственного подхода электролита при окислительно-восстановительных превращениях во время циклирования. Образец (4) – единственный, в котором зависимость iАН/v означает отсутствие диффузионных ограничений во время электрохимических циклирований. При исследовании полимеризации анилина в присутствии сульфата Mn в составе электролита [24] мы показали, что за счет образования внутренних координационных связей между оксидом Mn- и N-центрами образующегося полианилина композитный материал представляет “сетчатую структуру”, достаточно жесткую и потому устойчивую по сравнению с исходным полианилином при многочисленных испытаниях. Аналогичная структура могла образоваться в образце (4) при полимеризации ДФАК в присутствии ионов Mn.
4.2. ИК-спектры
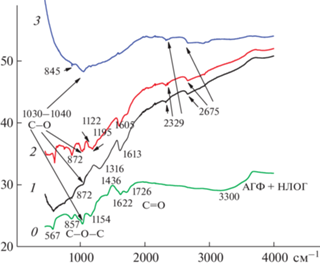
На рис. 17 представлены ИК-спектры образцов (1), (2) и (3). Полосы поглощения (пп) в диапазоне 1200–1400 см–1 обусловлены валентными колебаниями связи С–N ароматического амина (спектры 1 и 2) [25]. Наличие этих пп в спектрах 1 и 2 подтверждает ЭС ПДФАК на поверхностях АГФ (спектр 1) и АГФ-НЛОГ (спектр 2). Пп при 1030–1040 см–1 можно отнести к валентным колебаниям связи S=O в SO3-группах. Это указывает на то, что все продукты (спектры 1–4) были получены в присутствии серной кислоты в электролите [25]. В спектре 0 присутствуют две полосы 1622 и 1726 см–1. Первый пик приписывается С=О в функциональной группе –СООН [26, 27]. Второй пик [28, 29] характеризует наличие С=О в других некислотных группах, например С(О)Н. Самую высокую интенсивность этот пик имеет в спектре 0, на котором изображен невосстановленный образец НЛОГ, адсорбированный на АГФ. В спектре 1, отражающем ЭС ПДФАК на поверхности АГФ, этого пика нет совсем, а в спектре 2, отражающем ЭС на поверхности АГФ с адсорбированным НЛОГ, этот пик имеет очень малую интенсивность. Это подтверждает факт восстановления групп С=О в НЛОГ в процессе ЭС. В спектре 2 пик 1122 см–1 является характерным при растяжении (В–NН+) [30]. Полосы в районе 850–870 (наиболее активные в спектрах 0 и 2, при наличии в них НЛОГ) характерны для С–Н деформационных внеплоскостных колебаний 1,4-дизамещенного бензольного кольца. Корреляция этих полос с наличием пп после 2000 см–1 (на спектрах 1, 2 и 3 полосы 2329 и 2675 см–1) свидетельствует о хорошей проводимости [29] в образцах (1) и (2) и частично в образце (3), которая во многом связана с тесной координацией ароматического скелета ДФАК и НЛОГ [30] и возможным образованием водородных связей [31].
4.3. РФЭ-спектры
ЭС изучаемых покрытий проводился на графеновых поверхностях АГФ (рис. 16, образцы 1, 3, 4) или НЛОГ (образец 2). Углеродные атомы этих поверхностей находятся в состоянии sp2 (спектр С1s, 284.3 эВ). Акцепторная графеновая поверхность должна активно взаимодействовать с ароматическими кольцами мономеров, адсорбированных на ней для дальнейшей полимеризации [32]. Помимо ароматической системы мономера активную роль в координации и дальнейшей активации адсорбированного мономера играет электронная пара атома азота, являясь активным донором для координации с акцепторной графитовой поверхностью. На спектрах N1s (рис. 18) можно проследить влияние взаимодействия амино-групп полимера с активированной поверхностью АГФ. Образование N-центром водородных связей также снимает с атома N часть электронной плотности на образование этой связи, показывая перенос заряда от богатых электронами атомов азота. При интерпретации РФЭ-спектров были использованы данные работ [4, 32–38]. Примерное состояние окисления азотного центра может быть представлено схемой 1 [34]:
Схема 1 . Состояние окисления азотного центра при полимеризации ДФАК.
Рис. 18.
РФЭ-спектры покрытий, полученные в ЭС: (1) на АГФ, (2) на АГФ с нанесенным НЛОГ, (3) на АГФ с добавлением в электролит суспензии НЛОГ, (4) на АГФ с добавлением в электролит сульфата Mn.
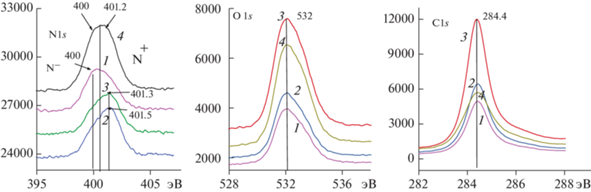
В спектрах N1s полимерного покрытия ПДФАК/АГФ (рис. 18, N1s, спектр 1) локализована одна основная вершина с энергиями связей 400 эВ, что соответствует (схема 1 , состояние А с переходом к состоянию Б) практически нейтральному cостоянию атома азота. В образцах (2) и (3) по аналогии с полианилином расположение вершины энергии связи при 401.3–401.5 эВ можно отнести, согласно схеме 1 , к состоянию Б с переходом к состоянию В. В этом случае образуются самые прочные координационные связи донора (атома N) с акцептором (поверхностью НЛОГ), т.е. положительно заряженного имина в биполяронном состоянии (дикатион-радикал) и протонированного амина в поляронном состоянии (катион-радикал) [37]. При изучении РФЭ-спектров N1s хорошо видно во всех четырех полученных образцах покрытий разное состояние энергий связей атомов N в зависимости от адсорбирующей поверхности. Более высокая степень окисления азотного центра может свидетельствовать о более тесном контакте образующегося полимера с подложкой. Из трех обсужденных к данному моменту образцов (1)–(3) образец (2) показал самое высокое значение СУД 800 мФ/см2 с самым высоким значением интервала циклирования заряда–разряда 2.5 В. В образце (3), также согласно данным РФЭС, наблюдается сдвиг энергии активации азотной связи в сторону комплексообразования с НЛОГ, участвующим в процессе полимеризации в качестве добавки в электролит. Возможно, в данном случае слои НЛОГ, попадая между цепями ПДФАК в недовосстановленном состоянии, снижают проводящую способность такого композита. Результатом является не очень высокое значение СУД (300 мФ/см2) по сравнению с образцом (2). Широкий пик N1s в спектре образца (4) указывает на то, что в пленках сосуществуют несколько структур, что явно является результатом более чем одного типа N. Каждый из этих спектров может быть разложен на четыре гауссовых пика с энергией связи 398.4, 399.5, 401.0 и 402.5 эВ. Склон пика с низкими энергиями характеризует присутствие аминного азота полимера, в то время как другой склон с энергиями 401–402 эВ соответствует положительно заряженному азоту. Сообщалось, что в результате сшивания полимерных цепей под влиянием Mn2+ возникают циклические виды азота, которые имеют энергию связи, близкую к протонированному имину (401.3 эВ [38]), поэтому пик при 401.3 эВ (рис. 18, N1s) должен перекрываться с сигналом протонированного имина и циклического азота. В спектрах О1s практически на всех спектрах наблюдается отклонение правого склона спектра от симметричного положения. Правый склон пика O1s для образца (4) имеет ярко выраженный несимметричный правый склон, который характеризует наличие, согласно данным [38], кислородных связей в соединениях Mn(II), Mn(III), Mn(IV). Это является следствием окисления Mn(II) в MnOx при электрохимическом циклировании электрода в среде MnSO4 и осаждения этих окислов на поверхности ПДФАК и их координационном взаимодействии. Сшивание полимерных цепей стабилизирует поведение полимера при окислительно-восстановительных превращениях. Поэтому образец (4) занимает промежуточное место в ряду (табл. 1) изученных вариантов модификации полимеров.
Таблица 1.
Численная характеристика образцов (1)–(4)
| Состав | СУД, мФ/см2 | Ток разряда, мА/см2 | Интервал потенциалов заряда–разряда, В |
|---|---|---|---|
| (Образец 1) ПДФАК/АГФ | 230 | 15 | 1.9 |
| (Образец 2) ПДФАК/АГФ + НЛОГ | 800 | 15 | 2.5 |
| (Образец 3) ПДФАК/АГФ НЛОГ в электролите | 300 | 15 | 2 |
| (Образец 4) ПДФАК/АГФ Mn+2 в электролите | 420 | 15 | 2.4 |
Спектры С1s для всех композитных материалов очень близки. Из этого следует, что образование координационных связей ПДФАК происходит в основном за счет взаимодействия атомов N (мономера, олигомеров и полимеров), ароматических структур и атомов О (кислородсодержащие группы АГФ, НЛОГ и MnOx), практически не затрагивая атомы С.
5. ВЫВОДЫ
Проведена электрохимическая полимеризация дифениламин-2-карбоновой кислоты на графеновых подложках:
1. Показано на примере расчета СУД, что электрохимическая активность покрытий в значительной степени зависит от координации осаждаемого на данную поверхность мономера (в дальнейшем и полимера) с подложкой. Как показало исследование РФЭС, такая координация оказалась самой эффективной в случае образования композита НЛОГ с ПДФАК на АГФ. Этот образец показал из всех исследованных образцов самое высокое значение СУД при широком интервале потенциалов зарядно-разрядного процесса.
2. Модификация композитных полимерных покрытий при ЭС ПДФАК на АГФ, исследованная при включении в состав электролита (1 М H2SO4) в одном случае суспензии НЛОГ (образец 3), в другом – сульфата Mn (образец 4) позволила улучшить количественные характеристики покрытий.
3. Введение дополнительных источников координации (модификация поверхности электрода или условий электросинтеза) активизирует окислительно-восстановительные процессы в полученных образцах, и их расчетные показатели (табл. 1) превышают показатели немодифицированного композита сравнения.
Список литературы
Вольфкович, Ю.М. Электрохимические суперконденсаторы. Электрохимия. 2021. Т. 57. С. 197. [Volfkovich, Yu.M., Electrochemical Supercapacitors, Russ. J. Electrochem., 2021, vol. 57, p. 311.]
Prasada, K.R. and Miura, N., Polyaniline–MnO2 Composite Electrode for High Energy Density Electrochemical Capacitor, Electrochem. Solid-State Lett., 2004, vol. 7, p. A425.
Reddy, R.N. and Reddy, R.G., Sol–gel MnO2 as an electrode material for electrochemical capacitors, J. Power Sources, 2003, vol. 124, p. 330.
Sun, L.-J., Liu, X.-X., Chena, L., and Gu, W.-M., Electrodeposited hybrid films of polyaniline and manganese oxide in nanofibrous structures for electrochemical supercapacitor, Electrochim. Acta, 2008, vol. 53, p. 3036.
Chigane, M. and Ishikawa, M., Manganese Oxide Thin Film Preparation by Potentiostatic Electrolyses and Electrochromism, J. Electrochem. Soc., 2000, vol. 147, p. 2246.
Feng, X., Li, Y., Chen, G., Liu, Z., Ning, X., Hu, A., Tang, Q., and Chen, X., Free-standing MnO2/nitrogen-doped graphene paper hybrids as binder-free electrode for supercapacitor applications, Mater. Lett., 2018, vol. 231, p. 114. https://doi.org/10.1016/j.matlet.2018.08.026
Zhang, X., Ji, L., Zhang, Sh., and Yang, W., Synthesis of a novel polyaniline-intercalated layered manganese oxide nanocomposite as electrode material for electrochemical capacitor, J. Power Sources, 2007, vol. 173, p. 1017. https://doi.org/10.1016/j.jpowsour.2007.08.083
Xie, Y., Yang, Ch., Chen, P., Yuan, D., and Guo, K., MnO2-decorated hierarchical porous carbon composites for high performance asymmetric supercapacitors, J. Power Sources, 2019, vol. 425, p. 1. www.elsevier.com/ locate/jpowsour.
Абаляева, В.В., Николаева, Г.В., Кабачков, Е.Н., Ефимов, О.Н. Исследование влияния подложки из стеклоуглерода и активированной графитовой фольги на электрохимическое поведение композитных покрытий на основе полианилина и его N-замещенных производных. Электрохимия. 2019. Т. 55. С. 948. DOI [Abalyaeva, V.V., Nikolaeva, G.V., Kabachkov, E.N., and Efimov, O.N., The Effect of Supports of Glassy-Carbon and Activated Graphite Foil on the Electrochemical Behavior of Composite Coatings Based on Polyaniline and Its N-Substituted Derivatives, Russ. J. Electrochem., 2019, vol. 55, p. 745.]https://doi.org/10.1134/S1023193519080020
Ozkan, S.Zh., Eremeev, I.S., Karpacheva, G.P., and Bondarenko, G.N., Oxidative Polymerization of N-Phenylanthranilic Acid in the Heterophase System, Open J. Polymer Chem., 2013, vol. 3, p. 63. https://doi.org/10.4236/ojpchem.2013.33012
Ozkan, S.Z., Eremeev, I.S., Karpacheva, G.P., Bondarenko, G.N., Shandryuk, G.A., Prudskova, T.N., and Veselova, E.V., Polymers of diphenylamine-2-carboxylic acid: synthesis, structure, and properties, Polymer Sci. B., 2013, vol. 55, no. 3–4, p. 107. https://doi.org/10.1134/S1560090413030032
Абаляева, В.В., Дремова, Н.Н., Кабачков, Е.Н., Ефимов, О.Н., Баскакова, Ю.В., Карпачева, Г.П. Электрополимеризации дифениламин-2-карбоновой кислоты на стеклоуглероде и активированной графитовой фольге. Высокомолек. соединения сер. Б. 2021. Т. 63. № 4. С. 258. [Abalyaeva, V.V, Dremova, N.N., Kabachkov, E.N., Efimov, O.N. Baskakova, Yu.V., and Karpacheva, G.P., Electrochemical Polymerization of Diphenylamine-2-Carboxylic Acidon Glassy Carbon and Activated Graphite Foil, Polymer Sci., Ser. B, 2021, vol. 63, no. 4, p. 392.] https://doi.org/10.1134/S1560090421040011
Yang, H. and Bard, A.J., The application of rapid scan cyclic voltammetry and digital simulation to the study of the mechanism of diphenylamine oxidation, radical cation dimerization, and polymerization in acetonitrile, J. Electroanalyt. Chem. and Interfac. Electrochem., 1991, vol. 306, nos. 1–2, p. 87.
Nassa, H.R., Souri, A., Javadian, A., and Aminia, M.K., A novel mercury-free stripping voltammetric sensor for uranium used on electropolymerized N-phenylanthranilic acid film electrode, Sensors and Actuators B: Chemical, 2015, vol. 215, p. 360. https://doi.org/10.1016/j.snb.2015.03.086
Chen, W. and Mu, Sh., The electrocatalytic oxidative polymerizations of aniline and aniline derivatives by grapheme, Electrochim. Acta, 2011, vol. 56, p. 2284.
Абаляева, В.В., Николаева, Г.В., Дремова, Н.Н., Кнерельман, Е.И., Давыдова, Г.И., Ефимов, О.Н., Ионов, С.Г. Электроактивные полимерные покрытия на модифицированной графитовой фольге в качестве электродов для суперконденсаторов. Физико-химия поверхности и защита материалов. 2019. Т. 55. № 2. С. 195. [Abalyaeva, V.V., Nikolaeva, G.V., Dremova, N.N., Knerel’man, E.I., Davydova, G.I., Efimov, O.N., and Ionov, S.G., Electroactive polymer coatings on a modified graphite foil as electrodes for supercapacitors, Protection metals and phys. chem. surfaces, 2019, vol. 55, no. 2, p. 321.] https://doi.org/10.1134/S2070205119020023
Shulga, Y.M., Baskakov, S.A., Smirnov, V.A., Shulga, N.Y., Belay, K.G., and Gutsev, G.L, Graphene oxide films as separators of polyaniline-based supercapacitors, J. Power Sources, 2014, vol. 245, p. 33. https://doi.org/10.1016/j.jpowsour.2013.06.094
Shulga, Y.M., Vasilets, V.N., Baskakov, S.A., Mura-dyan, V.E., Skryleva, E.A., and Parkhomenko, Yu.N., Photoreduction of Graphite Oxide Nanosheets with Vacuum Ultraviolet Radiation, High Energy Chemistry, 2012, vol. 46(2), p. 117. https://doi.org/10.1134/S0018143912020099
Ghasemi, S., Hosseini, S.R., and Boore-talari, O., Sonochemical assisted synthesis MnO2/RGO nanohybrid as effective electrode material for supercapacitor, Ultrason.Sonochem., 2018, vol. 40, p. 675. https://doi.org/10.1016/j.ultsonch.2017.08.013
Elgrishi, N., Rountree, K.J., McCarthy, B.D., Rountree, E.S., Eisenhart, T.T., and Dempsey, J.L., A practical beginner’s guide to cyclic voltammetry, J. Chem. Educ., 2018, vol. 95, p. 197. https://doi.org/10.1021/acs.jchemed.7b00361
Dreyer, D.R., Park, S., Bielawskia, Ch.W., and Ruoff, R.S., The chemistry of graphene oxide, Chem. Soc. Rev., 2010, vol. 39, p. 228.
Абаляева, В.В., Баскаков, С.А., Дремова, Н.Н., Ефимов, О.Н. Электросинтез композита на основе нанолистов оксида графена и полианилина с участием гексахлориридат_аниона. Изв. Академии наук. Сер. xим. 2014. № 3. С. 627. [Abalyaeva, V.V., Baskakov, S.A., Dremova, N.N., and Efimov, O.N., Electrosynthesis of a composite based on grapheme oxide nanosheets and polyaniline with hexachloroiridate anion, Russ. Chem. Bull., 2014, no. 3, p. 634.]
Park, S. and Ruoff, R.S., Chemical methods for the production of graphenes, Nature Nanotechnol., 2009, vol. 4, p. 217.
Абаляева, В.В., Ефимов, О.Н., Дремова, Н.Н., Кабачков, Е.Н. Cинтез и электрохимические свойства композитных покрытий на основе полианилина и соединений марганца на активированной графитовой фольге. Физикохимия поверхности и защита материалов. 2021. Т. 57. № 3. С. 277. [Abalyaeva, V.V., Efimov, O.N., Dremova, N.N., and Kabachkov, E.N., Synthesis and electrochemical properties of composite coatings based on polyaniline and manganese compounds on activated graphite foil, Protection metals and phys. chem. surfaces, 2019, vol. 57, no. 3, p. 314.]https://doi.org/10.31857/S0044185621030025
Wang, Y.-G., Li, H.-Q., and Xia, Y.-Y., Ordered Whiskerlike Polyaniline Grown on the Surface of Mesoporous Carbon and Its Electrochemical Capacitance Performance, Adv. Mater., 2006, vol. 18, p. 2619.
Gonc, D., Faria, R.C., Yonashiro, M., and Bulhŏes, L.O.S., Electrochemical oxidation of o-aminophenol in aqueous acidic medium: formation of film and soluble products, J. Electroanal. Chem., 2000, vol. 487, p. 90.
Trchová, M., Šeděnkov, I., and Stejskal, J., FTIR spectroscopic and conductivity study of the thermal degradation of polyaniline films, Polym. Degradation and Stability, 2004, vol. 86, no. 1, p. 179.
Yang, N., Zhai, J., Wanc, M., Wanga, D., and Jiangca, L, Layered nanostructures of polyaniline with graphene oxide as the dopant and template, Synth. Met., 2010, vol. 160, p. 1617.
Janosěvic, A., Marjanovi, B., Holler, P., Trchov, M., and Stejskal, J., Synthesis and characterization of conducting polyaniline 5-sulfosalicylate Nanotubes, Nanotechnology, 2008, vol. 19, p. 135606 (8pp).
Moyseowicz, A. and Gryglewicz, G., Hydrothermal-assisted synthesis of a porous polyaniline/reduced grapheme oxide composite as a high-performance electrode material for supercapacitors, Composites Part B: Engineering, 2019, vol. 159, p. 4.
Li, X., Fang, X., Zhang, P., Yan, J., Chen, Y., and Chen, X., Preparation and properties of reduced graphene oxide/polyimide composite films, High Performance Polymers, 2020, vol. 32(1), p. 65.
Ren, J., Huang, X., Wang, N., Zhang, X., Li, W., and Liu, D., Preparation of polyaniline-coated polyacrylonitrile fiber mats and their application to Cr(VI) removal, Synth Met., 2016, vol. 222, p. 255.
Zhang, M., Jia, Y., Li, H., and Wang, J., A facile method to synthesis reduced graphene oxide/carbon nanotube hybrid fibers as binder-free electrodes for supercapacitors, Synth. Met., 2017, vol. 232, p. 66.
Yang, H. and Bard, A.J., The application of rapid scan cyclic voltammetry and digital simulation to the study of the mechanism of diphenylamine oxidation, radical cation dimerization, and polymerization in acetonitrile, J. Electroanal. Chem. Interfacial Electrochem., 1991, vol. 306, p. 87. https://doi.org/10.1016/0022-0728(91)85224
Yanchun, Z., Miao, Ch.M., and Chen, X., Electrochemical synthesis of polydiphenylamine nanofibrils through AAO template, Mater. Chem. and Phys., 2005, vol. 91(2–3), p. 518. https://doi.org/10.1016/j.matchemphys.2004.12.019
Lee, T., Yun, T., Park, B., Sharma, B., Song, H.-K., and Kim, B.-S., Hybrid multilayer thin film supercapacitor of graphene nanosheets with polyaniline: importance of establishing intimate electronic contact through nanoscale blending, J. Mater. Chem., 2012, vol. 22, p. 21092. https://doi.org/10.1039/c2jm33111j
Kim, M., Lee, Ch., and Jang, J., Fabrication of Highly Flexible, Scalable and High-Performance Supercapacitors Using Polyaniline/Reduced Graphene Oxide. Film with Enhanced Electrical Conductivity and Crystallinity, Adv. Funct. Mater., 2014, vol. 24, p. 2489.https://doi.org/10.1002/adfm.201303282
Hu, C.C. and Wang, C.C., Nanostructures and Capacitive Characteristics of Hydrous Manganese Oxide Prepared by Electrochemical Deposition, J. Electrochem. Soc., 2003, vol. 150, p. A1079.
Дополнительные материалы отсутствуют.