Электрохимия, 2022, T. 58, № 6, стр. 273-281
Электрокаталитическое окисление этанола на платиновом электроде в растворе метансульфокислоты
М. А. Ахмедов a, *, Ш. Ш. Хидиров b, **
a ДФИЦ РАН, Аналитический центр коллективного пользования
Махачкала, Россия
b Дагестанский государственный университет, Химический факультет
Махачкала, Россия
* E-mail: muhamadahmedov@mail.ru
** E-mail: khidirovdgu@mail.ru
Поступила в редакцию 24.09.2020
После доработки 08.12.2021
Принята к публикации 15.12.2021
- EDN: IJBGVQ
- DOI: 10.31857/S0424857022060032
Аннотация
В настоящей работе методами вольтамперометрии и молекулярной спектроскопии исследованы процессы электроокисления этанола (C2H5OH) на поверхности платинового (Pt) электрода в 1.0 М водном растворе метансульфоновой кислоты (CH3SO3H). Установлено, что полное вытеснение адсорбированного водорода с поверхности Pt в области потенциалов 0.03–0.4 В происходит при концентрации 2.0 М C2H5OH. В анодной области обнаружены три волны окисления этанола при потенциалах E: 0.8–1.1, 1.15–1.45 и 1.5–1.8 В. Анализ продуктов препаративного электролиза при указанных областях потенциалов методами молекулярной (УФ-, ближняя ИК-фурье- и КРС) спектроскопии показал, что первая волна окисления этанола соответствует образованию ацетальдегида, вторая волна – уксусной кислоте, а третья связана с образованием диоксида углерода (СO2). При изменении направления поляризации в катодную сторону обнаруживается одна волна анодного тока с пиком при 0.55 В, связанная с прямым окислением этанола до СO2. Cделано предположение, что механизм электроокисления этанола на Pt в 1.0 М СH3SO3H аналогичен механизму, реализуемому в растворах серной кислоты.
ВВЕДЕНИЕ
Метансульфокислота благодаря хорошей растворимости и ионной проводимости является перспективным электролитом для получения различных металлических покрытий [1, 2], композитов, электродных материалов и мембран [3–7].
Ранее [7] было обнаружено, что электродные процессы, протекающие до 1.8 В (о. в. э.) на поверхности Pt-электрода в 1.0 М растворе СH3SO3H, аналогичны процессам, протекающим в 0.5 М H2SO4, и связаны с адсорбцией–десорбцией водород- и кислородсодержащих частиц, а формы циклических вольтамперограмм (ЦВА) имеют различия лишь при потенциалах ≥2.0 В (о. в. э.). Авторами [8] также было установлено, что электродные процессы, протекающие на поверхности поликристаллической платины в 10.0 М растворе метансульфокислоты в пределах потенциалов Е = = 2.0–2.5 В, связаны с разрядом молекул воды, а при Е = 2.9–3.7 В – происходит образование пероксида димезилата в концентрированных растворах метансульфокислоты с участием мезильных (CH3S(O)2O)-групп.
В работе [9] показано, что метансульфокислота не адсорбируется на платиновых поверхностях, а ее взаимодействие с водой вызывает лишь некоторые изменения формы характерных вольтамперометрических профилей. Приведенное в работе [9] различие вольт-амперных откликов при сравнении водных растворов CH3SO3H и HClO4 на поверхности Pt (111) в области адсорбции ОН-частиц также связывается с влиянием аниона на структуру воды.
Следует отметить, что в мировой литературе отсутствуют сведения по исследованию адсорбции и электроокисления алифатических спиртов на платиновом электроде в растворах метансульфокислоты. В данной работе методами вольтамперометрии и молекулярной (УФ-, ближняя ИК- и КРС) спектроскопии изучено электрохимическое окисление этанола на платиновом (Pt) электроде в 1.0 М растворе метансульфоновой кислоты в широкой области потенциалов (0.03–1.8 В (о. в. э.)).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использованы следующие реактивы без дополнительной очистки: этанол (C2H5OH) марки “ос. ч.” и метансульфокислота марки BASF. В качестве фонового электролита использовали 1.0 М раствор метансульфоновой кислоты (CH3SO3H). Для приготовления растворов использовали бидистиллированную, деионизованную воду.
Все исследования проводили в трехэлектродной электрохимической ячейке с разделением анодного и катодного отделений керамической диафрагмой со стеклянным шлифом. Потенциалы измеряли относительно обратимого водородного электрода сравнения (о. в. э.), при температуре 20 ± 2°С. Измерения проводили методом вольтамперометрии с использованием автоматизированного потенциостата-гальваностата IPC-Pro MF (НТФ “Вольта”, Россия). Водород со степенью чистоты 99.9999 получали с помощью генератора ГВЧ-6 (НПП Химэлектроника, Россия). Электрод сравнения с помощью электролитического мостика подводили к рабочему электроду через капилляр Луггина, заполненный рабочим раствором. Исследуемый раствор в ячейке продували инертным газом (аргон). В качестве рабочего электрода использовали поликристаллическую платину с геометрической площадью 0.016 см2, а его истинная поверхность, определенная по методике [10], составила 0.02 см2. Вспомогательным электродом служила также платина (Pt) в виде пластины.
Изучение процессов адсорбции этанола проводили методом адсорбционного вытеснения [11–14]. Степень заполнения поверхности платины (θ) в зависимости от концентраций определяли путем интегрирования на прямом (0.03–0.4 В (о. в. э.) – водородная область) и обратном (0.9–0.3 В (о. в. э.) – область электровосстановления хемосорбированных кислородсодержащих частиц Pt–O) участках вольтамперограмм и нахождения значения количества прошедшего заряда Q. Скорость развертки потенциала в обоих направлениях составляла 1 В/с. Для получения воспроизводимых результатов рабочий электрод предварительно подвергали многократному циклированию в фоновом растворе электролита, после чего стабилизировали при потенциале 0.03 В (о. в. э.). При потенциале 0.03 В (о. в. э.) поверхность электрода полностью заполнена адсорбированным водородом. Количество заряда Q, затрачиваемое на десорбцию водорода или хемосорбированных кислородсодержащих частиц Pt–O, определяли с использованием программы IPC2000.exe (НТФ “Вольта”, Россия) из импульсных вольтамперограмм интегрированием тока в соответствующей области потенциалов по соотношению (1). Степень заполнения (θ) рассчитывали по методике [12, 14].
Препаративный электролиз осуществляли на платиновых электродах с геометрической поверхностью 0.25 см2 при контролируемом потенциале в диафрагменном электролизере с использованием выпрямителя постоянного тока TYPE:TR-9252 в течение 32 ч. Диафрагмой служила перфторированная катионитовая мембрана марки МФ-4СК (ООО “Пластомер”). Температура при стационарном электролизе поддерживалась в интервале 25–30°С.
Продукты электроокисления этанола в растворе метансульфокислоты анализировали с помощью спектрального комплекса комбинационного рассеяния DXR Smart Raman Research (Thermo Scientific, США) и спектрометра UV-3600 (Shimadzu Corp., Япония). Для измерения УФ- и ближней ИК-спектров анализируемый образец помещали в кварцевую кювету, а для спектров КРС – в кварцевую ампулу, из которой откачивали воздух с помощью вакуумного насоса, а затем ампулу заполняли инертным газом – аргоном и запаивали.
Идентификацию полученных веществ проводили с использованием программного обеспечения OMNIC.exe (Thermo Scientific, США) и справочной информации [15–18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Приведенные на рис. 1 ЦВА Pt-электрода в 1.0 М растворе CH3SO3H в присутствии этанола в низких и высоких концентрациях, снятые в пределах потенциалов 0.03–1.0 В (о. в. э.), указывают на существенное различие протекающих электродных процессов. Необходимо отметить, что пики слабо- и прочносвязанного водорода на Pt-электроде (рис. 1) в 1.0 М растворе CH3SO3H при потенциалах 0.03–0.4 В (о. в. э.) полностью подавляются в присутствии этанола. На кривой прямого хода развертки потенциала при концентрации 0.01–2.0 М этанола происходит существенное подавление значений плотности тока пиков адсорбции водорода, тогда как на кривой обратного хода развертки потенциала возможны процессы дегидрирования этанола, приводящие к образованию газообразных продуктов [19, 20].
Рис. 1.
ЦВА Pt-электрода в 1 М растворе CH3SO3H (1), в присутствии низких (a) и высоких (б) концентраций этанола, М: 10–4 (2); 10–3 (3); 10–2 (4); 0.1 (5); 0.5 (6); 1.0 (7); 2.0 (8). Скорость развертки потенциала V = 0.1 В/с.

На обратном ходе кривой фонового электролита (рис. 1a) в области 0.37 < E < 1.2 В (о. в. э.) протекают процессы, связанные с зарядом ДЭС (0.37–0.6 В (о. в. э.)) [11, 20] и с десорбцией адсорбированных частиц кислорода (0.6–1.2 В (о. в. э.)) [21, 22] (1):
(1)
${{{\text{O}}}_{{{\text{ads}}}}} + 2{{{\text{H}}}^{ + }} + 2{\text{e}} \to {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$На кривых 2–8 прямого хода при потенциалах ≥0.4 В (о. в. э.) наблюдается подъем тока с четко выраженным максимумом при потенциале 0.965 В (о. в. э.). По-видимому, этот пик может быть обусловлен окислением этанола на поверхности Pt-электрода до ацетальдегида [19, 23–26]. В то же время на кривой обратного хода развертки потенциала наблюдается также еще один пик электроокисления. Можно предположить, что данный пик может быть связан с окислением ацетальдегида (образовавшегося из этанола на кривой прямого хода развертки потенциала при поляризации Pt-электрода до потенциалов 1.0 В (о. в. э.)) или продуктов хемосорбции этанола.
При низких концентрациях этанола в пределах потенциалов 1.15–1.45 В (о. в. э.) и 1.5–1.8 В (о. в. э.) на рис. 2а уже прослеживаются 2 волны окисления. При изменении направления поляризации в области потенциалов 1.15–1.47 В (о. в. э.) на кривых 3–4 (рис. 2а) также наблюдается волна, соответствующая окислению этанола, а на кривых 2–4 при 0.7–0.3 В наблюдается подавление волны восстановления хемосорбированных кислородсодержащих частиц [19, 20].
Рис. 2.
ЦВА Pt-электрода в 1 М растворе CH3SO3H (1), в присутствии низких (а) и высоких (б) концентраций этанола, М: 10–4 (2); 10–3 (3); 10–2 (4); 0.1 (5); 0.5 (6); 1.0 (7); 2.0 (8). Скорость развертки потенциала V = 0.1 В/с.
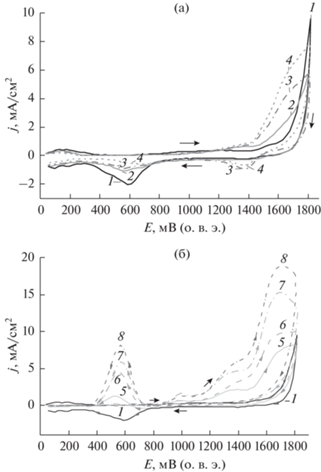
При концентрации этанола ≥0.1 М на анодной ЦВА-кривой Pt-электрода (рис. 2б) прослеживаются три волны окисления с максимумами тока при потенциалах около 1.0, 1.4 и 1.7 В (о. в. э.). По-видимому, это может быть также обусловлено тем, что в присутствии этанола пик катодного-анодного тока является компромиссным между токами электровосстановления оксида платины и электроокисления ацетальдегида, образовавшегося при окислении этанола. При малых концентрациях этанола превалирует ток электровосстановления оксида платины, а ток окисления ацетальдегида проявляется при высоких концентрациях этанола и только на обратном ходе развертки потенциала из-за образовавшегося оксида платины, на котором он не окисляется при прямом ходе. На рис. 2 в пределах потенциалов 0.8–1.8 В (о. в. э.) наблюдается небольшое смещение максимумов анодных пиков в сторону меньших потенциалов.
Следует также обратить внимание на то, что увеличение анодного предела циклирования на рис. 1 и рис. 2 существенно повлияло на вид кривых и токовые отклики, что говорит о влиянии переокисления поверхности платины на кинетику процесса.
Из работ авторов [27–32] известно, что поверхность Pt-электрода в области анодных потенциалов от 0.8 до 1.8 В (о. в. э.) претерпевает серьезные структурные изменения за счет образования на платине различных хемосорбированных кислородсодержащих частиц:
(2)
${\text{Pt}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{Pt--OH}} + {{{\text{H}}}^{ + }} + {\text{e}}~~~~~~~~E \leqslant 0.92\,\,{\text{В}},$(3)
$\begin{gathered} {\text{Pt}} + {\text{Pt--OH}} \to {\text{Pt--O--Pt}} + {{{\text{H}}}^{ + }} + {\text{ e}}~ \\ E{\text{ }} = 0.85{\text{--}}1.1\,\,{\text{В}}\,\,{\text{(о}}{\text{.}}\,\,{\text{в}}{\text{.}}\,\,{\text{э}}{\text{.)}}, \\ \end{gathered} $(4)
$\begin{gathered} {\text{Pt}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{{\text{H}}}_{{\text{2}}}}{\text{O--Pt--O}}{{{\text{H}}}_{2}} \to \\ \to {\text{Pt}}{{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }} + 4{\text{e}}~~~~E{\text{ }} = 1.1{\text{--}}1.4\,\,{\text{В}}\,\,{\text{(о}}{\text{.}}\,\,{\text{в}}{\text{.}}\,\,{\text{э}}{\text{.)}}, \\ \end{gathered} $(5)
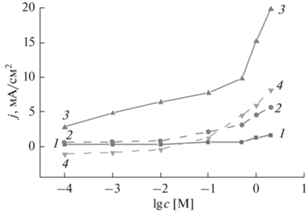
$\begin{gathered} 3{\text{Pt}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{P}}{{{\text{t}}}_{{\text{3}}}}{{{\text{O}}}_{4}} + 8{{{\text{H}}}^{ + }} + 8{\text{e}}~~ \\ E{\text{ }} = 1.5{\text{--}}1.6\,\,{\text{В}}\,\,\,{\text{(о}}{\text{.}}\,\,{\text{в}}{\text{.}}\,\,{\text{э}}{\text{.)}}. \\ \end{gathered} $Зависимость максимума плотности токов окисления от концентрации этанола в 1 М растворе CH3SO3H (рис. 3), определенных при потенциалах прямого (1.0, 1.4 и 1.7 В (о. в. э.)) и обратного (0.55 В (о. в. э.)) хода (рис. 2), имеет нелинейный характер. По-видимому, это может быть обусловлено различием электродных процессов, протекающих на Pt-электроде в 1 М растворе CH3SO3H в присутствии низких и высоких концентраций этанола.
Рис. 3.
Зависимость максимума тока окисления этанола от концентрации при потенциалах, В (о. в. э.): прямого 1.0 (1); 1.4 (2); 1.7 (3) и обратного хода 0.55 (4).
Представленные зависимости степени заполнения поверхности платины водородом (рис. 4, кривая 1) в области потенциалов 0.03–0.4 В (о. в. э.) и кислородсодержащими частицами (0.9–0.3 В (о. в. э.)) (рис. 4, кривая 2) в 1.0 М растворе CH3SO3H в присутствии низких и высоких концентраций этанола имеют сложный характер и различны по форме.
Рис. 4.
Изотермы адсорбции этанола на Pt-электроде в 1 М растворе CH3SO3H, снятые в областях потенциалов: (1) адсорбции водорода (0.03–0.4 В (о. в. э.)); (2) электровосстановления хемосорбированных кислородсодержащих частиц (0.9–0.3 В (о. в. э.)).

Из рис. 4 видно, что вытеснение водород- и кислородсодержащих частиц (оксида платины) происходит уже при низких концентрациях этанола (10–4 М), а при концентрациях 1.0–2.0 М этанола степень заполнения достигает максимального значения.
Можно предположить, что форма изотермы адсорбции (рис. 4, кривая 1), наблюдаемая в водородной области (0.03–0.4 В (о. в. э.)), характерна для случаев, когда при определенной концентрации адсорбата (в данном случае, этанола) достигается предельная адсорбция. Причем вогнутый относительно оси концентрации участок указывает, что с увеличением доли занятых адсорбционных мест адсорбированные частицы этанола с повышением их концентрации в растворе за счет межмолекулярного взаимодействия склонны образовывать большие ассоциаты на поверхности Pt- электрода [33, 34]. В то же время наличие дополнительного плато на адсорбционной кривой (рис. 4, кривая 2) может быть обусловлено полимолекулярной адсорбцией или изменением пространственной ориентации молекул этанола–ацетальдегида относительно поверхности Pt-электрода [11, 34].
Для выяснения природы образующихся продуктов был проведен препаративный электролиз в анодном отделении диафрагменного электролизера на Pt-электроде в 1.0 М растворе CH3SO3H в присутствии 2.0 М этанола при потенциалах 0.6, 1.0, 1.4 и 1.7 В (о. в. э.). По окончании электролиза полученный анолит анализировали методами УФ-, ближней ИК- и КРС-спектроскопии.
На рис. 5 представлены УФ- и ближней ИК-спектры поглощения, полученные до и после электролиза в 1.0 М растворе CH3SO3H – 2.0 М C2H5OH при потенциалах 0.6, 1.0, 1.4 и 1.7 В (о. в. э.).
Рис. 5.
УФ- (а) и ближний ИК-спектры (б), снятыe в 1.0 М растворе CH3SO3H–2.0 М C2H5OH до (1) и после электролиза при контролируемых потенциалах E, В (о. в. э.): 0.6 (2); 1.0 (3); 1.4 (4); 1.7 (5).

Как видно из рис. 5, в образцах анолита до и после электролиза при потенциале 0.6 В этанол не окисляется, тогда как для образцов, полученных после электролиза при потенциалах 1.0, 1.4 и 1.7 В (о. в. э.), спектры поглощения, снятые в УФ- и ближней ИК-областях, претерпевают значительные изменения состава электролита. Так, в УФ- и ближней ИК-областях для кривых 3 и 4 наблюдается перекрывание полос поглощения ОН-групп молекулы воды [15]. По-видимому, резкий рост интенсивности поглощения в обертонов растяжения O–Н связано с наличием сложных клатратоподобных структур (комплексов) с продуктами электроокисления этанола при взаимодействии ОН-групп с альдегидной (C(O)H) и карбоксильной (C(O)OH) группами [15], образующимися при потенциалах 1.0 и 1.4 В (о. в. э.), соответственно. Рост интенсивности поглощения в образце – продукте электроокисления этанола при анодном потенциале 1.0 В (рис. 5б, кривые 3 и 4) в сравнении с продуктом, полученном при 1.4 В (о. в. э.), указывает, что наличие концентрации альдегидной C(O)H-группы выше, чем карбоксильной C(O)OH. В то же время при потенциале 1.7 В (о. в. э.) наблюдается резкое падение интенсивности полос поглощения УФ и ближней ИК, что может быть связано с полным электроокислением этанола до СО2.
Наиболее чувствительные изменения колебаний функциональных групп в растворе 1.0 М CH3SO3H–2.0 М C2H5OH проявляются в КРС-спектрах (рис. 6). Как видно из рис. 6, интенсивность колебаний функциональных групп частиц этанола во всей области 250–3500 см–1 при потенциале ≥1.0 В (о. в. э.) падает. Это можно объяснить тем, что окисление молекулы C2H5OH происходит по С–OH-группе. Можно предположить, что изменения спектров в области 900–1100 см-–1 могут быть связаны с перекрыванием колебаний сульфогруппы SO3H и этилсульфогруппы –SO3ОCH2–CH3.
Рис. 6.
КРС-спектры (а) – в области “отпечатков пальцев” и (б) – колебаний метильных групп и водородных связей, снятыe в 1.0 М растворе CH3SO3H – 2.0 М C2H5OH до (1) и после электролиза при контролируемых потенциалах E, В (о. в. э.): 0.6 (2); 1.0 (3); 1.4 (4); 1.7 (5).

Наиболее сложные формы колебаний на КРС-спектрах до и после электроокисления этанола (рис. 6) наблюдаются в области 2500–3000 и 3000–3500 см–1.
Из работ [16–18] известно, что в разбавленных водно-этанольных растворах вокруг молекул этанола образуются клатратоподобные структуры; в то же время увеличение содержания этанола (в диапазоне концентраций 20–30%) в бинарном растворе вызывает разрушение клатратоподобной структуры раствора и перестройку его структуры в пользу гидратного типа этанола, отличного от полуклатратного за счет усиления водородных связей. Ранее [18] в результате разложения полос в области ≥ 2400 см–1 в форме гауссовых кривых удалось идентифицировать 12 колебаний полос, относимых к взаимодействию CH– и ‒OH. Следует отметить, что после электроокисления интенсивность колебаний метильных групп (CH/CH2/CH3) падает (рис. 5б), что указывает на окисление С–С-связи. В то же время интенсивность колебаний OH-групп в 2.0 М растворе этанола после электролиза в 1.0 М растворе CH3SO3H при E = 1.4 В (о. в. э.) последовательно возрастает (кривые 1–4, рис. 6б), тогда как после проведения электролиза в 1.0 М растворе CH3SO3H – 2.0 М C2H5OH, при E = 1.7 В (о. в. э.) интенсивность колебаний OH-групп на КРС-спектрах падает (кривая 5, рис. 6б). По-видимому, усиление интенсивности колебаний OH-групп может быть связано с образованием устойчивых клатратоподобных структур с продуктами электроокисления этанола (уксусного альдегида и кислоты), тогда как в случае полного электроокисления этанола до СO2 падение их интенсивности может быть обусловлено колебаниями OH-групп клатратоподобных структур с молекулами электролита (1.0 М раствора CH3SO3H) и остаточными количествами продуктов электроокисления этанола. Важно также отметить, что методами молекулярной спектроскопии изменения состава в растворе 1.0 М CH3SO3H–2.0 М C2H5OH после электролиза в анодном отделении при E = 0.6 В (о. в. э.) не обнаружено.
Из данных табл. 1 видно, что максимальные значения выхода из образовавшихся продуктов после электролиза, определенных по отношению площади высоты пика на КРС-спектрах (рис. 6б), проявляется при анодных потенциалах 1.0 и 1.4 мВ (о. в. э.).
Таблица 1.
Данные количественного анализа колебаний СH-групп (3100–2900 см–1) до и после электролиза этанола в 1.0 М растворе CH3SO3H методом КРС-спектроскопии
| № | Потенциал электролиза Е, В (о. в. э.) | Выход*, % | Продукт электролиза |
|---|---|---|---|
| 1 | 0.6 | 0 | Этанол |
| 2 | 1.0 | 64.59 | Ацетальдегид |
| 3 | 1.4 | 55.42 | Уксусная кислота |
| 4 | 1.7 | 50.86 | Диоксид углерода |
Клатратоподобные структуры (клатра́ты от лат. clathratus – обрешеченный, закрытый решеткой) этанола – соединения включения, образуются путем включения молекул вещества – “гостя” в полости кристаллической решетки, составленной из молекул другого типа – “хозяев” (решетчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты) [35]. Наличие таких структур было подтверждено ранее в работах при исследовании водно-этанольных растворов [15–18, 35].
ЗАКЛЮЧЕНИЕ
На основании проведенных вольтамперометрических измерений установлено, что увеличение анодного предела циклирования от 0.03–1.0 до 0.03–1.8 В (о. в. э.) существенно влияет на ЦВА кривых и их токовые отклики. Поверхность Pt-электрода в области анодных потенциалов от 0.8 до 1.8 В (о. в. э.) претерпевает серьезные структурные изменения за счет образования различных хемосорбированных кислородсодержащих частиц.
Форма S-кривых описывает модель изотермы Фрумкина, что свидетельствует о взаимодействии адсорбированных частиц между собой на неоднородной поверхности. Наличие изломов на участках изотерм адсорбции в областях потенциалов адсорбции водорода (0.03–0.4 В (о. в. э.)) и кислородсодержащих частиц (0.9–0.3 В (о. в. э.)) указывает на то, что хемосорбция этанола и продуктов его электроокисления протекает через этапы: адсорбции частиц при небольших количествах вещества → агрегации частиц с образованием ассоциатов → насыщения поверхности адсорбированным слоем частиц этанола → увеличения концентрации частиц с незначительным изменением структуры поверхности Pt-электрода.
На основании анализа продуктов электролиза этанола, проведенного при контролируемых потенциалах, методами молекулярной спектроскопии было определено, что основными продуктами при 1.0 В (о. в. э.) является ацетальдегид (CH3COH), при 1.4 В (о. в. э.) – уксусная кислота (CH3COOH) и при 1.7 В (о. в. э.) – диоксид углерода (CO2). Сделано предположение, что их образование при потенциалах E ≥ 0.9 В (о. в. э.) может быть обусловлено наличием ОНадс и Oадс частиц, присутствующих на поверхности Pt-электрода.
Методами ближней ИК- и КРС-спектроскопии установлено, что этанол и продукты его электроокисления в 1.0 М растворе CH3SO3H образуют сложные по составу клатратоподобные структуры (комплексы), что в свою очередь может являться основным препятствием для использования разбавленных водно-этанольных растворов в топливном элементе прямого окисления этанола.
Следует отметить, для изучения влияния структуры электрода и понимания механизма электроокисления этанола в 1.0 М растворе метансульфокислоты необходимо проведение кинетических измерений и использование in situ спектроэлектрохимических методов (синхротронное излучение и молекулярная спектроскопия).
Список литературы
Palden, T., Onghena, B., Regadío, M., and Binnemans, K., Methanesulfonic acid: a sustainable acidic solvent for recovering metals from jarosite residue of the zinc industry, Green Chemistry, 2019, vol. 21, p. 5394. https://doi.org/10.1039/c9gc02238d
Walsh, F.C. and Ponce de León, C., Versatile electrochemical coatings and surface layers from aqueous methanesulfonic acid, Surf. Coat. Technol., 2014, vol. 259, p. 676. https://doi.org/10.1016/j.surfcoat.2014.10.010
Kim, G., Kim, Y., Yim, T., and Kwon, K., Effects of methanesulfonic acid on electrolyte for vanadium redox flow batteries, J. Industrial and Engineering Chem., 2021, vol. 99, p. 326. https://doi.org/10.1016/j.jiec.2021.04.043
Krishna, M., Wallis, L.P.J., Wills, R.G.A., Hall, D., and Shah, A.A., Measurement of key electrolyte properties for improved performance of the soluble lead flow battery, Intern. J. Hydrogen Energy, 2017, vol. 42(29), p. 18491. https://doi.org/10.1016/j.ijhydene.2017.05.0
Vijayalekshmi, V. and Khastgir, D., Eco-friendly methanesulfonic acid and sodium salt of dodecylbenzene sulfonic acid doped cross-linked chitosan based green polymer electrolyte membranes for fuel cell applications, J. Membrane Sci., 2017, vol. 523, p. 45. https://doi.org/10.1016/j.memsci.2016.09.058
Ахмедов, М.А., Хидиров, Ш.Ш. Модифицирование целлюлозы в растворах метансульфокислоты. Изв. Академии наук. Сер. хим. 2021. № 2(70). С. 412. [Akhmedov, M.A., and Khidirov, Sh.Sh., Modification of cellulose in the solution of methanesulfonic acid. Russ. Chem. Bull., 2021, no. 2(70), p. 412]. https://doi.org/10.1007/s11172-021-3101-y
Ахмедов, М.А., Хидиров, Ш.Ш. Анодные процессы в концентрированном растворе метансульфокислоты на платиновом электроде. Электрохимия. 2019. Т. 55. С. 757. [Akhmedov, M.A. and Khidirov, Sh.Sh., Anodic processes at smooth platinum electrode in concentrated solution of methanesulfonic acid, Russ. J. Electrochem., 2019, vol. 55, p. 579.] https://doi.org/10.1134/S1023193519060028
Ахмедов, М.А., Хидиров, Ш.Ш. Определение состава и свойств метансульфокислоты методом вольтамперометрии. Журн.структур.химии. 2014. Т. 55. № 6. С. 1259. [Akhmedov, M.A. and Khidirov, Sh.Sh., Voltammetric determination of the composition and properties of methanesulfonic acid, J. Structur. Chem., 2014, vol. 55, no. 6, p. 1148.] https://doi.org/10.1134/S0022476614060249
Sandoval, A.P., Suárez-Herrera, M.F., Climent, V., and Feliu, J.M., Interaction of water with methanesulfonic acid on Pt single crystal electrodes, Electrochem. Comm., 2015, vol. 50, p. 47. https://doi.org/10.1016/j.elecom.2014.11.007
Trasatti, S. and Petrii, O.A., Real surface area measurements in electrochemistry, J. Electroanalyt. Chem., 1992, vol. 327, p. 353. https://doi.org/10.1016/0022-0728(92)80162-w
Багоцкий, В.С., Васильев, Ю.Б. В кн.: Успехи электрохимии органических соединений, М.: Наука, 1966. С. 40. [Bagotsky, V.S. and Vasiliev, Yu.B. In the book: Successes of electrochemistry of organic compounds (in Russian), M.: Nauka, 1966. p. 40.]
Дамаскин, Б.Б., Петрий, О.А. Введение в электрохимическую кинетику, М.: Высш. шк., 1983. 400 с. [Damaskin, B.B. and Petrii, O.A., Introduction to electrochemical kinetics (in Russian), M.: Higher School, 1983. 400 p.]
Шольц, Ф. Электроаналитические методы. Теория и практика. М.: Бином. Лаборатория знаний, 2014. 326 с. [Scholz, F., Electro-analytical methods. Guide to experiments and applications, Berlin-Heidelberg: Springer-Verlag, 2002. 326 p.]
Ахмедов, М.А., Ибрагимова, К.О., Хидиров, Ш.Ш. Сравнительная оценка адсорбции диметилсульфоксида и диметилсульфона на гладком платиновом электроде в кислой среде. Электрохимия. 2020. Т. 56. С. 416. [Akhmedov, M.A., Ibragimova, K.O., and Khidirov, Sh.Sh., Comparative evaluation of dimethylsulfoxide and dimethylsulfone adsorption on a smooth platinum electrode in acidic environment, Russ. J. Electrochem., 2020, vol. 56, p. 396.] https://doi.org/10.1134/S1023193520040023
Пентин, Ю.А., Курамшина, Г.М. Основы молекулярной спектроскопии, М.: Мир, 2008. 398 с. [Pentin, Yu.A. and Kuramshina, G.M., The fundamentals of molecular spectroscopy (in Russian), M.: Mir, 2008. 398 p.]
Burikov, S.A., Dolenko, S., Dolenko, T., Patsaeva Svetlana, and Yuzhakov, V., Decomposition of water Raman stretching band with a combination of optimization methods, Molecular Phys., 2010, vol. 108, no. 6, p. 739. https://doi.org/10.1080/00268970903567288
Harris, K.R., Newitt, P.J., and Derlacki, Z.J., Alcohol tracer diffusion, density, NMR and FTIR studies of aqueous ethanol and 2,2,2-trifluoroethanol solutions at 25°C, J. Chem. Soc. Faraday Trans, 1998, vol. 94, no. 14, p. 1963. https://doi.org/10.1039/a802567c
Dolenko, T.A., Burikov, S.A., Dolenko, S.A., Efitorov, A.O., Plastinin, I.V., Yuzhakov, V.I., and Patsa-eva, S.V., Raman spectroscopy of water–ethanol solutions: the estimation of hydrogen bonding energy and the appearance of clathrate-like structures in solutions, J. Phys. Chem. A, 2015, vol. 119, no. 44, p.10806. https://doi.org/10.1021/acs.jpca.5b06678
Кузов, А.В. Адсорбция и электроокисление этанола на платиносодержащих катализаторах в кислых средах. Альтернатив. энергетика и экология. 2010. № 5(85). С. 126. [Kuzov, A.V., Adsorption and electrooxidation of ethanol on platinum-containing catalysts in acidic media, Alternative Energy and Ecology (in Russian), 2010, no. 5(85), p. 126.]
Подловченко, Б.И. О процессах, протекающих при введении платинированного платинового электрода в растворы С2Н5ОН, H–C3H7OH и Н–С4Н9ОН. Электрохимия. 1965. Т. 1. С. 101. [Podlovchenko, B.I., On the processes occurring during the introduction of a platinized platinum electrode into solutions of C2H5OH, H–C3H7OH and H–C4H9OH, Soviet. Electrochem. (in Russian), 1965, vol. 1, p. 101.]
Тарасевич, М.Р., Корчагин, О.В. Электрокатализ и pH (обзор). Электрохимия. 2013. Т. 49. С. 676. [Tarasevich, M.R. and Korchagin, O.V., Electrocatalysis and pH (review), Russ. J. Electrochem, 2013, vol. 49, p. 676.] https://doi.org/10.1134/S102319351307015X
Данилов, А.И., Молодкина, Е.Б., Полукаров, Ю.М. Поверхностный и подповерхностный кислород на платине. Раствор 0.5 М H2SO4. Электрохимия. 2004. Т. 40. С. 667. [Danilov, A.I., Molodkinа, E.B., and Polukarov, Yu.M., Surface and subsurface oxygen on platinum. Solution 0.5 M H2SO4, Russ. J. Electrochem., 2004, vol. 40, p. 667.]
Тарасевич, М.Р., Корчагин, О.В., Кузов, А.В. Электрокатализ анодного окисления этанола. Успехи химии. 2013. № 11(82). С. 1047. [Tarasevich, M.R., Korchagin, O.V., and Kuzov, A.V., Electrocatalysis of anodic oxidation of ethanol, Russ. Chem. Rev., 2013, no. 11(82), p. 1047.] https://doi.org/10.1070/RC2013v082n11ABEH004276
Podlovchenko, B.I., Petrii, O.A., Frumkin, A.N., and Hira Lal, Behavior of a platinized platinum electrode in solutions of alcohols containing more than one carbon atom, aldehydes and formic acid, J. Electroanalyt. Chem., 1966, no. 1(11), p. 12. https://doi.org/10.1016/0022-0728(66)80053-0
Suib, S.L., New and future developments in catalysis batteries, hydrogen storage and fuel cells, Amsterdam, Oxford, Waltham: Publisher Elsevier. 2013. 550 p.
Yaqoob, L., Noor, T., and Iqbal, N., A comprehensive and critical review of the recent progress in electrocatalysts for the ethanol oxidation reaction, RSC Advances, 2021, no. 11(27), p. 16768. https://doi.org/10.1039/D1RA01841H
Изотова, В.В., Тюрин, Ю.М., Володин, Г.Ф. Влияние состава раствора на предельное заполнение Pt-анода окислами. Электрохимия. 1970. Т. 6. С. 1186. [Izotova, V.V., Tyurin, Yu.M., and Volodin, G.F., Influence of the composition of the solution on the limiting filling of the Pt anode with oxides, Soviet. Electrochem. (in Russian), 1970, vol. 6, p. 1186.]
Тюрин, Ю.М., Володин, Г.Ф., Батталова, Ю.В. Моделирование катодных ЦВА кривых на основе данных по кинетике ЦВА восстановления кислородных слоев. Электрохимия. 1981. Т. 17. С. 241. [Tyurin, Yu.M., Volodin, G.F., and Battalova, Yu.V., Simulation of cathode CV curves based on data on the CV kinetics of oxygen layer reduction, Soviet. Electrochem. (in Russian), 1981, vol. 17, p. 241.]
Hommond, J.S. and Winograd, N., XPS spectroscopic study of potentiostatic and galvanostatic oxidation of Pt electrodes in H2SO4 and HClO4, J. Electroanalyt. Chem., 1977, vol. 78, p. 55. https://doi.org/10.1016/S0022-0728(77)80422-1
Яковлева, А.А., Байрамов, Р.К., Кирсанова, Е.В. Изучение адсорбции катионов цезия на платине при высоких анодных потенциалах. Электрохимия. 1976. Т. 12. С. 1317. [Yakovleva, A.A., Bayramov, R.K., and Kirsanova, E.V., Study of the adsorption of cesium cations on platinum at high anodic potentials, Soviet. Electrochem. (in Russian), 1976, vol. 12, p. 1317.]
Тюрин, Ю.М., Володин, Г.Ф. Влияние состава раствора на предельное заполнение Pt-анода окислами. Электрохимия. 1970. Т. 6. С. 1186. [Tyurin, Yu.M. and Volodin, G.F., Influence of the composition of the solution on the limiting filling of the Pt-anode with oxides, Soviet. Electrochem. (in Russian), 1970, vol. 6, p. 1186.]
Казаринов, В.Е., Гирина, Г.П. Исследование строения двойного электрического слоя на платине в присутствии ацетат – ионов. Электрохимия. 1967. Т. 3. С. 107. [Kazarinov, V.E. and Girina, G.P., Study of the structure of the double electric layer on platinum in the presence of acetate – ions, Soviet. Electrochem. (in Russian), 1967, vol. 3, p. 107.]
Гаврилова, Н.Н., Назаров, В.В. Анализ пористой структуры на основе адсорбционных данных. М.: РХТУ им. Д.И. Менделеева, 2015. 132 с. [Gavrilova, N.N. and Nazarov, V.V., Analysis of porous structures based on adsorption data (in Russian), M.: MUCTR. D.I. Mendeleeva, 2015, 132 p.]
Ng, K.C., Burhan, M., Shahzad, M.W., and Ismail, A.B., A Universal Isotherm Model to Capture Adsorption Uptake and Energy Distribution of Porous Heterogeneous Surface, Scientific Reports, 2017, vol. 7(1), p. 10634. https://doi.org/10.1038/s41598-017-11156-6
Alavi, S., Ohmura, R., and Ripmeester, J.A., A molecular dynamics study of ethanol–water hydrogen bonding in binary structure I clathrate hydrate with CO2, Chem. Phys., 2011, vol. 134(5), p. 054702. https://doi.org/10.1063/1.3548868
Дополнительные материалы
- скачать ESM.doc
- Приложение 1.


