Электрохимия, 2022, T. 58, № 8, стр. 466-475
Фотоэлектроокисление метанола на гематитовых пленках, модифицированных TiО2, Bi и Cо
В. А. Гринберг a, *, В. В. Емец a, Н. А. Майорова a, А. А. Аверин a, М. В. Цодиков b, Д. А. Маслов b
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
b Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: vitgreen@mail.ru
Поступила в редакцию 15.12.2021
После доработки 09.02.2022
Принята к публикации 11.02.2022
- EDN: RVKIJW
- DOI: 10.31857/S0424857022080059
Аннотация
Изучено фотоэлектрокаталитическое окисление метанола на тонкопленочных нанокристаллических гематитовых электродах, изготовленных золь–гель-методом и промотированных TiO2, Bi и Co. Показано, что модифицирование гематита приводит к его превращению в материал, демонстрирующий высокую активность в фотоэлектрохимическом процессе окисления метанола при освещении светом видимой области спектра. Согласно данным спектроскопии модуляционного фототока это связано с уменьшением скорости рекомбинации электронно-дырочных пар, генерируемых при освещении. Поэтому тонкопленочные фотоаноды на основе модифицированного гематита имеют хорошие перспективы для практического применения в фотоэлектрохимической деградации органических загрязнителей.
ВВЕДЕНИЕ
Гематит α-Fe2O3 представляет собой полупроводник, имеющий невысокую энергию запрещенной зоны (2.1–2.2 эВ) и поэтому способный фотовозбуждаться при освещении светом видимой области спектра [1, 2]. Этот материал характеризуется низкой стоимостью, нетоксичностью и хорошей химической стойкостью в большинстве водных растворов при pH > 3 [3, 4], вследствие чего он может найти применение для фотоэлектрокаталитического разложения органических загрязнителей [5, 6]. Как и оксид вольфрама, сам гематит недостаточно эффективен в фотокаталитических процессах вследствие высокой скорости рекомбинации фотоиндуцированных пар e–/h+. Он также обладает невысокой проводимостью, что может быть недостатком с точки зрения его применения в качестве материала для фотоэлектродов. Однако эти недостатки можно устранить, допируя α-Fe2O3 подходящими металлами [6]. Как было показано Сузой и др. [7], высокотемпературный отжиг гематита в присутствии некоторых промоторов (например, Ti, Sn) значительно повышает его фотоэлектрокаталитическую активность в реакции фотолиза воды (что, вероятно, связано с уменьшением электронно-дырочной рекомбинации). В качестве легирующих добавок для улучшения фотоэлектрохимических характеристик гематита были исследованы также Si, Mg, Sn, Zn, Pt, Al, Mo, Cr, Со, Au, Ag [8‒14]. Авторы работ [13, 14] показали, что пленки α-Fe2O3 при их легировании кобальтом демонстрируют высокую эффективность преобразования энергии фотонов в ток в 0.1 M NaOH при потенциале 1.43 В (отн. OВЭ). Для получения пленок гематита используются различные методики синтеза, среди которых магнетронное напыление, пиролиз с ультразвуковым распылением, золь–гель-метод, а также электрохимическое осаждение [15–17].
В работе [18] было показано, что легирование тонкой пленки гематита титаном способствует существенному росту квантовой эффективности процесса фотолиза воды в 1 М NaOH. По мнению авторов, титан, присутствующий в решетке гематита, может влиять на фотоэлектрохимическое окисление воды за счет увеличения проводимости тонкой пленки. Кроме того, легирование гематитных пленок титаном увеличивает время жизни фотовозбужденных электронно-дырочных пар по сравнению с нелегированной пленкой гематита, что способствует увеличению производительности фотоэлектрохимической ячейки. Как показано в работе [19], большое влияние на фотоэлектрокаталитическую активность при разложении воды оказывает одновременное нанесение на гематитные пленки титанатных слоев и кобальта. Влияние концентрации и распределения кислорода на перенос дырок и фотоэлектрокаталитические свойства гематитных пленок в разложении воды рассмотрено в недавно опубликованной работе [20].
Анализ литературных данных показывает, что результаты, полученные различными авторами по фотоэлектрокаталитической активности модифицированного гематита в водных растворах, сильно разнятся. Эффективность фотоконверсии тонких пленок гематита все еще остается недостаточной вследствие короткой диффузионной длины носителей, низкого коэффициента поглощения и высокой скорости электронно-дырочной рекомбинации.
В настоящей работе мы исследовали фотоэлектрокаталитическую активность гематитных пленок, приготовленных золь–гель-методом и модифицированных TiO2, висмутом и кобальтом, в реакции деградации спиртов, в частности метанола, а также роль рекомбинационных процессов в гематитных пленках в зависимости от характера их модификации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Химически чистые (>99%) нитрат железа (Fe(NO3)3·9H2O), тетра н-бутоксид титана (Ti(OBu)4), моноэтаноламин (C2H7NO), ацетилацетонат кобальта (Co(acac)2), нитрат висмута (Bi(NO3)3·5H2O), а также ледяная уксусная кислота были приобретены в Aldrich и использованы в процессе синтеза без дополнительной обработки. Для изготовления фотоанодов использовали стекла марки ТСО 22-15 с электропроводящим покрытием из фтор-стабилизированного диоксида олова (F:SnO2, FTO) производства Solaronix (удельное сопротивление ≈ 15 Ом см–2).
ПРИГОТОВЛЕНИЕ ГЕМАТИТНЫХ И ЛЕГИРОВАННЫХ ГЕМАТИТНЫХ ПЛЕНОК
Приготовление фотоанодов из гематита
Фотоаноды из поликристаллического α-Fe2O3 были сформированы на стеклянной подложке с FTO-покрытием. Подложку предварительно очищали выдержкой в сернокислом растворе бихромата калия в течение 1 ч, промывали дистиллированной водой и обрабатывали абсолютированным ацетоном непосредственно перед нанесением α‑Fe2O3. Пленку гематита формировали путем нанесения коллоидного раствора, приготовленного из нитрата железа и моноэтаноламина (MEA), с последующей термообработкой. Для этого к одномолярному водному раствору Fe(NO3)3·9H2O добавляли MEA в количестве, необходимом для соотношения [MEA]/[Fe] = 2 (моль/моль), интенсивно перемешивали в течение 1 ч, а затем выдерживали более 12 ч при комнатной температуре до момента перехода цвета раствора от прозрачного желтого в непрозрачный темно-красный. Полученный раствор по каплям наносили на подложку методом spin-coating при вращении со скоростью 2000 об/мин, после чего образец подвергали термообработке при 500°С в течение 10 мин. Процедуру нанесения раствора с последующей термообработкой повторяли до тех пор, пока не формировалось ровное плотное покрытие с массовой долей железа 0.1%.
Модифицирование пленок гематита
Для приготовления фотоанодов из модифицированного гематита вначале наносили гематитную пленку по вышеописанной методике, а затем на сформированное покрытие наносили тетра-бутоксититан (Ti(OBu)4) в количестве 0.3 мл при вращении образца со скоростью 2000 об/мин. После высушивания образец прокаливали при 700°С в течение 15 мин (нагрев и охлаждение в печи, скорость нагрева 20 град/мин).
Приготовленные таким образом образцы гематита, модифицированного титаном, использовали затем для дальнейшего легирования кобальтом или висмутом. Для этого полученное покрытие TiO2/Fe2O3/FTO пропитывали либо 0.5 мМ раствором Co(Аcac)2 в воде или толуоле, либо 0.5 мМ раствором Bi(NO3)3 в смеси вода–ледяная уксусная кислота (1 : 1 по объему) в количестве 1 мл (в виде “большой капли”). После выдержки раствора на поверхности в течение 30 мин и последующей промывки дистиллированной водой образцы прокаливали в печи при 500°С в течение 3 ч.
ХАРАКТЕРИЗАЦИЯ ГЕМАТИТНЫХ ПЛЕНОК
Исследование фазового состава и структуры пленочных покрытий
Рентгеновская дифрактометрия. Фазовый состав твердых железосодержащих остатков исследовали методом рентгеновской дифракции на дифрактометре RigakuRotaflexD/Max-RC с вращающимся медным анодом и вторичным графитовым монохроматором (длина волны CuKα-излучения 0.1542 нм) в режиме непрерывного θ–2θ сканирования в угловом диапазоне 2θ = 10°–100°. Режим работы рентгеновского источника 50 кВ и 100 мА, скорость сканирования 1°/мин. Обработка экспериментальных дифрактограмм велась в программе MDIJade 6.5, фазовый состав был идентифицирован с использованием базы дифракционных данных ICDDPDF-2. Усредненный размер кристаллитов идентифицированной фазы определяли по уширению наблюдаемых дифракционных максимумов по методу Уильямсона–Холла.
Спектральные характеристики. Спектральные характеристики полученных пленок изучали в диапазоне 300–1100 нм при комнатной температуре с использованием спектрометра Lambda35 “PerkinElmer”.
Рамановские спектры. Спектры зарегистрированы на спектрометре комбинационного рассеяния inVia “Renishaw”. Длина волны возбуждения – 633 нм, мощность – менее 0.2 мВт, объектив – 20×.
Фотоэлектроокисление. При проведении фотоэлектрохимических исследований использовали компьютеризированную установку, состоящую из фотоэлектрохимической трехэлектродной ячейки PECC-2 (Zahner Elektrik, Германия), симулятора солнечного спектра 96000 (Newport, США) мощностью 150 Вт с фильтром АМ1.5G и потенциостата IPC-Pro MF (ИФХЭ РАН, Россия). Рабочий электрод в ячейке представлял собой фотоанод из гематита или из гематита, легированного титаном, титаном и висмутом или титаном и кобальтом, в виде пленочного покрытия с площадью поверхности 1 см2. Вспомогательным электродом служила платиновая проволока с площадью поверхности ≈3 см2. Серебряную проволоку использовали в качестве электрода сравнения, относительно которого приведены все потенциалы в данной работе. Потенциал относительно обратимого водородного электрода при рН 13 можно определить по формуле ERHE = = ${{E}_{{{{{\text{Ag}}} \mathord{\left/ {\vphantom {{{\text{Ag}}} {{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}}}} \right. \kern-0em} {{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}}}}}}$ + 1.16 [21]. Освещение осуществляли с обратной стороны фотоанода, а мощность освещения на различных расстояниях от источника света определяли с помощью прибора Nova (OPHIR-SPIRICON Inc., Израиль). Фотоэлектрохимическое окисление метанола на приготовленных фотоанодах проводили при освещении видимым светом 1 sun при мощности 100 мВт см–2. Модуляционные спектры фототока IMPS снимали на компьютеризированной фотоэлектрохимической станции Zahner PP 211 CIMPS (Zahner-Elektrik) Gmbh & Co.KG, Kronach, Германия) в диапазоне частот от 0.02 до 105 Гц. Станция была оснащена источником монохроматического света TLS03 с набором светодиодов с длиной волны от 320 до 1020 нм и пакетом программного обеспечения CIMPS-QE/IPCE. Спектры IMPS записывали при освещении фотоанода монохроматическим светом с длиной волны λ = 428 нм и фиксированной интенсивностью 12 мВт см–2. Синусоидальное возмущение (~10% от стационарного освещения) было наложено на постоянную базовую интенсивность света.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлена дифрактограмма образца Со2+/TiO2/Fe2O3/FTO. Как следует из рис. 1, на полученной дифрактограмме образца идентифицированы три кристаллических фазы: TiO2 в структуре анатаза, оксида олова SnO2 и частиц оксида железа в структуре гематита. Размер частиц оксида железа, рассчитанный по уширению рефлексов, составляет 22 нм, анатаза – 25 нм.
Характерный пик в области 143 см–1 на рамановском спектре (рис. 2) принадлежит диоксиду титана в форме анатаза, что согласуется с данными рентгеновской дифракции. Смещение линий образца Co2+/TiO2/Fe2O3/FTO по сравнению с α‑Fe2O3 можно объяснить влиянием Co, который способен замещать железо в решетке оксида.
Рис. 2.
Рамановский спектр образца пленки Co2+/TiO2/Fe2O3/FTO. (Для сравнения приведены спектры для TiO2 и α‑Fe2O3).

Спектры поглощения пленок: (1) Fe2O3/FTO; (2) TiO2/Fe2O3/FTO; (3) Co2+/TiO2/Fe2O3/FTO и (4) Bi3+/TiO2/Fe2O3 /FTO приведены на рис. 3. Все образцы показывают примерно одинаковый край поглощения, лежащий около 2.2 эВ. Для исключения вклада, связанного с толщиной пленки, кривые, приведенные на рис. 3, были нормализованы по оси Y в интервале от 0 до 1. Энергия ширины запрещенной зоны полупроводника (Eg) при прямом переходе электронов из валентной зоны в зону проводимости была получена путем экстраполяции на ось Х зависимости линейной части функции (αhν)2 от энергии фотона hν [22, 23] (рис. 4). Как видно из рис. 4, модификация Fe2O3 титаном, кобальтом и висмутом слабо влияет на энергию ширины запрещенной зоны, значения которой для всех исследованных образцов находятся в интервале 2.15–2.18 эВ. Тем не менее, некоторое увеличение энергии ширины запрещенной зоны при модификации Fe2O3 титаном, кобальтом и висмутом, по-видимому, способствует снижению рекомбинационных потерь.
Рис. 3.
Спектры поглощения пленочных фотоанодов: (1) Fe2O3/FTO, (2) TiO2/Fe2O3/FTO, (3) Co2+/TiO2/Fe2O3/FTO, (4) Bi3+/TiO2/Fe2O3/FTO.
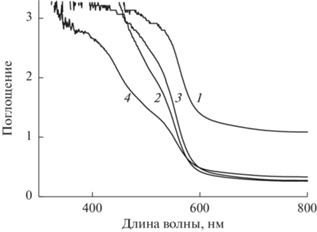
Рис. 4.
Зависимость (αhν)2 от энергии фотона hν для пленочных фотоанодов: (1) Fe2O3/FTO, (2) TiO2/Fe2O3/FTO, (3) Co2+/TiO2/Fe2O3/FTO, (4) Bi3/TiO2/Fe2O3/FTO.

Влияние содержания легирующего компонента на фотоэлектрокаталитическое окисление воды и метанола
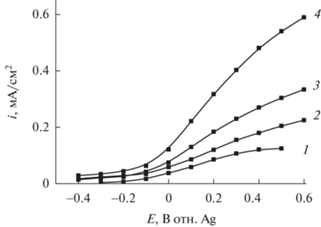
На рис. 5а–5г приведены вольт-амперные характеристики фотоанодов с нанесенными пленками Fe2O3, TiO2/Fe2O3, Co2+/TiO2/Fe2O3 и Bi3+/TiO2/Fe2O3 в темновых условиях и при облучении видимым светом мощностью 100 мВт см–2 в 0.1 М растворе КОН и в растворе 0.1 М КОН + + 39.2 мМ MeOH. Как видно из рисунка, при освещении фотоанодов наблюдается значительный фототок по сравнению с i,E-кривой, снятой в темновых условиях. Как следует из рис. 3, облучение исследованных фотоанодов имитатором солнечного света сопровождается абсорбцией света в УФ и видимой части спектра в интервале длин волн 390–600 нм. Энергия кванта в этой области спектра больше ширины запрещенной зоны исследованных полупроводниковых материалов, что приводит к генерации пары электрон/дырка (ecb/hvb) с переходом электронов в зону проводимости и появлением в валентной зоне положительно заряженных дырок. Дырки, генерируемые на поверхности как модифицированных, так и немодифицированных гематитовых пленок, являются сильными окислителями и при достаточно положительных потенциалах электрода способны инициировать фотоэлектрохимический процесс окисления воды и метанола [5, 6, 17, 18], что и вызывает появление фототока (рис. 5а–5г). Однако из-за относительно невысоких значений ширины запрещенной зоны только часть фотовозбужденных дырок переходит в раствор, остальная их часть рекомбинирует с электронами как в объеме полупроводника, так и на его поверхности. Фотовозбужденные дырки могут переходить на акцепторы в растворе как непосредственно из валентной зоны, так и через поверхностные состояния (ПС), локализованные на межфазной границе полупроводник/раствор, на которых протекает также рекомбинация фотовозбужденных дырок с электронами из зоны проводимости.
Рис. 5.
Вольт-амперные характеристики пленочных фотоанодов (а) Fe2O3/FTO, (б) TiO2/Fe2O3/FTO, (в) Co2+/TiO2/Fe2O3/FTO и (г) Bi3+/TiO2/Fe2O3/FTO, полученные в темновых условиях (1) и при освещении фотоанодов видимым светом мощностью 100 мВт см–2 в водных растворах 0.1 М КОН (2) и 0.1 М КОН + 39.2 мМ MeOH (3).

Абсорбция света пленками Fe2O3, TiO2/Fe2O3, Co2+/TiO2/Fe2O3 и Bi3+/TiO2/Fe2O3 приводит к увеличению концентрации свободных носителей заряда в приповерхностном слое электрода и к снижению поверхностного потенциального барьера (изгиб зон). По мере смещения потенциала в положительную сторону изгиб зон вверх увеличивается, и электрическое поле более эффективно разделяет электроны и дырки [17, 18], а рекомбинационные потери в реакциях фотооэлектрокисления воды и метанола снижаются [5, 6, 17–20]. Это приводит к росту фототока по мере перехода от отрицательных потенциалов к положительным (рис. 5а–5г).
Из сопоставления рис. 5а и 5б видно, что при модифицировании Fe2O3 титаном бестоковый потенциал электрода в 0.1 М водном растворе KOH сдвигается в отрицательную сторону, что указывает на дополнительное, по сравнению с Fe2O3, накопление электронов в зоне проводимости и дырок – в валентной зоне. Сдвиг бестокового потенциала и связанное с ним увеличение изгиба зоны проводимости и валентной зоны при переходе от Fe2O3 к TiO2/Fe2O3 повышает фотоэлектрокаталитическую активность фотоанода в реакции электрофотолиза воды (рис. 5б). Полученный результат согласуется с выводами работ [17, 18]. Кроме того, похожие явления мы наблюдали при модификации поверхности TiO2 индием, висмутом и свинцом [21, 24–27]. Из сопоставления рис. 5б с рис. 5в и 5г видно, что дополнительная модификация пленки TiO2/Fe2O3 кобальтом несколько увеличивает (рис. 5в), а модификация висмутом немного подавляет (рис. 5г) электрокаталитический эффект при электрофотолизе воды. Снижение электрокаталитического эффекта в реакции электрофотолиза воды на Bi3+/TiO2/Fe2O3/FTO-фотоаноде коррелирует с пониженой абсорбцией света для этого образца (см. рис. 3).
Добавка 39.2 мМ метанола в фоновый раствор приводит к дополнительному сдвигу бестокового потенциала в отрицательную сторону при облучении каждого из исследованных фотоанодов (рис. 5а–5г). Такое поведение фотоэлектродов может быть связано с тем, что, как будет показано ниже, в присутствии метанола снижается скорость рекомбинации фотогенерируемых носителей заряда (ecb/hvb). При сдвиге потенциала в положительную сторону токи фотоэлектроокисления метанола на пленках Fe2O3, TiO2/Fe2O3, Co2+/TiO2/Fe2O3 и Bi3+/TiO2/Fe2O3 (кривые 3 на рис. 5а–5г) значительно превышают фоновые фототоки, связанные с электрофотолизом воды. Аналогичные результаты были получены нами при исследовании фотоэлектроокисления метанола на диоксиде титана, модифицированном висмутом, свинцом и индием [21, 24–27].
На рис. 6 приведены парциальные вольт-амперные зависимости, для реакции фотоэлектроокисления метанола из водного раствора 0.1 М КОН + 39.2 мМ MeOH на исследованных образцах пленочных фотоанодов. Эти зависимости были определены вычитанием соответствующих вольт-амперных кривых, полученных в 0.1 М КОН + + 39.2 мМ MeOH и в 0.1 М КОН (рис. 5а–5г). Приведенные на рис. 6 парциальные кривые связаны только с фотоэлектрокаталитическим окислением метанола. Из рисунка видно, что фотоэлектрокаталитическая активность модифицированных пленок зависит от природы модифицирующей добавки и возрастает в ряду: Fe2O3 < TiO2/Fe2O3 < < Bi3+/TiO2/Fe2O3 < Co2+/TiO2/Fe2O3. Тот факт, что дополнительное легирование TiO2/Fe2O3 кобальтом (рис. 5б и 5в) слабо влияет на фотолиз воды, но существенно ускоряет фотоокисление метанола, указывает на повышенную селективность Co2+/TiO2/Fe2O3/FTO-фотоанода по отношению к реакции фотоэлектроокисления метанола.
Оценка рекомбинационных потерь при фотоэлектроокислении метанола
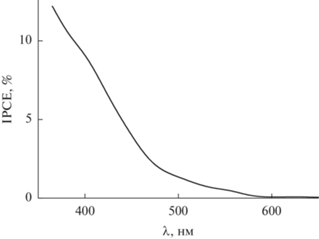
На рис. 7 приведена зависимость квантовой эффективности (IPCE) пленки Co2+/TiO2/Fe2O3 в реакции окисления метанола и воды от длины волны монохроматического света. Из сопоставления рис. 7 и 3 видна хорошая корреляция спектра IPCE с соответствующим спектром поглощения для данного образца (рис. 3). Важным фактором, понижающим значения IPCE, является рекомбинация фотоиндуцированных зарядов как в объеме, так и на поверхности (в том числе на ПС) полупроводника. Рекомбинационные потери при фотоэлектроокислении воды и метанола на исследованных пленочных фотоанодах оценивали с помощью метода модуляционной спектроскопии фототока (Intensity Modulated Photocurrent Spectroscopy (IMPS)) [28–31]. Для записи IMPS-зависимостей использовали монохроматическое излучение в видимой области с длиной волны 428 нм, обеспечивающее достаточно высокое значение IPCE.
На рис. 8 приведены IMPS-кривые для фотоанодов с пленками TiO2/Fe2O3 и Co2+/TiO2/Fe2O3. Регистрируемые IMPS-кривые, в целом, зависят от ряда факторов, в том числе от химической природы легирующих компонентов пленки, величины приложенного потенциала, состава электролита. На примере фотоанода TiO2/Fe2O3/FTO в 0.1 М KOH при потенциале 0 В (рис. 8, кривая 1) видно, что вследствие значительной поверхностной рекомбинации, фототок (точка пересечения кривой IMPS с осью X при низких частотах (НЧ)) составляет небольшую долю от тока генерации дырок (точка пересечения кривой IMPS с осью X при высоких частотах (ВЧ)). Ток генерации представляет собой выраженный в электрических единицах поток фотовозбужденных неосновных носителей заряда из объема полупроводника к его поверхности (т.е., ток при отсутствии поверхностной рекомбинации дырок). Введение в раствор 39.2 ммоля MeOH слабо влияет на ток генерации фотоиндуцированных носителей заряда в пленке TiO2/Fe2O3 (ВЧ-предел IMPS на рис. 8, кривая 2), но значительно снижает рекомбинационные потери на поверхности фотоэлектрода из-за превалирующего участия фотоиндуцированных дырок в процессе фотоэлектрохимического окисления метанола. Это видно по сближению ВЧ- и НЧ-пределов IMPS (рис. 8, кривая 2). Сдвиг потенциала TiO2/Fe2O3 фотоанода в положительную сторону до 0.15 В улучшает эффективность разделения фотоиндуцированных пар (ecb/hvb), что проявляется через увеличение тока генерации дырок (ВЧ-предел IMPS на рис. 8, кривая 3). Это приводит также к некоторому росту фототока в 0.1 М KOH (сдвиг НЧ-предела IMPS на рис. 8, при переходе от кривой 1 к кривой 3), хотя из-за значительных рекомбинационных потерь большая часть фотоиндуцированных зарядов, выходящих на поверхность пленки TiO2/Fe2O3, по-прежнему теряется (рис. 8, кривая 3). Введение 39.2 ммоля MeOH значительно подавляет рекомбинационные процессы на поверхности пленки TiO2/Fe2O3 (рис. 8, кривая 4). В результате почти весь поток фотоиндуцированных дырок из объема к границе раздела полупроводник/раствор участвует в фотоокислении метанола, а фототок значительно увеличивается и приближается к току генерации (сближение ВЧ- и НЧ-пределов IMPS на рис. 8, кривая 4).
Рис. 8.
IMPS-зависимости для пленочного фотоанода TiO2/Fe2O3/FTO при потенциале 0 В (1, 2) и 0.15 В (3, 4), а также для пленочного фотоанода Co2+/TiO2/Fe2O3/FTO при потенциале 0.15 В (5, 6) в 0.1 М КОН (1, 3, 5) и в 0.1 М КОН + + 39.2 мМ MeOH (2, 4, 6). Освещение монохроматическим светом 428 нм. Мощность освещения 12 мВт см–2.

Модифицирование TiO2/Fe2O3 кобальтом увеличивает ток генерации дырок, что видно по росту ВЧ-предела IMPS на рис. 8 при переходе от кривой 3 к кривой 5. В 0.1 М KOH это приводит к относительно небольшому увеличению фототока (НЧ-предел IMPS на рис. 8, кривая 5) из-за значительных рекомбинационных потерь. В растворе с добавкой 39.2 мМ MeOH практически весь поток фотогенерированных дырок к поверхности фотоанода используется для окисления метанола (сближение ВЧ- и НЧ-пределов IMPS на рис. 8, кривая 6), что сопровождается существенным ростом фототока. Из полученных данных следует, что молекулы метанола в 0.1 М растворе KOH являются значительно более эффективными акцепторами фотоиндуцированных дырок на поверхности пленки Co2+/TiO2/Fe2O3, чем молекулы воды. В целом, результаты, полученные методом IMPS, хорошо согласуются с данными, иллюстрируемыми рис. 5 и 6, и объясняют их.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты проведенного исследования показывают, что фотокаталитические свойства тонкопленочного гематитового фотоэлектрода, полученного золь–гель-методом, в реакции деградации метанола из водного раствора улучшаются при модифицировании его поверхности титаном, кобальтом и висмутом, при этом фотоэлектрокаталитическая активность возрастает в ряду: Fe2O3 < TiO2/Fe2O3 < Bi3+/TiO2/Fe2O3 < < Co2+/TiO2/Fe2O3. Такое модифицирование поверхности гематита повышает эффективность переноса заряда через границу раздела фотоанод/раствор метанола при облучении имитатором солнечного света как за счет увеличения тока генерации носителей заряда, так и за счет снижения рекомбинационных потерь, поскольку молекулы метанола в 0.1 М растворе KOH, являясь более эффективными акцепторами фотоиндуцированных дырок по сравнению с молекулами воды, подавляют рекомбинационные процессы на поверхности модифицированных фотоанодов. Показано, также, что модифицирование Fe2O3 одновременно титаном и кобальтом обеспечивает повышенную селективность фотоанода по отношению к реакции фотоэлектроокисления метанола из водного раствора.
Список литературы
Bessegato, G.G., Guaraldo, T.T., and Zanoni, M.V.B., Enhancement of photoelectrocatalysis effciency by using nanostructure electrodes. Chapter 10. In: Modern Electrochemical Methods in Nano, Surface and Corrosion Science; Aliokhazraei, M., Ed.; IntechOpen: London, UK, 2014, p. 271. https://doi.org/10.5772/58333
Peleyeju, M.G. and Arotiba, O.A., Recent trend in visible-light photoelectrocatalytic systems for degradation of organic contaminants in water/wastewater, Environ. Sci. Water Res. Technol., 2018, vol. 4, p. 1389. https://doi.org/10.1039/C8EW00276B
Mishra, M. and Chun, D., α-Fe2O3 as a photocatalytic material: A review, Appl. Catal., A., 2015. vol. 498, p. 126. https://doi.org/10.1016/j.apcata.2015.03.023
Zhang, M., Pu, W., and Pan, S., Photoelectrocatalytic activity of liquid phase deposited α-Fe2O3 films under visible light illumination, J. Alloys Compd., 2015, vol. 648, p. 719. https://doi.org/10.1016/j.jallcom.2015.07.026
Mesa, C.A., Kafizas, A., Francas, L. Pendlebury, S.R., Pastor, E.Ma,Y, Formal, F.L., Mayer, M.T., Grätzel M., and Durrant, J.R., Kinetics of Photoelectrochemical Oxidation of Methanol on Hematite Photoanodes, J. Am. Chem. Soc., 2017, vol. 139, p. 11537. https://doi.org/10.1021/jacs.7b05184
Iervolino, G., Tantis, I., Sygellou, L., Vaiano, V., Sannino, D., and Lianos, P., Photocurrent increase by metal modification of Fe2O3 photoanodes and its effect on photoelectrocatalytic hydrogen production by degradation of organic substances, Appl. Surf. Sci., 2017, vol. 400, p. 176. https://doi.org/10.1016/j.apsusc.2016.12.173
Souza, F.L. and Leite, E.R., Latest Advances on the Columnar Nanostructure for Solar Water Splitting, Nanoenergy, Springer Internat. Publ. AG, 2018, p. 141. https://doi.org/10.1007/978-3-319-62800-4_4
Cesar, I., Kay, A., Gonzalez Martinez, J.A., and Grätzel, M., Translucent thin film Fe2O3 photoanodes for efficient water splitting by sunlight: nanostructure-directing effect of Si-doping, J. Am. Chem. Soc., 2006, vol. 128, p. 4582. https://doi.org/10.1021/ja060292p
Hahn, N.T. and Mullins, C.B., Photoelectrochemical performance of nanostructured Ti- and Sn-doped α‑Fe2O3 photoanodes, Chem. Mater., 2010, vol. 22, p. 6474. https://doi.org/10.1021/cm1026078
Ingler, W.B., Jr. and Khan, S.U.M., Photoresponse of spray pyrolytically synthesized magnesium-doped iron(III) oxide (α-Fe2O3) thin films under solar simulated light illumination, Thin Solid Films, 2004, vol. 461, p. 301. https://doi.org/10.1016/j.tsf.2004.01.094
Kleiman-Shwarsctein, A., Hu, Y-S., Forman, A.J., Stucky, G.D., and McFarland, E.W., Electrodeposition of α-Fe2O3 doped with Mo or Cr as photoanodes for photocatalytic water splitting, J. Phys. Chem., C, 2008, vol. 112, p. 15900. https://doi.org/10.1021/jp803775j
Watanabe, A. and Kozuka, H., Photoanodic properties of sol–gel-derived α-Fe2O3 thin films containing dispersed gold and silver particles, J. Phys. Chem. B, 2003,vol. 107, p. 12713. https://doi.org/10.1021/jp0303568
Schrebler, R.S., Ballesteros, L., Burgos, A. Muñoz,, E.C., Grez, P., Leinen, D., Martín, F., Ramos-Barrado, J.R., and Dalchiele, E.A., Electrodeposited Nanostructured α‑Fe2O3 Photoanodes for Solar Water Splitting: Effect of Surface Co-Modification on Photoelectrochemical Performance, J. Electrochem. Soc., 2011, vol. 158, (8), p. D500. https://doi.org/10.1149/1.3599059
Hamd, W., Cobo, S., Fize, J., Baldinozzi, G., Schwartz, W., Reymermier, M., Pereira, A., Fontecave, M., Artero, V., Laberty-Robert, Ch., and Sanchez, C., Mesoporous α-Fe2O3 thin films synthesized via the sol–gel process for light-driven water oxidation, Phys. Chem. Chem. Phys., 2012. https://doi.org/10.1039/c2cp42535a
Baratto, C., Lottici, P.P., Bersani, D., Antonioli, G., Gnappi, G., and Montenero, A., Sol–gel preparation of α-Fe2O3 thin films: structural characterization by XAFS and Raman, J. Sol–Gel Sci. Technol., 1998, vol. 13, p. 667. https://doi.org/10.1023/A:1008694519106
Duret, A. and Gratzel, M., Visible light-induced water oxidation on mesoscopic α-Fe2O3 films made by ultrasonic spray pyrolysis, J. Phys. Chem. B, 2005, vol. 109, p. 17184. https://doi.org/10.1021/jp044127c
Uribe, J., Osorio, J., Barrero, C., Girata, D., Morales, A., Devia, A., Gómez, M.E., Ramirez, J.G., and Gancedo, J.R., Hematite thin films: growth and characterization, Hyperfine Interact., 2006, vol. 169, p. 1355. https://doi.org/10.1007/s10751-006-9450-y
Lian, X., Yang, X., Liu, S., Xu, Y., Jiang, Ch., Chen, J., and Wang, R., Enhanced photoelectrochemical performance of Ti-doped hematite thin films prepared by the sol–gel method, Appl. Surf. Sci., 2012, vol. 258, p. 2307. https://doi.org/10.1016/j.apsusc.2011.10.001
Chen, S., Zeng1, Q., Bai, J., Li, J., Li, L., Xia, L., and Zhou, B., Preparation of hematite with an ultrathin iron titanate layer via an in situ reaction and its stable, long-lived, and excellent photoelectrochemical performance, Appl. Catal. B, 2017, vol. 218, p. 690. https://doi.org/10.1016/j.apcatb.2017.07.012
Zhou, M., Chen, S., Bai, J., Wang, J., Zhang, Y., Zhou, T., Li, J., Shangguan, W., and Zhou, B., Effect of oxygen concentration and distribution on holes transfer and photoelectrocatalytic properties in hematite, Int. J. Hydrog. Energy, 2021, vol. 46, p. 7309. https://doi.org/10.1016/j.ijhydene.2020.11.245
Maslov, D.A., Tsodikov, M.V., Nikolaev, S.A., Kriventsov, V.V., Grinberg, V.A., Emets, V.V., and Mayorova, N.A., Structural features and photoelectrocatalytic properties of bismuth-doped titanium oxides, Mater. Chem. Phys., 2021, vol. 259, p. 123936. https://doi.org/10.1016/j.matchemphys.2020.123936
Tauc, J. and Menth, A., State in the gap, J. Non-Cryst. Solids, 1972, vol. 8, p. 569. https://doi.org/10.1016/0022-3093(72)90194-9
Chakrabarti, M., Dutta, S., Chattapadhyay, S., Sarkar, A., Sanyal, D., and Chakrabarti, A., Grain size dependence of optical properties and positron annihilation parameters in Bi2O3 powder, J. Nanotech, 2004, vol. 15, p. 1792. https://doi.org/10.1088/0957-4484/15/12/017
Гринберг, В.А., Емец, В.В., Майорова, Н.А., Маслов, Д.А., Аверин, А.А., Поляков, С.П., Левин, И.С., Цодиков, М.В. Фотоэлектрокаталитическое окисление муравьиной кислоты в видимой области спектра на пленках нанокристаллического диоксида титана, легированного висмутом. Физикохимия поверхности и защита материалов. 2019. Т. 55. С. 359. [Grinberg, V.A., Emets. V.V., Maiorova, N.A., Maslov, D.A., Averin, A.A., Polyakov, Levin, I.S., and Tsodikov, M.V., Photoelectrocatalytic oxidation of formic acid in the visible spectral region on films of nanocrystalline titanium oxide doped by bismuth., Prot.Met.Phys.Chem.Surf., 2019, vol. 55, no. 4, p. 637.] https://doi.org/10.1134/S207020511904005110.1134/S2070205119040051https://doi.org/10.1134/S0044185619040053
Гринберг, В.А., Емец, В.В., Майорова, Н.А., Маслов, Д.А., Аверин, А.А., Поляков, С.Н., Молчанов, С.П., Левин, И.С., Цодиков, М.В. Фотоэлектрохимическая активность в видимой области спектра наноразмерных пленок диоксида титана, легированного висмутом и свинцом. Физикохимия поверхности и защита материалов. 2019. Т. 55. С. 48. [Grinberg, V.A., Emets, V.V., Maiorova, N.A., Maslov, D.A., Averin, A.A., Polyakov, S.N., Molcha-nov, S.P., Levin, I.S., and Tsodikov, M.V., Photoelectrochemical activity of nanosized titania, doped with bismuth and lead, in visible light region, Prot. Met. Phys. Chem. Surf., 2019, vol. 55, no. 1, p. 55.] https://doi.org/10.1134/S207020511901012X10.1134/S207020511901012Xhttps://doi.org/10.1134/S0044185619010121
Grinberg, V.A., Emets, V.V., Maslov, D.A., Tsodikov, M.V., Mayorova, N.A., Averin, A.A., Fedotov, A.S., Marinova, M., and Simon, P., Photoelectrocatalytic activity of In(III)-modified TiO2 photoanodes in the visible spectrum region, New J. Chem., 2020, vol. 44, p. 16200. https://doi.org/10.1039/D0NJ03162C
Гринберг, В.А., Емец, В.В., Цодиков, М.В., Майорова, Н.А., Маслов, Д.А. Фотоэлектрокаталитическая деградация органических соединений на полупроводниковых наноразмерных материалах. Физикохимия поверхности и защита материалов. 2021. Т. 57. С. 381. [Grinberg, V.A., Emets, V.V., Tsodikov, M.V., Mayorova, N.A., and Maslov, D.A., Photoelectrocatalytic Degradation of Organic Compounds on Nanoscale Semiconductor Materials, Prot. Met. Phys. Chem. Surf., 2021, vol. 57, no. 4, p. 699.] https://doi.org/10.1134/S207020512104010910.1134/S2070205121040109https://doi.org/10.31857/S0044185621040100
Peter, L.M., Ponomarev, E.A., and Fermin, D.J., Intensity-modulated photocurrent spectroscopy: reconciliation of phenomenological analysis with multistep electron transfer mechanisms, J. Electroanal. Chem., 1997, vol. 427, p. 79. https://doi.org/10.1016/S0022-0728(96)05033-4
Peter, L.M., Wijayantha, K.G.U., and Tahir, A.A., Kinetics of light-driven oxygen evolution at α-Fe2O3 electrodes, Faraday Discuss., 2012, vol. 155, p. 309. https://doi.org/10.1039/C1FD00079A
Thorne, E.J., Jang, J.W., Liu, E.Y., and Wang, D., Understanding the Role of Co-Catalysts on Silicon Photocathodes Using Intensity Modulated Photocurrent Spectroscopy, J. Chem. Sci., 2016, vol. 7, p. 3347. https://doi.org/10.1039/C7CP06533G
Klotz, D., Ellis, D.S., Dotana, H., and Rothschild, A., Empirical in operando Analysis of the Charge Carrier Dynamics in Hematite Photoanodes by PEIS, IMPS and IMVS, J. Phys. Chem.Chem.Phys., 2016, vol. 18, p. 23438. https://doi.org/10.1039/C6CP04683E
Дополнительные материалы отсутствуют.