Электрохимия, 2022, T. 58, № 9, стр. 523-534
Реакция электровосстановления кислорода на модифицированных углеродных нанотрубках в щелочном электролите
В. А. Богдановская a, *, И. Е. Вернигор a, **, М. В. Радина a, Н. В. Панченко a, В. Н. Андреев a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Россия
* E-mail: bogd@elchem.ac.ru
** E-mail: msnoviinna@gmail.com
Поступила в редакцию 04.02.2022
После доработки 11.03.2022
Принята к публикации 15.03.2022
- EDN: DUAWDC
- DOI: 10.31857/S0424857022090043
Аннотация
Электрохимические характеристики углеродных нанотрубок (УНТ), подвергнутых различным видам модификации для повышения активности и стабильности в реакции электровосстановления кислорода (РВК) в щелочном электролите, определены методом циклической вольтамперометрии на вращающемся дисковом и вращающемся дисковом электроде с кольцом. Измерения выполнены на УНТ после их функционализации, допирования азотом и последующего модифицирования платиной в количестве до 20 мас. %. Полученный дисперсный материал в виде предельно тонкого слоя наносили на дисковый электрод и исследовали влияние предварительной обработки УНТ на эффективность в РВК в щелочном электролите. Показано, что активность выше, а степень деградация меньше по мере повышения селективности в РВК до воды. При восстановлении кислорода через промежуточное образование пероксида водорода в процессе восстановления О2 деградация исследуемой системы увеличивается. Наибольший вклад реакции с промежуточным образованием Н2О2, по данным ВДЭК, наблюдается на УНТ после функционализации, а допирование азотом увеличивает активность и вклад 4-электронной реакции, и величина n составляет 3.2. После модифицирования платиной РВК протекает преимущественно с разрывом О–О-связи и восстановлением кислорода до воды. Влияние носителя на характеристики нанотрубок, модифицированных платиной, сказывается в области потенциалов меньше 0.70 В, где электровосстановление О2 на поверхности, свободной от Pt, протекает с переносом двух электронов и вносит вклад в суммарный процесс. Деградация катализатора тем меньше, чем меньше пероксида водорода образуется в ходе РВК. Необходимо дальнейшее повышение активности УНТ путем увеличения количества определенного типа азотсодержащих групп на их поверхности, обеспечивающих вклад 4-электронного пути реакции восстановления кислорода.
ВВЕДЕНИЕ
Реакция электровосстановления кислорода (РВК) является одной из наиболее распространенных реакций в электрохимических источниках тока с водными кислыми и щелочными электролитами. Механизм РВК на платиновых катализаторах исследовали при использовании гладких электродов, таких как Pt, Pd, Au и углеродные материалы и др. ([1–7] и ссылки в них), в кислых или щелочных электролитах. Показано, что на Pt-электроде РВК протекает преимущественно до воды и включает в качестве медленной стадии перенос первого электрона. При этом в зависимости от условий, состава и рН электролита на Pt-электроде реализуется 4-электронное восстановление молекулярного кислорода с разрывом О–О-связи и образованием воды или последовательный путь РВК, включающий образование Н2О2 с переносом 2 электронов и последующее восстановление пероксида водорода до воды. На углеродных материалах в щелочных электролитах РВК, как правило, осуществляется по последовательному пути с промежуточным образованием Н2О2 [2, 4]. При этом, как показано в работах [5, 7] в щелочных электролитах РВК на УМ, предварительно допированных азотом, протекает при потенциалах близких, к наблюдаемым на материалах, содержащих платину.
Значительный вклад в выяснение механизма РВК внесли исследования, выполненные методом вращающегося дискового электрода с кольцом (ВДЭК), который позволяет оценить вклад одного (восстановление кислорода до воды) или другого пути (восстановление кислорода через промежуточное образование пероксида водорода). В работах [2, 7, 8] было показано, что заполнение поверхности электрода хемосорбированным кислородом или другими частицами оказывает значительное влияние на активность и путь РВК, во всяком случае на активность как Pt, так и Pd [8, 9]. Так в области потенциалов, близких к стационарному (в атмосфере кислорода ~1.0 В о. в. э.) на поверхности Pt в кислом и щелочном электролитах хемосорбируется кислород из воды. Чем больше заполнение поверхности хемосорбированными частицами, тем меньше вклад прямой реакции до воды с разрывом О–О-связи. Влияние рН электролита на электрокатализ катодного восстановления кислорода рассмотрено в [2, 7]. Показано, что на платиновых и неплатиновых катализаторах переход от кислых к щелочным электролитам сопровождается снижением энергии адсорбции молекулярного кислорода и, как следствие, уменьшением доли РВК по прямому пути восстановления кислорода до воды. Вероятно, изменение пути РВК в щелочном электролите связано с адсорбцией на поверхности значительного количества ОН–-ионов, препятствующих адсорбции О2 на Pt в ориентации, благоприятной для разрыва О–О-связи, и непосредственному восстановлению до воды. Влияние хемосорбированных частиц на активность Pt при различных потенциалах электрода в РВК на платине отражено, например, в работах [8, 9]. Показано, что в зависимости от потенциала на Pt в кислом электролите адсорбируются кислородсодержащие частицы и ${\text{HSO}}_{4}^{ - }$-анионы, которые по мере смещения потенциала в сторону менее положительных значений десорбируются с поверхности, и достигается максимальное значение тока в виде предельного диффузионного тока. Затем при E < 0.35 В вновь наблюдается некоторое снижение величины измеряемого тока. Наблюдаемый эффект связан с тем, что в этой области потенциалов на поверхности Pt адсорбируются Н+, что следует из ЦВА на платине, который также затрудняет адсорбцию молекул О2. В то же время на поляризационной кривой восстановления кислорода, записанной в анодном направлении (от 0.10 В), активность в РВК при E > 0.40 В увеличивается, поскольку поверхность свободна от хемосорбированных частиц, препятствующих адсорбции молекулярного кислорода в ориентации, благоприятной для разрыва О–О-связи [8]. Подобное влияние на реакцию восстановления кислорода оказывают также анионы ${\text{HSO}}_{4}^{ - }.$ Это подтверждается данными по исследованию РВК в электролитах на основе H2SO4 и HClO4, поскольку анион ${\text{ClO}}_{4}^{ - }$ не адсорбируется на платине [9], то активность в РВК в электролите на основе HClO4 выше.
В щелочных электролитах, где велика степень заполнения хемосорбированным из воды кислородом на Pt [7, 10], а на модифицированных кислород- и азотсодержащими группами УНТ гидроксил-ионы не адсорбируются, при этом РВК протекает на этих материалах при близких потенциалах. Однако близость потенциалов в этом случае обусловлена изменением пути реакции – кислород восстанавливается по 2-электронному пути с образованием пероксида водорода. При этом лимитирующей стадией является присоединение первого электрона [2, 7], после чего в кислых электролитах связь О–О рвется и кислород восстанавливается до воды. В щелочном электролите присоединение первого электрона не приводит к разрыву О–О-связи, поскольку на Pt адсорбируются ОН–-ионы и степень заполнения поверхности велика в области потенциалов, близких к стационарному. На функционализированных и допированных азотом нанотрубках, поверхность которых имеет отрицательный заряд, гидроксил-ионы не адсорбируются, состояние поверхности Pt и модифицированных УНТ сближается, энергия адсорбции кислорода на таких поверхностях снижается [7], и РВК протекает преимущественно через промежуточное образование пероксида водорода.
Катализаторы, включающие палладий, золото и другие металлы и сплавы, занимают промежуточное положение по активности в РВК между платиной и углеродным материалом. При этом, например, в случае PdNi/C-катализатора высокая активность и стабильность системы обусловлена снижением количества, образующегося при восстановлении О2 пероксида водорода, благодаря присутствию никеля в сплаве [11].
Значительно меньше исследований посвящено изучению механизма РВК на дисперсных катализаторах, которые применяются при создании активных слоев электродов источников тока. Применение методов ВДЭ и ВДЭК при нанесении на исследуемый дисковый электрод предельно тонкого слоя дисперсного катализатора [12] показало, что качественно поляризационные кривые РВК совпадают с таковыми на гладких электродах. Однако пористая структура и морфология дисперсных катализаторов вносят некоторые количественные изменения в путь РВК.
В ряде работ [12–18], а также в работах, выполненных нами [19, 20], было показано, что активность и коррозионная устойчивость УНТ в РВК зависит от природы и количества функциональных групп на поверхности. Высокую активность УНТ, особенно после модификации, проявляют в щелочных электролитах. Состав и свойства поверхности определяют, кроме того, путь РВК: 2- или 4‑электронное восстановление О2. На УМ как правило реакция протекает через промежуточное образование пероксида водорода, который в свою очередь влияет на деградацию УМ.
Целью данного исследования являлось установление пути РВК методом ВДЭК на УНТ, модифицированных кислородсодержащими (УНТNaОН), кислород- и азотсодержащими группами (УНТNaOH + N), а также на этих типах УНТ, модифицированных Pt. При выборе этого ряда материалов исходили из того, что мягкие условия функционализации не вызывают существенных изменений в пористой структуре УНТ. Допирование азотом приводит к появлению на поверхности кислород- и азотсодержащих22 групп. Модифицирование платиной, зависит от количества активных центров для связывания металла.
В данной работе исследована активность (установление пути РВК) и стабильность в водных щелочных электролитах на УНТ, подвергнутых различным обработкам. Это позволит оценить перспективность применения УНТ как собственно катализатора, так и в отношении активности и стабильности Pt/УНТ-катализатора, синтезированного на них.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали углеродные нанотрубки Таунит производства “НаноТехЦентр, ООО”, (Тамбов, Россия). Исходные УНТ имеют удельную поверхность 260–270 м2/г, внешний диаметр составляет 10–30 нм.
Перед использованием УНТ подвергали функционализации в щелочи, допированию азотом и модифицированию Pt-полиольным методом.
Методы модификации УНТ
Функционализация УНТ. Функционализацию УНТ проводили в 1 М NaOH. При перемешивании добавляли УНТ в щелочь и выдерживали в ней при 110–120°С в течение 1 ч. После охлаждения до комнатной температуры УНТ отмывали деионизованной водой до нейтрального значения рН, осадок сушили в вакуумном шкафу при 90°C. УНТ после обработки NaOH обозначены как УНТNaOH.
Допирование азотом. Функционализированные УНТ смешивали с меламином (C3H6N6), который использовали в качестве источника азота, в соотношении 1 : 0.7, и помещали в размольные агатовые стаканы объемом 12 мл с тремя агатовыми шарами (d = 10 мм), и размалывали на шаровой мельнице (Pulverizette 7, фирмы FRITSCH) в течение 1 ч при 800 об/мин. Обработку осуществляли на воздухе. Полученную порошкообразную смесь помещали в кварцевую трубку и подвергали термической обработке в течение 1 ч при 600°С в атмосфере аргона. УНТ после обработки NaOH и допирования азотом обозначены как УНТNaOH + N.
Полиольный метод модифицирования УНТ платиной. Метод заключается в восстановлении ионов платины многоосновным спиртом (этиленгликолем) при температуре, близкой к температуре его кипения. Навеску УНТ после обработки помещали в этиленгликоль (ОСЧ ЗАО “ЭКОС-1”, Россия) и подвергали ультразвуковому диспергированию в течение 1 ч. Затем суспензию УМ в этиленгликоле помещали в трехгорлую круглодонную колбу, снабженную капельной воронкой, обратным холодильником и капилляром для барботирования аргона. Колбу устанавливали в лабораторную баню, заполненную глицерином. Через капельную воронку добавляли в этиленгликоль раствор, содержащий H2PtCl6·6H2O (фирма “Аурат”). Баню нагревали до 110–130°С. Температурную обработку продолжали в течение 1.5 ч при барботировании аргоном. Полученную смесь отстаивали, промывали водой, твердый осадок отделяли на центрифуге и помещали в сушильный шкаф.
Определение содержания платины в синтезированных катализаторах. Метод основан на измерении оптической плотности раствора комплекса Pt с хлоридом двухвалентного олова (SnCl2) в широком диапазоне концентраций Pt – от 0.4 до 100 мкг Pt мл–1. Измерение оптической плотности исследуемого раствора проводили на спектрофотометре SPECORD M40. Более подробная методика измерений представлена в работе [21].
Электрохимические методы исследования. При проведении электрохимических измерений методом циклической вольтамперометрии (ЦВА) использовали потенциостат-гальваностат Р-40Х (г. Черноголовка, Россия) при работе на ВДЭ. Измерения на ВДЭК выполнены на установке Pine Instrument Company Bipotentiostat Model AFCBP1.
Исследования проводили в 0.1 М КОН в трехэлектродной электрохимической ячейке. В качестве рабочего электрода использовали ВДЭ из углеситалла, впрессованный в тефлоновую втулку, рабочая площадь которого (Sраб) составляет 0.126 см2. Вспомогательный электрод выполнен в виде платиновой проволоки. В качестве электрода сравнения использовали Hg/HgO-электрод, помещенный в 0.1 M KOH. Все значения потенциалов приведены относительно обратимого водородного электрода (о. в. э).
Измерения на ВДЭК выполнены на дисковом электроде из стеклоуглерода, на который наносили предельно тонкий слой дисперсного катализатора. Кольцевой электрод, выполненный из платины, перед измерениями платинировали из раствора платинохлористоводородной кислоты до достижения фактора шероховатости ~70–80. Перед каждым измерением кольцевой электрод активировали путем записи ЦВА в интервале 0.05–1.20 В в инертной атмосфере при скорости наложения потенциала 0.05 В/с. Измерения выполнены на установке Pine Instrument Company Bipotentiostat Model AFCBP1.
Для приготовления каталитических чернил 2 мг исследуемого материала диспергировали в 500 мкл изопропилового спирта (или воды), аликвоту этой смеси (~100–150 мкг/см2) наносили микропипеткой на поверхность рабочего электрода (углеситалл в ВДЭ и стеклоуглерод во ВДЭК) и сушили на воздухе при комнатной температуре.
Метод ЦВА применяли для определения электрохимически активной поверхности (SЭАП), оценки состояния поверхности исследуемого материала и определения состава активного слоя на поверхности электрода по наличию характерных максимумов при отсутствии деполяризатора (кислорода) в растворе электролита. Для проведения эксперимента электролит продували аргоном в течение 30 мин при комнатной температуре. ЦВА записывали в диапазоне 0.05–1.20 В (о. в. э.), при скорости наложения потенциала 0.05 В/с на стационарном электроде.
По результатам измерения ЦВА оценивали удельную поверхность (для платинового катализатора) и поляризационную емкость (для неплатиновых катализаторов). Электрохимически активную поверхность (SЭАП) Pt рассчитывали путем интегрирования заряда на ЦВА в области десорбции водорода, предполагая, что 0.210 мКл/см2 необходимо для монослойного заполнения 1 см2 поверхности Pt водородом. Оценку величины электрохимически активной поверхности УНТ проводили по величине заряда ЦВА, как 1/2Q, где Q – суммарный заряд катодного и анодного участков ЦВА в интервале потенциалов 0.05–1.20 В.
Активность исследуемых материалов в РВК определяли по поляризационным кривым, полученным в O2-насыщенном электролите, при скорости наложения потенциала 0.005 В/с при различных скоростях вращении электрода. Каталитическую активность определяли по потенциалу полуволны (Е1/2, В) и плотности тока в кинетической области (iкин, А/см2) при отсутствии диффузионных ограничений. Массовую активность каталитической системы, содержащей платину, определяли при потенциале 0.9 В по величине тока на анодном ходе поляризационной кривой.
Коррозионную стойкость определяли методом ускоренного тестирования. Метод заключается в циклировании потенциала электрода со скоростью 0.10 В/с в интервале 0.6–1.3 В (о. в. э) при отсутствии кислорода в 0.1 М KOH. До начала циклирования и после 100, 500 и 1000 циклов определяли величину поверхности (SЭАПPt и 1/2 Q для УНТ) и активность по поляризационным кривым восстановления кислорода.
Структурные методы исследования
Определение поверхности методом БЭТ. Площадь поверхности по БЭТ (SBET) и значения пористости исследуемых материалов определяли методом физической адсорбции газообразного азота при 77 К. Изотермы адсорбции при температуре 77 К получали на объемной высоковакуумной адсорбционной установке ASAP-2020 MP Micromeritics USA в интервале относительных давлений от 10–6 до 0.99 объемным методом. СЭМ-изображения получали при использовании JEOL сканирующего электронного микроскопа (JSM-6510LV).
Метод эталонной контактной порометрии (МЭКП). Для исследования пористой структуры и гидрофильно-гидрофобных свойств УНТ использовали метод эталонной контактной порометрии [22]. Этот метод позволяет изучать не только пористую структуру любого материала в максимально широком диапазоне радиусов пор от 1 до 3 × 105 нм, но и их гидрофобно-гидрофильные свойства. Когда в качестве измерительной жидкости используется октан, получаемые кривые описывают все поры, при использовании воды – измеряются только гидрофильные поры.
Метод динамического светорассеяния (МДС). Дзета-потенциал модифицированных УНТ определяли методом динамического светорассеяния с использованием прибора Malvern Zetasize Nano. Для проведения измерений готовили суспензию УНТ (<1 мкг) в воде (2 мл). Измерения проводили при 25°С, с использованием кювет Clear disposable zeta cell [23].
Рентгеновская фотоэлектронная спектроскопия (РФЭС). РФЭ-спектры получали на оже-спектрометре (Vacuum Generators, Великобритания) с приставкой CLAM 2 для измерения спектров РФЭС. Вакуум в камере анализатора достигал 10–8 Торр. Источником монохроматического излучения служил анод из алюминия (200 Вт). Положение пика стандартизировано относительно положения C1s пика с энергией 285.0 эВ. Для количественных соотношений использовались коэффициенты чувствительности, указанные в программе обработки спектров VG1000. Состав поверхностного слоя определялся до глубины 10 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для исследования методом ВДЭК были выбраны 4 типа УНТ. При выборе типа УНТ исходили из того, что мягкие условия функционализации в щелочи не вносят существенных изменений в структуру, а на поверхности образуются группы преимущественно одного вида – гидроксильные. Допирование метиламином функционализированных УНТ обеспечивает образование на поверхности кислородсодержащих групп различного типа и азотсодержащие группы, как показано на рис. 1. Последующее модифицирование платиной выполнено полиольным методом, что также позволяет сохранить структуру УНТ.
Рис. 1.
РФЭ-спектры УНТ с различными обработками: О1s на УНТNaOH (а), О1s (б) и N1s на УНТNaOH + N (в).
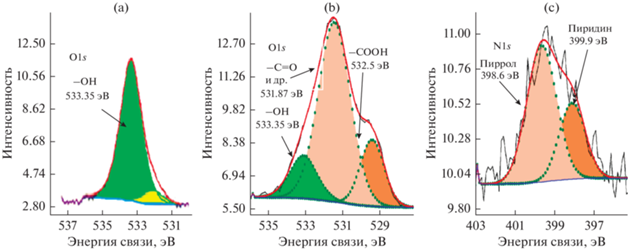
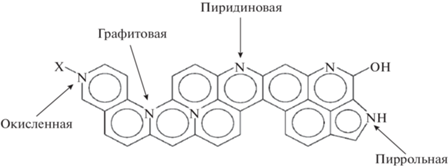
В результате обработки УНТ в NaOH, на них формируются в основном только гидроксильные группы (рис. 1а), что вносит незначительные изменения в распределение заряда на поверхности, поэтому УНТNaOH характеризуются малым значением дзета-потенциала при измерении в водной суспензии (–1.47). Кроме того, УНТNaOH являются гидрофобными, о чем свидетельствует большая разница между удельной площадью поверхности УНТ (табл. 1) и объемом пор (рис. 2), измеренным по октану и по воде. Для этих УНТ отношение величины удельной поверхности (Sуд) по октану к Sуд по воде равняется 3.2. В процессе допирования (600°С) УНТNaOH атомами азота наблюдается образование не только азотсодержащих групп, но и значительное увеличение кислородсодержащих групп различных типов (рис. 1б, табл. 1). При сохранении поверхности, измеренной по октану близкой к поверхности УНТNaOH, их удельная поверхность по воде значительно возрастает (табл. 1, рис. 2). Это обеспечивает более высокую электрохимически активную поверхность (SЭАП) и активность в РВК на УНТNaOH + N (табл. 1). Следует отметить, что функционализация приводит только к незначительному увеличению активности по сравнению с УНТ без обработки. Потенциал полуволны смещается в положительную сторону на 0.03 В (табл. 1). На УНТNaOH + N наблюдается существенное смещение потенциала полуволны в положительную сторону на 0.14 В, при этом величина n достигает 3.2, что указывает на вклад 4-электронного восстановления кислорода на данном материале. Таким образом, азотсодержащие группы на УНТ, наряду с кислородсодержащими, обеспечивают каталитическую активность в отношении прямого восстановления кислорода до воды. Высокая активность в РВК обусловлена присутствием пиридиновых и карбоксильных групп, которые, как показано в [24, 25], наиболее активны по отношению к этой реакции. Типы азотсодержащих групп представлены на рис. 3. Высокая активность азотсодержащих групп обусловлена тем, что азот встраивается в структуру УНТ и значительно изменяет их электронные свойства. Электронодонорная активность УМ после допирования азотом увеличивается [24]. Из числа кислородсодержащих групп только карбоксильные приближаются по своему влиянию на электронную структуру УНТ [26].
Таблица 1.
Структурные и электрохимические характеристики УНТ после различных обработок. Величина n – число переносимых электронов в РВК при 0.5 В и скорости вращения электрода 1500 об/мин
| Катализатор | Элементный состав поверхности, ат. % | Суммарная УПП*, м2/г по C8H18//по H2O | 1/2Q0ц // 1/2Q1000ц, Кл/г | Е1/2, В//ζ-потенциал//n** | iкин, мА/см2//при E, В |
|---|---|---|---|---|---|
| УНТисх | О/0.46 | – | 18.7//18.6 | 0.64 | 0.10//0.75 |
| УНТNaOH | O/2.18 2.2% гидроксильные (основной пик) |
333//49.2 | 21.5//20.7 | 0.67//–1.47//1.7 | 0.12//0.75 |
| УНТNaOH + N | O/10.08 1.9% карбоксильные 6.8% хинонные, карбонильные и др. 1.39% гидроксильные N/1.15 0.77% пиррольные 0.38% пиридиновые |
268//154.2 | 53//49 | 0.81//–14.7//3.2 | 0.70//0.85 |
Рис. 2.
Интегральные кривые распределения удельного объема пор V по эффективному радиусу R (порометрические кривые), полученные при измерении с водой (1, 2) и октаном (1 ', 2 ') на 1, 1 ' – УНТNaOH, 2, 2 ' – УНТNaOH + N.
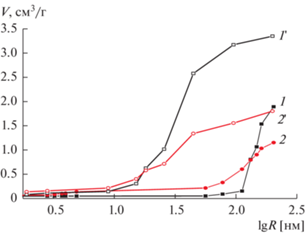
Стабильность, по данным циклирования потенциала, исключительно высокая для двух типов УНТ (табл. 1). Снижение величины поверхности (оценку проводили по величине заряда на ЦВА) не превышает 1% от исходной и несколько выше на УНТNaOH. В этом случае стабильность обеспечена незначительным количеством дефектов в условиях мягкой обработки в щелочи. Образующиеся при допировании азотсодержащие группы (обработка при 600°С), с одной стороны, вызывают образование дефектов при повышенной температуре, а с другой стороны, допирование азотом способствует повышению стабильности и активности, поскольку азот значительно повышает электроотрицательность поверхности УНТ [24]. На электроотрицательной поверхности ОН–-ионы не адсорбируются и не препятствуют адсорбции молекулярного кислорода в ориентации, благоприятной для разрыва О–О-связи и электровосстановления кислорода до воды. Таким образом, допирование азотом способствует повышению активности в РВК, а также коррозионной устойчивости, поскольку адсорбцию ОН-ионов можно рассматривать как стадию, предшествующую коррозии. Можно также отметить, что дзета-потенциал, измеренный в водной суспензии (табл. 1), для УНТNaOH + N смещается в сторону отрицательных значений и составляет –14.7. Для УНТNaOH + N величина удельной поверхности (Sуд) по воде значительно больше, чем для УНТNaOH (рис. 2), что обеспечивает значительную величину электрохимически активной поверхности.
Наблюдаемые различия в величинах дзета-потенциалов, гидрофильно-гидрофобных свойствах и значениях ЭАП обусловлены в значительной степени количеством кислород-содержащих функциональных групп на поверхности модифицированных УНТ. В то время как каталитическая активность в РВК в основном определяется типом функциональных групп азота. Коррозионная устойчивость УНТ, которую оценивали по снижению величины заряда на ЦВА при циклировании потенциала электрода, высокая. Изменение величины поляризационной емкости ЦВА после 1000 циклов не превышает 1% (табл. 1).
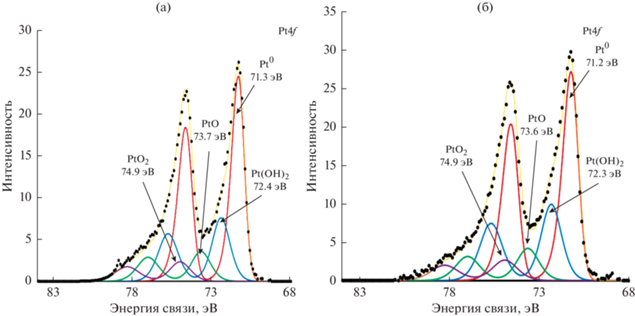
Физико-химические характеристики УНТ, функционализированных в щелочи, допированных азотом и модифицированных платиной. На рис. 4 представлены РФЭ-спектры поверхности катализаторов, содержащих платину, нанесенную на УНТ, подвергнутые различным предобработкам. Как следует из представленных данных при увеличении массового содержания платины, которое в свою очередь зависит от количества активных центров на подложке, атомное содержание платины больше в случае УНТNaOH + N, на которых количество кислород- и азотсодержащих групп больше. Следует отметить, что в случае УНТ, допированных азотом, содержание металлической платины несколько выше, чем в катализаторе, синтезированном на УНТ с незначительным содержанием азота (возможно, следы атмосферного азота) и составляет 1.53 и 1.21 ат. % соответственно. Как будет показано ниже, на ЦВА для катализатора с меньшим содержанием платины наблюдается меньшая величина поверхности платины.
На рис. 5 представлены ЦВА, характеризующие свойства поверхности моноплатиновых катализаторов, нанесенных на два типа нанотрубок. На ЦВА, модифицированных платиной, наблюдаются характерные для Pt максимумы адсорбции и десорбции кислорода и водорода. По водородной области были рассчитаны величины поверхности платины (табл. 2). При расчете принимали удельную величину количества электричества, пошедшую на монослойное заполнение водородом 1 см2 поверхности Pt, равную 0.21 мКл/см2.
Рис. 5.
ЦВА, полученные на катализаторах в 0.1 М KOH. Атмосфера Ar, 100 мВ/с; комнатная температура: а – катализатор Pt/УНТNaOH; б – Pt/УНТNaOH + N.

Таблица 2.
Структурные и электрохимические характеристики двух типов УНТ, модифицированных платиной. Величины n приведены при потенциале 0.5 В и скорости вращения электрода 1500 об/мин
| Содержание Pt мас. %/тип УНТ | Элементный состав поверхности, ат. % | Электрохимические характеристики | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| исходные данные | после 1000 циклов | |||||||||
| Pt4f/Pt0 | O1s | N1s | C1s | SPt, м2/гPt | Е1/2, В//n | i, мА/см2 при 0.9 В |
SPt, м2/гPt | Е1/2, В | i, мА/см2 при 0.9 В |
|
| 13% Pt/УНТNaOH | 2.2/1.2 | 2.8 | 0.3 | 95 | 48.7 | 0.85//3.4 | 1.38 | 31.5 | 0.79 | 0.79 |
| 18% Pt/УНТNaOH + N | 2.8/1.5 | 2.9 | 1.6 | 93 | 57.0 | 0.86//3.7 | 1.50 | 39.6 | 0.83 | 0.97 |
Как следует из полученных данных (табл. 2, рис. 5), на этих катализаторах поляризационная емкость и поверхность платины выше на УНТNaOH + N. В табл. 2 представлены структурные и электрохимические характеристики исследованных систем.
Прежде всего, на УНТNaOH + N закрепляется большее количество платины, поскольку количество активных центров на УНТ, допированных азотом, существенно больше (рис. 1, табл. 1 и 2). Активность этой системы также выше и снижается в меньшей степени при коррозионном тестировании путем циклирования потенциала (табл. 2). Снижение величины поверхности платины можно, вероятно, объяснить изменением размера наночастиц платины в результате растворения наиболее мелких частиц Pt и последующим их осаждении на более крупные частицы [21, 27]. При этом поверхность платины уменьшается, а активность (потенциал полуволны и кинетический ток вблизи стационарного потенциала) снижается (табл. 2).
Как показано, при измерениях методом ВДЭК (рис. 6), в процессе восстановления кислорода на моноплатиновых катализаторах возможно образование пероксида водорода, который образуется на материале носителя (УНТ в нашем случае). Вероятность вклада реакции восстановления кислорода до пероксида водорода обусловлена большой долей поверхности УНТ, свободной от модифицирующих частиц, где эффективное восстановление кислорода наблюдается при потенциалах отрицательнее 0.70 и 0.85 В на УНТNaOH и УНТNaOH + N соответственно. При этом количество образующегося пероксида водорода также больше (рис. 7) на моноплатиновом катализаторе, нанесенном на УНТNaOH.
Рис. 6.
Поляризационные кривые восстановления O2 и соответствующие им кривые окисления ${\text{HO}}_{2}^{ - }$ (Eк = 1.2 В) на а – УНТNaOH, б – УНТNaOH + N, а' – Pt/УНТNaOH, б' – Pt/УНТNaOH + N. Cкорость вращения электрода, об/мин: 1 – 650; 2 – 980; 3 – 1500; 4 – 1900; 5 – 2800 об/мин. 0.1 М KOH, 100 мкг/см2, 5 мВ/с.
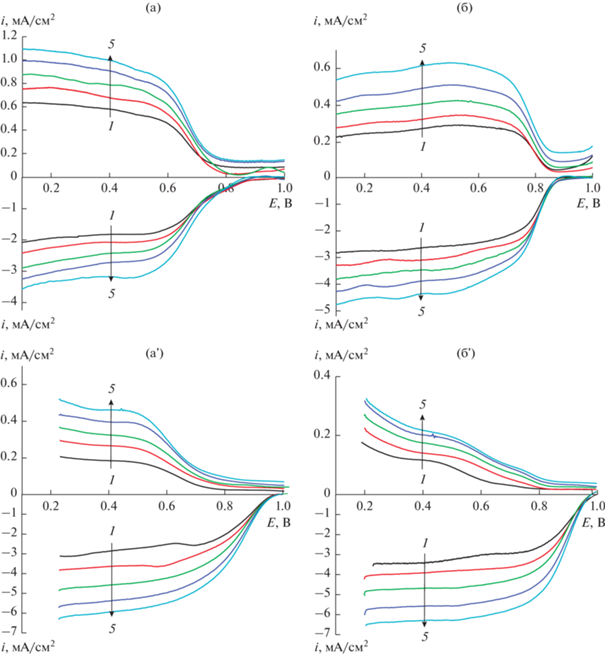
Рис. 7.
Зависимость выхода ${\text{HO}}_{2}^{ - }$ от потенциала электрода на: 1 – УНТNaOH, 2 – УНТNaOH-N, 3 – Pt/УНТNaOH, 4 – Pt/УНТNaOH-N. 0.1 М KOH, 100 мкг/см2.

Наблюдаемый эффект вклада тока восстановления кислорода на носителе (УНТ), имеющем высокую величину поверхности, обусловлен тем, что в условиях эксперимента при достижении определенной величины потенциала молекулярный кислород начинает восстанавливается на поверхности собственно носителя (рис. 6а, 6б), на которой нет частиц платины. На гладких носителях, поверхность которых на порядки меньше, чем УНТ, вклад тока восстановления на носителе будет незначительным, соответственно.
На рис. 6 представлены поляризационные кривые электровосстановления кислорода на дисковом электроде и соответствующие им кривые окисления супероксид-радикала ${\text{НО}}_{2}^{ - }$ на кольцевом электроде. Качественно поляризационные кривые совпадают в широкой области потенциалов. Наиболее существенные различия наблюдаются в отношении количества промежуточного продукта, окисляющегося на кольце. На УНТ двух типов токи окисления на кольцевом электроде выше по сравнению с моноплатиновыми катализаторами (рис. 6, 7). При этом предельные диффузионные токи на дисковом электроде выше на моноплатиновых катализаторах. Наблюдаемые различия обусловлены тем, что на УНТNaOH и УНТNaOH + N реакция в значительной степени протекает с присоединением 2 электронов. В то же время на моноплатиновых катализаторах, нанесенных на эти УНТ, преимущественно протекает прямая РВК до воды. Величина n в этом случае приближается к 4 (табл. 2). Реакция электровосстановления кислорода в щелочной среде протекает, как правило, по 2-электронному пути и может быть записана как:
Определение количества образующегося пероксида водорода на каталитических системах проводили по формуле:
Таким образом, результаты исследований методом ВДЭК показывают вклад носителя в суммарный ток РВК. Чем выше активность дисперсного носителя, тем меньше пероксида водорода образуется в процессе РВК. В свою очередь, образующийся пероксид водорода, вызывает коррозию материала электрода. Полученные данные показывают, что деградация моноплатиновых катализаторов тем больше, чем больше образуется супероксид-радикалов в процессе РВК. Снижение величины поверхности платины и активности в случае 13% Pt/УНТNaOH составляет 35–40%, и, вероятно, значительный вклад в деградацию катализатора вносит образующийся пероксид водорода. Катализатор 18% Pt/УНТNaOH + N в меньшей степени деградирует в процессе циклирования потенциала. Снижение величины поверхности платины и активности в кинетической области составляет 30–35%. Следовательно, необходимо дальнейшее повышение активности носителя за счет целенаправленного синтеза наиболее активных в РВК азот- и кислородсодержащих групп, а также за счет увеличения их количества. Это позволит увеличить долю реакции восстановления кислорода, протекающую непосредственно до воды, без промежуточного образования пероксида водорода.
ЗАКЛЮЧЕНИЕ
Исследован ряд материалов, представляющих интерес в качестве активного слоя электрода для катодов ТЭ со щелочным электролитом. УНТ, допированные кислород- и азотсодержашими группами, активны в РВК, и число переносимых электронов на них достигает 3.2.
Наличие на поверхности УНТ активных центров в виде азот- и кислородсодержащих групп обеспечивает равномерное распределение наноразмерных частиц Pt при их нанесении на поверхность. При этом количество нанесенной Pt может быть изменено в зависимости от необходимого содержания платины в катализаторе за счет увеличения числа кислород- и азотсодержащих групп.
Вклад РВК на носителе в суммарную РВК на каталитической системе зависит от потенциала электрода и определяется величиной активности носителя, которая в свою очередь зависит от природы и количества модифицирующих групп. Чем больше карбоксильных и пиридиновых групп, тем выше активность.
Более детальное выяснение роли кислород- и азотсодержащих групп, а также величины поверхности носителя может быть получено при разработке методов селективного синтеза на поверхности определенного вида групп как кислородсодержащих, так и азотсодержащих на углеродных материалах с различной величиной удельной поверхности. Это является предметом дальнейших исследований.
Список литературы
Tarasevich, M.R., Sadkovski, A., and Yeager, E. Comprehensive Treatise of Electrochemistry. V. 7. Kinetics and Mechanism of Electrode Processes / Eds. Conway, B.E., Bockris, J.O.M., and Yeager, E. N.Y., London: Plenum Press, 1983, p. 301.
Ramaswamy, N. and Mukerjee, S., Fundamental mechanistic understanding of electrocatalysis of oxygen reduction on Pt and non-Pt surfaces: acid versus alkaline media, Adv.Phys.Chem., 2012, p. 1.
Тарасевич, М.Р., Хрущева, Е.И., Филиновский, В.Ю. Вращающийся дисковый электрод с кольцом. М.: Наука,1987. 247 c. [Tarasevich, M.R., Khrustcheva, E.I., and Philinovskii, V.Yu., Rotating ring disk electrode (in Russian), M.: Nauka, 1987. 247 p.]
Ma, R., Gaoxin, Lin, Yao, Zhou, Qian, Liu, Tao, Zhang, Guangcun, Shan, Minghui, Yang, and Jiacheng, Wang, A review of oxygen reduction mechanisms for metal-free carbon-based electrocatalysts, Computational Materials, 2019, vol. 5, p. 78.
Park, J.-W. and Seo, J., Ultrafine TaOx/CB Oxygen reduction Electrocatalysts Operating in Both Acidic and Alkaline Media, Catalysts, 2022, vol. 12(1), no. 35.
Богдановская, В.А., Кольцова, Е.М., Тарасевич, М.Р., Радина, М.В., Жутаева, Г.В., Кузов, А.В., Гаврилова, Н.Н. Активные и стабильные катализаторы для топливных элементов на основе нанотрубок, модифицированных платиной. Электрохимия. 2016. Т. 52. С. 810. [Bogdanovskaya, V.A., Kol’tsova, E.M., Tarasevich, M.R., Radina, M.V., Zhutaeva, G.V., Kuzov, A.V., and Gavrilova, N.N., Highly Active and Stable Catalysts Based on Nanotubes and Modified Platinum for Fuel Cells, Russ. J. Electrochem., 2016, vol. 52, p. 723.]
Тарасевич, М.Р., Корчагин, О.В. Электрокатализ и рН. Электрохимия. 2013. Т. 49. С. 676. [Tarasevich, M.R. and Korchagin, O.V., Electrocatalysis and pH (a review), Russ. J. Electrochem., 2013, vol. 49, p. 600.]
Gasteiger, H.A., Kocha, S.S., Sompalli, B., and Wagner, F.T., Activity Benchmarks and Requirements for Pt, Pt-Alloy, and Non-Pt Oxygen Reduction Catalysts for PEMFCs, Appl. Catal. B: Environmental, 2005, vol. 56, p. 9.
Paulus, U.A., Schmidt, T.J., Gasteiger, H.A., and Behm, R.J., Oxygen reduction on a high-surface area Pt/Vulcan carbon catalyst: a thin-film rotating ring-disk electrode study, J. Electroanal. Chem., 2001, vol. 495, p. 134.
Богдановская, В.А., Тарасевич, М.Р. Электрохимические процессы на многокомпонентных катодных катализаторах PtM и PtM1M2 (M = Co, Ni, Cr): влияние состава поверхности на стабильность катализатора и его активность в восстановлении О2. Электрохимия. 2011. Т. 47. С. 404. [Bogdanov-skaya, V.A. and Tarasevich, M.R., Electrochemical processes on multi-component cathodic catalysts PtM and PtM1M2 (M = Co, Ni, Cr): the effect of surface composition on the catalyst stability and its activity in O2 reduction, Russ. J. Electrochem., 2011, vol. 47, p. 380.]
Khan, M.S., Khattak, R., Khan, A., Chen, Q., Nisar, J., and Iqbal, Z., Synthesis and Characterizations of PdNi Carbon Supported Nanomaterials: Studies of Electrocatalytic Activity for Oxygen Reduction in Alkaline Medium, Molecules, 2021, vol. 26, p. 3440.
Volperts, A., Plavniece, A., Kaare, K., Dobele, G., Zhurinsh, A., and Kruusenberg, I., Influence of Chemical Activation Temperatures on Nitrogen Doped Carbon Material Structure and Pore Distribution Impact on the Oxygen Reduction Reaction, Catalysts, 2021, vol. 11, no. 1460.
Zhang, S. and Chen, Q., Enhanced-electrocatalytic activity of Pt nanoparticles supported on nitrogen-doped carbon for the oxygen reduction reaction, J. Power Sources, 2013, vol. 240, p. 60.
Podyacheva, O.Y. and Ismagilov, Z.R., Nitrogen-doped carbon nanomaterials: To the mechanism of growth, electrical conductivity and application in catalysis, Catal. Today, 2015, vol. 249, p. 12.
Wang, Y., Song, W., Li, M., and Wu, Z., Oxygen Reduction Reaction Mechanisms on Heteroatom-Doped Single Walled Carbon Nanotube Catalysts: Insights from a Theoretical Study, J. Electrochem. Soc., 2019, vol. 166, p. 670.
Sang, Y., Fu, A., Li, H., Jintao, Zhang, Zichao, Li, Hongliang, Li, Zhao, X.S., and Peizhi, Guo, Experimental and theoretical studies on the effect of functional groups on carbon nanotubes to its oxygen reduction reaction activity, Colloids and Surfaces A: Physicochem. Aspects, 2016, vol. 506, p.476.
Rizzi, P.G., Abdirisak, A., Gennaro, A, Brandiele, R., Durante, C., Zerbetto, M., and Vicentini, N., Probing the correlation between Pt-support interaction and oxygen, Electrochim. Acta, 2018, vol. 277, p. 287.
Zhang, J., Yuan, Y., Gao, L., Zeng, G., Li, M., and Huang, H., Stabilizing Pt-Based Electrocatalysts for Oxygen Reduction Reaction: Fundamental Understanding and Design Strategies, Adv. Mater., 2021, vol. 33, no. 2006494.
Bogdanovskaya, V.A., Vernigor, I.E., Radina, M.V., Andreev, V.N., and Korchagin, O.V., Nanocomposite Cathode Catalysts Containing Platinum Deposited on Carbon Nanotubes Modified by O, N, and P Atoms, Catalysts, 2021, vol. 11, article no. 335.
Bogdanovskaya, V., Vernigor, I., Radina, M., Sobolev, V., Andreev, V., and Nikolskaya, N., Modified Carbon Nanotubes: Surface Properties and Activity in Oxygen Reduction Reaction, Catalysts, 2021, vol. 11, article no. 1354.
Богдановская, В.А., Кузов, А.В., Радина, М.В., Филимонов, В.Я., Сударев, Г.М., Осина, М.А. Устойчивость к деградации и активность катализаторов с различным содержанием платины, синтезированных на углеродных нанотрубках. Электрохимия. 2020. Т. 56. С. 1083. [Bogdanovskaya, V.A., Kuzov, A.V., Radina, M.V., Filimonov, V.Ya., Sudarev, G.M., and Osina, M.A., Stability against Degradation and Activity of Catalysts with Different Platinum Load Synthesized at Carbon Nanotubes, Russ. J. Electrochem., 2020, vol. 56, p. 969.]
Volfkovich, Y.M., Sakars, A.V., and Volinsky, A.A., Application of the standard porosimetry method for nanomaterials, International J. Nanotechnology, 2005, vol. 2, p. 292.
Youssry, M., Al-Ruwaidhi, M., and Zakeri, M., Physical functionalization of multi-walled carbon nanotubes for enhanced dispersibility in aqueous medium, Emergent Mater, 2020, vol. 3, p. 25.
Guo, D., Shibuya, R., Akiba, C., Saji, S., Kondo, T., and Nakamura, J., Active sites of nitrogen-doped carbon materials for oxygen reduction reaction clarified using model catalysts, Science, 2016, vol. 351, p. 361.
Stamatin, S.N., Borghei, M., Dhiman, R., Andersena, S.M., Ruiz, V., Kauppinen, E., and Skou, E.M., Activity and stability studies of platinized multi-walled carbon nanotubes as fuel cell electrocatalysts, Appl. Catal. B: Environmental, 2015, vol. 162, p. 289.
Запороцков, П.А. Полупроводящие модифицированные структуры на основе углеродных нанотрубок. Дис. канд. физ.-мат. наук. Волгоград. гос. ун-т. М.: МИСИС, 2016.
Antolini, E., Formation, microstructural characteristics and stability of carbon supported platinum catalysts for low temperature fuel cells, J. Materials Sci., 2003, vol. 38, no. 14, p. 2995.
Дополнительные материалы отсутствуют.