Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 1, стр. 73-75
ВОЗРАСТНАЯ И ТКАНЕВАЯ ОСОБЕННОСТИ ИНДУКЦИИ α,ω-ГЕКСАДЕКАНДИКАРБОНОВОЙ КИСЛОТОЙ КАЛЬЦИЙ-ЗАВИСИМОЙ ПЕРМЕАБИЛИЗАЦИИ МИТОХОНДРИЙ КРЫС
М. В. Дубинин 1, *, К. С. Теньков 1, В. С. Старинец 1, А. Е. Степанова 1, К. Н. Белослудцев 1, В. Н. Самарцев 1
1 Марийский государственный университет
Йошкар-Ола, Россия
* E-mail: dubinin1989@gmail.com
Поступила в редакцию 03.04.2017
После доработки 08.08.2018
Принята к публикации 15.08.2018
Одним из путей метаболизма монокарбоновых жирных кислот у млекопитающих и человека является их ω-окисление, происходящее, главным образом, в клетках печени и почек и приводящее к образованию соответствующих α,ω-дикарбоновых кислот [1]. В нормальных физиологических условиях только 5–10% свободных жирных кислот метаболизируется по пути ω-окисления. Однако этот путь значительно усиливается под влиянием различных ксенобиотиков, при потреблении этанола, а также при различных нарушениях метаболизма свободных монокарбоновых жирных кислот [1].
Ранее нами установлено, что одна из насыщенных длинноцепочечных α,ω-дикарбоновых кислот – α,ω-гексадекандикарбоновая кислота (ГДК) при добавлении к митохондриям печени, предварительно нагруженных Ca2+ или Sr2+, в присутствии циклоспорина А (ЦсА) способна индуцировать высокоамплитудное набухание органелл, выход этих ионов из матрикса и падение ΔΨ [2]. Это рассматривалось как свидетельство индукции ГДК ЦсА-нечувствительной неспецифической пермеабилизации внутренней мембраны митохондрий печени [2]. В опытах на модельных мембранных системах – липосомах показано, что механизм индукции α,ω-дикарбоновыми кислотами Ca2+-зависимой неспецифической проницаемости связан с процессами слияния и/или агрегации мембран [2].
Известно, что липидный и белковый состав митохондриальных мембран, а следовательно, и их физические свойства, зависят от типа ткани и возраста животного [3]. Предполагается, что это может оказывать существенное влияние на процессы образования в мембранах липидных пор. В частности, ранее было показано, что одна из самых распространенных природных жирных кислот – пальмитиновая, наиболее эффективно индуцирует открытие подобного типа Са2+-зависимых пор в митохондриях печени крыс и менее эффективна при добавлении к органеллам, выделенным из сердца [4]. Также установлено, что образование такой поры в митохондриях печени крысы существенно облегчается с увеличением возраста животного [4].
В настоящей работе изучено действие продукта ω-окисления пальмитиновой кислоты – ГДК как индуктора Са2+-зависимой пермеабилизации митохондрий, выделенных из различных тканей лабораторных крыс, а также зависимость эффективности индукции такой пермеабилизации от возраста экспериментальных животных.
Митохондрии из печени, почек и сердец белых крыс-самцов массой 210–250 г выделяли общепринятым методом дифференциального центрифугирования с последующим освобождением от эндогенных жирных кислот с помощью БСА в соответствии с описанной ранее методикой [2]. В отдельных опытах использованы крысы-самцы в возрасте 1, 4, 8 и 18 мес. Среда выделения содержала 250 мМ сахарозы, 1 мМ EGTA (2 мМ для митохондрий сердца), 5 мМ MOPS-Tris, рН 7.4. Одновременно выделялись митохондрии (один препарат митохондрий) из печени одной взрослой крысы или из печени двух месячных крысят. Набухание митохондрий указанных органов регистрировали по изменению оптической плотности суспензии митохондрий (А) при длине волны 540 нм, как подробно описано ранее [2]. Среда инкубации содержала 200 мМ сахарозы, 20 мМ KCl, 20 мкМ ЭГТА, 5 мМ янтарной кислоты, 2 мкМ ротенона, 1 мкМ ЦсА и 10 мМ МОПС-Трис, рН 7.4. Проницаемость внутренней мембраны митохондрий для Ca2+ и тетрафенилфосфония (ТФФ+) определяли с помощью Ca2+- и ТФФ+-селективного электрода соответственно. В этих экспериментах среда инкубации была дополнена 1.6 мкМ ТФФ+.
Как показано ранее [2] и подтверждено в настоящей работе, добавление 20 мкМ ГДК к митохондриям печени половозрелых крыс-самцов, инкубируемых в сахарозной среде, в присутствии 50 мкМ Ca2+ и 1 мкМ ЦсА приводит к высокоамплитудному набуханию органелл при формировании неспецифической ЦсА-нечувствительной проницаемости внутренней мембраны (рис. 1). Набухание органелл сопровождается падением мембранного потенциала органелл и выходом ионов кальция из матрикса (не показано). Подобная картина наблюдается и в случае добавления хлорида кальция и ГДК к митохондриям, выделенным из почек и сердца (рис. 1). Как видно на рисунке, скорость набухания митохондрий сердца ниже по сравнению с таковой митохондрий почек и печени крыс.
Рис. 1.
Влияние ионов кальция и ГДК на кинетику ЦсА-нечувствительного изменения оптической плотности суспензии митохондрий печени (а), почек (б) и сердца (в) крыс. Условия эксперимента и состав среды инкубации приведены в тексте. V – скорость ГДК/Са2+-индуцированного набухания митохондрий (ΔА/мин на 1 мг белка), приведены средние значения ± ± стандартная ошибка среднего (n = 4). Концентрация митохондриального белка в ячейке – 0.8 мг/мл. Добавки: 50 мкМ хлорида кальция (Са2+), 20 мкМ ГДК. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. Аналогичные результаты были получены еще в четырех независимых экспериментах.
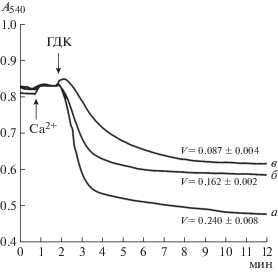
Полученные результаты свидетельствуют о том, что митохондрии сердца проявляют большую резистентность к ГДК как индуктору Са2+-зависимой пермеабилизации, чем митохондрии печени и почек крыс. Это может быть обусловлено разным как липидным, так и белковым составом митохондриальных мембран этих тканей. В частности, в митохондриях печени и почек крыс, по сравнению с митохондриями сердца, увеличено соотношение кардиолипина к общим фосфолипидам [3], который, как известно, способствует образованию подобного типа липидных пор в мембране [4]. Кроме того, различия в амплитуде набухания митохондрий сердца, почек и печени, по литературным данным, могут быть обусловлены существенно большим содержанием АТФ:креатин-N-фосфотрансферазы (КФ 2.7.3.2) – белка, участвующего в формировании контактных сайтов между митохондриальными мембранами, в митохондриях сердца и почек по сравнению с митохондриями печени [5].
В настоящей работе также были изучены параметры индукции ГДК/Са2+-активируемой пермеабилизации внутренней мембраны в митохондриях, выделенных из печени крыс 4 возрастных групп: 1, 4, 8 и 18 мес. Известно, что с возрастом в митохондриях снижается мембранный потенциал, активность электрон-транспортной цепи в целом и ее отдельных комплексов, меняются состав и свойства митохондриальных мембран [3, 6].
В таблице 1 приведены значения скоростей ЦсА-нечувствительного Са2+-зависимого набухания митохондрий печени крыс разного возраста, индуцированного ГДК в концентрации 5, 10, 20 и 40 мкМ. Видно, что митохондрии печени молодых неполовозрелых крыс в возрасте 1 и 4 мес. проявляют значительно большую резистентность к ГДК как индуктору Са2+-зависимой пермеабилизации по сравнению с митохондриями печени половозрелых особей возрастом 8 мес. и старых крыс возрастом 18 мес. В то же время для индукции пермеабилизации в митохондриях печени старых крыс необходима меньшая концентрация ГДК. Полученные данные указывают на существенное снижение резистентности митохондрий к действию ГДК как к индуктору такой пермеабилизаии с возрастом. Можно предположить, что это может быть связано со структурно-функциональными изменениями, облегчающими пермеабилизацию мембран, в частности, с развитием окислительного стресса. Одним из путей моделирования in vitro окислительного стресса в изолированных митохондриях является их инкубация с различными окисляющими агентами, в частности, с трет-бутилгидропероксидом (ТБГ) [7]. Как известно, инкубация митохондрий с ТБГ приводит к окислению пиридиновых нуклеотидов и глутатиона и сопровождается образованием метильного и других свободных радикалов, а также повышением уровня продуктов перекисного окисления липидов – диеновых конъюгатов [7]. В настоящей работе мы применяли ТБГ в концентрации 200 мкМ, известно, что в концентрации этот агент не оказывает влияния на дыхание и окислительный синтез АТФ [7]. Установлено, что предварительная инкубация митохондрий печени крыс возрастом 4 мес. c 200 мкМ ТБГ приводит к увеличению скорости набухания митохондрий, индуцированного 50 мкМ Са2+ и 5 мкМ ГДК, с 0.092 ± 0.006 до 0.131 ± 0.004 ΔА/мин на 1 мг белка (n = 3). Таким образом, окислительный стресс, индуцированный ТБГ, оказывает слабое влияние на индукцию митохондриальной ГДК/Са2+-зависимой пермеабилизации. Можно предположить, что снижение резистентности митохондрий к действию ГДК как индуктору Са2+-зависимой пермеабилизации с возрастом обусловлено и другими факторами, в частности, с увеличением содержания холестерина и свободных жирных кислот в митохондриальных мембранах с возрастом [3], которые, как считается, облегчают индукцию липидных пор [4].
Таблица 1.
Сравнение скоростей ЦсА-нечувствительного набухания митохондрий (МХ) печени крыс в возрасте 1, 4, 8 и 18 мес., индуцированного 50 мкМ Са2+ и различными концентрациями ГДК
| Скорость набухания митохондрий (ΔА/мин на 1 мг белка) | ||||
|---|---|---|---|---|
| 5 мкМ ГДК | 10 мкМ ГДК | 20 мкМ ГДК | 40 мкМ ГДК | |
| МХ печени крысы 1 мес. | 0.099 ± 0.001* | 0.185 ± 0.001 | 0.238 ± 0.001* | 0.282 ± 0.006* |
| МХ печени крысы 4 мес. | 0.139 ± 0.005* | 0.194 ± 0.003 | 0.263 ± 0.001 | 0.307 ± 0.001* |
| МХ печени крысы 8 мес. | 0.169 ± 0.004 | 0.181 ± 0.024 | 0.281 ± 0.016 | 0.417 ± 0.003 |
| МХ печени крысы 18 мес. | 0.171 ± 0.006 | 0.237 ± 0.020* | 0.373 ± 0.015* | 0.482 ± 0.021* |
Примечание. * Выявлены статистически значимые различия между скоростями ГДК/Са2+-индуцированного набухания митохондрий печени половозрелых крыс возрастом 8 мес. и указанных групп животных, p < 0.05 (критерий Стьюдента). Условия опыта и состав среды инкубации описаны в тексте. Приведены средние значения ± стандартная ошибка среднего (n = 4).
Список литературы
Wanders R.J., Komen J., Kemp S. Fatty acid ω-oxidation as a rescue pathway for fatty acid oxidation disorders in humans // FEBS J. 2011. V. 278. P. 182–194.
Dubinin M.V., Samartsev V.N., Astashev M.E., Kazakov A.S., Belosludtsev K.N. A permeability transition in liver mitochondria and liposomes induced by α,ω‑dioic acids and Ca2+ // Eur. Biophys. J. 2014. V. 43. P. 565–572.
Daum G. Lipids of mitochondria // Biochem. Biophys. Acta. 1985. V. 822. P. 1–42.
Belosludtsev K.N., Saris N.E., Belosludtseva N.V., Trudovishnikov A.S., Lukyanova L.D., Mironova G.D. Physiological aspects of the mitochondrial cyclosporin A-insensitive palmitate/Ca2+-induced pore: tissue specificity, age profile and dependence on the animal’s adaptation to hypoxia // J. Bioenerg. Biomembr. 2009. V. 41. P. 395–401.
Brdiczka D.G., Zorov D.B., Sheu S. Mitochondrial contact sites: their role in energy metabolism and apoptosis // Biochem. Biophys. Acta. 2006. V. 1762. P. 148–163.
Hagen T.M., Yowe D.L., Bartholomew J.C., Wehr C.M., Do K.L., Park J.Y., Ames B.N. Mitochondrial decay in hepatocytes from old rats: membrane potential declines, heterogeneity and oxidants increase // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 3064–3069.
Кожина О.В., Самарцев В.Н. Разобщающая активность жирных кислот в митохондриях печени в присутствии субстратов ADP/ATP- и аспартат/глутаматного антипортеров усиливается при окислительном стрессе // Биол. мембраны. 2010. Т. 27. С. 184–188.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


