Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 138-144
ОСОБЕННОСТИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ АСТРОЦИТОВ СУБГРАНУЛЯРНОЙ ЗОНЫ ЗУБЧАТОЙ ФАСЦИИ ГИППОКАМПА КРОЛИКА
Е. Г. Сухорукова 1, О. В. Кирик 1, Д. А. Суфиева 1, О. С. Алексеева 1, 2, *, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: osa72@inbox.ru
Поступила в редакцию 19.07.2018
После доработки 05.10.2018
Принята к публикации 04.02.2019
Аннотация
В субгранулярной зоне (SGZ) гиппокампа млекопитающих в течение всей жизни идут процессы нейрогенеза. Предполагается, что астроциты этой специализированной пролиферативной зоны обладают свойствами прогениторных клеток. Структурные особенности этих клеток и межвидовые различия SGZ остаются малоизученными. Знания же о структурной организации астроцитов этой области мозга у кролика, представителя отряда Lagomorpha (Зайцеобразные) надотряда Glires (Грызунообразные), широко используемого при проведении экспериментальных медико-биологических исследований, отсутствуют. Цель настоящего исследования состояла в изучении структурной и цитохимической организации астроцитов субгранулярной зоны зубчатой фасции гиппокампа кролика с использованием методов конфокальной лазерной микроскопии. Материалом для исследования служил головной мозг половозрелых кроликов породы Шиншилла, в качестве объекта сравнения использовали головной мозг половозрелых крыс линии Вистар. Проведенные нами исследования позволили идентифицировать в SGZ у кролика 2 морфотипа клеток: 1) клетки, сходные с радиальными глиоцитами; 2) клетки, напоминающие атипичные фиброзные астроциты. В отличие от кролика, у крысы в SGZ преобладают астроциты второго морфотипа, лишенные длинных неветвящихся отростков, пронизывающих гранулярный слой и достигающих молекулярного слоя. Характерной чертой астроцитов SGZ как у кролика, так и у крысы является интенсивная иммуногистохимическая реакция на глутаминсинтетазу, прежде всего в отростках, формирующих периваскулярную глиальную пограничную мембрану. Следует подчеркнуть, что особенности организации астроцитов зубчатой фасции гиппокампа кролика позволяют определить границы SGZ, тогда как у крысы астроциты SGZ не имеют локальных морфологических особенностей. Это свидетельствует о более сложной организации нейрогенной зоны гиппокампа зайцеобразных, в отличие от аналогичной зоны у грызунов.
ВВЕДЕНИЕ
Гиппокамп является основной структурой головного мозга, обеспечивающей реализацию механизмов памяти, поведенческих реакций, в том числе избегания стрессовых воздействий. Гиппокамп выполняет функцию отбора и фиксации эмоционально значимых событий [1–3]. Наряду с этим известно, что гиппокамп – особая область головного мозга, где в субгранулярной зоне (SGZ), расположенной по внутренней границе гранулярного слоя, в течение всей жизни животного продолжается пролиферация клеток и дифференцировка новых нейронов и глиоцитов из стволовых и полустволовых предшественников [4]. При этом клетки-предшественники располагаются в данной области не хаотично, а локализуются в определенной биологической нише – особом микроокружении, которое позволяет им поддерживать идентичность, регулирует их пролиферацию и определяет направление дифференцировки [5, 6]. Разнообразные функции, а также структурный и молекулярный полиморфизм астроцитов, позволили некоторым ученым [7, 8] сделать предположение, согласно которому в пренатальном, а затем и в постнатальном онтогенезе именно астроциты в пролиферативных зонах могут обладать свойствами стволовых/прогениторных клеток и способны участвовать в воспроизведении популяций нейронов и глиоцитов.
Структурная организация и функциональная активность нейронов гиппокампа активно изучаются с использованием лабораторных животных. Наиболее изученной эта структура является у представителей надотряда Glires (Грызунообразные), причем основное внимание уделяется, прежде всего, отряду Rodentia (Грызуны) как наиболее распространенным в научной практике лабораторным животным. К ним относятся мышь и крыса [9–11]. При этом знания о структуре и функциональных особенностях астроцитов гиппокампа кролика – представителя отряда Lagomorpha (Зайцеобразные) надотряда Glires (Грызунообразные), широко используемого при проведении экспериментальных медико-биологических исследований [12–14] – остаются фрагментарными. В отношении же трехмерной организации астроцитов субгранулярной зоны гиппокампа кролика сведения отсутствуют. В связи с этим цель настоящего исследования состояла в изучении структурной и цитохимической организации астроцитов субгранулярной зоны зубчатой фасции гиппокампа кролика.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали головной мозг половозрелых кроликов породы Шиншилла (Chinchilla) (n = 10). При содержании и умерщвлении животных руководствовались “Правилами проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.), Хельсинкской декларацией 1975 г. и ее пересмотренным вариантом 2000 г. Материал фиксировали в цинк-этанол-формальдегиде, который обеспечивает высокую сохранность антигенов, необходимую для получения оптимальных результатов при постановке иммуноцитохимических реакций [15]. Фиксированный материал обезвоживали и заливали в парафин по общепринятой методике. Из парафиновых блоков готовили фронтальные срезы толщиной 5 и 10 мкм на ротационном микротоме Leica RM2125RT (Leica, Германия).
Для изучения клеточного состава SGZ гиппокампа использовали два маркера астроцитов: глиальный фибриллярный кислый белок (GFAP) и глутаминсинтетазу (GS). GFAP – белок промежуточных филаментов астроцитов, который позволяет визуализировать тела и многочисленные отростки этих клеток [16]. Кроме того, этот белок принято считать также маркером нейральных стволовых клеток [17]. Другим используемым в работе маркером астроцитов является фермент, присутствующий в этих клетках – глутаминсинтетаза, катализирующий превращение глутамата в глутамин. Третий маркер, используемый в исследовании, – виментин – один из белков промежуточных филаментов незрелых астроцитов и радиальных глиоцитов.
Для иммуноцитохимического выявления GFAP были использованы мышиные моноклональные антитела (клон SPM510, разведение 1:100, SpringBioscience, США), виментина – мышиные моноклональные антитела (клон V9, разведение 1:100, Dako, Дания), GS – мышиные моноклональные антитела (клон GS-6, разведение 1:400, Chemicon, США). Для выявления первичных антител для световой микроскопии использовали набор MACH2 Mouse HRP Polymer (MHRP520 G, H,L) (Biocare medical, США). Перед постановкой реакции проводили тепловое демаскирование антигена в модифицированном цитратном буфере (S1700, Dako, Дания) в течение 25 мин. Пероксидазную метку выявляли с использованием диаминобензидинового хромогена (DAB+; Dako, Дания). Часть срезов подкрашивали квасцовым гематоксилином. Для конфокальной лазерной микроскопии в качестве вторичных антител был использован биотинилированный антимышиный Fab-фрагмент иммуноглобулинов осла (Jackson ImmunoResearch, США; разведение 1:100) и стрептавидин, коньюгированный с флуорохромом Cy2 (Jackson ImmunoResearch, США; разведение 1:50), максимум флуоресценции которого (λem = 506 нм) соответствует зеленой части видимого спектра. Ядра клеток подкрашивали 7-аминоактиномицином D (7-AAD), максимум флуоресценции которого (λem = 647 нм) соответствует красной части видимого спектра. Анализ препаратов для микроскопии в проходящем свете и фотосъемку выполняли, используя микроскоп Leica DM750 и цифровую фотокамеру ICC50 (Leica, Германия). Препараты, подготовленные для флуоресцентного исследования, изучали с использованием конфокального лазерного микроскопа LSM-710 (Zeiss, Германия). Для возбуждения флуоресценции Су2 и 7-AAD использовали аргоновый лазер с длиной волны 488 нм и твердотельный лазер с длиной волны 561 нм соответственно. Обработку полученных изображений и трехмерную реконструкцию проводили с использованием компьютерной программы Zen-2011 (Zeiss, Германия). Измерения изучаемых объектов (n = 3) проводились с использованием трехмерных реконструкций по 5 полям зрения, количество оптических срезов составило 48–50, величина z-серии 9.5–10 мкм в компьютерной программе LSM Image Browser (Zeiss, Германия).
РЕЗУЛЬТАТЫ
Проведение иммуноцитохимических реакций с антителами к различным белкам промежуточных филаментов на последовательных срезах головного мозга кролика показало, что ведущей клеточной популяцией SGZ являются GFAP-иммунопозитивные (GFAP+) и GS-иммунопозитивные (GS+) отростчатые клетки. Виментин содержат клетки эндотелия части кровеносных сосудов головного мозга, тогда как в астроцитах гиппокампа виментин отсутствует.
GFAP+ клетки SGZ имеют сложную форму, восстановить которую не удается по препаратам, окрашенным с помощью иммунопероксидазного метода. При проведении конфокальной лазерной микроскопии было отмечено, что эти клетки отличаются высокой интенсивностью реакции на GFAP (рис. 1) и не дают положительную реакцию на виментин. Трехмерная реконструкция GFAP+ клеток SGZ показывает, что они принадлежат к двум различным морфотипам. Непосредственно под гранулярным слоем расположен первый тип GFAP+ клеток, которые образуют один ряд клеток, не плотно прилегающих друг другу. Эти клетки имеют вытянутое тело ромбовидной формы и формируют два типа отростков, отходящих преимущественно от полюсов тела клетки. От апикального конца тел этих клеток под прямым углом отходит единичный длинный (70–80 мкм) толстый (1.8–2.2 мкм) радиальный отросток, идущий через толщу гранулярного слоя в молекулярный слой (см. рис. 1). Ближе к границе гранулярного слоя с молекулярным слоем этот отросток слабо ветвится. От базального конца и боковых поверхностей тела этих астроцитов отходят многочисленные, более тонкие (0.7–1 мкм), мало ветвящиеся, волнистые (максимальная амплитуда волны до 3 мкм) отростки, посредством которых эти клетки контактируют между собой и со вторым типом GFAP+ клеток, расположенных в более глубоких участках SGZ и формирующих крупноячеистую сеть. Тела второго типа клеток имеют типичную звездчатую форму и длинные, довольно толстые (1.3–1.5 мкм), мало ветвящиеся, расходящиеся отростки. От толстых отростков астроцитов второго типа отходят тонкие (0.5–0.9 мкм), длинные, практически неветвящиеся отростки, формирующие в еще более глубоких участках SGZ вторую, мелкоячеистую густую сеть. Через эту сеть проходят неветвящиеся тонкие отростки и редкие, более крупные отростки, направляющиеся далее в хилус (см. рис. 1). В хилусе преимущественно располагаются многочисленные тонкие отростки астроцитов, тела которых встречаются в поле зрения крайне редко из-за их малочисленности (рис. 2а).
Рис. 1.
Трехмерная реконструкция участка зубчатой фасции гиппокампа кролика. SGZ – субгранулярная зона, GZ – гранулярная зона, Hilus – хилус. Стрелками указаны радиальные астроциты первого морфотипа (б). Иммуноцитохимическая окраска на GFAP. Визуализация с помощью флуорохрома Cy2. Ядра окрашены красителем 7 AAD. Конфокальная лазерная микроскопия. Объектив – LD C-Apochromat 40×/1.1 W Korr M27 zoom 1.0 (а), zoom 2.0 (б). Величина Z-серии – 9.6 мкм, количество оптических срезов – 49. Съемка и реконструкция осуществлены в программном модуле ZEN 2011 (Zeiss, Германия). Цена деления 50 мкм (а), 10 мкм (б).
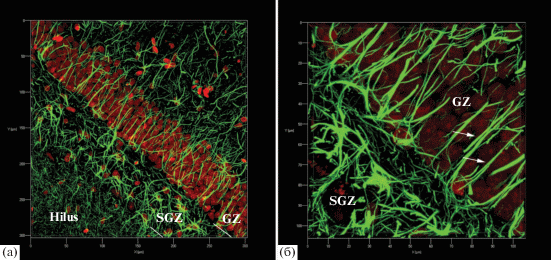
Рис. 2.
Участок зубчатой фасции гиппокампа кролика (а) и крысы (б). SGZ – субгранулярная зона, GZ – гранулярная зона, ML – молекулярный слой, Hilus – хилус. Стрелками указаны радиальные астроциты первого морфотипа (б). Иммуноцитохимическая окраска на GFAP. Визуализация с помощью флуорохрома Cy2. Конфокальная лазерная микроскопия. Объектив – Plan-Apochromat 20×/0.8 M27. Отдельный оптический срез. Съемка осуществлена в программном модуле ZEN 2011 (Zeiss, Германия). Масштабный отрезок равен 50 мкм

У крыс в SGZ астроциты, имеющие характерные структурные признаки радиальных астроцитов первого морфотипа, встречаются редко (рис. 2б). Большинство же астроцитов имеют неправильную звездчатую форму и два типа отростков. Преобладающими являются толстые (3–4 мкм) длинные (около 40 мкм) почти неветвящиеся или слабо ветвящиеся сразу после отхождения от тела клетки отростки; реже наблюдаются более короткие (около 20 мкм) тонкие (0.5–1 мкм) маловетвящиеся отростки. Однако точно измерить длину отростков на всем протяжении по трехмерным реконструкциям (z-серии 10 мкм) не представляется возможным, поскольку они имеют извилистый ход. При этом астроциты этого морфотипа располагаются как в SGZ, так и в зоне хилуса. Структурных особенностей у астроцитов SGZ, отличающих их от астроцитов хилуса и молекулярного слоя зубчатой фасции, при проведении пространственных реконструкций выявить не удалось.
При иммуноцитохимической реакции на глутаминсинтетазу в гиппокампе кролика было отмечено, что в SGZ реакция на GS была интенсивнее, чем в хилусе. Непосредственно под слоем зернистых нейронов располагались GS+ клетки, отростки которых, за исключением тех, что радиально следуют в зернистый слой, не прослеживались. В SGZ и подлежащей области хилуса встречались единичные клетки с интенсивной реакцией цитоплазмы на GS, проследить отростки которых не представлялось возможным. Интенсивная реакция на GS наблюдалась в отростках астроцитов, формирующих периваскулярную глиальную пограничную мембрану сосудов SGZ.
У крысы в субгранулярной зоне гиппокампа, как и у кролика, отмечается повышенная иммунореактивность к GS. Встречаются много округлых клеток без отростков с интенсивной GS+ цитоплазматической реакцией и редкие клетки звездчатой формы с плохо прослеживаемыми отростками. Интенсивная реакция на GS наблюдалось, как и у кролика, в отростках астроцитов, формирующих периваскулярную глиальную пограничную мембрану сосудов SGZ.
ОБСУЖДЕНИЕ
Структурная организация и позитивная реакция на белки-маркеры астроцитарной глии клеток субгранулярной зоны зубчатой фасции гиппокампа свидетельствуют в пользу того, что эти клетки действительно являются астроцитами [18]. Что касается принадлежности этих клеток к двум традиционно выделяемым субпопуляциям астроцитов, то их пространственная реконструкция (рис. 1) показывает, что по формальным признакам они не могут рассматриваться ни в качестве протоплазматических астроцитов, ни в качестве типичных волокнистых астроцитов [19]. Морфологические особенности выявленных глиальных клеток первого морфотипа напоминают описанные в литературе униполярные астроцитарные предшественники (радиальные глиоциты), которые представляют собой нейральные стволовые клетки [20], клетки же второго морфотипа напоминают атипичные фиброзные астроциты [19].
Сравнение полученных данных со сведениями о структурной организации радиальных астроцитов у мышей показывает, что существуют видовые различия в организации этих клеток. У мышей длинный радиальный отросток проходит через гранулярный слой и обильно ветвится в молекулярном слое [4], тогда как и у кролика, и у крысы радиальные отростки астроцитов в молекулярном слое ветвятся слабо, преимущественно на два или три более тонких отростка.
Поскольку в SGZ происходит генерация новых клеток [21, 22], то именно эта важная функция определяет своеобразие глиальной организации данной области гиппокампа. Полученные реконструкции свидетельствуют о том, что астроглиальный каркас гиппокампа также имеет четкие межвидовые различия. Особенности организации астроцитов зубчатой фасции гиппокампа кролика позволяют определить границы SGZ, тогда как у крысы (равно как и у мышей [23]) астроциты SGZ не имеют морфологических особенностей.
У кролика в SGZ гиппокампа располагаются астроциты с отростками, более толстыми, чем в хилусе. Такие специализированные атипичные волокнистые астроциты были отмечены нами ранее в субвентрикулярной зоне боковых желудочков крысы [10]. У крысы, в отличие от кролика, астроглиальный каркас SGZ и хилуса образован однотипными астроцитами. Более того, радиальные астроциты имеют нечеткую морфологию.
Известно, что развивающиеся в нейрогенных зонах клетки-предшественники и их потомки находятся в тесном контакте с целым рядом других клеточных элементов: эндотелиальными клетками капилляров, астроцитами, олигодендроцитами, NG-2 глиоцитами, соседними зрелыми нейронами, активно влияющими на процессы нейрогенеза посредством выделения сигнальных молекул (транскрипционные факторы, ростовые факторы, молекулы межклеточного матрикса) [6]. Особое место среди сигнальных молекул занимают нейромедиаторы. Молекулы нейромедиаторов оказывают существенное влияние на развитие клеток в течение эмбриогенеза, а также в ходе постэмбрионального нейрогенеза [24, 25]. В частности, в мозге взрослых млекопитающих такой медиатор, как глутамат регулирует процессы постэмбрионального нейрогенеза [26]. Показано, что воздействие глутамата, реализующееся через ионотропные рецепторы, подавляет пролиферацию недифференцированных нейральных предшественников. При этом активация метаботропных глутаматных рецепторов ускоряет дифференцировку прогениторов в сторону астроглии.
Глутамат может быть инактивирован при помощи глутаминсинтетазы, экспрессируемой астроцитами [27]. При проведении иммуногистохимического исследования нами было показано, что во всех исследованных препаратах у кролика и крысы в SGZ присутствовала выраженная реакция на глутаминсинтетазу. Это указывает на то, что в SGZ происходят интенсивные процессы, связанные с инактивацией глутамата и синтезом глутамина у обоих видов лабораторных животных.
Таким образом, астроциты субгранулярной пролиферативной зоны мозга кролика характеризуются особыми морфологическими признаками, к которым могут быть отнесены характерная форма клеток, наличие протяженных маловетвящихся отростков, образующих широкопетлистую сеть в субгранулярном слое и неветвящихся отростков, пронизывающих гранулярный слой зубчатой фасции. Эти астроциты у кролика отличаются от астроцитов подлежащей области хилуса, что не характерно для астроцитов гиппокампа крысы аналогичной локализации, не обладающих выраженным полиморфизмом. На основании полученных данных можно сделать вывод о том, что нейрогенная зона гиппокампа у представителей зайцеобразных более сложно организована в сравнении с аналогичной областью гиппокампа грызунов. Причины этих различий не ясны, но можно предположить, что в их основе лежит разница в условиях обитания, кормовой базе, ориентированности активности животных на день/ночь. Полученные в настоящем исследовании сведения являются первыми данными о пространственной организации астроцитов субгранулярной зоны гиппокампа кролика и могут быть использованы при проведении сравнительных нейробиологических исследований.
Список литературы
McEwen B.S. Plasticity of the hippocampus: adaptation to chronic stress and allostatic load // Ann. N. Y. Acad. Sci. 2001. V. 933. P. 265–277.
Clark R.E., Broadbent N.J., Larry R. Squire Hippocampus and Remote Spatial Memory in Rats // Hippocampus. 2005. V. 15. № 2. P. 260–272.
Bartsch T., Döhring J., Rohr A., Jansen O., Deuschl G. CA1 neurons in the human hippocampus are critical for autobiographical memory, mental time travel, and autonoetic consciousness // Proc. Natl. Acad. Sci. U.S.A. 2011. V. 108. № 42. P. 17562–17567.
Encinas J.M., Sierra A., Valcárcel-Martín R., Martín-Suárez S. A developmental perspective on adult hippocampal neurogenesis // Int. J. Dev. Neurosci. 2013. V. 31. № 7. P. 640–645.
Александрова М.А., Марей М.В. Стволовые клетки в мозгу млекопитающих и человека: фундаментальные и прикладные аспекты // Ж. высш. нервн. деят. им. И.П. Павлова. 2015. Т. 65. № 3. С. 1–35.
Gage F.H. Neurogenesis in the adult brain // J. Neurosci. 2002. V. 22. № 3. P. 612–613.
Steinler D.A., Laywell E.D. Astrocytes as stem cells: nomenclature, phenotype, and translation // Glia. 2003. V. 43. № 1. P. 62–69.
Kriegstein A., Alvarez-Buylla A. The glial nature of embryonic and adult neural stem cells // Annu. Rev. Neurosci. 2009. V. 32. P. 149–184.
Чавушян В.А., Меликсетян И.Б., Саркисян Д.С., Степанян А.Ю., Аветисян З.А., Симонян К.В., Даниелян М.А., Каменецкий В.С. Электрофизиологическое и морфогистохимическое исследование воздействия адреналэктомии на нейроны гиппокампа // Ж. эвол. биохим. и физиол. 2013. Т. 49. № 2. С. 153–161.
Коржевский Д.Э., Сухорукова Е.Г., Кирик О.В., Алексеева О.С. Астроциты субвентрикулярной зоны конечного мозга // Морфология. 2011. Т. 139. № 3. С. 77–79.
Хожай Л.И., Отеллин В.А. Распределение GAD-67-экспрессирующих нейронов и морфологические изменения в структурах гиппокампа в пубертатный период после острой перинатальной гипоксии у крыс // Ж. эвол. биохим. и физиол. 2017. Т. 53. № 6. С. 448–452.
Oikonomidis N., Kavantzas N., Korou L.M., Konstantopoulos P., Pergialiotis V., Misiakos E., Rizos I., Verikokos C., Perrea D.N. Pre-treatment with simvastatin prevents the induction of diet-induced atherosclerosis in a rabbit model // Biomed. Rep. 2016. V. 5. № 6. P. 667–674.
Yershov A.L., Jordan B.S., Guymon C.H., Dubick M.A. Relationship between the inoculum dose of Streptococcus pneumoniae and pneumonia onset in a rabbit model // Eur. Respir. J. 2005. V. 25. № 4. P. 693–700.
Ионичева Л.В., Смирнов Л.Д., Кустикова И.Н., Микуляк Н.И., Зиновьев А.И. Антиоксидантная коррекция пострадиационных нарушений кроветворения и клеточного состава крови в эксперименте у кроликов // Вестн. новых мед. технол. 2008. Т. 15. № 1. С. 8–11.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Gri-gorev I.P. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde // Europ. J. Histochem. 2015. V. 59. № 3. P. 2530.
Сухорукова Е.Г., Коржевский Д.Э., Алексеева О.С. Глиальный фибриллярный кислый белок – компонент промежуточных филаментов астроцитов мозга позвоночных // Ж. эвол. биохим. и физиол. 2015. Т. 51. № 1. С. 3–9.
Doetsch F., Caillé I., Lim D.A., García-Verdugo J.M., Alvarez-Buylla A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain // Cell. 1999. V. 97. № 6. P. 703–716.
Сухорукова Е.Г., Алексеева О.С., Кирик О.В., Грудинина Н.А., Коржевский Д.Э. Сравнительные аспекты структурной организации астроцитов первого слоя коры головного мозга человека и крысы // Ж. эвол. биохим. и физиол. 2012. Т. 48. № 3. С. 280–286.
Verkhratsky A., Zorec R., Rodriguez J.J., Parpura V. Pathobiology of neurodegeneration: the role for astroglia // Opera Med. Physiol. 2016. № 1. P. 13–22.
Barry D.S., Pakan J.M., McDermott K.W. Radial glial cells: key organisers in CNS development // Int. J. Biochem. Cell Biol. 2014. V. 46. P. 76–79.
Ярыгин К.Н., Ярыгин В.Н. Нейрогенез в центральной нервной системе и перспективы регенеративной неврологии // Журн. неврол. психиатр. им. С.С. Корсакова. 2012. № 1. С. 1–13.
Cameron H.A., McKay R.D. Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus // J. Comp. Neurol. 2001. V. 435. № 4. P. 406–417.
Amador-Arjona A., Elliott J., Miller A., Ginbey A., Pazour G.J., Enikolopov G., Roberts A.J., Terskikh A.V. Primary cilia regulate proliferation of amplifying progenitors in adult hippocampus: implications for learning and memory // J. Neurosci. 2011. V. 31. № 27. P. 9933–9944.
Coulthard L.G., Hawksworth O.A., Li R., Balachandran A., Lee J.D., Sepehrband F., Kurniawan N., Jeanes A., Simmons D.G., Wolvetang E., Woodruff T.M. Complement C5aR1 Signaling Promotes Polarization and Proliferation of Embryonic Neural Progenitor Cells through PKCζ // J. Neurosci. 2017. V. 37. № 22. P. 5395–5407.
Chen J.J., Wang T., An C.D., Jiang C.Y., Zhao J., Li S. Brain-derived neurotrophic factor: a mediator of inflammation-associated neurogenesis in Alzheimer’s disease // Rev. Neurosci. 2016. V. 27. № 8. P. 793–811.
Nakamichi N., Takarada T., Yoneda Y. Neurogenesis mediated by gamma-aminobutyric acid and glutamatesignaling // J. Pharmacol. Sci. 2009. V. 110. № 2. P. 133–149.
Anlauf E., Derouiche A. Glutamine Synthetase as an Astrocytic Marker: Its Cell Type and Vesicle Localization // Front Endocrinol. 2013. V. 4. P. 1–5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


