Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 2, стр. 145-147
ВСАСЫВАНИЕ ГЛЮКОЗЫ В ТОНКОЙ КИШКЕ КРЫС ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ДИАБЕТЕ ТИПА 2
Л. В. Громова 1, *, А. С. Полозов 1, 2, О. В. Корнюшин 2, Н. М. Грефнер 3, Ю. В. Дмитриева 1, А. С. Алексеева 1, А. А. Груздков 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
3 Институт цитологии РАН
Санкт-Петербург, Россия
* E-mail: gromovalv@infran.ru
Поступила в редакцию 22.04.2018
После доработки 21.11.2018
Принята к публикации 04.02.2019
Известно, что одним из факторов, вносящих вклад в развитие гипергликемии при диабете, является повышенное всасывание глюкозы в тонкой кишке благодаря увеличению экспрессии основных транспортеров глюкозы SGLT1 и GLUT2 в энтероцитах [1]. Это позволяет рассматривать всасывание глюкозы в тонкой кишке как ключевой процесс при разработке стратегий, направленных на нормализацию углеводного обмена при диабете. Вместе с тем существующие представления об изменении всасывания глюкозы при диабете и о механизмах, лежащих в основе этих изменений, базируются в основном на данных, полученных в опытах in vitro и острых опытах in vivo, которые не вполне адекватно отражают реальные закономерности функционирования живых систем [2]. В связи с этим выглядит весьма актуальной задача проанализировать особенности всасывании глюкозы при диабете в условиях, максимально близких к физиологическим, то есть в отсутствие наркоза и операционной травмы. С этой целью в данной работе всасывание глюкозы в тонкой кишке у крыс с экспериментальным диабетом типа 2 и у контрольных животных (в отсутствие диабета) оценивалось по скорости свободного потребления этими животными (после их предварительного голодания) концентрированного раствора глюкозы. Как было показано нами ранее [2], такой подход позволяет вполне объективно судить о скорости всасывания глюкозы в тонкой кишке крыс в естественных условиях. По окончании опытов у части крыс методами иммуногистохимии и конфокальной микроскопии определялось содержание транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов из тощей кишки.
В работе использовались самцы крыс Вистар (180–200 г), полученные из ЦКП Биоколлекция ИФ РАН. Опыты проводились в полном соответствии с Директивой Европейского Совета (The European Council Directive (86/609/EEC)) по соблюдению этических принципов в работе с животными. Во время опытов крысы содержались на жировой диете (20% белка, 22% жира, 25.4% крахмала и 1.83% сахарозы, в % от влажного веса, принятого за 100). Всасывание глюкозы в тонкой кишке определялось по скорости свободного потребления предварительно голодавшими (18–20 ч) животными 20% раствора глюкозы [2]. До начала опытов с диабетом у всех животных были определены исходные значения скорости всасывания глюкозы (в мкмоль/мин) и сформированы две группы животных: опытная (n = 12) и контрольная (n = 8) с близкими средними значениями этих скоростей. В опытной группе диабет типа 2 вызывали путем инъекции стрептозотоцина (в/б, доза 30 мг/кг) животным, содержавшимся в течение двух месяцев на жировой диете [3]. При тех же условиях контрольным животным вместо стрептозотоцина вводили его растворитель (цитратный буфер, pH 4.5). Через 10 дней после введения указанных препаратов животных тестировали на толерантность к глюкозе, используя тест ОГТТ. В этих опытах уровень глюкозы в крови, взятой из хвостовой вены крыс, определяли в точке 0 (после голодания в течение 18 ч), а затем, после орального введения животным глюкозы в дозе 2 г/кг массы тела, каждые 30 мин в течение 2-х часов. На основании результатов опытов по всасыванию глюкозы, проводившихся через 21–23 дня после введения стрептозотоцина или цитратного буфера, в опытной группе были выделены животные с выраженными признаками диабета: уровень гликемии по интегральному показателю (площадь под глюкозной кривой в тесте ОГТТ), составлял 29.1–57.7 мМ ч (n = 6). У контрольных животных этот показатель был в диапазоне 10.2–10.8 мМ ч (n = 5).
В конце опытов с регистрацией потребления крысами раствора глюкозы, после их декапитации, отбирали образцы ткани из середины тощей кишки для иммуногистохимического анализа транспортеров глюкозы SGLT1 и GLUT2 в энтероцитах по методике, описанной ранее [4]. Готовые срезы смотрели на конфокальном микроскопе Leica TCS SL (Германия). Содержание транспортеров глюкозы в апикальной мембране энтероцитов, расположенных в верхней трети кишечных ворсинок, оценивалось полуколичественным способом по программе Image J путем измерения интенсивности иммунофлюоресценции на полосках фиксированной длины и ширины, покрывающих апикальную мембрану.
Результаты выражались как М ± SEM. При сравнении средних значений использовали непарный t-критерий Стъюдента. Достоверными считались различия при P < 0.05.
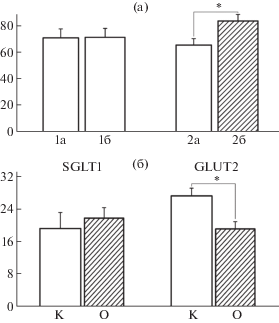
После введения стрептозотоцина у крыс опытной группы в течение 4 недель опытов отсутствовал прирост массы тела, тогда как в контроле (введение растворителя препарата) за тот же период наблюдался ее достоверный прирост: 16.5 ± 3.4 г (p < < 0.05). При этом скорость всасывания глюкозы в тонкой кишке у крыс с диабетом увеличилась на 27.7% (p < 0.02), а у контрольных животных – не изменялась по сравнению с исходным уровнем (до введения препаратов) (рис. 1а). Таким образом, в наших опытах, проводившихся в условиях, наиболее близких к естественным, как и в работах других авторов, использовавших острые опыты in vivo и in vitro [1, 5, 6], наблюдалась повышенная скорость всасывания глюкозы при экспериментальном диабете типа 2. В дополнение к этому у крыс с диабетом нами была впервые обнаружена обратная корреляция между приростом скорости всасывания глюкозы в тонкой кишке и уровнем гликемии по интегральному показателю у тех же животных (коэффициент корреляции r = –0.71). Данный факт обусловлен, по-видимому, снижением оттока глюкозы из энтероцитов через базолатеральную мембрану (с участием транспортера GLUT2) в кровь вследствие повышенной концентрации в ней глюкозы. Это может приводить к торможению поступления глюкозы через апикальную мембрану с участием транспортеров SGLT1 и GLUT2. Такое предположение подкрепляется нашими данными о сниженном на 30% (p < 0.05) уровне транспортера GLUT2 в апикальной мембране энтероцитов у крыс с диабетом по сравнению с контролем (рис. 1б). Важно отметить, что содержание транспортера SGLT1 в апикальной мембране энтероцитов при этих условиях не менялось по сравнению с контролем. В наших опытах у крыс с диабетом обнаружено также повышение массы слизистой оболочки в тонкой кишке (на 36% в двенадцатиперстной, p < 0.0027, и на 78.5% в подвздошной кишке, p < 0.02). Такое повышение могло быть следствием увеличения в этих отделах тонкой кишки высоты ворсинок и соответственно численности энтероцитов. Это предположение согласуется с данными других авторов, которые наблюдали у крыс с диабетом, вызванным введением стрептозотоцина, увеличение высоты ворсинок в тощей и подвздошной кишке [6].
Рис. 1.
Влияние экспериментального диабета типа 2 на всасывание глюкозы в тонкой кишке (а) и на содержание транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов (б). По вертикали на (а): скорость всасывания глюкозы (мкмоль/мин), на (б): интенсивность иммунофлюоресценции меток к транспортерам SGLT1 и GLUT2 (пиксель/мкм). Обозначения на (а): 1а и 1б – исходные уровни всасывания глюкозы до введения цитратного буфера в контрольной группе и стрептозотоцина в группе с диабетом, соответственно; 2а и 2б – уровни всасывания глюкозы в тех же группах через 21–23 дня после введения вышеуказанных препаратов; *p < 0.02. На (б): К и О – контрольная группа и группа с диабетом через 21–23 дня после введения цитратного буфера и стрептозотоцина, соответственно; *p < 0.05. В контрольной группе n = 5, в группе с диабетом n = 6. Указаны M ± SEM.
Таким образом, у крыс с диабетом типа 2 повышенное всасывание глюкозы в тонкой кишке может происходить за счет прироста в ней массы слизистой оболочки (вследствие увеличения численности энтероцитов). Основной вклад в повышение всасывания глюкозы вносит, по-видимому, ее активный транспорт с участием SGLT1.
Список литературы
Song P., Onishi A., Koepsel H., and Vallon V. Sodium glucose cotransporter SGLT1 as a therapeutic target in diabetes mellitus // Expert Opinion on Therapeutic Targets. 2016. V. 20. № 9. P. 1109–1125.
Груздков А.А., Громова Л.В., Дмитриева Ю.В. Алексеева А.С. Скорость свободного потребления крысами раствора глюкозы как критерий оценки ее всасывания в тонкой кишке (Экспериментальное исследование и математическое моделирование) // Рос. физиол. журн. им. И.М. Сеченова. 2015. Т. 101. № 6. С. 708–720.
Skovsø S. Modeling type 2 diabetes in rats using high fat diet and streptozotocin // Journal of Diabetes Investigation. 2014. V. 5. № 4. P. 349–358.
Грефнер Н.М., Громова Л.В., Груздков А.А., Комиссарчик Я.Ю. Сравнительный анализ распределения транспортеров SGLT1 и GLUT2 в энтероцитах тонкой кишки крыс и клетках Caco 2 при всасывании гексоз // Цитология. 2010. V. 52. № 7. P. 580–587.
Wong T.P., Debnam E.S., Leung P.S. Diabetes mellitus and expression of the enterocyte renin-angiotensin system: implications for control of glucose transport across the brush border membrane // Am. J. Physiol. Cell Physiol. 2009. V. 297. P. C601–C610.
Debnam E.S., Smith M.V., Sharp P.A., Srai S.K., Turvey A., Keable S.J. The effects of streptozotocin diabetes on sodium-glucose transporter (SGLT1) expression and function in rat jejunal and ileal villus-attached enterocytes // Pflugers Arch. 1995. V. 430. № 2. P. 151–159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


