Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 3, стр. 172-178
ВОЗРАСТ-ЗАВИСИМАЯ АКТИВНОСТЬ ЛАКТАТДЕГИДРОГЕНАЗЫ В СТРУКТУРАХ ГОЛОВНОГО МОЗГА КРЫС В ПОСТНАТАЛЬНОМ ОНТОГЕНЕЗЕ, ГИПОКСИРОВАННЫХ В ПЛОДНЫЙ ПЕРИОД
А. М. Рашидова 1, *, У. Ф. Гашимова 1
1 Институт физиологии им. академика Абдуллы Караева Национальной Академии Наук Азербайджана
Баку, Азербайджан
* E-mail: afag.rashidova@gmail.com
Поступила в редакцию 12.04.2017
После доработки 29.11.2018
Принята к публикации 20.02.2019
Аннотация
Статья посвящена выявлению возрастной динамики изменения активности лактатдегидрогеназы (ЛДГ) в структурах головного мозга в раннем постнатальном онтогенезе и репродуктивном периоде белых крыс, гипоксированных внутриутробно в 18–20-й дни плодного периода. Установлено, что в постнатальном онтогенезе с увеличением возраста у крыс, перенесших гипоксию пренатально, восстановление активности ЛДГ до контрольных показателей не наблюдается. Также было установлено, что гипоксия в большинстве случаев приводит к повышению активности ЛДГ в исследованных нами структурах головного мозга.
ВВЕДЕНИЕ
Лактатдегидрогеназа (ЛДГ; L-лактат: НАД-оксидоредуктаза; КФ 1.1.1.27) является внутриклеточным энзимом, находящимся практически во всех тканях и органах организма. Этот фермент, участвуя в конечных этапах превращения глюкозы в гликолизе, катализирует обратимую реакцию превращения пирувата в лактат при участии НАДH. Изменение активности ЛДГ в структурах головного мозга в ответ на воздействие неблагоприятных факторов среды, в том числе и гипоксии в плодном периоде, представляет определенный интерес. Гипоксия относится к широко распространенным и важным в клиническом отношении неблагоприятным факторам воздействия на организм. Патогенетический эффект гипоксии зависит от периода пренатального развития. Любое воздействие на определенном этапе пренатального онтогенеза откладывает отпечаток на последующее развитие головного мозга [1]. Проявление неврологических и интеллектуальных расстройств в постнатальном онтогенезе вследствие воздействия стресс-факторов в критические периоды пренатального развития, скорее всего, связано со снижением репаративных процессов в головном мозге в пре- и постнатальном онтогенезе [2]. В это же время происходят резкие изменения и в энергетическом обмене ЦНС. Из литературных источников известно, что большая часть поступающего в организм кислорода используется мозгом для обеспечения протекающих в нем биохимических реакций энергоснабжения, поэтому мозг по сравнению с другими органами является наиболее чувствительным к гипоксии [3–6].
Реакция, катализируемая ЛДГ, является заключительным этапом анаэробного механизма окисления глюкозы. Так как энергетический обмен в головном мозге протекает с высокой интенсивностью, то изменения активности ЛДГ, с одной стороны, нарушают, в основном, энергозависимые процессы и приводят организм к патологическому состоянию [7]. С другой стороны, ЛДГ-зависимые реакции считаются наиболее приемлемыми системами для исследования изменений соотношения аэробных и анаэробных процессов, происходящих в живых организмах при различных неблагоприятных воздействиях окружающей среды. В анаэробных условиях образующийся в тканях при гликолизе пируват при участии фермента ЛДГ превращается в лактат, что приводит к снижению внутриклеточного рН и возникновению ацидоза, нарушающего протекание биохимических процессов [8]. Необходимо отметить, что скорость и направление ЛДГ-реакций являются показателями соотношения между интенсивностью гликолиза и скоростью использования пирувата в цикле трикарбоновых кислот, глюконеогенезе и в других реакциях. Молекулярное преобразование тетрамера фермента ЛДГ с изменением соотношения Н- и М‑субъединиц сопряжен с анаэробизацией гликолитического цикла и, следовательно, ЛДГ-зависимые реакции можно использовать как маркер для исследования изменений, происходящих в соотношении аэробных и анаэробных процессов в мозговой ткани при гипоксии. Также можно предположить, что фермент ЛДГ на уровне ЦНС для регуляции механизмов энергообеспечения и внутриклеточной пластичности на генетическом уровне регулируется двумя системами – сигнальной (цитомембранной) и цитоплазматической (транс-крипционной) и повышение активности ЛДГ в мозге можно объяснить ускорением гликолитического пути обмена углеводов. Повышение содержания накапливающегося в результате гипоксии лактата вызывает активацию анаэробных изоферментов ЛДГ4,5 и одновременное ингибирование аэробных ЛДГ1,2 из-за различия их кинетических свойств, т.е. аэробно-анаэробное соотношение фракций ЛДГ изменяется в зависимости от возраста животного, структурных особенностей отдела мозга и срока гипоксии [9]. При этом можно сказать, что активация ЛДГ сопряжена с анаэробизацией спектра ее изоферментов.
Влияние гипоксии на физиологические и биохимические характеристики широко изучено у взрослых животных, однако в раннем периоде постнатального развития этот вопрос освещен недостаточно, особенно в области нейрохимических исследований структур головного мозга на субклеточном уровне в зависимости от возраста [1, 10]. Поскольку энергетический баланс головного мозга на 80% обеспечивается глюкозой, мы попытались проанализировать действие гипоксии на гликолиз, а именно, на динамику активности фермента энергообмена ЛДГ в структурах головного мозга крыс в различные периоды постнатального онтогенеза, подвергнутых воздействию пренатальной гипоксии в плодном периоде развития.
МАТЕРИАЛ И МЕТОДИКА
В качестве объекта исследований использовали белых нелинейных крыс, подвергшихся гипоксии внутриутробно в 18–20 дни плодного периода, характеризующегося снижением уровня пролиферации клеток в мозге, ускорением процессов их созревания и дифференцировки. Воздействие гипоксии в этот период приводит к эмбриотоксическим последствиям и различным патологиям развития [5]. Беременные самки были разделены на 2 группы: 1 – контрольная – самки (n = 5), помещавшиеся в барокамеру на 18–20-е сутки беременности при свободном доступе атмосферного воздуха; 2 – опытная – самки (n = 8), подвергавшиеся в барокамере гипоксии в аналогичные сроки беременности. Модель гипоксии создавали у беременных крыс в барокамере с подачей смеси газов 5% кислорода и 95% азота и ежедневной экспозицией 20 мин в течение 3 сут. Полученное от самок обеих групп потомство было в дальнейшем использовано для исследований по достижении 17-го (период прозревания); 30-го (период отъема детенышей от матери, завершение раннего периода постнатального онтогенеза) и 90-го (репродуктивный период) дня постнатального онтогенеза. Отметим, что как в контроле, так и в опыте каждой возрастной группы было использовано по 6 крысят-самцов. По окончании каждой серии опытов крыс декапитировали, извлекали головной мозг на льду и идентифицировали структуры головного мозга [11]. Поскольку энергетический обмен происходит в митохондриях и цитозоле, то посчитали целесообразным провести сравнительный анализ динамики активности ЛДГ в этих субклеточных фракциях, а также в гомогенатах тканей орбитальной, сенсомоторной, лимбической коры, гипоталамуса и мозжечка головного мозга крыс. Ткани структур мозга гомогенизировали в буферной среде, состоящей из 0.2 М трис- НСl (рН 7.4); 1 mМ ЭДТА; 0.25 М сахарозы в соотношении 1:9, и центрифугировали в течение 10 мин при 1000 g. Далее митохондриальную и цитозольную фракции выделяли дифференциальным центрифугированием. Для этого супернатант центрифугировали при 11 000–14 000 g в течение 20 мин, после чего в осадке остается митохондриальная масса, а из супернатанта ультрацентрифугированием при 100 000 g в течение 1.5–2.0 ч выделяли цитозольную субфракцию. Митохондрии после повторного ресуспендирования в 5 мл 0.32 М сахарозы осаждали центрифугированием при 14 000g. Для определения максимальной внутримитохондриальной активности ЛДГ мембраны митохондрий разрушали 1%-ным раствором Тритона Х-100/0.25 М сахарозы [12]. Активность фермента ЛДГ определяли по методу Bergmeyer H.U. (1975) спектрофотометрически при λ = 340 нм [13]. Удельную активность фермента считали как µM NADH/1 мг белка в 1 мин. Содержание общего белка определяли по Брэдфорд с использованием 0.01%-ного раствора Кумасси бриллиантового синего G-250 при λ = = 595 нм [14]. Обработка данных проводилась в программе Origin Pro 7.0. Статистическую обработку проводили с использованием пакета анализа программ Statisticа. Оценка значимости различий данных между группами проводилась с использованием t-критерия Стьюдента. Различия считались достоверными при значениях р < 0.01.
В процессе экспериментов соблюдались правила гуманного обращения с экспериментальными животными, изложенные в директиве Европейского сообщества (Директива Совета Европейского сообщества (86/609/ЕЕС)), под наблюдением локального комитета по биоэтике НАН Азербайджана.
РЕЗУЛЬТАТЫ
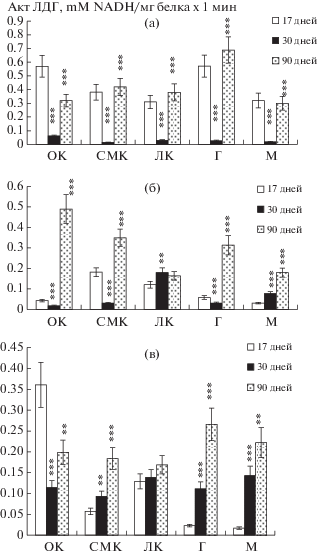
Результаты проведенных исследований динамики удельной активности ЛДГ в гомогенатах тканей структур головного мозга у интактных животных показали, что активность фермента на 30-е сутки постнатального онтогенеза резко снижалась, в то время, как на 17-й и 90-й дни развития она достигала своего максимального значения (рис. 1а). В митохондриях активность ЛДГ на 90-й день постнатального развития была в 6–25 раз выше, по сравнению с показателями активности на 17-й и 30-й дни развития (p < 0.001). Исключение составила лимбическая кора, где разница в уровне активности ЛДГ по сравнению с показателями на 30‑й день была незначительной (рис. 1б). В цитозольной фракции изучаемых структур так же, как и в митохондриях, активность ЛДГ на 90-й день развития была выше, чем в предыдущие дни исследования, за исключением орбитальной коры, где на 17-й день активность фермента была в 2–3 раза выше, чем в последующие сроки развития (p < 0.001) (рис. 1в).
Рис. 1.
Изменение удельной активности ЛДГ в тканях (а), митохондриях (б) и цитозоле (в) структур головного мозга контрольных крыс в онтогенезе (µMNADH/мг белка ×1 мин; М ± m; n = 6).
Примечание: 1. ОК – орбитальная кора; СМК – сенсомоторная кора; ЛК – лимбическая кора; Г – гипоталамус; М – мозжечок;
2. * – p < 0.05; ** – p < 0.01; *** – p < 0.001 – значения достоверности, отражающие различия в активности ЛДГ относительно значения предыдущей возрастной группы.
У крыс, перенесших пренатальную гипоксию, в гомогенатах всех исследуемых структур головного мозга активность ЛДГ значимо повысилась на 17-е и 30-е сутки жизни, тогда как после достижения половой зрелости на 90-е сутки жизни ее активность снизилась (рис. 2а).
Рис. 2.
Изменение удельной активности ЛДГ в тканях (а), митохондриях (б) и цитозоле (в) структур головного мозга экспериментальных крыс в онтогенезе в % от показателей контрольной группы соответствующего возраста (М ± m; n = 6).За 100% приняты значения удельной активности ЛДГ в контроле для каждой возрастной группы в отдельности.
* – p < 0.05; ** – p < 0.01; *** – p < 0.001 – значения достоверности, отражающие различия в активности ЛДГ относительно значения у контрольных крыс соответствующего возраста.
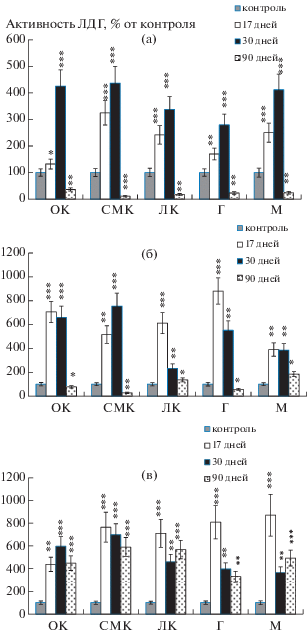
В митохондриальной субклеточной фракции структур головного мозга гипоксированных крыс картина динамики активности ЛДГ иная: резко повышаясь на 17-е сутки (p < 0.001), далее на 30-е и 90-е сутки жизни ее активность снизилась (p < < 0.001; 0.01). Исключение составила сенсомоторная кора, где картина динамики активности ЛДГ схожа с таковой в гомогенате данной структуры (рис. 2а, 2б). Точнее, с увеличением возраста при достоверном повышении активности ЛДГ на 17-й день жизни в 5 раз (р < 0.001), и к 30-му дню в 7.5 раза (р < 0.001), на 90-й день ее активность была почти в 3.6 раза ниже контрольных показателей и составила 27% (р < 0.01) (рис. 2б).
В цитозольной субклеточной фракции исследуемых структур головного мозга гипоксированных крыс в постнатальном онтогенезе активность ЛДГ меняется неоднозначно. Результаты показали, что общая картина динамики активности ЛДГ в сенсомоторной коре и гипоталамусе схожа – активность ЛДГ в онтогенезе уменьшается, но до контрольных значений не доходит. В лимбической коре и мозжечке при максимальном повышении активности ЛДГ на 17-е сутки (р < 0.001), далее на 30-е сутки она снижалась с последующим повышением в репродуктивном периоде на 90-е сутки. В орбитальной коре максимальная активность фермента на 30-е сутки была выше контроля в 6 раз (р < 0.001), на 17-е и 90-е сутки жизни активность фермента была ниже, чем на 30-е сутки, но по сравнению с контролем в 4.5 раза выше (р < 0.01; р < 0.001 соответственно) (рис. 2в).
С другой стороны, абсолютные показатели удельной активности ЛДГ в гомогенате структур 17-дневных крысят контрольной группы были выше, чем в митохондриях и цитозоле. У экспериментальных животных данной возрастной группы эти показатели по сравнению с контролем были повышены в несколько раз и особенно в цитозоле корковых структур (р < 0.01) (рис. 1, 2).
У 30-дневных крысят контрольной группы удельная активность ЛДГ в гомогенате и митохондриях была ниже, чем у 17-дневных крысят. В цитозоле же, наоборот, активность ЛДГ была повышена во всех структурах, кроме орбитальной коры (рис. 1). В экспериментальной группе крыс этой же возрастной группы как в гомогенате, так и в субклеточных фракциях наблюдалось достоверное повышение активности фермента по сравнению с контрольными показателями 30-дневных крыс. По сравнению с 17-дневными гипоксированными животными, у 30-дневных гипоксированных крыс повышение активности ЛДГ регистрировалось лишь в цитозоле (рис. 1, 2).
У 90-дневных крыс контрольной группы активность ЛДГ была, в основном, повышенной как в тканях, так и в субклеточных фракциях структур мозга по сравнению с 17- и 30-дневными животными (р < 0.001). У 90-дневных крыс экспериментальной группы при снижении активности ЛДГ в тканях и митохондриях, в цитозоле наблюдалось достоверное повышение активности фермента по сравнению с контролем (р < 0.001). При сравнении же с данными для 17- и 30-дневных гипоксированных крысят активность ЛДГ в гомогенатах структур мозга 90-дневных крыс снижалась; в митохондриях при повышении ее уровня в лимбической коре и мозжечке в других структурах она также снижалась; в цитозоле активность фермента повышалась (рис. 1, 2).
ОБСУЖДЕНИЕ
В наших исследованиях с увеличением возраста у крыс, перенесших перинатальную гипоксию, восстановление активности ЛДГ до контрольных показателей не наблюдается, и в большинстве случаев активность фермента в структурах головного мозга повышается. Полученные результаты можно объяснить тем, что исследуемые структуры мозга способны адаптироваться к изменениям, т.е. в ответ на воздействие гипоксии усиливать защитно-адаптивную функцию и аккумулировать энергию. При этом динамика активности фермента в возрастном ряду 17 → 30 → 90 дней схожа в гомогенате всех исследуемых структур головного мозга (рис. 2а). Вместе с тем в цитозольной фракции динамика активности ЛДГ в зависимости от возраста более плавная, чем в тканях, что, вероятно, может быть объяснено гомогенностью данной фракции (рис. 2в). Совсем иная картина в митохондриях структур мозга. Здесь с увеличением возраста динамика фермента в структурах изменяется неоднозначно: максимум активности ЛДГ достигается на 17-й день постнатального развития, снижаясь с увеличением возраста, за исключением показателей в сенсомоторной коре (рис. 2б).
Неравномерное изменение активности фермента ЛДГ в митохондриях и цитозоле с увеличением возраста животного предположительно зависит от морфофункциональных и физиологических особенностей изучаемых структур в каждой конкретной возрастной группе (рис. 2б, 2в). Также не исключено, что в процессе развития организма преобладание активности ЛДГ в субклеточных фракциях меняется, т.е. наблюдается эффект инверсии, и после воздействии неблагоприятных факторов среды этот процесс может быть более интенсивен.
Таким образом, имеются несколько возможных объяснений полученных результатов. Так, в ответ на гипоксию в головном мозге образуется белок НIF-1, который участвует в регуляции транскрипции более чем 60 белков, в том числе и гликолитических ферментов [15–17]. Вследствие того, что головной мозг является органом, управляющим основными функциями, удовлетворение его энергетических потребностей осуществляется в первую очередь. Как известно, гликолитические процессы в мозговой ткани протекают в аэробных условиях, а ЛДГ является единственным ферментом, который участвует в гликолизе в анаэробных условиях. Этой особенностью фермента можно объяснить повышение анаэробных фракций в изоферментном спектре ЛДГ в мозговой ткани после воздействия гипоксии.
Резюмируя сказанное, можно предположить, что после пренатальной гипоксии активность ЛДГ преимущественно повышаясь на 17-, 30- и 90-е сутки постнатального онтогенеза по сравнению с контрольными показателями в соответствующей возрастной группе, указывает на подключение защитно-адаптационных функций головного мозга. Также результаты экспериментов показали, что в цитозольной фракции изучаемых структур головного мозга активность ЛДГ в основном выше, чем в гомогенатах тканей этих структур. В то же время наблюдалась существенная схожесть показателей активности ЛДГ в гомогенате и цитозоле мозжечка: в обоих случаях активность фермента была самая низкая по сравнению с другими структурами мозга (рис. 2а, 2в). Наряду с этим имело место как увеличение, так и уменьшение активности ЛДГ, например, для гомогената тканей структур мозга на 90-е сутки. Это, возможно, объясняется тем, что при достаточном количестве ресурсов наблюдаются активизация защитно-адаптационных механизмов и повышение активности ЛДГ, то есть происходит анаэробизация ЛДГ. В то время как при истощении ресурсов наблюдается обратная реакция – снижение активности фермента.
Полученные данные свидетельствуют о том, что после воздействия пренатальной гипоксии обменные процессы в головном мозге в ранние периоды постнатального развития перестраиваются. Повышение активности ЛДГ в гомогенатах тканей структур мозга можно объяснить, с одной стороны, возможным нарушением цепи гликолиза на стадии образования глицеральдегид-3–фосфата, который утилизируется более интенсивно для обеспечения тканей структур мозга кислородом при гипоксии. При этом НАД+ восстанавливается, выступая в роли акцептора электронов. Усиленное восстановление НАД, основного субстрата ЛДГ, вызывает активацию пула ЛДГ для восстановления баланса [НАД+]/[НАДH]. В митохондриях изучаемых структур головного мозга активность фермента в контрольной группе была значительно ниже, чем в цитозоле идентичных структур мозга. И здесь нужно отметить тот факт, что соотношение субстратов ЛДГ [НАД+]/[НАДН] в митохондриях приблизительно в 100 раз ниже, чем в цитозоле. При гипоксии наиболее уязвимыми, прежде всего, оказываются цикл трикарбоновых кислот и цепь переноса электронов. Исходя из этого, можно предположить, что при гипоксии мозг смещает нормальный баланс между гликолизом и дыханием в пользу гликолиза. Полученные нами данные показывают, что эффект гипоксии по-разному реализуется в структурах головного мозга. Это, по-видимому, связано с морфофункциональными особенностями этих структур и каталитической активностью ЛДГ в них. Резкая активация ЛДГ в митохондриях у 17-дневных экспериментальных крыс в этот ранний период онтогенеза, для которого характерно открытие глаз, прозревание, миелинизация – процессы, требующие больших затрат энергии – отражает значительное увеличение потребности головного мозга в АТФ.
С другой стороны, как известно, гипоксические повреждения развивающегося мозга могут приводить к гибели или психическим и нейродегенеративным заболеваниям в постнатальном онтогенезе [18]. Гипоксия может индуцировать экспрессию генов, пагубную для организма. Многие ферменты гликолиза, кодируются чувствительными к гипоксии генами [19]. Индукция их экспрессии происходит главным образом на ранних этапах гипоксического воздействия. Это свидетельствует о том, что активация гликолиза является острым ответом плода на гипоксию, призванным компенсировать недостаток энергии [19]. Авторы, рассматривая современные представления о возможных механизмах трансгенерационной передачи эффектов антенатального стресса и по мере изучения этой проблемы, выяснили, что во время беременности влияние неблагоприятных факторов на потомство не ограничивается одним поколением. В связи с этим вопрос о наличии трансгенерационных эффектов антенатального стресса, регистрируемых не только в первом (F1), но и в последующих поколениях (F2–F4), стал актуальным [19]. Исходя из вышесказанного, можно предположить, что последствия гипоксического воздействия могут быть необратимыми и наследуемыми. В наших исследованиях с увеличением возраста крыс даже на 90-й день в ответ на гипоксию восстановления активности ЛДГ до контрольного уровня не происходило.
Полученные результаты свидетельствуют в пользу действия гипоксии по оксидативному механизму. Изучение особенностей динамики изменения активности ЛДГ в структурах мозга после пренатальной гипоксии может внести определенную ясность в механизмы редокс-сдвигов в головном мозге в зависимости от возраста.
Суммируя все выше изложенное, можно заключить:
1. В процессе постнатального онтогенеза у крыс, перенесших пренатальную гипоксию в 18–20-й дни развития, не наблюдается восстановление активности фермента ЛДГ в структурах головного мозга до контрольных показателей.
2. С увеличением возраста у крыс, гипоксированных в 18–20-й дни пренатального развития, активность ЛДГ в основном повышается, что можно объяснить анаэробизацией фермента, необратимостью изменений, вызванных гипоксией, активизацией защитно-адаптационных механизмов и, как следствие этого, переходом изученных структур мозга на иной путь энергообеспечения.
Список литературы
Кассиль В.Г., Отеллин В.А., Хожай Л.И., Косткин В.Б.. Критические периоды развития головного мозга. Рос. физиол. ж. 86 (11): 1418–1425. 2000 [Kassil’ V.G., Otellin V.A., Khozhaǐ L.I., Kostkin V.B. Critical phases of the brain development. Ross Fiziol Zh Im I M Sechenova. 86 (11): 1418–1425. 2000 (In Russ.)].
Михеева И.Г., Рюкерт Е.Н., Брусов О.С., Фактор М.И., Верещагина Т.Г., Курасова О.Б. Содержание серотонина в сыворотке крови новорожденных детей с гипоксически-ишемическим поражением ЦНС. Педиатрия. 87 (1): 40–44. 2008 [Mikheeva I.G., Ryukert E.N., Brusov O.S., Faktor M.I., Vereshagina T.G., Kurasova O.B., Rudnitskaya S.Ya. Serum serotonin level in neonates with hypoxic ischemic CNS. Pediatry. 87 (1): 40–44. 2008. (In Russ.)].
Журавин И.А., Туманова Н.Л., Васильев Д.С. Изменение адаптивных механизмов мозга в онтогенезе крыс, перенесших пренатальную гипоксию. Докл. Акад. наук. 425 (1): 123–125. 2009 [Zhuravin I.A., Tumanova N.L., Vasilyev D.S. Changes in the mechanisms of brain adaption during postnatal ontogeny of rats exposed to prenatal hypoxia. Doklady biological sciences. 425 (1): 123–125. 2009. (In Russ.)].
Дубровская Н.М., Журавин И.А. Онтогенетические особенности поведения крыс, перенесших гипоксию на 14-е или 18-е сутки эмбриогенеза. Журн. высш. нервн. деят. 58 (6): 718–727. 2008 [Dub-rovskaya N.M., Zhuravin I. A. Specificity of Ontogenic Development of Behavior of Rats Subjected to Prenatal Hypoxia on the 14-th or 18-th Days of Embryogenesis. Zhurn Vyssh Nerv Deyat Im I.P. Pavlova. 58 (6): 718–727. 2008. (In Russ.)].
Граф А.В., Гончаренко Е.Н., Соколова Н.А., Ашмарин И.П. Антенатальная гипоксия: участие в развитии патологий ЦНС в онтогенезе. Нейрохимия. 25 (1-2): 11–16. 2008 [Graf A.V., Goncharenko E.N., Sokolova N.A., Ashmarin I.P. Antenatal Hypoxia: Contribution to the Development of CNS Pathologies in Ontogenesis. Neurochemistry. 25 (1-2): 11–16. 2008. (In Russ.)].
Pellerin L., Magistretti P. J. How to balance the brain energy budget while spending glucose differently. J. Physiol. 546: 325. 2003.
Mazurek S., Zwerschke W., Jansen-Dürr P. Eigenbrodt E. Effects of the human papilloma virus HPV-16 E7 oncoprotein on glycolysis and glutaminolysis: role of pyruvate kinase type M2 and the glycolytic-enzyme complex. Biochem. J. 356: 247–256. 2001.
Панахова Х.Г., Рашидова А.М., Мовсумзаде К.М. Изменение аэробно-анаэробного соотношения субъединиц лактатдегидрогеназы в ткани головного мозга годовалых крыс при белковом голодании. Тр. института физиологии им. А.И. Караева и общества физиологов Азербайджана “Современные проблемы сравнительной физиологии и биохимии”. ХХIV:307-312. 2006. [Panakhova H.G., Rashidova A.M., Movsumzade K.M. Izmenenie aerobno-anaerobnogo sootnosheniya subedinic laktatdegidrogenazy v tkani golovnogo mozga godovalyh krys pri belkovom golodanii. [Change of the aerobic/anaerobic ratio of subunits of lactic dehydrogenase in brain tissue of a one-year-old rats at protein starvation]. Trudy Instituta Fiziologii im. A.I. Karaeva i obshchestva fiziologov Azerbajdzhana “Sovremennye problemy sravnitel’noj fiziologii i biohimii”. ХХIV: 307–312. 2006)].
Рашидова А.М., Гашимова У.Ф. Зависимость активности ферментов ЛДГ и ПК в тканях структур головного мозга белых крыс от уровня гипоксии, перенесенной на стадии органогенеза. Известия НАНА. 72 (1): 121–125. 2017. [Rashidova A.M., Hashimova U.F. Dependence of Activity of LDH and PK in Some Brain Structures of Rats from the Hypoxia Level Endured in the Stage of Organogenesis. Isvestia NANA. 72 (1): 121–125. 2017 (In Aze)].
Дубровская Н.М., Журавин И.А., Туманова Н.Л. Постнатальное физиологическое развитие крыс после острой пренатальной гипоксии. Рос. физиол. ж. 89(5): 522–532. 2003. [Dubrovskaya N.M., Zhuravin I.A., Tumanova N.L. Postnatal physiological development of rats after acute prenatal hypoxia. Ross Fiziol Zh Im I M Sechenova. 89 (5): 522–532. 2003. (In Russ.)].
Pellegrino L.J., Pellegrino A.S., Cusman A.Z. A stereotaxic atlas of the rat brain. Plenum Press, NY. 1979.
Chinopoulos C., Zhang S.F., Thomas B., Ten V., Starkov A.A. Isolation and functional assessment of mitochondria from small amounts of mouse brain tissues. Methods Mol. Biol. 793: 311–324. 2011.
Bergmeyer H.U. Biochemistry information. Methods of Enzymatic Analysis. V. II. P. 82–83. 1975.
Kruger N.J. Bradford method for protein quantitation. The protein Protocols hand-book, 2-nd ed. Ed. be J.M. Walker, Humana press Inc., Totowa N.J. 15–21. 2002.
Анохина Е.Б., Буравкова Л.Б. Механизмы регуляции транскрипционного фактора HIF при гипоксии. Биохимия. 75:185–195. 2010 [Anokhina E.B., Buravkova L.B. Mechanisms of regulation of transcription factor HIF under hypoxia. Biochemistry. 75: 185–195. 2010. (In Russ.)].
Semenza G.L., Roth P.H., Fang H.M., Wang G.L. Transkriptional regulation of genes encoding glycolytic enzymes by hypoxia-inducible factor 1. J. Exp. Biol. 209: 3851–3861. 2006.
Semenza, G.L. Hypoxia-inducible factors in physiology and medicine. Cell. 148 (3): 399–408. 2012.
Пальчик А.Б., Шабалов Н.П. Гипоксически-ишемическая энцефалопатия новорожденных: руководство для врачей. СПб.: Питер. 2001. [Pal’chik A.B., Shabalov N.P. Gipoksicheski-ishemicheskaya encefalopatiya novorozhdennyh: rukovodstvo dlya vrachej [Hypoxemic – ischemic encephalopathy of newborns: the manual for physicians]. SPb.: Piter. 2001].
Граф А.В., Дунаева Т.Ю., Маклакова А.С., Маслова М.В., Соколова Н.А. Трансгенерационные эффекты антенатального стресса разной этиологии. Изв. РАН. Сер. биол. 5:529-539. 2012. [Graf A.V., Dunaeva T.Y., Maklakova A.S., Maslova M.V., Sokolova N.A. Transgenerational effects of prenatal stress of different etiology. Izvestiya rossijskoj akademii nauk. Seriya biologicheskaya. 5:529–539. 2012. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


