Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 3, стр. 219-222
КРЫСА (Rattus norvegicus) КАК ОБЪЕКТ ИССЛЕДОВАНИЯ В МОДЕЛИ ОСТРОГО ОТРАВЛЕНИЯ ФОСФОРОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ. 4. М1-ХОЛИНОРЕЦЕПТОРЫ И ЭСТЕРАЗНАЯ АКТИВНОСТЬ В ГОМОГЕНАТАХ ГОЛОВНОГО МОЗГА
В. Е. Соболев 1, В. И. Шмурак 1, Н. В. Гончаров 1, 2, *
1 НИИ гигиены, профпатологии и экологии человека, ФМБА России
Ленинградская обл., г.п. Кузмоловский, ст. Капитолово, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 18.04.2018
После доработки 19.10.2018
Принята к публикации 04.02.2019
После острого отравления фосфорорганическими соединениями (ФОС) в организме происходит развитие ряда признаков, являющихся следствием “холинэргического криза”, в том числе повреждение ЦНС и периферической нервной системы, эндотелия, других тканей и органов [1–3]. Поскольку значительная часть токсикологических исследований проводится на грызунах, необходимо учитывать наличие в крови грызунов карбоксилэстеразы (КЭ), которая, будучи сериновой эстеразой, стехиометрически связывает ФОС, модулируя тем самым состояние интоксикации и развитие отставленной патологии. Для подавления КЭ используют различные ингибиторы КЭ, наиболее известным из которых является 2-(о-крезил)-4Н-1,3,2-бензодиоксафосфорин-2-оксид (CBDP). Другой, более простой способ моделирования острого отравления ФОС на грызунах состоит в том, что ФОС вводят двукратно с интервалом 1 ч, при этом первая доза идет преимущественно на подавление активности КЭ [4]. Второй вариант является, однако, менее специфическим, но сравнительный анализ динамики развития оставленной патологии после острого отравления ФОС на фоне подавления активности КЭ ранее не проводился.
Цель настоящего исследования – иммуногистохимическая идентификация мускариновых рецепторов М1 в нейронах неокортекса, гиппокампа и стриатума и определение эстеразной активности гомогенатов головного мозга крыс в разные сроки после острого отравления параоксоном после предварительного ингибирования КЭ параоксоном и СВDP.
В работе применяли следующие реактивы: параоксон (O,O-диэтил-O-п-нитрофенилфосфат, POX, Sigma); 2-(о-крезил)-4Н-1,3,2-бензодиоксафосфорин-2-оксид (2-(O-cresyl)-4H-1,3,2-benzodioxaphosphorin-2-oxide, CBDP), синтезирован в НИИ гигиены, профпатологии и экологии человека ФМБА России. Буфер для ИГХ TBS IHC Wash Buffer+Tween, 20× (Cell Marcue). Первичные антитела Abcam (ab180636). Система детекции REVEAL-Biotin-Free Polyvalent DAB (Spring Bioscience).
Токсикологические исследования проводили на крысах-самцах Rattus norvegicus аутбредной линии Вистар массой 200–240 г в соответствии с правилами, рекомендованными Физиологической секцией Российского национального комитета по биологической этике и положениями “Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ”. Токсикологическая модель подробно описана в первой публикации по результатам серии исследований [4]. Эксперимент включал три группы сравнения: 1 – интактный контроль; 2 – интоксикация параоксоном в дозе 0.6ЛД50 через час после введения параоксона в дозе 0.45ЛД50 (РОХ2х); 3 – интоксикация параоксоном в дозе 0.6ЛД50 через час после введения CBDP в дозе 3.3 мг/кг в/б (CBPОХ). Наблюдения за животными продолжались в течение 6 нед после отравления. Через 1, 3 сут, 1, 2, 4 и 6 нед после отравления проводили выборочную эвтаназию животных в каждой группе и отбор материала для иммуногистохимического исследования (ИГХ). После декапитации головной мозг животных извлекали и вырезали тканевые образцы сегментальной плоскости левого полушария в стереотаксических координатах: ‒1.13 до –2.07 mmant. Bregma. Срезы толщиной 7 мкм фиксировали в ацетоне 5 мин, после чего промывали 0.01 М буфером TBSIHC Wash Buffer + + Tween, 20× (Cell Marque). Для окрашивания срезов использовали мультимерную безбиотиновую систему детекции REVEAL-Biotin-Free Polyvalent DAB (SpringBio). Окрашенные срезы просматривали под микроскопом при увеличении 103×; 247× и 413×. Методом случайного отбора фотографировали области неокортекса, гиппокампа и стриатума и в программе Videotest Size 5.0 определяли плотность распределения позитивных клеток на площади среза (количество клеток на мм2, N/мм2).
Ацетилхолинэстеразную, бутирилхолинэстеразную и карбоксилэстеразную активность гомогенатов головного мозга определяли в супернатанте при помощи методик, адаптированных для 96-луночных микропланшетов, с последующим измерением на микропланшетном спектрофотометре Multiskan FC (Thermo Fischer Scientific) [5].
Статистическую и математическую обработку данных выполняли в программе GraphPad Prizm 5.0 методом One-Way Anova, с использованием критерия Краскела-Уоллиса. Статистически обработанные данные представлены как среднее арифметическое ± стандартная ошибка. Различия между группами считали статистически значимыми при р < 0.05.
На разных сроках после отравления параоксоном установлены изменения плотности распределения нейронов, позитивных для М1-холинорецепторов в неокортексе, гиппокампе и стриатуме крыс (рис. 1). Через 24 ч после отравления наблюдается увеличение плотности М1-позитивных клеток на 40% в гиппокампе крыс 2-й группы (4.27 ± ± 0.11*11) и на 10% в гиппокампе крыс 3-й группы (3.38 ± 0.12) по сравнению с контролем (3.04 ± 0.15) (рис. 1а, в). Через трое суток после отравления наблюдается уменьшение М1-позитивных клеток в неокортексе крыс 2-й и 3-й групп на 25 и 30% (3.24 ± 0.11 и 3.04 ± 0.18* соответственно) по сравнению с контролем (4.28 ± 0.42), но еще более повышается (до 35%) разница в плотности М1-позитивных клеток в гиппокампе крыс 3-й группы относительно контроля. Через 1 нед после отравления выявлено увеличение плотности М1-позитивных клеток на 45% в гиппокампе (3.24 ± 0.11#22) и почти на 60% в стриатуме (2.43 ± 0.11#) крыс 3-й группы (CBPОХ) по сравнению с показателями животных группы 2 (POX2х) (2.24 ± 0.20 и 1.54 ± 0.08 соответственно). Спустя 2 нед после отравления отмечена увеличенная плотность М1-позитивных клеток в неокортексе крыс 2-й группы на 60% (273 ± ± 025*) (рис. 1б) и 3-й группы на 75% (3.01 ± 0.21*) по сравнению с показателями контрольной группы (1.7 ± ± 0.16), а также их уменьшение на 24% в стриатуме у животных 3-й группы (1.43 ± 0.08#) по сравнению с крысами 2-й группы (1.87 ± 0.07). Через 4 нед после отравления у крыс 2-й группы наблюдается снижение на 20% (2.77 ± 0.1*) плотности М1‑позитивных клеток в неокортексе по сравнению с контролем (3.5 ± 0.22), тогда как у животных 3-й группы в гиппокампе отмечено увеличение на 40% количества синаптически активных по М1‑холинорецептору клеток (2.52 ± ± 0.21#) по сравнению с группой 2 (1.8 ± 0.08). Через 6 нед после интоксикации во всех изучаемых отделах мозга крыс статистически значимых отличий плотности распределения М1-позитивных нейронов в сравнении с показателями контроля не выявлено.
Рис. 1.
М1-позитивные нейроны в различных отделах мозга крыс. Иммуногистохимическое исследование. Хромоген: 3,3’ диаминобензидин (DAB). (а) Неокортекс крыс контрольной группы; (б) неокортекс крыс 2-й группы (POX2х) через 2 нед после отравления; (в) гиппокамп крыс 2-й группы (POX2х) через 24 ч после отравления; (г) стриатум крыс контрольной группы.

Резюмируя результаты оценки плотности распределения М1-позитивных клеток в отделах головного мозга крыс после отравления параоксоном по двум схемам – POX2х (группа 2) и CBРОХ (группа 3) – следует отметить, что наибольшие изменения выявлены в гиппокампе крыс 3-й группы в период от первых суток до 4 нед после отравления. В неокортексе отравленных крыс через 3 сут отмечено уменьшение плотности М1-позитивных клеток, с последующим их увеличением через 2 нед после отравления. Стриатум крыс оказался наименее подвержен изменениям плотности М1-позитивных клеток вследствие отравления параоксоном в обеих экспериментальных группах (рис. 1г). Незначительное увеличение плотности клеток в стриатуме отмечено только через 1 нед после отравления.
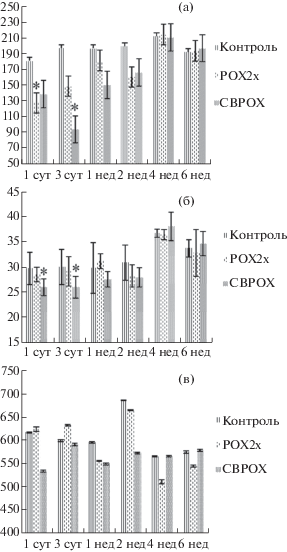
Наиболее выраженное снижение активности АХЭ в гомогенатах головного мозга крыс выявлено через 1 сут после отравления у крыс 2-й группы (на 30%) и через 3 сут – у крыс 3-й группы (на 55%) (рис. 2а). Снижение активности БХЭ на 10‑15% отмечено у крыс 3-й группы через 1 и 3 сут после отравления (рис. 2б). Статистически значимых отличий в активности карбоксилэстеразы у животных групп 2 и 3 не выявлено, хотя следует отметить тенденцию к уменьшению активности у крыс 3-й группы через сутки и 2 недели после отравления (рис. 2в).
Рис. 2.
а) Ацетилхолинэстеразная активность (мкмоль × × мин–1 × л–1) в гомогенатах головного мозга крыс в разные сроки после отравления параоксоном. * – p ≤ 0.05 по сравнению с контрольной группой. По оси абсцисс: группа, по оси ординат: (а) активность АХЭ в гомогенатах головного мозга (мкмоль×мин–1 × л–1). (б) Бутирилхолинэстеразная активность (мкмоль×мин–1 × л–1) в гомогенатах головного мозга крыс в разные сроки после отравления параоксоном. * – p ≤ 0.05 по сравнению с контрольной группой. По оси абсцисс: группа, по оси ординат: активность БХЭ в гомогенатах головного мозга (мкмоль × мин–1 × л–1). (в) Карбоксилэстеразная активность (мкмоль × мин–1× л–1) в гомогенатах головного мозга крыс в разные сроки после отравления параоксоном. По оси абсцисс: группа, по оси ординат: активность КЭ в гомогенатах головного мозга (мкмоль × мин–1 × л–1).
Известно, что параоксон способен вызывать развитие нейродегенеративных изменений в нейронах как при непосредственном введении в различные отделы головного мозга (гиппокамп), так и при парентеральном поступлении в организм. Каскад патологических изменений в тканях мозга включает в себя развитие клеточного отека, повышение уровня цитоплазматического кальция, индукцию апоптоза, аксональную дегенерацию и гибель нейронов [6]. Параоксон, как и другие высокотоксичные ФОС, увеличивает концентрацию ацетилхолина в головном мозге с последующей активацией мускариновых и никотиновых рецепторов в гиппокампе [7]. Увеличение плотности М1-позитивных нейронов наблюдается преимущественно в группе СВРОХ, что свидетельствует о существенной роли карбоксилэстераз в модуляции токсикодинамического ответа при острой интоксикации параоксоном и, вероятно, других ФОС. В литературе описана down-регуляция субтипов M1 и M2-холинорецепторов в головном мозге крыс при воздействии ФОС: понижение их плотности в коре на 21.7%, гиппокампе на 11% и стриатуме на 30.2% [8]. Мы также наблюдали уменьшение плотности М1-позитивных клеток в неокортексе крыс через 3 сут и 4 нед после отравления. В то же время в гиппокампе мы выявили повышение плотности М1-позитивных клеток через 1, 3 и 7 сут, а в неокортексе – через 2 нед после отравления параоксоном. Степень отклонений от контроля отличается в двух предложенных нами моделях интоксикации с применением специфического (CBDP) и неспецифического (малая доза параоксона) ингибиторов карбоксилэстераз, но направленность изменений совпадает. Возможная взаимосвязь карбоксилэстеразной активности и экспрессии М1-рецепторов требует дальнейшего изучения.
Список литературы
Гончаров Н.В., Прокофьева Д.С., Войтенко Н.Г., Бабаков В.Н., Глашкина Л.М. Молекулярные механизмы холинергической регуляции и дисрегуляции. Токсикол. Вестник. 2: 5-10. 2010. [Goncharov N.V., Prokofieva D.S., Boitenko N.G., Babakov V.N., Glashkina L.M. Molecular mechanism of cholinergic regulation and dysregulation. Toksikologicheskiy vestnik. 2: 5–10. 2010. (In Russ)].
Goncharov N.V., Nadeev A.D., Jenkins R.O., Avdonin P.V. Markers and Biomarkers of Endothelium: When Something Is Rotten in the State. Oxid. Med. Cell. Longev. V. 2017 (2017). 27 p. https://doi.org/10.1155/2017/9759735
Sobolev V.E., Jenkins R.O., Goncharov N.V. Sulfated glycosaminoglycans in bladder tissue and urine of rats after acute exposure to paraoxon and cyclophosphamide. Exp. Toxicol. Pathol. 69 (6): 339–347. 2017.
Гончаров Н.В., Терпиловский М.А., Шмурак В.И., Белинская Д.А., Авдонин П.В. Крыса (Rattus norvegicus) как объект исследования в модели острого отравления фосфорорганическими соединениями. 1. Биохимические аспекты. ЖЭБФ. 55 (2): 28–38. 2019. [Goncharov N.V., Terpilovskii M.A., Shmurak V.I., Belinskaya D.A., Avdonin P.V. The Rat (Rattus norvegicus) as a Model Object for Acute Organophospate Poisoning. 1. Biochemical aspects. J. Evol. Biochem. Physiol. 2. 2019. In print. (In Russ).].
Prokofieva D.S., Jenkins R.O., Goncharov N.V. Microplate biochemical determination of Russian VX: Influence of admixtures and avoidance of false negative results. Anal. Biochem. 424 (2): 108–113. 2012.
Chen Y. Organophosphate-induced brain damage: mechanisms, neuropsychiatric and neurological concequences, and potential therapeutic strategies. Neurotoxicology, 33:391-400. 2012.
Harrison P.K., Sheridan R.D., Green A.C., Scott I.R., Tattersal J.E.H. A guinea pig hippocampal slice model of organophosphate-induced seizure activity. J. Pharmacol. Exp. Ther. 310: 678–686. 2004.
Fitzgerald B.B., Costa, L.G. Modulation of M1 and M2 muscarinic receptor subtypes following repeated organophosphate exposure in rats. Toxicol. Appl. Pharmacol. 117: 122–125. 1992.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


