Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 4, стр. 255-262
АГОНИСТЫ 5-НТ1 И 5-НТ2-РЕЦЕПТОРОВ ПО-РАЗНОМУ МОДУЛИРУЮТ ВОЗБУДИМОСТЬ МОТОНЕЙРОНОВ СПИННОГО МОЗГА ЛЯГУШКИ
Н. И. Калинина 1, *, А. В. Зайцев 1, Н. П. Веселкин 1, 2
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: nkalinina54@mail.ru
Поступила в редакцию 11.02.2019
После доработки 25.02.2019
Принята к публикации 22.03.2019
Аннотация
На препарате изолированного поясничного сегмента спинного мозга лягушки с помощью методики внутриклеточного отведения потенциалов исследовано модулирующее влияние специфических агонистов и антагонистов 5-НТ1,2-рецепторов на мембранные свойства поясничных мотонейронов. Аппликация агониста 5-НТ2А,В,С-рецепторов α-Ме-5-НТ вызывала деполяризацию мембраны мотонейрона. Деполяризация не развивалась при совместной аппликации α-Ме-5-НТ со специфическим антагонистом 5-НТ2В,С-рецепторов SB206553. α-Ме-5-НТ уменьшал амплитуду mAHP и увеличивал число антидромных потенциалов действия. Этот эффект нивелировался при аппликации антагониста SB206553. Агонист 5-НТ1А/7-рецепторов 8-ОН-DPAT оказывал время-зависимый эффект на количество антидромных ПД, вызывая вначале кратковременное возбуждающее, а позже тормозное действие. Полученные данные свидетельствуют о наличии 5-НТ1А/7 и 5-НТ2В,С-рецепторов на постсинаптической мембране мотонейронов. Мы предполагаем возможную совместную модуляцию аккомодационных свойств мотонейрона двумя типами серотониновых рецепторов 5-НТ2В,С и 5-НТ1А.
ВВЕДЕНИЕ
Серотонин (5-НТ) – один из основных нейромедиаторов и нейромодуляторов в ЦНС позвоночных и беспозвоночных животных [1]. Большинство серотонинергических нейронов расположены в ядрах шва и ретикулярной формации ствола мозга. Нисходящие проекции серотонинергических нейронов в спинной мозг обеспечивают модуляцию локомоции, половой функции и мочеиспускания [2, 3]. Согласно гипотезе, предложенной Якобсом и Форнелом, серотонин облегчает моторный выход и подавляет сенсорный вход в спинном мозге [4]. Многие экспериментальные данные подтверждают эту гипотезу [5–8], однако нейронные и молекулярные механизмы действия серотонина в спинном мозге известны лишь частично.
Серотонин оказывает влияние на нейронную активность посредством 14 генетически, фармакологически и функционально различающихся 5‑НТ-рецепторов, принадлежащих семи семействам, 5-НТ1–5-НТ7 [9, 10]. За исключением одного типа (5-HT3), являющегося лиганд-управляемым ионным каналом, все 5-НТ-рецепторы являются метаботропными, связанными с G-белками. В мембране мотонейронов спинного мозга млекопитающих экспрессируются несколько типов серотониновых рецепторов: 5-HT1A,В,D, 5-HT2A,B,C и 5-HT5A [3]. Данные об экспрессии серотониновых рецепторов в спинном мозге у других классов позвоночных животных пока неполные. Описаны некоторые пре- и постсинаптические механизмы модуляции нейронной активности серотонином в спинном мозге низших позвоночных, в частности, у круглоротых [11] и амфибий [12–16]. Недавно мы показали, что серотонин уменьшает частоту глицинергических миниатюрных тормозных постсинаптических потенциалов (мТПСП), не оказывая заметного влияния на частоту ГАМКергических мТПСП [17]; этот эффект реализуется посредством активации пресинаптических 5-НТ1B,D-рецепторов и приводит к частичному облегчению моторного выхода [18].
Постсинаптические механизмы действия серотонина ранее исследовались на мотонейронах млекопитающих [19, 20], круглоротых (миноги) [21, 22] и рептилий (черепахи) [3]. Как правило, серотонин уменьшает частотную аккомодацию нейронов из-за уменьшения амплитуды средней фазы следовой гиперполяризации, поэтому мотонейрон разряжается дольше и с более высокой частотой [23]. При использовании селективного агониста 5‑НТ1А/7-рецепторов 8-ОН-DPAT было показано, что реализация данного эффекта на спинальных мотонейронах черепахи [3, 24], крысы [19] и миноги [25] обеспечивается посредством активации 5‑НТ1А-рецепторов. Показана роль 5-HT2-рецепторов в облегчении постоянных внутренних токов (PIC) в спинальных мотонейронах крыс [26, 27], а также в облегчении кальциевых токов, способствующих поддержанию плато потенциалов в спинальных мотонейронах черепахи [28]. На мотонейронах земноводных подобного рода исследований до настоящего времени не проводилось.
Целью данной работы стало исследование модулирующего действия агонистов и антагонистов серотониновых рецепторов первого и второго типа (5-НТ1,2) на мембранные свойства спинальных мотонейронов лягушки.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проводили на препарате изолированного спинного мозга лягушки Rana ridibunda. Под эфирным наркозом производили дорсальную ламинэктомию. После снятия оболочки выделяли IX и X поясничные сегменты спинного мозга вместе с корешками в виде фронтальных срезов толщиной 2–3 мм. Один из них фиксировали в экспериментальной камере ростральной поверхностью вверх. Второй помещали в физраствор и оставляли при температуре 4°С и использовали в эксперименте на следующий день. Между перерезкой нисходящих серотонинергических волокон и внутриклеточным отведением от мотонейронов проходило 4–5 ч в первый день и 26–30 ч на второй день эксперимента.
Для суперфузии использовали раствор следующего состава (в мМ): 100 NaCl, 2KCl, 0.5MgCl2, 5.5 глюкоза, 1.5CaCl2, 9NaHCO3, 2 Трис, рН 7.4–7.6, аэрируемый газовой смесью (98% О2 и 2% СО2) и имеющий температуру 16–18°С. Скорость протока составляла 6 мл/мин, объем ванны 0.5 мл. Мотонейроны идентифицировали по антидромному потенциалу действия, возникающему при стимуляции вентрального корешка. Контроль мембранного потенциала покоя осуществлялся с помощью цифрового вольтметра.
Потенциалы отводили от мотонейронов IX или X сегментов внутриклеточно с помощью острых стеклянных микроэлектродов с диаметром кончика 1–1.5 мкм, заполненных раствором KCl (3 М), имевших сопротивление 5–10 МОм. В части экспериментов (при проверке действия апамина – блокатора Са2+-зависимых калиевых каналов малой проводимости) микроэлектроды заполнялись смесью 3М KCl и 2М CsCl в равных пропорциях. Потенциалы регистрировали с помощью микроэлектродного дифференциального усилителя, разработанного в нашей лаборатории (вед. инженер Б.Т. Рябов), оцифровывали c частотой 10–20 кГц с помощью АЦП NI USB-6211 (National Instruments, США) и записывали на компьютере, используя программу WinWCP (Strathclyde Electrophysiology Software, Великобритания).
В ходе экспериментов регистрировали мембранный потенциал покоя, входное сопротивление нейрона (по величине изменения потенциала мембраны на инъецируемый постоянный ток), амплитуду и полуширину потенциала действия (ПД), быструю и среднюю фазы следовой гиперполяризации антидромного ПД.
Специфический агонист 5-НТ2А,2В,2С-рецепторов α-Ме-5-НТ (α-Methyl-5-hydroxytryptamine maleate) (10 мкМ), агонист 5-НТ1А/7-рецепторов 8-ОН-DPAT (±)-8-Hydroxy-2-(di-n-propylamino)tetralin hydrobromide (10 мкМ), агонист 5-НТ1В/D-рецепторов суматриптан (3-[2-(Dimethylamino)ethyl]-N-methyl-1H-indole-5-methanesulfonamide succinate) (10 мкМ), селективный антагонист 5-НТ2А-рецепторов кетансерин (3-[2-[4-(4-Fluorobenzoyl)-1-piperidinyl]ethyl]-2,4[1H,3H]-quinazolinedione tartrate) (10 мкМ), селективный антагонист 5-НТ2В,2С-рецепторов SB206553 (3,5-Dihydro-5-methyl-N-3-pyridinylbenzo[1,2-b:4,5-b']dipyrrole-1(2H)-carboxamide hydrochloride (10 мкМ), блокатор Са-зависимых калиевых каналов апамин (100 нМ) добавляли в перфузирующий раствор. Выбор концентраций веществ был основан на данных литературы (Holohean, Hackman, 2004; Hsiao et al., 1997). Время, необходимое для замены раствора в ванне, составляло порядка 40–60 с. Все реактивы были приобретены в Sigma-Aldrich или Tocris Bioscience.
Сравнение средних величин производилось с помощью парного t-критерия Стьюдента. Данные представлены как среднее ± стандартная ошибка среднего. Для статистического анализа и построения графиков использовали программы Sigma Plot 11.0 и MS Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поясничные мотонейроны идентифицировали по наличию антидромного потенциала действия, возникающего при стимуляции IX или X вентрального корешка. У всех нейронов измеряли входное сопротивление и характеристики вызванных антидромных ПД. В дальнейший анализ включали мотонейроны с мембранным потенциалом покоя от -60 мВ и амплитудой антидромного потенциала не менее 65 мВ. Средние значения электрофизиологических параметров мотонейронов в контроле и при действии агонистов 5-НТ1,2-рецепторов представлены в табл 1.
Действие агониста 5-НТ2А,В,С-рецепторов α-Ме-5-НТ на электрофизиологические свойства мотонейронов. Чтобы выявить эффект активации 5-НТ2-рецепторов на пассивные свойства мембраны мотонейронов, агонист 5-НТ2А,В,С-рецепторов α-Ме-5-НТ (10 мкМ) добавляли в перфузирующий раствор в условиях блока спайковой активности с помощью ТТХ (1 мкМ). α-Ме-5-НТ вызывал деполяризацию мембраны поясничных мотонейронов на 0.7–3.4 мВ (n = 5, парный t-тест, p < 0.05, рис. 1а, таблица 1), деполяризация не наблюдалась при совместной аппликации α-Ме-5-НТ и специфического антагониста 5-НТ2В,С-рецепторов SB206553 (рис. 1б) во всех исследованных клетках. Этот факт указывает на то, что в мембране мотонейрона экспрессированы 5-НТ2В,С-рецепторы. Входное сопротивление мембраны при аппликации α-Ме-5-НТ увеличивалось на 20% (табл. 1).
Рис. 1.
Действие агониста и антагониста 5-НТ2-рецепторов α-Ме-5-НТ и SB 206553 соответственно на МПП. а – аппликация α-Ме-5-НТ (10 мкМ, 2 мин) вызывает деполяризацию в мотонейроне (ТТХ-блок); б – деполяризация исчезает при совместной аппликации α-Ме-5-НТ и SB 206553 (10 мкМ).
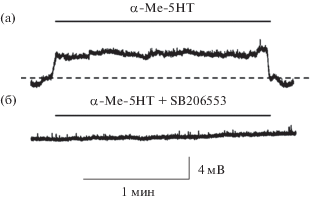
Таблица 1.
Сравнение свойств мотонейронов в контроле и в присутствии агонистов 5-НТ1,2-рецепторов
| Контроль | α-Ме-5-НТ | 8-ОН-DPAT | |
|---|---|---|---|
| Число мотонейронов (n) | 14 | 7 | 5 |
| Мембранный потенциал покоя, мВ | –67.2 ± 1.6 | –63.7 ± 2.7 * | –66.5 ± 1.2 |
| Входное сопротивление, МОм | 7.3 ± 0.7 | 8.8 ± 0.8 * | 7.0 ± 0.6 |
| Амплитуда антидромного ПД, мВ | 75 ± 2 | 73 ± 5 | 75 ± 2 |
| Полуширина антидромного ПД, мс | 0.79 ± 0.03 | 1.1 ± 0.2 * | 0.83 ± 0.02 |
| Быстрая фаза следовой гиперполяризации (fАНР), мВ | –12.9 ± 1.2 | –8.6 ± 1.5 * | –10.7 ± 1.3 |
| Средняя фаза следовой гиперполяризации (mАНР), мВ | –3.0 ± 0.2 | –1.7 ± 0.5 * | –2.5 ± 0.4 |
| Число вызванных антидромных ПД за секунду | 1.0 ± 0.0 | 10.0 ± 3.0 * | 2.5 ± 0.5 (В) 0.5 ± 0.5 (Т) |
Эффекты активации 5-НТ2-рецепторов на активные свойства мембраны мотонейронов изучали на вызванных антидромных ПД. Аппликация α‑Ме-5-НТ вызывала увеличение полуширины антидромного ПД, а также уменьшение амплитуды быстрой фазы следовой гиперполяризации (fАНР) на 25–38% и средней фазы (mAHP) примерно в 2 раза (n = 7, p < 0.05, таблица, рис. 2). При отмывке fАНР восстанавливалась к исходному значению, однако восстановления mAHP не происходило (рис. 2а).
Рис. 2.
Действие агонистов и антагониста 5-НТ1,2-рецепторов на fAHP и mAHP антидромного ПД. а – слева направо: контроль, при аппликации α-Ме-5-НТ, отмывка. Аппликация агониста 5-НТ2-рецепторов α-Ме-5-НТ (10 мкМ) вызывает уменьшение fAHP и mAHP антидромного ПД, при отмывке не происходит восстановления mAHP; б – антагонист 5-НТ2-рецепторов SB 206553 (10 мкМ) (справа) нивелирует действие агониста (слева). Контроль (черный цвет), вещество (серый цвет); в – диаграммы, иллюстрирующие достоверное уменьшение амплитуды fAHP и mAHP под действием агонистов и антагониста 5-НТ2-рецепторов.
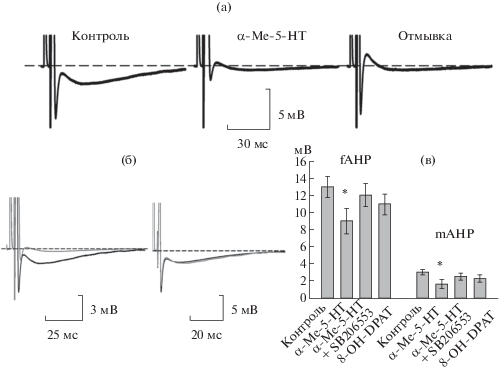
Антагонист 5-НТ2А-рецепторов кетансерин (10 мкМ) и селективный антагонист 5-НТ2В,С -рецепторов SB 206553 (10 мкМ), добавленные в перфузирующий раствор совместно с агонистом α‑Ме-5-НТ, нивелировали эффект последнего (n = 5, рис. 2б).
Добавление α-Ме-5-НТ также увеличивало число вызванных антидромных ПД в несколько раз (рис. 3а, б, регистрации ПД проводилась в течение 1 с, n = 5). При совместной аппликации α-Ме-5-НТ и антагониста 5-НТ2А-рецепторов кетансерина наблюдался тот же самый эффект (рис. 3в), в то время как при совместной аппликации α-Ме-5-НТ и антагониста 5-НТ2В,С-рецепторов SB206553 число антидромных ПД не изменялось по сравнению с контролем (рис. 3г).
Рис. 3.
Действие агониста и антагонистов 5-НТ2-рецепторов α-Ме-5-НТ, кетансерина и SB206553 соответственно на число антидромных ПД. а – контроль (2 отдельных пробега), б – при аппликации α-Ме-5-НТ (10 мкМ) (2 отдельных пробега); в – сверху вниз: контроль, при совместной аппликации α-Ме-5-НТ и кетансерина без стимуляции и при стимуляции (одиночные пробеги); для а–в: калибровка 50 мВ, развертка 1 с; г – контроль (слева), при совместной аппликации α-Ме-5-НТ и SB206553 (10 мкМ) (справа), наложение 10 пробегов; а–в и г – два разных мотонейрона. Заметьте отсутствие повторяющихся разрядов при совместной аппликации α-Ме-5-НТ и SB206553; д – действие α-Ме-5- НТ на латентность первого ПД, вызванного стимуляцией дорсального корешка.
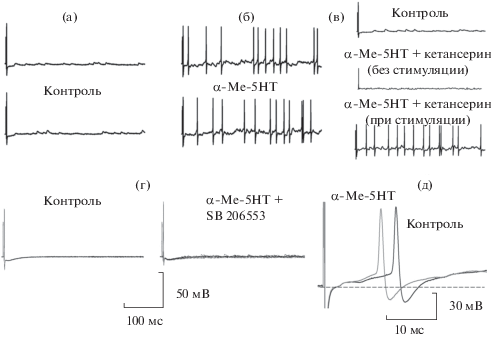
Для антидромного ПД мы не могли измерить латентность, т.к. она маскируется артефактом стимула, но мы могли регистрировать ее у ПД, вызванного стимуляцией дорсального корешка. Средняя латентность ПД, возникающего на стимуляцию дорсального корешка (считая от артефакта стимула) в контроле составила 25 ± 6 мс, при этом минимальная латентность для первого спайка была 12 мс, и максимальная латентность для последнего спайка – 67 мс. Через 3 мин аппликации α-Me-5-HT средняя латентность составила 18.6 ± 1.4 мс, минимальная латентность для первого спайка 8 мс (рис. 3д), и максимальная латентность для последнего спайка 29 мс. Этот факт также может свидетельствовать об увеличении возбудимости мембраны мотонейрона.
Действие агонистов 5-НТ1-рецепторов на электрофизиологические свойства мотонейронов. В отличие от α-Ме-5-НТ, агонист 5-НТ1А/7-рецепторов 8-ОН-DPAT не вызывал деполяризацию мембраны и не изменял входное сопротивление, однако амплитуда mAHP уменьшилась в трех клетках из пяти (в гораздо меньшей степени, чем от α-Ме-5-НТ, таблица и рис. 4а). По-видимому, даже этого незначительного уменьшения было достаточно, чтобы вызвать увеличение числа антидромных ПД в первые минуты аппликации вещества. Но позже развивался тормозный эффект, вплоть до полного угнетения ПД. Агонист 5-НТ1B,D-рецепторов суматриптан (n = 4) не оказывал заметного влияния на форму следовой гиперполяризации.
Рис. 4.
Действие агониста 5-НТ1А,7-рецепторов 8-OH-DPAT на электрофизиологические параметры мотонейрона. а – действие на амплитуду fAHP и mAHP антидромного ПД; б – время-зависимый эффект 8-OH-DPAT на частоту и время возникновения антидромного ПД. Сверху вниз: контроль, 3, 10 и 15 мин аппликации 8-OH-DPAT (10 мкМ), калибровка 50 мВ; в (слева) – влияние на полевой антидромный потенциал в контроле и через 5 и 14 мин аппликации 8-OH-DPAT; в (справа) – график зависимости средней амплитуды антидромного полевого потенциала (ось у) от времени аппликации агониста (ось х) для индивидуального мотонейрона.
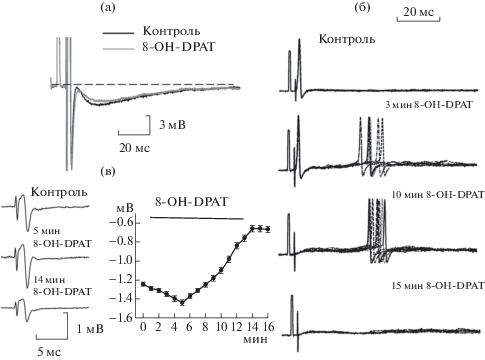
В то же время 8-ОН-DPAT оказывал время-зависимый эффект на число спайков и время их возникновения: в первые 3–7 мин аппликации 8-ОН-DPAT наблюдалось увеличение числа ПД, затем через 10 мин латентный период возникновения первого вызванного ПД увеличивался на 40–60 мс по сравнению с контролем, а через 15 мин ПД полностью исчезали (рис. 4б). Таким образом, 8-ОН-DPAT первоначально увеличивал возбудимость мотонейронов, а затем уменьшал ее. Аналогичный время-зависимый эффект действия 8-ОН-DPAT мы наблюдали при регистрации антидромного полевого потенциала: в первые 3–5 мин – увеличение амплитуды полевого потенциала, а затем снижение ее через 15 мин (рис. 4в).
Увеличение возбудимости мотонейронов реализуется через модуляцию работы Са-зависимых калиевых каналов. Известно, что mAHP опосредуется Са2+-зависимыми К+-каналами (SK-каналы), которые блокируются апамином [22, 29, 24, 30 ]. Уменьшение амплитуды mAHP под действием α-Ме-5-НТ может быть обусловлено как ослаблением тока через SK-каналы, вызванным их негативной модуляцией, либо увеличением катионных токов через кальциевые или натриевые каналы, маскирующих mAHP и обеспечивающих следовую деполяризацию. Чтобы выявить механизм действия агонистов серотониновых рецепторов на следовые процессы, мы использовали фармакологический подход. Аппликация апамина (100 нМ) уменьшала амплитуду mAHP, а также выявляла следовую деполяризацию. При совместной аппликации апамина и α-Ме-5-НТ дополнительных эффектов не наблюдалось (рис. 5). Таким образом, активация 5-НТ2А,В,С-рецепторов с помощью агониста α-Ме-5-НТ приводит к ослаблению тока через SK-каналы.
ОБСУЖДЕНИЕ
В мембране мотонейронов спинного мозга млекопитающих экспрессируются несколько типов серотониновых рецепторов: 5-HT1A,В,D, 5-HT2A,B,C и 5-HT5A (Perrier et al., 2013). В наших экспериментах аппликация агониста 5-НТ2А,В,С-рецепторов α‑Ме-5-НТ вызывала деполяризацию мембраны мотонейрона, деполяризация не развивалась при совместной аппликации α-Ме-5-НТ со специфическим антагонистом 5-НТ2В,С-рецепторов SB206553. В данной работе мы также показали, что α-Ме-5-НТ уменьшает амплитуду mAHP и увеличивает число антидромных ПД. Этот эффект нивелировался при аппликации антагониста SB 206553. Агонист 5-НТ1А-рецепторов 8-ОН-DPAT оказывал время-зависимый эффект на количество антидромных ПД, вызывая вначале кратковременное возбуждающее, а позже тормозное действие. Таким образом, наши электрофизиологические и фармакологические данные свидетельствуют о наличии 5-НТ1А и 5-НТ2В,С-рецепторов на постсинаптической мембране мотонейронов спинного мозга лягушки.
Одним из хорошо известных механизмов действия 5-НТ является уменьшение амплитуды mAHP, которая опосредуется Са2+-зависимыми апамин-чувствительными К+ каналами (SK каналами) [24, 30]. Фармакологические тесты показали, что 5-НТ, добавленный к внеклеточной среде, ингибирует mAHP в спинальных мотонейронах [24], гипоглоссальных мотонейронах [19], тройничных мотонейронах [20] или мотонейронах-закрывателях челюсти, [31]. mAHP играет важную роль в установлении частоты разрядов мотонейронов за счет задержки появления следующего потенциала действия. Таким образом, модуляция mAHP является очевидной мишенью для тонкой настройки активности мотонейронов. Perrier и Delgado-Lezama показали, что синаптически высвобождаемый 5-НТ из ядер шва также ингибирует mAHP мотонейронов [32]. В результате частота разрядов сильно возрастает. Большинство исследований согласуются с тем, что это действие 5-НТ обусловлено активацией 5-НТ1А-рецепторов [24, 19, 25, ].
Наши результаты хорошо согласуются с экспериментами, проведенными на мотонейронах морской свинки [20], в которых авторами было показано, что аппликация в ванну 10 мкМ 5-НТ снижает максимальную амплитуду mAHP на 51%, что является результатом снижения кальций-зависимого калиевого тока, лежащего в основе mAHP. В наших исследованиях амплитуда mАНР снижалась под действием агониста 5-НТ2А,В,С-рецепторов α-Ме-5-НТ, но не агониста 5-НТ1А-рецепторов 8-ОН-DPAT, как это было показано на спинальных мотонейронах черепахи [3, 24], крысы [19] и миноги [25]. В исследовании на миноге аппликация агониста 5-НТ2 рецепторов (α-CH3-5-HT) также вызывала уменьшение амплитуды mAHP, причем этот эффект нивелировался с помощью антагониста 5‑НТ2А и D2 типа дофаминовых рецепторов спиперона, но не специфического антагониста 5-НТ2А-рецепторов кетансерина [25]. Возможно, это различие указывает на то, что типы 5-НТ-рецепторов, участвующие в модуляции мембранных свойств мотонейронов, могут различаться между разными видами животных. Можно также предположить, что после перерезки серотонинергических волокон из ядер шва (через 4–30 ч, которые проходят от момента перерезки до регистрации) увеличивается экспрессия 5-НТ2-рецепторов, как, например, это было показано для 5-НТ2С-рецепторов у мышей, где повреждение спинного мозга вызывало увеличение количества и плотности 5-HT2C-рецепторов в вентральном роге поясничного отдела спинного мозга [33].
В данной работе мы выявили, что агонист 5-НТ1А-рецепторов 8-ОН-DPAT оказывал время-зависимый эффект на число ПД, вызывая вначале кратковременное возбуждающее, а позже тормозное действие (рис. 4). В статье Cotel и соавт. показано, что активация 5-НТ1А-рецепторов тормозит генерацию ПД [34]. Таким образом, можно предположить совместную модуляцию аккомодационных свойств мотонейрона двумя типами серотониновых рецепторов 5-НТ2В,С и 5-НТ1А. Если активация 5-НТ2В,С-рецепторов усиливает частоту повторяющихся разрядов, то более поздняя активация 5-НТ1А-рецепторов оказывает тормозный эффект. Полученные данные укладываются в гипотезу, согласно которой одни подтипы 5-НТ-рецепторов (в частности, 5-НТ2), усиливающие реакции фосфорилирования, оказывают возбуждающее действие в ЦНС, а другие подтипы (в частности, 5-НТ1), ингибирующие реакции фосфорилирования, оказывают тормозное действие [35].
Список литературы
Nakamura K., Wong-Lin K. Functions and computational principles of serotonergic and related systems at multiple scales. Front. Integr. Neurosci. 8: 1–2. 2014.
Ghosh M., Pearse D. The role of the serotonergic system in locomotor recovery after spinal cord injury. Frontiers in Neural Circuits, Article 151. 8: 1–14. 2015. https://doi.org/10.3389/fncir.2014.00151
Perrier J.-F., Rasmussen H.B., Christensen R.K., Petersen A.V. Modulation of the intrinsic properties of motoneurons by serotonin. Current Pharmaceutical Design. 19: 4371–4384. 2013.
Jacobs B.L., Fornal C.A. 5-HT and motor control: a hypothesis. Trends Neurosci. 16: 346–352. 1993.
Wallis D.I. 5-HT receptors in.ved in initiation or modulation of motor patterns: Opportunities for drug development. Trends Pharmacol. Sci. 15: 288–292.
Takahashi T., Berger A.J. Direct excitation of rat spinal motoneurones by serotonin. J. Physiol. (Lond). 423: 63–76. 1990.
Garraway S.M., Hochman S. Modulatory actions of serotonin, norepinephrine, dopamine, and acetylcholine in spinal cord deep dorsal horn neurons. J. Neurophysiol. 86: 2183–2194. 2001.
Ciranna L. Serotonin as a modulator of glutamate- and GABAmediated neurotransmission: implications in physiological functions and in pathology. Curr Neuropharmacol. 4: 101–114. 2006.
Fink K.B., Gőthert M. 5-HT receptor regulation of neurotransmitter release. Pharmacol. Rev. 59: 360–417. 2007.
Hannon J., Hoyer D. Molecular biology of 5-HT receptors. Behav. Brain Res. 195: 198–213. 2008.
El Manira A., Zhang W., Svensson E., Bussieres N.K. 5-HT inhibits calcium current and synaptic transmission from sensory neurons in lamprey. J. Neurosci. 17: 1786–1794. 1997.
Sillar K.T., Simmers A.J. Presynaptic inhibition of primary afferent transmitter release by 5-hydroxytryptamine at a mechanosensory synapse in the vertebrate spinal cord. J. Neurosci. 74: 2636–2647. 1994.
Holohean A.M., Hackman J.C., Davidoff R.A. Changes in membrane potential of frog motoneurons induced by activation of serotonin receptor subtypes. Neuroscience. 34: 555–564. 1990.
Holohean A.M., Hackman J.C., Shope S.B., Davidoff R.A. Activation of 5-HT1C/2 receptors depresses polysynaptic reflexes and excitatory amino acid-induced motoneuron responses in frog spinal cord. Brain Res. 579: 8–16. 1992.
Holohean A.M., Hackman J.C. Mechanisms intrinsic to 5-HT2B receptor-induced potentiation of NMDA receptor responses in frog motoneurones. Br. J. Pharmacol. 143 (3): 351–360. 2004.
Ovsepian S.V., Vesselkin N: Serotonergic modulation of synaptic transmission and action potential firing in frog motoneurons. Brain Research, 1102: 71–77. 2006. https://doi.org/10.1016/j.brainres.2006.04.035
Калинина Н.И., Курчавый Г.Г., Зайцев A.В., Веселкин Н.П. Пресинаптическая серотонинергическая модуляция спонтанной и миниатюрной синаптической активности в поясничных мотонейронах лягушки. Ж. эвол. биох. и физиол. 52 (5): 328–3362016. [Kalinina N.I., Kurchavyi G.G., Zaitsev A.V., Veselkin N.P. Presynaptic serotonergic modulation of spontaneous and miniature synaptic activity in frog lumbar motoneurons. J. Evol. Biochem. Physiol. 52 (5): 359–368. 2016.]
Kalinina N.I., Zaitsev A.V., Vesselkin N.P. Presynaptic serotonin 5-HT1B/D receptor mediated inhibition of glycinergic transmission to the frog spinal motoneurons. J.Comp. Physiol. A. 204 (3): 329–337. 2018. https://doi.org/10.1007/s00359-017-1244-y
Bayliss D.A., Umemiya M., Berger A.J. Inhibition of N- and P-type calcium currents and the after-hyperpolarization in rat motoneurones by serotonin. J. Physiol. 485: 635–47. 1995.
Hsiao C.F., Trueblood P.R., Levine M.S., Chan S.H. Multiple effects of serotonin on membrane properties of trigeminal motoneurons in vitro. J. Neurophysiol. 77: 2910–2924. 1997.
Wallen P., Buchanan J.T., Grillner S., Hill R.H., Christenson J., Hokfelt T. Effects of 5-hydroxytryptamine on the afterhyperpolarization, spike frequency regulation, and oscillatory membrane properties in lamprey spinal cord neurons. J. Neurophysiol. 61: 759–768. 1989.
Meer D.P., Buchanan J.T. Apamin reduces the late afterhyperpolarization of lamprey spinal neurons, with little effect on fictive swimming. Neurosci. Lett. 143: 1–4. 1992.
Miles G.B., Sillar K.T. Neuromodulation of vertebrate locomotor control networks. Physiology. 26: 393–41. 2011. https://doi.org/10.1152/physiol.00013.2011
Grunnet M., Jespersen T., Perrier J-F. 5-HT1A receptors modulate small-conductance Ca2-activated K channels. J. Neurosci. Research. 78: 845–854. 2004. https://doi.org/10.1002/jnr.20318
Wikstrom M., Hill R., Hellgren J., Grillner S. The action of 5-HT on calcium-dependent potassium channels and on the spinal locomotor network in lamprey is mediated by 5-HT1A like receptors. Brain Res. 678 (1–2): 191–199. 1995. doi: 0006-8993 (95)00183-Q.
Harvey P.J., Li X., Li Y., Bennett D.J. 5-HT2 receptor activation facilitates a persistent sodium current and repetitive firing in spinal motoneurons of rats with and without chronic spinal cord injury. J. Neurophysiol. 96 (3): 1158–1170. 2006. https://doi.org/10.1152/jn.01088.2005
Murray K.C., Stephens M.J., Ballou E.W., Heckman C.J., Bennett D.J. Motoneuron excitability and muscle spasms are regulated by 5-HT2B and 5-HT2C receptor activity. J. Neurophysiol. 105: 731–748. 2011.
Perrier J.F., Hounsgaard J. 5-HT2 receptors promote plateau potentials in turtle spinal motoneurons by facilitating an L-type calcium current. J. Neurophysiol. 89: 954–959. 2003.
Sah P. Ca2+-activated K+ currents in neurones: types, physiological roles and modulation. TINS. 19 (4): 150–154. 1996. https://doi.org/10.1016/S0166-2236
Li X., Bennett D.J. Apamin-sensitive calcium-activated potassium currents (SK) are activated by persistent calcium currents in rat motoneurons. J. Neurophysiol. 97: 3314–3330. 2007.
Inoue T., Itoh S., Kobayashi M., Kang Y., Matsuo R., Wakisaka S., Morimoto T. Serotonergic modulation of the hyperpolarizing spike afterpotential in rat jaw-closing motoneurons by PKA and PKC. J. Neurophysiol. 82: 626–637. 1999.
Perrier J.F., Delgado-Lezama R. Synaptic release of serotonin induced by stimulation of the raphe nucleus promotes plateau potentials in spinal motoneurons of the adult turtle. J. Neurosci. 25: 7993–7999. 2005.
Husch A., Van Patten G.N., Hong D.N., Scaperotti M.M., Cramer N., Harris-Warrick R.M. Spinal cord injury induces serotonin supersensitivity without increasing intrinsic excitability of mouse V2a interneurons. J. Neuroscience. 32: 13145–13154. 2012.
Cotel F., Exley R., Cragg S.J., Perrier J.-F Serotonin spillover onto the axon initial segment of motoneurons induces central fatigue by inhibiting action potential initiation. PNAS Early Edition. 1–6. 2013. https://doi.org/10.1073/pnas.1216150110
Hochman S., Garraway S.M., Machacek D.W., Shay B.L. 5-HT receptors and the neuromodulatory control of spinal cord function. Motor Neurobiology of the Spinal Cord / Ed Timothy C. Cope. CRC Press. 47–88. 2001. https://doi.org/10.1201/9781420042641.ch3
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии



