Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 4, стр. 263-271
ВЛИЯНИЕ ДИЕТА-ИНДУЦИРОВАННОГО И МЕЛАНОКОРТИНОВОГО ОЖИРЕНИЯ НА ЭКСПРЕССИЮ ТРИПТОФАНГИДРОКСИЛАЗЫ 2 ТИПА В ДОРСАЛЬНОМ ЯДРЕ ШВА И ВЕНТРАЛЬНОЙ ПОКРЫШКЕ СРЕДНЕГО МОЗГА У МЫШЕЙ
Е. В. Михайлова 1, И. В. Романова 1, К. В. Деркач 1, О. Н. Вишневская 1, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 10.11.2018
После доработки 14.03.2019
Принята к публикации 01.04.2019
Аннотация
Серотонин и его сигнальные пути вовлечены в центральную регуляцию пищевого поведения и энергетического обмена, причем наиболее важную роль в этом играют дофаминергические нейроны дорсального ядра шва (DRN) и вентральной области покрышки (VTA), в которых экспрессируется триптофангидроксилаза 2 типа (ТПГ2), катализирующая скорость-лимитирующую стадию синтеза серотонина. Изменение активности серотонин-синтезирующей системы в DRN и VTA может вносить значительный вклад в развитие метаболических расстройств, в том числе ожирения. Однако данные по экспрессии ТПГ2 в DRN и VTA при ожирении отсутствуют. Цель работы состояла в сравнительном изучении с применением методов иммуногистохимии экспрессии ТПГ2 в DRN и VTA у самок мышей С57Bl/6J (a/a) с диета-индуцированным ожирением (ДИО), вызываемым 8- и 16-недельной высококалорийной диетой, и у агути-мышей С57Bl/6J (Ay/a) с генетически обусловленным меланокортиновым ожирением. С помощью двойного иммуномечения показано, что у ДИО-мышей с продолжительностью диеты 16 недель экспрессия ТПГ2 в DRN, основном источнике серотонина в мозге, снижается, а в VTA повышается. У агути-мышей экспрессия ТПГ2 в DRN не менялась, в VTA повышалась. У ДИО-мышей, находящихся на диете в течение 8 недель, и у мышей С57Bl/6J (a/a), резистентных к диете, экспрессия ТПГ2 в DRN и VTA не менялась. Таким образом, в DRN и VTA у ДИО-мышей при длительной (16 недель) диете и в VTA у агути-мышей с меланокортиновым ожирением выявлены специфичные изменения синтеза серотонина, отсутствующие у резистентных к диете мышей, что указывает на определяющую роль серотонинового сигналинга в ответе организма на избыточное потребление калорий.
ВВЕДЕНИЕ
Биогенный амин серотонин является одним из ключевых нейротрансмиттеров в ЦНС, осуществляя регуляцию широкого спектра биохимических и физиологических процессов в мозге. Установлено, что в ЦНС серотонин синтезируется преимущественно в дорсальном ядре шва (dorsal raphe nucleus, DRN) и, в меньшей степени, в вентральной покрышке среднего мозга (ventral tegmental area, VTA) [1–3]. Отростки серотонинергических нейронов, локализованных в DRN и VTA, формируют проекции, идущие к нейронам другой эргичности, которые располагаются в гипоталамусе и других отделах мозга. Они контролируют не только поведение и эмоции, но также потребление пищи и расход энергии и, как следствие, вовлечены в регуляцию липидного и углеводного обмена и чувствительности тканей к инсулину [4]. В условиях ожирения меняются мотивация к потреблению пищи и чувство насыщения, результатом чего являются гиперфагия, нарушение энергетического баланса и инсулиновая резистентность, а в этих процессах ключевую роль играют пептидергические и моноаминергические системы мозга, в том числе серотониновая система в DRN и VTA. Вследствие этого, одной из актуальных задач современной молекулярной эндокринологии и физиологии является изучение процессов биосинтеза серотонина в DRN и VTA при метаболических расстройствах. Важнейшим ферментом, отвечающим за синтез серотонина в этих областях мозга, является триптофангидроксилаза 2 типа (ТПГ2), которую рассматривают как маркер серотонинергических нейронов [5, 6].
ТПГ2, специфичная для ЦНС изоформа триптофангидроксилазы, катализирует скорость-лимитирующую стадию синтеза серотонина – гидроксилирование 5-гидрокситриптофана. Уровень экспрессии ТПГ2 в DRN и VTA многократно превосходят таковые в других отделах мозга, что обусловлено высокой интенсивностью синтеза серотонина в DRN и VTA [3]. Необходимо отметить, что если в DRN в основном происходит синтез серотонина, то в VTA среди синтезируемых моноаминов превалирует дофамин, что ассоциировано с высоким уровнем экспрессии фермента тирозингидроксилазы, катализирующей скорость-лимитирующую стадию синтеза дофамина – конверсию тирозина в L-дигидроксифенилаланин. Вследствие этого, VTA обогащена дофаминергическими нейронами, а ТПГ2 в нейронах этой области мозга локализована совместно с тирозингидроксилазой [3].
Изучение экспрессии ТПГ2 в DRN и VTA при ожирении и других метаболических расстройствах позволяет изучить активность в них системы синтеза серотонина и оценить функциональное состояние серотонинергической системы мозга, нарушения в которой могут стать как причиной, так и следствием этих расстройств. Ранее нами было показано, что в аркуатных ядрах гипоталамуса крысы и мыши при различных формах ожирения меняются экспрессия и распределение серотониновых рецепторов 1B- и 2C-подтипа. Это может рассматриваться, как функциональный ответ на изменение продукции серотонина и активности серотонинергических нейронов в DRN и VTA, прямо или опосредованно иннервирующих гипоталамические структуры [7, 8]. Важно отметить, что в настоящее время отсутствуют данные по экспрессии и функциональной активности ТПГ2 в DRN и VTA в условиях ожирения, метаболического синдрома и сахарного диабета 2-го типа.
В соответствии с вышесказанным, целью работы было с помощью иммуногистохимических методов сравнить экспрессию ТПГ2 в DRN и VTA у мышей с ожирением различной этиологии. Для исследования были выбраны две модели ожирения – диета-индуцированное ожирение (ДИО) у самок мышей С57Bl/6J (a/a), вызванное длительной (8 и 16 нед) высококалорийной диетой, и генетически обусловленное ожирение меланокортинового типа у самок мышей С57Bl/6J (Ay/a), для которых характерна гиперпродукция агути-сигнального пептида (ASIP2), ингибирующего активность меланокортиновых рецепторов. В этой связи необходимо отметить, что меланокортиновая система гипоталамуса, включающая специфичные для ЦНС меланокортиновые рецепторы 4-го типа, мишени для ASIP2, является ключевым регулятором энергетического обмена, глюконеогенеза и инсулиновой чувствительности на периферии, и подавление ее активности ведет к ожирению и другим метаболическим расстройствам [9].
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов были взяты виргинные самки мышей С57Bl/6J (a/a) (возраст 4 мес.) и самки агути-мышей С57Bl/6J (Ay/a) (возраст 4 мес.) с ожирением, вызванным мутацией в гене, кодирующем ASIP1. Мыши C57Bl/6J (a/a) были получены из питомника Рапполово (Ленинградская область, Россия), агути-мыши – из вивария Института цитологии и генетики СО РАН (Новосибирск, Россия). Все эксперименты проводили в полном соответствии с требованиями Этического комитета ИЭФБ РАН, European Communities Council Directive 1986 (2010/63/EEC) и правилами, изложенными в “Guide for the Care and Use of Laboratory Animals”.
После периода адаптации (две недели) мыши С57Bl/6J (a/a) были разделены на три группы – контроль, который содержали на стандартном сухом корме (группа К, n = 9), ДИО-мыши, которые получали высококалорийную диету в течение 8 (ДИО8, n = 9) или 16 нед (ДИО16, n = 12). В группе ДИО16 на заключительной стадии эксперимента была выделена группа резистентных к диете животных (ДИО16Р, n = 5). Высококалорийная диета включала животный жир, обогащенный насыщенными жирными кислотами (свиное сало), и 30%-ный раствор сахарозы, который животным давали вместо питьевой воды. Агути-мыши С57Bl/6J (Ay/a) (Агути, n = 9), как и контрольные животные, находились на стандартной диете.
Уровни глюкозы оценивали в крови, полученной из хвостовой вены, используя глюкометр “Life Scan Johnson & Johnson” (Дания) и тест-полоски “One Touch Ultra” (США). Образцы крови для определения уровней гормонов были взяты в конце эксперимента из сердца мышей после анестезии хлоралгидратом (400 мг/кг, в/б). Концентрацию инсулина определяли с помощью набора “Mouse Insulin ELISA” (Mercodia AB, Швеция), концентрацию лептина – с помощью набора “ELISA Kit for Leptin” (Cloud-Clone Corp., США).
Для иммуногистохимического анализа мышей анестезировали хлоралгидратом (400 мг/кг, в/б), транскардиально перфузировали 0.1 М Na+-фосфатным буфером (PB, рН 7.4) и раствором 4%-ного параформальдегида в 0.2 М PB. Мозг извлекали, дофиксировали в течение ночи в том же фиксаторе (+4°С) и после криопротекции в 30%-ном растворе сахарозы в 0.2 М PB, содержащем и 0.9% NaCl, замораживали.
Для иммуногистохимического исследования использовали фронтальные срезы мозга (16 мкм), монтированные на стеклах, как описано ранее [10]. От каждого животного получали 10–12 срезов из области VTA и 5–6 срезов из области DRN. Исследования проводили на чередующихся фронтальных срезах мозга (каждый десятый срез из области VTA и каждый пятый срез из области DRN монтировали на стекло). На срезах мозга контрольных и ДИО-мышей С57Bl/6J (a/a) из области, включающей крупноклеточную часть DRN, располагающуюся под полостью сильвиевого водопровода, проводили флуоресцентное иммуномечение, для чего использовали первичные антитела кролика к ТПГ2 (“Millipore Corp.”, США) и вторичные антитела цыпленка против кролика, конъюгированные с флуорохромом Alexa-488 (“Invitrogen”, США). На срезах мозга контрольных мышей, ДИО-мышей С57Bl/6J (a/a) и агути-мышей (Ay/а) из области VTA проводили двойное флуоресцентное иммуномечение с теми же антителами к ТПГ2, а также использовали первичные антитела мыши к тирозингидроксилазе, как основному маркеру дофаминергических нейронов (“Sigma”, США), и вторичные антитела осла против мыши, конъюгированные с флуорохромом Alexa-568 (“Invitrogen”, США). Для выявления ТПГ2 на срезах мозга контрольных и агути-мышей из области DRN проводили одиночное иммуномечение с помощью тех же первичных антител к ТПГ2. Использовали вторичные антитела козы против кролика, конъюгированные с биотином (“Vector Labs”, США), и комплекс стрептавидин-пероксидаза (“Sigma”, США). Визуализацию проводили с помощью 0.05%-ного раствора 3,3'-диаминобензидина в соответствии с протоколом, описанным ранее [11].
Анализ флуоресцентного иммуномечения проводили с помощью конфокального микроскопа DMI6000 и лазерной установки SP5 II (“Leiсa Microsystems”, Германия). Интенсивность свечения ТПГ2 в нейронах анализировали количественно с помощью пакета программ Leica LAS AF. Значения интенсивности свечения нормировали по их значениям в контроле. Микрофотографии одиночного иммуномечения получали с помощью микроскопа Carl Zeiss Imager A1 (“Carl Zeiss Micriscopy GmbH”, Германия) и анализировали с помощью программы ImageJ. Уровень экспрессии ТПГ2 рассчитывали по оптической плотности. Специфичность иммуногистохимических реакций проверяли с помощью негативного контроля.
Статистический анализ проводили с помощью программного обеспечения “GraphPad Prism 7” (“GraphPad Software”, США). Оценку нормальности распределения данных проводили с использованием теста D’Agostino–Pearson. В случае нормального распределения (α = 0.05) различия между группами оценивали с помощью непарного t-теста и рассматривали, как статистически значимые, при p < 0.05. Метаболические и гормональные показатели представлены как M ± SD, данные гистограмм как M ± SEM.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
У ДИО-мышей, находящихся на высококалорийной диете, повышались масса тела и доля жировой ткани, отмечалось возрастание уровней глюкозы, инсулина и лептина в крови, причем для мышей группы ДИО16 различия всех показателей с группой К были статистически значимыми (табл. 1). Необходимо отметить, что у части мышей группы ДИО16 приведенные показатели менялись слабо, и их объединили в группу “резистентных” к ожирению животных (ДИО16Р, n = 5). Таким образом, совокупность полученных нами данных указывает на то, что у мышей, находящихся на высококалорийной диете в течение 8 нед, метаболические изменения были выражены в небольшой степени, в то время как при более продолжительной, 16-недельной, диете метаболические и гормональные показатели у ДИО-мышей достоверно отличались от таковых в контроле. В группе ДИО16 на фоне ожирения отмечали снижение чувствительности тканей к инсулину, о чем свидетельствует повышение индекса инсулиновой резистентности, рассчитанное как произведение концентраций глюкозы и инсулина, которое в группе ДИО16 было на 97% выше, чем в контроле, и на 34 и 57% выше, чем в группах ДИО8 и ДИО16Р. В группе ДИО16 также отмечали выраженную гиперлептинемию – повышение уровня лептина на 114% в сравнении с контролем (p < 0.05), что является признаком развития резистентности тканей к лептину. Эти данные в целом согласуются с нашими ранними результатами [6, 7] и с данными других авторов, изучавших метаболические и гормональные показатели у ДИО-мышей [12, 13].
Таблица 1.
Масса тела, доля жировой ткани, уровни глюкозы, инсулина и лептина в крови у ДИО-мышей и агути-мышей
| К1/K2 | ДИО8 | ДИО16 | ДИО16Р | Агути | |
|---|---|---|---|---|---|
| Масса тела, г | 20.1 ± 1.0; 20.5 ± 0.6 | 22.7 ± 1.6 | 24.9 ± 1.3* | 22.1 ± 1.7 | 43.6 ± 1.5* |
| Доля жира, % | 1.33 ± 0.19; 1.49 ± 0.23 | 2.41 ± 0.42* | 2.85 ± 0.51* | 1.97 ± 0.45* | 10.02 ± 0.51* |
| Глюкоза, мМ | 5.6 ± 0.7; 5.4 ± 0.5 | 6.5 ± 0.8 | 7.2 ± 0.5* | 6.4 ± 0.9 | 9.8 ± 1.3* |
| Инсулин, нг/мл | 0.30 ± 0.08; 0.29 ± 0.07 | 0.38 ± 0.11 | 0.46 ± 0.09* | 0.33 ± 0.14 | 0.87 ± 0.15* |
| Лептин, нг/мл | 1.38 ± 0.30; 1.51 ± 0.32 | 2.39 ± 0.34* | 2.96 ± 0.48* | 1.97 ± 0.52 | 11.41 ± 3.17* |
Агути-мыши, несмотря на то, что находились на стандартной диете, имели массу тела, в два раза превышающую таковую у контрольных мышей, и в значительной степени увеличенную долю жировой ткани. У них также отмечали повышенные уровни глюкозы, инсулина и лептина (табл. 1). Эти данные свидетельствуют о развитии у агути-мышей гипергликемии, гиперинсулинемии и сильно выраженной гиперлептинемии, что является характерной чертой снижения активности меланокортиновых сигнальных путей [9].
При изучении с помощью иммуногистохимических методов экспрессии фермента ТПГ2 в DRN и VTA ДИО-мышей были получены следующие результаты. Показано, что в группе ДИО8 с относительно слабо выраженными метаболическими нарушениями существенных изменений экспрессии ТПГ2 в DRN и VTA выявлено не было, в то время как в группе ДИО16 экспрессия ТПГ2 в этих структурах мозга достоверно отличалась от таковой в контроле (рис. 1, 2). При этом изменения экспрессии фермента были разнонаправленными – в DRN отмечали снижение экспрессии ТПГ2 на 36%, в VTA экспрессия ТПГ2, напротив, была повышена на 68% (в обоих случаях – P < 0.05 в сравнении с контролем). Поскольку DRN вносит основной вклад в общий пул серотонина, синтезируемого в ЦНС, то значительное снижение экспрессии ТПГ2 в DRN свидетельствует о дефиците серотонина в мозге, что согласуется с данными о снижении внутримозгового уровня серотонина в ЦНС при ожирении и метаболическом синдроме [14–16], а также об эффективности восполнения его дефицита с помощью интраназально вводимого серотонина [17] или селективных ингибиторов обратного захвата серотонина [18]. Показано также, что пациенты с ожирением и инсулиновой резистентностью имеют сниженную активность ТПГ2 [19]. По результатам двойного иммуномечения в VTA контрольных и ДИО-мышей отмечали отчетливо выраженную колокализацию ТПГ2 и тирозингидроксилазы, что указывает на функциональную взаимосвязь между дофаминовыми и серотониновыми путями в структурах среднего мозга [8, 20].
Рис. 1.
Экспрессия триптофангидроксилазы 2 типа (ТПГ2) в дорсальном ядре шва (DRN) у С57Bl/6J-мышей с диета-индуцированным ожирением.
(а–г) – флуоресцентное иммуномечение; (д) – гистограмма. (а) – контроль; (б) – ДИО8; (в) – ДИО16; (г) – ДИО16Р. Значения интенсивности свечения у ДИО-мышей нормированы по отношению к контрольной группе, где этот показатель принят за 1.0 усл.ед. * – различия с контролем статистически значимы при p < 0.05. Масштаб 50 мкм.
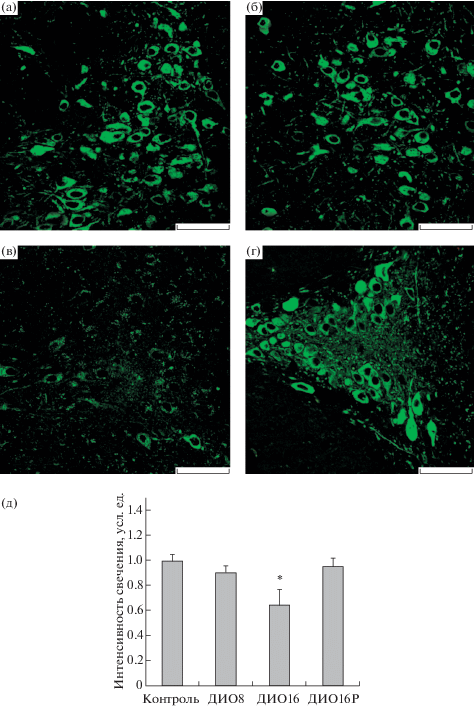
Рис. 2.
Экспрессия триптофангидроксилазы 2 типа (ТПГ2) в вентральной покрышке среднего мозга (VTA) у мышей С57Bl/6J с диета-индуцированным ожирением.
(а–г) – флуоресцентное иммуномечение; (д) – гистограмма. а – контроль; б – ДИО8; в – ДИО16; г – ДИО16Р. Значения интенсивности свечения у ДИО-мышей нормированы по отношению к контрольной группе, где этот показатель принят за 1.0 усл. ед. * – различия с контролем статистически значимы при p < 0.05. Сплошные стрелки – ТПГ2, локализованная в тирозингидроксилаза-иммунопозитивных нейронах, прерывистые стрелки – ТПГ2, локализованная в других структурах. Масштаб 20 мкм.
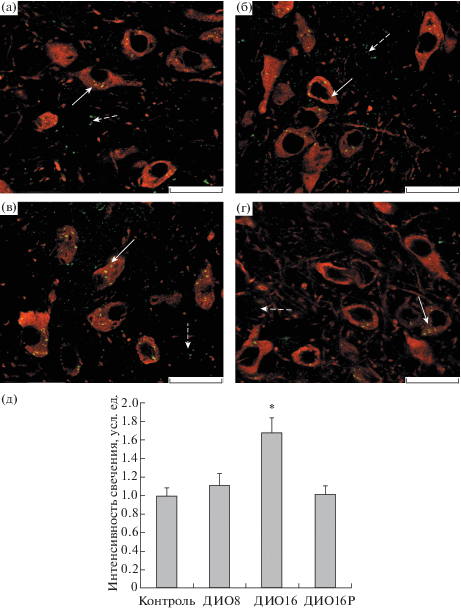
Представляет интерес тот факт, что экспрессия ТПГ2 в DRN и VTA ДИО-мышей с резистентностью к высококалорийной диете (ДИО16Р) не менялась в сравнении с контролем и достоверно отличалась от таковой у ДИО-мышей, чувствительных к диете (ДИО16) (рис. 1, 2). Полученные данные указывают на то, что сохранение активности серотониновых путей и, как можно полагать, всей интегративной системы сигнальных каскадов мозга, запускает адаптационные механизмы, препятствующие негативному влиянию высококалорийной диеты на метаболические и гормональные показатели у ДИО-мышей. Другие авторы также выявляли группы животных, устойчивых к высококалорийной диете, хотя и не связывали резистентность c активностью серотониновых путей в ЦНС [21].
Выдвигаются две основные гипотезы развития резистентности к диете. Первая основывается на различиях в способности белой жировой ткани аккумулировать избыточное количество калорий, поступающих с пищей, что, в свою очередь, определяется способностью жировой ткани образовывать новые кровеносные сосуды. Усиление ангиогенеза в белой жировой ткани способствует ее разрастанию и является фактором, усиливающим ДИО [22, 23]. В соответствии со второй гипотезой, ключевую роль в регуляции чувствительности организма к высококалорийной диете играет активность сигнальных систем гипоталамуса и других отделов мозга, ответственных за функционирование систем вознаграждения и подкрепления, контроль аппетита и энергетического обмена и за взаимодействие между этими системами. На примере ДИО-грызунов показано, что существует врожденная генетическая предрасположенность к резистентности тканей мозга к инсулину и лептину, а также к развитию нарушений синтеза и обмена серотонина и других моноаминов в гипоталамусе. Чем быстрее на фоне избыточного потребления калорий возникают такие нарушения, тем ниже устойчивость к высококалорийной диете [24]. Наши результаты являются подтверждением второй, “сигнальной”, гипотезы ДИО-резистентности.
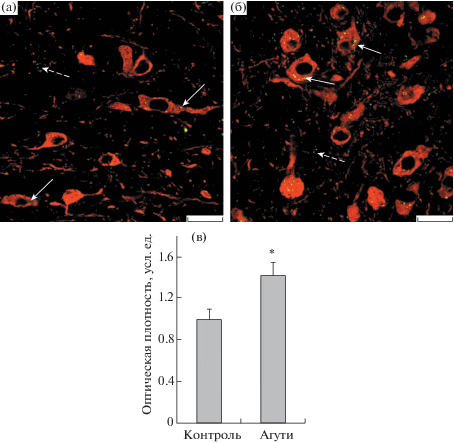
Исследование экспрессии ТПГ2 в DRN агути-мышей с меланокортиновым ожирением не выявило существенных ее отличий от контроля, в то время как в VTA экспрессия фермента у агути-мышей была повышена в сравнении с контролем на 42% (p < 0.05) (рис. 3, 4). Эти данные указывают на то, что, в отличие от ДИО, при генетически обусловленном меланокортиновом типе ожирения происходит компенсаторное повышение уровня серотонина в VTA. Ранее нами было показано, что экспрессия серотониновых рецепторов 1B- и 2C-подтипов на нейронах аркуатных ядер гипоталамуса, экспрессирующих проопиомеланокортин (ПОМК), заметно повышается, что свидетельствует об усилении стимулирующего влияния на них серотонина в условиях меланокортинового ожирения [8]. Наряду с этим было выявлено значительное повышение экспрессии гена, кодирующего ПОМК, являющийся предшественником меланокортиновых пептидов с анорексигенной активностью. Следует отметить, что стимулирующий эффект серотонина на экспрессию ПОМК осуществляется через посредство серотониновых рецепторов 2C-подтипа, расположенных на ПОМК-экспрессирующих нейронов [25]. В условиях ожирения меланокортинового типа в гипоталамусе агути-мышей также меняется активность дофаминергической системы, что, как можно полагать, опосредуется изменениями выброса дофамина VTA-нейронами [7, 8]. Вследствие этого повышение синтеза серотонина этими нейронами у агути-мышей может быть функционально связано с изменением в них активности тирозингидроксилазы и синтеза дофамина.
Рис. 3.
Иммуногистохимическая реакция к триптофангидроксилазе 2 типа (ТПГ2) в дорсальном ядре шва (DRN) агути-мышей.
а, б – одиночное иммуномечение для групп К и Агути соответственно; в – гистограмма. Стрелки указывают на тела нейронов с иммуноположительной реакцией к ТПГ2. Paq – periaqueductal gray. Масштаб 100 мкм.
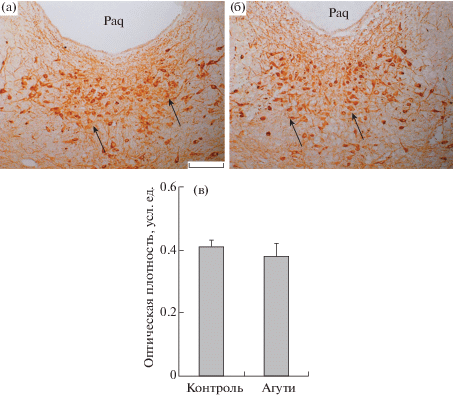
Рис. 4.
Иммуногистохимическая реакция к триптофангидроксилазе 2 типа (ТПГ2) в вентральной покрышке среднего мозга (VTA) агути-мышей.
а, б – флуоресцентное иммуномечение для групп К и Агути соответственно; в – гистограмма. Сплошные стрелки – ТПГ2, локализованная в тирозингидроксилаза-иммунопозитивных нейронах, прерывистые стрелки – ТПГ2, локализованная в других структурах. Значения интенсивности свечения нормированы по отношению к контролю. * – различия с контролем статистически значимы при p < 0.05. Масштаб 20 мкм.
Таким образом, нами впервые показано, что в DRN и VTA у чувствительных к высококалорийной диете С57Bl/6J-мышей с ДИО продолжительностью 16 нед и в VTA у агути-мышей с меланокортиновым типом ожирения меняется экспрессия ТПГ2, основного фермента синтеза серотонина, причем изменения характеризуются специфичностью для изученных нами типов ожирения. Так, у С57Bl/6J-мышей экспрессия ТПГ2 в DRN, основном источнике серотонина в мозге, снижается и при этом компенсаторно повышается в VTA-области, в то время как у агути-мышей экспрессия фермента повышается в VTA, но остается неизменной в DRN. Крайне важным является тот факт, что у С57Bl/6J-мышей, резистентных к высококалорийной диете, экспрессия ТПГ2 в DRN и VTA, а соответственно и синтез в них серотонина, не меняются. Эти данные указывают на важную роль синтеза серотонина в DRN и VTA и зависимых от серотонина сигнальных путей в ответе организма на избыточное потребление калорий.
Список литературы
Halliday G.M., Tork I. Serotonin-like immunoreactive cells and fibres in the rat ventromedial mesencephalic tegmentum. Brain Res. Bull. 22: 725–735. 1989.
Baker K.G., Halliday G.M., Hornung J.P., Geffen L.B., Cotton R.G., Tork I. Distribution, morphology and number of monoamine-synthesizing and substance P-containing neurons in the human dorsal raphe nucleus. Neuroscience. 42: 757–775. 1991.
Carkaci-Salli N., Salli U., Kuntz-Melcavage K.L., Pennock M.M., Ozgen H., Tekin I., Freeman W.M., Vrana K.E. TPH2 in the ventral tegmental area of the male rat brain. Brain Res. Bull. 84(6): P. 376–380. 2011. https://doi.org/10.1016/j.brainresbull.2011.01.006
Fox M.A., Jensen C.L., French H.T., Stein A.R., Huang S.J., Tolliver T.J., Murphy D.L. Neurochemical, behavioral, and physiological effects of pharmacologically enhanced serotonin levels in serotonin transporter (SERT)-deficient mice. Psychopharmacology (Berl.). 201: 203–218. 2008.
Walther D.J., Peter J.U., Bashammakh S., Hortnagl H., Voits M., Fink H., Bader M. Synthesis of serotonin by a second tryptophan hydroxylase isoform. Science. 299: 76. 2003.
Heydendael W., Jacobson L. Glucocorticoid status affects antidepressant regulation of locus coeruleus tyrosine hydroxylase and dorsal raphé tryptophan hydroxylase gene expression. Brain Res. 1288: 69–78. 2009. https://doi.org/10.1016/j.brainres.2009.06.082
Михайлова Е.В., Романова И.В., Деркач К.В., Бондарева В.М., Шпаков А.О. Количество и локализация серотониновых и дофаминовых рецепторов на гипоталамических проопиомеланокортин-иммунопозитивных нейронах мышей и их изменения при диета-индуцированном и меланокортиновом ожирении. Рос. Физиол. журн. им. И.М. Сеченова. 104(6): 683–691. 2018. [Mikhailova E.V., Romanova I.V., Der-kach K.V., Bondareva V.M., Shpakov A.O. The number and localization of the 5-hydroxytryptamine and dopamine receptors on the hypothalamic proopiomelanocortin-immunopositive neurons of mice and their changes in the diet-induced and melanocortin obesity. Ross. Physiol. Zhurn. im. I.M. Sechenova. 104(6): 683–691. 2018. (in Russ)].https://doi.org/10.7868/S0869813918060114
Romanova I.V., Derkach K.V., Mikhrina A.L., Sukhov I.B., Mikhailova E.V., Shpakov A.O. The leptin, dopamine and serotonin receptors in hypothalamic POMC-neurons in normal and obese rodents. Neurochem. Res. 43(4): 821–837. 2018. https://doi.org/10.1007/s11064-018-2485-z
Shpakov A.O., Derkach K.V. The melanocortin signal system of the hypothalamus and its functional state in type 2 diabetes mellitus and metabolic syndrome. Neurosci. Behav. Physiol. 47(5): 495–507. 2017. https://doi.org/10.1007/s11055-017-0426-y
Романова И.В., Михайлова Е.В., Шпаков А.О. Иммунохимическая идентификация меланокортиновых и лептиновых рецепторов на серотонинергических нейронах среднего мозга крыс. Рос. Физиол. журн. им. И.М. Сеченова. 104(1): 68–77. 2018. [Romanova I.V., Mikhailova E.V., Shpakov A.O. Immunochemical identification of the melanocortin and leptin receptors on serotoninergic neurons of the rat midbrain. Ross. Physiol. Zhurn. im. I.M. Sechenova. 104(1): 68–77. 2018. (in Russ)].
Романова И.В. Морфофункциональное взаимодействие CART-пептида и дофаминергических нейронов мозга. Журн. эвол. биохим. физиол. 49(1):78-84. 2013. [Romanova I.V. Morphfunctional interaction of cart-peptide and dopaminergic brain neurons. J. Evol. Biochem. Physiol. 49(1):78-84. 2013.(in Russ)].
Sousa-Lima I., Park S.Y., Chung M., Jung H.J., Kang M.C., Gaspar J.M., Seo J.A., Macedo M.P., Park K.S., Mantzoros C., Lee S.H., Kim Y.B. Methylsulfonylmethane (MSM), an organosulfur compound, is effective against obesity-induced metabolic disorders in mice. Metabolism. 65(10): 1508–1521. 2016. https://doi.org/10.1016/j.metabol.2016.07.007
Yashiro H., Takagahara S., Tamura Y.O., Miyahisa I., Matsui J., Suzuki H., Ikeda S., Watanabe M. A Novel Selective Inhibitor of Delta-5 Desaturase Lowers Insulin Resistance and Reduces Body Weight in Diet-Induced Obese C57BL/6J Mice. PLoS One. 11: e0166198. 2016. https://doi.org/10.1371/journal.pone.0166198
Muldoon M.F., Mackey R.H., Williams K.V., Korytkowski M.T., Flory J.D., Manuck S.B. Low central nervous system serotonergic responsivity is associated with the metabolic syndrome and physical inactivity. J. Clin. Endocrinol. Metab. 89: 266–271. 2004.
Herrera-Marquez R., Hernandez-Rodriguez J., Medina-Serrano J., Boyzo-Montes de Oca A., Manjarrez-Gutierrez G. Association of metabolic syndrome with reduced central serotonergic activity. Metab. Brain Dis. 26: 29–35. 2011.
Shpakov A.O., Derkach K.V., Berstein L.M. Brain signaling systems in the Type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Sci. OA. 1(3): FSO25. 2015. https://doi.org/10.4155/fso.15.23
Derkach K.V., Bondareva V.M., Chistyakova O.V., Berstein L.M., Shpakov A.O. The effect of long-term intranasal serotonin treatment on metabolic parameters and hormonal signaling in rats with high-fat diet/low-dose streptozotocin-induced type 2 diabetes. Int. J. Endocrinol. 2015: 245459. 2015. .https://doi.org/10.1155/2015/245459
Deuschle M. Effects of antidepressants on glucose metabolism and diabetes mellitus Type 2 in adults. Curr. Opin. Psychiatry. 26: 60–65. 2013.
Kloiber S., Kohli M.A., Brueckl T., Ripke S., Ising M., Uhr M., Menke A., Unschuld P.G., Horstmann S., Salyakina D., Muller-Myhsok B., Binder E.B., Holsboer F., Lucae S. Variations in tryptophan hydroxylase 2 linked to decreased serotonergic activity are associated with elevated risk for metabolic syndrome in depression. Mol. Psychiatry. 15: 736–747. 2010.
Шпаков А.О., Деркач К.В. Гормональные системы мозга и сахарный диабет 2-го типа. СПб: Изд-во Политехн. университета. 2015. [Shpakov A.O., Derkach K.V. Gormonal’nye sistemy mozga i saharnyj diabet 2-go tipa [Hormonal systems of a brain and diabetes of the 2nd type]. SPb: Izd-vo Politekhn. universiteta. 2015. (in Russ)].
Kim D.H., Gutierrez-Aguilar R., Kim H.J., Woods S.C., Seeley R.J. Increased adipose tissue hypoxia and capacity for angiogenesis and inflammation in young diet-sensitive C57 mice compared with diet-resistant FVB mice. Int. J. Obes. (Lond.). 37(6): 853–860. 2013. https://doi.org/10.1038/ijo.2012.141
Rupnick M.A., Panigrahy D., Zhang C.Y., Dallabrida S.M., Lowell B.B., Langer R., Folkman M.J. Adipose tissue mass can be regulated through the vasculature. Proc. Natl. Acad. Sci. USA. 99(16): 10730–10735. 2002.
Fukumura D., Ushiyama A., Duda D.G., Xu L., Tam J., Krishna V., Chatterjee K., Garkavtsev I., Jain R.K. Paracrine regulation of angiogenesis and adipocyte differentiation during in vivo adipogenesis. Circ. Res. 93(9): 88–97. 2003.
Levin B.E. Developmental gene x environment interactions affecting systems regulating energy homeostasis and obesity. Front. Neuroendocrinol. 31(3): 270–283. 2010.
Heisler L.K., Cowley M.A., Kishi T., Tecott L.H., Fan W., Low M.J., Smart J.L., Rubinstein M., Tatro J., Zigman J.M., Cone R.D., Elmquist J.K. Central serotonin and melanocortin pathways regulating energy homeostasis. Ann. N. Y. Acad. Sci. 994: 169–174. 2003.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


