Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 4, стр. 302-304
РАСПРЕДЕЛЕНИЕ ГАМКЕРГИЧЕСКИХ НЕЙРОНОВ В НЕОКОРТЕКСЕ КРЫС В ОТДАЛЕННЫЕ ПОСТНАТАЛЬНЫЕ СРОКИ ПОСЛЕ ПЕРИНАТАЛЬНОЙ ГИПОКСИИ
Л. И. Хожай 1, *, В. А. Отеллин 1
1 Институт физиологии им. И.П.Павлова РАН
Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 24.12.2018
После доработки 14.01.2019
Принята к публикации 05.02.2019
Основным тормозным синаптическим нейротрансмиттером в мозге человека и млекопитающих является ГАМК (гамма аминомасляная кислота). Во взрослом мозге существуют две изоформы глутамат декарбоксилазы (фермента синтеза ГАМК) 67КДа и 65КДа (GAD67 и GAD65). GAD65 в основном находится в пресинаптических терминалях ГАМергических интернейронов, а GAD67 распределена в цитоплазме нейронов, и ее, как правило, используют для маркировки ГАМКергических интернейронов. Экспрессия этого фермента может меняться в зависимости от активности нейрона [1]. Неокортекс является важной структурой конечного мозга, который выполняет основную роль в осуществлении многочисленных физиологических функций, таких как сенсорные, моторные, познавательные, зрительные, слуховые и т.д. [2, 3]. Эти функции контролируются разными областями коры, каждая из которых характеризуется определенной цитоархитектоникой, составом типов нейронов, плотностью их распределения и связями с другими формациями мозга. Кортикальные нейронные микроцепи включают ГАМКергические интернейроны [4], которые отвечают за тормозную трансмиссию в неокортексе и играют, как полагают, ключевую роль в регуляции кортикальных входов [5]. В последние годы установлено, что нарушения в неокортикальной ГАМКергической тормозной сети приводят у человека к тяжелым нейрогенным расстройствам, таким как шизофрения, эпилепсия, аутизм [6–8].
Также показано, что воздействие перинатальной гипоксии оказывает повреждающее действие на структурно-функциональные характеристики неокортекса на ранних постнатальных сроках, в том числе, на элементы ГАМКергической системы [9, 10], при этом неизвестно, остаются ли эти последствия повреждающего действия на ГАМКергическую систему у животных в отдаленные постнатальные сроки.
Целью настоящей работы было изучить распределение GAВАергических интернейронов в сенсомоторной области неокортекса у крыс, достигших половозрелости, после воздействия острой гипоксии в перинатальный период.
Работа выполнена на крысах линии Вистар, содержащихся в виварии Института физиологии им. И.П. Павлова РАН. Новорожденные крысята были разделены на 2 группы: 1 – животные, подвергавшиеся в барокамере воздействию гипоксии; 2 – интактные животные. Каждая группа содержала по 8–10 крысят. Воздействие гипоксии на головной мозг новорожденных крысят осуществляли на 2-е сутки постнатального развития (П2) в специальной камере в течение 1 ч. Дыхательная смесь содержала: кислород – 7.6–7.8%; углекислый газ – 0.15–0.21%; азот – 91.8%, при температуре – 21.3–23°С и нормальном общем давлении (760 мм рт.ст.).
Для гистологических исследований мозг животных, достигших половозрелого возраста (на 90-е сутки, П90), обрабатывали общепринятыми гистологическими методами, готовили серийные фронтальные срезы толщиной 5–7 мкм, окрашивали метиленовым синим (Sigma, США) по методу Ниссля и заключали в синтетическую среду Permaunt (Termo, США). Исследование проводилось на световом микроскопе Leica DME (Leica, Германия). Изображения получали при помощи цифровой видеокамеры Leica EC3 (Leica, Германия).
Рис. 1.
Неокортекс крысы на П90, сенсомоторная область, контроль. Иммуноцитохимическая реакция на выявление GAD-67; нейроны с высоким уровнем экспрессии GAD-67 (короткая стрелка); нейроны с низким уровнем экспрессии GAD-67 (длинная стрелка). Увел. Ок.×10; об.×100.
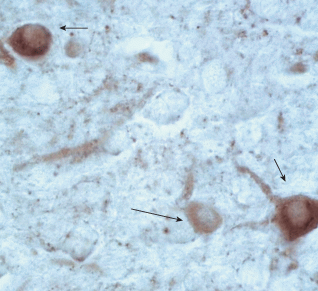
Иммуноцитохимическую реакцию на выявление нейронов, экспрессирующих GAD-67, проводили с использованием кроличьих поликлональных антител к GAD-67 (Spring Bioscience, США). В качестве вторичных реагентов использовали реактивы из набора EnVision+System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США). Для визуализации продукта реакции применяли хромоген DAB+ (Dako, Дания). После проведения иммуноцитохимической реакции срезы докрашивали гематоксилином и заключали в заливочную среду Permaunt (Termo, США).
Для оценки оптической плотности продукта реакции в цитоплазме нейронов и нейропиле использовали изображения, полученные с помощью цифровой видеокамеры и программного обеспечения ВидеоТест Мастер Морфология (ООО “Видео Тест”, Санкт-Петербург). Данные обрабатывали, вычисляя среднее арифметическое значение и ошибку среднего, достоверность различий оценивали средствами анализа ANOVA (Statistica 7.0, Statsoft Inc., USA) при р < 0.05.
Компьютерную морфометрию проводили на изображениях, полученных с гистологических препаратов поперечных срезов конечного мозга на уровне Bregma –1.80 mm–2.04 mm. Количественные подсчеты проводили на стандартной площади 0.1 мм2 сенсомоторной области неокортекса на 10–15 серийных срезах мозга, взятого у 4 животных каждой группы исследования. Статистическая обработка полученных показателей осуществлялась при помощи пакета прикладных компьютерных программ Statistica 6.0., ImageScope Color и ORIGIN50. Значимость различий определяли с помощью t-критерия Стьюдента. Различия считали значимыми при р < 0.05.
Распределение нейронов, экспрессирующих GAD-67 в сенсомоторной области неокортекса у животных на П90 в контроле. Количество нейронов, экспрессирующих GAD-67, подсчитывали на стандартной площади при увеличении ок.× 10; об.×10 во фрагменте сенсомоторной области неокортекса, в который входили слои II–III–IV–V–VI. У животных в контроле присутствует 57.9 ± 2.7 иммунореактивных нейронов, которые по величине значения оптической плотности иммуноокрашивания цитоплазмы можно разделить на 3 значимо отличающихся группы: 1. нейроны с высоким уровнем экспрессии GAD-67 (оптическая плотность – 0.40 ± 0.02), число таких нейронов составляет 16.2 ± 1.3; 2. нейроны со средним уровнем экспрессии (оптическая плотность – 0.34 ± 0.02), число нейронов 22.8 ± 1.8; 3. нейроны с низким уровнем экспрессии (оптическая плотность – 027 ± 0.02), число таких нейронов 18.9 ± 1.4.
Распределение нейронов, экспрессирующих GAD-67 в сенсомоторной области неокортекса у животных на П90 после воздействия перинатальной гипоксии. У крыс, переживших воздействие перинатальной гипоксии, присутствует 38.3 ± 1.8 иммунокрашенных нейронов, которые по величине оптической плотности можно разделить на 2 значимо отличающиеся группы: 1. нейроны со средним уровнем экспрессии GAD-67 (оптическая плотность – 0.31 ± 0.03), число нейронов составляет 20.4 ± 1.3; 2. нейроны с низким уровнем экспрессии (оптическая плотность – 0.22 ± 0.01), число таких нейронов 18.6 ± 1.2.
Таким образом, результаты исследования показали, что воздействие гипоксии в перинатальный период приводит к структурным изменениям в ГАМКергической системе неокортекса, которые сохраняются у животных, достигших половозрелого возраста. Воздействие перинатальной гипоксии вызывает снижение общей численности ГАМКергических нейронов на 34%. Выявлено, что у контрольных животных популяция GABAергических нейронов неоднородная, она включает 3 разных типа интернейронов, отличающихся интенсивностью экспрессии ГАМК: нейроны с высоким уровнем экспрессии составляют 28% от общего их числа, нейроны со средним уровнем экспрессии составляют 39.4% и нейроны с низким уровнем экспрессии – 32.6%. У животных, подвергавшихся воздействию перинатальной гипоксии, отсутствуют нейроны с высоким уровнем экспрессии ГАМК. Присутствующая популяция состоит из нейронов со средним уровнем экспрессии, их 53.2%, и нейронов с низким уровнем экспрессии ГАМК 47%.
Установлено, что во время раннего онтогенеза неокортикальные интернейроны продуцируются в определенных областях вентральной части конечного мозга и мигрируют на достаточно большие расстояния, достигая своего дефинитивного местоположения в неокортексе [11, 12]. Полагают, что нормальное развитие и функционирование неокортекса во многом зависят от правильной координации процессов генерации и миграции тормозных интернейронов [12–15]. Результаты данного исследования показали, что воздействие гипоксии в перинатальной период приводит к структурным изменениям в ГАМКергической системе неокортекса, которые сохраняются у животных, достигших половозрелого возраста. Ранее показано, что нарушение становления неокортикальной ГАМКергической тормозной сети у человека приводит к тяжелым нейрологическим расстройствам, таким как шизофрения, эпилепсия, аутизм [7, 8], поэтому важно получать новые данные для более детального понимания механизмов, контролирующих процессы развития интернейронов и формирования неокортикальной тормозной сети.
Список литературы
Виноградова О.С. Нейронаука конца второго тысячелетия: смена парадигм. Журн. Высш. Нервн. Деят. 50 (5): 743–774. 2000. [Vinogradova O.S. Neuroscience at the end of the second millennium: change in paradigms. Zh Vyssh Nerv Deiat Im I P Pavlova. 50 (5): 743–774. 2000. (in Russ)].
Leingartner A., Thuret S., Kroll T.T., Chou S.J., Leasure J.L., Gage F.H., O’Leary D.D. Cortical area size dictates performance at modality-specific behaviors. Proc. Natl. Acad. Sci. U.S.A. 104: 4153–4158. 2007.
O’Leary D.D., Sahara S. Genetic regulation of arealization of the neocortex. Curr. Opin. Neurobiol. 18: 90–100. 2008.
Hensch T. K. Critical period plasticity in local cortical circuits. Nat. Rev. Neurosci. 6: 877–888. 2005.
Семьянов А.В. ГАМК-эргическое торможение в ЦНС: типы ГАМК-рецепторов и механизмы тонического ГАМК-опосредованного тормозного действия. Нейрофизиология. 34 (1): 82–92. 2002. [Semyanov A.V. GABAergic inhibition in the central nervous system: types of GABA-receptors and mechanisms of the tonic GABA-mediated inhibition effect. Neurophysiology. 34 (1): 82–92. 2002. (in Russ)].
Lewis D.A. GABAergic local circuit neurons and prefrontal cortical dysfunction in schizophrenia. Brain Res. Rev. 31 (2–3): 270–276. 2000.
Armijo J.A., Valdizan E.M., De Las Cuevas I., Cuadrado A. Advances in the physiopathology of epileptogenesis: molecular aspects. Rev. Neurol. 34: 409–429. 2002.
Rubenstein J.L., Merzenich M.M. Model of autism: increased ratio of excitation/inhibition in key neural systems. Genes Brain Behav. 2: 255–267. 2003.
Хожай Л.И., Отеллин В.А. Архитектоника GABAергической тормозной сети в сенсомоторной области неокортекса крыс в ранний постнатальный период в норме и после острой перинатальной гипоксии. Ж. эвол. биохим. и физиол. 53 (3): 208–214. 2017. [Khozhai L.I., Otellin V.A. Architectonics of GABAergic inhibitory network in the sensorimotor area of the rat neocortex in the early postnatal period under normal conditions and after acute perinatal hypoxia Journ. Evol. Biochem. Physiol. 53 (3): 208–214. 2017. (in Russ)].
Хожай Л.И., Отеллин В.А. Распределение GAD-67-экспрессирующих нейронов и морфологические изменения в структурах гиппокампа в пубертатный период после острой перинатальной гипоксии у крыс. Ж. эвол. биохим. и физиол. 53 (6): 448–452. 2017. [Khozhai L.I., Otellin V.A. Distribution of GAD67-expressing neurons and morphological changes in hippocampal structures during pubertal period after acute perinatal hypoxia in rats. Journ. Evol. Biochem. Physiol. 53 (6): 448–452. 2017. (in Russ)].
Anderson S. A., Marin O., Horn C., Jennings K., Rubenstein J.L. Distinct cortical migrations from the medial and lateral ganglionic eminences. Development. 128: 353–363. 2001.
Molyneaux B.J., Arlotta P., Menezes J.R., Macklis J.D. Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci. 8:427–437. 2007.
Powell E.M., Campbell D.B., Stanwood G.D., Davis C., Noebels J.L., Levitt P. Genetic disruption of cortical interneuron development causes region and GABA cell type-specific deficits, epilepsy, and behavioral dysfunction. J. Neurosci. 23: 622–631. 2003.
Kowalczyk T., Pontious A., Englund C., Daza R.A., Bedogni F., Hodge R., Attardo A., Bell C., Huttner W.B., Hevner R.F. Intermediate neuronal progenitors (basal progenitors) produce pyramidal-projection neurons for all layers of cerebral cortex. Cereb. Cortex. 19: 2439–2450. 2009.
Bartolini G., Ciceri G., Marin O. Integration of GABAergic interneurons into cortical cell assemblies: lessons from embryos and adults. Neuron. 79: 849–864. 2013.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


