Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 5, стр. 331-338
РОЛЬ α-ТОКОФЕРОЛА И ЦИКЛОФЕРОНА В РЕГУЛЯЦИИ АПОПТОЗА НЕЙРОНОВ СУПРАХИАЗМАТИЧЕСКОГО ЯДРА ГИПОТАЛАМУСА И ПИНЕАЛОЦИТОВ ПРИ СТРЕССЕ И СТАРЕНИИ
Л. К. Хужахметова 1, М. М. Беляева 3, Д. Л. Теплый 2, Е. Д. Бажанова 2, 3, 4, *
1 ФГБОУ ВО Астраханский ГМУ Минздрава РФ, кафедра биологии
Астрахань, Россия
2 Астраханский государственный университет, кафедра физиологии и морфологии человека и животных
Астрахань, Россия
3 Федеральное государственное бюджетное учреждение науки
“Институт токсикологии Федерального медико-биологического агентства”
Санкт-Петербург, России
4 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: bazhanovae@mail.ru
Поступила в редакцию 23.11.2018
После доработки 26.03.2019
Принята к публикации 26.04.2019
Аннотация
Супрахиазматическое ядро (СХЯ) гипоталамуса и эпифиз играют важную роль не только в регуляции циркадных ритмов организма, но и в реализации адаптивных ответов, в том числе на различные стресс-факторы. Возраст-зависимые морфофункциональные изменения этих органов, в том числе связанные с повышением оксидативного стресса, могут иметь значительное влияние на организм в целом. Цель работы – изучить динамику и механизм апоптоза пинеалоцитов и нейросекреторных клеток СХЯ и определить возможности фармакологической коррекции (антиоксидант альфа-токоферол, иммуномодулятор циклоферон) данных процессов в физиологических условиях и при иммобилизационном стрессе у молодых и старых животных. Исследованы крысы линии Wistar, молодые и старые (2–4 и 30 мес), препараты вводились ежедневно per os один раз в сутки в течение 14 дней. Уровень апоптоза возрастал при старении в СХЯ и эпифизе, введение альфа-токоферола, циклоферона и их комбинации приводило к уменьшению апоптоза. Показано, что стресс-индуцируемый апоптоз в СХЯ и эпифизе идет по р53-зависимому пути, и введение α-токоферол-ацетата и циклоферона (α-ТФ и ЦФ), а также их комбинации, снижает уровень апоптоза пинеалоцитов, подавляя экспрессию р53 у молодых и старых животных. В СХЯ не выявлено взаимосвязи между уровнем апоптоза и экспрессией р53 после введения изученных препаратов при стрессе, очевидно, здесь реализуются иные механизмы.
ВВЕДЕНИЕ
Старение – биологический процесс, характеризующийся прогрессивным снижением физиологических функций, повышением оксидативного стресса, снижением возможности организма адекватно отвечать на предъявляемый стресс и увеличением риска возникновения связанных с возрастом болезней [1]. Одним из важнейших аспектов физиологии человека является естественный 24‑часовой цикл биологических процессов, особенность, присущая жизни на Земле [2]. Несмотря на связь с внешними стимулами, циркадные ритмы имеют эндогенное происхождение, представляя таким образом биологические часы организма, основными компонентами которых являются зрительный анализатор [3], эпифиз и супрахиазматическое ядро (СХЯ) гипоталамуса [4]. Годовая цикличность длины дня синхронизирует сезонные ритмы, которые у млекопитающих опосредуются ночной секрецией гормона эпифиза, мелатонина, пропорциональной длине ночи [5]. Мелатонин, эндогенный индоламин, продуцируется из триптофана и играет ключевую роль в регуляции циркадных ритмов, генерируемых СХЯ [4]. Мелатонин выполняет множество функций, включая хронобиотическую, антиоксидантную и нейропротекторную, оказывает противовоспалительный эффект, уменьшает повреждения, вызванные оксидативным стрессом [6]. Это особенно важно при старении, когда отмечается нарушение свободнорадикальных процессов.
Различные заболевания, в том числе нейродегенеративные, а также снижение продолжительности жизни, связаны с функцией циркадных часов. Так, в исследованиях с Drosophila melanogaster продолжительность жизни была снижена у трех аритмических мутантов, включающих ClkAR, cyc0 и tim0. У мутантных фенотипов отмечалось увеличение окислительного стресса, что коррелировало с потерей дофаминергических нейронов [7]. Было обнаружено нарушение ритмического метилирования BMAL1 у пациентов с болезнью Альцгеймера в нейронах мозга, т.е. очевидно, что изменения в метилировании ДНК часовых генов могут способствовать снижению когнитивной способности и изменению поведения у больных [8]. На моделях животных (болезнь Паркинсона) при использовании препарата леводопа также наблюдаются уменьшение уровней экспрессии часовых генов BMAL1 и RORα, что свидетельствует о нарушении функции циркадного ритма при долгосрочном лечении данным препаратом [9]. Старение приводит к нарушению циркадных ритмов, повышению экспрессии провоспалительных цитокинов и нарушению иммунореактивности [10]. Таким образом, исследования различных авторов свидетельствуют о значительной роли биологических часов и органов, их представляющих (СХЯ, эпифиз), в развитии заболеваний, адаптационных и инволюционных изменений, в том числе связанных с оксидативным стрессом. Нейроиммунное взаимодействие выявлено в различных органах млекопитающих, таких как передняя доля гипофиза, кожа, костный мозг, центральные (тимус) и периферические лимфатические органы и т.д. Показано наличие в гипоталамусе рецепторов к интерферону-альфа [11], что позволяет обоснованно говорить о влиянии иммуномодуляторов на деятельность нейросекреторной системы. Участие витамина Е (α‑токоферол-ацетата (α-ТФ)) в регуляции деятельности ЦНС и возможность прохождения его через гематоэнцефалический барьер (ГЭБ) выявлено ранее [12, 13]. В связи с этим целью нашей работы было изучение динамики и механизмов апоптоза пинеалоцитов и нейросекреторных клеток (НСК) СХЯ гипоталамуса, а также определение возможности фармакологической коррекции данных процессов (антиоксидант α-ТФ, иммуномодулятор циклоферон – индуктор эндогенного интерферона) в физиологических условиях и при стрессе у молодых и старых животных.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящем исследовании использованы крысы-самцы линии Wistar, молодые и старые (2–4 и 30 мес). Животных содержали по 6 особей в клетке в стандартных условиях вивария при температуре воздуха 18–22оС и относительной влажности воздуха 50–65%. В ходе эксперимента обеспечивался свободный доступ к воде и корму. Все эксперименты выполняли в соответствии с Национальным стандартом Российской Федерации ГОСТ Р-53434-2009 “Принципы надлежащей лабораторной практики”, Приказом Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики”.
В эксперименте использован один из наиболее характерных видов эмоционального стресса – иммобилизация. Животные были разделены на следующие группы 2–4-мес. (n = 6) и 30-мес. крыс (n = = 6): 1. интактные крысы (контроль); 2. крысы, получавшие масляный 10% раствор α-токоферол-ацетата (α-ТФ); 3. крысы, получавшие циклоферон (ЦФ); 4. крысы, получавшие совместно 10% масляный раствор α-ТФ и ЦФ; 5. крысы, подвергшиеся иммобилизационному стрессу в пластиковых цилиндрах по 1 часу в день в течение двух недель; 6. стрессированные крысы, получавшие предварительно 10% масляный раствор α-ТФ в тех же дозах в течение двух недель; 7. стрессированные крысы, получавшие предварительно ЦФ в тех же дозах в течение двух недель; 8. стрессированные крысы, получавшие предварительно раствор α-ТФ и ЦФ в тех же дозах в течение двух недель. Препараты вводились ежедневно per os один раз в сутки в течение 14 дней в дозах: масляный 10% раствор α‑ТФ – в дозе 0.5 мг на 100 гр. массы тела; ЦФ per os (0.77 мг. на 100 гр. массы тела – 10-месячным и 1.19 мг на 100 гр. массы тела – 30-месячным) (α-токоферол-ацетат (НИЖФАРМ, Нижний Новгород, Россия) 10% масляный раствор, циклоферон (ПОЛИСАН, Санкт-Петербург, Россия) таблетки для приема внутрь (150 мг активного вещества). Дозы препаратов рассчитывали, исходя из действующих терапевтических доз. Выведение животных из эксперимента проводилось под золетиловым наркозом (золетил 4 мг/кг массы) методом декапитации через сутки после окончания воздействия. Материал для исследования – гипоталамическая область мозга, содержащая супрахиазматическое ядро (СХЯ) и эпифиз.
Для оценки уровня апоптоза нейросекреторных клеток (НСК) СХЯ и пинеалоцитов эпифиза применен метод детекции апоптоза TUNEL (Terminal deoxynucleotidyl Transferase Biotin-dUTP Nick End Labeling) (нерадиоактивное мечение биотином, выявление диаминобензидином) с использованием терминальной дезоксинуклеотидил-трансферазы для выявления разрывов ДНК (кит для TUNEL Sileks, Россия) (http://www.cmmr.ca/protocols/tunel_labeling.pdf). Определяли экспрессию проапоптотического белка р53 на срезах гипоталамуса, содержащих СХЯ, и эпифиза методом иммуногистохимии (ИГХ) [14] с использованием немеченных моноклональных антител (Abcam, USA) и вторичных биотинилированных антимышиных антител (Vector Lab, USA). Изображения срезов гипоталамуса, содержащих СХЯ, и эпифиза после выполнения ИГХ реакций и TUNEL были получены с помощью микроскопа PFM (WPI, USA) и видеокамеры Leika DFC 300 FX (Germany), разрешение 1392 × 1040 пикселей (увеличение × 40). Для оценки интенсивности экспрессии изучаемых белков и уровня апоптоза использовалась программа VideoTest Software (ИГУ, TUNEL). Количество апоптотических клеток (темноокрашенных, TUNEL-позитивных) подсчитывали на 4–5 срезах СХЯ и эпифиза у каждой крысы с последующим определением среднего количества TUNEL-позитивных клеток на группу.
Оптическую плотность иммунореактивного (ИР) вещества в p53-ИР клетках определяли на 5–6 срезах гипоталамуса (СХЯ) и эпифиза для каждого животного. На основании этого высчитывали среднюю оптическую плотность (выражена в относительных единицах, представляющих отношение яркости фона к яркости объекта) изучаемого белка для группы крыс.
Полученные данные были обработаны с использованием критерия Стьюдента с помощью программы Microsoft Excel 5.0a. Значимость различий при нормальном распределении количественных признаков оценивали с помощью t-критерия Стьюдента (для независимых выборок). Статистическую значимость изменений показателей в динамике у животных одной и той же группы оценивали, применяя критерий Вилкоксона для связанных выборок. Определяли статистическую достоверность различия величины изучаемых показателей в сопоставляемых группах при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
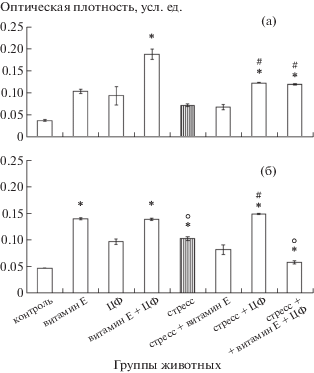
Уровень апоптоза НСК СХЯ. Как известно, СХЯ играет важную роль в организации циркадных ритмов позвоночных [15], в связи с чем его морфофункциональная сохранность на всех этапах онтогенеза приобретает немаловажное значение. Мы показали, что уровень апоптоза НСК СХЯ молодых крыс невысок и увеличивается при старении (рис. 1а). Как известно, α-ТФ, как фенольный антиоксидант, обладает значительным антирадикальным действием и является универсальным протектором клеточных мембран. Модуляция концентраций внутриклеточных антиоксидантов представляет большой интерес, поскольку любое изменение приводит к цепи связанных друг с другом событий, особенно при старении и в условиях стресса. В то же время антиоксидант-активируемые молекулярные пути могут быть критическими для дизайна новых терапевтических стратегий, в том числе для борьбы с раком [16]. Введение α-ТФ и совместное действие α-ТФ и ЦФ снижают долю апоптотических клеток в СХЯ, тогда как использование только ЦФ не влияет на данный показатель. Иммобилизация является разновидностью психоэмоционального стресс-воздействия. При использовании иммобилизации возникают фазные изменения, характерные для психоэмоционального стресса, происходит активация симпатоадреналовой системы, изменения в системе крови, надпочечников, ЦНС, изменяется синтез белков [17]. Стандартность изменений, отсутствие дополнительных повреждающих факторов и доступность технического осуществления делают иммобилизацию целесообразной моделью стрессового воздействия. При стрессе апоптоз НСК у молодых животных несколько повышается, но введение изученных препаратов и их комбинации снижают данный показатель, приводя его к базовому уровню (рис. 1а).
Рис. 1.
Уровень апоптоза клеток в СХЯ молодых (а) и старых (б) крыс. Примечание. Здесь и везде далее: * – достоверность различий в сравнении с контрольной группой животных, p < 0.05; # – достоверность различий между группой “стресс” и группами “стресс + α-ТФ”, “стресс + ЦФ”, “стресс + α-ТФ + ЦФ” в своей возрастной группе животных, p < 0.05; о – достоверность различий между молодыми и старыми животными, p < 0.05. Группы животных: контроль – интактные крысы; α-ТФ – крысы, получавшие α-ТФ; ЦФ – крысы, получавшие циклоферон; α-ТФ+ЦФ – крысы, получавшие α-ТФ и ЦФ; стресс – крысы, подвергшиеся иммобилизационному стрессу в пластиковых цилиндрах по 1 ч в день в течение 2 нед; α-ТФ + стресс – стрессированные крысы, получавшие предварительно α-ТФ в тех же дозах в течение 2 нед; ЦФ + стресс – стрессированные крысы, получавшие предварительно ЦФ в тех же дозах в течение 2 нед; ЦФ + α-ТФ + + стресс – стрессированные крысы, получавшие предварительно α-ТФ и ЦФ в тех же дозах в течение 2 нед. Далее обозначения те же.
У старых крыс уровень апоптоза НСК СХЯ значительно выше, чем у молодых, и снижается в группе крыс, получавших α-ТФ (рис. 1б). Как известно, способность α-ТФ ингибировать свободные радикалы играет важную роль в поддержании структурно-функциональной целостности и стабильности мембран нейронов. При исследовании механизмов позитивного действия токоферола на синаптосомы показано, что он ингибирует избыточное перекисное окисление липидов (ПОЛ) и стабилизирует трансмембранный потенциал, что определяется структурирующим влиянием токоферола на бислой синаптосом. Дефицит витамина Е приводит к нарушению процесса спонтанного освобождения нейромедиаторов в регенерирующих нервных окончаниях и развитию неврологических нарушений [18]. Усиление ПОЛ служит условием для возникновения качественного нарушения ферментативной инактивации медиаторов.
ЦФ (активное вещество – акридонуксусная кислота) – лекарственный препарат, экзогенный низкомолекулярный индуктор эндогенных альфа-, бета-, гамма-интерферонов, продуцируемых лейкоцитами, макрофагами, эпителиальными клетками, тканями селезенки, печени, легких, мозга. ЦФ проникает в цитоплазму и ядерные структуры клетки, стимулирует стволовые клетки костного мозга на выработку иммунных клеток, является активатором системы естественных клеток-киллеров, стимулирует распознавание и лизис дефектных клеток, быстро проникает в плазму крови, где взаимодействует с иммунокомпетентными клетками. ЦФ отличается низкой токсичностью, отсутствием мутагенных, тератогенных, эмбриотоксических, канцерогенных эффектов, и широко применяется в клинической практике [19]. В наших экспериментах при введении ЦФ и комбинации препаратов наблюдается тенденция к снижению количества гибнущих клеток. При иммобилизационном стрессе отмечено значительное возрастание программированной клеточной гибели НСК в изучаемом центре. В группах крыс, получавших перед стрессом α-ТФ, ЦФ и их комбинацию, доля апоптотических клеток снижается (рис. 1б).
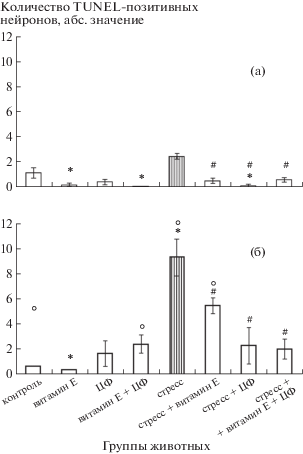
Экспрессия р53 в НСК СХЯ. Исследование экспрессии транскрипционного фактора р53, участвующего в индукции апоптоза при различных воздействиях, показало следующее. У молодых животных, получавших комбинацию антиоксиданта α‑ТФ и иммуномодулятора ЦФ, синтез р53 усиливается (рис. 2а). Иммобилизационный стресс не оказывает влияния на экспрессию р53, однако введение ЦФ и сочетания α-ТФ и ЦФ индуцирует синтез данного фактора (рис. 2а).
Рис. 2.
Содержание р53-иммунореактивного материала в клетках СХЯ молодых (а) и старых (б) крыс исследуемых групп.
У интактных старых крыс уровень экспрессии р53 в НСК СХЯ не отличается от такового у молодых (рис. 2б). Введение изучаемых препаратов и их комбинации приводит к активации синтеза р53, так же как и воздействие стресс-фактора (рис. 2б). Использование α-ТФ с последующим стрессированием не влияет на уровень р53 в НСК гипоталамуса, тогда как введение ЦФ перед стрессом приводит к повышению данного показателя (рис. 2б). Сочетанное действие препаратов на крыс, подвергшихся стрессу, снижает экспрессию р53 (рис. 2б).
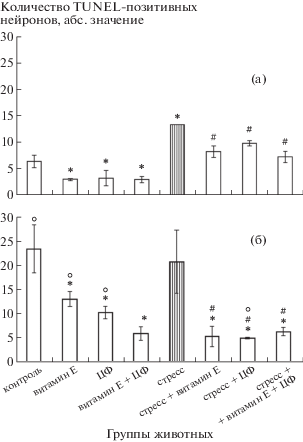
Уровень апоптоза пинеалоцитов эпифиза. Многочисленные работы сообщают об участии мелатонина в регуляции апоптоза клеток различных органов [20], однако практически нет исследований динамики клеточной гибели пинеалоцитов в онтогенезе. Мы показали, что у молодых крыс невысокий изначально уровень апоптоза клеток эпифиза снижается при введении α-ТФ, ЦФ и их комбинации (рис. 3а). Стресс-индуцированное возрастание апоптоза пинеалоцитов уменьшается в случае предварительного введения изученных препаратов и их сочетания (рис. 3а).
Доля апоптотических клеток в эпифизе старых крыс значительно превышает таковую у молодых (рис. 3б). Большинство авторов указывают на антиапоптотические эффекты витамина Е [21], но в последнее время появляются работы, характеризующие данный витамин как проапоптозный агент [22]. В нашей работе введение α-ТФ, ЦФ и их комбинации приводит к уменьшению количества гибнущих пинеалоцитов у старых животных. Процент апоптоза в группах старых крыс, получавших α‑ТФ и ЦФ, больше, чем в аналогичных группах молодых крыс. Уровень апоптоза у животных старшей возрастной группы так же высок, как и в контроле. Предварительное введение изученных препаратов – антиоксиданта, иммуномодулятора и их сочетания – снижает уровень программированной клеточной гибели в эпифизе на поздних этапах онтогенеза (рис. 3б).
Изменение уровня витамина Е в организме может оказывать значительное модифицирующее действие на мембранные компоненты ГЭБ и функциональное состояние мозговых структур [23], токоферол способствует усилению защитных функций ГЭБ. По данным литературы, комплексное действие препаратов α-ТФ и ЦФ приводит к нивелированию продуктов ПОЛ и окислительной модификации белков в крови и гомогенатах головного мозга, образованных в результате стресс-индуцированных процессов [23]. Таким образом, уменьшается цитоповреждающее, дестабилизирующее действие продуктов окисления на мембранные структуры ГЭБ.
Итак, выявлено антиапоптотическое действие α-ТФ на НСК СХЯ гипоталамуса как при физиологических условиях, так и при стрессе в группах молодых и старых крыс. Те же эффекты обнаружены в отношении пинеалоцитов. По данным литературы, витамин Е (α-ТФ) способен оказывать влияние на Erk1/2-киназный путь, обеспечивающий выживание клетки [24], а также индуцировать синтез антиапоптотического белка Bcl-2 [25], очевидно, это и происходит в наших экспериментах. Аналогичное влияние (снижение апоптоза НСК и пинеалоцитов), более выраженное у старых животных в контроле и при стрессе и у молодых стрессированных крыс, показано при введении иммуномодулятора ЦФ, а также комбинации исследуемых препаратов. Ранее в экспериментах нами было показано активное участие ЦФ в регуляции апоптоза НСК супраоптического и паравентрикулярного ядер, выявлена супрессия клеточной гибели, связанная со снижением уровня проапоптотического белка Вах, у молодых и старых мышей, и при стрессе – у старых животных [26].
Экспрессия р53 в эпифизе. Как известно, онкосупрессор р53 играет важную роль в контроле пролиферации и индукции апоптоза в нормальных клетках, кроме того, в экспериментах с десинхронозом показано вовлечение фактора р53 в регуляцию циркадных ритмов [27]. В наших экспериментах уровень р53 в эпифизе у молодых крыс повышается при введении α-ТФ и комбинации α-ТФ с ЦФ и значительно снижается у крыс, получавших ЦФ (рис. 4а). Уровень р53 у стрессированных животных не отличается от базового, но предварительное введение α-ТФ и ЦФ подавляет экспрессию данного белка. По некоторым данным, α-ТФ не влияет на экспрессию р53 [28], другие исследователи показали, что α-ТФ способен снижать экспрессию мутантных форм р53 [29], возможно, это и происходит в нашем эксперименте. Сочетанное применение изученных препаратов индуцирует синтез транскрипционного фактора р53 (рис. 4а). Экспрессия р53 в клетках эпифиза у интактных старых крыс не отличается от таковой у молодых, и α-ТФ не изменяет значение данного показателя (рис. 4б). Комбинация его с ЦФ снижает экспрессию р53, тогда как введение ЦФ индуцирует синтез данного белка в эпифизе, как и иммобилизационный стресс. Применение изученных препаратов перед стрессом как отдельно, так и в комбинации, снижает экспрессию р53, что коррелирует с уровнем апоптоза пинеалоцитов у старых животных (рис. 3б, 4б).
Рис. 4.
Содержание р53-иммунореактивного материала в эпифизе молодых (а) и старых (б) крыс исследуемых групп.
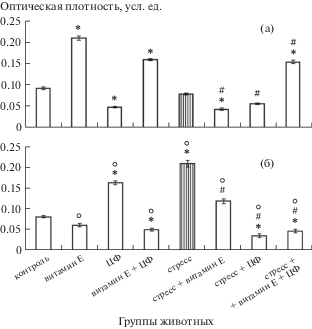
Сравнительный анализ действия препаратов показал, что в большинстве случаев эффект изучаемых антиоксиданта и иммуномодулятора был сходным, как при влиянии на уровень апоптоза, так и на экспрессию р53. Можно отметить более выраженное стимулирующее влияние ЦФ на экспрессию р53 как в СХЯ, так и в эпифизе.
Таким образом, в исследовании влияния иммобилизационного стресса на индукцию и механизмы программированной клеточной смерти показано, что стресс-индуцируемый апоптоз в СХЯ и эпифизе идет по р53-зависимому пути, и введение α-ТФ и ЦФ, а также их комбинации, снижает уровень апоптоза пинеалоцитов, подавляя экспрессию р53 у молодых и старых животных. В СХЯ не выявлено взаимосвязи между уровнем апоптоза и экспрессией р53 после введения изученных препаратов при стрессе, очевидно, здесь реализуются иные механизмы.
Список литературы
Paradies G., Paradies V., Ruggiero F.M., Petrosillo G. Mitochondrial bioenergetics decay in aging: beneficial effect of melatonin. Cell Mol. Life Sci. 74 (21): 3897–3911. 2017.https://doi.org/10.1007/s00018-017-2619-5
McKenna H., van der Horst G.T.J., Reiss I., Martin D. Clinical chronobiology: a timely consideration in critical care medicine. Crit. Care. 22 (1): 124. 2018.https://doi.org/10.1186/s13054-018-2041-x
Morioka E., Kanda Y., Koizumi H., Miyamoto T., Ikeda M. Histamine regulates molecular clock oscillations in human retinal pigment epithelial cells via H1 receptors. Front. Endocrinol. (Lausanne). 19 (9): 108. 2018.https://doi.org/10.3389/fendo.2018.00108
Tan D.X., Manchester L.C., Reiter R.J. CSF generation by pineal gland results in a robust melatonin circadian rhythm in the third ventricle as an unique light/dark signal. Med. Hypotheses. 86 (3): 9. 2016.https://doi.org/10.1016/j.mehy.2015.11.018
Hazlerigg D., Blix A.S., Stokkan K.A. Waiting for the Sun: the circannual programme of reindeer is delayed by the recurrence of rhythmical melatonin secretion after the arctic night.// J Exp Biol. 1;220 (Pt 21): 3869–3872. 2017.https://doi.org/10.1242/jeb.163741
Porfirio M.C., Gomes de Almeida J.P., Stornelli M., Giovinazzo S., Purper-Ouakil D., Masi G. Can melatonin prevent or improve metabolic side effects during antipsychotic treatments? Neuropsychiatr Dis Treat. 10 (13): 2167–2174. 2017.https://doi.org/10.2147/NDT.S127564
Vaccaro A., Issa A.R., Seugnet L., Birman S., Klarsfeld A. Drosophila clock is required in brain pacemaker neurons to prevent premature locomotor aging independently of its circadian function. PLoS Genet. 13 (1): e1006507. 2017.
Cronin P., McCarthy M.J., Lim A.S.P., Salmon D.P., Galasko D., Masliah E., et al. Circadian alterations during early stages of Alzheimer’s disease are associated with aberrant cycles of DNA methylation in BMAL1. Alzheimer’s & dementia: the journal of the Alzheimer’s Association. 13 (6): 689–700. 2017.
Li S.Y., Wang Y.L., Liu W.W., Lyu D.J., Wang F., Mao C.J., et al. Long-term levodopa treatment accelerates the circadian rhythm dysfunction in a 6-hydroxydopamine rat model of Parkinson’s disease. Chin. Med. J. 130 (9) P.1085–1092. 2017.
Vinod C., Jagota A. Daily Socs1 rhythms alter with aging differentially in peripheral clocks in male Wistar rats: therapeutic effects of melatonin. Biogerontology. 18 (3): 333–345. 2017.https://doi.org/10.1007/s10522-017-9687-7
Marx C., Bornstein S.R., Wolkersdorfer G.W. Cellular immune-endocrine interaction in adrenocortical tissues. Eur. J. Clin. Invest. 30 (Suppl. 3): 1–5. 2000.
Теплый Д.Л. Влияние витамина Е на проницаемость гемато-энцефалического барьера. Физиологический журнал СССР им. Сеченова. 65 (10): 1506-1512. 1979. [Teplyi D. L. The effect of vitamin E on permeability of the blood-brain barrier. Russ. J. Physiol. 65 (10): 1506–1512. 1979 (in Russ)].
Lee P., Ulatowski L.M. Vitamin E: Mechanism of transport and regulation in the CNS. IUBMB Life. 71 (4): 424–429. 2019.https://doi.org/10.1002/iub.1993
Sternberger L.A., Joseph S.A. The unlabeled antibody method. Contrasting color staining of paired pituitary hormones without antibody removal. J. Histochem Cytochem. 27 (11): 1424–1429. 1979.
Bedont J.L., LeGates T.A., Slat E.A., Byerly M.S., Wang H., Hu J., Rupp A.C., Qian J., Wong G.W., Herzog E.D., Hattar S., Blackshaw S. Lhx1 controls terminal differentiation and circadian function of the suprachiasmatic nucleus. Cell Re: 7 (3): 609–622. 2014.https://doi.org/10.1016/j.celrep.2014.03.060
Kwee J.K. A paradoxical chemoresistance and tumor suppressive role of antioxidant in solid cancer cells: a strange case of Dr. Jekyll and Mr. Hyde. Biomed Res. Int.: 209845. 2014.https://doi.org/10.1155/2014/209845
Daviu N., Rabasa C., Nadal R., Armario A. Comparison of the effects of single and daily repeated immobilization stress on resting activity and heterotypic sensitization of the hypothalamic-pituitary-adrenal axis. Stress. 17 (2): 176–185. 2014.https://doi.org/10.3109/10253890.2014.880834
Schneider C. Chemistry and biology of vitamin E. Mol. Nutr. Food Res. 2005. 49 (1): 7–30.
Li W., Wang Z., Chen Y., Wang K., Lu T., Ying F., Fan M., Li Z., Wu J. Melatonin treatment induces apoptosis through regulating the nuclear factor-κB and mitogen-activated protein kinase signaling pathways in human gastric cancer SGC7901 cells. Oncol. Lett. 13 (4): 2737–2744. 2017.https://doi.org/10.3892/ol.2017.5785
Yoshida H., Nishikawa M., Kiyota T. Uno S., Toyota H., Takahashi R., Narita M., Takakura Y. 5'-Phosphate oligodeoxynucleotides enhance the phosphodiester-CpG DNA-induced inflammatory response in macrophages. Eur. J. Immunol. 41 (2): 425–436. 2011.https://doi.org/10.1002/eji.201040396
Zhang S., Chen S., Li Y., Liu Y. Melatonin as a promising agent of regulating stem cell biology and its application in disease therapy. Pharmacol Res. 117: 252–260. 2017.https://doi.org/10.1016/j.phrs.2016.12.035
Savorani C., Manfé V., Biskup E., Gniadecki R. Ellipticine induces apoptosis in T-cell lymphoma via oxidative DNA damage. Leuk. Lymphoma. 56 (3): 739-747. 2015.https://doi.org/10.3109/10428194.2014.929673
Wu X.X., Kakehi Y., Jin X.H., Inui M., Sugimoto M. Induction of apoptosis in human renal cell carcinoma cells by vitamin E succinate in caspase-independent manner. Urology. 73 (1): 193–199. 2009.https://doi.org/10.1016/j.urology.2008.04.055
Тёплый Д.Л. Нейрофизиологические эффекты витамина Е. Астрахань: ЛЕОН. 2008. [ Teplyi D. L. Nejrofiziologicheskie effekty vitamina E [Neurophysiological effects of vitamin E]. Astrahan’: LEON. 2008. (in Russ)].
Crouzin N., de Jesus Ferreira M. C., Cohen-Solal C., M’Kadmi C., Bernad N., Martinez J., Barbanel G., Vignes M., Guiramand J. α-tocopherol and α-tocopheryl phosphate interact with the cannabinoid system in the rodent hippocampus. Free Radic Biol Med. 51 (9): 1643–1655. 2011 .07.012. 2011.https://doi.org/10.1016/j.freeradbiomed
Vineetha R.C., Binu P., Arathi P., Nair R. H. L-ascorbic acid and α-tocopherol attenuate arsenic trioxide-induced toxicity in H9c2 cardiomyocytes by the activation of Nrf2 and Bcl2 transcription factors. Toxicol. Mech. Methods. 28 (5): 353–360. 2018.https://doi.org/10.1080/15376516.2017.1422578
Бажанова Е.Д. Роль циклоферона и альфа-интерферона в регуляции апоптоза нейроэндокринной системы при старении. Журн. эксперим. и клинич. фармакологии. 75 (10): 42–46. 2012. [Bazhanova E.D. Role of Cycloferon and Interferon-Alpha in Apoptosis Regulation in Neuroendocrinal System on Aging. Russian Journal of Experimental and Clinical Pharmacology. 75 (10): 42–46. 2012 (in Russ)].
Hamada T., Niki T., Ishida N. Role of p53 in the entrainment of mammalian circadian behavior rhythms. Genes Cells. 19 (5): 441–448. 2014.https://doi.org/10.1111/gtc.12144
Wawrzyniak A., Górnicka M., Hamułka J., Gajewska M., Drywień M., Pierzynowska J., Gronowska-Senger A. α-Tocopherol, ascorbic acid, and β-carotene protect against oxidative stress but reveal no direct influence on p53 expression in rats subjected to stress. Nutr. Res. 33 (10): 868–875. 2013.https://doi.org/10.1016/j.nutres.2013.07.001
Ayinampudi B.K., Varikoti S.B, Baghirath: V., Vinay B.H., Gayathri C., Gannepalli A. Assessing alpha-tocopherol levels in patients with keratocystic odontogenic tumor: A cross-sectional study. Indian J Dent Res. 28 (2): 122–125. 2017.https://doi.org/10.4103/ijdr.IJDR_714_16
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии