Журнал эволюционной биохимии и физиологии, 2019, T. 55, № 5, стр. 316-323
АДАПТИВНЫЕ МЕХАНИЗМЫ БАРОРЕФЛЕКТОРНОЙ РЕГУЛЯЦИИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ ЭКСТРЕМАЛЬНОЙ ГИПЕРОКСИИ
С. Ю. Жиляев 1, Т. Ф. Платонова 1, О. С. Алексеева 1, *, Е. Р. Никитина 1, И. Т. Демченко 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: sa72@inbox.ru
Поступила в редакцию 22.01.2019
После доработки 08.02.2019
Принята к публикации 15.03.2019
Аннотация
Известными реакциями сердечно-сосудистой системы человека и позвоночных животных на гипероксию являются вазоконстрикция, брадикардия и снижение сократимости левого желудочка сердца. Мы предположили, что все названные реакции представляют собой компоненты барорефлекса, регулирующего артериальное давление и кровообращение при гипероксии. Для проверки этой гипотезы проведены опыты на бодрствующих крысах, у которых регистрировали изменения артериального давления, органного кровотока (в головном мозге, почке и нижних конечностях) и ЭКГ в ответ на дыхание чистым кислородом под давлением 1, 3 и 5 АТА (атмосфер абсолютных). Афферентные и эфферентные пути гипероксического барорефлекса изучались с помощью денервации барорецепторов сино-каротидных зон, перерезки аортальных депрессорных нервов и вагуса. Эффективность барорефлекса оценивалась с помощью инъекций фенилэфрина или спонтанных повышений артериального давления. Исследования продемонстрировали наличие барорефлекторной реакции на вдыхание кислорода, триггером которой является системная вазоконстрикция, приводящая к повышению артериального давления. Вазоконстрикция при гипероксии возникает за счет связывания эндотелиального оксида азота (NO) супероксиданионами с последующей утратой вазодилататорного компонента базального сосудистого тонуса. Барорецепторы в аорте и каротидных синусах с отходящими от них нервными волокнами идентифицированы как афферентное звено гипероксического барорефлекса. Брадикардия и снижение сократимости миокарда левого желудочка реализуют гипероксический барорефлекс путем сдвига симпато-вагусного баланса в сторону преобладания парасимпатикотонии и снижения тонуса симпатического отдела автономной нервной системы. При 1 и 3 АТА О2 эффективность барорефлекса возрастала по сравнению с дыханием атмосферным воздухом, а экспозиция под давлением кислорода 5 АТА подавляла барорефлекторный механизм. Активация ГАМК-ергической системы мозга предохраняла от утраты гипероксического барорефлекса. Барорефлекторный механизм в гипероксии реализует адаптивные реакции сердечно-сосудистой системы, направленные на снижение доставки в организм избыточного кислорода.
ВВЕДЕНИЕ
Барорецепторный рефлекс является наиболее известным нейрогенным механизмом контроля артериального давления. Барорефлекс запускается в ответ на разнообразные внутренние и внешние стимулы, которые вызывают резкое повышение или снижение артериального давления, например, при различных стрессорных состояниях, физической нагрузке и изменениях положения тела в пространстве. Барорефлекторный механизм возвращает артериальное давление к начальному уровню через контролируемые вегетативной нервной системой хронотропные и инотропные реакции сердца и сосудов.
Увеличение содержания кислорода в дыхательной среде в нормобарических или гипербарических условиях никогда не рассматривалось в качестве причинного фактора, запускающего нейрогенный механизм регуляции кровообращения. Тем не менее сердечно-сосудистая система человека и позвоночных животных отвечает на гипероксию путем вазоконстрикции, брадикардии и снижения сократимости миокарда левого желудочка сердца. Указанные физиологические реакции изучаются давно, и каждая из них рассматривается как самостоятельный адаптивный механизм, направленный на ограничение поступления в организм избыточного количества кислорода через снижение кровообращения. Гипероксическая вазоконстрикция наблюдается у человека и животных [1–4] и, как предполагалось, эта реакция осуществляется путем прямого действия кислорода на гладкие мышцы сосудов [5, 6]. Однако за долгие годы изучения феномена гипероксической вазоконстрикции механизм прямого действия кислорода на сосуды остается неясным. Сравнительно недавно показано, что в реализации гипероксической вазоконстрикции принимает участие эндотелий-производный оксид азота [7, 8]. Кровеносные сосуды суживаются по причине того, что усиленно генерируемые в их стенке супероксиданионы связывают (инактивируют) оксид азота (NO), в результате чего утрачивается NO-опосредованный базальный вазорелаксирующий компонент сосудистого тонуса [2, 9–11]. Артериальное давление при дыхании нормобарическим или гипербарическим кислородом повышается как у человека [4, 12], так и у позвоночных животных [13], однако механизм развития острой гипертензии остается малопонятным. Брадикардия является самой известной реакцией на гипероксию, которая ослабевает у животных при блокаде мускариновых холинергических рецепторов или ваготомии [12, 14]. Спектральный анализ вариабельности пульсового ритма показал, что кислород приводит к замедлению сердечных сокращений через повышение активности парасимпатической системы [14], однако причина возникновения брадикардической реакции не ясна. Снижение минутного объема кровотока при гипероксии многократно демонстрировалось и связывалось с брадикардией, хотя понижение сократимости миокарда (уменьшение ударного объема) также не исключалось [15, 16].
Итак, если вазоконстрикцию рассматривать как первичный ответ на гипероксию, приводящую к острой гипертензии, а брадикардию и снижение сердечного выброса – как ответные реакции, тогда все названные сердечно-сосудистые реакции можно объединить в единый барорефлекторный механизм регуляции артериального давления и кровообращения при дыхании кислородом. Данная гипотеза предполагает, что подъем артериального давления, возникающий за счет NO-опосредованной вазоконстрикции, стимулирует аортальные и каротидные барорецепторы, импульсация от которых интегрируется в головном мозге, а затем по нисходящим эфферентным путям вызывает брадикардию и снижение сердечного выброса. Тестирование этой гипотезы являлось целью настоящего исследования, для решения которой были поставлены задачи изучить афферентные, эфферентные и центральные звенья артериального барорефлекса, его устойчивость и эффективность в регуляции сердечно-сосудистой системы при дыхании кислородом под давлением 1, 3 и 5 АТА.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования выполнены на крысах-самцах линии Wistar массой 280–320 г. Протокол опытов одобрен Комиссией по этике ИЭФБ РАН в соответствии с Международными рекомендациями по проведению медико-биологических исследований с использованием животных (CIOMS, Geneva, 1985). Животному под наркозом (нембутал, 50 мг/кг внутрибрюшинно) вводили полиэтиленовые катетеры диаметром 2 мм в дугу аорты через правую сонную артерию и в правое предсердие через яремную вену. Два дисковых электрода устанавливали на груди подкожно для регистрации электрокардиограммы (ЭКГ). Катетеры вместе с отводящими проводами ЭКГ проводили подкожно и закрепляли на кости черепа. Катетеры заполняли раствором, содержащим NaCl (0.9%), глюкозу (2.5%), гепарин (300 МЕ/мл), и промывали ежедневно. Для внутримозгового введения препаратов каждому животному устанавливали металлическую канюлю в боковой желудочек головного мозга (стереотаксические координаты: Р = –1.0 мм, L = 1.5 мм, D = 3.5 мм). В теменную кость черепа билатерально до соприкосновения с твердой мозговой оболочкой имплантировали 2 стальных винта, которые использовались для регистрации ЭЭГ. Канюлю с металлическими винтами фиксировали на кости зубопротезным цементом. В день опыта в боковой желудочек мозга вводили нипекотиновую кислоту (НПК) (Nipecotic acid, Sigma Aldrich, Germany) – неселективный ингибитор синаптических ГАМК-транспортеров. Препарат растворяли в искусственном ликворе и в необходимом количестве (0.05 мг НПК в 7 мкл ликвора) вводили в мозговой желудочек через размещенную в канюле иглу, соединенную с микрошприцем (Hamilton, 10 мкл). Указанная доза является пороговой величиной, выше которой наблюдаются расстройства двигательной функции у крыс при тестировании их на вращающемся стержне (Rotarod test). Животным контрольной группы вводили искусственный ликвор в таком же объеме. Измерения органного кровотока проводили у животных отдельной группы методом клиренса водорода с помощью платиновых электродов, установленных вокруг левой почечной вены, каудальной полой вены и над стоком синусов твердой мозговой оболочки [17]. Для изучения эфферентных и афферентных путей барорефлекса выполняли механическую и химическую деафферентацию каротидных барорецепторов, перерезку аортальных депрессорных нервов или одно- или двустороннюю ваготомию по известной методике [18]. Эксперименты на бодрствующих животных проводились в следующем порядке. Через 5–7 дней после операции крысу размещали в барокамере в специально сконструированной матерчатой жилетке, мягко фиксирующей ее в подвешенном горизонтальном положении. К такой фиксации животное приучали до опыта. После 30-минутной стабилизации измеряли контрольные значения физиологических параметров при дыхании атмосферным воздухом. Далее в течение 30 мин измеряли органный кровоток при дыхании чистым кислородом через маску или определяли индекс чувствительности барорефлекса (ЧБР), являющийся показателем эффективности барорефлекторного контроля артериального давления [19], путем вычисления соотношения между изменением частоты сердечных сокращений и среднего артериального давления в ответ на внутривенное введение фенилэфрина (2 мг/кг). После этого воздух в закрытой барокамере заменяли на кислород (>95% О2) и осуществляли его компрессию со скоростью 1 АТА/мин до достижения заданных значений давления (3 или 5 АТА). Экспозиция (изопрессия) продолжалась в течение 60 минут. Температуру в барокамере поддерживали в пределах 23–25°С. Измерения физиологических параметров (артериальное давление, ЭКГ, ЭЭГ) проводили непрерывно. Во время гипербарической гипероксии (3 и 5 АТА) ЧБР определяли на основе вычислений соотношения между спонтанными изменениями артериального давления и ЧСС у животных в барокамере [19]. Для расчетов применяли специализированные программы обработки данных (LabView 2, iWORK, CA, USA).Статистическую обработку данных проводили с использованием программного обеспечения StatView (SAS Institute, Cary, NC, USA). Абсолютные или процентные изменения гемодинамических параметров и показатели чувствительности барорефлекса сравнивали с исходными величинами на воздухе, используя однофакторный дисперсионный анализ (ANOVA). Двухфакторный дисперсионный анализ с повторением использовали для определения эффектов ГБО2 при сравнении результатов между двумя опытными группами животных. Для выявления достоверности использовали парный t-критерий. Все данные представлены как М ± m, при этом в качестве статистически значимых принимали значения p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
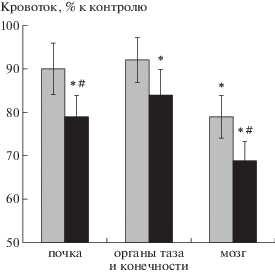
Дыхание чистым кислородом под давлением 1 и 3 АТА приводило к снижению кровотока в головном мозге, левой почке и суммарно в органах таза и нижних конечностях (рис. 1). Уменьшение органного кровотока наблюдалось на фоне подъема артериального давления, что свидетельствует о вазоконстрикции в исследуемых сосудистых бассейнах. Достоверный прессорный эффект выявлялся уже при парциальном давлении кислорода 1 АТА (100% О2 при атмосферном давлении). По мере повышения дозы вдыхаемого кислорода прессорная реакция возрастала. Расчет сосудистого сопротивления току крови (∆ давление/∆ кровоток) в изучаемых органах показал наибольшую величину этого параметра в головном мозге. Следовательно, причиной острого подъема артериального давления является повышение периферического сосудистого сопротивления, возникающего вследствие гипероксической вазоконстрикции в органах.
Рис. 1.
Изменения органного кровотока у крыс при дыхании кислородом под давлением 1 и 3 АТА. По оси абсцисс: исследуемые органы – левая почка, органы малого таза и нижние конечности суммарно, головной мозг. По оси ординат: изменения кровотока при гипероксии, в процентах, по отношению к кровотоку при дыхании воздухом (контроль принят за 100%). 1 АТА (серый), 3 АТА (черный цвет). * p < 0.05 к контролю, # p < 0.05 к 1 АТА.
Прессорные реакции и вазоконстрикция сохранялись при гипероксии после введения селективных или неселективных блокаторов альфа-адренорецепторов (празозин, фентоламин) или бета-адренорецепторов (атенолол, пропранолол). Однако артериальное давление и органный кровоток достоверно не изменялись в ответ на ингаляцию кислорода после системного ингибирования синтазы оксида азота (NOS) с помощью L-NAME (N(G)-Nitro-L-arginine methyl ester).
Рис. 2.
Прессорные реакции артериального давления на дыхание кислородом 1 АТА у крыс с интактными и денервированными барорецепторами. По оси абсцисс: время дыхания кислородом (сек). По оси ординат: изменение артериального давления (мм рт.ст) по отношению к исходным значениям при дыхании воздухом. АКД – аортально-каротидная бароденервация; СКД – сино-каротидная бароденервация; ИНТ – интактные барорецепторы. ** р < 0.01 к СКД и ИНТ.
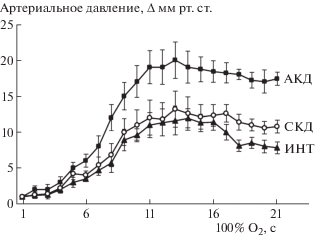
При двусторонней денервации барорецепторов каротидных синусов прессорная реакция на кислород 1 АТА была такой же, как и у интактных животных, тогда как совместная каротидная бароденервация и перерезка аортальных нервов усиливали прессорную реакцию на гипероксию (рис. 2). Прессорная реакция на гипероксию 3 АТА у животных с двусторонней денервацией каротидных барорецепторов достоверно повышалась на 17 ± ± 2.1% (р < 0.05), тогда как у крыс с полной деафферентацией аортальных и каротидных барорецепторов артериальное давление увеличивалось на 39 ± 4.4% (р < 0.05). У крыс с односторонней ваготомией брадикардия ослаблялась в гипероксии 3 АТА на 43 ± 6.4% (р < 0.05) и не проявлялась после перерезки двух вагусных нервов.
Рис. 3.
Эффективность барорефлекса у крыс с интактными и денервированными барорецепторами. По оси абсцисс: изменение систолического давления (мм рт.ст.). По оси ординат: изменение R–R интервалов на ЭКГ (мс). ИНТ – интактные барорецепторы, АКД – аортально-каротидная бароденервация.
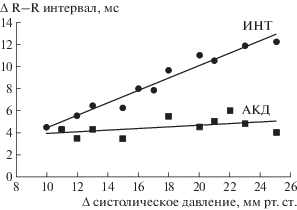
Показатель чувствительности барорефлекса у контрольной группы крыс, определяемый при введении фенилэфрина, составлял 1.07 ± 0.18 (∆ЧСС/∆АД), а при гипероксии 1 АТА этот показатель увеличивался до 1.63 ± 0.23 (рис. 3). Артериальное давление у бодрствующих животных в барокамере иногда резко повышалось, особенно когда крысы пытались освободиться от мягкой тканевой жилетки. Фрагменты таких спонтанных прессорных реакций совместно с ЭКГ использовались для расчета чувствительности барорефлекса [19]. У крыс с интактными барорецепторами индекс ЧБР увеличивался при гипероксии 3 АТА в среднем в 1.9 раза по отношению к контрольной величине (p < 0.05). Полная денервация аортальных и каротидных барорецепторов приводила к утрате барорефлекторной реакции (данные не показаны).
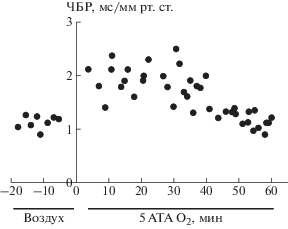
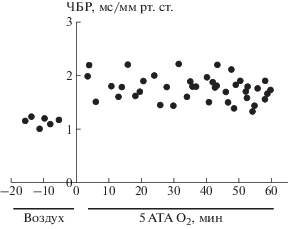
При гипероксии 5 АТА у интактных крыс наблюдались 2-фазные сердечно-сосудистые реакции. В первой фазе отмечались умеренная артериальная гипертензия и брадикардия. Во второй фазе, через 30–40 минут экспозиции в ГБО2 наблюдалось острое повышение артериального давления, развивалась тахикардия и появлялись спайковые, высокоамплитудные разряды на ЭЭГ, свидетельствующие о начале судорожного синдрома. Чувствительность барорефлекса в первой фазе повышалась в среднем в 2.2 раза по отношению к контрольной величине, а во второй фазе барорефлекторная функция резко ослаблялась (рис. 4).
Рис. 4.
Чувствительность барорефлекса у крыс в гипероксии 5 АТА. По оси абсцисс: время гипероксической экспозиции (мин). По оси ординат: чувствительность барорефлекса (ЧБР), мс/мм рт. ст.
Введение нипекотиновой кислоты в латеральный желудочек мозга не вызывало достоверных изменений сердечно-сосудистых параметров у контрольных животных при дыхании атмосферным воздухом. Однако у крыс с денервированными барорецепторами отмечалось замедление сердечного ритма и умеренное понижение артериального давления. Эффективность барорефлекса возрастала в гипероксии после активации ГАМК-ергической системы с помощью нипекотиновой кислоты, а чувствительность барорефлекса сохранялась на одинаковом уровне в течение 60-минутной кислородной экспозиции при давлении 5 АТА (рис. 5).
Рис. 5.
Чувствительность барорефлекса у крыс в гипероксии 5 АТА. После активации ГАМК–ергической системы в головном мозге. По оси абсцисс и ординат: обозначения как на рис. 4.
ОБСУЖДЕНИЕ
Выполненные исследования продемонстрировали наличие барорефлекса при дыхании нормобарическим или гипербарическим кислородом. Триггером рефлекса является острый подъем внутрисосудистого давления, возникающий в результате системной гипероксической вазоконстрикции. Афферентную дугу рефлекса представляют барорецепторы аорты и каротидных синусов вместе с отходящими от них нервными волокнами. Эфферентное звено барорефлекса представлено нисходящими волокнами в составе вагусного нерва, иннервирующими сердце и сосуды. Брадикардия и снижение сердечного выброса являются эффекторами реализации барорефлекса, изменяющими артериальное давление и кровообращение при гипероксии. Следовательно, по структурным компонентам гипероксический рефлекторный механизм не отличается от “классического” барорефлекса, контролирующего быстрые изменения артериального давления. Однако существует несколько отличительных особенностей в реализации нейрогенного рефлекса при гипероксии. Во-первых, если в нормальных физиологических условиях триггером барорефлекса является повышение внутрисосудистого давления, вызываемое, в основном, сосудосуживаюшими симпатическими влияниями, то при гипероксии вазоконстрикция не связана с нервными вазомоторными механизмами. Гипероксия вызывает усиленную продукцию супероксиданионов, которые инактивируют эндотелиальный оксид азота, и, косвенно, вызывают вазоконстрикцию вследствие утраты NO-опосредованного вазодилататорного компонента базального сосудистого тонуса [10, 11]. Убедительным подтверждением этому является отсутствие гипероксической вазоконстрикции у мышей с нокаутом эндотелиальной NOS [20]. Во-вторых, если в нормальных условиях одним из важных исполнительных механизмов барорефлекса является вазодилатация, то при гипероксии основной механизм снижения артериального давления – вагус-опосредованная брадикардия, выявленная в настоящей работе, и снижение сократимости миокарда, показанное нами в предыдущем исследовании [21]. В‑третьих, барорефлекторный механизм в гипероксии понижает возросшее артериальное давление, но полностью не возвращает его к исходному уровню. По всей вероятности, барорефлекс при гипероксии адаптируется или “перезапускается” для обеспечения долговременного контроля артериального давления, как это происходит в условиях хронической гипертонии или после краткого гипертензивного эпизода [22, 23].
В настоящей работе не изучались центральные звенья гипероксического барорефлекса и, в частности, причастность отдельных структур мозга к его реализации. При нормоксии активация барорецепторов увеличивает частоту импульсов, передаваемых по афферентным путям к ядрам солитарного тракта, различным областям продолговатого мозга и к другим вышележащим мозговым структурам, где осуществляется обработка этих сигналов [24]. Участвуют ли указанные структуры в передаче и обработке сигналов при гипероксической активации барорецепторов, остается неизвестным. Можно лишь отметить, что в опытах с введением НПК в желудочек мозга выявлена причастность ГАМК-ергической нейропередачи к барорефлекторной регуляции гемодинамики при гипероксии. Установлено, что активация ГАМК-ергической системы в мозге с помощью ингибирования синаптических ГАМК-транспортеров повышала эффективность барорефлекторной регуляции при экстремальной гипероксии 5 АТА.
Как показали настоящие исследования, эффективность и устойчивость барорефлекса зависели от уровня гипероксического воздействия. Индексы ЧБР при гипероксии 1 и 3 АТА были достоверно выше, чем при дыхании атмосферным воздухом, что свидетельствует о повышении эффективности барорефлекса. При 5 АТА наблюдались фазные изменения ЧБР, которые коррелировали с соответствующими реакциями сердечно-сосудистой системы. В первые 30–40 мин кислородной экспозиции отмечались умеренная брадикардия, снижение активности симпатической нервной системы и повышение индекса ЧБР. Продолжение гипербарической оксигенации приводило к развитию второй фазы, которая характеризовалась переключением брадикардии на тахикардию и резким увеличением симпатической активности. В этот период наблюдались положительный хронотропный и инотропный эффекты в работе сердца, значительное увеличение содержания в плазме крови адреналина и норадреналина, а также острое повышение артериального давления [21]. Чувствительность барорефлекса постепенно снижалась и полностью утрачивалась на фоне появления кислородных судорог.
Эффективность барорефлекса при дыхании кислородом зависела также от продолжительности гипероксического воздействия. При нормоксической гипероксии (100% О2) чувствительность барорефлекса сохранялась примерно в течение 60 ч до появления признаков легочной формы отравления кислородом [25]. При 3 АТА чувствительность барорефлекса была выше, чем до гипероксической экспозиции, и поддерживалась на этом уровне около 4 ч, что позволяет более эффективно реализовать адаптивные гемодинамические реакции, ограничивающие доставку токсической дозы кислорода в организм. Эти реакции в виде прогрессирующей брадикардии и снижения сократительной способности миокарда реализуются путем снижения симпатических и увеличения парасимпатических влияний на сердечную деятельность и периферические сосуды. Существенный вклад в краткосрочную адаптацию к гипероксии вносит также церебральная вазоконстрикция, благодаря которой ограничивается доставка избыточной дозы кислорода в головной мозг и замедляется скорость генерации супероксиданионов и оксида азота [2, 10].
Таким образом, при гипероксии 3 АТА NO-опосредованная вазоконстрикция и последующий барорефлекс совместно ограничивают доставку кислорода, понижают скорость развития окислительного стресса в мозге и отодвигают нейротоксический эффект гипербарического кислорода, по меньшей мере, на 4 часа. Более высокий уровень гипероксии быстро подавляет гипероксический барорефлекс и существенно сокращает время развития кислородных судорог, что мы наблюдали в опытах при 5 АТА. Остается пока неизвестным, какие звенья рефлекторной дуги ответственны за утрату барорефлекса при развитии судорожного синдрома, равно как и какие молекулярные редокс-опосредованные механизмы ответственны за утрату его чувствительности и эффективности. На эти вопросы или на часть из них смогут ответить проводимые нами дальнейшие экспериментальные исследования.
Список литературы
Bulte D.P., Chiarelli P.A., Wise R.G., Jezzard P. Cerebral perfusion response to hyperoxia. J. Cereb. Blood Flow Metab. 27: 69–75. 2007.
Demchenko I.T., Oury T.D., Crapo J.D., Piantadosi C.A. Regulation of the brain’s vascular responses to oxygen. Circ. Res. 91: 1031–1037. 2002.
Floyd T.F., Clark J.M., Gelfand R., Detre J.A., Ratcliffe S., Guvakov D., Lambertsen C.J., Eckenhoff R.G. Independent cerebral vasoconstrictive effects of hyperoxia and accompanying arterial hypocapnia at 1 ata. J. Appl. Physiol. 95: 2453–2461. 2003.
Molénat F., Boussuges A., Grandfond A., Rostain J.-C., Sainty J.-M., Robinet C., Galland F., Meliet J.-L. Haemodynamic effects of hyperbaric hyperoxia in healthy volunteers: An echocardiographic and doppler study. Clin. Sci. (Lond.). 106: 389–395. 2004.
Jackson W.F. Arteriolar oxygen reactivity: Where is the sensor?. Am. J. Physiol. – Heart Circ. Physiol. 253: H1120–H1126. 1987.
Wolin M.S., Ahmad M., Gupte S.A. Oxidant and redox signaling in vascular oxygen sensing mechanisms: Basic concepts, current controversies, and potential importance of cytosolic NADPH. Am. J. Physiol. – Lung Cell. Mol. Physiol. 289: L159–L173. 2005.
Dallinger S., Dorner G.T., Wenzel R., Graselli U., Findl O., Eichler H.-G., Wolzt M., Schmetterer L. Endothelin-1 contributes to hyperoxia-induced vasoconstriction in the human retina. Invest. Ophthalmol. Vis. Sci. 41: 864–869. 2000.
Rousseau A., Tesselaar E., Henricson J., Sjöberg F. Prostaglandins and radical oxygen species are involved in microvascular effects of hyperoxia. J. Vasc. Res. 47: 441–450. 2010.
Rubanyi G.M., Vanhoutte P.M. Superoxide anions and hyperoxia inactivate endothelium-derived relaxing factor. Am. J. Physiol. Heart Circ. Physiol. 250: H822–827. 1986.
Demchenko I.T., Boso A.E., Bennett P.B., Whorton A.R., Piantadosi C.A. Hyperbaric oxygen reduces cerebral blood flow by inactivating nitric oxide. Nitric Oxide. 4: 597–608. 2000.
Pasgaard T., Stankevicius E., Jørgensen M.M., Østergaard L., Simonsen U., Frøbert O. Hyperoxia reduces basal release of nitric oxide and contracts porcine coronary arteries. Acta Physiol. 191: 285–296. 2007.
Shibata S., Iwasaki K.-I., Ogawa Y., Kato J., Ogawa S. Cardiovascular neuroregulation during acute exposure to 40, 70, and 100% oxygen at sea level. Aviat. Space Environmen. Med. 76: 1105–1110. 2005.
Gole Y., Gargne O., Coulange M., Steinberg J.-G., Bouhaddi M., Jammes Y., Regnard J., Boussuges A. Hyperoxia-induced alterations in cardiovascular function and autonomic control during return to normoxic breathing. European J. Appl. Physiol. 111: 937–946. 2011.
Larsson A., Uusijärvi J., Eksborg S., Lindholm P. Tissue oxygenation measured with near-infrared spectroscopy during normobaric and hyperbaric oxygen breathing in healthy subjects. European J. Appl. Physiol. 109: 757–761. 2010.
Neubauer B., Tetzlaff K., Staschen C.-M., Bettinghausen E. Cardiac output changes during hyperbaric hyperoxia. Intern. Arc. Occupation. Environmen. Health. 74: 119–122. 2001.
Savitt M.A., Rankin J.S., Elberry J.R., Owen C.H., Cam-poresi E.M. Influence of hyperbaric oxygen on left ventricular contractility, total coronary blood flow, and myocardial oxygen consumption in the conscious dog. Undersea Hyperb. Med. 21: 169–183. 1994.
Демченко И.Т. Измерения органного кровотока методом водородного клиренса. Физиол. Ж. СССР им. И.М. Сеченова. 67 (1):178-183. 1981. [Demchenko I.T. Measurement of organ blood flow by means of hydrogen clearance. Fiziol. Zh. SSSR im. I.M. Sechenova. 67 (1):178–183. 1981 (in Russ)].
Schreihofer A.M., Sved A.F. Use of sinoaortic denervation to study the role of baroreceptors in cardiovascular regulation. Am. J. Physiol. – Regulat. Integr. Compar. Physiol. 266: R1705–R1710. 1994.
Stauss H.M., Moffitt J.A., Chapleau M.W., Abboud F.M., Johnson A.K. Baroreceptor reflex sensitivity estimated by the sequence technique is reliable in rats. Am. J. Physiol. – Heart Circ. Physiol. 291: H482–H483. 2006.
Atochin D.N., Demchenko I.T., Astern J., Boso A.E., Piantadosi C.A., Huang P.L. Contributions of endothelial and neuronal nitric oxide synthases to cerebrovascular responses to hyperoxia. J. Cereb. Blood Flow Metab. 23: 1219–1226. 2003.
Demchenko I.T., Zhilyaev S.Y., Moskvin A.N., Piantadosi C.A., Allen B.W. Autonomic activation links cns oxygen toxicity to acute cardiogenic pulmonary injury. Am. J. Physiol. – Lung Cell. Mol. Physiol. 300: L102–L111. 2011.
Thrasher T.N. Baroreceptors, baroreceptor unloading, and the long-term control of blood pressure. Am. J. Physiol. – Regul. Integr. Compar. Physiol. 288: R819–R827. 2005.
Guyenet P.G. The sympathetic control of blood pressure. Nat. Rev. Neurosci. 7: 335–346. 2006.
Henderson L.A., Richard C.A., Macey P.M., Runquist M.L., Yu P.L., Galons J.-P., Harper R.M. Functional magnetic resonance signal changes in neural structures to baroreceptor reflex activation. J. Appl. Physiol. 96: 693–703. 2004.
Demchenko I.T., Welty-Wolf K.E., Allen W.A., Piantadosi C.A. Similar but not the same: normobaric and hyperbaric pulmonary oxygen toxicity, the role of nitric oxide. Am. J. Physiol. Lung Cell Mol. Physiol. 293: L229–L238. 2007.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


