Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 3, стр. 213-223
АКТИВНОСТЬ ФЕРМЕНТОВ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА И СОДЕРЖАНИЕ АТФ В ТКАНЯХ МОЗГА И ЖАБР МОРСКОГО ЕРША SCORPAENA PORCUS LINNAEUS ПРИ КРАТКОВРЕМЕННОЙ ГИПОКСИИ
А. А. Солдатов 1, 2, *, И. В. Головина 1, Е. Э. Колесникова 1, И. В. Сысоева 1, А. А. Сысоев 1, Т. А. Кухарева 1, Е. С. Кладченко 1
1 ФГБУН ФИЦ “Институт биологии южных морей имени А.О. Ковалевского РАН”
Севастополь, Россия
2 ФГАОУ ВО Севастопольский государственный университет
Севастополь, Россия
* E-mail: alekssoldatov@yandex.ru
Аннотация
В условиях эксперимента изучали влияние краткосрочной гипоксии на активность оксиредуктаз (малат- и лактатдегидрогеназы: МДГ, ЛДГ) в структурах головного мозга и жабр (передняя дуга) морского ерша, определяющих процессы срочной адаптации организма к дефициту кислорода. Контрольная группа рыб содержалась при 4.5–6.7 мг O2 л–1 (нормоксия), опытные группы – при 1.7–3.7 мг O2 л–1 (умеренная гипоксия) и 0.3–1.0 мг O2 л–1 (острая гипоксия). Содержание кислорода в воде снижали путем насыщения ее азотом. Экспозиция – 90 мин. Температура воды – 21–22°С. Показано, что гипоксия не оказывала значимого влияния на структуры головного мозга морского ерша. Активность МДГ, ЛДГ, значения индекса МДГ/ЛДГ и содержание АТФ в переднем, промежуточном и среднем мозге (СПМ), а также продолговатом мозге (ПМ) в условиях острой гипоксии сохранялись на уровне контрольных значений. Умеренные формы гипоксии вызывали пропорциональный рост активности МДГ, ЛДГ и повышение уровня АТФ в СПМ. Последнее скорее является следствием снижения потребности СПМ в данном соединении, в основе этого явления может лежать ГАМК-эргический механизм регуляции активности тканевых структур мозга, который способен понижать энергетические потребности нервной ткани за счет увеличения плотности ГАМКА рецепторного аппарата. Жабры отличались минимальными активностями МДГ, ЛДГ при высоких значениях индекса МДГ/ЛДГ. Острые формы гипоксии приводили к снижению в них активности ЛДГ и повышению значений индекса МДГ/ЛДГ, что отражает переход данного органа на анаэробный режим работы. В условиях острой гипоксии отмечалось усиление связи в системе “активность МДГ ↔ активность ЛДГ” (r = 0.81–0.94, p < 0.05–0.01) во всех типах тканевых структур, что характерно для видов, толерантных к дефициту кислорода. По-видимому, основу данного эффекта составляет сопряжение МДГ с субстратами гликолиза в условиях острого дефицита О2, что исключает накопление лактата при метаболической депрессии.
ВВЕДЕНИЕ
Жизнь в водной среде значительно увеличивает вероятность возникновения гипоксии, которая связана прежде всего с тем, что вода может содержать гораздо меньше О2, чем воздух, а также потому, что скорость диффузии О2 в воде составляет лишь около 1/10 000 от скорости диффузии в воздухе [1]. Именно поэтому у водных обитателей гипоксия может быть важной движущей силой выработки физиологических стратегий выживания [1], конечной целью которой является формирование устойчивости к гипоксии/аноксии.
При внешней гипоксии “первую линию обороны” организма рыб составляют кардиореспираторные рефлексы, которые обеспечивают предельно корректный баланс потребления О2 согласно метаболическому запросу [2]. Обычно рыбы реагируют на гипоксию рефлекторной брадикардией и усилением вентиляторных движений [3]. Источником кардиореспираторных реакций является активность специализированных О2-чувствительных хеморецепторов в виде хромаффинных нейро-эпителиальных клеток, преимущественно располагающихся на первых жаберных дугах [4, 5]. При изменении напряжения кислорода (PwО2) афферентная импульсация от жаберных хеморецепторов поступает в соответствующие нервные центры продолговатого мозга, где преобразуется в реакции дыхательной и сердечно-сосудистой систем.
“Вторую линию обороны” при изменениях PwО2 составляют быстрые и адекватные метаболические перестройки. Животные с более развитой толерантностью к гипоксии/аноксии могут реагировать на резкое снижение О2 в окружающей среде, перепрограммируя свой метаболизм, чтобы скорректировать продукцию и потребление АТФ и предотвратить катастрофические последствия резкого падения энергетического статуса клеток. Выживаемость и переносимость гипоксии, по-видимому, прежде всего определяются способностью рыб поддерживать стабильный уровень АТФ в тканях, несмотря на снижение продукции энергии [6]. Установлено, что поддержание энергетического баланса может достигаться за счет активации O2-независимой продукции АТФ, в том числе за счет анаэробного гликолиза, равно как и за счет обратимой депрессии метаболизма [6]. Причем у рыб первичной и универсальной причиной гибели при экспозиции к гипоксии является нарушение гомеостаза АТФ в мозге независимо от общей устойчивости определенного вида к фактору гипоксии [7].
Оценку параметров энергетического обмена, интенсивности и направления составляющих его путей проводят на основании определения активности ряда ферментов энергетического метаболизма [8]. Малатдегидрогеназа (МДГ, НФ 1.1.1.37) – фермент, катализирующий окислительно-восстановительное превращение малата и оксалоацетата, а также окислительное декарбоксилирование малата до пирувата; относится к оксидоредуктазам, действующим на CH–OH-группу донора водорода, акцептором которого являются НАД+ или НАДФ+. МДГ принимает участие в глюконеогенезе и липогенезе и вовлекается в малат-аспартатный шунт при аэробном гликолизе. На двойственную роль МДГ в аэробном и анаэробном метаболизме указывает использование оксалоацетата и НАДН МДГ в качестве субстрата [9]. Для индикации уровня гликолиза используется активность лактатдегидрогеназы (ЛДГ, НФ 1.1.1.27), катализирующей взаимопревращения лактата и пирувата. ЛДГ участвует в завершении гликолиза с образованием лактата или в окислении лактата до пирувата, который поступает в цикл трикарбоновых кислот, либо в глюконеогенезе. ЛДГ является главным индикатором анаэробного потенциала организма [10]. Соотношение активности цитоплазматической МДГ и ЛДГ используется как маркер интенсивности и направленности окислительных процессов в тканях [9–16]. Увеличение индекса МДГ/ЛДГ свидетельствует об адаптивной реакции организма на условия гипоксии, что происходит, в основном, за счет ингибирования активности ЛДГ, при этом возрастает роль МДГ в поддержании уровня НАДН, необходимого для гликолитического процесса.
Отдельные виды черноморских рыб обладают высокой степенью устойчивости к действию гипоксии, в частности, морской ерш – Scorpaena porcus [17, 18], что позволяет этим рыбам переносить 20–30 мин эпизоды аноксии [19]. Ранее тканевые механизмы высокой устойчивости скорпены к гипоксии – биохимические адаптации [11] – были исследованы недостаточно.
В настоящей работе исследуются активность МДГ, ЛДГ и содержание АТФ в органах, ответственных за процессы срочной адаптации организма к дефициту кислорода (мозг и жабры), у толерантного к гипоксии морского ерша в условиях кратковременной гипоксии различной степени тяжести.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа выполнена на половозрелых особях черноморского ерша Scorpaena porcus Linnaeus, 1758 в летний период (17 экз., II–III стадия зрелости гонад, длина тела – 15–17 см, вес – 90–110 г). Рыбу отлавливали в июле при помощи ставного невода в акватории Севастополя (Крым) и доставляли в лабораторию в течение двух–трех часов в пластиковых баках объемом 60 л с принудительной аэрацией. После отлова ершей помещали в проточный аквариум, температура воды в котором была такая же, как в море (21–22°С), и выдерживали в течение одной недели для снятия стресса после отлова и транспортировки. Особей кормили рыбным фаршем, в работе использовали только подвижных и активно питающихся ершей.
Экспериментальная часть выполнена с применением специально разработанного стенда, который позволяет стабилизировать требуемую температуру и концентрацию кислорода в воде на протяжении неограниченного периода времени. Температура воды в рабочей камере поддерживалась на уровне 21–22°С. Фотопериод – 12 ч день: 12 ч ночь. Содержание кислорода – 4.5–6.7 мг O2 л–1 (контрольная группа). После адаптации к этим условиям (24 ч) содержание кислорода в воде в одной серии экспериментов снижали в течение 2.5–3.0 ч до 0.3–1.0 мг O2 л–1 (опыт 1), а в другой серии – до 1.7–3.7 мг O2 л–1 (опыт 2) путем прокачивания азота. Экспозиция особей в обеих сериях эксперимента составляла 90 мин. Содержание кислорода в воде контролировали потенциометрически с помощью оксиметра ELWRO PRL T N5221 (Польша).
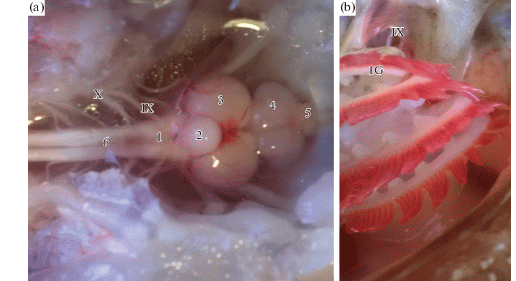
Ткани (мозг, жабры) для исследования брали сразу после декапитации рыб. Препарирование тканей, гомогенизацию и центрифугирование проводили при охлаждении (0 ± 4°С). Образцы мозга разделяли на две части: средний, передний и промежуточный (далее СПМ) и продолговатый мозг (далее ПМ), мозжечок экстирпировали и не учитывали в исследовании в связи с его отдельной, сложной функцией (рис. 1). Навески тканей хранили при температуре –80°С в морозильной камере (Farma 900 Series, Termo Scientific, USA).
Рис. 1.
Общий вид мозга (a) и жаберного аппарата (b) Scorpaena porcus.
1 – продолговатый мозг; 2 – мозжечок; 3 – средний мозг; 4 – передний мозг; 5 – обонятельные доли переднего мозга; 6 – спинной мозг; 1G – первая жаберная дуга; IX – языкоглоточный черепно-мозговой нерв, иннервирующий первую жаберную дугу; X – блуждающей черепно-мозговой нерв. Fig. 1. 1 – oblongata; 2 – cerebellum; 3 – mesencephalon; 4 – forebrain; 5 – olfactory lobes of the forebrain; 6 – spinal chord; 1G-1st gills bow; IX – lat. nervus glossopharyngeus, innervating 1G; Х – lat. nervus vagus.
Активность цитоплазматических оксидоредуктаз – малатдегидрогеназы (L-малат: НАД-оксиредуктаза; МДГ, 1.1.1.37) и лактатдегидрогеназы (лактат: НАД-оксидоредуктаза; ЛДГ, 1.1.1.27) – измеряли спектрофотометрически в кварцевой кювете c ходом луча 10 мм, объемом 3 мл при длине волны 340 нм по скорости окисления восстановленной формы кофермента НАДН, используя в качестве трансформирующей среды 0.2 М Трис-HCl буфер, рН 7.5, как описано ранее [20]. Изменение оптической плотности на 0.207 соответствует превращению 0.1 мкмоль субстрата. Реакцию начинали внесением экстракта и снимали отсчеты через 30 с в течение 2–3 мин. Температура инкубации реакционной смеси составляла 25°C. Субстратом для определения активности ЛДГ служил пируват, а для МДГ – оксалоацетат. Удельную активность ферментов выражали в мкмолях НАДН мин–1 мг–1 белка супернатанта. Содержание белка определяли микробиуретовым методом, экстинкцию измеряли при длине волны 330 нм. В качестве стандарта для построения калибровочной кривой использовали препарат кристаллического сывороточного альбумина.
Навески тканей, хранившихся при температуре –80°С, помещали в 3 мл кипящего трис-ацетатного буфера (рН 7.75) для дезактивации АТФ-азы, гомогенезировали и инкубировали в течение 5 мин на кипящей водяной бане. Средняя масса навески жабр составляла 38 мг, СПМ – 28 мг, ПМ – 12 мг. Охлажденные экстракты хранили при температуре –80°С до определения АТФ. Содержание АТФ в тканях определяли хемилюминесцентным методом с регистрацией на приборе ATP-Luminometer (LKB–1250, Швеция) [21]. Результаты выражали в нг АТФ мг–1 сырой массы ткани.
Результаты представлены как M ± m. Нормальность распределения проверена при помощи критерия Пирсона. Статистически сравнения выполнены на основе двустороннего t-критерия Стьюдента. Различия считали значимыми при p < 0.05. Уровень двусторонней корреляции рассчитывали по Спирмену. Статистическая обработка и графическое оформление полученной информации проводились при помощи стандартного пакета “Grapher-7”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Реакция тканей морского ерша на краткосрочную ранжированную гипоксию была неоднозначна.
В тканях СПМ выявлена максимальная активность МДГ и ЛДГ: 4.70 ± 0.22 и 2.09 ± 0.22 мкмоль НАД Н2 мин–1 мг–1 белка, соответственно (рис. 2). В сравнении с ПМ различия были незначительны 4–15% (p > 0.05), тогда как в отношении жабр они достигали 7–11 раз (p < 0.001). Индекс МЛГ/ЛДГ находился на уровне 2.55 ± 0.27. При этом содержание АТФ в СПМ, напротив, было минимально – 0.74 ± 0.17 нг АТФ мг–1 сырого веса ткани, что в 1.7–2.2 раза ниже (p < 0.05), чем ПМ и жабрах (рис. 3 ).
Рис. 2.
Активность МДГ (a, b), ЛДГ (c, d) и индекс МДГ/ЛДГ (e) в жабрах и мозгу Scorpaena porcus. 1 – контроль; 2 – умеренная гипоксия; 3 – острая гипоксия. СПМ – средний, передний и промежуточный мозг; ПМ – продолговатый мозг; * – достоверно по сравнению с контролем, р < 0.05; ** – достоверно по сравнению с умеренной гипоксией, р < 0.05. Fig. 2. MDH activity (a, b), LDH activity (c, d) and MDH/LDH index (e) in the gills and brain of Scorpaena porcus. 1 – control; 2 – moderate hypoxia; 3 – acute hypoxia. MFD – midbrain, forbrain and diencephalon; OB – oblongate; * – reliable compared to control, p < 0.05; * * – reliable compared to moderate hypoxia, p < 0.05.
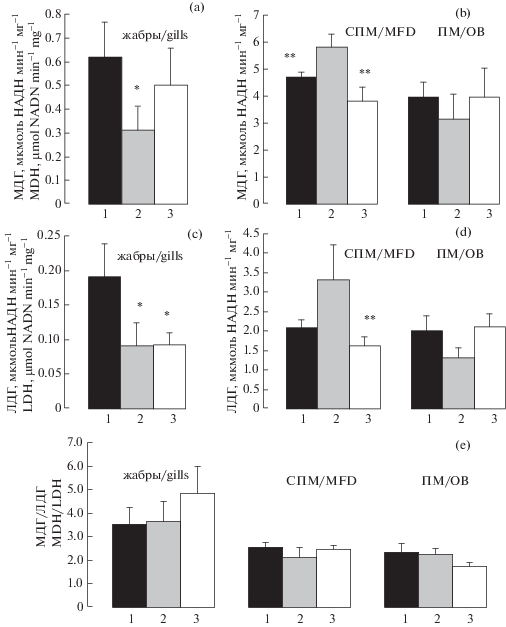
Рис. 3 .
Содержание АТФ в жабрах и мозгу Scorpaena porcus. Обозначения – как на рис. 2. Fig. 3. Content of ATP in gills and brain of Scorpaena porcus. The notation are as in Fig. 2.
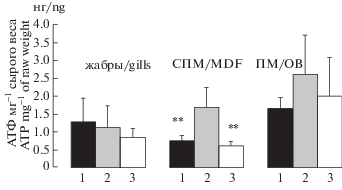
Содержание особей морского ерша в условиях умеренной гипоксии (1.7–3.7 мг O2 л–1) сопровождалось пропорциональным ростом активности обоих ферментов. При этом статистически значимые отличия зарегистрированы только в отношении МДГ (p < 0.05). Значения индекса МДГ/ЛДГ сохранялись на уровне контрольных значений. Одновременно в ткани повышалось содержание АТФ на 27.3% (p < 0.05).
Острые формы гипоксии (0.3–1.0 мг O2 л–1), напротив, не приводили к изменению энергетического статуса ткани. Активности МДГ, ЛДГ, значения индекса МЛГ/ЛДГ и содержание АТФ были близки к значениям, зарегистрированным у рыб в условиях нормоксии (4.5–6.7 мг O2 л–1). Имеющиеся различия не были статически выражены.
ПМ. Данная структура, в сравнении с СПМ, является филогенетически более древней. При сходных значениях активности МДГ и ЛДГ, относительно СПМ, в ПМ отмечен более высокий уровень АТФ. Он в 2.2 раза превышал величины, полученные для СПМ (p < 0.05; рис. 2). При этом реакция ПМ на умеренные и острые формы гипоксии не была выражена. Все измеряемые величины сохранялись на уровне контрольных значений. Рост содержания АТФ в ткани носил характер тенденции и не был статистически значимым (p = = 0.063; рис. 3 ).
Жабры. В сравнении с СПМ и ПМ жабры характеризовались минимальными активностями МДГ и ЛДГ, о чем упоминалось выше (рис. 2). При этом значения индекса МДГ/ЛДГ были выше, чем в тканевых структурах мозга (p < 0.05).
Умеренные формы гипоксии приводили к снижению активности обоих ферментов на 50–63% (p < 0.05; рис. 2). Изменения были пропорциональны. Значения индекса МЛГ/ЛДГ относительно контроля не изменялись. В условиях острой гипоксии снижалась только активность ЛДГ на 53–54% (p < 0.05), что приводило к росту индекса на 39–40%. Однако последние изменения не были достоверны (p = 0.066). При этом уровень АТФ в жабрах был стабилен и не зависел от вариантов гипоксической нагрузки (рис. 3 ). В целом при усилении гипоксической нагрузки заметна тенденция к росту индекса МЛГ/ЛДГ и одновременному снижению уровня АТФ в жабрах (p = 0.068).
Корреляционные отношения. Следует обратить внимание на следующие моменты. В СПМ в условиях нормоксии (4.5–6.7 мг О2 л–1) и умеренной гипоксии (1.7–3.7 мг О2 л–1) значения коэффициента корреляции (r) не превышали 0.6 (табл. 1). Тогда как острые формы гипоксии (0.3–1.0 мг О2 л–1), напротив, характеризовались усилением этого взаимодействия: r превышал 0.8 (p = 0.061). Увеличение значений r в условиях острой гипоксии показано и для жабр. Однако оно не было статистически значимо (p = 0.315). В случае с ПМ рост r значений отмечали уже при умеренных формах гипоксии: значения коэффициента превышали 0.9 (p < 0.05) и сохранялись на этом уровне в условиях острой гипоксии.
Таблица 1.
Коэффициент корреляции (r) между активностью МДГ и ЛДГ при нормоксии и гипоксии в тканях Scorpaena porcus Table 1. Correlation coefficient (r) between MDH and LDH activity in normoxia and hypoxia in tissues of Scorpaena porcus
| Ткани Tissues | Концентрация кислорода, мг О2 л–1 Concentration of O2, mg L–1 | ||
|---|---|---|---|
| 4.5–6.7 | 1.7–3.7 | 0.3–1.0 | |
| СПМ/MDF | 0.52 ± 0.19 | 0.57 ± 0.17 | 0.81 ± 0.19 |
| ПМ/OB | 0.74 ± 0.09 | 0.96 ± 0.06 | 0.94 ± 0.07 |
| Жабры/Gills | 0.75 ± 0.18 | 0.61 ± 0.16 | 0.87 ± 0.15 |
ОБСУЖДЕНИЕ
Из представленной выше информации необходимо остановиться на следующих аспектах:
• СПМ отличался высокой активностьюМДГ и ЛДГ и минимальным содержанием АТФ. Умеренные формы гипоксии (1.7–3.7 мг O2 л–1) индуцировали рост активности данных ферментов при сохранении значений индекса МДГ/ЛДГ. Одновременно повышалось содержание АТФ в ткани. Острые формы гипоксии не оказывали существенного влияния на энергетический статус СПМ.
• Гипоксия не оказывала значимого влияния на состояние ПМ.
• Жабры отличались минимальными активностями МДГ, ЛДГ при высоких значениях индекса МДГ/ЛДГ. Острые формы гипоксии приводили к снижению активности ЛДГ и повышению значений индекса МДГ/ЛДГ.
• В условиях острой гипоксии отмечалось усиление связи в системе “активность МДГ ↔ активность ЛДГ” во всех типах тканей при достоверном увеличении коэффициента корреляции между активностью ферментов (r = 0.81–0.94, p < 0.05–0.01).
Мозг костистых рыб относится к ихтиопсидному типу и является ведущим центром рефлекторной деятельности. В мозгу рыб выделяют следующие основные отделы – передний, промежуточный, средний мозг, мозжечок и продолговатый мозг [22, 23]. Степень развития отделов мозга рыб зависит от сенсорного потока, поступающего из среды. Мозг донных рыб в среднем крупнее, чем у пелагических [17]. Размеры мозжечка донных рыб относительно малы, однако передний и продолговатый отделы мозга развиты сильнее.
Мозг является наиболее сложным, чувствительным к О2 органом, состоящим из множества структурных и функциональных компонентов с заметно различающимися и независимо регулируемыми уровнями функциональной и метаболической активности. Основной путь использования глюкозы мозгом – аэробное окисление, которое определяет крайне высокую чувствительность мозга к гипоксии. Кроме того, известно, что часть промежуточных продуктов окисления глюкозы используется мозгом для образования медиаторов (ацетилхолина, ГАМК), которые (в частности, ГАМК) служат поддержанию устойчивости мозга к гипоксии, а также для резервирования ацетильного остатка в виде ацетиласпартата [24, 25]. Известно, что мозг рыб, а также почки и жабры используют 60–90% потребляемой глюкозы [26], что указывает на их высокую метаболическую активность.
Реакция СПМ на гипоксию. Анализ результатов исследования показал, что умеренные формы гипоксии (1.7–3.7 мг О2 л–1) активизировали обменные процессы в СПМ (рис. 2). Об этом свидетельствовал пропорциональный рост активности МДГ и ЛДГ при сохранении значений индекса МДГ/ЛДГ. Одновременно в ткани повышалось содержание АТФ (рис. 3 ). Последнее скорее является следствием снижения потребности СПМ в данном соединении. В основе данного явления может лежать ГАМК-эргический механизм (ГАМК – γ‑аминомасляная кислота). Он приобретает ведущее значение при адаптации структур мозга к условиям гипоксии/аноксии, поскольку способствует уменьшению запроса нервной ткани на макроэрги под тормозным воздействием ГАМК [27]. Установлено, что при аноксии (2 ч) количество ГАМКА рецепторов способно увеличиваться, продолжая расти до 24 ч экспозиции [28], что повышает эффективность реализации тормозного действия высвобождающейся ГАМК. Данный механизм считают универсальным (по плотности рецепторного аппарата мозга, его регуляторным и кинетическим свойствам) для разных классов позвоночных животных [29].
Полученные нами данные по увеличению активности ферментов энергетического метаболизма в структурах СПМ скорпены при умеренной гипоксии совпадают с представлениями о предпочтительном использовании гликогена в мозге некоторых бесчелюстных и бентосных костистых рыб в качестве ближайшего источника глюкозы при снижении РwО2, а также возможном привлечении к метаболическим преобразованиям лактата или кетонов при дефиците глюкозы [30].
Острые формы гипоксии (0.3–1.0 мг O2 л–1), напротив, не оказывали существенного влияния на состояние СПМ. Все контролируемые показатели сохранялись на уровне контрольных величин (рис. 2 и 3 ).
Причины устойчивости структур СПМ к гипоксии могут быть следующие. Маловероятно, что гипоксия усиливала анаэробные процессы в данном отделе мозга, поскольку это было бы сопряжено со снижением уровня АТФ, что в свою очередь ограничивало бы дыхательную и сердечную ритмику. Скорее всего в СПМ сохраняется аэробная ориентация метаболизма и поддержание этого обеспечивается избирательным перераспределением и активизацией объемного кровотока. Такая реакция отмечена у ряда видов рыб [31]. Она происходит на фоне мобилизации гликогена печени [32] и росте содержания глюкозы в крови [33]. С другой стороны, виды, устойчивые к острым формам гипоксии, содержат в митохондриях цитохромоксидазу, обладающую высоким сродством к кислороду. Это позволяет поддерживать аэробный метаболизм при крайне низком напряжении О2 в ткани [34]. Не следует исключать из внимания и нескомпенсированный тип организации дыхательной цепи в митохондриях, для которого характерно увеличение содержания терминальной группы цитохромов (аа3). Последнее было отмечено нами ранее для ряда донных видов рыб [35]. Определенное значение в адаптации СПМ к острым формам гипоксии может иметь и ГАМК-эргический механизм, снижающий запрос нервной ткани на АТФ, который был рассмотрен выше [27].
Реакция ПМ на гипоксию. Продолговатый мозг (ПМ) рыб принимает участие в образовании ствола мозга и содержит базовые рефлекторные центры, регулирующие дыхание, сердечную деятельность, тонус сосудов, является местом прохождения восходящих и нисходящих путей. В ПМ расположены ядра шести пар (V–X) черепно-мозговых нервов [22]. Как уже отмечали, ПМ является эволюционно наиболее древним отделом головного мозга. Наличие в ПМ респираторного и сердечно-сосудистого центров накладывает определенные требования на поддержание кислородного гомеостаза в данном отделе мозга. Из результатов, представленных в настоящей работе, следует, что ПМ имел сопоставимые с СПМ активности МДГ и ЛДГ (рис. 2). При этом уровень АТФ в данной структуре был более чем в 2 раза выше (рис. 3 ). Умеренные и острые формы гипоксии не оказывали существенного влияния на метаболизм ПМ. Все измеряемые величины сохранялись на уровне контрольных значений, что позволяет поддерживать активность автоматических нервных центров в данной структуре, прежде всего респираторного и сердечно-сосудистого. Известно, что способность поддерживать стабильные уровни АТФ во время гипоксии, особенно в оксифильных тканях, таких как мозг, считается признаком толерантности к гипоксии [36].
В основе толерантности ПМ к дефициту кислорода, по-видимому, лежит изначально низкая скорость аэробного обмена. Об этом свидетельствует высокий уровень АТФ в данной структуре в сравнении со СПМ. За этим качеством могут стоять высокая плотность ГАМКА рецепторов, повышенное содержание цитохромов терминальной группы (аа3), высокое сродство к кислороду цитохромоксидазы и т.д.
Жабры. Жаберный аппарат морского ерша, как и у других бентосных видов рыб, обладает относительно небольшой площадью по сравнению с активными, быстро плавающими рыбами [37]. Для изучения особенностей метаболического профиля скорпены нами использовалась ткань только первой жаберной дуги (рис. 1b). Как известно, первые жаберные дуги многих видов костистых рыб, включая скорпену [38], получают иннервацию со стороны языкоглоточного (IX) и блуждающего (X) нервов (рис. 1a) и содержат чувствительные к колебаниям РwО2 нейро-эпителиальные клетки, что определяет специфическую функцию первой жаберной дуги в качестве места расположения О2‑сенсора, запускающего каскад кардиореспираторных рефлексов как “первую линию обороны” при гипоксии [3].
С точки зрения цитоморфологии жаберный эпителий рыб представляет собой “мозаику” респираторных, слизистых и хлор-секретирующих клеток – ионоцитов, содержащих большое количество митохондрий [39]. Респираторные клетки, контактирующие с артериальным кровотоком, составляют существенную часть эпителия жаберных ламелл; в то же время как ионоциты, топографически связанные с венозным руслом, располагаются преимущественно на филаментах. Жаберная ткань характеризуется высокой интенсивностью кровотока; давление в афферентной жаберной артерии составляет около 30 мм рт. ст. и является одним из самых высоких, зарегистрированных у позвоночных животных [40]. Установлено, что респираторные клетки напрямую связаны не только с газообменом в жаберном аппарате, а также с регуляцией кислотно-щелочного баланса, выделением аммония и других продуктов азотного катаболизма [41]. За исключением обмена воды, кислорода и углекислого газа, которые, по-видимому, определяются простой диффузии, все остальные процессы, упомянутые выше, требуют приложения значительной метаболической активности и затраты макроэргов.
Известно, что на снижение РwО2 многие виды рыб реагируют уменьшением частоты сердечных сокращений и увеличением частоты дыхания; причем, брадикардия обычно компенсируется повышением давлением кровотока [42]. Очевидно, подобного рода физиологическая реакция рыб оказывается полезной для эффективности поглощения О2, поскольку более высокое пульсовое давление способствует расправлению жаберных ламелл и приводит к выраженному равномерному распределению интраламеллярного кровотока. В упомянутой ситуации “раскрытие” закрытых ламелл под действием высокого давления крови сопровождается их интенсивной перфузией на фоне гипоксии, содействуя наиболее полному удовлетворению кислородного запроса организма рыб. Диффузионная способность жаберной ткани при гипоксии может заметно повышаться на фоне увеличения кровотока либо гематокрита [43].
Ткани жабр характеризуются существенным “внутренним” поглощением О2 жаберными филаментами, которое не относится непосредственно к дыхательной функции жаберного аппарата и связано прежде всего с функционированием специализированных жаберных клеток-ионоцитов [40]. В покое жаберная ткань потребляет около 27% О2, составляя всего лишь 3.9% от массы тела [43].
Известно, что одними из следствий адаптации организма рыб к гипоксии являются накопление лактата (лактатный ацидоз) и снижение рН крови; причем в зависимости от видовой принадлежности упомянутые сдвиги имеют разную степень выраженности [44, 45]. Показано, что жабры и почки рыб являются основными участками ионного и кислотно-щелочного обмена с помощью Na+/кислотного и Cl–/щелочного эквивалентов [46]. При этом жаберная ткань в 2–3 раза эффективнее почек по степени нейтрализации кислотной нагрузки [47]. Развитие плазменного ацидоза в условиях внешней гипоксии у рыб может быть обусловлено не только накоплением лактата, но и ростом РСО2 вследствие слабой буферной емкости крови [48]. Отмечено также, что жабры у рыб не отличаются высокой эффективностью по выведению СО2 из крови [49]. Дополнительным активатором метаболического феномена в жабрах скорпены следует считать высвобождение адреналина, который обладает дополнительной способностью увеличивать проницаемость жабр для воды [50] и газов, в частности для О2 [49]. Таким образом, помимо функции респирации жаберная ткань, является своего рода регулятором рН, РО2 в крови при стрессорных воздействиях, которая при прогрессирующей гипоксии должна реагировать на увеличение концентрации лактата, СО2 и других метаболических агентов.
Из результатов, представленных в настоящей работе, следует то, что жабры при крайне низких активностях МДГ и ЛДГ относительно СПМ и ПМ имеют более высокие значения индекса МДГ/ЛДГ (p = 0.061) (рис. 2), отражающие анаэробную ориентацию метаболизма в данном органе. Доказательством этого является значительный ресурс гликогена в жаберной ткани, отмеченный в работах на представителях рода Fundulus [51], а также способность их к утилизации повышенных количеств лактата [41]. Снижение активности МДГ и ЛДГ в жабрах в условиях умеренной гипоксии (1.7–3.7 мг O2 л–1), отмеченное в настоящей работе, при сохранении значений индекса МДГ/ЛДГ и ресурса АТФ, следует рассматривать как общую метаболическую депрессию. Данная реакция характерна для начальных этапов адаптации большинства гидробионтов к условиям гипоксии [9]. Острые формы гипоксии (0.3–1.0 мг O2 л–1) сопровождались исключительно понижением активности ЛДГ и ростом значений индекса МДГ/ЛДГ в жабрах, что отражает переход данного органа на анаэробный режим работы.
Сохранение высокой активности МДГ в условиях дефицита (отсутствия) кислорода характерно для гидробионтов, толерантных к гипоксии/аноксии [12, 52]. Известно, что цитоплазматическая фракция МДГ сопряжена с гликолитическими процессами через фосфоенолпируваткарбоксикиназу [13], трансформирующую фосфоенолпируват в оксалоацетат. МДГ восстанавливает оксалоацетат до малата, который затем посредством малат-сукцинатного переносчика направляется в митохондрии и доводится ферментами ветви цикла Кребса, при участии митохондриальной МДГ, до сукцината. Подобная ориентация метаболизма ограничивает поток углеводных субстратов в направлении лактата, исключая его чрезмерное накопление, и сохраняет энергетический статус ткани. Ранее данная реакция описана нами для жаберной ткани моллюсков [20].
Представленные в настоящей работе результаты исследований совпадают с данными, полученными на других видах костистых рыб. Так, увеличение активности ЛДГ как показателя анаэробного обмена в тканях жабр рыбы-пятна Leiostomus xanthurus, обитающей у восточного побережья Северной Америки, отмечалось только при 10% насыщении О2 (0.8 мг О2 л–1) [53] без изменения активности цитратсинтазы как индикатора аэробного метаболизма. При более высоких значениях насыщения воды О2 (более 25%) активность ЛДГ в жабрах не изменялась.
Корреляционные отношения. Одним из эффектов, выявленных в настоящей работе, является рост значений коэффициента корреляции между МДГ и ЛДГ в условиях острой гипоксии. В отдельных тканях (ПМ) его значения превышали 0.9. В основе этого эффекта, по-видимому, лежит факт сопряжения МДГ в условиях острого дефицита О2 с субстратами гликолиза, которые фермент получает через фосфоенолпируваткарбоксикиназу [13]. Такая ориентация биохимических процессов исключает накопление лактата и сохраняет энергетический статус ткани в условиях метаболической депрессии.
Можно заключить, что краткосрочная гипоксия (90 мин) не оказывала значимого влияния на структуры головного мозга морского ерша. Активность МДГ, ЛДГ, значения индекса МДГ/ЛДГ и содержание АТФ в СПМ и ПМ в условиях острой гипоксии (0.3–1.0 мг O2 л–1) сохранялись на уровне контрольных значений (4.5–6.7 мг О2 л–1). Умеренные формы гипоксии (1.7–3.7 мг О2 л–1) вызывали пропорциональный рост активности МДГ, ЛДГ и повышение уровня АТФ в СПМ. Последнее скорее является следствием снижения потребности СПМ в данном соединении, в основе которого может лежать ГАМК-эргический механизм регуляции активности тканевых структур мозга, способный понижать энергетические потребности нервной ткани через увеличение плотности ГАМКА рецепторов. Жабры отличались минимальной активностью МДГ, ЛДГ при высоких значениях индекса МДГ/ЛДГ. Острые формы гипоксии приводили к снижению в них активности ЛДГ и повышению значений индекса МДГ/ЛДГ, что отражает переход данного органа на анаэробный режим работы. В условиях острой гипоксии отмечалось усиление связи в системе “активность МДГ ↔ активность ЛДГ” во всех типах тканей при росте коэффициента корреляции между активностью ферментов (p < < 0.05–0.01), что характерно для видов, толерантных к дефициту кислорода. В основе данного эффекта, по-видимому, лежит факт сопряжения МДГ с субстратами гликолиза в условиях острого дефицита О2, что исключает накопление лактата при метаболической депрессии.
Список литературы
Nilsson G.E., Renshaw G.M.C. Hypoxic survival strategies in two fishes: extreme anoxia tolerance in the North European crucian carp and natural hypoxic preconditioning in a coral-reef shark. J. Exp. Biol. 207: 3131–3139. 2004.
Turesson J., Sundin L. N-methyl-D-aspartate receptors mediate chemoreflex in the shorthorn sculpin Myoxocephalus scorpius. J. Exp. Biol. 206: 1251–1259. 2003.
Taylor E.W., Leite C.A.C., McKenzie D.J., Wang T. Control of respiration in fish, amphibians and reptiles. Braz. J. Med. Bio. Res. 43(5): 409–424. 2010.
Saunders R.L., Sutterlin A.M. Cardiac and respiratory responses to hypoxia in the sea raven, Hemitripterus americanus and an investigation of possible control mechanisms. J. Fish. Res. Bd. Can. 28: 491–503. 1971.
Sundin L., Reid S.G., Kalinin A.L., Rantin F.T., Milsom W.K. Cardiovascular and respiratory reflexes: the tropical fish, traira (Hoplias malabaricus) O2 chemoresponses. Respir. Physiol. 116(2–3): 181–199. 1999.
Richards J.G. Metabolic and molecular responses of fish to hypoxia. Fish Physiol. 27: 443–485. 2009.
Nilsson G.E., Ostlund-Nilsson S. Does size matter for hypoxia tolerance in fish? Biol. Rev. Camb. Philos. Soc. 83(2): 173–189. 2008.
Чурова М.В., Мещерякова О.В., Немова Н.Н. Взаимосвязь активности ферментов энергетического обмена с темпами роста и размерами рыб. Ученые записки Петрозаводского государственного университета. 4: 31–37. 2011. [Churova M.V., Meshcheryakova O.V., Nemova N.N. Vzaimosvyaz’ aktivnosti fermentov energeticheskogo obmena s tempami rosta i razmerami ryb. Uchenye zapiski Petrozavodskogo gosudarstvennogo universiteta. 4: 31–37. 2011. (In Russ.)].
Hochachka P.W., Somero G.N. Biochemical adaptation. Princeton University Press. Princeton. NJ. 1984.
Panepucci R.A., Panepucci L., Fernandes M.N., San-ches J.R., Rantin F.T. The effect of hypoxia and recuperation on carbohydrate metabolism in Pacu (Piaractus mesopotamicus). Braz. J. Biol. 61(4): 547–554. 2001.
Hochachka P.W., Somero G.N. Biochemical Adaptation: Mechanism and Process in Physiological Evolution. Oxford. Oxford University Press. 2002.
Шапиро А.З., Бобкова А.Н. Роль малатдегидрогеназы беспозвоночных в адаптации к дефициту кислорода. Ж. эвол. биохим. и физиол. 11: 547–547. 1975. [Sha-piro A.Z., Bobkova A.N. Rol’ malatdegidrogenazy bespozvonochnyh v adaptacii k deficitu kisloroda. J. Evol. Biochem. Physiol. 11: 547–547. 1975. (In Russ.)].
Skorkowski E.F. Mitochondrial malic enzyme from crustacean and fish muscle. Comp. Biochem. Physiol. 90(B): 19–24. 1988.
Panepucci L., Fernandes M.N., Sanches J.R., Rantin F.T. Changes in lactate dehydrogenase and malate dehydrogenase activities during hypoxia and after temperature acclimation in the armored fish, Rhinelepis strigosa (Siluriformes, Loricariidae). Rev. Brasil. Biol. 60(2): 353–360. 2000.
Washizu T., Nakamura M., Izawa N., Suzuki E., Tsuruno S., Washizu M., Nakajo S., Arai T. The activity ratio of the cytosolic MDH/LDH and the isoenzyme pattern of LDH in the peripheral leukocytes of dogs, cats and rabbits. Vet. Res. Commun. 26(5): 341–346. 2002.
Bishop R.E., Iliffe T.M. Ecological physiology of the anchialine shrimp Barbouria cubensis: a comparison of epigean and hypogean populations. Marine Biodiversity. 42(3): 303–310. 2012.
Шульман Г.Е., Столбов А.Я., Солдатов А.А., Минюк Г.С., Ивлева Е.В., Трусевич В.В., Дробецкая И.В. Метаболические реакции черноморских рыб на долговременную экспериментальную гипоксию. Гидробиол. журн. 39(1): 21–30. 2003. [Shul’man G.E., Stolbov A.Ya., Soldatov A.A., Minyuk G.S., Ivleva E.V., Trusevich V.V., Drobeckaya I.V. Metabolicheskie reakcii chernomorskih ryb na dolgovremennuyu eksperimental’nuyu gipoksiyu. Hydrobiol. J. 39(1): 21–30. 2003. (In Russ.)].
Soldatov A.A., Andreeva A.Y., Novitskaya V.N., Parfe-nova I.A. Coupling of membrane and metabolic functions in nucleated erythrocytes of Scorpaena porcus L. under hypoxia in vivo and in vitro. J. Evol. Biochem. Physiol. 46(4): 409–415. 2014.
Lushchak V.I., Lushchak L.P., Bahnjukova T.V., Spichenkov A.V., Storey K.B. Comparative study of free and bound glycolytic enzymes from sea scorpion brain. Biochem. Cell Biol. 76: 609–614. 1998.
Soldatov A.A., Andreenko T.I., Golovina I.V., Stolbov A.Y. Peculiarities of organization of tissue metabolism in molluscs with different tolerance to external hypoxia. J. Evol. Biochem. Physiol. 50(5): 341–349. 2010.
Holm-Hansen O., Booth C.R. The measurement of adenosine triphosphate in the Ocean and its ecological significance. Limnol. Oceanogr. 11(4): 510–519. 1966.
Анисимова И.М., Лавровский В.В. Ихтиология. Строение и некоторые физиологические особенности рыб. Нервная система и органы чувств. Москва. Высшая школа. 1983. [Anisimova I.M., Lavrovskij V.V. Ihtiologiya. Stroenie i nekotorye fiziologicheskie osobennosti ryb. Nervnaya sistema i organy chuvstv. Moskva. Vysshaya shkola. 1983. (In Russ.)].
Kotrschal K., Staaden M.J., Huber R. Fish brains: evolution and anvironmental relationships. Rev. in Fish Biology and Fisheries. 8(4): 373–408. 1998.
Marshal W.J. Clinical biochemistry. Elsevier Science. 1995.
Kolesnikova E.E. Neurophysiological mechanisms of respiratory activity in cyclostomes and fish during aquatic breathing. J. Evol. Biochem. Physiol. 55(2): 85–96. 2019.
Polakof S., Mommsen T.P., Soengas L.J. Glucosensing and glucose homeostasis: from fish to mammals. Comp. Biochem. and Physiol. B(160): 123–149. 2011.
Nilsson G.E. Evidence for a role of GABA in metabolic depression during anoxia in Crucian carp (Carassius carassius). J. Exp. Biol. 164: 243–259. 1992.
Lutz P.L., Leone-Kabler S.A. Upregulation of GABAA/benzodiazepine receptor during anoxia in the freshwater turtle brain. Am. J. Physiol. 37: 1332–1335. 1995.
Sakurai S.Y. N-Methyl-D-aspartate binding sites in the vertebrate central nervous system: characterization using quantitative autoradiography of [3H]MK-801 binding. Thesis, University of Michigan. 1992.
Soengas J.L., Aldegunde M. Energy metabolism of fish brain. Comp. Biochem. Physiol. Part B: Biochem. Molec. Biol. 131(3): 271–296. 2002.
Nilsson G.E., Hylland P., Löfman C.O. Anoxia and adenosine induce increased cerebral blood flow rate in crucian carp // Am. J. Physiol. 267(2): 590–595. 1994.
Heath A.G., Pritchard A.W. Effects of severe hypoxia on carbohydrate energy stores and metabolism in two species of fresh-water fish. Physiol. Zool. 38(4): 325–334. 1965.
Silkin Yu.A., Silkina E.N. Effect of hypoxia on physiological-biochemical blood parameters in some marine fish. J. Evol. Biochem. Physiol. 41(5): 527–532. 2005.
Wilson A., Owen Cn., Erecinska M. Quantitative dependence of mitochondrial oxidative phosphorylation on oxygen concentration: a mathematical model. Arch. Biochem. Biophys. 195(2): 494–504. 1979.
Soldatov A.A. Cytochrome system and oxygen tension in muscle tissue of salt-water fish with different natural activity. J. Evol. Biochem. Physiol. 32(2): 112–115. 1996.
Hochachka P.W., Buck L.T., Doll C.J., Land S.C. Unifying theory of hypoxia tolerance: molecular/metabolic defense and rescue mechanisms for surviving oxygen lack. Proc. Natl. Acad. Sci. USA. 93(18): 9493–9498. 1996.
Gray I.E. Comparative study of the gill area of marine fishes. The Biol. Bull. 107(2): 219–225. 1954.
Stammer A. The microscopic innervation of the gill-apparate in Scoprpaena porcus. Acta Biologica. 12: 101–113. 1966.
Payan P., Girard J.P., Mayer-Gostan N. Branchial ion movements in teleosts: the role of respiratory and chloride cells. Fish Physil. 10: 39–63. 1984.
Johansen K. Heart and circulation in gills, skin and lung breathing. Respir. Physiol. 14: 193–210. 1972.
Mommsen T.P. Metabolism of the fish gill. Fish Physiology. 10: 203–238. 1984.
Sollid J., Nilsson G.E. Plasticity of respiratory structures – adaptive remodeling of fish gills induced by ambient oxygen and temperature. Resp. Physiol. Neurobiol. 154: 241–251. 2006.
Daxboeck C., Davie P.S., Perry S.F., Randall D.J. Oxygen uptake in a spontaneously ventilating, blood-perfused trout preparation. J. Exp. Biol. 101: 35–45. 1982.
Cochran R.E., Burnett L.E. Respiratory responses of the salt marsh animals, Fundulus heteroclitus, Leiostomus xanthurus and Palaemonetes pugio, to environmental hypoxia and hypercapnia. J. Exp. Mar. Biol. Ecol. 195(1): 125–144. 1996.
Affonso E.G., Polez V.L.P., Correa C.F., Mazon A.F., Araujo M.R.R., Moraes G., Rantinc F.T. Blood parameters and metabolites in the teleost fish Colossoma macropomum exposed to sulfide or hypoxia. Comp. Biochem. Physiol. Part C: 375–382. 2002.
Wood C.M. Acid-base and ionic exchanges at gills and kidney after exhaustive exercise in the rainbow trout. J. Exp. Biol. 136: 461–481. 1988.
Cameron J.N., Kormanic G.A. The acid-base responses of gills and kidneys to infused acid and base loads in the Channel catfish, Ictalurus punctatus. J. Exp. Biol. 99: 143–160. 1982.
Holeton G.F., Randall D.J. The effect of hypoxia upon the partial pressure of gases in the blood and water afferent and efferent to the gills of Rainbow trout. J. Exp. Biol. 46: 317–327. 1967.
Randal D. The control of respiration and circulation in fish during exercise and hypoxia. J. Exp. Biol. 100: 275–288. 1982.
Isaia J., Girard J.P., Payan P. Kinetic study of gill epithelial permeability to water diffusion in the freshwater trout, Salmo gairdneri: effect of adrenaline. J. Membrane Biol. 41: 337–347. 1978.
Philpott C.W., Copeland D.E. Fine structure of chloride cells from three species of fundulus. J. Cell Biol. 18(2): 389–404. 1963.
Almeida-Val V.M.F., Farias I.P., Paula-Silva M.N., Duncan W.P. Biochemical adjustments to hypoxia by amazon cichlids. Braz. J. Med. Biol. Res. 28: 1257–1263. 1995.
Cooper R.U., Clough L.M., Farwell M.A. West hypoxia-induced metabolic and antioxidant enzymatic activities in the estuarine fish Leiostomus xanthurus. J. Exp. Mar. Biol. Ecol. 279(1–2): 1–20. 2002.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


