Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 4, стр. 319-334
ВЛИЯНИЕ БЛОКАДЫ М-ХОЛИНОРЕЦЕПТОРОВ НА СОМАТО-ВИСЦЕРАЛЬНЫЕ МЕЖСИСТЕМНЫЕ ВЗАИМОДЕЙСТВИЯ ПРИ АКТИВАЦИИ ХОЛИНОРЕАКТИВНЫХ СТРУКТУР В РАННЕМ ОНТОГЕНЕЗЕ КРЫС
В. А. Сизонов 1, Л. Е. Дмитриева 1, С. В. Кузнецов 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: ksv@iephb.ru
Поступила в редакцию 27.06.2019
После доработки 12.11.2019
Принята к публикации 18.12.2019
Аннотация
На ненаркотизированных 1- (Р1) и 16-дневных (Р16) крысятах проведен анализ межсистемных сомато-висцеральных взаимодействий в норме и при усилении холинергических влияний. В работе использовали ингибитор ацетилхолинэстеразы эзерин и М-холинолитик метацин. Установлено, что у интактных 1-дневных крысят межсистемные взаимодействия реализуются в основном посредством колебаний около- и многоминутного диапазона. Корреляционные взаимодействия ритмов декасекундного диапазона, не участвующие в интегративных процессах у однодневных крысят, существенно возрастают у крысят старшего возраста. У крысят обоих возрастов изменения интенсивности и паттерна моторной активности (МА) имеют тенденцию предшествовать возникновению модулирующих осцилляций дыхательного и сердечного ритма. Ингибирование ацетилхолинэстеразы эзерином и последующая активация холинореактивных структур вызывают снижение уровня межсистемных взаимодействий по всем диапазонам модулирующих ритмов у крысят обоих возрастов. Блокада периферических М-холинорецепторов (М-ХР) вызывает снижение уровня взаимодействий, опосредованных около- и многоминутными ритмами на Р1, но усиливает их на Р16. Инъекция эзерина на Р1 и Р16 не оказывает значимого влияния на кардио-соматомоторные взаимодействия, причем у крысят младшего возраста они поддерживаются бóльшим диапазоном модулирующих ритмов. Аналогичная ситуация наблюдается и в период последействия препарата для всех взаимодействующих системных пар. При блокаде М-ХР, напротив, имеющиеся межсистемные взаимодействия оказалось труднее нарушить у 16-дневных крысят. Активация холинореактивных структур, происходящая на фоне блокады М-ХР, приводит к нарушению координационных взаимодействий в паре “МА – Ритм дыхания”. У крысят на Р1 восстановления этих функциональных связей не происходит, а на Р16 они возобновляются уже в период последействия. Показано, что мощность модулирующих ритмов активности исследуемых систем не имеет прямой связи с межсистемными взаимодействиями. Изменения межсистемных взаимодействий обусловлены как гетерохронией созревания этих функциональных систем, так и гетерохронией вовлеченности различных холинореактивных структур в процессы межсистемной регуляции.
ВВЕДЕНИЕ
В раннем постнатальном периоде развития, благодаря относительно стабильным условиям существования незрелорождающихся животных, эндогенные ритмические формы функционирования являются преобладающими. В первые часы после рождения у крысят усиливается взаимосвязь между активностью соматомоторной и сердечно-сосудистой систем. Происходит кардинальное изменение работы дыхательной системы, меняется характер ее взаимодействия с другими возбудимыми системами организма. Функциональная активность этих трех систем носит ритмический характер, и координация их деятельности является важным элементом механизма адаптивных перестроек при изменении факторов внутренней и внешней среды. Характер межсистемной интеграции неразрывно связан с развитием регуляторных систем организма. Одна из основных ролей в регуляции и взаимной адаптации функций принадлежит развивающейся холинергической системе. В настоящее время существует большое количество информации по различным аспектам развития холинергической системы [1, 2]. Однако динамика развития регуляторных влияний на ритмические функции организма, а также последствия нарушения нормального функционирования холинергической системы в ранний постнатальный период остаются слабо изученными. Ранее нами были проведены исследования механизмов формирования кардиореспираторных и висцеро-соматомоторных взаимодействий в раннем постнатальном онтогенезе крыс при активации центральных и периферических механизмов депрессии двигательной активности [3, 4].
Целью настоящего исследования стало изучение характера межсистемных взаимодействий в условиях активации холинореактивных структур, вызванной инъекцией крысятам ингибитора ацетилхолинэстеразы (АХЭ) эзерина, при блокаде мускариновых холинорецепторов (М-ХР), а также в условиях избытка эндогенного ацетилхолина на фоне предварительной блокады М-ХР в раннем постнатальном онтогенезе крыс.
МАТЕРИАЛ И МЕТОДИКА
Для изучения механизмов межсистемных взаимодействий на новорожденных 1-дневных (Р1) и 16-дневных (Р16) лабораторных крысах линии Вистар исследовали характер перестройки взаимодействий эндогенной ритмики сердечной, дыхательной и соматомоторной систем после изменения уровня холинергических влияний. Регистрацию электрокардиограммы (ЭКГ) проводили на ненаркотизированных крысятах в условиях, детально описанных в нашем предыдущем исследовании [5]. Всего в экспериментах было использовано 70 животных. Выбор сроков исследования обусловлен радикальными различиями параметров двигательной активности, играющей у крысят важную роль в осуществлении висцеро-соматомоторных взаимодействий. Опыты выполнены в соответствии с правилами, рекомендованными Физиологической секцией Российского национального комитета по биологической этике. Регистрировали ЭКГ в нестандартном отведении от теменной части головы и крестцовой области, пьезограмму экскурсии грудной и электромиограмму (ЭМГ) икроножной мышцы. Для детекции медленноволновых составляющих ритмов сердечной и дыхательной систем преобразовывали сигналы ЭКГ и пьезограммы дыхания в периодограммы ритмов. Периодограмму ритма дыхания вычисляли по опорным точкам, которые соответствовали моментам максимального растяжения грудной клетки. Медленноволновые составляющие двигательной активности определяли по колебаниям мощности ЭМГ, которую рассчитывали как квадрат миоэлектрического сигнала.
В ходе исследования было проведено три серии экспериментов. В первой серии после 30-минутной регистрации показателей у интактных животных крысятам вводили внутрибрюшинно антихолинэстеразное вещество обратимого действия эзерин для 1-дневных в дозе 0.875 мг/кг, а для 16‑дневных – 0.7 мг/кг. Выбор более низкой дозы препарата для 1-дневных крысят обусловлен необходимостью сохранения регулярного дыхания для построения периодограмм дыхательного ритма. Используемая нами ранее рабочая доза (1.3 мг/кг) препарата [6] вызывала значительную дестабилизацию ритма дыхания, которая в свою очередь приводила к невозможности построения периодограмм. Анализировали 30-минутные фрагменты активности интактного крысенка, фрагменты записей с 10-й по 40-ю минуту после инъекции эзерина, включающие в себя 20-ти минутные периоды максимального эффекта эзерина (ПМЭ), и последующие 30-минутные фрагменты – периоды последействия (схема 30 + 30 + 30 мин). Такой подход к рассмотрению данных связан с высокой вариативностью исследуемых ритмов после активации холинореактивных структур.
Во второй серии экспериментов, проводимой по вышеуказанной схеме (30 + 30 + 30 мин), после введения крысятам метацина анализировали фрагменты записи, начиная с 20-й минуты после инъекции. Таким образом, рассматривали влияние холинолитика на ритмическую активность исследуемых систем на временном отрезке, соответствующем периоду действия эзерина (ПДЭ) в предыдущих экспериментах. Каждая возрастная группа во всех исследованиях состояла из 10-ти животных.
Для выявления роли периферических M-холинорецепторов в реализации процессов межсистемных взаимодействий была проведена третья серия экспериментов, в которой выполняли премедикацию животных М-холинолитиком метацином (1 мг/кг, внутрибрюшинно) с последующей (через 10 мин) инъекцией эзерина. Анализ данных также проводили по схеме (30+30+30 мин).
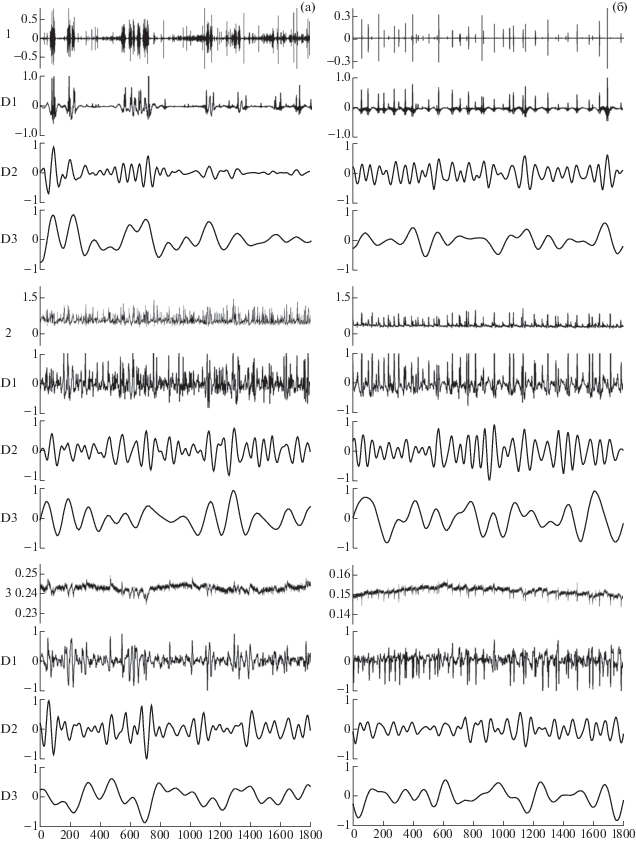
Для оценки степени межсистемных взаимодействий использовали корреляционный анализ медленноволновых составляющих ритмической активности. В программе “PowerGraph 3.3.9” выполняли нормализацию и фильтрацию исследуемых сигналов – ЭМГ, периодограмм ритмов сердца и дыхания. Фильтрацию осуществляли по трем диапазонам: декасекундному, D1 – 0.02–0.2 Гц (5–50 с); околоминутному, D2 – 0.0083–0.02 Гц (50 с – 2 мин); многоминутному, D3 – 0.0017–0.0083 Гц (2–10 мин). На рис. 1 приведен пример ЭМГ, периодограмм дыхательного и сердечного ритмов 1- и 16-дневных интактных крысят с результатами фильтрации исходных сигналов на медленноволновые составляющие – диапазоны D1, D2, D3. Для анализа мощности колебаний исследуемых ритмов рассчитывали дисперсию отфильтрованных по трем диапазонам (D1, D2, D3) сигналов. При этом суммарная дисперсия нормализованных аналоговых сигналов равна единице, а величина выраженности каждого из диапазонов зависит от характера сигнала. Значения дисперсии, выраженные в условных единицах, рассчитывали для интактных крысят и в процентах к их фоновым показателям после инъекции препаратов.
Рис. 1.
Пример обработки исходных сигналов 1-дневного (а) и 16-дневного (б) интактного крысенка.
Фильтрация ЭМГ (1), периодограммы дыхательного ритма (2), периодограммы сердечного ритма (3) на медленноволновые составляющие (диапазоны D1, D2, D3).
По оси абсцисс – время (с), по оси ординат – амплитуды сигналов ЭМГ, D1, D2, D3 (у.е.); периодограмм дыхательного и сердечного ритмов (с).
Fig. 1. The example of processing an initial signal in 1-day-old (P1) (a) and 16-day-old (P16) (b) intact rat pups.
Filtration of EMG (1), respiratory rhythm periodogram (2) and heart rhythms periodogram (3) to slow-wave components (ranges D1, D2, D3). Abscissa: observation time (s); ordinate: amplitudes of EMG, D1, D2, and D3 signals (arb. units); respiratory and heart rhythm periodograms (s).
В программе “Origin 2015” для каждого частотного диапазона осуществляли анализ межсистемных взаимодействий, выраженность которых количественно оценивали по величине корреляционной связи (ВКС), рассчитываемой как среднее арифметическое абсолютных значений максимумов кросскорреляционных функций и характеризующей уровень взаимодействий. В наших предыдущих исследованиях [3, 4] была показана статистическая неопределенность направлений корреляционных связей. Поэтому в этой работе анализировали качественную оценку направления корреляционных связей, опираясь на знак коэффициента корреляции Пирсона, доминирующего в группе. Положительное направление корреляционной связи рассматривали как преобладающее синфазное изменение модулирующих ритмов, отрицательное, как противофазное.
Поскольку ритмы сердца и дыхания в нашем исследовании представлены периодограммами ритмов, т.е. изменениями длительности циклов во времени, а моторная активность (МА) – колебаниями мощности ЭМГ, то под синфазностью пары ритмов с участием МА следует понимать то, что увеличению МА соответствует урежение ритма дыхания и сердца, и наоборот. Тогда как противофазность – это увеличение МА с соответствующим учащением ритма дыхания и сердца и наоборот.
При анализе корреляционных связей использовали шкалу, применяемую при математическом анализе физиологических процессов [7]. Считали, что при максимуме кросскорреляционной функции (оценка по ВКС) в диапазоне: 0–0.1 – связь отсутствует; 0.1–0.3 – связь слабая; 0.3–0.5 – связь умеренная; 0.5–0.7 – связь значительная; 0.7–0.9 – связь высокая; 0.9–1 – связь очень высокая. Корреляционный анализ физиологических показателей выполняли только для животных с типичной реакцией на препараты и без фоновых отклонений.
Для всех интактных новорожденных крысят из-за различий в физиологических показателях, связанных с сезоном и уровнем сытости, использовали усредненную групповую величину “Общий фон”.
Статистическую обработку данных осуществляли в программе “Origin 2015”. Использовали парный тест Стьюдента с поправками Холма. Статистически обработанные данные представлены как среднее ± стандартная ошибка. Все изменения рассматривали по отношению к фоновым показателям до введения препаратов. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У интактных крысят наблюдаются медленноволновые сочетанные колебания сердечной, дыхательной и моторной активности, как было показано нами ранее [3, 4]. Существенная роль в межсистемных взаимодействиях принадлежит спонтанной периодической моторной активности. Чередование циклов “активность–покой” у новорожденных крысят создает декасекундные, околоминутные и многоминутные колебания МА. При этом модуляции сердечного и дыхательного ритмов охватывают те же диапазоны. МА 1-дневных крысят представлена совокупностью длительных моторных комплексов, моторных вспышек и джерков (вздрагиваний) в различных сочетаниях, а у 16-дневных животных – высокоамплитудными моторными вспышками и джерками [6].
Межсистемные взаимодействия у интактных крысят
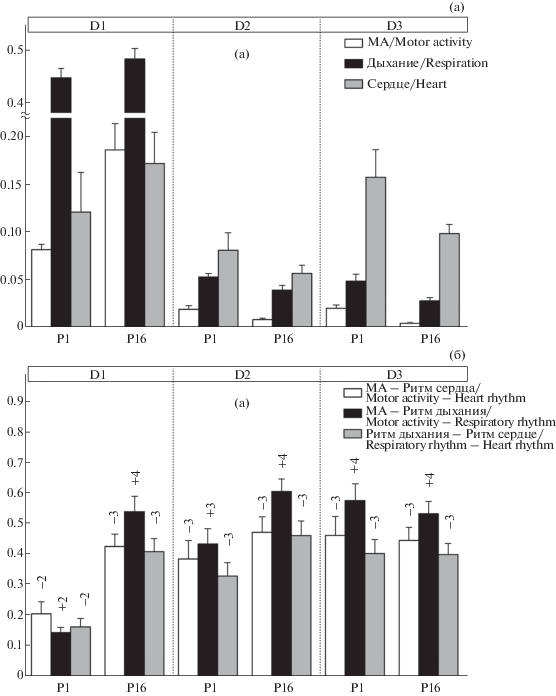
У 1-дневных крысят межсистемные взаимодействия реализуются в основном посредством медленноволновых колебаний около- и многоминутного диапазона. ВКС исследуемых функциональных систем падает от многоминутного к декасекундному диапазону ритмической активности. Корреляционные взаимодействия, опосредуемые ритмами декасекундного диапазона, существенной роли в интегративных процессах не играют (рис. 2). Однако их мощность существенно доминирует над около- и многоминутными колебаниями, за исключением многоминутных колебаний ритма сердца. Отрицательное направление корреляционной связи характерно в парах систем “соматомоторная – сердечная” и “дыхательная – сердечная” во всех частотных диапазонах. Наряду с этим присутствует положительное направление корреляционной связи в паре “соматомоторная – дыхательная” системы. У 16-дневных крысят в отличие от животных младшего возраста наблюдаются падение мощности колебаний в около- и многоминутном диапазоне и рост в декасекундном. Подобные результаты были получены нами ранее для близких частотных диапазонов в разные сроки онтогенеза [8]. На Р16 отмечаются существенное усиление корреляционных взаимодействий в декасекундном диапазоне (D1), тенденция к росту в околоминутном (D2) и незначительное снижение в многоминутном диапазоне (D3). Показатели ВКС становятся близкими по величинам для всех частотных диапазонов (рис. 2). Направление корреляционных связей у животных старшей возрастной группы такое же, как и у однодневных.
Рис. 2.
Показатели средней мощности колебаний ритмов исследуемых систем (а) и средней величины их корреляционной связи (ВКС) (б) у 1-дневных (Р1) и 16-дневных (Р16) интактных крысят, общий фон трех серий экспериментов.
По оси абцисс – частотные диапазоны и возраст. По оси ординат – для (а) показатели средней мощности; для (б) показатели ВКС (у.е.).
Здесь и на рис. 3, 4 . Цифры над столбиками, ВКС: 1 – связь отсутствует (0-0.1), 2 – связь слабая (0.1-0.3), 3 – связь умеренная (0.3-0.5), 4 – связь значительная (0.5-0.7). Знаки: плюс – прямая связь, минус – обратная связь.
Fig. 2. Average power indices of rhythm oscillations in the studied systems (a) and average values of correlative relationships (CR) indices (b) in 1- and 16-day-old intact rat pups (common background of three series of experiments).
Abscissa – frequency ranges and age of rats. Here and in Fig. 3, 4 – numbers above the columns: 1 – no correlation (0−0.1), 2 – weak correlation (0.1−0.3), 3 – moderate correlation (0.3−0.5), 4 – considerable correlation (0.5−0.7). Signs: plus – direct correlation, minus – reverse correlation; ordinate – (a) average power indices, (b) CR indices (arb. units) .
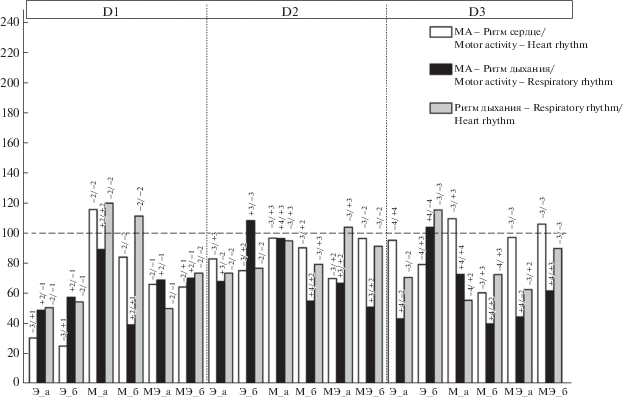
Инъекция эзерина 1-дневным крысятам в дозе 0.875 мг/кг вызывает аналогичное изменение вегетативных показателей, как и для рабочей (1.3 мг/кг) дозы эзерина (табл. 1). В ПМЭ развивается значительная брадикардия, на фоне которой возникают комплексы еще более медленного сердечного ритма – “стадия брадикардической аритмии”. Параллельно с развитием брадикардии происходит урежение и снижение регулярности дыхательного ритма. В то же время значительно увеличивается длительность периодов моторного возбуждения, которая может становиться практически непрерывной с минимальными периодами покоя. В последействии наблюдается ослабление МА. Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после применения препарата для 1-дневных крысят представлены в табл. 2, 3. В ПМЭ прослеживается снижение мощности колебаний уровня МА во всех частотных диапазонах и мощности колебаний ритма дыхания в диапазоне D1. Вместе с тем растет мощность модулирующих ритмов сердца во всех диапазонах и дыхания в диапазонах D2 и D3. В последействии отмечается тенденция к восстановлению их мощности к фоновым показателям, кроме колебаний ритма сердца в диапазоне D1 и дыхания в диапазоне D2, где рост мощности продолжается. Инъекция эзерина вызывает снижение межсистемных взаимодействий во всех диапазонах и парах модулирующих ритмов. Это снижение сохраняется и в последействии, кроме пар “МА – Ритм дыхания” в диапазонах D2, D3 и “Ритм дыхания – Ритм сердца” в диапазоне D3. Знак направления корреляционных связей меняется на противоположный в парах с участием соматомоторной системы (рис. 3).
Таблица 1.
Изменение физиологических показателей крысят после введения эзерина в разных дозах Table 1. Changes in physiological indices of rat pups injected with physostigmine at different doses
| Показатели Indices | Фон Background | Период максимального эффекта Maximum effect period | Последействие Aftereffect | ||
|---|---|---|---|---|---|
| опыт experiment | % к фону % to background | опыт experiment | % к фону % to background | ||
| Р1 | |||||
| Эзерин, 1.3 мг/кг/Physostigmine, 1.3 mg/kg | |||||
| ЧСС, в мин/HR, min | 224.9 ± 7.8 | 89.9 ± 9.2* | 40.0 | 165.8 ± 14.3* | 73.7 |
| ЧДД, в мин/RR, min | 76.8 ± 2.9 | 41.4 ± 2.6* | 53.9 | 42.9 ± 2.7* | 55.9 |
| Эзерин, 0.875 мг/кг/Physostigmine, 0.875 mg/kg | |||||
| ЧСС, в мин/HR, min | 232.5 ± 12.3 | 112.4 ± 23.3* | 48.3 | 185.6 ± 11.4* | 79.8 |
| ЧДД, в мин/RR, min | 94.8 ± 8.3 | 60.9 ± 6.6* | 64.2 | 68.2 ± 4.4* | 71.9 |
| Р16 | |||||
| Эзерин, 0.7 мг/кг/Physostigmine, 0.7 mg/kg | |||||
| ЧСС, в мин/HR, min | 462.4 ± 18.5 | 357.4 ± 21.6* | 77.3 | 417.2 ± 18.3 | 90.2 |
| ЧДД, в мин/RR, min | 130.1 ± 15.9 | 85.8 ± 6.8* | 65.9 | 119.5 ± 7.7 | 91.9 |
Таблица 2.
Средняя мощность модулирующих ритмов у новорожденных крысят после применения препаратов в % к фону Table. 2. Average power of modulatory rhythms in neonatal rat pups after injection of physostigmine, methacin, and methacin+physostigmine (% to background)
| Показатели Indices | Р1 | Р16 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Диапазоны модулирующих ритмов Ranges of modulatory rhythms | |||||||||||||||||||
| МА Motor activity | Ритм дыхания Respiratory rhythm | Ритм сердца Heart rhythm | МА Motor activity | Ритм дыхания Respiratory rhythm | Ритм сердца Heart rhythm | ||||||||||||||
| D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | ||
| Эзерин Physostigmine | Период максимального эффекта Maximum effect period | 55.2 | 42.3 | 37.5 | 90.3 | 121.8 | 221.4 | 169.7 | 349.1 | 261.3 | 199.0 | 511.1 | 775.0 | 68.0 | 70.0 | 71.4 | 336.9 | 215.4 | 165.5 |
| Последействие Aftereffect | 74.7 | 65.4 | 45.8 | 95.6 | 127.3 | 211.9 | 173.3 | 196.4 | 186.8 | 64.9 | 100.0 | 225.0 | 67.8 | 106.7 | 323.8 | 150.0 | 132.7 | 101.2 | |
| Метацин Methacin | Период действия эзерина Physostigmine effect period | 123.5 | 57.1 | 72.7 | 97.9 | 83.1 | 64.1 | 23.0 | 26.1 | 63.5 | 101.1 | 125.0 | 133.3 | 104.8 | 134.4 | 146.4 | 74.8 | 120.0 | 197.1 |
| Последействие Aftereffect | 126.5 | 92.9 | 109.1 | 95.8 | 94.9 | 62.5 | 18.2 | 20.4 | 62.0 | 97.8 | 150 | 133.3 | 93.0 | 137.5 | 139.3 | 57.3 | 100.0 | 219.4 | |
| Метацин-Эзерин Methacin-Physostigmine | Период максимального эффекта Maximum effect period | 92.9 | 113.3 | 63.6 | 103.7 | 93.8 | 97.8 | 45.4 | 88.7 | 123.9 | 80.9 | 300.0 | 283.3 | 63.0 | 71.4 | 129.0 | 26.3 | 22.4 | 60.2 |
| Последействие Aftereffect | 102.4 | 86.7 | 95.5 | 117.4 | 102.1 | 100.0 | 39.2 | 60.6 | 139.4 | 49.2 | 80.0 | 100.0 | 83.6 | 73.5 | 148.4 | 71.9 | 49.3 | 63.1 | |
Таблица 3.
Показатели средней величины корреляционной связи (ВКС) у 1-дневных крысят в фоне и после применения препаратов Table 3. Average values of correlative relationship indices in 16-day-old rat pups during and after injection of physostigmine, methacin, and methacin+physostigmine
| Показатели Indices | Взаимодействующие системы и диапазоны модулирующих ритмов Interacting systems and ranges of modulatory rhythms |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| МА–Ритм сердца MA–Heart rhythm |
МА–Ритм дыхания MA–Respiratory rhythm |
Ритм дыхания–Ритм сердца Respiratory rhythm–Heart rhythm |
||||||||
| D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | ||
| Эзерин, 0.875 мг/кг Physostigmine, 0.875 mg/kg | Фон Background | 0.258 ± ± 0.035 | 0.365 ± ± 0.121 | 0.481 ± ± 0.099 | 0.144 ± ± 0.028 | 0.381 ± ± 0.112 | 0.509 ± ± 0.126 | 0.154 ± ± 0.066 | 0.225 ± ± 0.032 | 0.360 ± ± 0.069 |
| Период максимального эффекта Maximum effect period | 0.078 ± ± 0.013 | 0.303 ± ± 0.068 | 0.459 ± ± 0.059 | 0.070 ± ± 0.021 | 0.258 ± ± 0.074 | 0.220 ± ± 0.026 | 0.078 ± ± 0.016 | 0.166 ± ± 0.026 | 0.254 ± ± 0.059 | |
| Последействие Aftereffect | 0.065 ± ± 0.026 | 0.274 ± ± 0.082 | 0.381 ± ± 0.075 | 0.083 ± ± 0.016 | 0.414 ± ± 0.123 | 0.529 ± ± 0.072 | 0.084 ± ± 0.031 | 0.173 ± ± 0.053 | 0.416 ± ± 0.060 | |
| Метацин,
1 мг/кг Methacin, 1 mg/kg |
Фон Background | 0.095 ± ± 0.019 | 0.335 ± ± 0.088 | 0.413 ± ± 0.177 | 0.148 ± ± 0.023 | 0.464 ± ± 0.084 | 0.590 ± ± 0.133 | 0.160 ± ± 0.057 | 0.398 ± ± 0.160 | 0.523 ± ± 0.102 |
| Период действия эзерина Physostigmine effect period | 0.110 ± ± 0.030 | 0.324 ± ± 0.026 | 0.453 ± ± 0.082 | 0.132 ± ± 0.026 | 0.447 ± ± 0.100 | 0.429 ± ± 0.094 | 0.192 ± ± 0.069 | 0.378 ± ± 0.018 | 0.290 ± ± 0.020 | |
| Последействие Aftereffect | 0.079 ± ± 0.038 | 0.302 ± ± 0.086 | 0.250 ± ± 0.110 | 0.058 ± ± 0.015 | 0.254 ± ± 0.094 | 0.235 ± ± 0.032 | 0.178 ± ± 0.030 | 0.316 ± ± 0.147 | 0.380 ± ± 0.045 | |
| Метацин-
Эзерин Methacin- Physostigmine |
Фон Background | 0.124 ± 0.062± | 0.304 ± 0.080± | 0.441 ± ± 0.141 | 0.123 ± ± 0.033 | 0.364 ± ± 0.051 | 0.591 ± ± 0.090 | 0.155 ± ± 0.045 | 0.310 ± ± 0.043 | 0.353 ± ± 0.100 |
| Период максимального эффекта Maximum effect period | 0.082 ± ± 0.017 | 0.213 ± ± 0.034 | 0.429 ± ± 0.019 | 0.085 ± ± 0.016 | 0.243 ± ± 0.078 | 0.263 ± ± 0.056 | 0.077 ± ± 0.025 | 0.323 ± ± 0.053 | 0.221 ± ± 0.077 | |
| Последействие Aftereffect | 0.080 ± 0.026± | 0.294 ± ± 0.056 | 0.468 ± ± 0.042 | 0.086 ± ± 0.025 | 0.186 ± ± 0.029 | 0.364 ± ± 0.072 | 0.114 ± ± 0.037 | 0.283 ± ± 0.074 | 0.317 ± ± 0.042 | |
Рис. 3.
Изменение средней величины корреляционной связи (ВКС) модулирующих ритмов (D1, D2, D3) в парах взаимодействующих систем у 1-дневных крысят после инъекции эзерина в дозе 0.875 мг/кг (Э), метацина в дозе 1 мг/кг (М), эзерина на фоне премедикации метацином (МЭ) в % к показателям интактных животных, принятых за 100%.
Здесь и на рис. 4. По оси ординат: (%), по оси абсцисс: препарат_а – ПМЭ или ПДЭ, препарат_б – последействие.
Числитель – фон, знаменатель – препарат.
Fig. 3. Changes in the average value of correlative relationship (CR) of modulatory rhythms (D, D2, D3) in the pairs of interacting systems in 1-day-old rat pups after injection of physostigmine (0.875 mg/kg; P), methacin (1 mg/kg; M), and physostigmine against the background of methacin premedication (MP) (% to values of intact rats taken for 100%).
Here and in Fig. 4: ordinate – %, abscissa – chemical agent_a – physostigmine maximum effect period (PMEP) or physostigmine action period (PAP), chemical agent_b – aftereffect. Numerator – background, denominator – chemical agent.
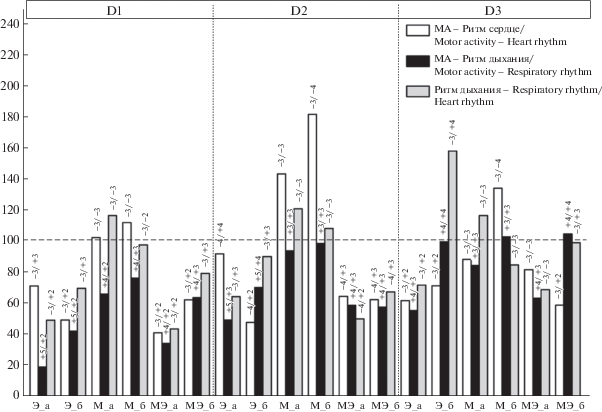
Инъекция эзерина 16-дневным крысятам вызывает в ПМЭ урежение сердечного ритма на 23%, что значительно меньше, чем у 1-дневных (табл. 1). В последействии наблюдается снижение амплитуды брадикардических комплексов с дальнейшим восстановлением правильного синусового ритма. В то же время происходит урежение ритма дыхания на 34%, и отмечается выраженная депрессия МА. Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после применения препарата для 16-дневных крысят представлены в табл. 2, 4. В ПМЭ во всех частотных диапазонах происходит рост мощности модулирующих ритмов соматомоторной и сердечной систем и падение в дыхательной системе. В последействии наблюдается тенденция к восстановлению мощности модулирующих ритмов к фоновым показателям, кроме колебаний ритма дыхания, мощность которых растет в диапазонах D2 и D3, и колебаний МА, мощность которых падает в диапазоне D1 ниже фонового значения. Ингибирование ацетилхолинэстеразы эзерином и последующая активация холинореактивных структур в ПМЭ вызывают нарушение корреляционных взаимосвязей. При этом распределение связей в системных парах отличается от 1‑дневных крысят. В последействии ВКС восстанавливается в паре “МА – Ритм дыхания”, а связь в паре “Ритм дыхания – Ритм сердца” значительно усиливается в диапазоне D3. Наряду с этим сохраняется депрессия остальных корреляционных взаимодействий. Знак направления корреляционных связей в парах с участием сердечной системы меняется на противоположный (рис. 4).
Таблица 4.
Показатели средней величины корреляционной связи (ВКС) у 16-дневных крысят в фоне и после применения препаратов Table 4. Average values of correlative relationship indices in 16-day-old rat pups during and after injection of physostigmine, methacin, and methacin+physostigmine
| Показатели Indices | Взаимодействующие системы и диапазоны модулирующих ритмов Interacting systems and ranges of modulatory rhythms |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| МА–Ритм сердца Heart rhythm |
МА–Ритм дыхания MA–Respiratory rhythm |
Ритм дыхания–Ритм сердца MA–Respiratory rhythm–Heart rhythm | ||||||||
| D1 | D2 | D3 | D1 | D2 | D3 | D1 | D2 | D3 | ||
| Эзерин,
0.7 мг/кг Physostigmine, 0.7 mg/kg |
Фон Background | 0.498 ± ± 0.056 | 0.567 ± ± 0.063 | 0.405 ± 0.122 | 0.706 ± 0.012 | 0.706 ± ± 0.048 | 0.616 ± 0.097 | 0.434 ± 0.090 | 0.488 ± ± 0.134 | 0.341 ± ± 0.082 |
| Период максимального эффекта Maximum effect period | 0.355 ± ± 0.089 | 0.521 ± ± 0.104 | 0.251 ± ± 0.035 | 0.136 ± ± 0.031 | 0.324 ± ± 0.067 | 0.342 ± ± 0.103 | 0.214 ± ± 0.030 | 0.315 ± ± 0.060 | 0.245 ± ± 0.069 | |
| Последействие Aftereffect | 0.246 ± ± 0.066 | 0.271 ± ± 0.093 | 0.289 ± ± 0.117 | 0.299 ± ± 0.055 | 0.497 ± ± 0.078 | 0.614 ± ± 0.079 | 0.303 ± ± 0.095 | 0.440 ± ± 0.096 | 0.540 ± ± 0.069 | |
| Метацин, 1 мг/кг Methacin, 1 mg/kg | Фон Background | 0.327 ± ± 0.054 | 0.304 ± ± 0.062 | 0.439 ± ± 0.067 | 0.450 ± ± 0.046 | 0.445 ± ± 0.057 | 0.462 ± ± 0.068 | 0.302 ± ± 0.067 | 0.335 ± ± 0.083 | 0.406 ± ± 0.079 |
| Период действия эзерина Physostigmine effect period | 0.335 ± ± 0.078 | 0.436 ± ± 0.086 | 0.388 ± ± 0.112 | 0.298 ± ± 0.051 | 0.418 ± ± 0.051 | 0.390 ± ± 0.098 | 0.352 ± ± 0.080 | 0.406 ± ± 0.059 | 0.474 ± ± 0.065 | |
| Последействие Aftereffect | 0.366 ± ± 0.040 | 0.553 ± ± 0.097 | 0.589 ± ± 0.095 | 0.344 ± ± 0.017 | 0.439 ± ± 0.082 | 0.475 ± ± 0.048 | 0.295 ± ± 0.085 | 0.364 ± ± 0.039 | 0.345 ± ± 0.074 | |
| Метацин-
Эзерин Methacin- Physostigmine |
Фон Background | 0.423 ± ± 0.071 | 0.520 ± ± 0.091 | 0.485 ± ± 0.066 | 0.510 ± ± 0.099 | 0.639 ± ± 0.063 | 0.508 ± ± 0.059 | 0.461 ± ± 0.076 | 0.527 ± ± 0.066 | 0.442 ± ± 0.053 |
| Период максимального эффекта Maximum effect period | 0.174 ± ± 0.042 | 0.336 ± ± 0.051 | 0.397 ± ± 0.094 | 0.175 ± ± 0.045 | 0.375 ± ± 0.069 | 0.322 ± ± 0.084 | 0.202 ± ± 0.027 | 0.265 ± ± 0.048 | 0.304 ± ± 0.076 | |
| Последействие Aftereffect | 0.264 ± ± 0.056 | 0.326 ± ± 0.054 | 0.286 ± ± 0.056 | 0.325 ± ± 0.055 | 0.369 ± 0.051± | 0.533 ± ± 0.083 | 0.356 ± ± 0.046 | 0.356 ± ± 0.070 | 0.438 ± ± 0.084 | |
Рис. 4.
Изменение средней величины корреляционной связи (ВКС) модулирующих ритмов (D1, D2, D3) в парах взаимодействующих систем у 16-дневных крысят после инъекции эзерина в дозе 0.7 мг/кг (Э), метацина в дозе 1 мг/кг (М), эзерина на фоне премедикации метацином (МЭ) в % к показателям интактных животных, принятых за 100%.
Fig. 4. Changes in the average value of correlative interaction (CI) indices of the modulatory rhythms (D1, D2, D3) in the pairs of interacting systems in 16-day-old rats after injection of physostigmine (0.7 mg/kg; P), methacin (1 mg/kg; M), and physostigmine against the background of methacin premedication (MP) (% to values of intact rats taken for 100%).
Блокада М-холинорецепторов (М-ХР) метацином не приводит к значимым изменениям вегетативных показателей у крысят обоих возрастов (табл. 5). У 1-дневных животных блокада М-ХР провоцирует усиление, а у 16-дневных – угнетение МА. Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после инъекции метацина для 1-дневных крысят представлены в табл. 2, 3. Из данных табл. 2 видно, что инъекция метацина вызывает глубокое падение мощности колебаний ритма сердца во всех частотных диапазонах, которое продолжается и в последействии. Наряду с этим мощность модулирующих ритмов дыхания также имеет тенденцию к снижению, которое наиболее значительно в диапазоне D3. Кроме того, наблюдается падение мощности модулирующих ритмов МА в диапазонах D2 и D3. После инъекции метацина межсистемные связи в диапазоне D1 остаются слабыми, хотя в процентном отношении к фону ВКС незначительно растет в парах “МА – Ритм сердца” и “Ритм дыхания – Ритм сердца”. Исключение составляет пара “МА – Ритм дыхания” с депрессией межсистемных взаимодействий, в последействии к которой присоединяется и пара “МА – Ритм сердца”. Направление корреляционных связей в диапазоне D1 не меняется. Корреляционные связи в диапазонах D2 и D3 снижаются, кроме пары “МА – Ритм сердца”, ВКС которой слабо повышается в диапазоне D3. В последействии депрессия межсистемных взаимодействий отмечается для всех системных пар. Знак направления корреляционных связей меняется на противоположный в парах с участием сердечной системы в диапазонах D2 и D3 (рис. 3).
Таблица 5.
Изменение физиологических показателей крысят после введения метацина и эзерина на фоне метацина Table 5. Changes in physiological indices of rats injected with methacin and physostigmine against the background of methacin premedication
| Показатели Indices |
Фон Background |
Период действия эзерина Период максимального эффекта Physostigmine effect period Maximum effect period |
Последействие Aftereffect | ||
|---|---|---|---|---|---|
| Опыт experiment |
% к фону % to background |
Опыт experiment |
% к фону % to background | ||
| Р1 | |||||
| Метацин, 1 мг/кг/Methacin, 1 mg/kg | |||||
| ЧСС, в мин/HR, min | 209.9 ± 11.6 | 204.0 ± 7.0 | 97.2 | 210.6 ± 6.5 | 100.3 |
| ЧДД, в мин/RR, min | 88.3 ± 7.1 | 88.7 ± 3.8 | 100.5 | 90.0 ± 4.4 | 101.9 |
| Метацин, 1 мг/кг и Эзерин, 0.875 мг/кг/Methacin, 1 mg/kg and Physostigmine, 0.875 mg/kg | |||||
| ЧСС, в мин/HR, min | 240.3 ± 11.3 | 210.0 ± 10.6 | 87.4 | 216.4 ± 14.6 | 90.1 |
| ЧДД, в мин/RR, min | 84.7 ± 6.4 | 57.9 ± 2.5* | 68.4 | 58.7 ± 2.3* | 69.3 |
| Р16 | |||||
| Метацин, 1 мг/кг/Methacin, 1 mg/kg | |||||
| ЧСС, в мин/HR, min | 444.6 ± 31.1 | 449.2 ± 33.0 | 101.0 | 459.7 ± 29.5 | 103.4 |
| ЧДД, в мин/RR, min | 140.9 ± 16.7 | 139.9 ± 16.3 | 99.3 | 132.2 ± 13.2 | 93.8 |
| Метацин, 1 мг/кг и Эзерин, 0.7 мг/кг/Methacin, 1 mg/kg and Physostigmine, 0.7 mg/kg | |||||
| ЧСС, в мин/HR, min | 473.7 ± 14.9 | 415.8 ± 15.4* | 87.8 | 463.2 ± 16.2 | 97.8 |
| ЧДД, в мин/RR, min | 150.8 ± 19.1 | 92.4 ± 10.5* | 61.3 | 154.5 ± 11.2 | 102.5 |
Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после инъекции метацина 16-дневным крысятам представлены в табл. 2, 4. Блокада М-ХР вызывает рост мощности модулирующих ритмов для всех систем во всех частотных диапазонах, кроме диапазона D1 ритма сердца. Мощность колебаний этого диапазона падает и продолжает снижаться в последействии. Также для периода последействия характерна тенденция к ослаблению мощности модулирующих ритмов дыхания и МА в этом диапазоне. В последействии продолжается рост мощности колебаний ритма дыхания и мощности МА в диапазоне D2 и ритма сердца в диапазоне D3. Введение метацина вызывает разнонаправленные изменения межсистемных связей в паре “Ритм дыхания – Ритм сердца”. Первоначальное увеличение ВКС этой системной пары сменяется ее снижением, при этом в диапазонах D1 и D3 – ниже фоновых значений. В паре “МА – Ритм сердца” отмечается рост межсистемных связей, который наиболее выражен в диапазоне D2, а в диапазоне D3 связь этой системной пары падает ниже фонового значения с последующим увеличением в последействии. Корреляционные связи пары “МА – Ритм дыхания” претерпевают общую депрессию, более значительную в диапазоне D1. В последействии наблюдается тенденция к росту ВКС этой пары, причем в диапазоне D3 – выше фонового значения. Знак направления корреляционных связей у всех системных пар не меняется (рис. 4).
Введение эзерина на фоне блокады М-ХР
Введение 1-дневным крысятам эзерина на фоне блокады М-ХР вызывает замедление ритма сердца на 13% без нарушений самого ритма (табл. 4). В ПМЭ стадия выраженной брадикардической аритмии полностью отсутствует. Наблюдаются нарушение регулярности и замедление ритма дыхания на 32%. Паттерн МА не претерпевает значимых изменений, при этом продолжается усиление МА, обусловленное инъекцией метацина. Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после инъекции эзерина на фоне блокады М-ХР для 1-дневных крысят представлены в табл. 3, 4. В ПМЭ наблюдается падение мощности колебаний ритма сердца в диапазонах D1 и D2, которое сохраняется и в последействии, но в диапазоне D3 их мощность повышается. Снижается мощность колебаний МА в диапазоне D3 с последующим ее восстановлением. Остальные показатели мощности колебаний ритма дыхания и МА незначительно изменяются относительно фоновых значений. Инъекция эзерина на фоне блокады М-ХР, в отличие от отдельной инъекции эзерина, вызывает в диапазоне D1 менее существенное снижение уровня межсистемных взаимодействий во всех парах модулирующих ритмов. В диапазонах D2 и D3 межсистемные связи в паре “МА – Ритм дыхания” претерпевают депрессию. В паре “МА – Ритм сердца” первоначальное снижение ВКС сменяется ее увеличением, причем в диапазоне D3 – выше фонового значения. Кардиореспираторная межсистемная связь в диапазоне D2 повышается выше фонового значения с последующим ее снижением в последействии. В многоминутном диапазоне наблюдается депрессия этой корреляционной связи. В ПМЭ знак направления корреляционных связей меняется на противоположный в диапазоне D2 в парах с участием сердечной системы и в диапазоне D3 в парах с участием дыхательной системы. В последействии знак направления корреляционных связей меняется на противоположный в диапазоне D1 в парах с участием соматомоторной системы (рис. 3).
Введение эзерина на фоне блокады М-ХР 16‑дневным крысятам вызывает замедление ритма сердца на 12% и ритма дыхания на 39% без значимых нарушений самих ритмов (табл. 5). Продолжается депрессия МА, вызванная инъекцией метацина. Мощность модулирующих ритмов и ВКС исследуемых функциональных систем после инъекции эзерина на фоне блокады М-ХР для 16-дневных крысят представлены в табл. 3, 5. В ПМЭ происходит падение мощности колебаний ритма сердца во всех диапазонах, с тенденцией к ее восстановлению в последействии. Мощность колебаний МА в диапазонах D2 и D3 существенно растет с последующим снижением в последействии, а в диапазоне D1 отмечается ее падение. Мощность колебаний ритма дыхания растет в диапазоне D3, тогда как в остальных диапазонах наблюдается ее депрессия. Инъекция эзерина на фоне блокады М-ХР вызывает нарушение всех межсистемных связей во всех частотных диапазонах с тенденцией к их последующему восстановлению: в диапазоне D1 – во всех системных парах; в диапазоне D2 – в паре “Ритм дыхания – Ритм сердца”; в диапазоне D3 – в паре “Ритм дыхания – Ритм сердца”, “МА – Ритм дыхания”. Причем для последней системной пары ВКС становится выше фонового значения. Знак направления корреляционных связей меняется в ПМЭ на противоположный в диапазоне D1, D2 и в период последействия в диапазоне D3 в парах с участием сердечной системы (рис. 4).
Анализ полученных данных показывает, что развитие межсистемных связей у интактных крысят имеет определенные онтогенетические особенности. Корреляционные взаимодействия ритмов декасекундного диапазона, не участвующие в интегративных процессах у однодневных крысят, существенно возрастают у крысят старшего возраста. Более того, с возрастом наблюдается увеличение ВКС околоминутных колебаний ритмов, подобные результаты были получены и для кардио-соматомоторных взаимодействий у плодов крыс на Е17–Е19 [9]. Вместе с тем направления корреляционных связей у интактных крысят с возрастом не меняются. Можно предположить, что усиление межсистемных связей у животных старшего возраста происходит за счет роста фазных регулирующих влияний со стороны вегетативной нервной системы (ВНС), в то время как показатели ВКС однодневных крысят отражают взаимодействие авторитмически функционирующих систем. Одновременно с ростом ВКС отмечается падение мощности околоминутных и многоминутных модулирующих ритмов. Возможно, что возрастная корреляционно-мощностная реципрокность околоминутных колебаний связана со становлением регуляторных функций ВНС. Выявленные изменения показателей мощности модулирующих ритмов подтверждают выводы, сделанные нами ранее на основании качественной оценки уровня синхронизации медленноволновых ритмов взаимодействующих систем [10, 11]. Кроме того, математический анализ данных, полученных на людях, показал, что доля мощности низкочастотных составляющих значительно выше в периодограммах сердечного ритма, чем в периодограммах дыхания [12]. Можно предположить, что направления корреляционных связей у интактных животных отражают компенсаторно-приспособительные свойства систем, когда колебания ритма сердца, с более лабильной регуляцией, противофазны колебаниям ритма дыхания и мощности МА (то есть усилению МА или урежению ритма дыхания сопутствует учащение ритма сердца) [13, 14]. Мы установили, что у крысят обоих возрастов изменения интенсивности и паттерна МА имеют тенденцию предшествовать модулирующим осцилляциям дыхательного и сердечного ритма. В то время как у 1-дневных крысят осцилляции дыхательного ритма могут как предшествовать возникновению осцилляций сердечного ритма, так и запаздывать по отношению к ним, у 16-дневных крысят модулирующие осцилляции дыхательного ритма в основном занимают опережающее положение по отношению к осцилляциям сердечного ритма. Мы не смогли выявить закономерности в характере распределения взаимодействующих систем относительно друг друга в условиях активации и недостаточности регуляторных холинергических влияний, так как временные соотношения становятся неинформативными из-за нарушений корреляционных связей.
Ингибирование ацетилхолинэстеразы эзерином и последующая активация холинореактивных структур вызывают снижение уровня межсистемных взаимодействий по всем диапазонам модулирующих ритмов у крысят обоих возрастов. Однако у 1-дневных животных количество системных пар, менее подверженных действию препарата во всех частотных диапазонах, больше чем у 16-дневных. В последействии – количество показателей ВКС, уровень которых превышает фоновые значения, больше на Р1. Направления корреляционных связей изменяются у крысят обоих возрастов. У 1-дневных наблюдаются противофазные колебания ритма дыхания с колебаниями ритма сердца и мощностью МА, а у животных старшего возраста все колебания становятся синфазными. Вероятно, такое синфазное направление связей на Р16 может свидетельствовать о нарушении компенсаторно-регуляторных свойств систем т.к. в этом случае усилению МА сопутствует урежение ритмов дыхания и сердца. Таким образом, несмотря на то, что при воздействии высоких доз эзерина развивающаяся дисфункция на Р1 носит более глубокий и длительный характер, чем на Р16, межсистемные взаимодействия сохраняются лучше у менее зрелых животных.
Блокада метацином периферических М-ХР вызывает на Р1 снижение уровня межсистемных взаимодействий, опосредованных околоминутными и многоминутными модулирующими ритмами, и их колебания становятся синфазными. Направления корреляционных связей декасекундных модулирующих ритмов сохраняются. На Р16 наблюдается большее количество взаимодействующих системных пар с показателями ВКС выше фоновых значений во всех частотных диапазонах, и направления корреляционных связей остаются такими же, как у интактных животных. Таким образом, блокада М-ХР, в основном, оказывает позитивное влияние на межсистемные связи у крысят старшего возраста. У 1-дневных крысят количество системных пар, менее подверженных действию эзерина, вводимого на фоне блокады М-ХР, больше чем у животных старшего возраста. Кроме того, на Р1 в период последействия происходит восстановление направлений корреляционных связей, реализуемых посредством медленноволновых колебаний около- и многоминутного диапазонов, в то время как на Р16 они становятся синфазны. Ранее нами было показано [6], что наиболее эффективно отрицательное хронотропное действие эзерина купируется блокадой М-ХР у 1-дневных крысят, тогда как у 16-дневных крысят в 67% случаев сохраняются низкоамплитудные брадикардические комплексы. Следовательно, исходя из наших данных, можно допустить, что нарушение межсистемных связей в условиях блокады М-ХР и активации холинореактивных структур, вызванной ингибированием АХЭ, более выражено у животных старшего возраста.
На рис. 5 представлена сравнительная схема возрастных различий степени вовлеченности модулирующих ритмов в процессы взаимодействия системных пар, наиболее устойчивых к действию препаратов. Инъекция эзерина и последующее увеличение уровня АХ не оказывают значимого влияния на кардио-соматомоторные взаимодействия в ПМЭ, причем у крысят младшего возраста они поддерживаются бóльшим диапазоном модулирующих ритмов. Аналогичная ситуация наблюдается и в период последействия препарата для всех взаимодействующих системных пар. При блокаде М-ХР, напротив, и в период максимального эффекта, и в период последействия, имеющиеся межсистемные взаимодействия оказалось труднее нарушить у 16-дневных крысят. Активация холинореактивных структур, вызванная ингибированием АХЭ и происходящая на фоне блокады М-ХР, в значительной мере затрагивает Н-ХР и приводит к нарушению координационных взаимодействий в паре “МА – Ритм дыхания”. У крысят младшей возрастной группы восстановления этих функциональных связей не происходит, а у 16-дневных они возобновляются уже в период последействия.
Рис. 5.
Сравнительная схема вовлеченности модулирующих ритмов, участвующих в межсистемных взаимодействиях, наиболее устойчивых к действию препаратов (а) и возрастные различия в представленности этих ритмов у 1- и 16-дневных крысят (б).
Взаимодействующую системную пару считали устойчивой, если ее процентное значение ВКС попадало в полосу ±25% от фона. Значения ВКС, выходящие за полосу 25%, в подавляющем большинстве случаев достоверно отличаются от исходного уровня.
Сегмент без штриховки соответствует системной паре с сохраненными корреляционными связями в период максимального эффекта препарата, со штриховкой – в период последействия.
В прямоугольниках, расположенных в сегментах, указаны частотные диапазоны модулирующих ритмов, а также направление корреляционной связи этих ритмов. Синфазные колебания обозначены знаком плюс, противофазные – минус. При анализе возрастных различий (б) направление связи не учитывалось.
Fig. 5. Comparative diagram of the involvement of the modulatory rhythms (most resistant to the effect of the chemical agents) in intersystemic interactions (a), and age-related differences in the representation of these rhythms in 1- and 16-day old rats (b).
A pair of interacting systems was considered stable if the percentage of its correlative relationships (CR) fell to the band ±25% of the background. CR values transcending the bounds of this band in most cases significantly differ from the initial level.
The unhatched segment corresponds to a systemic pair that retains correlative interactions during the period of the chemical agent’s maximum effect, while the hatched segment – to a systemic pair that does the same during the aftereffect period. In the rectangles located in the segments, the frequency ranges of the modulatory rhythms, as well as the direction of correlative relationships of these rhythms, are indicated. In-phased oscillations are marked by the plus, while anti-phased – by the minus signs. When analyzing age-related differences (b), the direction of relationships was disregarded.
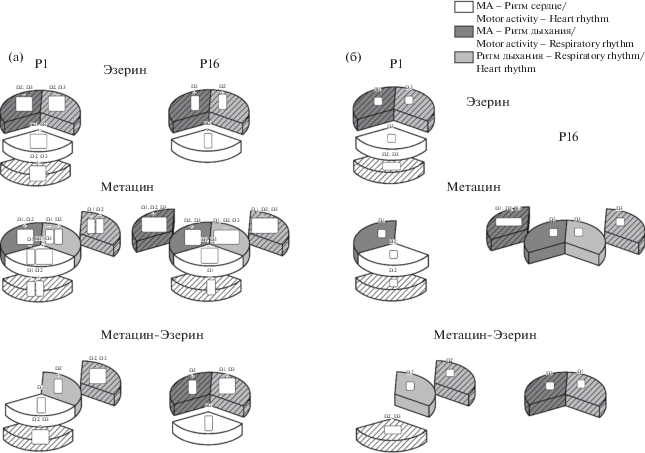
Полученные нами результаты свидетельствуют о том, что мощность модулирующих ритмов активности исследуемых систем не имеет прямой связи с межсистемными взаимодействиями. Рассмотренные нами возрастные изменения межсистемных взаимодействий обусловлены как гетерохронией созревания этих функциональных систем, так и гетерохронией вовлеченности различных холинореактивных структур в процессы межсистемной регуляции. Кроме того, наблюдаемые сдвиги показателей межсистемных связей в ответ на изменение уровня холинергической активации обусловлены гетерохронией становления реципрокных взаимодействий между М- и Н-холинорецепторами [15, 16].
В формировании модулирующих ритмов принимают участие как вегетативная нервная система, так и гуморально-метаболические факторы, причем в постнатальном онтогенезе доля последних смещается в сторону доминирования многоминутных колебаний. Кроме того, нельзя исключить, что в регуляции медленноволновой модулирующей ритмики определенную роль играет взаимодействие пептидной и холинергической систем [17].
Список литературы
Coyle J.T. and Vamamura H.I. Neurochemical aspects of the ontogenesis of cholinergic neurons in the rat brain. Brain Res. 118: 429–440. 1976.
Holler T., Berse B., Cermak J. M., Diebler M.F., Blusztajn J.K. Differences in the developmental expression of the vesicular acetylcholine transporter and choline acetyltrasferase in the rat brain. Neurosci. Lett. 212: 107–110. 1996.
Кузнецов С.В., Сизонов В.А., Дмитриева Л.Е. Изменение характера межсистемных взаимодействий у новорожденных крысят в условиях снижения центральных влияний (уретановый наркоз). Ж. эвол. биохим. и физиол. 50 (4): 207–218. 2014. [Kuznetsov S.V., Sizonov V.A., Dmitrieva L.E. Change of character of intersystemic interactions in newborn rat pups under conditions of decreased central influences (urethane anesthesia). J. Evol. Biochem. Physiol. 50 (3): 234–246. 2014].
Сизонов В.А., Дмитриева Л.Е., Кузнецов С.В. Сомато-висцеральные межсистемные взаимодействия у новорожденных крысят на фоне депрессии моторной активности. Ж. эвол. биохим. и физиол. 51 (4): 290–298. 2015. [Sizonov V.A., Dmitrieva L.E., Kuznetsov S.V. Somatovisceral intersystemic interactions in newborn rat pups under decreased motor activity. J. Evol. Biochem. Physiol. 51 (4): 332–341. 2015].
Сизонов В.А., Дмитриева Л.E. Нарушения ритма сердца, вызванные инъекцией ингибитора холинэстеразы эзерина в раннем онтогенезе крыс. Бюл. экспер. биол. и мед. 165 (1): 52–56. 2018. [Sizonov V.A., Dmitrieva L.E. Heart rhythm disturbances caused by injection of cholinesterase inhibitor physostigmine to rats during the early ontogeny. Bull. Experimental Biol. and Med. 165 (1): 44–47. 2018].
Сизонов В.А., Дмитриева Л.Е., Кузнецов С.В. Влияние блокады М-холинорецепторов на функциональную активность моторной, сердечной и дыхательной систем новорожденных крысят при активации холинореактивных структур. Ж. эвол. биохим. и физиол. 55 (3):179–187. 2019. [Sizonov V.A., Dmitrieva L.E., Kuznetsov S.V. The effect of M-cholinoreceptor blockade on functional activity of somatomotor, cardiovascular and respiratory systems in newborn rats upon activation of cholinoreactive structures. J. Evol. Biochem. Physiol. 55 (3):198–207. 2019].
Биопотенциалы мозга человека. М. Медицина. 1987. [Biopotentsialy mozga cheloveka [Human brain biopotentials]. Moscow. Meditsina. 1987 (in Russ)].
Кузнецов С.В., Дмитриева Л.Е., Сизонов В.А. Сердечная, дыхательная и моторная деятельность в норме и после активации катехоламинергических систем у новорожденных крысят. Ж. эвол. биохим. и физиол. 48 (4): 367–379. 2012. [Kuznetsov S.V., Dmitrieva L.E., Sizonov V.A. Cardiac, respiratory and motor activity in the norm and after activation of catecholaminergic systems in newborn rats. J. Evol. Biochem. Physiol. 48 (4): 430–444. 2012].
Вдовиченко Н.Д., Тимофеева О.П., Бурсиан А.В. Количественная оценка связи колебаний ритма сердцебиений с моторной активностью у плодов крыс. Ж. эвол. биохим. и физиол. 50 (2):92–96. 2014. [Vdovichenko N.D., Timofeeva O.P., Bursian A.V. Quantitative estimation of connection of the heart rate rhythm with motor activity in rat fetuses. J. Evol. Biochem. Physiol. 50 (2): 103–108. 2014].
Бурсиан А.В., Дмитриева Л.Е., Сизонов В.А. Вторичные ритмы авторитмически функционирующих систем. Ж. эвол. биохим. и физиол. 45 (6): 553–558. 2009. [Bursian A.V., Dmitrieva L.E., Sizonov V.A. Secondary rhythms of automatically functioning systems. J. Evol. Biochem. Physiol. 45 (6): 670–677. 2009].
Бурсиан А.В., Дмитриева Л.Е., Сизонов В.А. Влияние изменения уровня моторной активности и иннервации на базовые и вторичные ритмы сердцебиений и дыхания у крыс в онтогенезе. Ж. эвол. биохим. и физиол. 47 (4): 311–317. 2011. [Bursian A.V., Dmitrieva L.E., Sizonov V.A. Effect of change in levels of motor activity and innervation on basic and secondary rhythms of rat heart beatings and respiration in ontogenesis. J. Evol. Biochem. Physiol. 47 (4): 366–373. 2011].
Бахилин В.М. Кросскорреляционный и кросс-спектральный анализ связи колебаний сердечного ритма и дыхания. Вестн. рос. воен.-мед. акад. 37 (1): 193–199. 2012. [Bahilin V.M. Cross-spectral and cross-covariation analyses of connection between fluctuations of heart rate and respiration. Vest. ross. voen.-med. acad. 37 (1): 193–199. 2012. (in Russ.)].
Курзанов А.Н., Заболотских Н.В., Мануйлов А.М. Клинико-физиологические аспекты диагностики функциональных резервов организма. Кубанский науч. мед. вестник. 155 (6): 73–77. 2015. [Kurzanov A.N., Zabolotskih N.V., Manuilov A.M. Clinical and physiological aspects of functional body reserves diagnostics. Kubanskiy nauch. med. vestnik. 155 (6): 73–77. 2015. (in Russ)].
Пушкарев Ю.П. Динамика сомато-вегетативного взаимодействия в онтогенезе животных и человека. Педиатр. 5 (1): 103–106. 2014. [Pushkarev Yu.P. Dynamic of somatic-vegetative relating ontogenesis of animals and man. Pediatr. 5 (1): 103–106. 2014. (in Russ.)].
Лосев Н.А., Евлахов В.И., Шалковская Л.Н. Реципрокный характер взаимодействия мускариновых и никотиновых холинергических механизмов в регуляции системной гемодинамики. Мед. акад. журн. 11 (2): 33–41. 2011. [Losev N.A., Evlakhov V.I., Shalkovskaya L.N. The reciprocal character of the muscarinic and nicotinic cholinergic mechanisms interaction in the systemic hemodynamics regulation. Med. akad. zhurn. 11 (2): 33–41. 2011. (in Russ.)].
Кузнецов С.В., Кузнецова Н.Н. Изменение показателей гемодинамики в раннем постнатальном онтогенезе крыс после инъекции ингибитора холинэстеразы эзерина и при премедикации М- и Н-холинолитиками. Физиол. ж. им. И.М. Сеченова. 104 (9): 1075–1085. 2018. [Kuznetsov S.V., Kuznetsova N.N. The influence of cholinesterase inhibitor physostigmine and cholinoreceptors preliminary blockade by anticholinergic drugs on cardiac output, heartbeat and frequency of respiration in intact newborn rats. Fiziol. Zh. im. I.M. Sechenova 104 (9): 1075–1085. 2018. (in Russ.)].
Соловьев В.Б., Генгин М.Т. Влияние ареколина и атропина на активность карбоксипептидазы Н и фенилметилсульфонилфторид-ингибируемой карбоксипептидазы в нервной ткани крыс. Биомедицинская химия. 54 (2): 201–209. 2008. [Solov’ev V.B., Gengin M.T. The effect of a single dose of arecholine and atropine administration on activities of carboxypeptidase H and phenylmethylsulfonyl fluoride-inhibited carboxypeptidase in the nervous system of rats. Biochemistry (Moscow) Supplement. Series B: Biomedical Chemistry. 2 (2): 183–188. 2008].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


