Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 4, стр. 313-318
ВНУТРИСУТОЧНАЯ ДИНАМИКА И ИНФРАДИАННЫЕ РИТМЫ КОНЦЕНТРАЦИИ ТЕСТОСТЕРОНА В КРОВИ ПТИЦ
М. Е. Диатроптов *
ФГБУН “Институт проблем экологии и эволюции им. А.Н. Северцова РАН”
119071 Москва, Ленинский проспект, 33, Россия
* E-mail: diatrom@inbox.ru
Поступила в редакцию 06.11.2019
После доработки 19.03.2020
Принята к публикации 19.03.2020
Аннотация
Исследовали внутрисуточную и многосуточную динамику концентрации тестостерона в сыворотке крови у самцов обыкновенного скворца Sturnus vulgaris и японского перепела Coturnix japonica. В условиях естественного освещения у обоих исследованных видов птиц, помимо утреннего максимума концентрации тестостерона, выявляется дополнительный максимум около 16:30, время проявления которого не зависит от продолжительности светового дня (12 ч и 16 ч). В условиях постоянного искусственного освещения у японского перепела максимальные показатели тестостерона наблюдаются в 8:30 и 16:30 ч. У исследованных видов птиц выявлен 4-суточный ритм изменения концентрации тестостерона. Выявленные параметры ритмических изменений тестостерона соответствуют таковым у млекопитающих, следовательно, механизмы формирования и синхронизации инфрадианных биоритмов у этих классов животных сходны.
ВВЕДЕНИЕ
Динамика физиологических показателей организма изменяется в различных частотных диапазонах. Механизмы формирования циркадианных (околосуточных) биоритмов хорошо изучены [1, 2]. К настоящему моменту накоплено много данных о ультрадианных (период от 0.5 ч до 20 ч) и инфрадианных (период от 28 ч до 30 сут) биоритмах у животных и человека [3–6]. Механизмы формирования ультрадианных и инфрадианных биоритмов не установлены. В последнее время активно изучаются 2–6 часовые колебания различных физиологических показателей, в частности двигательной активности, сна, питания, температуры тела, уровня гормонов в сыворотке крови. Установлен так называемый дофаминэргический осциллятор, имеющий период около 4 ч и наряду с циркадианным, контролирующий цикл отдых/активность [7]. Было показано, что мутация в гене транспортера дофамина Slc6a3−/− приводит к увеличению периода ультрадианного ритма двигательной активности [8].
Ультрадианные ритмы взаимодействуют с циркадианными, но их механизмы формирования различны. Показано, что постоянное освещение или добавление в питьевую воду оксида дейтерия увеличивает продолжительность циркадианного ритма двигательной активности, но не изменяют период ультрадианных ритмов [9]. Также было установлено, что ультрадианный ритм секреции кортикостерона сохраняется при повреждении супрахиазматического ядра гипоталамуса – главного водителя циркадианного ритма [10]. Что касается связи инфрадианных и циркадианных биоритмов, то в условиях постоянного освещения у самцов крыс Вистар также была установлена их автономность [11].
Исследование инфрадианных и ультрадианных ритмов колебания концентрации гормонов выполнено на млекопитающих. У человека и лабораторных животных установлены циркасептанные (околонедельные) и циркасемисептанные (околополунедельные) изменения концентрации глюкокортикоидных гормонов, мелатонина, митотической активности, экскреции натрия, вариабельности сердечного ритма и др. [12–16]. Предполагается, что эти ритмы, так же как и циркадианные, самоподдерживающиеся, и имеют пока еще неустановленные внешние синхронизаторы [3, 17].
В динамике концентрации тестостерона у крыс установлены около 4-часовая и 8-часовая периодичности [18, 19]. Вне зависимости от режима освещения максимальный уровень тестостерона в сыворотке крови у кроликов наблюдается около полуночи, 8 и 16 ч по местному солнечному времени [20]. В динамике колебаний тестостерона установлен 4-суточный ритм, он выявлен у юношей [21] и у самцов крыс Вистар [22]. Продолжительные исследования показали, что примерно каждые 60–72 сут акрофаза этого инфрадианного ритма смещается на 1 сут вперед, что позволило уточнить длину периода до 4.058 сут [23].
Однако в литературе отсутствуют данные об ультрадианных и инфрадианных биоритмах концентрации тестостерона в сыворотке крови птиц. Также представляется интересным выяснить взаимосвязь фаз ультрадианных и циркадианных биоритмов, а именно: определяется ли фаза ультрадианных ритмов местным солнечным временем или же она определяется моментом восхода или захода Солнца.
Цель исследования – изучить наличие ультрадианных и инфрадианных ритмов концентрации тестостерона в сыворотке крови у двух видов птиц (Sturnus vulgaris и Coturnix japonica).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования были проведены на 6 годовалых самцах обыкновенного скворца Sturnus vulgaris, взятых в птенцовом возрасте из разных гнезд. Также исследования были выполнены на 8 самцах японского перепела Coturnix japonica в возрасте 4–5 мес. Птицы содержались в индивидуальных клетках при естественном освещении и комнатной температуре.
Изучение внутрисуточной динамики тестостерона у скворцов проводили в два временных интервала: 24–28 марта 2012 г. при длительности дня 12 ч и 10–14 мая 2012 г. при длительности дня в 16 ч. Интервал между забором крови у животных составлял 120 мин, однако круглосуточных исследований не проводилось и некоторые (22:30, 0:30, 2:30) временные точки отсутствуют. У японских перепелов внутрисуточную динамику исследовали как при естественном освещении (в период с 29 июня по 1 июля 2019 г.), так и в условиях постоянного освещения от источника с цветовой температурой 4000 К и интенсивностью около 1000 лк на уровне пола клетки. Исследование концентрации гормонов начали через 3 недели после помещения птиц в условия постоянного освещения (в период с 3 по 8 августа 2019 г.).
С целью избежать возможной синхронизации изменений уровня тестостерона стрессорным воздействием от первого взятия крови во всех экспериментах птицы были разделены на две равнозначные подгруппы, взятие крови у животных второй подгруппы начинали через 120 мин после первой.
Забор крови для исследования инфрадианных ритмов у скворцов проводили в период 10–24 апреля 2012 г., а у перепелов – с 3 по 16 июля 2019 г., ежедневно в 8:00–8:30. Также с целью избежать возможной синхронизации инфрадианных ритмов стрессорным воздействием от первого взятия крови во всех экспериментах птицы были разделены на две подгруппы, взятие крови у животных второй подгруппы начинали через 2 дня после первой. Кровь брали из вены голени, в количестве не более 150 мкл. Процедура забора крови не превышала 1 мин. Через 20 мин после забора кровь центрифугировали 10 мин при 300 g. Полученную сыворотку хранили не более месяца при температуре –20°С.
Концентрацию тестостерона в сыворотке крови определяли методом иммуноферментного анализа, используя наборы “НВО Иммунотех” (Россия). Регистрацию цветной реакции проводили на многоканальном ИФА анализаторе ANTHOS 2010 (Австрия).
Статистическую обработку данных проводили с помощью программного пакета Statistica 6.0. Полученные данные выражали в виде медианы и интерквартильных размахов Me (Q25–Q75). Для выявления периодов инфрадианных ритмов подсчитывали коэффициент автокорреляции между исходным рядом и рядом, сдвинутым на 1, 2, 3 и 4 сут. С целью установления статистической значимости 4‑суточного периода был применен метод наложенных эпох [24]. Статистическую значимость различий показателя в акрофазе (точка периода, когда показатель имеет максимальные значения) и батифазе (точка периода, когда показатель имеет минимальные значения) оценивали с помощью непараметрического критерия Манна–Уитни и критерия множественного сравнения Крускалла–Уоллиса.
Работу с животными проводили согласно рекомендациям национального стандарта по принципам надлежащей лабораторной практики Российской Федерации ГОСТ З 53434-2009 и было получено положительное заключение этической комиссии ИПЭЭ РАН № 14 от 15.01.2018 г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика концентрации тестостерона у скворцов 24–28 марта при продолжительности дня 12 ч (восход Солнца в 06:20 , заход – 18:50) имела два максимума: около 6–8 ч утра и 16:30 (рис. 1, ряд 1). Была установлена статистическая значимость различий (z = 4.3; р = 0.0001) между показателями, в 16:30 составляющими 10.6 (7.4; 16.7) нмоль/л, и соседними точками, концентрация тестостерона в которых была равна 5.4 (5.1; 7.6) нмоль/л. В период 10–14 мая при продолжительности дня 16 ч (восход Солнца в 04:30, заход – 20:30) утренний пик сместился на более ранние часы 4–6 ч, тогда как вечерний остался в районе 16:30 (рис. 1, ряд 2). Между показателями, в 16:30 составляющими 7.6 (6.1; 9.1) нмоль/л, и соседними точками, где уровень тестостерона составил 4.3 (3.3; 5.9) нмоль/л выявлена статистически значимая разница (z = 3.6; р = 0.0002).
Рис. 1.
Суточная динамика концентрации тестостерона в сыворотке крови обыкновенных скворцов (n = 6), данные получены за 24, 26 и 28 марта 2012 г. (ряд 1) и за 10, 12, 14 мая 2012 г. (ряд 2). Представлены медианы и интерквартильный размах.
Fig. 1. Daily dynamics of serum testosterone concentration in the ordinary starling (n = 6); data were obtained on March 24, 26 and 28, 2012 (row 1) and May 10, 12, 14, 2012 (row 2). Median and interquartile span are shown. Ordinate – nmol/L, abscissa – time.
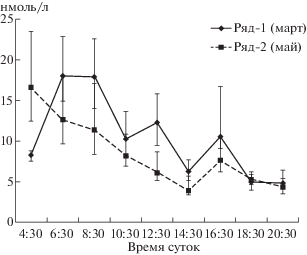
Изменение времени утреннего пика исследуемого гормона объясняется его связью с началом светового периода. Вечерний же пик нельзя объяснить ни этим фактором, ни стратегией поведения: в конце марта около 16 ч вольные скворцы активно поют у гнездовий, а в середине мая особи, оставшиеся холостыми, начинают вечернее пение значительно позже, ориентируясь на время захода Солнца.
Исследование суточной динамики концентрации тестостерона у самцов японского перепела проводилось в начале июля, при длительности дня 17.5 ч (восход Солнца в 03:50, заход – 21:15). Динамика показателя была сходной со скворцами (рис. 2). Также выявлено статистическое различие (z = 2.3; р = 0.022) показателей концентрации тестостерона в 16:30, составляющее 7.2 (6.0; 10.7) нмоль/л, и соседними точками, где значения были равны 4.4 (2.8; 7.4) нмоль/л. Дальнейшее исследование проводилось в условиях постоянного освещения. Максимумы концентрации тестостерона наблюдались в 8:30 и 16:30 (рис. 2b). Между значениями концентрации тестостерона в 6:30 и 8:30, составляющими 4.2 (3.4; 5.3) нмоль/л и 7.0 (5.2; 9.9) нмоль/л соответственно установлено статистически значимое различие (z = 3.2; р = 0.002). Между показателями в 14:30 и 16:30, равными 3.4 (2.6; 4.6) нмоль/л и 6.4 (4.1; 9.0) нмоль/л соответственно, также выявлено значимое различие (z = 2.7; р = 0.008).
Рис. 2.
Суточная динамика концентрации тестостерона в сыворотке крови японских перепелов (n = 8), находившихся при естественном освещении (а) и при постоянном искусственном освещении (b). Данные рисунка (а) получены за 29 июня и 1 июля 2019 г., (b) – за 3, 5, 7 и 8 августа 2019 г.
Fig. 2. Daily dynamics of serum testosterone concentration in the Japanese quail (n = 8) revealed under natural (a) and constant artificial illumination (b). Fig. 2a data were obtained on June 29 and July 1, 2019; fig. 2b – on August 3, 5, 7 and 8, 2019. Median and interquartile span are shown. Ordinate nmol/L, abscissa – time.
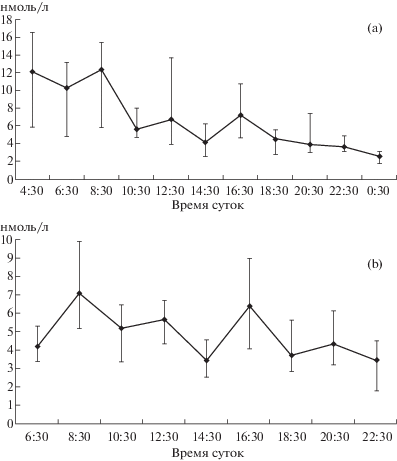
Таким образом, так же как и при естественном освещении, в условиях отсутствия суточного светового ориентира – смены дня и ночи, в 16:30 наблюдается максимум содержания тестостерона в сыворотке крови. Важно отметить, что у крыс и кроликов максимальные значения тестостерона также наблюдаются в 8, 16 и 24 ч по местному солнечному времени [20, 22]. В случае грызунов и зайцеобразных такой полифазный характер суточной динамики тестостерона можно объяснить их сумеречным образом жизни. Однако исследованные птицы являются дневными видами, поэтому, возможно, несколько суточных пиков концентрации тестостерона необходимо для нормального функционирования семенников [5].
Выявленный факт сохранения времени проявления максимумов концентрации тестостерона в сыворотке крови перепелов при содержании их в условиях постоянного освещения, по нашему мнению, указывает на существование внешнего неучтенного фактора, влияющего на концентрацию тестостерона в крови птиц.
Ранее нами было показано, что смещение или инверсия светового режима не изменяли период и фазу 8-часового ритма тестостерона у кроликов [20]. После трансмеридианного перемещения кроликов из г. Омска в г. Москву с сохранением светового режима, характерного для местности, из которой были вывезены экспериментальные животные, фаза ультрадианных ритмов уровня тестостерона синхронизировалась с местным временем. Следовательно, существует внешний синхронизатор с периодом, кратным 8 часам и проявляющийся по местному времени.
Что касается возможного внешнего фактора, синхронизирующего этот биоритм, хочется отметить установленный Ю.П. Горго и Л.А. Дидык [25] факт влияния микрофлуктуаций атмосферного давления (в диапазоне 0.01–0.1 Гц) на активацию симпатической системы и сердечную деятельность у здоровых добровольцев. Микрофлуктуации атмосферного давления имеют суточную ритмику с максимумом около 16–17 ч по местному времени. Показано действие как естественных, так и искусственно генерируемых колебаний атмосферного давления [26]. Однако в этом же диапазоне периодов наблюдаются геомагнитные колебания, которые также могут быть искомыми факторами синхронизации инфрадианных и ультрадианных биоритмов.
При ежедневном исследовании динамика концентрации тестостерона в сыворотке крови скворцов имела около 4-суточную ритмичность. Максимальные значения регистрировались 11–12, 16, 20 и 23 апреля (рис. 3а). Коэффициент автокорреляции между исходным рядом и рядом, сдвинутым на 1 сут составил r = 0.05 (p = 0.87); на 2 сут – r = –0.56 (p = 0.05); на 3 сут – r = –0.005 (p = 0.98) и на 4 сут – r = 0.40 (p = 0.21). С целью установления статистической значимости различий в разные фазы ритма был применен метод наложенных эпох: все полученные значения были распределены по дням 4-суточного периода. К первому дню 4-суточного периода были отнесены значения концентрации тестостерона за 10, 14, 18 и 22 апреля, ко второму – за 11, 15, 19 и 23 апреля, к третьему – за 12, 16, 20 и 24 апреля, к четвертому – за 13, 17 и 21 апреля. Концентрация тестостерона в батифазе – первый день 4‑суточного периода составила 11.6 (10.6; 14.3) нмоль/л и была статистически значимо ниже, чем в акрофазе – третий день – 15.2 (13.1; 17.2) нмоль/л (р = 0.043). Таким образом, в динамике концентрации тестостерона в сыворотке крови нами установлен 4-суточный ритм.
Рис. 3.
Динамика концентрации тестостерона в сыворотке крови обыкновенных скворцов (n = 6) в период с 10 по 24 апреля 2012 г. (a) и японских перепелов (n = 8), (Б) в период с 3 по 16 июля 2019 г. Птиц содержали при естественном освещении. Представлены медианы и интерквартильный размах.
Fig. 3. Dynamics of serum testosterone concentration in the ordinary starling (n = 6) during the period from April 10 to 24, 2012 (a) and Japanese quail (n = 8), (b) from July 3 to 16, 2019. Median and interquartile span are presented. Ordinate – nmol/L, abscissa – time.
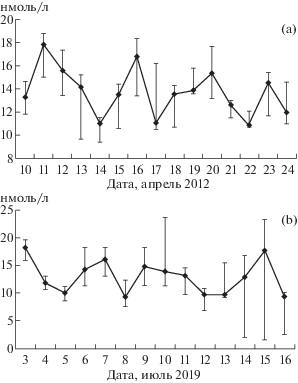
Изучение многодневной динамики концентрации тестостерона у японских перепелов в период с 3 по 16 июля также выявило 4-суточный ритм. Максимальные значения зарегистрированы 3, 6–7, 10, 14–15 июля (рис. 3b). Коэффициент автокорреляции между исходным рядом и рядом, сдвинутым на 1 сут, составил r = –0.16 (p = 0.60); на 2 сут – r = –0.36 (p = 0.26); на 3 сут – r = –0.18 (p = 0.59) и на 4 сут – r = 0.39 (p = 0.25). Применение метода наложенных эпох выявило, что показатели в акрофазе (3, 7, 11, 15 июля) и батифазе (5, 9 и 13 июля) составляли соответственно 16.3 (12.6; 18.5) и 9.6 (7.5; 11.9) нмоль/л и статистически значимо различались (р = 0.02). Таким образом, у двух видов птиц нами зарегистрирован 4-суточный ритм в динамике концентрации тестостерона, период которого совпадает с аналогичным биоритмом у млекопитающих.
Таким образом, выявленные закономерности внутрисуточной динамики и инфрадианных ритмов концентрации тестостерона у птиц совпадают с таковыми у млекопитающих, эволюционно разошедшихся с классом птиц около 310 млн лет назад [27]. Следовательно, механизмы формирования и синхронизации биоритмов разных диапазонов у этих классов животных сходны и сформировались в процессе эволюции значительно раньше.
Список литературы
Dunlap J.C. Molecular bases for circadian clocks. Cell. 96: 271–290. 1999. https://doi.org/10.1016/s0092-8674(00)80566-8
Kondratov R.V., Antoch M.P. Circadian proteins in the regulation of cell cycle and genotoxic stress responses. TRENDS Cell Biology. 17 (7): 311–316. 2007. https://doi.org/10.1016/j.tcb.2007.07.001
Halberg F., Cornelissen G., Wang Z., Wan C., Ulmer W., Katinas G., Singh R., Singh R.K., Singh R.K., Gupta B.D., Singh R.B., Kumar A., Kanabrocki E., Sothern R.B., Rao G., Bhatt M.L., Srivastava M., Rai G., Singh S., Pati A.K., Nath P., Halberg F., Halberg J., Schwartzkopff O., Bakken E., Shastri S.V.K. Chronomics: circadian and circaseptan timing of radiotherapy, drugs, calories, perhaps nutriceuticals and beyond. J. Exp. Ther. Oncol. 3 (5): 223–260. 2003. https://doi.org/10.1111/j.1533-869x.2003.01097.x
Guan J., You C., Liu Y., Liu Y., Zhang R., Wang Z. Characteristics of infradian and circadian rhythms in the persistent vegetative state. J. Int. Med. Res. 39 (6): 2281–2287. 2011. https://doi.org/10.1177/147323001103900625
Bittman E.L. Timing in the Testis. J. Biol. Rhythms. 31 (1): 12–36. 2016. https://doi.org/10.1177/0748730415618297
Blessihg W., Ootsuka Y. Timing of activities of daily life is jaggy: How episodic ultradian changes in body and braintemperature are integrated into this process. Temperature (Austin). 3 (3): 371–383. 2016. https://doi.org/10.1080/23328940.2016.1177159
Bourguignon C., Storch K.F. Control of rest:activity by a dopaminergic ultradian oscillator and the circadian clock. Front Neurol. 8 (614). 2017. https://doi.org/10.3389/fneur.2017.00614
Blum I.D., Zhu L., Moquin L., Kokoeva M.V., Gratton A., Giros B., Storch K.F. A highly tunable dopaminergic oscillator generates ultradian rhythms of behavioral arousal. Elife. 3. 2014. https://doi.org/10.7554/eLife.05105
Prendergast B.J., Cisse Y.M., Cable E.J., Zucker I. Dissociation of ultradian and circadian phenotypes in female and male Siberian hamsters. J. Biol. Rhythms. 27 (4): 287–298. 2012. https://doi.org/10.1177/0748730412448618
Waite E.J., McKenna M., Kershaw Y., Walker J.J., Cho K., Piggins H.D., Lighman S.L. Ultradian corticosterone secretion is maintained in the absence of circadian cues. Eur. J. Neurosci. 36 (8): 142–150. 2012. https://doi.org/10.1111/j.1460-9568.2012.08213.x
Диатроптов М.Е., Симонова Е.Ю., Макарова О.В. Закономерности проявления 4-суточного биоритма митотической активности эпителия пищевода у крыс Вистар при содержании их в условиях постоянного освещения или световой депривации. Клин. эксп. морфология. 3 (11): 27–35. 2014. [Diatrop-tov M.E.,Simonova E.Y., Makarova O.V. Patterns of manifestation of a 4-day biorhythm of mitotic activity of the epithelium of the esophagus in Wistar rats when kept under constant lighting or light deprivation. Clin. Exp. Morphology. 3 (11): 27–35. 2014. (In Russ.)].
Focan C., Cornélissen G., Halberg F. Chronometaanalysis: circasemiseptan (3.5-day) pattern in mitotic activity of murine sarcoma after treatment with cyclophosphamide. In Vivo. 9 (4), 401–406. 1995.
Delyukov A., Gorgo Y., Cornelissen G., Otsuka K. Infradian, notably circaseptan testable feedsidewards among chronomes of the ECG and air temperature and pressure. Biomed. Pharmacother. 55 (Suppl 1): 84–89. 2001. https://doi.org/10.1016/s0753-3322(01)90009-5
Maschke C., Harder J., Cornelissen G., Hecht K., Otsuka K., Halberg F. Chronoecoepidemiology of “strain”: infradian chronomics of urinary cortisol and catecholamines during nightly exposure to noise. Biomed. Pharmacother. 57: 126–135. 2003. https://doi.org/10.1016/j.biopha.2003.08.021
Jozsa R., Olah A., Cornelissen G., Csernus V., Otsuka K., Zeman M., Nagy G., Kaszaki J., Stebelova K., Csokas N., Pan W., Herold M., Bakken E.E., Halberg F. Circadian and extracircadian exploration during daytime hours of circulating corticosterone and other endocrine chronomes. Biomed. Pharmacother. 59: 109–116. 2005. https://doi.org/10.1016/s0753-3322(05)80018-6
Birukov A., Rakova N., Lerchl K., Engberink R.H., Johannes B., Wabel P., Moissl U., Rauh M., Luft F.C., Titze J. Ultra-long-term human salt balance studies reveal interrelations between sodium, potassium, and chloride intake and excretion. Am. J. Clin. Nutr. 104 (1): 49–57. 2016. https://doi.org/10.3945/ajcn.116.132951
Stankevich A.A., Dzhalilova D.Sh., Diatroptov M.E. A 12.175-Day periodicity in heliogeophysical, atmospheric, and biological processes. Biophysics. 63 (2): 152–161. 2018. https://doi.org/10.1134/S0006350918020215
Mock E.J., Nortonm H.W., Frankel A.I. Daily rhythmicity of serum testosterone concentration in the male laboratory rat. Endocrinology. 103 (4): 1111–1121. 1978. https://doi.org/10.1210/endo-103-4-1111
Jilge B., Stahle H. The internal synchronization of five circadian functions of the rabbit. Chronobiol. Int. 1 (3): 195–204. 1984. https://doi.org/10.3109/07420528409063896
Диатроптов М.Е. Влияние режима освещения на ультрадианный ритм уровня тестостерона в сыворотке крови кроликов-самцов. Геофизические процессы и биосфера. 12 (1): 62–69. 2013. [Diatrop-tov M.E. The influence of the lighting mode on the ultradian rhythm of testosterone level in the serum of male rabbits. Geophysical Processes and Biosphere. 12 (1): 62–69. 2013. (In Russ.)].
Пронина Т.С. Циркадные и инфрадианные ритмы экскреции тестостерона и альдостерона у детей. Проблемы эндокринологии. 38 (5): 38–42. 1992. [Pronina T.S. Circadian and infradian rhythms of testosterone and aldosterone excretion in children. Probl. Endokrinol. (Mosk.). 38 (5): 38–42. 1992. (In Russ.)]
Diatroptov M.E. Infradian fluctuations in serum testosterone levels in male laboratory rats. Bull. Exp. Biol. Med. 151 (5): 638–641. 2011. https://doi.org/10.1007/s10517-011-1403-z
Diatroptov M.E., Makarova O.V. Infradian biorhythms of mitotic activity esophageal epithelium in male Wistar rats. Bull. Exp. Biol. Med. 158 (3): 380–384. 2015. https://doi.org/10.1007/s10517-015-2767-2
Descherevsky A.V., Lucc A.A. Isolation of regular components in temporal variations of geophysical parameters by decomposition into non-harmonic components. Volcanology and Seismology. (5): 65–78. 2002. https://doi.org/10.1134/S0001433817080035
Горго Ю.П., Дидык Л.А. Биологическая активность и значимость сверхнизкочастотных колебаний атмосферного давления // в кн. Биотропное воздействие космической погоды. СПб: Изд. ВВМ. 2010. С. 259–289. [Gorgo Y.P., Didyk L.A., in Biotropic Effects of Space Weather (VVM, Moscow, 2010) (In Russ.)].
Didyk L.A., Bogdanov V.B., Lysenko V.A., Didyk N.P., Gorgo Y.P., Dirckx J.J. The effects of slight pressure oscillations in the far infrasound frequency range on the pars flaccida in gerbil and rabbit ears. Int. J. Biometeorol. 51 (3): 221–231. 2007. https://doi.org/10.1007/s00484-006-0051-x
Kumar S., Hedges S.B.A molecular timescale for vertebrate evolution. Nature. 392 (6679): 917–920. 1998. https://doi.org/10.1038/31927
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


