Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 380-390
ОСОБЕННОСТИ СТИМУЛЯЦИИ СТЕРОИДОГЕНЕЗА В СЕМЕННИКАХ ОРТОСТЕРИЧЕСКИМИ И АЛЛОСТЕРИЧЕСКИМИ АГОНИСТАМИ РЕЦЕПТОРА ЛЮТЕИНИЗИРУЮЩЕГО ГОРМОНА
А. А. Бахтюков 1, К. В. Деркач 1, Д. В. Дарьин 2, В. Н. Сорокоумов 2, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 28.01.20
После доработки 13.03.20
Принята к публикации 23.03.20
Аннотация
Лютеинизирующий гормон (ЛГ) и хорионический гонадотропин человека (ХГЧ), связываясь с рецептором ЛГ/ХГЧ, активируют аденилатциклазную систему, регулирующую продукцию тестостерона (Т). Длительное введение ЛГ и ХГЧ вызывает десенситизацию этой системы и ослабляет стероидогенный ответ, вследствие чего ведется поиск новых агонистов рецептора ЛГ/ХГЧ. Целью работы было изучить в сравнении с ХГЧ стимулирующие эффекты ранее разработанных тиено-[2,3-d]пиримидинов TP03 и TP04 и нового производного 5-амино-N-(трет-бутил)-4-(3-(4-аминопиримидин-5-карбоксамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамида (TP37) на активность аденилатциклазы (АЦ) в тестикулярных мембранах крыс, на продукцию Т и экспрессию генов рецептора ЛГ/ХГЧ и ключевых стероидогенных белков в семенниках при однократном и трехдневном введении самцам крыс. ХГЧ повышал активность АЦ в тестикулярных мембранах более эффективно, чем тиено-[2,3-d]пиримидины, а при однократном введении (50 и 100 МЕ/крысу) превосходил TP03 и TP04 (15–50 мг/кг) по стероидогенному эффекту. При трехдневном введении стероидогенный эффект ХГЧ был снижен в сравнении с TP03 и TP04. Через три дня обработки гонадотропином в семенниках была значительно повышена экспрессия генов, кодирующих StAR-белок и цитохром Р450scc, но подавлена экспрессия генов Lhr и Cyp17a1, кодирующих рецептор ЛГ/ХГЧ и цитохром Р450-17α. TP03 и TP04 в небольшой степени повышали экспрессию гена StAR-белка, но слабо влияли на экспрессию других генов. Активное in vitro соединение TP37 после непродолжительной стимуляции продукции Т, в дозе 50 мг/кг подавляло стероидогенную функцию, что, вероятно, обусловлено его деградацией и способностью подавлять экспрессию гена Cyp17a1. Полученные данные указывают на значимые различия механизмов действия гонадотропинов и тиено-[2,3-d]пиримидинов с активностью агонистов рецептора ЛГ/ХГЧ на тестикулярный стероидогенез, а также на то, что длительное применение тиено-[2,3-d]пиримидинов для стимуляции продукции Т не приводит к ослаблению стероидогенеза и не вызывает резистентности к ЛГ.
ВВЕДЕНИЕ
Основными регуляторами репродуктивной системы являются гонадотропины – лютеинизирующий гормон (ЛГ) и его гомолог – хорионический гонадотропин человека (ХГЧ), которые через посредство рецептора ЛГ/ХГЧ стимулируют продукцию половых стероидных гормонов в клетках Лейдига семенников и в фолликулярных клетках яичников. Рецептор ЛГ/ХГЧ относится к семейству сопряженных с G-белками рецепторов, семь раз пронизывающих плазматическую мембрану. При связывании с гонадотропинами он переходит в активированное состояние, результатом чего является стимуляция различных типов ГТФ-связывающих белков – Gs-белков, опосредующих активацию аденилатциклазы (АЦ), катализирующей образование цАМФ, и Gq/11-белков, опосредующих активацию фосфолипазы Сβ, катализирующей образование инозитол-1,4,5-трифосфата и диацилглицерина. При активации фосфоинозитидного пути повышается активность форбол-чувствительных изоформ протеинкиназы С, возрастает уровень внутриклеточного Ca2+ и активируются кальций-зависимые пути [1–3]. Длительная активация рецептора ЛГ/ХГЧ приводит к запуску β-аррестиновых каскадов, вызывающих как стимуляцию каскада митогенактивируемых протеинкиназ, так и интернализацию лиганд-рецепторных комплексов внутрь клетки, где они либо подвергаются деградации в протеасомах, либо после диссоциации транслоцируются в плазматическую мембрану [3, 4].
Низкая специфичность ЛГ и ХГЧ в отношении внутриклеточных сигнальных каскадов и вызываемая ими гиперактивация рецептора ЛГ/ХГЧ могут стать причинами побочных эффектов и развития резистентности к гонадотропинам [5–7]. Вследствие этого на протяжении последних лет ведется поиск новых, селективных в отношении эффекторных белков агонистов рецептора ЛГ/ХГЧ с умеренной активностью, не вызывающих резистентности к гонадотропинам. Наибольший интерес среди них представляют низкомолекулярные агонисты – производные тиено-[2,3-d]пиримидина [8, 9]. Первое тиено-[2,3-d]пиримидиновое производное с активностью агониста рецептора ЛГ/ХГЧ, соединение Org 43553, было разработано в 2002 г. и в дальнейшем показало специфическую активность в условиях in vitro и in vivo [10–12]. В отличие от гонадотропинов, которые связываются с высокоаффинным ортостерическим сайтом, расположенным во внеклеточном домене рецептора ЛГ/ХГЧ, тиено-[2,3-d]пиримидины проникают в его трансмембранный канал и связываются с расположенным там аллостерическим сайтом. Вследствие этого гонадотропины относят к ортостерическим агонистам, в то время как производные тиено-[2,3-d]пиримидина – к аллостерическим агонистам.
Нами ранее была синтезирована серия различающихся по структуре производных тиено-[2,3-d]пиримидина, наделенных активностью аллостерических агонистов рецептора ЛГ/ХГЧ [13–16]. Одно из них, 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид (соединение TP03), при инкубации с плазматическими мембранами, выделенными из семенников крыс, повышало в них активность АЦ, ответственной за стимуляцию тестикулярного стероидогенеза, при инкубации с клетками Лейдига усиливало продукцию тестостерона (Т), а при пероральном и внутрибрюшинном введении самцам крыс повышало у них уровень Т в крови и меняло экспрессию стероидогенных генов в семенниках, в том числе в условиях сахарного диабета [14–17]. Стимулирующее влияние TP03 на активность АЦ и стероидогенез было выражено слабее в сравнении с таковым ХГЧ, но при этом являлось более специфичным в отношении аденилатциклазной системы и относительно слабо влияло на экспрессию рецептора ЛГ/ХГЧ в семенниках, обеспечивая сохранение чувствительности к эндогенным гонадотропинам. При введении TP03 и ХГЧ самцам крыс были выявлены различия в их влиянии на экспрессию стероидогенных генов [17]. Однако вопрос о том, являются ли различия в исследуемых эффектах характерными для всех производных тиено-[2,3-d]пиримидинов или выявляются только в случае TP03, а также о том, как продолжительность воздействия влияет на эти эффекты, остается открытым. Не исследовано также то, как соотносится величина стимулирующего эффекта тиено-[2,3-d]пиримидинов на активность АЦ в условиях in vitro и на продукцию Т in vivo с их влиянием на интратестикулярную экспрессию генов, кодирующих рецептор ЛГ/ХГЧ и стероидогенные белки.
Цель работы состояла в сравнительном изучении стимулирующего влияния ХГЧ и производных тиено-[2,3-d]пиримидина на активность АЦ в тестикулярных мембранах, на продукцию Т и экспрессию генов рецептора ЛГ/ХГЧ и ключевых стероидогенных белков в семенниках самцов крыс при однократном и трехдневном их введении. Наряду с соединениями TP03 и структурно близким ему 5-амино-N-(трет-бутил)-4-(3-(1-метил-1Н-пиразол-4-карбоксамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамидом (TP04), было изучено впервые синтезированное нами соединение 5-амино-N-(трет-бутил)-4-(3-(4-аминопиримидин-5-карбоксамидо)фенил)-2-(метилтио)тиено[2,3-d]пиримидин-6-карбоксамид (TP37).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Для экспериментов использовали трехмесячных самцов крыс линии Wistar, которых содержали на стандартном рационе со свободным доступом к пище и воде. Все процедуры проводили в соответствии с правилами, разработанными и утвержденными Комитетом по биоэтике ИЭФБ РАН (15.02.2018 г.), правилами и требованиями, изложенными в документах “European Communities Council Directive 1986” (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
В экспериментах использовали креатинфосфат, креатинфосфокиназу из мышц кролика, цАМФ, АТФ производства фирмы “Sigma” (США), ХГЧ производства Московского эндокринологического завода (Россия), [α-32P]АТФ (150 ГБк/ммоль) производства “Изотоп” (Россия). Синтез тиено-[2,3-d]пиримидинов – соединений TP03, TP04 и TP37, осуществляли путем ацилирования 5-амино-4-(3-аминофенил)-N-трет-бутил-2-(метилсульфанил)тиено[2,3-d]пиримидин-6-карбоксамида, что обеспечивало включение в целевую молекулу варьируемого функционального заместителя. Реакцию проводили в N,N-диметилформамиде с добавками HATU и N,N-диизопропилэтиламина. Структуру синтезированных производных тиено-[2,3-d]пиримидина подтверждали с помощью протонной ЯМР-спектроскопии (спектрометр Bruker Avance III 400, “Bruker”, Германия) и масс-спектрометрии (electrospray ionization – time of flight, ESI-TOF, спектрометр micrOTOF, “Bruker”, Германия). Все используемые в ходе синтеза реагенты были получены из фирмы “Sigma» (США).
В экспериментах in vivo производные тиено-[2,3-d]пиримидина растворяли в диметилсульфоксиде (ДМСО) и вводили самцам крыс внутрибрюшинно, однократно, в дозах 15, 25 и 50 мг/кг или в течение трех дней в суточных дозах 25 и 50 мг/кг. В каждой экспериментальной группе было по шесть животных. ХГЧ вводили подкожно в дозах 50 и 100 МЕ/крысу однократно или в течение трех дней. Инъекции проводили в 11.00. Контрольным животным вместо препаратов вводили ДМСО в те же сроки и в том же объеме. Согласно ранее полученным данным, введение ДМСО не влияет на стероидогенез у самцов крыс [14]. При однократном введении уровень Т оценивали до (10.00) и через 1, 3 и 5 ч (12.00, 14.00, 16.00) после введения препаратов, при введении в течение трех дней – до начала обработки и ежедневно через 3 ч после введения препаратов. Кровь для определения Т получали из хвостовой вены, используя местный наркоз с помощью анестезии 2%-ным лидокаином (2–4 мг/кг). Уровень Т определяли в нмоль/л с помощью наборов “Тестостерон-ИФА” (“Алкор-Био”, Россия), используя спектрофотометр Anthos Absorbance Reader 2020 (“Anthos Labtec Instruments”, Австрия).
Активность АЦ в плазматических мембранах, выделяемых из семенников интактных крыс, определяли как описано ранее [13]. Образцы тканей семенников промывали 40 мМ Tris-HCl-буфером (pH 7.4), содержащим 5 мМ MgCl2, 10% сахарозу и ингибиторы протеаз (4°C), измельчали, гомогенизировали в 10 объемах того же буфера, гомогенат центрифугировали (1500 g, 10 мин), полученный супернатант отделяли и повторно центрифугировали (20 000 g, 30 мин), осажденные мембраны ресуспендировали в буфере без сахарозы и использовали для определения активности АЦ. Для этого образцы мембран (50–100 мкг белка) инкубировали (37°С, 12 мин) в смеси, содержащей 50 мМ Tris-HCl (pH 7.5), 5 мМ MgCl2, 0.1 мМ цАМФ, 1 мМ АТФ, 37 КБк [α-32P]-АТФ, 20 мМ креатинфосфата, 0.2 мг/мл креатинфосфокиназы. Активность АЦ оценивали по количеству цАМФ, генерируемого в ходе ферментативной реакции, и выражали в пмоль цАМФ/мин/мг белка. Тиено-[2,3-d]пиримидины растворяли в ДМСО, в контрольные пробы добавляли растворитель без исследуемых соединений, рассматривая активность фермента в них как базальную.
Для изучения содержания мРНК в семенниках крыс использовали ПЦР в реальном времени как описано ранее [18], для чего с помощью реагента ExtractRNA (“Евроген”, Россия) из тестикулярной ткани выделяли тотальную РНК. Обратную транс-крипцию осуществляли с помощью набора MMLV RT Kit (“Евроген”, Россия). Количественную оценку экспрессии генов проводили с помощью амплификатора 7500 Real-Time PCR System (“Thermo Fisher Scientific Inc.”, США). Использовали следующие праймеры: Lhr (рецептор ЛГ/ХГЧ) – CTGCGCTGTCCTGGCC (For) и CGACCTCATTAAGTCCCCTGAA (Rev); Star (StAR-белок) – AAGGCTGGAAGAAGGAAAGC (For) и CACCTGGCACCACCTTACTT (Rev); Cyp11a1 (цитохром Р450scc) – TATTCCGCTTTGCCTTTGAG (For) и CACGATCTCCTCCAACATCC (Rev); Cyp17a1 (цитохром Р450-17α) – CATCCCCCACAAGGCTAAC (For) и TGTGTCCTTGGGGACAGTAAA (Rev). В качестве референсных генов использовали гены β-актина (Actb) – CTGGCACCACACCTTCTACA (For) и AGGTCTCAAACATGATCTGGGT (Rev), и глицеральдегидфосфатдегидрогеназы (Gapdh) – GTGTTCCTACCCCCAATGTATCC (For) и GATGTCATCATACTTGGCAGGTTT (Rev). Результаты анализировали с помощью порогового метода ΔΔСt и программного обеспечения 7500 Software v2.0.6 и Expression Suite Software v1.0.3, значения RQ рассчитывали по отношению к контролю.
Статистический анализ экспериментальных данных проводили с помощью программы “Microsoft Office Excel 2007”. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при уровне значимости p < 0.05. Данные представляли как M ± SEM.
РЕЗУЛЬТАТЫ
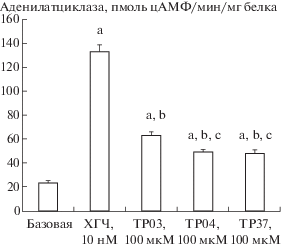
Базальная активность АЦ в тестикулярных мембранах составила 24.3 ± 1.1 пмоль цАМФ/мин/мг белка. ХГЧ (10–8 М) и исследуемые производные тиено-[2,3-d]пиримидина (10–4 М) достоверно ее повышали, причем стимулирующий АЦ эффект TP03 превосходил таковые TP04 и TP37, и все эффекты тиено-[2,3-d]пиримидинов в значительной степени уступали стимулирующему АЦ эффекту ХГЧ (рис. 1). Эти результаты указывают на способность исследуемых тиено-[2,3-d]пиримидинов, подобно гонадотропинам, стимулировать активность аденилатциклазной сигнальной системы в семенниках, ответственной за регуляцию стероидогенеза в клетках Лейдига.
Рис. 1.
Стимулирующий эффект ХГЧ и производных тиено-[2,3-d]пиримидина на базальную активность АЦ в тестикулярных мембранах крыс. ХГЧ взят в концентрации 10–8 М, TP03, TP04 и TP37 – в концентрации 10–4 М. a – различия по сравнению с базальной активностью АЦ статистически значимы при p < 0.05; b – различия по сравнению с ХГЧ-стимулированной активностью статистически значимы при p < 0.05; с – различия между активностью АЦ, стимулированной TP03, и активностью фермента, стимулированной TP04 или TP37, статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 6.
Fig. 1. Stimulatory effect of hCG and thieno[2,3-d]pyrimidine derivatives on basal AC activity in rat testicular membranes. hCG is taken at a concentration of 10–8 M, TP03, TP04 and TP37 at a concentration of 10–4 M. a – the differences versus basal AC activity are statistically significant at p < 0.05; b – differences versus hCG-stimulated activity are statistically significant at p < 0.05; с – differences between TP03-stimulated AC activity and TP04- or TP37-stimulated activity are statistically significant at p < 0.05. Values presented as M ± SEM, n = 6.
Через 1–5 ч после однократного введения самцам крыс соединений TP03 и TP04 в дозах 15–50 мг/кг уровень Т в крови достоверно повышался (табл. 1). Стероидогенные эффекты TP03 и TP04 были дозо-зависимыми, причем в дозах 25 и 50 мг/кг они достигали максимума через 3 ч, а затем начинали снижаться. Эффект TP03 был более выражен в сравнении с таковым TP04 (табл. 1). Однако статистически значимые различия выявлялись только при использовании низкой дозы тиено-[2,3-d]пиримидинов – 15 мг/кг, на что указывает статистически значимое различие между значениями AUC12.00–16.00 для этих групп животных (p < 0.05). Стероидогенные эффекты ХГЧ были выражены в большей степени, чем таковые TP03 и TP04. Так, различия между эффектами ХГЧ и обоих тиено-[2,3-d]пиримидинов были статистически значимыми, за исключением групп животных, обработанных 50 МЕ/крысу ХГЧ и 50 мг/кг TP03, что иллюстрируют значения AUC12.00–16.00 (табл. 1). Динамика изменения уровня Т при обработке крыс соединением TP37 существенно отличалась от таковой для TP03 и TP04. После повышения через 1 ч после введения, в дальнейшем концентрация Т снижалась до контрольных значений (табл. 1). Эти данные демонстрируют, что TP03 и TP04, подобно ХГЧ, обладают выраженным стероидогенным эффектом при действии на семенники крыс, в то время как TP37 в этом отношении не эффективно.
Таблица 1.
Уровни тестостерона до и после однократного введения ХГЧ в двух дозах (50 и 100 МЕ/крысу, подкожно) и производных тиено-[2,3-d]пиримидина в трех дозах (15, 25 и 50 мг/кг, внутрибрюшинно) самцам крыс Table 1. Testosterone levels before and after a single injection of hCG at two doses (50 and 100 IU/rat, SC) and thieno[2,3-d]pyrimidine derivatives at three doses (15, 25 and 50 mg/kg, IP) to male rats
| До введения/Before treatment, 10.00 | Через 1 ч/ After 1 h, 12.00 | Через 3 ч/ After 3 h, 14.00 | Через 5 ч/ After 5 h, 16.00 | AUC12.00–16.00, усл. ед./arb. units | |
|---|---|---|---|---|---|
| Контроль/control | 16.2 ± 2.4 | 16.7 ± 2.5 | 13.1 ± 2.2 | 15.4 ± 4.3 | 58.3 ± 7.8 |
| ХГЧ, 50МЕ/крысу/hCG, 50 IU/rat | 14.2 ± 2.2 | 58.2 ± 7.4a | 115.7 ± 12.2a | 89.9 ± 9.1a | 379.6 ± 31.1b |
| ХГЧ, 100 МЕ/крысу/hCG, 100 IU/rat | 18.9 ± 1.3 | 71.2 ± 8.3a | 153.5 ± 17.9a | 110.3 ± 11.6a | 488.5 ± 44.1b |
| TP03, 15 мг/кг/TP03, 15 mg/kg | 14.1 ± 2.7 | 36.6 ± 2.5a | 65.2 ± 2.6a | 63.2 ± 1.1a | 230.3 ± 6.4b,c,d |
| TP03, 25 мг/кг/TP03, 25 mg/kg | 12.7 ± 2.3 | 35.6 ± 3.4a | 87.1 ± 4.2a | 65.9 ± 1.2a | 275.7 ± 7.0b,c,d |
| TP03, 50 мг/кг/TP03, 50 mg/kg | 11.0 ± 1.4 | 38.9 ± 2.7a | 106.2 ± 6.3a | 77.0 ± 5.5a | 328.4 ± 11.6b,d |
| TP04, 15 мг/кг/TP04, 15 mg/kg | 15.1 ± 2.8 | 18.3 ± 2.4 | 40.3 ± 2.2a | 46.5 ± 6.2a | 145.4 ± 7.2b,c,d |
| TP04, 25 мг/кг/TP04, 25 mg/kg | 17.0 ± 4.1 | 35.0 ± 5.8 | 75.6 ± 5.5a | 60.4 ± 7.0a | 246.5 ± 16.1b,c,d |
| TP04, 50 мг/кг/TP04, 50 mg/kg | 14.1 ± 3.1 | 34.1 ± 7.4 | 84.0 ± 9.3a | 63.6 ± 8.1a | 265.6 ± 25.2b,c,d |
| TP37, 15 мг/кг/TP37, 15 mg/kg | 17.7 ± 4.3 | 35.2 ± 2.9a | 14.5 ± 1.9 | 12.3 ± 1.6 | 76.6 ± 6.2c,d |
| TP37, 25 мг/кг/TP37, 25 mg/kg | 20.2 ± 1.6 | 39.9 ± 3.5a | 17.6 ± 3.5 | 16.2 ± 4.1 | 91.2 ± 13.8c,d |
| TP37, 50 мг/кг/TP37, 50 mg/kg | 14.7 ± 2.6 | 32.0 ± 3.9a | 14.9 ± 1.7 | 11.2 ± 1.8 | 73.1 ± 6.1c,d |
Примечание. Все препараты вводили в 11.00. a – различия по сравнению с начальным базовым уровнем Т статистически значимы при p < 0.05; b – различия значений AUC12.00–16.00 по сравнению с контролем статистически значимы при p < 0.05; c,d – различия значений AUC12.00–16.00 по сравнению с группами, обработанными ХГЧ в дозах 50 и 100 МЕ/крысу, соответственно, статистически значимы при p < 0.05. Значения представлены как M ± SEM, n=6.
Note. All drugs were injected at 11.00. a – differences versus the baseline T are statistically significant at p < 0.05; b – differences in AUC12.00–16.00 values versus control are statistically significant at p < 0.05; c,d – differences in AUC12.00-16.00 values versus the groups treated with hCG at doses of 50 and 100 IU/rat, respectively, are statistically significant at p < 0.05. Values presented as M ± SEM, n = 6.
Поскольку при продолжительном введении стероидогенные эффекты гонадотропинов с ЛГ-активностью ослабляются, нами было изучено влияние трехдневного введения тиено-[2,3-d]пиримидинов и ХГЧ на уровни Т в крови крыс, а также на экспрессию генов рецептора ЛГ/ХГЧ и стероидогенных белков в семенниках. Стимулирующий эффект ХГЧ на продукцию Т снижался во второй и третий дни его введения (табл. 2). Так, прирост уровня Т во второй и третий дни введения ХГЧ в дозе 100 МЕ/крысу составил 71 и 34% от такового в первый день обработки (табл. 2). В отличие от ХГЧ, динамика изменения стероидогенного эффекта TP03 и TP04 была иной – этот эффект возрастал с первого по третий дни обработки. Более того, в третий день стероидогенные эффекты TP03 и TP04 были сходными и не зависели от дозы (табл. 2). Если в первый день они уступали таковому ХГЧ, то в третий день, напротив, его превышали. Так, в третий день стимулирующие эффекты TP03 и TP04 (50 мг/кг) на продукцию Т были на 213 и 189% выше, чем соответствующие эффекты ХГЧ (100 МЕ/крысу). Значения AUC1-3 показывают, что продукция Т в группах крыс, которых в течение 3 дней обрабатывали TP03 и TP04, не различается, но превышает таковую в группе крыс с обработкой 50 МЕ/крысу ХГЧ. В случае использования TP03 (50 мг/кг) отмечали более высокую продукцию Т, чем при использовании ХГЧ (100 МЕ/крысу) (табл. 2). Обработка крыс TP37 не только не повышала уровень Т, но в третий день после введения препарата в дозе 50 мг/кг даже вызывала его снижение в сравнении с контролем (табл. 2).
Таблица 2.
Динамика изменения уровней тестостерона при трехдневном введении ХГЧ в суточных дозах 50 и 100 МЕ/крысу (подкожно) и тиено-[2,3-d]пиримидиновых производных в суточных дозах 25 и 50 мг/кг (внутрибрюшинно) самцам крыс. Table 2. Dynamics of testosterone levels during a 3-day administration of hCG at daily doses of 50 and 100 IU/rat (SC) and thieno[2,3-d]pyrimidine derivatives at daily doses of 25 and 50 mg/kg (IP) to male rats.
| 0-й день/day 0 | 1-й день/day 1 | 2-й день/day 2 | 3-й день/day 3 | AUC1–3, усл. ед./ arb. units | |
|---|---|---|---|---|---|
| Контроль/Control | 13.7 ± 2.6 | 12.8 ± 2.6 | 12.0 ± 2.8 | 14.4 ± 4.4 | 25.6 ± 4.7 |
| ХГЧ, 50 МЕ/крысу/hCG, 50 IU/rat | 8.9 ± 1.9 | 108.9 ± 18.6a | 87.3 ± 14.6a | 68.4 ± 13.3a | 176.0 ± 7.1b |
| ХГЧ, 100 МЕ/крысу/hCG, 100 IU/rat | 16.7 ± 4.2 | 150.2 ± 25.8a | 109.4 ± 22.0a | 60.6 ± 10.0a | 214.8 ± 11.2b |
| TP03, 25 мг/кг/TP03, 25 mg/kg | 13.9 ± 2.9 | 89.9 ± 14.7a | 146.3 ± 26.0a | 158.0 ± 27.2 a | 270.2 ± 20.5b,c |
| TP03, 50 мг/кг/TP03, 50 mg/kg | 11.2 ± 2.3 | 102.4 ± 19.4a | 145.3 ± 24.7a | 159.3 ± 24.9 a | 276.1 ± 10.6b,c,d |
| TP04, 25 мг/кг/TP04, 25 mg/kg | 15.2 ± 3.0 | 67.3 ± 10.9a | 129.6 ± 21.4a | 152.6 ± 28.6a | 239.5 ± 17.1b,c |
| TP04, 50 мг/кг/TP04, 50 mg/kg | 11.5 ± 2.0 | 77.6 ± 14.6a | 140.3 ± 25.7a | 148.1 ± 25.5a | 253.1 ± 18.5b,c |
| TP37, 25 мг/кг/TP37, 25 mg/kg | 16.5 ± 2.6 | 20.8 ± 3.8 | 18.2 ± 4.2 | 12.8 ± 3.2 | 35.0 ± 2.6c,d |
| TP37, 50 мг/кг/TP37, 50 mg/kg | 14.1 ± 3.3 | 16.3 ± 3.3 | 16.5 ± 3.1 | 5.9 ± 0.5a | 27.6 ± 2.8c,d |
Примечание. Препараты вводили в 11.00, уровни Т оценивали через 3 ч (в 14.00). a – различия по сравнению с уровнем Т до начала обработки (0-й день) статистически значимы при p < 0.05; b – различия по сравнению с AUC1–3 в контрольной группе статистически значимы при p < 0.05; c,d – различия значений AUC12.00–16.00 по сравнению с группами, обработанными ХГЧ в дозах 50 и 100 МЕ/крысу, соответственно, статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 6.
Note. All drugs were injected at 11.00; T levels were evaluated after 3 h (at 14.00). a – differences versus the T level before treatment (day 0) are statistically significant at p < 0.05; b – differences versus AUC1–3 values in the control group are statistically significant at p < 0.05; c,d – differences in AUC12.00−16.00 values versus groups treated with hCG at doses of 50 and 100 IU/rat, respectively, are statistically significant at p < 0.05. Values presented as M ± SEM, n = 6.
Таким образом, при трехдневном введении стероидогенные эффекты ХГЧ снижались, соответствующие эффекты TP03 и TP04 усиливались, в то время как TP37 заметного влияния на уровень Т не оказывал, действуя в высокой дозе, как ингибитор стероидогенеза. Через три дня введения ХГЧ в дозах 50 и 100 МЕ/крысу экспрессия гена Lhr, кодирующего рецептор ЛГ/ХГЧ, в семенниках крыс в значительной степени подавлялась (рис. 2). Трехдневная обработка с помощью TP03 и TP37 (25 мг/кг) слабо влияла на экспрессию гена Lhr, в то время как TP04 ее снижала, хотя и в меньшей степени в сравнении с гонадотропином. Это указывает на значительное ослабление чувствительности семенников к агонистам рецептора ЛГ/ХГЧ при обработке животных ХГЧ и на ее сохранение (TP03 и TP37) или умеренное снижение (TP04) при их обработке тиено-[2,3-d]пиримидинами.
Рис. 2.
Влияние трехдневного введения ХГЧ и производных тиено-[2,3-d]пиримидина самцам крыс на экспрессию в семенниках генов, кодирующих рецептор ЛГ/ХГЧ и стероидогенные белки.
Fig. 2. Effect of a 3-day administration of hCG and thieno[2,3-d]pyrimidine derivatives to male rats on testicular expression genes encoding LH/hCG receptor and steroidogenic proteins.
1 – контроль; 2 – ХГЧ, 50 МЕ/крысу; 3 – ХГЧ, 100 МЕ/крысу; 4 – TP03, 25 мг/кг; 5 – TP04, 25 мг/кг; 6 – TP37, 25 мг/кг. a – различия по сравнению с контрольной группой статистически значимы при p < 0.05; b, c – различия по сравнению с группами, обработанными ХГЧ в дозах 50 или 100 МЕ/крысу, соответственно, статистически значимы при p < 0.05; d – различия между группами, обработанными TP03 и TP37, статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 6.
1 – control; 2 – hCG, 50 IU/rat; 3 – hCG, 100 IU/rat; 4 – TP03, 25 mg/kg; 5 – TP04, 25 mg/kg; 6 – TP37, 25 mg/kg. a – differences versus the control group are statistically significant at p < 0.05; b, c – differences versus the groups treated with hCG at doses of 50 or 100 IU/rat, respectively, are statistically significant at p < 0.05; d – differences between the groups treated with TP03 and TP37 are statistically significant at p < 0.05. Values presented as M ± SEM, n = 6.
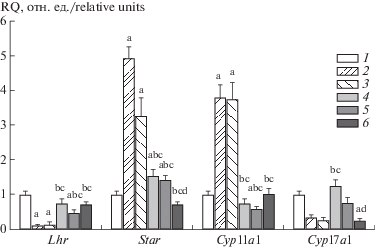
Показано, что ХГЧ, TP03 и TP04 достоверно повышают экспрессию гена Star, кодирующего белок StAR, катализирующий транспорт холестерина в митохондрии, причем эффект ХГЧ был выражен в существенно большей степени. Соединение TP37 не влияло на экспрессию Star, что согласуется с отсутствием у него стероидогенного эффекта (рис. 2). Гонадотропин в обеих исследуемых дозах стимулировал экспрессию гена Cyp11a1, кодирующего цитохром Р450scc, катализирующий синтез прегненолона из холестерина, и ингибировал экспрессию гена Cyp17a1, кодирующего цитохром Р450-17α, катализирующий синтез 17-гидроксипрогестерона и андростендиона из прогестерона (рис. 2). В отличие от ХГЧ, TP03 и TP04 существенно не влияли на экспрессию генов цитохромов. Соединение TP37, как и ХГЧ, снижало экспрессию гена Cyp17a1 (рис. 2). Таким образом, несмотря на более выраженный в сравнении с ХГЧ стероидогенный эффект, TP03 и TP04 умеренно стимулировали (Star) или слабо влияли (Cyp11a1, Cyp17a1) на экспрессию стероидогенных генов, в то время как ХГЧ отчетливо ее стимулировал (Star, Cyp11a1) или, напротив, ингибировал (Cyp17a1), что указывает на различия в механизмах действия гонадотропинов и тиено-[2,3-d]пиримидинов на систему стероидогенеза. При этом имеются различия между влиянием на экспрессию стероидогенных генов между различающимися по структуре тиено-[2,3-d]пиримидинами, как это показано на примере TP37.
ОБСУЖДЕНИЕ
Активация гонадотропинами аденилатциклазной системы в клетках Лейдига является основным механизмом запуска тестикулярного стероидогенеза. Полученные нами данные укладываются в эту парадигму, хотя и с определенными ограничениями. Так, ХГЧ и все исследуемые тиено-[2,3-d]пиримидины при действии на тестикулярные мембраны, в которых локализованы начальные звенья аденилатциклазной системы – рецептор ЛГ/ХГЧ, гетеротримерный Gs-белок и фермент АЦ, стимулировали базальную активность АЦ, каталитического компонента этой системы. Нами показано, что стимулирующий АЦ эффект ХГЧ в насыщающей концентрации 10–8 М в среднем в 3–4 раза превосходил соответствующие эффекты TP03 и TP04, взятых в концентрации 10–4 М, обеспечивающей, как показано нами ранее, максимальную стимуляцию АЦ [14]. Это согласуется с тем, что стероидогенный эффект ХГЧ при его однократном введении самцам крыс был выше, чем таковой тиено-[2,3-d]пиримидинов TP03 и TP04, хотя различия в условиях in vivo были менее значимыми. Это обусловлено тем, что система обратных отрицательных связей, которая запускается на уровне клеток Лейдига и гонадной оси в условиях in vivo и модулирует стимулирующие эффекты агонистов рецептора ЛГ/ХГЧ на стероидогенез, не функционирует в тестикулярных мембранах [2, 3, 19]. Другими словами, в тестикулярных мембранах наблюдается “чистый” эффект агонистов рецептора ЛГ/ХГЧ на стимулирующую стероидогенез аденилатциклазную систему.
Соединение TP37, которое по АЦ эффекту было сопоставимым с TP03 и TP04, при введении самцам крыс повышало продукцию Т через 1 ч, после чего его стероидогенный эффект затухал (табл. 1). Это указывает на то, что в условиях in vivo может происходить быстрая деградация молекулы TP37. В отличие от TP03 и TP04, TP37 имеет свободную, высоко реакционноспособную аминогруппу в четвертом положении пиримидинового кольца в варьируемой части тиено-[2,3-d]пиримидина. Эта группа является подходящей мишенью для микросомальных аминооксидаз, тем более что имеются данные о высокой реакционной способности аминогруппы в 4-аминопиримидинах, которая легко подвергается окислению и другим модификациям [20]. Следует отметить, что 4-аминопиримидин является частью тиаминдифосфата, кофактора для ряда ферментов, включая пируватдекарбоксилазу. В ходе ферментативных реакций 4-аминопиримидина подвергается не только таутомеризации, но и необратимым структурным изменениям [21]. Мы полагаем, что в результате деградации TP37 генерируются производные, наделенные активностью антагонистов или инверсионных агонистов рецептора ЛГ/ХГЧ. В пользу этого свидетельствует то, что при трехдневном введении крысам соединения TP37 (50 мг/кг) уровень Т у них снижался ниже контрольных значений (табл. 2). Необходимо отметить, что изменение паттерна активности низкомолекулярных регуляторов G-белок-сопряженных рецепторов вследствие биодеградации этих регуляторов является распространенным явлением. Так, например, в процессе моногидроксилирования соединения VU0403602 с активностью положительного аллостерического модулятора метаботропного глутаматного рецептора 5-го типа, вызываемого цитохромом P450, генерируются его производные с активностью агонистов, что приводит к судорогам и другим побочным эффектам при введении VU0403602 крысам [22].
Изучение динамики стероидогенного эффекта ХГЧ показало, что при его однократном введении после достижения максимума через 3 ч этот эффект снижается через 5 ч, а при трехдневном введении ослабевает во второй день и, в еще большей степени, в третий день обработки (табл. 1, 2). Стероидогенные эффекты TP03 и TP04, используемых в дозах 25 и 50 мг/кг, имели сходную с ХГЧ динамику в течение первых 5 ч после их однократного введения крысам, с максимумом через 3 ч. В то же время динамика стероидогенных эффектов гонадотропина и тиено-[2,3-d]пиримидинов при трехдневном введении существенно различалась. Эффекты TP03 и TP04 во второй и третий дни были выше, чем в первый день, и начинали превышать таковой ХГЧ (табл. 2). Причинами ослабления стероидогенного эффекта ХГЧ могут быть показанные нами снижение, в среднем в 7 раз, экспрессии гена Lhr, кодирующего рецептор ЛГ/ХГЧ, что должно ослаблять ответ семенников на гонадотропины, и снижение экспрессии гена Cyp17a1, кодирующего цитохром Р450-17α, что должно приводить к ослаблению заключительных стадий стероидогенеза, поскольку цитохром Р450-17α катализирует сразу две ферментативные реакции – превращение прогестерона в 17α-гидроксипрогестерон и конверсию 17α-гидроксипрогестерона в андростендион, предшественник Т.
Еще на рубеже 1970–1980-х годов было установлено, что длительное воздействие ЛГ и ХГЧ на клетки Лейдига в условиях in vitro и in vivo снижает количество функционально активных рецепторов ЛГ/ХГЧ и ослабляет ответ АЦ на стимуляцию гонадотропинами [23–25]. Через три дня после инъекции самцам крыс 75 МЕ ХГЧ содержание рецепторов ЛГ/ХГЧ в семенниках животных снижалось до 5–10% от контрольного уровня [23]. В дальнейшем было установлено, что важную роль в снижении чувствительности клеток Лейдига к гонадотропинам и в ослаблении стероидогенного ответа играют изменения распределения рецепторов ЛГ/ХГЧ во внутриклеточных компартментах [26, 27]. В клинических исследованиях было показано, что длительное введение гонадотропинов вызывает образование вторичных антител, что приводит к аутоиммунному ингибированию рецепторов ЛГ/ХГЧ в семенниках и снижению стероидогенного ответа, а также способно нарушать функционирование щитовидной железы, блокируя рецепторы тиреотропного гормона, структурно близкие рецепторам ЛГ/ХГЧ [28, 29].
Снижение экспрессии и активности цитохрома Р450-17α приводит к острому дефициту андрогенов, что обусловлено, как отмечалось выше, его ключевой ролью в тестикулярном стероидогенезе. В настоящее время ингибиторы цитохрома Р450-17α, наделенные антиандрогенной активностью, используются для лечения рака предстательной железы и других андроген-зависимых опухолей [30, 31]. В основе вызываемого острым иммобилизационным стрессом дефицита Т лежит ингибирование активности цитохрома Р450-17α в семенниках, сопровождаемое накоплением в них прогестерона и значительным снижением интратестикулярного уровня 17α-гидроксипрогестерона и Т [32]. В экспериментах по многократному введению ХГЧ пациентам и экспериментальным животным было продемонстрировано ингибирующее воздействие такой обработки на активность цитохрома Р450-17α, в том числе при повторной инъекции высокой дозы ХГЧ [33, 34]. В то же время однократное введение ХГЧ через 2 ч приводило к повышению активности цитохрома Р450-17α в семенниках крыс, но в дальнейшем вызывало снижение активности этого фермента [33]. В пользу подавления стимулирующего эффекта гонадотропинов на активность и экспрессию цитохрома Р450-17α через 6 ч после обработки свидетельствуют и результаты изучения стероидогенного эффекта ХГЧ в яичниках крысы [35, 36].
Нами выявлено снижение экспрессии гена Cyp17a1 не только при введении крысам ХГЧ в течение трех дней, но и при введении им TP37. Однако если в первом случае отмечали ослабление экспрессии стероидогенных генов, но уровень Т в крови оставался повышенным, то при использовании TP37 уровень Т не превышал контрольных значений. При этом экспрессия гена Cyp17a1 в группах, обработанных TP03 и TP04, не отличалась от таковой в контроле, что указывает на отсутствие негативного влияния на нее длительной обработки животных этими соединениями (рис. 2).
В семенниках крыс с трехдневным введением ХГЧ, наряду со снижением экспрессии Cyp17a1, многократно повышалась экспрессия генов, кодирующих белок StAR и цитохром Р450scc, ответственные за начальные стадии стероидогенеза. Важно отметить, что повышение экспрессии белка StAR, как правило, положительно коррелирует со способностью агонистов рецептора ЛГ/ХГЧ повышать продукцию Т [2]. Однако соединения TP03 и TP04, которые в третий день в сравнении с ХГЧ имели более выраженный стероидогенный эффект, лишь в небольшой степени повышали экспрессию Star и не влияли на экспрессию цитохромов. Поскольку TP03 и TP04, в отличие от ХГЧ, не подавляют экспрессию цитохрома Р450–17α, катализирующего заключительные стадии стероидогенеза, то, как можно полагать, умеренная стимуляция экспрессии белка StAR оказывается достаточной для обеспечения высокой интенсивности синтеза Т при действии на семенники этих тиено-[2,3-d]пиримидинов. Наиболее вероятной причиной этого является более высокая избирательность действия тиено-[2,3-d]пиримидинов по отношению к аденилатциклазной сигнальной системе и их слабое влияние на фосфоинозитидный и β-аррестиновый пути, как это было ранее показано нами для TP03 и другими авторами для структурно близкого ему соединения Org43553 [11, 15]. Стимуляция экспрессии белка StAR и цитохрома Р450scc осуществляется в основном вследствие cross-talk между цАМФ-зависимыми и фосфоинозитидными путями и каскадом митогенактивируемых протеинкиназ [37, 38]. Поскольку тиено-[2,3-d]пиримидины слабо влияют на фосфолипазу Сβ, форбол-чувствительные изоформы протеинкиназы С и ERK1/2-киназы, то регуляторные эффекты TP03 и TP04 на экспрессию стероидогенных генов реализуются преимущественно через цАМФ-зависимые механизмы и не приводят к гиперстимуляции экспрессии Star и Cyp11a1, как это происходит при действии ХГЧ. Известно, что активация гонадотропинами фосфоинозитидного пути и ERK1/2-киназ подавляет экспрессию и активность цитохрома Р450-17α и приводит к накоплению прогестерона в стероидогенных клетках [39]. В нашем случае при длительном воздействии ХГЧ также отмечаются снижение экспрессии гена Cyp17a1 и ослабление ХГЧ-стимулированной продукции Т.
Таким образом, нами впервые показано, что при однократном введении ХГЧ превосходит по стероидогенному эффекту тиено-[2,3-d]пиримидины TP03 и TP04 с активностью аллостерических агонистов рецептора ЛГ/ХГЧ, в то время как при трехдневном введении эффект ХГЧ, напротив, уступает таковому TP03 и TP04. Это обусловлено различиями в паттерне регуляции экспрессии генов, кодирующих рецептор ЛГ/ХГЧ и стероидогенные белки, в семенниках крыс при их длительной обработке ХГЧ и тиено-[2,3-d]пиримидинами. Ослабление стероидогенного эффекта ХГЧ обусловлено ингибированием экспрессии генов рецептора ЛГ/ХГЧ и ключевого фермента стероидогенеза цитохрома Р450-17α, в то время как TP03 и TP04 на эти показатели заметного влияния не оказывают. Тиено-[2,3-d]пиримидиновое производное TP37, сопоставимое по способности активировать АЦ с соединениями TP03 и TP04, в условиях in vivo не только быстро теряло способность стимулировать тестикулярный стероидогенез, но при трехдневном введении в дозе 50 мг/кг снижало продукцию Т. Это может быть обусловлено деградацией TP37, приводящей к генерации соединений с антагонистической активностью по отношению к рецептору ЛГ/ХГЧ, способных подавлять экспрессию цитохрома Р450-17α. Полученные данные свидетельствуют о возможности длительного применения тиено-[2,3-d]пиримидиновых производных для стимуляции стероидогенеза, без ослабления стероидогенной функции и развития резистентности семенников к гонадотропинам. При этом, однако, нужно учитывать возможность деградации активных in vitro тиено-[2,3-d]пиримидинов, что может привести не только к их инактивации, но и к генерации соединений, ингибиторов тестикулярного стероидогенеза.
Список литературы
Ulloa-Aguirre A., Crepieux P., Poupon A., Maurel M.C., Reiter E. Novel pathways in gonadotropin receptor signaling and biased agonism. Rev. Endocr. Metab. Disorders. 12 (4): 259–274. 2011. https://doi.org/10.1007/s11154-011-9176-2
Riccetti L., De Pascali F., Gilioli L., Potì F., Giva L.B., Marino M., Tagliavini S., Trenti T., Fanelli F., Mezzullo M., Pagotto U., Simoni M., Casarini L. Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod. Biol. Endocrinol. 15 (1): 2. 2017. https://doi.org/10.1186/s12958-016-0224-3
Riccetti L., Yvinec R., Klett D., Gallay N., Combarnous Y., Reiter E., Simoni M., Casarini L., Ayoub M.A. Human luteinizing hormone and chorionic gonadotropin display biased agonism at the LH and LH/CG receptors. Sci. Rep. 7 (1): 940. 2017.
Casarini L., Reiter E., Simoni M. β-Arrestins regulate gonadotropin receptor-mediated cell proliferation and apoptosis by controlling different FSHR or LHCGR intracellular signaling in the hGL5 cell line. Mol. Cell. Endocrinol. 437: 11–21. 2016. https://doi.org/10.1016/j.mce.2016.08.005
Cailleux-Bounacer A., Reznik Y., Cauliez B., Menard J.F., Duparc C., Kuhn J.M. Evaluation of endocrine testing of Leydig cell function using extractive and recombinant human chorionic gonadotropin and different doses of recombinant human LH in normal men. Eur. J. Endocrinol. 159: 171–178. 2008.
Veldhuis J.D., Liu P.Y., Takahashi P.Y., Keenan D.M. Dynamic testosterone responses to near-physiological LH pulses are determined by the time pattern of prior intravenous LH infusion. Am. J. Physiol. 303 (6): E720–E728. 2012. https://doi.org/10.1152/ajpendo.00200.2012
Шпаков А.О. Гонадотропины – от теории к клинической практике. Санкт-Петербург: ПОЛИТЕХ-ПРЕСС. 2018. 347 c. ISBN 978-5-7422-6330-2. [Shpakov A.O. Gonadotropiny – ot teorii k klinicheskoj praktike. Sankt-Peterburg: POLITEKH-PRESS. 2018. 347 p. ISBN 978-5-7422-6330-2. (In Russ)].
Lane J.R., Ijzerman A.P. Allosteric approaches to GPCR drug discovery. Drug Discov. Today Technol. 10 (2): e219–e221. 2013. https://doi.org/10.1016/j.ddtec.2013.01.006
Шпаков А.О. Новые достижения в разработке и изучении механизмов действия низкомолекулярных агонистов рецепторов тиреотропного и лютеинизирующего гормонов. Цитология. 57(3): 167–176. 2015. [Shpakov A.O. New achievements in the development and study of the mechanisms of action of the low molecular weight agonists of receptors of the thyroid-stimulating and the luteinizing hormones. Tsitologiia. 57(3): 167–176. 2015. (In Russ)].
van Straten N.C., Schoonus-Gerritsma G.G., van Some-ren R.G., Draaijer J., Adang A.E., Timmers C.M., Hanssen R.G., van Boeckel C.A. The first orally active low molecular weight agonists for the LH receptor: Thienopyr(im)idines with therapeutic potential for ovulation induction. ChemBioChem. 3 (10): 1023–1026. 2002.
van Koppen C.J., Zaman G.J., Timmers C.M., Kelder J., Mosselman S., van de Lagemaat R., Smit M.J., Hanssen R.G. A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch. Pharmacol. 378(5): 503–514. 2008. https://doi.org/10.1007/s00210-008-0318-3
van de Lagemaat R., Raafs B.C., van Koppen C., Timmers C.M., Mulders S.M., Hanssen R.G. Prevention of the onset of ovarian hyperstimulation syndrome (OHSS) in the rat after ovulation induction with a low molecular weight agonist of the LH receptor compared with hCG and rec-LH. Endocrinology. 152 (11): 4350–4357. 2011. https://doi.org/10.1210/en.2011-1077
Шпаков А.О., Дарьин Д.В., Деркач К.В., Лобанов П.С. Стимулирующее влияние тиенопиримидиновых производных на аденилатциклазную сигнальную систему в семенниках крыс. Докл. Акад. Наук. 456 (4): 494–498. 2014. [Shpakov A.O., Dar’in D.V., Derkach K.V., Lobanov P.S. The stimulating influence of thienopyrimidine compounds on the adenylyl cyclase systems in the rat testes. Dokl. Biochem. Biophys. 456: 104–107. 2014. https://doi.org/10.1134/S1607672914030065].
Деркач К.В., Дарьин Д.В., Бахтюков А.А., Лобанов П.С., Шпаков А.О. Изучение функциональной актив-ности новых низкомолекулярных агонистов рецептора лютеинизирующего гормона in vitro и in vivo. Биол. мембр. 33 (4): 263–271. 2016. https://doi.org/10.7868/S0233475516040046 [Derkach K.V., Dar’in D.V., Bakhtyukov A.A., Lobanov P.S., Shpakov A.O. In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow). Suppl. Ser. A: Memb. Cell Biol. 10 (4): 294–300. 2016. https://doi.org/10.1134/S1990747816030132]
Деркач К.В., Бахтюков А.А., Шпаков А.А., Дарьин Д.В., Шпаков А.О. Особенности регуляции гетеротримерных G-белков хорионическим гонадотропином и низкомолекулярным агонистом рецептора лютеинизирующего гормона. Цитология. 59(7): 474–481. 2017. [Derkach K.V., Bakhtyukov A.A., Shpakov A.A., Dar’in D.V., Shpakov A.O. Specificity of heterotrimeric G protein regulation by human chorionic gonadotropin and low-molecular agonist of luteinizing hormone receptor. Cell Tissue Biol. 11 (6): 475–482. 2017. https://doi.org/10.1134/S1990519X17060037].
Бахтюков А.А., Деркач К.В., Дарьин Д.В., Степочкина А.М., Шпаков А.О. Низкомолекулярный агонист рецептора лютеинизирующего гормона эффективно стимулирует аденилатциклазу в тестикулярных мембранах и стероидогенез в семенниках крыс с диабетом 1-го типа. Биол. Мембр. 36 (5): 322–331. 2019. https://doi.org/10.1134/S0233475519050037[Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Ste-pochkina A.M., Shpakov A.O. A low molecular weight agonist of the luteinizing hormone receptor stimulates adenylyl cyclase in the testicular membranes and steroidogenesis in the testes od rats with type 1 diabetes. Biochemistry (Moscow). Suppl. Series A: Membr. Cell Biol. 13 (4): 301–309. 2019. .https://doi.org/10.1134/S1990747819040032.]
Бахтюков А.А., Деркач К.В., Дарьин Д.В., Шпа-ков А.О. Стероидогенный эффект низкомолекулярного агониста рецептора лютеинизирующего гормона при его введении самцам крыс. Докл. Акад. Наук. 484 (6): 103–106. 2019. [Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Shpakov A.O. Conservation of steroidogenic effect of the low-molecular-weight agonist of luteinizing hormone receptor in the course of its long-term administration to male rats. Dokl. Biochem. Biophys. 484 (1): 78–81. 2019.https://doi.org/10.1134/S1607672919 010216.]
Бахтюков А.А., Деркач К.В., Дарьин Д.В., Шарова Т.С., Шпаков А.О. Ослабление базальной и стимулированной агонистами рецептора лютеинизирующего гормона продукции тестостерона у стареющих самцов крыс. Успехи геронтологии. 31 (5): 654–661. 2018. [Bakhtyukov A.A., Derkach K.V., Dar’in D.V., Sharova T.S., Shpakov A.O. Decrease in the basal and luteinizing hormone receptor agonist-stimulated testosterone production in aging male rats. Adv. Gerontol. 9 (2): 179–185. 2019. doi: 10.1134/S2079057019020036].
Veldhuis J.D., Dufau M.L. Steroidal regulation of biologically active luteinizing hormone secretion in men and women. Hum. Reprod. 8 (2): 84–96. 1993.
Raczyńska E.D., Kolczyńska K., Stępniewski T.M. Consequences of one-electron oxidation and one-electron reduction for 4-aminopyrimidine–DFT studies. J. Mol. Model. 18 (8): 3523–3533. 2012. https://doi.org/10.1007/s00894-012-1358-7
Balakrishnan A., Gao Y., Moorjani P., Nemeria N.S., Tittmann K., Jordan F. Bifunctionality of the thiamin diphosphate cofactor: assignment of tautomeric/ionization states of the 4'-aminopyrimidine ring when various intermediates occupy the active sites during the catalysis of yeast pyruvate decarboxylase. J. Am. Chem. Soc. 134 (8): 3873–3885. 2012. https://doi.org/10.1021/ja211139c
Bridges T.M., Rook J.M., Noetzel M.J., Morrison R.D., Zhou Y., Gogliotti R.D., Vinson P.N., Jones C.K., Niswender C.M., Lindsley C.W., et al. Biotransformation of a Novel Positive Allosteric Modulator of Metabotropic Glutamate Receptor Subtype 5 Contributes to Seizures in Rats Involving a Receptor Agonism-Dependent Mechanism. Drug Metab. Dispos. 41 (9): 1703–1714. 2013.
Purvis K., Torjesen P.A., Haug E., Hansson V. hCG suppression of LH receptors and responsiveness of testicular tissue to hCG. Mol. Cell. Endocrinol. 8(1): 73–80. 1977.
Jahnsen T., Purvis K., Torjesen P.A., Hansson V. Temporal relationship between hCG induced desensitization of LH/hCG responsive adenylyl cyclase and downregulation of LH/hCG receptors in the rat testis. Arch. Androl. 6 (2): 155–162. 1981.
Veijola M., Kellokumpu S., Rajaniemi H. The effect of varying doses of hCG on the in vivo uptake by rat testis and serum testosterone response. Horm. Res. 19 (3): 191–199. 1984.
Diaz E.S., Pellizzari E., Casanova M., Cigorraga S.B., Denduchis B. Type IV collagen induces down-regulation of steroidogenic response to gonadotropins in adult rat Leydig cells involving mitogen-activated protein kinase. Mol. Reprod. Dev. 72 (2): 208–215. 2005.
Wolf-Ringwall A.L., Winter P.W., Roess D.A., George Barisas B. Luteinizing hormone receptors are confined in mesoscale plasma membrane microdomains throughout recovery from receptor desensitization. Cell. Biochem. Biophys. 68 (3): 561–569. 2014. https://doi.org/10.1007/s12013-013-9738-x
Thau R.B., Goldstein M., Yamamoto Y., Burrow G.N., Phillips D., Bardin C.W. Failure of gonadotropin therapy secondary to chorionic gonadotropin-induced antibodies. J. Clin. Endocrinol. Metab. 66 (4): 862–867. 1988.
Ogura T., Mimura Y., Otsuka F., Kishida M., Yokota K., Suzuki J., Nagai A., Hirakawa S., Makino H., Tobe K. Hypothyroidism associated with anti-human chorionic gonadotropin antibodies secondarily produced by gonadotropin therapy in a case of idiopathic hypothalamic hypogonadism. J. Endocrinol. Invest. 26 (11): 1128–1135. 2003.
Vasaitis T.S., Bruno R.D., Njar V.C. CYP17 inhibitors for prostate cancer therapy. J. Steroid. Biochem. Mol. Biol. 125 (1–2): 23–31. 2011. https://doi.org/10.1016/j.jsbmb.2010.11.005
Ye L., Chen X., Li X., Zhu Q., Yu L., Guo J., Chen B., Akingbemi B.T., Ge R.S., Li H. Effects of methoxychlor and its metabolite 2,2-bis(p-hydroxyphenyl)-1,1,1-trichloroethane on human and rat 17α-hydroxylase/17,20-lyase activity. Toxicol. Lett. 225 (3): 407–412. 2014. https://doi.org/10.1016/j.toxlet.2014.01.011
Orr T.E., Taylor M.F., Bhattacharyya A.K., Collins D.C., Mann D.R. Acute immobilization stress disrupts testicular steroidogenesis in adult male rats by inhibiting the activities of 17 alpha-hydroxylase and 17,20-lyase without affecting the binding of LH/hCG receptors. J. Androl. 15 (4): 302–308. 1994.
Chasalow F., Marr H., Haour F., Saez J.M. Testicular steroidogenesis after human chorionic gonadotropin desensitization in rats. J. Biol. Chem. 254 (13): 5613–5617. 1979.
Forest M.G., Roulier R. Kinetics of the steroidogenic response of the testis to stimulation by hCG. V. Blockade of 17–20 lyase induced by hCG is an age-dependent phenomenon inducible by pre-treatment with hCG. Ann. Endocrinol. (Paris). 45: 281–290. 1984.
Suzuki K., Tamaoki B. Acute decrease by human chorionic gonadotropin of the activity of preovulatory ovarian 17 alpha-hydroxylase and C-17-C-20 lyase is due to decrease of microsomal cytochrome P-450 through de novo synthesis of ribonucleic acid and protein. Endocrinology. 113 (6): 1985–1991. 1983.
Johnson D.C., Griswold T. Relationship between in vivo and in vitro 17 alpha-hydroxylase and C17,20-lyase activity in ovaries of immature hypophysectomized rats treated chronically with human chorionic gonadotropin. J. Steroid. Biochem. 24 (2): 637–643. 1986.
Stocco D.M., Wang X., Jo Y., Manna P.R. Multiple Signaling pathways regulating steroidogenesis and steroidogenic acute regulatory protein expression: more complicated than we thought. Mol. Endocrinol. 19: 2647–2659. 2005.
Manna P.R., Stocco D.M. The role of specific mitogen-activated protein kinase Signaling cascades in the regulation of steroidogenesis. J. Signal Transduct. 2011: 821615. 2011. https://doi.org/10.1155/2011/821615
Manna P.R., Huhtaniemi I.T., Stocco D.M. Mechanisms of protein kinase C signaling in the modulation of 3, 5 -cyclic adenosine monophosphate-mediated steroidogenesis in mouse gonadal cells. Endocrinology. 150 (7): 3308–3317. 2009.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


