Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 337-349
АНАЛИЗ СТРУКТУРЫ ПОЛОВЫХ ФЕРОМОНОВ И АТТРАКТАНТОВ ZYGAENIDAE (INSECTA, LEPIDOPTERA): БИОХИМИЧЕСКИЙ И ЭВОЛЮЦИОННЫЙ АСПЕКТЫ
К. А. Ефетов 1, *, Е. Е. Кучеренко 1, **
1 Крымский федеральный университет имени В. И. Вернадского
Симферополь, Россия
* E-mail: efetov@ma.cfuv.ru
** E-mail: shysh1981@mail.ru
Поступила в редакцию 22.11.2019
После доработки 13.03.2020
Принята к публикации 16.03.2020
Аннотация
В обзоре проанализированы данные о химическом составе и строении известных половых феромонов и аттрактантов Zygaenidae (Insecta, Lepidoptera). Предприняты попытки проследить возможные пути эволюции аттрактивных молекул Zygaenidae и выявить особенности структуры, определяющие их биологическую активность. В настоящее время строение феромонов и аттрактантов известно для двух из пяти подсемейств. У Zygaeninae аттрактивной способностью обладают сложные эфиры уксусной кислоты и жирных спиртов, у Procridinae – сложные эфиры втор-бутилового спирта и жирных кислот. Углеводородные радикалы жирных спиртов и кислот известных аттрактивных молекул Zygaenidae содержат четное количество атомов углерода (12, 14, 16) и, как правило, одну двойную связь. Видоспецифичность химического сигнала определяется не только качественным составом, но и количественным соотношением компонентов феромонной/аттрактантной композиции.
ВВЕДЕНИЕ
В мировой научной литературе накопилось достаточно фактического материала о химической коммуникации животных, тем не менее сведения о феромонных системах абсолютного большинства групп Insecta разрозненны и неполны (http://www.pherobase.com) [1]. Изучение молекулярных основ хемосигналов показало, что набор макро- и микрокомпонентов феромонных композиций представлен относительно небольшим количеством веществ по сравнению с огромным числом видов данного таксона. Насекомые относительно экономно расходуют энергетические ресурсы для биосинтеза новых соединений [2–4]. Применение вероятностного подхода к обработке данных дало возможность установить, что химическая структура половых феромонов является таксономическим признаком и может рассматриваться как дополнительный биологический маркер в комплексе с другими традиционными подходами в решении вопросов филогении и биосистематики некоторых групп Lepidoptera (Insecta), в частности Tortricidae и Noctuidae [3, 5]. Выявленные закономерности в строении и составе феромонных компонентов позволяют не только прогнозировать структуру половых аттрактантов и определять тактику их полевого скрининга, но и проследить эволюцию видов в пределах одного рода [3, 5].
Необходима четкая дифференциация терминов “половой феромон” и “половой аттрактант”, которые часто используются в литературе как тождественные понятия. Традиционно половыми феромонами называют соединения, секретируемые организмами в окружающую среду, оказывающие возбуждающее действие на особей противоположного пола того же биологического вида, стимулирующие брачное поведение и влияющие на процессы размножения [6]. Половыми аттрактантами принято обозначать природные или синтетические вещества, также привлекающие и/или возбуждающие особей одного из полов, но не присутствующие в феромонных железах животных этого вида [7]. Таким образом, половые феромоны одного вида могут оказаться половыми аттрактантами для другого вида, но половые аттрактанты не могут быть названы половыми феромонами конкретного вида до тех пор, пока вещества с данной структурой не будут обнаружены в железах одного из полов этого вида. Мы в своей работе будем придерживаться этой терминологии.
В качестве объекта исследований нами было выбрано семейство Zygaenidae (Lepidoptera), которое согласно последней ревизии разделено на пять подсемейств: Inouelinae Efetov & Tarmann, 2017, Procridinae Boisduval, 1828, Chalcosiinae Walker, 1865, Callizygaeninae Alberti, 1954 и Zygaeninae Latreille, 1809 [8, 9]. Данное семейство, насчитывающее свыше 1000 видов, распространенных во всех зоогеографических областях мира (за исключением Антарктической) [10–16], является удобной модельной группой для мониторинга состояния окружающей среды. Среди Zygaenidae встречаются как редкие, охраняемые виды, так и серьезные вредители виноградарства и садоводства, поэтому накопление знаний о хемоаттракции необходимо не только для изучения филогенетических взаимоотношений таксонов в семействе, но и для разработки мер охраны исчезающих видов и методов борьбы с видами-вредителями сельского хозяйства.
Цель настоящего обзора – проанализировать химический состав и строение известных половых феромонов и аттрактантов Zygaenidae, проследить возможные пути эволюции привлекающих молекул и выявить особенности структуры, определяющие их биологическую активность.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В работе использовали сведения о строении и составе природных половых феромонов и синтетических половых аттрактантов Zygaenidae из электронной глобальной базы данных “The Pherobase” (http://www.pherobase.com) [1]. Материалы были дополнены результатами тестирования в полевых условиях синтезированных нами [17–19] аналогов половых феромонов Zygaenidae в Албании, Греции, Иране, Испании, Лаосе, России, Таджикистане, Таиланде, Турции, Японии в 2013– 2018 гг. [20–28].
Химические названия аттрактивных соединений закодированы по общепринятым правилам:
1. Сложные эфиры уксусной кислоты и высших непредельных спиртов, например, (7Z)-додеценилацетат, зашифрованы как 7Z-12:Ac. 7 – порядковый номер атома углерода при двойной связи, Z – цис-изомер данного вещества (или Е для транс-изомера), 12 – количество атомов углерода в спиртовом радикале, Ac – ацетат.
2. Сложные эфиры втор-бутилового спирта и высших непредельных кислот, например, (2R)-бутил-(7Z)-тетрадеценоат, записаны как 2R-7Z-14. 2R указывает на то, что сложный эфир является производным R-энантиомера втор-бутилового спирта (или 2S для S-энантиомера втор-бутилового спирта), 7 – порядковый номер атома углерода при двойной связи, Z – цис-изомер данного вещества (или Е для транс-изомера), 12 – количество атомов углерода в кислотном радикале.
Полные названия веществ даны при первом упоминании.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Компонентный состав и химическое строение половых феромонов Zygaenidae
Выделению и идентификации половых феромонов Zygaenidae предшествовал целый комплекс работ по изучению различных аспектов хемокоммуникации, а именно: брачного поведения самцов и самок, электрофизиологических ответных реакций на запахи, влияния возраста особей и времени суток на образование половых феромонов, механизмов восприятия химических сигналов, анатомии и физиологии секреторных желез.
Первые упоминания о привлечении Zygaenidae с помощью обонятельных сигналов можно найти в расширенном обзоре М. Джекобсона [29], где сообщается о факте массового прилета самцов Zygaena (Zygaena) filipendulae (Linnaeus, 1758) (Zygaeninae) к девственной самке Lasiocampa quercus (Linnaeus, 1758) (Lasiocampidae). Позже экспериментально была подтверждена возможность привлечения самцов некоторых видов подсемейства Procridinae на половые феромоны девственных самок другого рода или подрода [30]. Было отмечено полное отсутствие аттракции между представителями следующих родов: Theresimima Strand, 1917 и Adscita Retzius, 1783; Theresimima и Jordanita Verity, 1946; Rhagades Wallengren, 1863 и Adscita; Rhagades и Jordanita; Adscita и Jordanita. Отрицательный результат наблюдался даже между особями из разных подродов рода Jordanita, а именно: Roccia Alberti, 1954 и Tremewania Efetov & Tarmann, 1999. Однако в нескольких биотестах была отмечена положительная реакция. Так, самки Theresimima ampellophaga (Bayle-Barelle, 1808) вызывали половое возбуждение у самцов Rhagades (Rhagades) pruni ([Denis & Schiffermüller], 1775) и, наоборот, самки Rh. (Rh.) pruni привлекали самцов Th. аmpellophaga (оба вида обитают в Крыму, где и были собраны для экспериментов). Самец Jordanita (Rjabovia) horni (Alberti, 1937) (из Армении) даже спарился с самкой J. (Solaniterna) subsolana (Staudinger, 1862) (из Крыма). Но самое активное половое поведение наблюдалось между аллопатрическими видами: самец Rh. (Wiegelia) amasina (Herrich-Schӓffer, 1851) (из Турции) возбуждался в присутствии самки Rh. (Rh.) pruni (из Крыма). Эти факты свидетельствовали в пользу того, что разные виды могут иметь схожий качественный состав половых феромонов, вследствие чего возможно ошибочное восприятие сигналов другого вида.
Наличие у Zygaenidae внутривидовой хемокоммуникации, осуществляемой с помощью летучих половых феромонов, было впервые обнаружено у опасного вредителя виноградарства Th. ampellophaga. Г.В. Долидзе и соавт. [31] описали успешный способ отлова самцов с применением “секс-ловушек”, в которых были размещены девственные самки данного вида. В ловушках не было обнаружено ни одной особи другого вида Insecta, что говорило о высокой видоспецифичности феромонного сигнала. Использование самками Zygaenidae феромонов для привлечения особей противоположного пола в дальнейшем было подтверждено экспериментально у целого ряда видов из трех подсемейств: Procridinae [30, 32], Chalcosiinae [33] и Zygaeninae [34–36].
Химическая структура первого полового феромона Zygaenidae была расшифрована у североамериканского вредителя винограда Harrisina metallica Stretch, 1885 (синоним Harrisina brillians Barnes & McDunnough, 1910) из подсемейства Procridinae [37]. Среди летучих веществ, выделяемых самками этого вида, были идентифицированы 2-бутилдеканоат, 2-бутилдодеканоат, изопропил-(7Z)-тетрадеценоат и 2-бутил-(7Z)-тетрадеценоат. Экспериментальным путем было установлено, что именно последнее вещество – активный компонент полового феромона самок H. metallica. Абсолютная конфигурация спиртового радикала в сложном эфире 2-бутил-(7Z)-тетрадеценоате при этом не была определена. Последующие полевые испытания показали, что наибольшей привлекательностью для самцов обладал 2S-бутил-(7Z)-тетрадеценоат (2S-7Z-14), в то время как присутствие R-энантиомера данного эфира снижало активность полового феромона [38].
Позже была предпринята попытка установить химическую структуру феромона другого вида подсемейства Procridinae – Illiberis (Primilliberis) pruni Dyar, 1905 [39]. Авторам удалось обнаружить в экстрактах феромонных желез самок непредельный бутилдодеценоат. Но хиральность спиртового радикала, положение и изомерия двойной связи в углеводородном радикале жирной кислоты остались невыясненными.
Полный стереохимический анализ полового феромона был осуществлен для вида-вредителя винограда – Theresimima ampellophaga (Procridinae) [40], распространенного преимущественно в Средиземноморье [30]. Природный феромон был экстрагирован гексаном из желез девственных самок, выведенных в лабораторных условиях. Авторы не только определили половой феромон как (2R)-бутил-(7Z)-тетрадеценоат (2R-7Z-14), но и произвели многостадийный стереоселективный синтез этого сложного эфира.
Через десять лет половой феромон был выделен и идентифицирован у самок восточноазиатского вида-вредителя плодовых розоцветных Illiberis (Primilliberis) rotundata Jordan, 1907 (Procridinae) [41]. В экстрактах женских феромонных желез, проанализированных методом газовой хроматографии/масс-спектрометрии, были обнаружены: 2-бутил-(7Z)-додеценоат и 2-бутил-(9Z)-тетрадеценоат. Тестирование энантиомеров указанных эфиров: 2R-7Z-12 и 2S-7Z-12, 2R-9Z-14 и 2S-9Z-14 – в лаборатории (метод электроантеннографии) и природных биотопах (адгезивные ловушки с аттрактивными приманками) позволило определить, что смеси 2R-7Z-12+2R-9Z-14 в соотношении соответствующих компонентов 30:100 и 50:100 обладают наибольшей аттрактивностью для самцов [41, 42].
На основании биологического материала Jordanita (Solaniterna) subsolana из Крыма, собранного профессором К.А. Ефетовым (Симферополь, Россия) и переданного им для исследования профессору W. Francke (Гамбург, ФРГ), W. Francke выявил в половом феромоне самок этого вида наличие двух компонентов: 2-бутилдодеценоата и 2-бутилдодекадиеноата (последний – впервые обнаруженное у Procridinae вещество с двумя двойными связями). Однако W. Francke так и не опубликовал эти результаты, но сообщил о них профессору M. Subchev (София, Болгария), который включил вышеупомянутую информацию (как “W. Francke, personal communication”) в свою обзорную статью по половой феромонной коммуникации Zygaenidae [7].
В 2019 г. была опубликована работа группы китайских ученых [43], в которой сообщалось об успешной идентификации полового феромона самок Phauda flammans (Walker, 1854) – вида, принадлежащего (согласно современной классификации) к семейству Phaudidae [44] и ошибочно отнесенного авторами [43] к Zygaenidae.
Таким образом, на сегодняшний день в семействе Zygaenidae структура половых феромонов установлена у пяти видов подсемейства Procridinae: H. metallica, Th. ampellophaga, I. (P.) pruni, I. (P.) rotundata и J. (S.) subsolana. Во всех случаях это втор-бутиловые эфиры ненасыщенных высших карбоновых кислот (у H. metallica, Th. ampellophaga и I. (P.) rotundata определено, что это цис-изомеры). Описанная молекулярная структура половых феромонов, как и расположение желез (в центрально-дорсальной части брюшка самок), их секретирующих, являются, по всей видимости, характерными для трибы Procridini подсемейства Procridinae [2, 4, 7]. Химический состав природных половых феромонов у представителей подсемейств Inouelinae, Chalcosiinae, Callizygaeninae и Zygaeninae на данный момент неизвестен.
Алкенилацетаты – синтетические половые аттрактанты Zygaeninae
Химические и визуальные сигналы обеспечивают узнавание партнера и успешное спаривание у видов Zygaenidae [36, 45, 46]. И хотя большинство представителей подсемейства Zygaeninae имеют яркую, хорошо заметную, апосематическую окраску [47–49], самцы этой группы для дальнедистантного поиска особей противоположного пола используют именно обонятельные стимулы. Половые аттрактанты Zygaeninae были открыты во время полевых экспериментов, проводимых разными коллективами ученых с известными половыми феромонами видов из других семейств Lepidoptera (например, Tortricidae, Sesiidae). Так, в конце 1970-х – начале 1980-х годов обнаружение самцов рода Zygaena Fabricius, 1775 (Zygaeninae) в клеевых феромонных ловушках с непредельными эфирами уксусной кислоты [50–52] послужило толчком для организации целенаправленного изучения химической коммуникации у представителей этого рода [53]. Для шести видов Zygaena были подобраны оптимальные концентрации и композиции сложных эфиров уксусной кислоты, привлекающие максимальное количество самцов к аттрактивным приманкам в природных биотопах и вызывающие такую же поведенческую реакцию самцов, как и в присутствии “зовущей” самки. Кроме того, для 12 видов Zygaena, одного вида из рода Reissita Tremewan, 1959 и одного – из рода Epizygaenella Tremewan & Povolny, 1968 (Reissita и Epizygaenella филогенетически близки к роду Zygaena) с помощью электроантеннографии была определена специфическая чувствительность рецепторных клеток, расположенных в антеннах самцов, к сложным эфирам уксусной кислоты и семи высших моноеновых спиртов: (5Z)-додеценилацетату (5Z-12:Ac), (7Z)-додеценилацетату (7Z-12:Ac), (9Z)-додеценилацетату (9Z-12:Ac), (7Z)-тетрадеценилацетату (7Z-14:Ac), (9Z)-тетрадеценилацетату (9Z-14:Ac), (11Z)-тетрадеценилацетату (11Z-14:Ac) и (11Z)-гексадеценилацетату (11Z-16:Ac).
Впоследствии аттрактивность цис-алкенилацетатов для самцов рода Zygaena неоднократно подтверждалась в полевых экспериментах, выполненных разными авторами [54–56]. Обобщенные данные о половых аттрактантах, известных из литературных источников для представителей подсемейства Zygaeninae, приведены в табл. 1.
Таблица 1.
Компонентный состав и химическое строение половых аттрактантов, привлекающих самцов Zygaeninae* Table 1. Components and chemical structure of female sex attractants in Zygaeninae (Zygaenidae)*
| Полное латинское название вида/подвида Species/Subspecies |
Половой аттрактант/атрактанты Sex attractant/attractants |
Источник Source |
|---|---|---|
| Reissita simonyi (Rebel, 1899) | 7Z-12:Ac+9Z-14:Ac+11Z-16:Ac | [53] |
| Epizygaenella caschmirensis (Kollar, 1844) | 9Z-14:Ac+11Z-14:Ac+11Z-16:Ac | [53] |
| Zygaena (Mesembrynus) tamara Christoph, 1889 | 7Z-12:Ac+9Z-12:Ac+9Z-14:Ac+11Z-14:Ac | [53] |
| Zygaena (Mesembrynus) minos ([Denis & Schiffermüller], 1775) | 7Z-12:Ac+9Z-14:Ac+11Z-14:Ac | [53] |
| Zygaena (Mesembrynus) purpuralis (Brünnich, 1763) | 7Z-12:Ac+7Z-14:Ac+9Z-14:Ac 7Z-12:Ac+9Z-14:Ac |
[53] [53] |
| Zygaena (Mesembrynus) favonia thevestis Staudinger, 1887 | 7Z-12:Ac+9Z-14:Ac+11Z-14:Ac | [53] |
| Zygaena (Mesembrynus) sarpedon (Hübner, 1790) | 7Z-12:Ac+9Z-12:Ac+9Z-14:Ac | [53] |
| Zygaena (Agrumenia) fausta (Linnaeus, 1767) | 11Z-14:Ac | [52] |
| Zygaena (Agrumenia) hilaris Ochsenheimer, 1808 | 11Z-14:Ac | [52] |
| Zygaena (Agrumenia) carniolica (Scopoli, 1763) | 7Z-12:Ac+9Z-14:Ac+11Z-16:Ac 7Z-12:Ac+9Z-12:Ac+9Z-14:Ac |
[53] [53] |
| Zygaena (Agrumenia) exulans (Hohenwarth, 1792) | 7Z-12:Ac+ 9Z-12:Ac+9Z-14:Ac | [53] |
| Zygaena (Agrumenia) viciae ([Denis & Schiffermüller], 1775) | 5Z-12:Ac+7Z-12:Ac+9Z-14:Ac | [53] |
| Zygaena (Agrumenia) niphona Butler, 1877 | 7Z-12:Ac+9Z-14:Ac | [54] |
| Zygaena (Zygaena) anthyllidis Boisduval, 1828 | 7Z-12:Ac+9Z-14:Ac | [53] |
| Zygaena (Zygaena) nevadensis gallica Oberthür, 1898 | 11Z-14:Ac+11E-14:Ac | [52] |
| Zygaena (Zygaena) osterodensis** Reiss, 1921 | 8Z-12:Ac+8E-12:Ac | [57] |
| Zygaena (Zygaena) ephialtes (Linnaeus, 1767) | 11Z-14:Ac+11E-14:Ac+12Ac 11Z-14:Ac+12Ac 11Z-14:Ac |
[51] [51] [52] |
| Zygaena (Zygaena) transalpinasplugena Burgeff, 1926 | 11Z-14:Ac+11Z-14OH | [50] |
| Zygaena (Zygaena) transalpina hippocrepidis (Hübner, 1799) | 11Z-14:Ac | [52] |
| Zygaena (Zygaena) angelicae Ochsenheimer, 1808 | 11Z-14:Ac+12Ac | [51] |
| Zygaena (Zygaena) filipendulae (Linnaeus, 1758) | 5Z-12:Ac+7Z-12:Ac+9Z-14:Ac 5Z-12:Ac+7Z-12:Ac, 7Z-12:Ac+9Z-14:Ac 11Z-14:Ac+11E-14:Ac |
[53] [53] [58] |
| Zygaena (Zygaena) lonicerae (Scheven, 1777) | 5Z-12:Ac+7Z-12:Ac+9Z-14:Ac | [53] |
| Zygaena (Zygaena) trifolii (Esper, 1783) | 5Z-12:Ac+7Z-12:Ac+9Z-14:Ac | [53] |
Как мы видим, основная масса компонентов синтетических половых аттрактантов Zygaeninae представлена сложными эфирами уксусной кислоты и непредельных алифатических длинноцепочечных спиртов с числом атомов углерода от 12 до 16. Абсолютное большинство из них является цис-изомерами, причем двойная связь расположена в нечетной позиции: у одиннадцатого, девятого, седьмого и реже пятого атома углерода. Перечисленные признаки являются отражением общих правил строения привлекающих молекул Lepidoptera [2, 4].
Сложные эфиры втор-бутилового спирта и высших непредельных кислот – половые аттрактанты Procridinae
После успешной идентификации компонентного состава и молекулярного строения половых феромонов Procridinae был осуществлен стереоселективный синтез их структурных копий: 2R-7-12, 2S-7-12, 2R-7-14, 2S-7-14, 2R-9-14, 2S-9-14 [40, 41]. Все они являются цис-изомерами. Самостоятельно и в различных сочетаниях эти сложные эфиры стали применяться в эколого-фаунистических исследованиях по всему миру, что привело к открытию половых аттрактантов для целого ряда видов Zygaenidae подсемейства Procridinae (табл. 2).
Таблица 2.
Компонентный состав и химическое строение половых аттрактантов, привлекающих самцов Procridinae* Table 2. Components and chemical structure of female sex attractants in Procridinae sp. (Zygaenidae)-
| Полное латинское название вида/подвида Species/Subspecies |
Половой аттрактант/аттрактанты Sex attractant/attractants |
Источник Source |
|---|---|---|
| Acoloithus falsarius Clemens, 1861 | 2R-7-14, 2R-7-14+2S-7-14 | [60, 61] |
| Acoloithus novaricus Barnes & McDunnough, 1913 | 2S-7-14, 2R-7-14 | [61] |
| Acoloithus rectarius Dyar, 1898 | 2R-9-14 | [7] |
| Neoilliberis fusca (H. Edwards, 1885) | 2R-9-14 | [7] |
| Neoalbertia constans (H. Edwards, 1881) | 2S-9-14 | [7] |
| Neoprocris aversa (H. Edwards, 1884) | 2R-9-14 | [7] |
| Pyromorpha (Pyromorpha) dyari (Jordan, 1913) | 2S-7-12 | [7] |
| Triprocris cyanea Barnes & McDunnough, 1910 | 2S-9-14 | [7] |
| Harrisina americana (Guérin-Méneville, 1844) | 2R-7-14, 2R-7-14+2S-7-14 | [60, 61] |
| Harrisina coracina (Clemens, 1861) | 2S-7-14, 2R-7-14 | [61] |
| Harrisina guatemalena (Druce, 1884) | 2S-7-14+2R-7-14, 2S-7-14, 2R-7-14 | [61] |
| Illiberis (Primilliberis) pruni Dyar, 1905 | 2R-7-12+2R-9-14, 2R-2-12 | [25, 62] |
| Theresimima ampellophaga (Bayle-Barelle, 1808) | 2R-2-12+2S-2-12, 2R-2-12, ClOil 135°** | [18, 19, 23] |
| Rhagades (Wiegelia) amasina (Herrich-Schäffer, 1851) | 2S-2-12, 2R-2-12+2S-2-12 | [26] |
| Rhagades (Wiegelia) predotae (Naufock, 1930) | 2S-2-12 | [27] |
| Rhagades (Rhagades) pruni ([Denis & Schiffermüller], 1775) | 2R-7-12, 2R-7-12+2S-7-12 2S-2-12, 2R-2-12+2S-2-12, 2R-2-12 |
[63] [21, 23, 27] |
| Zygaenoprocris (Zygaenoprocris)chalcochlora Hampson, 1900 | 2R-7-12, 2R-7-12+2R-9-14 | [7, 64] |
| Zygaenoprocris (Zygaenoprocris) eberti (Alberti, 1968) | 2R-7-12, 2R-7-12+2R-9-14 | [64] |
| Zygaenoprocris (Molletia) taftana (Alberti, 1939) | 2R-7-12 | [65] |
| Adscita (Procriterna) subtristis (Staudinger, 1887) | 2R-2-12+2S-2-12 | [20] |
| Adscita (Adscita) statices statices (Linnaeus, 1758) | 2R-2-12 | [22] |
| Adscita (Adscita) statices drenowskii (Alberti, 1939) | 2R-2-12+2S-2-12, 2R-2-12 | [23] |
| Adscita (Adscita) obscura (Zeller, 1847) | 2S-7-12, 2S-7-12+2R-7-12 2R-2-12, 2S-2-12, 2R-2-12+2S-2-12 |
[66] [26] |
| Adscita (Adscita) geryon (Hübner, 1813) | 2S-7-12, 2R-7-12+2S-7-12 2R-2-12+2S-2-12 |
[63, 67] [21] |
| Adscita (Adscita) albanica (Naufork, 1926) | 2S-7-12+2R-7-12, 2S-7-12+2S-9-14 | [63] |
| Adscita (Tarmannita) mannii (Lederer, 1853) | 2S-7-12, 2R-7-12+2S-7-12, 2R-7-12 2S-7-12+2S-9-14, 2S-9-14 |
[63, 67, 68] [68] |
| Adscita (Tarmannita) bolivari (Agenjo, 1937) | 2R-2-12+2S-2-12 | [27] |
| Jordanita (Tremewania) notata (Zeller, 1847) | 2R-7-12, 2R-7-12+2S-7-12 2R-7-12+2R-9-14, 2R-7-12+2S-9-14 2R-2-12+2S-2-12 |
[63, 67, 68] [63, 68] [21] |
| Jordanita (Tremewania) splendens (Staudinger, 1887) | 2R-2-12+2S-2-12 | [20] |
| Jordanita (Jordanita) graeca (Jordan, 1907) | 2R-2-12+2S-2-12 | [18, 21] |
| Jordanita (Jordanita) globulariae (Hübner, 1793) | 2R-2-12+2S-2-12 | [18, 21, 23] |
| Jordanita (Praviela) anatolica (Naufock, 1929) | 2R-7-12+2S-7-12, 2R-7-12 2R-2-12, 2R-2-12+2S-2-12 |
[66] [26] |
| Jordanita (Praviela) rietzschi Keil, 2016 | 2R-2-12+2S-2-12 | [69] |
| Jordanita (Solaniterna) subsolana (Staudinger, 1862) | 2R-2-12, 2R-2-12+2S-2-12 | [21, 23, 26] |
| Jordanita (Rjabovia) horni (Alberti, 1937) | 2R-7-12+2S-7-12, 2R-7-12 | [65] |
| Goazrea lao Mollet, 2016 | 2R-2-12+2S-2-12, 2S-2-12 | [24] |
Таким образом, половые феромоны самок одного вида могут служить одновременно половыми аттрактантами для самцов других видов. Зная молекулярную структуру известных половых феромонов и половых аттрактантов Procridinae (принадлежность к классу сложных эфиров, образованных втор-бутиловым спиртом и высшей карбоновой кислотой с количеством атомов углерода 12 или 14), нами был осуществлен целенаправленный синтез следующих веществ:
1) втор-бутилового эфира додекановой (лауриновой) кислоты [71];
2) втор-бутилового эфира додеценовой кислоты [17, 18] и его R- и S-энантиомеров;
3) сложных эфиров втор-бутилового спирта и полиненасыщенных жирных кислот рыбьего жира (ClOil 135°) [19].
При этом мы также учитывали, что в известных половых феромонах Procridinae есть двойная связь в кислотном радикале и хиральный центр в спиртовом радикале.
Сравнительный полевой скрининг полученных соединений в природных биотопах и агробиоценозах показал, что R- и S-энантиомеры втор-бутилового эфира додеценовой кислоты (2R-2-12 и 2S-2-12 соответственно) по отдельности и/или в смеси (2R-2-12+2S-2-12) привлекают самцов почти двух десятков видов Procridinae (табл. 2). Высокая эффективность этих соединений как половых аттрактантов дала возможность обнаруживать виды с очень низкой плотностью популяций. В частности, были привлечены самцы Rhagades (Wiegelia) predotae (Naufock, 1930) в Испании [27], Rh. (Rh.) pruni в Испании и Турции [23, 27]. Кроме того, даже были открыты два новых для науки вида Jordanita (Praviela) rietzschi Keil, 2016 [69] и Goazrea lao Mollet, 2016 [24], обитающие в Иране и Лаосе, Таиланде. К сожалению, применение половых аттрактантов, привлекающих самцов, позволяет обнаружить только особей одного пола [27, 64, 72].
Анализ литературных данных и результатов наших собственных экспериментов показал, что для восприятия химической молекулы феромона/аттрактанта сенсорным аппаратом самцов Procridinae имеет значение наличие двойной связи в радикале жирной кислоты, хотя положение этой двойной связи может быть различно. Приведем несколько примеров.
1. 2R-2-12 и 2S-2-12 представляют собой сложные эфиры втор-бутилового спирта и моноеновой жирной кислоты с двенадцатью атомами углерода и двойной связью во втором положении. Похожие по строению сложные эфиры 2R-7-12 и 2S-7-12, но отличающиеся позицией двойной связи (у седьмого атома углерода), также являются половыми аттрактантами для некоторых видов Procridinae (табл. 2). В частности, и 2-12, и 7-12 привлекают самцов Illiberis (P.) pruni, Rhagades (Rh.) pruni, Adscita (Adscita) geryon (Hübner, 1813), Jordanita (Tremewania) notata (Zeller, 1847), Jordanita (Praviela) anatolica (Naufock, 1929). Вместе с тем проверка биологической активности сложного эфира втор-бутилового эфира и лауриновой (насыщенной) кислоты не выявила его аттрактивности в отношении представителей Procridinae, хотя это вещество привлекло самцов жука Tilloidea unifasciata (Fabricius, 1787) [71].
2. Половым феромоном самок Th. ampellophaga является 2R-7-14 с незначительными количествами 2S-7-14 [40]. Однако самцы этого вида демонстрируют характерное половое поведение и активно улавливаются адгезивными ловушками с искусственно синтезированными половыми аттрактантами: 2R-2-12+2S-2-12 [18, 28], 2R-2-12 [23], ClOil 135° [19]. Все сложные эфиры, как компоненты полового феромона, так и половых аттрактантов, имеют одинаковый спиртовой, но разные кислотные радикалы. Структурные вариации заключаются в длине углеводородного радикала кислоты, положении и количестве двойных связей в нем. Несмотря на это, все вышеперечисленные сложные эфиры обладают аттрактивными свойствами в отношении самцов Th. ampellophaga в отличие от втор-бутилдодеканоата.
Важно отметить, что обонятельные рецепторы самцов Procridinae проявляют разную чувствительность к оптическим изомерам аттрактивных молекул. Например, при одновременном тестировании в биотопе 2R-7-12 и 2S-7-12 самцы Adscita (Tarmannita) mannii (Lederer, 1853) преимущественно привлекаются к S-энантиомеру, тогда как самцы Jordanita (Tremewania) notata – к R-энантиомеру [67]. Более того, для самцов J. (T.) notatа присутствие 2S-7-12 в рацемической смеси 2R-7-12+2S-7-12, как и присутствие 2S-2-12 в рацемической смеси 2R-2-12+2S-2-12 не снижает аттрактивности соответствующих R-энантиомеров [21, 67]. Противоположная ситуация наблюдается у самцов Zygaenoprocris (Molletia) taftana (Alberti, 1939): 2R-7-12 активно привлекает самцов, а 2S-7-12 полностью подавляет привлекательность 2R-7-12 в равнокомпонентной смеси [65]. Частичное ингибирование действия полового аттрактанта вследствие присутствия S‑энантиомера показано у видов Harrisina americana (Guérin-Méneville, 1844) и Acoloithus falsarius Clemens, 1861, самцы которых значительно эффективнее отлавливаются ловушками с 2R-7-14 по сравнению с таковыми с 2R-7-14+2S-7-14 [60]. Виды I. (Р.) pruni и J. (S.) subsolana привлекаются преимущественно на 2R-2-12 [23, 25, 26], в то время как виды рода Rhagades – на 2S-2-12 [26, 27].
Таким образом, к структурным особенностям, определяющим биологическую активность известных аттрактивных молекул Procridinae, можно отнести наличие двойной связи в кислотном радикале и хирального центра в спиртовом радикале сложного эфира.
Половые феромоны и аттрактанты Zygaenidae в эволюционном аспекте
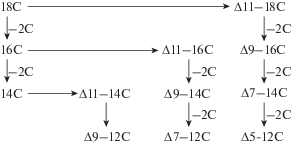
В последние годы бурное развитие молекулярной биологии позволило уточнить эволюционные взаимоотношения в отряде Lepidoptera [73], которые ранее анализировались только на основе данных морфологии и биологии. Исследования большого количества ядерных и митохондриальных генов, а также строения РНК дали возможность реконструировать филогению Lepidoptera с высокой достоверностью, что было отражено и в таксономии. Мы предприняли попытку сопоставить возможный ход эволюции половых феромонов у представителей семейства Zygaenidae и некоторых филогенетически близких к нему групп на основе современных данных о систематике Lepidoptera. Как было уже сказано выше, в семействе Zygaenidae известные к настоящему времени половые феромоны и аттрактанты представлены двумя типами соединений: сложными эфирами втор-бутилового спирта и жирных кислот и сложными эфирами уксусной кислоты и жирных спиртов. Первые характерны для подсемейства Procridinae (триба Procri-dini), вторые – для подсемейства zygaeninae (триба Zygaenini). В то же время можно наблюдать структурное сходство аттрактивных молекул Zygaenidae и других Lepidoptera. Оно заключается в аналогичности строения длинноцепочечных углеводородных радикалов сложных эфиров с тем лишь отличием, что у Procridinae – это кислотный радикал, а у Zygaeninae (и многих Lepidoptera) – спиртовой. Ряд авторов объясняют химико-структурное “однообразие” сигнальных молекул Lepidoptera особенностями биосинтеза компонентов половых феромонов и работой ферментов десатураз, что в свою очередь является отражением генетически детерминированных закономерностей, связанных с общим филогенетическим происхождением [3, 74–78]. В частности, работа фермента ∆11-десатуразы в комбинации с каскадом реакций укорочения жирных кислот на два атома углерода в процессе β-окисления позволила видам производить из стеариновой (С18) и пальмитиновой (С16) насыщенных кислот-предшественников различные ненасыщенные жирные кислоты, альдегиды и спирты. Эти кислоты и спирты могут образовывать сложные эфиры с втор-бутиловым спиртом и уксусной кислотой соответственно. Таким образом, почти все известные сочетания компонентов половых феромонов и аттрактантов Zygaenidae легко определяются из каскада указанных превращений путем ограничения стадий укорочения цепи (рис. 1).
Рис. 1.
Возможные пути биосинтеза мононенасыщенных компонентов половых феромонов Lepidoptera. Красным цветом выделены варианты длинноцепочечных углеводородных радикалов, известных в аттрактивных молекулах Zygaenidae.
Fig. 1. Possible biosynthetic pathways of monounsaturated sex pheromone components in Lepidoptera. Long-chain hydrocarbon radicals in attractant molecules of Zygaenidae are marked by red color.
Мы проанализировали имеющиеся данные о строении половых феромонов и аттрактантов как у Zygaenoidea, так и у систематически близких надсемейств Sesioidea и Cossoidea и взятого в качестве сестринской группы надсемейства Tortricoidea. Оказалось, что сложные эфиры уксусной кислоты и жирных спиртов являются половыми феромонами и аттрактантами как у представителей семейств Sesiidae (Sesioidea) и Cossidae (Cossoidea), так и Tortricidae (Tortricoidea) (http://www.pherobase.com) [1]. Следовательно, указанная группа соединений – эволюционно более древняя, чем сложные эфиры втор-бутилового спирта и жирных кислот. Эти данные позволяют с высокой долей вероятности говорить о том, что появление сложных эфиров втор-бутилового спирта и жирных кислот в качестве половых феромонов является апоморфным признаком трибы Procridini подсемейства Procridinae (в настоящее время строение аттрактивных молекул у Procridinae известно только для представителей этой трибы [21, 25, 27, 37, 40, 65, 67]). С другой стороны, наличие сложных эфиров уксусной кислоты и жирных спиртов как половых аттрактантов – это плезиоморфный признак, который характерен для подсемейства zygaeninae (Zygaenidae), а также семейств Sesiidae, Cossidae и Tortricidae (рис. 2).
Рис. 2.
Схема, отражающая эволюцию строения половых феромонов у Zygaenidae и некоторых других семейств Lepidoptera. Красным цветом изображены кислоты, черным – спирты; длинноцепочечные углеводородные радикалы обозначены линией, короткоцепочечные – квадратом. Зеленая ветвь на дендрограмме показывает подсемейство Procridinae, у которого феромонами являются сложные эфиры втор-бутилового спирта и жирных кислот (но не уксусной кислоты и жирных спиртов, как у всех других приведенных таксонов).
Fig. 2. A scheme showing the evolution of the structure of sex pheromones in Zygaenidae and some other families of Lepidoptera. Acids are marked by red, alcohols – by black; long-chain hydrocarbon radicals are marked by lines, short-chain radicals – by squares. Green branch of the dendrogram shows the subfamily Procridinae in which pheromones represented by 2-butanol and fatty acid esters (but not acetic acid and fatty alcohol esters, as in all the above-mentioned taxa).
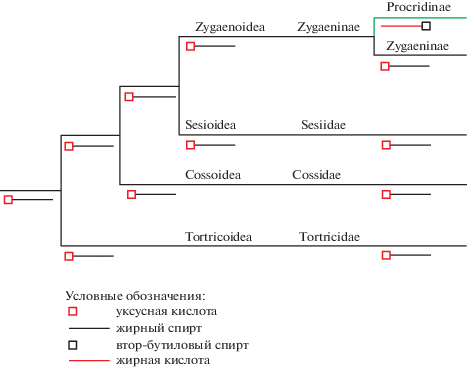
Внутри надсемейства Zygaenoidea в настоящее время половые феромоны и аттрактанты известны только для некоторых видов семейств Himantopteridae, Phaudidae и Limacodidae. Если у Himantopteridae это также сложные эфиры уксусной кислоты и жирных спиртов, то у Phaudidae и Limacodidae аттрактивные молекулы представлены жирными альдегидами и спиртами (http://www.pherobase.com) [1], которые по своей пространственной структуре напоминают сложные эфиры короткоцепочечных кислот и многоатомных спиртов. Иногда сходство конфигураций молекул альдегидных феромонов с длинным радикалом с эфирами жирных спиртов и, например, муравьиной кислоты, может приводить к ошибочному связыванию последних с обонятельными рецепторами самцов и вызывать у них даже более сильную физиологическую и поведенческую реакцию [79]. У некоторых видов рода Darna Walker, 1862 (Limacodidae) в качестве феромонов отмечены сложные эфиры метанола, бутанола и изобутанола (http://www.pherobase.com) [1], но производные втор-бутилового спирта отсутствуют.
Применение статистического анализа сходства и различия видов по компонентному составу половых феромонов показало таксономическую ценность этого признака для анализа филогенетических взаимоотношений и внутри семейств чешуекрылых [3, 5]. Например, было показано, что эволюция феромонных систем у видов семейства листоверток (Tortricidae) шла в направлении: 1) увеличения доли транс-изомеров веществ, 2) укорочения длины углеродной цепи с шестнадцати до двенадцати атомов [5]. У видов подсемейства Zygaeninae (семейство Zygaenidae) транс-изомеры 11E-14:Ac или 8E-12:Ac (табл. 1) появляются в качестве компонентов половых аттрактантов у видов из эволюционно более молодого подрода Zygaena (Zygaena) Fabricius, 1775. Эти виды образуют единый кластер, включающий близкие виды nevadensis-, transalpina- и filipendulae-групп [59]. В то же время самцы двух видов, принадлежащих к архаичным родам Reissita и Epizygaenella (табл. 1), чувствительны к сложным эфирам, содержащим 16-углеродный радикал с цис-изомерией (11Z-16:Ac). Хотя малая изученность феромонных/аттрактантных составов Zygaenidae осложняет анализ, тем не менее эти факты хорошо коррелируют с установленными ранее закономерностями в эволюции феромонных систем других семейств Lepidoptera.
Многие авторы склонны полагать, что химические сигналы могут играть значительную роль как в феромонной конкуренции внутри вида, так и в обеспечении репродуктивной изоляции между близкородственными таксонами и, как следствие, в видообразовании [51, 58, 80–84]. Гипотеза, подчеркивающая важность феромонной коммуникации в формировании предкопуляционных барьеров благодаря существованию видоспецифического запаха, находит подтверждение и среди Zygaenidae. Например, симпатрические популяции (в Японии, Китае, Корее) двух филогенетически близких видов одного рода и подрода Illiberis (Primilliberis) rotundata и I. (P.) pruni имеют перекрывающиеся периоды лёта. Особенности в строении гениталий этих видов не препятствуют межвидовому скрещиванию [85]. Более того, самцы обоих видов привлекаются смесью двух сложных эфиров 2R-7-12+2R-9-14 [42, 62]. Однако полевые испытания показали, что самцы I. (Р.) rotundata и I. (Р.) pruni неодинаково реагируют на разные количественные соотношения 2R-7-12 и 2R-9-14 в смесях. Определяющим является процентное содержание указанных эфиров в композиции: для самцов I. (Р.) rotundata – 30/50:100 соответственно, для самцов I. (Р.) pruni – 100:10. По нашим данным, самцы I. (Р.) pruni привлекались аттрактантом 2R‑2-12, в то время как самцы I. (Р.) rotundata не реагировали на это вещество [25]. Таким образом, видоспецифичность химического сигнала является важным изолирующим механизмом, препятствующим скрещиванию этих двух видов [86].
Все эти данные свидетельствуют о том, что молекулярная структура аттрактивных соединений может быть дополнительным признаком для анализа родственных отношений между таксонами и реконструкции эволюции Lepidoptera.
ЗАКЛЮЧЕНИЕ
Обзор имеющейся научной литературы по привлекающим молекулам Zygaenidae показывает, что вопросы химической коммуникации данного семейства изучены недостаточно, а структура половых феромонов и аттрактантов выяснена только для небольшого числа видов двух из пяти подсемейств, а именно: Procridinae и Zygaeninae. Если для Zygaeninae аттрактивной способностью обладают сложные эфиры уксусной кислоты и высших ненасыщенных спиртов, то для Procridinae – сложные эфиры втор-бутилового спирта и высших ненасыщенных карбоновых кислот. Длинноцепочечные углеводородные радикалы известных аттрактивных молекул содержат четное количество атомов углерода: 12, 14, 16. При этом данные радикалы являются непредельными в большинстве случаев.
Таким образом, в разных подсемействах Zygaenidae в качестве половых феромонов или аттрактантов представлены разные варианты сложных эфиров, тогда как в пределах одного подсемейства близкородственные виды используют уникальные соотношения сходных компонентов. Видоспецифичность химического сигнала определяется не только качественным, но и количественным составом феромонной/аттрактантной композиции, а различие феромонных систем служит важным дополнительным изолирующим механизмом, препятствующим межвидовому скрещиванию.
Список литературы
El-Sayed A.M. The Pherobase: database of pheromones and semiochemicals [Internet edition]. <http://www.pherobase.com> Accessed 18 (10)2019.
Ando T., Inomata S., Yamamoto M. Lepidopteran sex pheromones. Top. Curr. Chem. 239: 51–96. 2004. https://doi.org/10.1007/b95449
Гричанов И.Я., Овсянникова Е.И. Феромоны для фитосанитарного мониторинга вредных чешуекрылых. СПб.–Пушкин: ВИЗР РАСХН. 2005. [Grichanov I.Ya., Ovsyannikova E.I. Pheromones for phytosanitary monitoring of Lepidoptera pests. St. Petersburg–Pushkin: VIZR RAAS. 2005. (In Russ)].
Francke W., Schulz S. Pheromones of terrestrial invertebrates. Compr. Nat. Prod. II. 4: 153–224. 2010. https://doi.org/10.1016/b978-008045382-8.00095-2
Сафонкин А.Ф. Феромоны и филогенетические отношения в семействе листоверток (Lepidoptera, Tortricidae). Зоол. Журн. 86 (12): 1464–1467. 2007. [Safonkin A.F. Pheromones and phylogenetic relations of leafrollers (Lepidoptera, Tortricidae). Zool. Zh. 86 (12): 1464–1467. 2007. (In Russ)].
Karlson P., Lüscher M. “Pheromones”: a new term for a class of biologically active substances. Nature. 183 (4653): 55–56. 1959. https://doi.org/10.1038/183055a0
Subchev M. Sex pheromone communication in the family Zygaenidae (Insecta: Lepidoptera): a review. Acta Zool. Bulg. 66 (2): 147–157. 2014.
Efetov K.A. Inouela gen. n. from Japan and Taiwan (Lepidoptera: Zygaenidae, Chalcosiinae). Entomol. Gaz. 50 (2): 91–95. 1999.
Efetov K.A., Tarmann G.M. The hypothetical ground plan of the Zygaenidae, with a review of the possible autapomorphies of the Procridinae and the description of the Inouelinae subfam. nov. J. Lep. Soc. 71 (1): 20–49. 2017. https://doi.org/10.18473/lepi.v71i1.a5
Efetov K.A. The description of the female of Illiberis (Alterasvenia) yuennanensis Alberti, 1951 (Lepidoptera: Zygaenidae, Procridinae). Entomol. Gaz. 47 (2): 111–113. 1996.
Efetov K.A., Tarmann G.M. Illiberis (Alterasvenia) cernyi sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from northern Thailand. Entomol. Gaz. 64 (1): 33–39. 2013.
Efetov K.A., Tarmann G.M. Chrysartona (Chrystarmanna) mineti sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from northern Vietnam. Entomol. Gaz. 64 (3): 197–206. 2013.
Efetov K.A., Tarmann G.M. Illiberis (Alterasvenia) banmauka sp. nov. (Lepidoptera: Zygaenidae, Procridinae) from China and Myanmar. Entomol. Gaz. 65 (1): 62–70. 2014.
Efetov K.A., Tarmann G.M. A new European species, Adscita dujardini sp. nov. (Lepidoptera: Zygaenidae, Procridinae) confirmed by DNA analysis. Entomol. Gaz. 65 (3): 179–200. 2014.
Efetov K.A., Tarmann G.M. Pseudophacusa multidentata Efetov & Tarmann, a new genus and species of Procridini from Myanmar, China and Laos (Lepidoptera: Zygaenidae, Procridinae). SHILAP Revta. Lepid. 44 (173): 81–89. 2016.
Efetov K.A., Tarmann G.M. Thibetana keili Efetov & Tarmann, a new species of the genus Thibetana Efetov & Tarmann, 1995, from Tibet (Lepidoptera: Zygaenidae, Procridinae, Artonini). SHILAP Revta. Lepid. 45 (180): 581–587. 2017.
Ефетов К.А., Баевский М.Ю., Бекетов А.А., Паршкова Е.В., Поддубов А.И. Синтез втор-бутилдодецен-2-оата, возможного аттрактанта представителей подсемейства Procridinae (Lepidoptera: Zygaenidae). ТМБВ. 16 (4): 53–57. 2013. [Efetov K.A., Baevsky M.Y., Beketov A.A., Parshkova E.V., Poddubov A.I. Synthesis of 2-butyl 2-dodecenoate, a possible sex attractant for the species of the subfamily Procridinae (Lepidoptera: Zygaenidae). Tavricheskiy Mediko-biologicheskiy Vestnik. 16 (4): 53–57. 2013. (In Russ)].
Ефетов К.А., Паршкова Е.В., Баевский М.Ю., Поддубов А.И. Сложный эфир бутанола-2 и додеценовой кислоты: синтез и аттрактивные свойства. Укр. Биохим. Журн. 86 (6): 175–182. 2014. [Efetov K.A., Parshkova E.V., Baevsky M.Y., Poddubov A.I. Sec-butyl ester of dodecenoate: synthesis and attractive properties. Ukr. Biochem. J. 86 (6): 175–182. 2014. (In Russ)]. https://doi.org/10.15407/ubj86.06.175
Ефетов К.А., Кучеренко Е.Е., Паршкова Е.В. Использование рыбьего жира как источника полиненасыщенных жирных кислот для получения полового аттрактанта Procridinae (Lepidoptera: Zygaenidae). ТМБВ. 19 (1): 34–39. 2016. [Efetov K.A., Kucherenko E.E., Parshkova E.V. The application of cod-liver oil, as a source of polyunsaturated fatty acids, for the synthesis of Procridinae sex attractant (Lepidoptera: Zygaenidae) // Tavricheskiy Mediko-biologicheskiy Vestnik. 19 (1): 34–39. 2016. (In Russ)].
Ефетов К.А., Кучеренко Е.Е., Дессе Ж.-М. Половой аттрактант Adscita (Procriterna) subtristis и Jordanita (Tremewania) splendens (Lepidoptera: Zygaenidae, Procridinae). КЖЭКМ. 6 (2): 33–36. 2016. [Efetov K.A., Kucherenko E.E., Desse J.-M. Sex attractant for Adscita (Procriterna) subtristis и Jordanita (Tremewania) splendens (Lepidoptera: Zygaenidae, Procridinae). Crimean Journal of Experimental and Clinical Medicine. 6 (2): 33–36. 2016. (In Russ)].
Efetov K.A., Kucherenko E.E., Parshkova E.V., Tarmann G.M. 2-butyl 2-dodecenoate, a new sex attractant for Jordanita (Tremewania) notata (Zeller, 1847) and some other Procridinae species (Lepidoptera: Zygaenidae). SHILAP Revta Lepid. 44 (175): 519–527. 2016.
Ефетов К.А., Горбунов О.Г. Привлечение самцов Adscita statices (Linnaeus, 1758) (Lepidoptera: Zygaenidae, Procridinae) к синтетическому половому аттрактанту в Московской области. ТМБВ. 19(3): 40–46. 2016. [Efetov K.A., Gorbunov O.G. Attraction of the males of Adscita statices (Linnaeus, 1758) (Lepidoptera: Zygaenidae, Procridinae) by synthetic sex attractant in Moscow Region. Tavricheskiy Mediko-biologicheskiy Vestnik. 19 (3): 40–46. 2016. (In Russ)].
Can Cengiz F., Efetov K.A., Kaya K., Kucherenko E.E., Okyar Z., Tarmann G.M. Zygaenidae (Lepidoptera) of Thrace Region of Turkey. Nota Lepi. 41 (1): 23–36. 2018. https://doi.org/10.3897/nl.41.21065
Efetov K.A., Mollet B., Kucherenko E.E. A discovery of the new genus and new species Goazrea lao Mollet, 2016 (Zygaenidae, Procridinae) in Laos and Thailand with the help of newly synthesized substances EFETOV-2 and EFETOV-S-S-2. Abstracts of the XVI. International Symposium on Zygaenidae (1–5 May 2018, İzmir –Turkey). İzmir. 2018.
Efetov K.A., Koshio C., Kucherenko E.E. A new synthetic sex attractant for males of Illiberis (Primilliberis) pruni Dyar, 1905 (Lepidoptera: Zygaenidae, Procridinae). SHILAP Revta. Lepid. 46 (182): 263–270. 2018.
Can F., Efetov K.A., Burman J., Kaya K., Kucherenko E.E., Ulaşlı B., Tarmann G.M. A study of the Zygaenidae (Lepidoptera) fauna of Central Anatolia, Turkey. Turk. J. Entomol. 43 (2):189–199. 2019. https://doi.org/10.16970/entoted.512580
Efetov K.A., Kucherenko E.E., Tarmann G.M. New synthetic sex attractants for the males of two endemic Iberian Procridinae species (Lepidoptera: Zygaenidae). SHILAP Revta. Lepid. 47 (186): 307–315. 2019.
Vrenozi B., Toshova T.B., Efetov K.A., Kucherenko E.E., Rredhi A., Tarmann G.M. The first well-documented record of the vine bud moth Theresimima ampellophaga (Bayle-Barelle, 1808) in Albania established by field screening of sex pheromone and sex attractant traps (Lepidoptera: Zygaenidae, Procridinae). SHILAP Revta Lepid. 47 (187): 567–576. 2019.
Джекобсон М. Половые феромоны насекомых. М.: Мир. 1976. [Jacobson M. Insect sex pheromones. New York and London: Academic Press. 1972. (Russ. Ed. Jacobson M. Polovyye feromony nasekomykh. Moscow: Mir. 1976)].
Efetov K. A. A review of the Western Palaearctic Procridinae (Lepidoptera: Zygaenidae). Simferopol: CSMU Press. 2001.
Долидзе Г.В., Ахаладзе Ц.Л., Татишвили Д., Маруаш-вили М.В., Шаламберидзе Н.Ш. Секс-ловушки как возможное средство борьбы с вредителями виноградной лозы и плодовых культур. Уч. зап. Тартуского гос. ун-та. 545: 88–90. 1980. [Dolidze G.V., Akhaladze Ts.L., Tatishvili D., Maruashvili M.V., Shalamberidze N.Sh. Sex-traps as a means of grape and fruit pest control. Acta et commentationes universitatis Tartuensis. 545: 88–90. 1980. (In Russ)].
Tanaka Y., Koshio C. Activity pattern and reproductive behavior of the plum moth Illiberis rotundata Jordan (Lepidoptera: Zygaenidae: Procridinae). Jap. J. Entomol. (N.S.). 5: 70–80. 2002.
Koshio C., Hidaka T. Reproductive behaviour of the white-tailed zygaenid moth, Elcysma westwoodii (Lepidoptera, Zygaenidae) I. Mating sequence. J. Ethol. 13 (2): 159–163. 1995. https://doi.org/10.1007/BF02350107
Zagatti P., Renou M. Les pheromones sexuelles des zygènes. Le comportement de Zygaena filipendulae L. (Lepidoptera, Zygaenidae). Ann. Soc. Entomol. Fr. 20 (4): 439–454. 1984.
Tremewan W.G. Ecology, phenotypes and the Mendelian genetics of Burnet moths (Zygaena Fabricius, 1775). Wallingford: Gem Publishing Company. 2006.
Hofmann A., Kia-Hofmann T. Experiments and observations on pheromone attraction and mating in burnet moths (Zygaena Fabricius, 1775) (Lepidoptera: Zygaenidae). Entomol. Gaz. 61 (2): 83–93. 2010.
Myerson J., Haddon W.F., Soderstrom E.L. Sec-butyl (Z)-7-tetradecenoate. A novel sex pheromone component from the western grapeleaf sceletonizer, Harrisina brillians. Tetrahedron Lett. 23 (27): 2757–2760. 1982.
Soderstrom E.L., Brandl D.G., Myerson J., Buttery R.G., Mackey A.E. Sex pheromone for attracting western grapeleaf skeletonizer (Lepidoptera: Zygaenidae). J. Econ. Entomol. 78(4): 799–801. 1985. https://doi.org/10.1093/jee/78.4.799
Li D., Li J., Li L. Studies on the sex pheromone of the pear leaf borer, Illiberis pruni Dyar I –identification of sex pheromone. J. Shanxi Agr. Sci. 25: 63–66. 1997.
Subchev M., Harizanov A., Francke W., Franke S., Plass E., Reckziegel A., Schröder F., Pickett J.A., Wadhams L.J., Woodcock C.M. Sex pheromone of female vine bud moth. Theresimima ampellophaga comprises (2S)-butyl (7Z)-tetradecenoate. J. Chem. Ecol. 24 (7): 1141–1151. 1998; J. Chem. Ecol. 25(5): 1203. 1999; erratum, i.e. corrected to (2R)-butyl (7Z)-tetradecenoate. https://doi.org/10.1023/A:1022438717287
Subchev M., Toshova T., Koshio C., Franke S., Tröger A., Twele R., Francke W., Pickett J.A., Wadhams L.J., Woodcock C.M. Identification and biological activity of sex pheromone components from females of the plum moth Illiberis rotundata Jordan (Lepidoptera: Zygaenidae: Procridinae). Chemoecology. 19 (1): 47–54. 2009. https://doi.org/10.1007/s00049-009-0008-8
Subchev M.A., Koshio C., Toshova T.B., Efetov K.A. Illiberis (Primilliberis) rotundata Jordan (Lepidoptera: Zygaenidae: Procridinae) male sex attractant: Optimization and use for seasonal monitoring. Entomol. Sci. 15: 137–139. 2012. https://doi.org/10.1111/j.1479-8298.2011.00485.x
Zheng X.-L., Liu J.-Y., Zhang Z.-L., Wang P., Lu W. Diel rhythms of sexual behavior and pheromone responses in Phauda flammans Walker (Lepidoptera: Zygaenidae). Pest Manag. Sci. 75(11): 3070–3075. 2019. https://doi.org/10.1002/ps.5423
Efetov K.A., Hofmann A., Tarmann G.M., Tremewan W.G. Taxonomic comments on the treatment of the Zygaenidae (Lepidoptera) in volume 3 of Moths of Europe, Zygaenids, Pyralids 1 and Brachodids (2012). Nota Lepi. 37 (2): 123–133. 2014. https://doi.org/10.3897/nl.37.7871
Naumann C.M., Tarmann G.M., Tremewan W.G. The Western Palaearctic Zygaenidae (Lepidoptera). Stenstrup: Apollo Books. 1999.
Toshova T.B., Subchev M.A., Tóth M. Role of olfactory and visual stimuli in the mating behaviour of male vine bud moths, Theresimima ampellophaga (Lepidoptera: Zygaenidae). Eur. J. Entomol. 104: 57–65. 2007. https://doi.org/10.14411/eje.2007.009
Efetov K.A. Zygaena (Agrumenia) sedi cimmerica Efetov, a new subspecies from the Crimea (Lepidoptera: Zygaenidae, Zygaeninae). SHILAP Revta. Lepid. 46 (182): 347–351. 2018.
Князев С.А., Ефетов К.А., Пономарёв К.Б. Пестрянки (Lepidoptera, Zygaenidae) Омской области. Зоол. журн. 94 (11): 1297–1302. 2015. [Knyazev S.A., Efetov K.A., Ponomaryov K.B. Zygaenidae (Lepidoptera) from Omsk Region. Zool. Zh. 94 (11): 1297–1302. 2015. (In Russ)].
Назаров В.В., Ефетов К.А. Участие пестрянок (Lepidoptera, Zygaenidae) Крыма в опылении орхидеи Anacamptis pyramidalis (Orchidaceae). Зоол. Журн. 72 (10): 54–67. 1993. [Nazarov V.V., Efetov K.A. On the role of Zygaenidae (Lepidoptera) in pollination of Anacamptis pyramidalis (Orchidaceae). Zool. Zh. 72 (10): 54–67. 1993. (In Russ)].
Benz G., von Salis G. Use of synthetic sex attractant of Larch bud moth Zeiraphera diniana (Gn.) in monitoring traps under different conditions, and antagonistic action of cis-isomer. Experientia. 29 (6): 729–730. 1973. https://doi.org/10.1007/BF01944802
Hrdy I., Marek J., Krampl F. Sexual pheromone activity of 8-dodecenyl and 11-tetradecenyl acetates for males of several lepidopteran species in field trials. Acta Entomol. Bohemoslov. 76: 65–84. 1979.
Decamps C., du Merle P., Gourio C., Luquet G. Attraction d’espèces du genre Zygaena F. Par des substances pheromonales de tordeuses (Lepidoptera, Zygaenidae et Tortricidae). Ann. Soc. Entomol. Fr. (N. S.). 17 (4): 441–447. 1981.
Priesner E., Naumann C., Stertenbrink J. Specificity of synthetic sex-attractants in Zygaena moths. Z. Naturforsch. 39 (7–8): 841–844. 1984. https://doi.org/10.1515/znc-1984-7-826
Toshova T., Subchev M., Yano T., Koshio C., Horie K. Calling behaviour of Zygaena niphona Butler, 1887 females and male electroantennographic response to synthetic pheromone compounds. Abstracts of the XI International Symposium on Zygaenidae (Lepidoptera) (Sofia, 17–21 September 2008). Sofia. 2008.
Oleander A., Thackery D., Burman J. The effect of exposure to synthetic pheromone lures on male Zygaena filipendulae mating behaviour: implications for monitoring species of conservation interest. J. Insect Conserv. 19 (3): 539–546. 2015. https://doi.org/10.1007/s10841-015-9775-4
Thackery D., Burman J. The effect of synthetic pheromone exposure on female oviposition and male longevity in Zygaena filipendulae (Linnaeus, 1758) (Lepidoptera: Zygaenidae, Zygaeninae). Entomol. Gaz. 67 (4): 249–256. 2016.
Hrdy I., Liska J., Vrkoc J., Hochmut R. New records on sex attractants for males and faunistic comments on moth (Lepidoptera) from Czechoslovakia. Acta Entomol. Bohemoslov. 86 (4): 252–268. 1989.
Гричанов И.Я., Булыгинская М.А., Букзеева О.Н., Законникова К.В., Овсянникова Е.И. Эколого-географическая изменчивость видоспецифичности половых аттрактантов чешуекрылых. Экология. 5: 377–380. 1995. [Grichanov I.Ya, Bulyginskaya M.A., Bukzeeva O.N., Zakonnikova K.V., Ovsyannikova E.I. Ecogeographical variation of species specificity of the artificial sex attractants of Lepidoptera. Russian J. Ecol. 26 (5): 349–352. 1995. (In Russ)].
Hofmann A.F., Tremewan W.G. The natural history of burnet moths (Zygaena Fabricius, 1775) (Lepidoptera: Zygaenidae). Part 1. Munich: Museum Witt. 2017. https://doi.org/10.3897/alpento.1.22129
Landolt P.J., Heath R.R., Sonnet P.E., Matsumoto K. Attraction of Harrisina americana and Acoloithus falsarius males (Lepidoptera: Zygaenidae) to R-(–) -2-butyl-(Z)-tetradecenoate. Environ. Entomol. 15 (4): 959–962. 1986. https://doi.org/10.1093/ee/15.4.959
Landolt P.J., Heath R.R., Tarmann G. Zygaenidae trapped with enantiomers of 2-butyl (Z)-7-tetradecenoate. J. Lepid. Soc. 45 (1): 63–65. 1991.
Subchev M., Toshova T., Koshio C., Efetov K. A., Francke W. (2R)-butyl (7Z)-dodecenoate, a main sex pheromone component of Illiberis (Primilliberis) pruni Dyar (Lepidoptera: Zygaenidae: Procridinae)?. Acta Zool. Bulg. 65 (3): 391–396. 2013.
Subchev M., Efetov K.A., Toshova T., Parshkova E.V., Tóth M., Francke W. New sex attractants for species of the zygaenid subfamily Procridinae (Lepidoptera: Zygaenidae). Entomol. Gen. 32 (4): 243–250. 2010.
Efetov K.A., Hofmann A., Tarmann G.M. Application of two molecular approaches (use of sex attractants and DNA barcoding) allowed to rediscover Zygaenoprocris eberti (Alberti, 1968) (Lepidoptera, Zygaenidae, Procridinae), hitherto known only from the female holotype. Nota Lepi. 37 (2): 151–160. 2014. https://doi.org/10.3897/nl.37.7871
Efetov K.A., Subchev M.A., Toshova T.B., Kiselev V.M. Attraction of Zygaenoprocris taftana (Alberti, 1939) and Jordanita horni (Alberti, 1937) (Lepidoptera: Zygaenidae, Procridinae) by synthetic sex pheromones in Armenia. Entomol. Gaz. 62 (2): 113–121. 2011.
Efetov K.A., Can F., Toshova T.B., Subchev M. New sex attractant for Jordanita anatolica (Naufock) (Lepidoptera: Zygaenidae: Procridinae). Acta Zool. Bulg. 62 (3): 315–319. 2010.
Efetov K.A., Tarmann G.M., Toshova T.B., Subchev M.A. Enantiomers of 2-butyl 7Z-dodecenoate are sex attractants for males of Adscita mannii (Lederer, 1853), A. geryon (Hübner, 1813), and Jordanita notata (Zeller, 1847) (Lepidoptera: Zygaenidae, Procridinae) in Italy. Nota Lepi. 38 (2): 161–169. 2015. https://doi.org/10.3897/nl.38.6312
Razov J., Efetov K.A., Franin K., Toshova T.B., Subchev M.A. The application of sex pheromone traps for recording the Procridinae fauna (Lepidoptera: Zygaenidae) in Croatia. Entomol. Gaz. 68 (1): 49–53. 2017.
Keil T. Eine neue Grünwidderchen-Art aus der iranischen Provinz Kerman (Lepidoptera, Zygaenidae, Procridinae). Entomol. Nachr. Ber. 60 (3/4): 201–203. 2016.
Efetov K.A., Tarmann G.M. A checklist of the Palaearctic Procridinae (Lepidoptera: Zygaenidae). Simferopol, Innsbruck: CSMU Press, Nata. 2012.
Ефетов К.А., Бекетов А.А., Паршиков В.А. Синтез и биологическая активность вторичного бутилового эфира лауриновой кислоты. ТМБВ. 15 (1): 345–347. 2012. [Efetov K.A., Beketov A.A., Parshikov V.A. Synthesis and biological activity of lauric acid sec-butyl ester. Tavricheskiy Mediko-biologicheskiy Vestnik. 15 (1): 345–347. 2012. (In Russ)].
Gorbunov O.G., Efetov K.A. The clearwing moth genus Bembecia Hübner 1819 [“1816”] (Lepidoptera, Sesiidae) in Crimea, with the description of a new species. Zool. Zh. 97 (7): 812–839. 2018.
Kawahara A.Y., Plotkin D., Espeland M., Meusemann K., Toussaint E.F.A., Donath A., Gimnich F., Frandsen P.B., Zwick A., dos Reis M., Barber J.R., Peters R.S., Liu S., Zhou X., Mayer C., Podsiadlowski L., Storer C., Yack J.E., Misof B., Breinholt J.W. Phylogenomics reveals the evolutionary timing and pattern of butterflies and moths. PNAS. 116 (45): 22657–22663. 2019. https://doi.org/10.1073/pnas.1907847116
Roelofs W.L. Chemistry of sex attraction. PNAS. 92 (1): 44–49. 1995. https://doi.org/10.1073/pnas.92.1.44
Tillman J.A., Seybold S.J., Jurenka R.A., Blomquist G.J. Insect pheromones –an overview of biosynthesis and endocrine regulation. Insect Biochem. Mol. Biol. 29: 481–514. 1999. https://doi.org/10.1016/s0965-1748(99)00016-8
Roelofs W.L., Rooney A.P. Molecular genetics and evolution of pheromone biosynthesis in Lepidoptera. PNAS. 100 (16): 9179–9184. 2003. https://doi.org/10.1073/pnas.1233767100a
Blomquist G.J., Vogt R.G. Insect pheromone biochemistry and molecular biology: the biosynthesis and detection of pheromones and plant volatiles. London: Elsevier Academic Press. 2003.
Byers J.A. Pheromone component patterns of moth evolution revealed by computer analysis of the Pherolist. J. Anim. Ecol. 75 (2): 399–407. 2006. https://doi.org/10.1111/j.1365-2656.2006.01060.x
Xu P., Garczynski S.F., Atungulu E., Syed Z., Choo Y.-M., Vidal D.M., Zitelli C.H.L., Leal W.S. Moth sex pheromone receptors and deceitful parapheromones. PLoS ONE. 7 (7): e41653. 2012. https://doi.org/10.1371/journal.pone.0041653
Löfstedt C. Population variation and genetic control of pheromone communication systems in moth. Entomol. Exp. Appl. 54: 199–218. 1990. https://doi.org/10.1111/j.1570-7458.1990.tb01331.x
Löfstedt C. Moth pheromone genetics and evolution. Philos. Trans. R. Soc. B. 340(1292): 167–177. 1993.
Groot A. T., Schofl G., Inglis O., Donnerhacke S., Classen A., Schmalz A., Santangelo R. G., Emerson J., Gould F., Schal C., Heckel D. G. Within-population variability in a moth sex pheromone blend: genetic basis and behavioural consequences. Proc. R. Soc. B. 281: 20133054. 2014. https://doi.org/10.1098/rspb.2013.3054
Суров А.В., Мальцев А.Н. Анализ химической коммуникации млекопитающих: зоологический и экологический аспекты. Зоол. журн. 95 (12): 1449–1458. 2016. [Surov A.V., Maltsev A.N. Analysis of chemical communication in mammals: zoological and ecological aspects. Zool. Zh. 95 (12): 1449–1458. 2016. (In Russ)].
Wyatt T.D. Pheromones and animal behavior: chemical signals and signatures. Cambridge: Cambridge University Press. 2014. https://doi.org/10.1017/CBO9781139030748
Efetov K.A. The Zygaenidae (Lepidoptera) of the Crimea and other regions of Eurasia. Simferopol: CSMU Press. 2005.
Subchev M.A., Efetov K.A., Toshova T.B., Koshio C. Sex pheromones as isolating mechanisms in two closely related Illiberis species –I. (Primilliberis) rotundata Jordan, 1907, and I. (P.) pruni Dyar, 1905 (Lepidoptera: Zygaenidae, Procridinae). Entomol. Gaz. 67 (1): 51–57. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


