Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 399-410
АКТИВНОСТЬ ОКСИДОРЕДУКТАЗ В ОКСИФИЛЬНЫХ ТКАНЯХ МОРСКОГО ЕРША SCORPAENA PORCUS LINNAEUS, 1758 ПРИ КРАТКОСРОЧНОЙ СЕРОВОДОРОДНОЙ НАГРУЗКЕ
Е. Э. Колесникова 1, *, И. В. Головина 1
1 ФГБУН ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН”
Севастополь, Россия
* E-mail: dr-kolesnikova@mail.ru
Поступила в редакцию 16.04.2020
После доработки 20.05.2020
Принята к публикации 26.05.2020
Аннотация
Сероводород способен оказывать токсическое действие и выполнять функции сигнальной молекулы в физиологических процессах. В условиях экспериментальной сероводородной нагрузки (СН) изучали активность оксидоредуктаз: малатдегидрогеназы (МДГ, 1.1.1.37), лактатдегидрогеназы (ЛДГ, 1.1.1.27) и каталазы (1.11.1.6) в оксифильных тканях (отделы мозга, камеры сердца, жаберные дуги) черноморской скорпены. Две группы рыб в течение 5 мин подвергли экспозиции к различным концентрациям сульфида натрия (37 и 75 мкМ Na2S), использованного в качестве донора сероводорода. Установлена высокая активность МДГ и ЛДГ в структурах мозга и камерах сердца скорпены, отражающая сходный энергетический потенциал этих тканей; высокая активность ЛДГ в мозге свидетельствовала об “анаэробизации” путей энергетического метаболизма. Обнаружено различие в активности оксидоредуктаз между первой и четвертой жаберными дугами, предсердием и желудочком сердца, а также отделами мозга. При СН отмечались признаки возникновения гипоксемии (нарастающее потемнение ламелл с увеличением концентрации Na2S) и метаболической депрессии в жаберной ткани скорпены. СН в низкой концентрации не вызывала существенных изменений активности ферментов энергетического метаболизма в тканях мозга и сердца, при двукратном увеличении СН изменения были более выражены. Интенсивная СН в ключевых оксифильных структурах (передние отделы мозга, желудочек сердца) приводила к одновременному увеличению активности ЛДГ и МДГ, что определялось способностью МДГ участвовать в анаэробных процессах. Менее О2-чувствительные отделы – продолговатый мозг и предсердие – почти не выказывали реакции МДГ и ЛДГ даже на СН высокой интенсивности, что предполагает для них иной режим энергетического метаболизма. Под воздействием интенсивной СН оксидоредуктазы энергетического метаболизма в желудочках сердца, передних отделах мозга демонстрировали реакцию, сходную с процессами при гипоксии/аноксии.
ВВЕДЕНИЕ
Сероводород (Н2S) известен как газообразное соединение, которое в естественных условиях активно образуется в морских отложениях [1]. Н2S способен оказывать токсическое действие на аэробные организмы, которое проявляется в первую очередь нарушением дыхательной функции, ограничением переноса кислорода (О2) и ингибированием цитохром с-оксидазы (цитохром с-кислород-оксидоредуктазы, цитохрома aa3 или комплекса IV митохондриальной дыхательной цепи, СОХ), что препятствует аэробному пути производства энергии [2, 3]. Вместе с тем, помимо токсической функции, Н2S выполняет роль сигнальной молекулы в широком спектре физиологических процессов [4].
Адаптивные возможности живых организмов в водной среде с постоянно варьирующим уровнем О2 (PwO2) и периодически возникающими эпизодами гипоксии/аноксии в значительной степени зависят от эффективности взаимодействия аэробного и анаэробного путей энергетического метаболизма. Оксидоредуктазы – малатдегидрогеназа (L‑малат: НАД-оксиредуктаза; МДГ, 1.1.1.37) и лактатдегидрогеназа (лактат: НАД-оксидоредуктаза; ЛДГ, 1.1.1.27) – прямо или косвенно вовлекаются в производство энергии и регулируют уровень окислительно-восстановительного потенциала клетки, важнейшего фактора клеточного гомеостаза. Активности МДГ и ЛДГ служат маркерами гликолитической и окислительной емкости энергетического метаболизма, а соотношение МДГ/ЛДГ указывает на направление метаболической стратегии целого организма. Каталаза (Н2О2 : Н2О2-оксидоредуктаза; 1.11.1.6) поддерживает дисмутацию пероксида (Н2О2), продукта побочных реакций в дыхательной цепи митохондрий при восстановлении О2 в воду и кислород, одновременно проявляя два вида активности, которые необходимы для защиты организма от генерируемой клеткой Н2О2 и обусловливают специфические окислительные процессы с участием перекиси, приводящие к образованию важных метаболитов с медиаторной функцией [5]. Кроме того, каталаза может осуществлять роль сульфид оксидазы, метаболизируя сходные с АФК активные формы сульфидов [5].
Характерной особенностью оксифильных тканей являются функционально оправданные высокие энергетические потребности, которые покрываются преимущественно за счет аэробного синтеза макроэргов с наибольшим суммарным энергетическим выходом.
Ткани мозга составляют 0.1–1% от массы тела большинства позвоночных, однако на их долю приходится приблизительно 1.5–8.5% от общего потребления энергии в организме эндотермных позвоночных; у эктотермных позвоночных, к которым относятся костистые рыбы, обнаруживается сопоставимый диапазон потребления энергии в пределах 2.7–3.4% [6]. Большая часть (около 80%) расхода энергии в клетках серого вещества мозга связана с глутаматергической передачей сигнала между нервными клетками.
Клетки сердечной мышцы также нуждаются в непрерывном снабжении АТФ. Высвобождающаяся в результате гидролиза АТФ энергия используется кардиомиоцитами для осуществления сокращений и поддержания внутриклеточного баланса ионов [7]; в клетках миокарда запас АТФ ограничен настолько, что может обеспечить лишь незначительное количество сокращений в течение нескольких секунд.
Жаберный эпителий рыб выделяется большим разнообразием типов клеток и осуществляемых физиологических функций. Жабры являются основным органом газообмена и рефлексогенной зоной, играют важную роль в поддержании ионного и осмотического баланса, отвечают за выведение азотистых соединений [8]. За исключением обмена воды, О2 и СО2 жаберной тканью, обеспечиваемых простой диффузией, все другие внутритканевые физиологические процессы требуют такого уровня метаболической активности, который превосходит остальные ткани костистых рыб.
Известно, что между производством/потреблением H2S и O2 в живом организме зачастую наблюдают реципроктную взаимосвязь, определяющую характер физиологических эффектов H2S и гипоксии [5]. Черноморская скорпена, или морской ерш, – донный хищник-засадчик – отличается особой устойчивостью к действию ряда стрессорных факторов, включая условия гипоксии/аноксии. Особый интерес представляет установление особенностей биохимической стратегии поддержания энергетического метаболизма оксифильными тканями скорпены с учетом специфических функций Н2S. В настоящей работе изучали активность оксидоредуктаз – МДГ, ЛДГ и каталазы – в оксифильных тканях скорпены при кратковременной сероводородной нагрузке.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служили половозрелые особи Scorpaena porcus Linnaeus, 1758 в нерестовый период (17 экз., длина тела – 12–17 см, вес – 70–130 г). S. porcus отлавливали в июле–августе 2019 г. ставным неводом и доставляли в лабораторию в пластиковых баках объемом 60 л с принудительной аэрацией. Для снятия стресса после отлова и транспортировки скорпену содержали одну неделю в проточном аквариуме, температура воды в котором была как в море (21–23°С), в работе использовали только подвижных и активно питающихся особей.
Экспериментальные группы рыб в течение 5 мин подвергли экспозиции в открытых стеклянных емкостях к двум концентрациям сульфида натрия (37 и 75 мкМ Na2S соответственно) [9], используемого в качестве донора H2S. Ни одна скорпена не подвергалась экспозиции более, чем к одной концентрации Na2S.
Препарирование тканей, гомогенизацию и центрифугирование проводили при охлаждении (0 ± 4°С). Ткани для исследования брали сразу после декапитации рыб и хранили до анализа при температуре –80°С в морозильной камере (Farma 900 Series, TermoScientific, USA). Образцы мозга разделяли на две части: продолговатый мозг (далее – М1), средний, передний и промежуточный (далее – М2). Мозжечок экстирпировали и не учитывали в исследовании в связи с его отдельной, сложной функцией (рис. 1a). Сердце разделяли на предсердие (СП) и желудочек (СЖ) (рис. 1b). Отдельно препарировали жаберные лепестки первой (1Ж) и четвертой (4Ж) жаберных дуг (рис. 2).
Рис. 1.
Отделы мозга (a, дорсальная поверхность) и сердца (b, вентральная поверхность) Scorpaena porcus. 1 – продолговатый мозг; 2 – мозжечок; 3 – средний мозг; 4 – передний мозг; 5 – обонятельные доли переднего мозга; 6 – спинной мозг; IX – языкоглоточный черепно-мозговой нерв, иннервирующий первую жаберную дугу; X – блуждающей черепно-мозговой нерв; 7 – предсердие; 8 – желудочек; 9 – луковица аорты; 10 – венозный синус.
Fig. 1. Compartments of the brain (a, dorsal view) and heart (b, ventral view) in Scorpaena porcus. 1 – medulla oblongata; 2 – cerebellum; 3 – midbrain; 4 – forebrain; 5 – olfactory lobes of the forebrain; 6 – spinal cord; IX – glossopharyngeal nerve; X – vagus nerve; 7 – heart atrium; 8 – heart ventricle; 9 – bulbus arteriosus; 10 – sinus venosus.
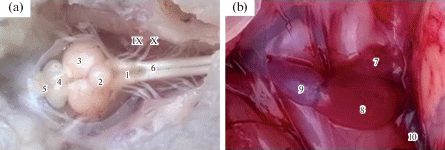
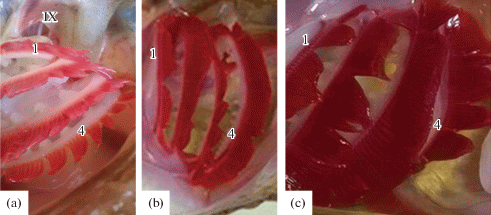
Рис. 2.
Цвет ламелл жаберного аппарата Scorpaena porcus при сероводородной нагрузке: a – контроль; b – 37 мкМ Na2S; c – 75 мкМ Na2S. 1 – первая жаберная дуга; 4 – четвертая жаберная дуга; IX – языкоглоточный черепно-мозговой нерв, иннервирующий первую жаберную дугу.
Fig. 2. Coloration of the branchial lamellae in the gills of Scorpaena porcus under hydrogen sulfide loading: a – control; b – 37 μМ Na2S; c – 75 μМ Na2S. 1 – first branchial arch; 4 – fourth branchial arch; IX – glossopharyngeal cranial nerve which innervates first branchial arch.
Активность цитоплазматической МДГ и ЛДГ измеряли спектрофотометрически в кварцевой кювете c ходом луча 10 мм, объемом 3 мл при длине волны 340 нм по скорости окисления восстановленной формы кофермента НАДН, используя в качестве среды выделения 0.2 М Трис-HCl буфер, рН 7.5, [10]. Изменение оптической плотности на 0.207 соответствует превращению 0.1 мкмоль субстрата. Реакцию начинали внесением экстракта и снимали отсчеты через 30 с в течение 2–3 мин. Субстратом для определения активности ЛДГ служил пируват, а для МДГ – оксалоацетат. Удельную активность ферментов выражали в мкмолях НАДН мин–1 мг–1 белка супернатанта. Активность каталазы определяли по реакции пероксида водорода с молибдатом аммония и образованием желтоокрашенного комплекса [11]. Величину экстинкции измеряли при 410 нм. В пробирки вносили по 1 мл 0,03% раствора пероксида водорода, 0.25 мл 0.05 М фосфатного буфера (pH 8.0) и 0.05 мл супернатанта. В контрольную пробу вносили 0.25 мл 12 мМ раствора азида натрия. После инкубации проб в течение 10 мин реакцию останавливали добавлением 2 мл 4% раствора молибдата аммония. Удельную активность каталазы выражали в мкМ Н2О2 мин–1 мг–1 белка супернатанта. Содержание белка определяли микробиуретовым методом, экстинкцию измеряли при длине волны 330 нм. В качестве стандарта для построения калибровочной кривой использовали препарат кристаллического сывороточного альбумина. Активность МДГ, ЛДГ и каталазы определяли при стандартной температуре инкубации реакционной смеси 25°C.
Статистически сравнения выполнены на основе двустороннего t-критерия Стьюдента, результаты представлены как M ± m. Нормальность распределения проверена при помощи критерия Пирсона. Различия считали значимыми при p < 0.05. Статистическая обработка и графическое оформление полученной информации проводились при помощи стандартного пакета “Grapher-7”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для контрольной группы рыб, не подвергавшихся воздействию H2S, установлена следующая градация активности МДГ в исследованных тканях: СЖ ≥ М1 ≥ СП ≥ М2 > 4Ж ≥ 1Ж (рис. 3a). Максимальная активность фермента, выявленная в СЖ, и минимальная – в 1Ж, составляла соответственно 1.3 ± 0.2 мкМ и 0.352 ± 0.084 мкМ НАДН мин–1 мг–1 белка (p < 0.001). В мозге и сердце активность МДГ была в 2–3.7 раза выше, чем в жабрах. Различия по активности МДГ между отделами мозга достигали 20% (p < 0.05), между отделами сердца и жаберными дугами были незначительны (p > 0.05).
Рис. 3.
Активность МДГ (a), ЛДГ (b), индекс МДГ/ЛДГ (c) и активность каталазы (d) в тканях Scorpaena porcus. 1Ж – первая жаберная дуга; 4Ж – четвертая жаберная дуга; СП – предсердие; СЖ – желудочек сердца; М1 – продолговатый мозг; М2 – средний, передний и промежуточный мозг; белые столбики – контроль, серые – 37 мкМ Na2S, черные – 74 мкМ Na2S; * – достоверно по сравнению с контролем, р < 0.05; ** – достоверно по сравнению с другим опытом, р < 0.05.
Fig. 3. Activity of MDH (a) and LDH (b), MDH/LDH index (c), and catalase activity (d) in Scorpaena porcus tissues. 1G – first branchial arch; 4G – fourth branchial arch; HA – heart atrium; HV – heart ventricle; B1 – medulla oblongata; B2 – forebrain, diencephalon, midbrain; white bars – control, gray bars – 37 μМ Na2S, black bars – 75 μМ Na2S; * – significant difference vs. control, р < 0.05; ** – significant difference between experiments, р < 0.05.
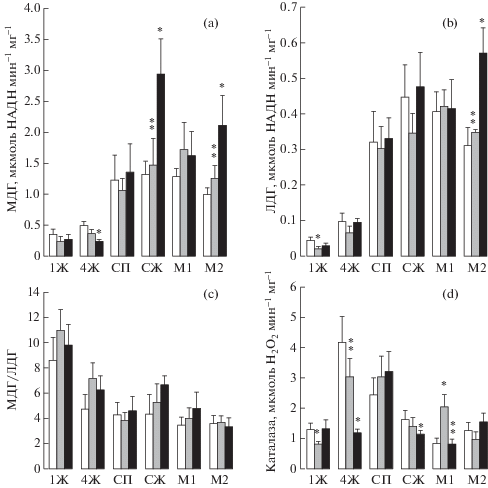
Характер градации тканей по активности ЛДГ был аналогичный: СЖ ≥ М1 ≥ СП ≥ М2 > 4Ж > 1Ж (рис. 3b). Активность фермента в сердце и мозге была выше, чем в жабрах в 3–10 раз (p < 0.05–0.001). Активность ЛДГ в ламеллах 1Ж и 4Ж отличалась в 2.3 раза (p < 0.05) и составляла 0.043 ± 0.009 и 0.098 ± 0.020 мкМ НАДН мин–1 мг–1 белка соответственно. Значительных различий по активности ЛДГ между М1 и М2 не обнаружено.
Наибольший индекс МДГ/ЛДГ – 8.6 ± 1.5 – установлен в 1Ж, что 1.8–2.5 раза выше (p < 0.05), чем в других исследованных тканях, которые по соотношению активности ферментов существенно не различались между собой (рис. 3c).
Максимальная активность каталазы обнаружена в ламеллах 4Ж и составляла 4.2 ± 0.8 мкМ Н2О2 мин–1 мг–1 белка, что на 42% больше, чем в СП (p < 0.05) и в 3.3 больше, чем в 1Ж (p < 0.05) (рис. 3d). Активность каталазы уменьшалась в ряду тканей: 4Ж > СП ≥ СЖ ≥ 1Ж = М2 > М1. Активность фермента в СП (2.4 ± 0.5 мкМ Н2О2 мин–1 мг–1 белка) была достоверно выше, чем в 1Ж и исследованных отделах мозга (p < 0.05–0.001). В свою очередь в 1Ж наблюдалась более высокая активность каталазы, чем в М1 (p < 0.05). Активность каталазы между отделами мозга отличалась на 35% (p < 0.05).
Опыт 1. После 5 мин экспозиции скорпены в морской воде с концентрацией 37 мкМ Na2S проявилась незначительная тенденция к снижению активности МДГ в 1Ж, 4Ж и СП, а в тканях СЖ, М1 и М2, наоборот, к повышению.
Активность ЛДГ уменьшилась вдвое в 1Ж – до 0.022 ± 0.004 мкМ НАДН мин–1 мг–1 белка (p < 0.05), в ткани 4Ж и СЖ обнаружена тенденция к уменьшению активности фермента. Активность ЛДГ в 1Ж была втрое меньше, чем в 4Ж (p < 0.05). Различия по активности фермента между отделами мозга составили 18% (p < 0.05).
Тканевая специфика величины индекса МДГ/ЛДГ сохранилась как в контроле, но проявилась тенденция к увеличению этого показателя в 1Ж, 4Ж, СЖ и М1.
Активность каталазы в 1Ж снизилась от 1.3 ± 0.2 до 0.785 ± 0.078 мкМ Н2О2 мин–1 мг–1 белка (p < 0.05), а в М1 возросла от 0.816 ± 0.155 до 2.0 ± 0.3 мкМ Н2О2 мин–1 мг–1 белка (p < 0.05). В результате активность фермента в 1Ж стала в 3.9 раза меньше, чем в 4Ж (p < 0.05), в М1 – вдвое больше, чем в М2 (p < < 0.05). Активность каталазы в СП и СЖ различалась в 2.2 раза: 3.1 ± 0.6 и 1.4 ± 0.3 мкМ Н2О2 мин–1 мг–1 белка соответственно (p < 0.05).
Опыт 2. Экспозиция скорпены в течение 5 мин в морской воде с концентрацией 75 мкМ Na2S существенно не повлияла на активность МДГ в 1Ж, СП, М1, но изменила активность фермента в 4Ж, СЖ и М2. По сравнению с контролем активность МДГ в 4Ж снизилась вдвое: от 0.488 ± 0.075 до 0.241 ± 0.031 мкМ НАДН мин–1 мг–1 белка (p < 0.05). Среди исследованных тканей максимальной величины активность фермента достигла в СЖ – 2.9 ± ± 0.5 мкМ НАДН мин–1 мг–1 белка, что значительно выше, чем в контроле и опыте 1 (p < 0.05). Отделы сердца различались по активности МДГ в 2.2 раза (p < 0.05). В М2 активность фермента увеличилась вдвое по сравнению с контролем и опытом (p < 0.05) и составила 2.1 ± 0.4 мкМ НАДН мин–1 мг–1 белка.
Увеличение концентрации сульфида натрия в воде привело к повышению активности ЛДГ в М2 до 0.571 ± 0.071 мкМ НАДН мин–1 мг–1 белка, что больше, чем в контроле (на 53%) и опыте 1 (на 41%) (p < 0.05). Активность фермента в 1Ж была меньше, чем в 4Ж, в 3.2 раза (p < 0.05).
Сохранилась тенденция к большей величине индекса МДГ/ЛДГ по сравнению с контролем, а в некоторых тканях (СП, СЖ, М1) и по сравнению с опытом 1. Соотношение активности ферментов оставалось неизменным только в М2.
Активность каталазы в 1Ж вернулась к уровню контроля, в 4Ж – понизилась до 1.2 ± 0.1 мкМ Н2О2 мин–1 мг–1 белка (p < 0.05). В СП и М2 обнаружилась лишь тенденция к увеличению активности фермента. Активность каталазы в СЖ снизилась по сравнению с контролем на 32% (p < 0.05), в М1 – вернулась к контрольному уровню после значительного увеличения в первом опыте (p < 0.05). Отделы сердца отличались по активности каталазы в 2.9 раза (p < 0.05), отделы мозга – в 1.9 раза (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Оксифильные ткани сердца, мозга, жабр, испытывающие повышенную потребность в О2 для обеспечения своего метаболизма, существенно отличаются происхождением, цитоархитектоникой и спецификой кровоснабжения, что может сказываться на особенностях метаболической активности.
Мозг. Мозг рыб – ведущий центр рефлекторной деятельности, в котором выделяют 5 основных отделов: передний, промежуточный, средний мозг, продолговатый мозг и мозжечок. Мозг является наиболее чувствительным к О2 органом, состоящим из множества структурных и функциональных компонентов с заметно различающимися и независимо регулируемыми уровнями функциональной и метаболической активности. В тканях мозга эктотермных позвоночных – агнат и донных рыб – прослеживаются определенные метаболические паттерны, напоминающие таковые у новорожденных млекопитающих; например, такой особенностью является высокое содержание гликогена в глиальных клетках головного мозга [12]. Установлено, что у представителей циклостом, эласмобранхий и костистых рыб, которые зачастую испытывают периоды гипогликемии либо ишемии, регистрируются очень высокие концентрации гликогена в тканях мозга. Высокий гликолитический потенциал, который характерен для мозга костистых рыб, связывают с высоким потенциалом цикла трикарбоновых кислот [13], поддерживающим мощный аэробный метаболизм этой ткани.
Мозг скорпены был разделен нами на два эволюционно “разновозрастных” образца – в виде переднего, среднего, промежуточного мозга (М2) и продолговатого мозга (М1) (рис. 1a). Наиболее “старым” в эволюционном отношении является М1, который в первую очередь обеспечивает совокупность базовых кардиореспираторных рефлексов. Отделы мозга, составляющие М2, осуществляют интегрирование и регуляцию функций организма, координируют сложные движения. Высокий уровень активности МДГ у скорпены в тканях разных отделов мозга сопряжен с энергетическим запросом и интенсивным метаболизмом мозга в целом, что отражает особенности его функционирования по сравнению с другими органами и тканями. В степени активности МДГ и ЛДГ между М2 и М1 отмечалась некоторая разница в пользу М1, которая, по-видимому, отражает выраженную биохимическую устойчивость М1 к варьирующему РwО2. Передние отделы мозга малоподвижной скорпены, будучи интегративными центрами, в том числе, и локомоторных функций, энергетически уступают М1, который, в частности, в “непрерывном режиме” обеспечивает кардиореспираторные реакции.
Найденная нами высокая активность ЛДГ в структурах мозга скорпены фактически свидетельствует об “анаэробизации” путей энергетического метаболизма, что может служить признаком высокого потенциала адаптационных механизмов, которые поддерживают продукцию макроэргов при изменении РwО2 в придонных слоях воды.
Сердце. Сердце костистых рыб состоит из предсердия и желудочка (двухкамерное сердце). Предсердие имеет вид камеры с тонкой трабекулированной стенкой. Архитектура желудочка как основной “силовой” камеры связана уже с двумя структурно различными типами организации миокарда – губчатым (трабекулярным) и компактным. У костистых рыб желудочек формируется либо исключительно губчатым (трабекулярным) миокардом, либо наружный слой губчатого миокарда соседствует с компактной разновидностью сердечной мышечной ткани. Единственный вариант кровоснабжения миокарда в сердце большинства костистых рыб обеспечивает венозная кровь, содержащаяся в просвете сердечных камер и внутритрабекулярных пространствах желудочка – лакунах (“просветная кровь”). При более сложной архитектуре сердца губчатый слой миокарда обеспечивает венозная кровь из трабекулярных лакун, а компактный слой получает артериальную кровь по гипобронхиальным артериям второй пары жаберных дуг.
Исходя из малоподвижного образа жизни скорпены, можно с большой долей вероятности предполагать наличие у данного вида рыб “аваскулированной/венозной” разновидности сердца, в стенках которого присутствует либо исключительно губчатый миокард, лишенный артериального кровоснабжения при отсутствии коронарных сосудов, либо мелкие артериальные сосуды ограниченно распределены в эпикарде и наружном компактном слое, не затрагивая губчатую часть миокарда. Установленная нами высокая активность МДГ и ЛДГ в камерах сердца скорпены подчеркивает в первую очередь оксифильность миокарда, который обладает дополнительным “запасом прочности” энергетического метаболизма в виде высокой активности ЛДГ, функционирующей в условиях перфузии миокарда бедной кислородом венозной кровью. Активность ЛДГ в сердце скорпены также может тесно коррелировать с компоновкой камер сердца губчатым веществом [14]. Так, в миокарде атлантического лосося (Salmo salar) показатели углеводного обмена, активности гексокиназы и ЛДГ были значительно выше в губчатом слое миокарда по сравнению с кортикальным компактным слоем желудочка сердца [14].
Отмеченная нами тенденция к повышенной активности ЛДГ желудочка по сравнению с предсердием, по-видимому, служит повышению анаэробного потенциала основной нагнетающей камеры сердца и является дополнительным фактором обеспечения работы желудочка. Кроме того, особенности функционирования оксидоредуктаз, обеспечивающих энергетический метаболизм сердечной ткани, могут коррелировать с некоторыми чертами тканевой морфологии. В качестве значимых морфологических факторов, поддерживающих специфическую физиологию органа, учитывают соотношение миофибриллярных и периферических митохондриальных популяций внутри кардиомиоцитов или разделение миокарда на типы клеток, “предпочитающих” аэробный или анаэробный метаболизм [15].
В структурах мозга и камерах сердца скорпены отмечена высокая активность МДГ и ЛДГ (рис. 3а и 3b). У большинства рыб ткани сердца и мозга обычно имеют сходный потенциал энергетического метаболизма, позволяющий синхронизировать высокую интенсивность аэробного и анаэробного метаболизма в органах, которые обеспечивают выживание целого организма. Следует отметить, что у видов, существующих в условиях варьирующего содержания О2 в водной среде (PwO2), несмотря на бесспорную значимость аэробного метаболизма для обеспечения макроэргами оксифильных тканей мозга и сердца, возможность продуктивно осуществлять анаэробный метаболизм приобретает дополнительную значимость для сохранения эффективной работы органов при изменении доступности О2.
Сочетание высокой активности ферментов энергетического обмена сердца и мозга скорпены составляет определенный феномен, поскольку газовый состав перфузирующей упомянутые органы крови (венозная vs. артериальная кровь соответственно) существенно различается. Известно, что содержание О2 и СО2 в артериальной и венозной (Pv) крови костистых рыб имеет кратную разницу [16]. Обращает на себя внимание тот факт, что на фоне существующих различий в газовом составе крови уровень активности МДГ, равно как и ЛДГ в структурах мозга и камерах сердца скорпены имеет близкие величины.
Несмотря на низкие значения PvO2 существуют некоторые механизмы, позволяющие кардиомиоцитам увеличивать экстракцию О2 из перфузирующей сердце венозной крови. Так, в сердечных мышечных клетках и клетках эндотелия лососевых присутствует фермент карбоангидраза (plasma-accessible carbonic anhydrase, CA), который идентифицируют как гликозилфосфатидилинозитол (GPI)-сопряженный мембрано-связанный изофермент (изозим) CА4, позволяющий клеткам локально повышать градиент РО2 при одновременном снижении сродства гемоглобина к О2 [17] и интенсивно поглощать О2 из циркуляторного русла, что дополнительно поддерживается такими служащими борьбе за О2 факторами, как большая площадь поверхности губчатого миокарда, расположение трабекул губчатого миокарда тонкими слоями для уменьшения диффузионного расстояния, минимизация внутреннего диффузионного расстояния за счет веретенообразной формы мышечных клеток. Показано, что CA может практически удвоить тканевое PO2 при соответствующих физиологических условиях [18]. Вероятно, другим механизмом, позволяющим осуществлять аэробный метаболизм в условиях, создаваемых венозной кровью, можно считать экспрессию комплекса изоферментов (изозимов), которые наиболее эффективно осуществляют свои функции при низком РvО2.
Жабры. Жаберный аппарат скорпены, как и у других бентосных видов рыб, имеет относительно небольшую площадь по сравнению с активными, быстро плавающими рыбами. С точки зрения перфузии жаберная ткань является тем местом, куда по четырем парам приносящих артерий поступает венозная кровь, превращающаяся при газообмене в артериальную.
Жаберный эпителий рыб обладает широким разнообразием физиологических функций [8]. В покое жаберная ткань потребляет около 27% О2, при этом составляя всего лишь 3.9% от массы тела. Показано, что при насыщенной воздухом окружающей воде около 58% общего количества О2 потребляется тканями жабр из перфузирующей крови, в то время как 42% О2 попадает в жаберные ткани непосредственно из окружающей воды [19]. Существенное “внутреннее” поглощением О2 жаберными филаментами не относится непосредственно к дыхательной функции жаберного аппарата и связано прежде всего с функционированием специализированных жаберных клеток-ионоцитов, содержащих большое количество митохондрий.
Нами была установлена заметная разница в активности оксидоредуктаз энергетического обмена (активность ЛДГ, в меньшей степени МДГ) между 1Ж и 4Ж, которая может определяться различными функциональными “обязанностями” (специализацией) и/или определяться особенностями иннервации рассматриваемых жаберных дуг. В частности, вероятно, в дополнение к дыхательной, в первую очередь, функции можно отметить “О2‑сенсорную” специализацию 1Ж, содержащую чувствительные к колебаниям РО2 нейроэпителиальные клетки [9], и “выделительную” – 4Ж, требующую большего энергетического обеспечения.
Хотя ткань 1Ж скорпены обладает существенно более низкими показателями активности ферментов аэробного и анаэробного метаболизма, чем ткани камер сердца, М1 и М2, однако в то же время самое высокое соотношение МДГ/ЛДГ (рис. 3с) в ее ткани является признаком интенсивности аэробных окислительных процессов, обеспечивающих ее функционирование как источника кардиореспираторных реакций.
Активность каталазы в оксифильных тканях. Анализ активности каталазы в различных структурах оксифильных органов скорпены позволяет предположить ее связь со скоростью окислительного фосфорилирования и устойчивостью к гипоксии. По-видимому, наиболее устойчивые к гипоксии ткани оксифильных органов по аналогии с целым организмом должны исходно обладать меньшей скоростью окислительного фосфорилирования [20], что позволяет с меньшей интенсивностью производить АФК в дыхательной цепи митохондрий клеток данных тканей. Повышенная активность каталазы в М2 по сравнению с М1 отражает более активное образование АФК, связанное с продукцией макроэргов в “эволюционно молодых”, более О2-зависимых и уязвимых к дефициту О2 участках мозга. Меньшая величина активности каталазы в желудочке vs. предсердие также служит маркером большей устойчивости к фактору О2 этой камеры сердца. Очевидно, что 4Ж, функционирующая в режиме “почки” vs. 1Ж, также в большей степени О2-зависима. Таким образом, исходя из антиоксидантной функции каталазы, можно предполагать особую зависимость метаболических процессов от доступности О2, определяющих уязвимость отдельных структур оксифильных органов скорпены.
Двойственная функция сероводорода в физиологических процессах. Естественный метаболит либо побочный продукт промышленного производства – H2S – может существенно ограничивать способность организмов выживать и размножаться. Как правило, концентрации H2S в окружающей среде являются низкими или переходными, высокие и устойчивые концентрации H2S создают экстремальные условия, которые создают смертельные условия для большей части живых организмов. Существует ряд механизмов, которые помогают костистым рыбам выдерживать токсичность сульфидов в виде взаимодействия сульфидов с белками крови, образования и накопления сульфгемоглобина, перехода на анаэробный метаболизм, определенной нечувствительности к сульфидам терминального комплекса дыхательной цепи МХ цитохром c-оксидазы [1, 2, 21]. Вместе с тем высокая толерантность к воздействию сульфидов у Teleostei может быть обусловлена, прежде всего, не столько способностью детоксицировать их, сколько осуществлять определенные метаболические настройки в сероводородной среде [21]. Причем, по-видимому, корректировки метаболизма, наблюдаемые при токсическом воздействии сульфидов, не являются специфическими, так как аналогичные физиологические события также могут возникать в условиях гипоксии.
Кроме токсического действия, H2S осуществляет функцию физиологически значимой сигнальной молекулы [4]. В качестве медиатора эндогенный H2S синтезируется преимущественно из аминокислоты L-цистеина и/или гомоцистеина. Синтез Н2S осуществляется во многих, если не во всех, тканях организма двумя цитозольными энзимами: цистатионин β-синтазой (ЦБС) и цистатионин γ-лиазой (ЦГЛ). Кроме того, H2S может генерироваться в митохондриях под действием цистеин аминотрансферазы и 3-меркаптопируваттрансферазы (также присутствует в цитозоле). Показано, что ЦБС, основной фермент синтеза H2S, также интегрирует взаимодействие между H2S и другими газообразными сигнальными молекулами – CO, NO, способствуя регуляции энергетического метаболизма [22].
H2S метаболизируется митохондриями посредством окисляющих H2S энзимов [23]. На первой ступени этот процесс катализируется мембрано-связанной сульфид:хинон оксиредуктазой, которая окисляет H2S до персульфида. В присутствии О2 и воды другой фермент – серная диоксигеназа – окисляет персульфид до сульфида, который в свою очередь соединяется с другой молекулой персульфида с помощью сульфур-трансферазы для производства тиосульфата. Кроме того, подобно СО, H2S может удаляться из организма рыб посредством его диффузии через жабры и другие проницаемые поверхности тела.
Согласно данным литературы, экспериментальное моделирование физиологических эффектов H2S осуществляется при насыщении водной среды самим H2S [2], путем экспозиции к растворенному в воде донору сероводорода сульфиду натрия (Na2S) [3, 9] и при введении раствора гидросульфида натрия (NaHS) в буккальную полость [24]. Na2S при растворении в водной среде диссоциирует, образуя гидросульфид натрия (NaHS–), анион HS– и H2S. За счет высокой растворимости в липидах H2S легко проникает в организм, проходя через клеточные мембраны.
В нашем исследовании использовались условно “физиологические” концентрации донора H2S – Na2S, кратковременная экспозиция к которым у рыб не сопровождалась нарушениями и депрессией внешнего дыхания [9], что свидетельствовало об отсутствии выраженного токсического эффекта упомянутых доз.
Реакция жаберной ткани на сероводородную нагрузку. Обращает на себя внимание тот факт, что при сероводородной нагрузке скорпены отмечалось градуированное в зависимости от концентрации Na2S потемнение жаберной ткани, которое могло быть обусловлено изменением цвета перфузирующей жаберные ламеллы крови (рис. 2). Выраженное потемнение тканей жабр соответствовало максимальной концентрации Na2S. Известно, что легко проникающие в эпителий жабр сульфиды могут препятствовать связыванию О2 с гемоглобином крови и способствовать развитию тканевой гипоксии, подобно той, которую вызывает цианид или снижение поступления О2 [25]. Согласно описанному механизму при взаимодействии H2S с гемоглобином крови у скорпены также могла возникать определенная степень гипоксемии (снижение PO2 крови), что определило цвет перфузирующей жаберные ламеллы крови. Предполагают [26], что кровь рыб, обладая определенной сульфид-окисляющей активностью, может действовать в качестве краткосрочной “первой линии защиты” от сульфидов, таким образом, минимизируя количество потенциально токсичных соединений, которое с током крови достигает жизненно важных органов. Помимо крови, сульфид-окисляющую активность также отмечают в жаберной ткани рыб, наряду с селезенкой, печенью и почками [26].
Предположение о возникновении гипоксемии в результате взаимодействия H2S с кровью скорпены возникает на основании результатов работы Портеус и соавт. [9], в которой сероводородная нагрузка, создаваемая при тех же самых концентрациях Na2S, увеличивала интенсивность вентиляции у Danio rerio, что авторы объясняли исходя исключительно из медиаторной функции H2S в механизмах регуляции дыхания без учета детоксифицирующей функции крови и возможного снижения ее РО2 в сероводородной среде. Кроме окисления/связывания сульфидов кровью, признаком активного взаимодействия H2S с жаберной тканью скорпены, по-видимому, может служить снижение активности каталазы, возникающее вследствие уменьшения интенсивности окислительного фосфорилирования при взаимодействии H2S с СОХ [3, 25].
Процессы, наблюдаемые при сероводородной нагрузке у скорпены в жаберной ткани, имели некоторые признаки метаболической депрессии; на упомянутый процесс указывало снижение активности МДГ в 1Ж и аэробных процессов в 4Ж. Полученные данные косвенно свидетельствовали о взаимодействии H2S с жаберной тканью.
Реакция тканей мозга и сердца на сероводородную нагрузку. Экспозиция скорпены к низкой концентрации донора H2S не вызывала статистически значимых изменений активности ферментов энергетического метаболизма в тканях мозга и сердца; в то же время при 2-кратном увеличении концентрации Na2S в среде экспозиции упомянутые изменения были более выражены. Подобный феномен практически отсутствующей реакции оксидоредуктаз (в пределах статистической погрешности) на низкую концентрацию Na2S, на уровне целого организма мог быть реализован за счет сульфид-связывающей активности жаберной ткани и крови, обеспечивших скорпене защиту от поступления в организм физиологически значимого количества сульфидов.
В то же время при высокой концентрации Na2S в отдельных структурах оксифильных органов (М2, желудочек сердца) происходило синхронное повышение активности МДГ и ЛДГ, что предполагает одновременную согласованную работу аэробных и анаэробных путей, характерную для средовой гипоксии [27].
Исходя из предположения о наличии гипоксемии/тканевой гипоксии при высокой дозе Na2S, значительный подъем активности МДГ в наиболее активно функционирующих либо О2-чувствительных частях оксифильных органов – желудочке сердца, М2 – мог быть в первую очередь связан с двойственной ролью МДГ, отводимой ей в аэробном и анаэробном метаболизме [15]. За счет высокой активности по сравнению с другими ферментами энергетического метаболизма МДГ вовлекается в анаэробные процессы и гликолиз, поддерживая таким образом цитоплазматический окислительно-восстановительный баланс.
Одновременное увеличение активности ЛДГ наравне с МДГ в ответ на сероводородную нагрузку в ключевых оксифильных структурах – мозге и сердце, с одной стороны, выявляет наличие фактора гипоксемии/тканевой гипоксии, возникающего при высокой концентрации Na2S, либо свидетельствует о прямой реакции оксидоредуктаз на присутствие Н2S. Известно, что высокие концентрации сульфидов заставляют некоторые водные организмы осуществлять анаэробиоз даже в присутствии высокого содержания О2 в воде [3, 21]. Однако переход к анаэробному метаболизму устойчивых к H2S видов рыб, например, тамбаку (бурый паку, Сolossoma macropomum), отмечают только после 24 ч непрерывного воздействия сульфидов [21], что противоречит краткосрочности экспозиции в нашем исследовании. С другой стороны, установлено, что H2S обладает способностью к существенному повышению каталитической активности ЛДГ за счет взаимодействия с ЛДГ-А субъединицей [28].
Так или иначе, высокие показатели активности МДГ в М2 и желудочке сердца, наиболее О2-зависимых/потребляющих структурах скорпены, не исключают сосуществования аэробного и анаэробного путей энергетического метаболизма при сероводородной нагрузке.
Необходимо отметить, что условно менее О2‑чувствительные отделы мозга и сердца – М1 и предсердие – на уровне оксидоредуктаз почти не выказывали реакции даже на высокую концентрацию Na2S, что предполагает иной режим энергетического метаболизма в данных структурах. Одним из процессов, возникающих при сероводородной нагрузке, может быть сульфид-окислительная активность при условно низких/нетоксических концентрациях H2S в упомянутых тканях, которые более устойчивы к колебаниям РО2 и/или к самому H2S.
Сульфиды могут использоваться митохондриями в качестве энергетического субстрата при низких, находящихся ниже уровня токсичности, микромолярных концентрациях [29]. При окислении сульфидов митохондриями отмечают два процесса, осуществляющих потребление кислорода: функционирование СОХ (митохондриальный комплекс IV) и образование серосодержащих продуктов, главным образом, тиосульфата (${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{{2 - }}$), сульфитов (${\text{SO}}_{3}^{{2 - }}$) и сульфатов (${\text{SO}}_{4}^{{2 - }}$) [29].
Анализ активности каталазы при сероводородной нагрузке обнаруживает сложное модулирующее действие H2S на процессы клеточного дыхания путем ограничения генерации АФК, что сопровождается снижением активности каталазы и ярче проявляется в О2-чувствительных частях оксифильных органов.
Обобщая результаты нашего исследования, можно сделать ряд выводов относительно взаимодействия H2S с оксидоредуктазами. Очевидно, что при сероводородной нагрузке активность оксидоредуктаз отражает возлагаемые на них функции. Основным проявлением реакции оксифильных тканей скорпены на сероводородную нагрузку являются инактивация “избытка” H2S и метаболические перестройки активности оксидоредуктаз энергетического метаболизма – МДГ и ЛДГ. Более функционально активные/О2-чувствительные или эволюционно молодые, требующие высоких затрат макроэргов оксифильные структуры могут быть более восприимчивы к действию H2S исходя из конкурентных/взаимообратных отношений между О2 и H2S [4]. В упомянутых функционально активных/О2-зависимых или эволюционно молодых структурах – желудочек сердца, М2 – реакция оксидоредуктаз на сероводородную нагрузку обладает чертами “ответа” на гипоксию/аноксию, что указывает на определенное сходство метаболических последствий воздействия H2S и гипоксии на активность оксидоредуктаз энергетического обмена [30, 31]. Реакция каталазы при краткосрочной экспозиции к H2S, по-видимому, регулируется присущими отдельным тканям особенностями электронотранспортной функции дыхательной цепи митохондрий (работы митохондриальных ферментных комплексов), связанных с их кинетическими характеристиками, и неодинаковым использованием субстратов окисления [20], которые определяют их чувствительность к О2.
Последние годы при экспериментальном воспроизведении определенных физиологических и патологических процессов (при старении, эндокринологических, кардиологических, неврологических нарушениях, онкологии, исследованиях в области токсикологии, фармакологии, генетики) широко используют некоторые виды костистых рыб, которые предоставляют для наблюдения идеальные сравнительные биологические модели [32]. Изучение реакции оксидоредуктаз при сероводородной нагрузке в тканях устойчивой к дефициту О2 скорпены может приблизить нас к пониманию роли H2S в процессах производства макроэргов и поддержания окислительно-восстановительного потенциала в О2-чувствительных/зависимых структурах, дать ответ на вопрос о том, каким образом достигаются специфичность и селективность действия сероводорода в качестве сигнальной молекулы, предоставив новые возможности в разработке подходов фармакологической коррекции ряда патологических состояний, которые связаны с нарушением метаболизма H2S.
Список литературы
Bagarinao T., Vetter R.D. Sulphide tolerance and adaptation in the California killifish, Fundulus parvipinnis, a salt marsh resident. J. Fish Biol. 42 (5): 729–748. 1993. https://doi.org/10.1111/j.1095-8649.1993.tb00381.x
Torrans E.L., Clemens H.P. Physiological and biochemical effects of acute exposure of fish to hydrogen sulfide. Comp. Biochem. Physiology. 71 (2):183–190. 1982. DOI: (82)90034-x.https://doi.org/10.1016/0306-4492
Forgan L.G., Forster M.E. Oxygen consumption, ventilation frequency and cytochrome c oxidase activity inblue cod (Parapercis colias) exposed to hydrogen sulphide or isoeugenol. Comp. Biochem. Physiol. 151 (1):57–65. 2010. https://doi.org/10.1016/j.cbpc.2009.08.008
Olson K.R. Mitochondrial adaptations to utilize hydrogen sulfide for energy and signaling. J. Comp. Physiol. 182: 881–897. 2012. https://doi.org/10.1007/s00360-012-0654-y
Olson K.R., Gao Y., DeLeona E.R., Arif M., Arif F., Arora N., Straub K.D. Catalase as a sulfide-sulfur oxido-reductase: An ancient (and modern?) regulator of reactive sulfur species (RSS). Redox Biol. 12: 325–339. 2017. https://doi.org/10.1016/j.redox.2017.02.021
van Ginneken V., Nieveen M., Van Eersel R., Van den Thillart G., Addink A. Neurotransmitter levels and energy status in brain of fish species with and without the survival strategy of metabolic depression. Comp. Biochem. Physiol. 114 (2): 189–196. 1996. DOI: (95)02127-2.https://doi.org/10.1016/0300-9629
Driedzic W.R. Cardiac energy metabolism. Fish Physiology. 12: 219–266. 1992. DOI: (08)60335-0.https://doi.org/10.1016/S1546-5098
Mommsen T.P. Metabolism of the Fish Gill. Fish Physiology. 10: 203–238. 1984. DOI: (08)60186-7.https://doi.org/10.1016/S1546-5098
Porteus C.S, Abdallah S.J., Pollack J., Kumai Y., Kwong R.W.M., Yew H.M., Milsom W.K., Perry S.F. The role of hydrogen sulphide in the control of breathing in hypoxic zebrafish (Danio rerio). J. Physiol. 592 (14): 3075–3088. 2014. https://doi.org/10.1113/jphysiol.2014.271098
Мильман Л.С., Юровецкий Ю.Г., Ермолаева Л.П. Определение активности важнейших ферментов углеводного обмена. Методы биологии развития. Москва. Наука. 346–364. 1974. [Milman L.S., Yurovetskiy Yu.G., Ermolaeva L.P. The determination of the activity of the most important carbohydrate metabolism enzymes. Developmental biology methods. Moscow: Nauka. 346–364. 1974. (In Russ)].
Гирин С.В. Модификация метода определения активности каталазы в биологических субстратах. Лаб. диагностика. 4: 45–46. 1999. [Girin S.V. Modification of the method for determining the activity of catalase in biological substrates. Lab. diagnostics. 4: 45–46. 1999. (In Russ)].
Plisetskaya E.M., Duguay S. Pancreatic hormones and metabolism in ectotherm vertebrates: Current views. The Endocrinology of Growth, Development, and Metabolism in Vertebrates. New York: Academic Press. P. 266–287. 1993.
Yang T.H., Somero G.N. Effects of feeding and food deprivation on oxygen consumption, muscle protein concentration and activities of energy metabolism enzymes in muscle and brain of shallow-living (Scorpaena guttata) and deep-living (Sebastolobus alascanus) scorpaenid fishes. J. Exp. Biol. 181: 213–232. 1993.
Ewart H.S., Driedzic W.R. Enzymes of energy metabolism in salmonid hearts: spongy versus cortical myocardia. Can. J. Zool. 65 (3): 623–627. 1987. https://doi.org/10.1139/z87-097
Hochachka P.W., Somero G.N. Biochemical Adaptation. New Jersey: Princeton Univ. Press, 560 P. 1984.
Wells R.M., Forster M.E., Davison W., Taylor H.H., Davie P.S., Satchell G.H. Blood oxygen transport in the free-swimming hagfish, Eptatretus cirrhatus. J. Exp. Biol. 123:43–53. 1986.
Alderman S.L., Harter T.S., Wilson J.M., Supuran C.T., Farrell A.P., Brauner C.J. Evidence for a plasma-accessible carbonic anhydrase in the lumen of salmon heart that may enhance oxygen delivery to the myocardium. J. Exp. Biol. 219: 719–724. 2016. https://doi.org/10.1242/jeb.130443
Rummer J.L., Brauner, C.J. Root effect haemoglobins in fish may greatly enhance general oxygen delivery relative to other vertebrates. PLoS ONE. 10: e0139477. 2015. DOI: doi:. pone.0139477.https://doi.org/10.1371/journal
Johansen K., Pettersson K. Gill O2 consumption in a teleost fish, Gadus morhua. Respir Physiol. 44 (3): 277–284. 1981. DOI: (81)90023-2.https://doi.org/10.1016/0034-5687
Лукьянова Л.Д. Молекулярные механизмы тканевой гипоксии и адаптация организма. Фiзiол. журн. (Украина). 49 (3): 17–35. 2003. [Lukyanova L.D. Molecular mechanisms of tissue hypoxia and body adaptation. Fizhiol. Zhurn. (Ukraine). 49 (3): 17–35. 2003. (In Russ)].
Affonso E.G., Polez V.L.P., Corrêa C.F., Mazon A.F., Araújo M.R.R., Moraes G., Rantin F.T. Blood parameters and metabolites in the teleost fish Colossoma macropomum exposed to sulfide or hypoxia. Comp. Biochem. Physiol. 133 (3): 375–382. 2002. DOI: (02)00127-8.https://doi.org/10.1016/S1532-0456
Giuffréa A., Colaço H.G., Mastronicola D., Mendes M.I.S., Sarti P., Leandro P., Vicente J.B. Cystathionine β-synthase and the interplay between the bioenergetically relevant gasotransmitters NO, CO and H2S. BBA-Bioenergetics. 1837: e71. 2014.
Olson K.R., Donald J.A., Dombkowski R.A., Perry S.F. Evolutionary and comparative aspects of nitric oxide, carbon monoxide and hydrogen sulfide. Respir. Physiol. Neurobiol. 184 (2): 117–129. 2012. https://doi.org/10.1016/j.resp.2012.04.004
Olson K.R., Healy M., Zhaohong Q., Vulesevic B., Duff D.W., Whitfield N., Yang G., Wang R., Perry S.F. Hydrogen sulfide as an oxygen sensor in trout gill chemoreceptors. Am J. Physiol. 295: R669–R680. 2008. doi.org/.https://doi.org/10.1152/ajpregu.00807.2007
Affonso E.G., Polez V.L.P., Corrêa C.F., Mazon A.F., Araújo M.R.R., Moraes G., Rantin F.T. Physiological responses to sulfide toxicity by the air-breathing catfish, Hoplosternum littorale (Siluriformes, Callichthyidae). Comp. Biochem. Physiol. 139 (4): 251–257. 2004. https://doi.org/10.1016/j.cca.2004.11.007
Bagarinao T., Vetter R.D. Sulfide tolerance and detoxification in shallow-water marine fishes. Mar. Biol. 103: 291–302. 1989.
Van Waarde A. Aerobic and anaerobic ammonia production by fish. Comp. Biochem. Physiol. 74 (4): 675–684. 1983.
Untereiner A.A., Oláh G., Módis K., Hellmich M.R., Szabo C. H2S-induced S-sulfhydration of lactate dehydrogenase A (LDHA) stimulates cellular bioenergetics in HCT116 colon cancer cells. Biochem. Pharmacol. 136: 86–98. 2017. https://doi.org/10.1016/j.bcp.2017.03.025
Goubern M., Andriamihaja M., Nubel T., Blachier F., Bouillaud F. Sulfide, the first inorganic substrate for human cells. FASEB J. 21: 1699–1706. 2007. https://doi.org/10.1096/fj.06-7407com
Oeschger R., Storey K.B. Regulation of glycolytic enzymes in the marine invertebrate Halicryptus spinulosus (Priapulida) during environmental anoxia and exposure to hydrogen sulfide. Mar. Biol. 106: 261–266. 1990.
Солдатов А.А., Головина И.В., Колесникова Е.Э., Сысоева И.В., Сысоев А.А., Кухарева Т.А., Кладченко Е.С. Активность ферментов энергетического обмена и содержание АТФ в тканях мозга и жабр морского ерша Scorpaena porcus Linnaeus, 1758 при кратковременной гипоксии. Ж. эвол. биохим. и физиол. 56 (3): 213–223. 2020. [Soldatov A.A., Golovina I.V., Kolesnikova E.E., Sysoeva I.V., Sysoev A.A., Kukhareva T.A., Kladchenko E.S. Energy Metabolism Enzyme Activity and ATP Content in the Brain and Gill Tissues in Black Sea Ruff Scorpaena porcus Linnaeus, 1758 during Short-Term Hypoxia. J. Evol. Biochem. Physiol. 56 (3): 213–223. 2020. (In Russ)]. https://doi.org/10.31857/S0044452920010143
Simonetti R.B., Marques L.S., Streit D.P.Jr., Oberst E.R. Zebrafish (Danio rerio): the future of animal model in biomedical research. J. Fisheries Sciences. com. 9 (3): 039–045. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


