Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 5, стр. 368-375
БЛОКАДА АДРЕНОРЕЦЕПТОРОВ В ГОЛОВНОМ МОЗГЕ ЗАДЕРЖИВАЕТ РАЗВИТИЕ СУДОРОГ ПРИ ДЫХАНИИ КИСЛОРОДОМ ПОД ДАВЛЕНИЕМ
Т. Ф. Платонова 1, С. Ю. Жиляев 1, О. С. Алексеева 1, *, Е. Р. Никитина 1, И. Т. Демченко 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: osa72@inbox.ru
Поступила в редакцию 03.03.2020
После доработки 05.04.2020
Принята к публикации 22.04.2020
Аннотация
Основным продромальным признаком развития судорог при дыхании гипербарическим кислородом является высокая активность периферического отдела симпатической нервной системы, проявляющаяся в нарушениях внешнего дыхания, деятельности сердца и сосудов. В работе тестировалась гипотеза о том, что мозговые адренорецепторы, как часть центральной адренергической системы, принимают участие в развитии генерализованных судорог при дыхании сжатым кислородом. В опытах на крысах блокировали α- и β-адренорецепторы путем введения в желудочки головного мозга неселективных и селективных антагонистов (пропранолол, атенолол, фентоламин и празозин), а затем оценивали реакции ЦНС и вегетативной нервной системы у животных при дыхании кислородом под давлением 5 АТА. Установлено, что у животных с интактными адренорецепторами гипербарический кислород вызывал судороги, которым предшествовали двухфазные реакции сердечно-сосудистой системы, внешнего дыхания и мозгового кровотока. Все использованные антагонисты адренорецепторов ослабляли вегетативные реакции и задерживали развитие кислородных судорог, но пропранолол проявил наиболее выраженные антигипертензивные и противосудорожные свойства. Полученные данные свидетельствуют об участии адренорецепторов головного мозга в реакциях вегетативной нервной системы на гипероксию и в механизмах развития кислородных судорог при дыхании гипербарическим кислородом. Результаты исследований могут быть использованы для разработки новых методов предотвращения судорог при экстремальной гипероксии и безопасного использования гипербарического кислорода в клинике и при подводных погружениях.
ВВЕДЕНИЕ
Дыхание сжатым (гипербарическим) кислородом имеет широкое практическое применение в медицине, при подводных погружениях, кессонных работах, в любительском и спортивном подводном плавании. Вместе с тем безопасность использования гипербарического кислорода (ГБО2) относительна из-за риска его токсического действия на ЦНС, проявляющегося на финальной стадии в виде мышечных тонических и клонических судорог, аналогичных генерализованному эпилептическому припадку [1–5]. Несмотря на многолетние исследования судорог в ГБО2, получивших название “кислородная эпилепсия” [2], их патогенез до сих пор остается малоизученным. Кислородная эпилепсия сопровождается гиперактивацией симпатического отдела вегетативной нервной системы, проявляющейся в нарушениях деятельности сердца и легких, что позволяет использовать показатели внешнего дыхания и частоты сердечных сокращений как продромальные маркеры судорог в ГБО2 [6–8]. Ранее для изучения механизмов сердечно-сосудистых реакций и развития судорог в токсической гипероксии использовалось системное блокирование α- и β-адренорецепторов у крыс путем внутрибрюшинного введения их антагонистов: фентоламина, празозина, пропранолола и атенолола [9]. Исследования показали, что каждый из указанных препаратов ослаблял реакции легких и сердца на гипероксический стимул, но только фентоламин и пропранолол достоверно увеличивали латентный период появления кислородных судорог. Поскольку адренолитики вводились внутрибрюшинно, а некоторые из них, например, атенолол, не проникают через гематоэнцефалический барьер [10], остается открытым вопрос об участии адренергической системы головного мозга в развитии судорожного синдрома при гипербарической гипероксии. Важнейшим структурным элементом центральной адренергической системы являются α- и β-адренорецепторы, медиаторами для которых являются адреналин и норадреналин. В ЦНС обнаружены α1-, α2-, β1-, β2, β3-адренорецепторы, различающиеся по локализации, сродству к медиаторам и опосредуемым эффектам [11, 12]. Адренорецепторы неравномерно распределены по головному мозгу и в отдельных его структурах могут преобладать разные типы рецепторов. Так, на нейронах голубого пятна присутствуют α- и β-адренорецепторы. Во фронтальной коре из β-адренорецепторов преобладает β1-, а в мозжечке – β2-подтип. Кроме того, в головном мозге экспрессируются гены трех подтипов α2-адренорецепторов, в частности в коре, гипоталамусе и голубом пятне ствола мозга преобладает α2А, в полосатом теле – α2С, а α2В-подтип преобладает в таламусе [13–15]. Функциональное значение α- и β-адренорецепторов в головном мозге остается до сих пор малоизученным, а их роль в физиологических и патологических реакциях на гипероксию ранее не исследовалась.
Целью настоящей работы являлось изучение участия α- и β-адренорецепторов головного мозга крыс в развитии эпилептиформных судорог при токсической гипероксии. Впервые в одном исследовании сравнивалось влияние α- и β-адренорецепторов на развитие кислородной эпилепсии путем их блокирования с помощью селективных и неселективных антагонистов, вводимых непосредственно в желудочки мозга. Данный способ блокирования адренорецепторов позволяет исключить эффекты периферийных рецепторов, активация которых затрудняет анализ роли центральных адренергических механизмов в развитии кислородных судорог.
МАТЕРИАЛ И МЕТОДЫ
Исследования выполнены на бодрствующих крысах-самцах Вистар весом 286–348 г в барокамере под действием повышенного давления кислорода 5 АТА. Протокол опытов одобрен Комиссией по этике ИЭФБ РАН в соответствии с “Международными рекомендациями по проведению медико-биологических исследований с использованием животных” (CIOMS, Женева, 1985). За 5–7 дней до проведения экспериментов каждому животному под наркозом (нембутал 50 мг/кг, внутрибрюшинно) согласно стереотаксическим координатам АР = –1.0 мм, LM = +/–1.5 мм, V = 3.5 мм в боковой желудочек мозга вживляли металлическую канюлю с наружным диаметром 0.24 мм, а в стриатум (координаты АР = +1.0 мм, LM = +/–2.5 мм, V = 5.5 мм) вводили парные игольчатые электроды из платиновой проволоки диаметром 0.15 мм. В теменную кость черепа билатерально ввинчивали 2 стальных винта, которые вместе с канюлей и электродами фиксировали на кости зубопротезным цементом. В день опыта животному под эфирным наркозом на груди устанавливали дисковые металлические электроды и в бедренную артерию вводили полиэтиленовый катетер. Парные платиновые электроды, изолированные по всей длине, за исключением кончика 1–2 мм, использовали для измерения кровотока в стриатуме методом клиренса водорода [16]. Стальные винты в черепе использовали для непрерывной регистрации биоэлектрической активности головного мозга (ЭЭГ), а дисковые электроды на груди – для мониторинга электрокардиограммы (ЭКГ). Катетеры в бедренной артерии использовались для измерений артериального давления (АД). Через канюли в желудочек мозга вводили празозин (селективный блокатор α1-адренорецепторов), фентоламин (неселективный блокатор α1 и α2-адренорецепторов), атенолол (селективный блокатор β1-адренорецепторов) и пропранолол (неселективный блокатор β1 и β2 – адренорецепторов). Препараты (Sigma Aldrich, Германия) растворяли в искусственном ликворе (ИЛ) и инъецировали в боковой желудочек мозга через введенную в канюлю иглу, соединенную с микрошприцем (Hamilton, 50 мкл). Доза вводимых препаратов составляла 20 мкг/10 мкл искусственного ликвора с продолжительностью введения 2 мин. Контрольной группе крыс вводили искусственный ликвор в объеме 10 мкл.
В работе использовано 47 крыс, разделенных на 5 групп по числу применяемых адреноблокаторов и одной контрольной. В состав каждой группы входило 8–11 животных, на которых проводили однократные опыты. Порядок проведения опытов был следующим. За 30 мин до кислородной экспозиции животным через имплантированные канюли в желудочки мозга вводили антагонисты адренорецепторов или искусственный ликвор. Каждое животное, оснащенное мозговой канюлей, электродами и катетером, размещали в барокамере в специально изготовленной матерчатой жилетке, мягко фиксирующей крысу в подвешенном горизонтальном положении. К такому положению животное приучали в процессе предварительной тренировки. После 10-минутной стабилизации измеряли контрольные значения физиологических параметров при дыхании атмосферным воздухом, а затем давление в барокамере повышали чистым кислородом до 5 АТА. Животное дышало сжатым кислородом до появления генерализованных судорог или максимально 90 мин. При введении ликвора (контроль) или прозазина продолжительность кислородной экспозиции составляла 60 мин, так как у всех этих животных судороги появлялись в течение часового пребывания в барокамере. В период ГБО2-экспозиции осуществляли непрерывное видеонаблюдение за животным и фиксировали время появления нарушений двигательной активности, а также начало генерализованных судорог. Физиологические параметры (АД, ЭЭГ и ЭКГ) регистрировали непрерывно, а кривые клиренса водорода – каждые 10 мин. После опытов проводили расчет абсолютных величин мозгового кровотока по кривым клиренса водорода, оценивали активность симпатической и парасимпатической нервной системы на основании коэффициента вагосимпатического баланса (LF/HF) как отношение мощности волн низкой частоты (LF) к мощности волн высокой частоты (HF) спектра сердечного ритма. По записям АД и ЭКГ рассчитывали коэффициент чувствительности барорефлекса [17] и определяли время появления судорожной активности на ЭЭГ. Респираторная функция у крыс оценивалась по числу дыхательных волн на записях артериального давления. Сбор экспериментальных данных и расчеты указанных параметров физиологических реакций осуществляли с помощью специализированных программ (WINDAQ, OH, USA и iWORK, CA, США). Статистический анализ полученных результатов проводили с использованием программного обеспечения StatView (StatView, version 3, Triange Park, NC, США). Достоверные различия оценивали по парному t-критерию. Данные представлены как M ± SEM, при этом значения p < 0.05 принимались статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
У крыс контрольной группы, которым в желудочки мозга вводился искусственный ликвор, в период ГБО2-экспозиции были выявлены характерные двигательные нарушения, развивающиеся в определенной стадийной последовательности (табл. 1).
Таблица 1.
Время появления 4 стадий судорожной активности у крыс под давлением кислорода 5 АТА после блокады адренорецепторов Table 1. Onset time of the four stages of seizure activity in rats during exposure to oxygen at 5 ATA after blockade of adrenergic receptors
| Препараты/ Drugs | Стадия 1, мин/ Stage 1, min | Стадия 2, мин/ Stage 2, min | Стадия 3, мин/ Stage 3, min | Стадия 4, мин/ Stage 4, min |
|---|---|---|---|---|
| Ликвор/Control | 18.5 ± 3.1 | 23.4 ± 3.3 | 25.4 ± 4.9 | 36.3 ± 4.3 |
| Атенолол/Atenolol | 24.3 ± 3.2 | 27.2 ± 3.6 | 31.7 ± 4.8 | 49.6 ± 5.1* |
| Пропранолол/Propranolol | 51.9 ± 4.4* | 67.5 ± 5.5* | 83.4 ± 3.5* | 88.3 ± 1.4* |
| Празозин/Prasozin | 19.3 ± 3.6 | 25.2 ± 3.6 | 29.7 ± 4.6 | 43.2 ± 5.5 |
| Фентоламин/Phentolamin | 36.9 ± 4.1* | 43.5 ± 3.5* | 53.3 ± 5.7* | 65.9 ± 6.1* |
Стадия 1 характеризовалась появлением интенсивного груминга и одиночных миоклоний мышц головы и передних лап. На стадии 2 наблюдались повторяющиеся локальные сокращения мышц мордочки, головы и передних конечностей продолжительностью до 10 сек с повторением через 1–3 мин. На стадии 3 у животных появлялись ритмические сокращения мышц всего тела продолжительностью до 5 сек и встряхивания типа эффекта “мокрой собаки” с характерными вращательными движениями хвоста. Стадия 4 характеризовалась генерализованными клоническими или тоническими конвульсиями, отчетливо заметными у животных даже в мягкой тканевой жилетке. У крыс, которым вводились антагонисты адренорецепторов, стадийное развитие судорожного синдрома сохранялось, но противосудорожная эффективность препаратов заметно различалась. Статистически достоверная задержка в появлении каждой стадии судорожного синдрома по отношению к контрольным значениям наблюдалась у животных, которым предварительно вводили в мозг пропранолол или фентоламин (табл. 1). Наибольший противосудорожный эффект вызывал пропранолол, при введении которого 4-я стадия двигательных нарушений в ГБО2 проявилась только у 2 из 11 крыс.
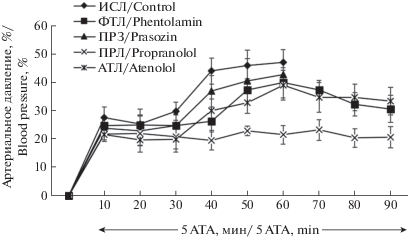
Во время кислородной компрессии у контрольных животных АД повышалось на 19–32% и оставалось на таком уровне 20–30 мин ГБО2-экспозиции, но на стадии 4 двигательных расстройств среднее артериальное давление повторно возрастало на 37–52% по отношению к уровню до кислородной экспозиции. Блокада адренорецепторов перед компрессией кислородом не влияла на первый подъем давления, но достоверно ослабляла его последующее повышение после введения пропранолола (p < 0.008), атенолола (p < 0.05) и фентоламина (p < 0.05), которые предотвращали острую гипертензию и судороги, наблюдаемые у контрольных животных (рис. 1).
Рис. 1.
Динамика артериального давления у крыс во время ГБО2-экспозиции при давлении кислорода 5 АТА после введения адреноблокаторов в мозговой желудочек. При введении ликвора или прозазина продолжительность экспозиции 60 мин. По оси абсцисс: время ГБО2-экспозиции, мин. По оси ординат: изменение артериального давления в % к значениям при дыхании воздухом.
Fig. 1. Time course of blood pressure in rats during HBO2 at 5 ATA after blockade of cerebral adrenergic receptors. During injection of cerebrospinal fluid (control) or prazosin, HBO2 exposure time was 60 min. Abscissa: oxygen breathing time, min. Ordinate: changes in arterial pressure, % vs. initial values during breathing atmospheric air.
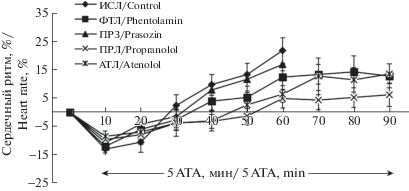
Частота сердечных сокращений в экстремальной гипероксической среде у крыс контрольной группы менялась двухфазно: брадикардия в начале экспозиции с последующим развитием тахикардии (рис. 2). Генерализованный судорожный припадок всегда сопровождался тахикардией и гипервентиляцией. Значение коэффициента вагосимпатического баланса (LF/HF) при дыхании воздухом (контроль) составило 0.24 ± 0.05, через 30 мин ГБО2 увеличилось до 0.36 ± 0.06 (p < 0.05), а в конце кислородной экспозиции понизилось до 0.17 ± 0.02 (p < 0.05). Эти данные свидетельствуют о преобладании парасимпатической активности в начальный период ГБО2 и о выраженном влиянии симпатического отдела вегетативной нервной системы на сердечный ритм. Из четырех адреноблокаторов пропранолол в большей степени (p < 0.001) предотвращал тахикардию, развивающуюся после 30 мин ГБО2-экспозиции (рис. 2).
Рис. 2.
Частота сердечных сокращений у крыс во время ГБО2-экспозиции при давлении кислорода 5 АТА после блокады адренорецепторов головного мозга. По оси абсцисс: время ГБО2-экспозиции, мин. По оси ординат: изменение частоты сердечных сокращений в % к значениям при дыхании воздухом.
Fig. 2. Heart rate in rats during HBO2 exposure at 5 ATA after blockade of adrenergic receptors. Abscissa: oxygen breathing time, min. Ordinate: changes in heart rate, % vs. initial values during breathing atmospheric air.
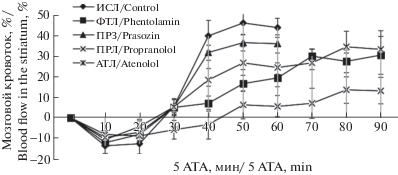
Мозговой кровоток в стриатуме у контрольных крыс в ГБО2 менялся разнонаправленно: снижался в начале экспозиции и увеличивался через 30–40 мин экстремальной гипероксии. Среди антагонистов адренорецепторов только пропранолол достоверно (p < 0.001) предотвращал увеличение кровотока в ходе экспозиции ГБО2 (рис. 3). Неселективный блокатор β1- и β2-рецепторов пропранолол наиболее эффективно предотвращал также нарушение сердечного ритма, изменения артериального давления и мозгового кровотока при дыхании сжатым кислородом под давлением 5 АТА, а также купировал появление эпилептиформных разрядов на ЭЭГ и моторных судорог.
Рис. 3.
Кровоток в стриатуме головного мозга крыс во время ГБО2-экспозиции при давлении кислорода 5 АТА после введения в мозговой желудочек блокаторов адренорецепторов. По оси абсцисс: время ГБО2-экспозиции, мин. По оси ординат: изменение кровотока в % к значениям при дыхании воздухом.
Fig. 3. Blood flow in the striatum during HBО2 exposure at 5 ATA after the administration of adrenergic receptor blockers into the cerebral ventricle. Abscissa: oxygen breathing time, min. Ordinate: changes in blood flow, % vs. initial values during breathing atmospheric air.
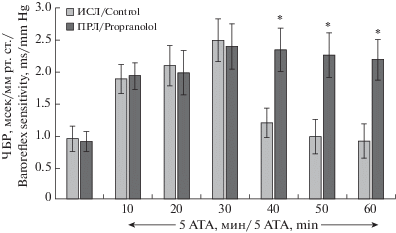
Эффективность барорефлекса в ГБО2 менялась также двухфазно: повышалась в первые 30 мин и полностью утрачивалась на четвертой стадии развития кислородных судорог (рис. 4).
Рис. 4.
Изменение чувствительности барорефлекса (ЧБР) крыс во время ГБО2-экспозиции при давлении кислорода 5 АТА после блокады адренорецепторов мозга. По оси абсцисс: время ГБО2-экспозиции, мин. По оси ординат: изменение ЧБР. * p < 0.05 к значениям при введении ликвора.
Fig. 4. Changes in baroreflex sensitivity (BRS) during HBO2 at 5 ATA after blockade of brain adrenergic receptors. Abscissa: oxygen breathing time, min. Ordinate: changes in baroreflex sensitivity, ms/mm Hg. *p < 0.05 vs. control.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящих исследованиях установлено, что развитие судорожного синдрома в ГБО2 сопровождалось высокой активностью симпатического отдела вегетативной нервной системы, которая проявлялась в виде гипервентиляции, тахикардии и острой гипертензии. Мы предположили, что адренорецепторы головного мозга принимают участие в реализации вегетативных реакций и в развитии кислородных судорог. Для проверки этой гипотезы в опытах на крысах мы блокировали α- и β-адренорецепторы путем внутрижелудочкового введения их селективных и неселективных антагонистов. Последующий анализ реакций ЦНС и вегетативной нервной системы на токсическое действие кислорода под давлением показал, что: (а) у животных с интактными адренорецепторами судорожный синдром развивался последовательно от локальных миоклоний до генерализованных конвульсий, а реакции дыхательной и сердечно-сосудистой систем носили фазный характер, (б) блокада α- и β-адренорецепторов задерживала развитие судорожного синдрома и ослабляла сердечно-сосудистые реакции.
Выявленные вегетативные реакции крыс при дыхании чистым кислородом под давлением 5 АТА носили двухфазный характер. В первые 20–30 мин гипероксии отмечались гиповентиляция легких, умеренная брадикардия и церебральная вазоконстрикция, а продолжение ГБО2-экспозиции приводило к развитию гипервентиляции, тахикардии и острой артериальной гипертензии. Первая фаза реакций является проявлением гипероксического барорефлекса [17, 18], который реализуются путем уменьшения симпатических и увеличения парасимпатических влияний на сердце и сосуды. В физиологическом значении такие реакции ограничивают доставку токсической дозы кислорода к органам и тканям. Существенный вклад в ограничение избыточной доставки кислорода к мозгу вносит также церебральная вазоконстрикция, выявленная в данной работе в виде понижения мозгового кровотока в первые 15–20 мин ГБО2-экспозиции. Важно отметить, что гипероксическая вазоконстрикция не связана с функцией адренорецепторов, так как в наших опытах снижение мозгового кровотока в период компрессии кислородом сохранялось после введения каждого из используемых антагонистов. Как ранее было показано, вазоконстрикция в мозге осуществляется за счет блокирования выделения оксида азота (NO) из эритроцитов при повышенном Ро2 в крови [19] и связывания NO супероксидными анионами в эндотелии сосудов с последующей утратой NО-опосредованного вазодилататорного тонуса [20–22].
Пролонгирование ГБО2-экспозиции приводило к развитию второй фазы сердечно-сосудистых реакций. Анализ частотного спектра сердечного ритма выявил повышение активности симпатического отдела автономной нервной системы. Чувствительность барорефлекса резко снижалась и полностью утрачивалась на фоне высокой активации симпатического отдела вегетативной нервной системы. В других исследованиях в этот период наблюдались положительные хронотропный и инотропный эффекты работы сердца, высокая активность почечного симпатического нерва и значительное увеличение содержания в плазме крови адреналина и норадреналина [18, 23].
Блокада α- и β-адренорецепторов в головном мозге изменяла реакции ЦНС и вегетативной нервной системы на экстремальную гипероксию в зависимости от типа использованных антагонистов. После селективного блокирования α1-рецепторов с помощью празозина время появления двигательных нарушений в ГБО2 и последовательность их появления, равно как и параметры фазных висцеральных реакций, достоверно не отличались от аналогичных ответов, наблюдаемых у контрольной группы животных. Фентоламин, неселективный блокатор группы α-адренорецепторов, оказывал более выраженное противосудорожное действие, чем празозин, но параметры первой фазы висцеральных реакций достоверно не отличались от контрольных значений. Селективный антагонист β1-рецепторов, атенолол, не ослаблял реакций первой фазы, но задерживал развитие второй фазы сердечно-сосудистых реакций и увеличение кровотока в стриатуме. Противосудорожные эффекты внутримозговой инъекции атенолола были более выраженными, чем при внутрибрюшинном введении этого препарата [9]. Выявленное различие является подтверждением того, что атенолол не проникает через гематоэнцефалический барьер и, в случае внутрибрюшинного введения, его эффекты распространяются только на периферические β1-адренорецепторы. Среди использованных нами адреноблокаторов наиболее выраженная способность в ослаблении симпатической активности и в предупреждении кислородных судорог выявлена у пропранолола. Этот неселективный блокатор β1- и β2-адренорецепторов эффективно противодействовал развитию судорожной активности у животных в ГБО2, начиная с предупреждения начальных стадий двигательных нарушений.
Сравнивая эффекты адреноблокаторов, следует отметить, что все использованные адренолитики не ослабляли первую стадию сердечно-сосудистых реакций и, за исключением празозина, задерживали вторую фазу реакций кровообращения и развитие судорожного синдрома. Эффекты пропранолола заметно отличались от действия других адреноблокаторов. Выключение двух подтипов β‑адренорецепторов стабилизировало деятельность легких, сердца и сосудов, предотвращало гиперемию в мозге и защищало от ГБО2-вызванных судорожных приступов в течение 90 мин экспозиции. Поскольку селективная блокада β1-адренорецепторов с помощью атенолола в наших опытах не предотвращала кислородные судороги, можно заключить, что противосудорожный эффект пропранолола связан с блокированием β2-адренорецепторов. Эти рецепторы обнаружены на сосудах мозга, нервных и глиальных клетках [12, 24]. Их различная локализация в мозге затрудняет анализ механизма противосудорожного действия пропранолола в ГБО2. Ряд исследователей полагают, что способность пропранолола предотвращать судороги не связана с блокадой β-адренорецепторов. Так, противосудорожная эффективность пропранолола показана на моделях электрошоковых [25, 26], пентилентетразоловых [27] и киндлинговых [28] судорог. Существуют также данные о применении пропранолола для лечения эпилепсии [28] и других неврологических расстройств различной этиологии [29, 30]. Противосудорожный эффект пропранолола связывают с блокированием натриевых каналов, что ограничивает распространение нейронального возбуждения за счет стабилизации мембран тела нервной клетки и аксонов в области синапса по типу действия фенитоина или карбамазепина [28]. Следует также отметить способность пропранолола уменьшать мозговой кровоток, видимо, через блокирование β2-адренорецепторов сосудов [31]. В наших экспериментах такой “сосудистый” механизм действия пропранолола проявлялся как устранение гиперемии в стриатуме у крыс в ГБО2 после неселективного блокирования β-рецепторов.
Таким образом, выполненные исследования позволяют заключить, что предвестником эпилептиформных кислородных судорог является чрезмерная центральная адренергическая медиация. Активация адренорецепторов при токсической гипероксии может приводить к возбуждению клеток-мишеней во многих структурах мозга и облегчать развитие генерализованного гипервозбуждения, проявляющегося в виде эпилептиформной ЭЭГ-активности и моторных конвульсий. Блокирование β-адренорецепторов посредством внутримозгового введения пропранолола предотвращает чрезмерную симпатическую активность в ГБО2 и купирует развитие судорожного синдрома. Полученные результаты могут быть использованы для разработки методов предупреждения судорог при дыхании кислородом под давлением с целью более эффективного и безопасного использования гипербарического кислорода в медицине и при подводных погружениях.
Список литературы
Bean J.W., Johnson P.C. Epinephrine and neurogenic factors in the pulmonary edema and CNS reactions induced by O2 at high pressure. Am. J. Physiol. 180: 438–444. 1955.
Зальцман Г.Л. Стадии развития кислородной эпилепсии и функциональное состояние нервной системы. В кн. Гипербарические эпилепсия и наркоз. Л.: Наука. 1968, 11–18. [Zaltsman G.L. Stages of oxygen epilepsy development and the functional state of the nervous system. In: Hyperbaric epilepsy and narcosis. Leningrad: Nauka. 1968. 11–18. (In Russ)].
Balentine J.D. Pathology of Oxygen Toxicity. NY: Academic. 1982.
Селивра А.И. Гипербарическая оксигенация. Физиологические механизмы реакций центральной нервной системы на гипероксию. Л.: Наука. 1983. [Selivra A.I. Hyperbaric oxygenation. Physiological mechanisms of reactions of the central nervous system to hyperoxia. Leningrad: Nauka. 1983. (In Russ)].
Ciarlone G.E., Hinojo C.M., Stavitzski N.M., Dean J.B. CNS function and dysfunction during exposure to hyperbaric oxygen in operational and clinical settings. Redox. Biol. 27: 101159. 2019. https://doi.org/10.1016/j.redox.2019.101159
Bean J.W., Zee D., Thom B. Pulmonary changes with convulsions induced by drugs and oxygen at high pressure. J. Appl. Physiol. 21 (3): 865–872. 1966. https://doi.org/10.1152/jappl.1966.21.3.865
Demchenko I.T., Zhilyaev S.Y., Moskvin A.N., Pian-tadosi C.A., Allen B.W. Autonomic activation links CNS oxygen toxicity to acute cardiogenic pulmonary injury. Am. J. Physiol. Lung Cell. Mol. Physiol. 300 (1): L102–L111. 2011. https://doi.org/10.1152/ajplung.00178.2010
Pilla R., Landon C.S., Dean J.B. A potential early physiological marker for CNS oxygen toxicity: hyperoxic hyperpnea precedes seizure in unanesthetized rats breathing hyperbaric oxygen. J. Appl. Physiol. (1985). 114 (8): 1009–20. 2013. https://doi.org/10.1152/japplphysiol.01326.2012
Gasier H.G., Demchenko I.T., Moskvin A.N., Zhilyaev S.Yu., Krivchenko A.I., Piantadosi. C.A. Adrenoceptor blockade modifies cardiovascular and regional cerebral blood flow responses to hyperbaric hyperoxia: Protection against CNS oxygen toxicity. J. Appl. Physiol. (1985). 2018. https://doi.org/10.1152/japplphysiol.00540.2018
Agon P., Goethals P., Van Haver D., Kaufman J.M. Permeability of the blood-brain barrier for atenolol. J. Pharm. Pharmacol. 43 (8): 597–600. 1991. https://doi.org/10.1111/j.2042-7158.1991.tb03545.x
Ciccarelli M., Sorriento D.E., Coscioni E., Iaccarino G., Santulli G. Adrenergic Receptors. In book: Endocrinology of the Heart in Health and Disease. Chapter 11: 285–315. Elsevier. 2016.
Oshima N., Onimaru H., Yamamoto K., Takechi H., Nishuda Y., Oda T., Kumagai H. Expression and functions of β1- and β2-adrenergic receptors on the bulbospinal neurons in the rostral ventrolateral medulla. Hypertens. Res. 37 (11): 976–983. 2014. https://doi.org/10.1038/hr.2014.112
Wang F., Lidow M.S. Alpha 2A-adrenergic receptors are expressed by diverse cell types in the fetal primate cerebral wall. J. Comp. Neurol. 378: 493–507. 1997.
Bylund D.B. Subtypes of α1- and α2-adrenergic receptors. FASEB J. 6 (3): 832–839. 1992. https://doi.org/10.1096/fasebj.6.3.1346768
Hertz L., Lovatt D., Goldman S.A., Nedergaard M. Adrenoceptors in Brain: Cellular Gene Expression and Effects on Astrocytic Metabolism and [Ca2+]i. Neurochem. Int. 57 (4): 411–420. 2010. https://doi.org/10.1016/j.neuint.2010.03.019
Демченко И.Т. Измерения органного кровотока методом водородного клиренса. Физиол. ж. СССР им. И.М. Сеченова. 67 (1): 178-183. 1981. [Demchenko I.T. Measurement of organ blood flow by the method of hydrogen clearance. Fiziol. zh. SSSR im. I.M. Sechenova. 67 (1): 178–183. 1981. (In Russ)].
Жиляев С.Ю., Платонова Т.Ф., Алексеева О.С., Никитина Е.Р., Демченко И.Т. Адаптивные механизмы барорефлекторной регуляции сердечно-сосудистой системы при экстремальной гипероксии. Ж. эвол. биохим. и физиол. 55 (5): 23–30. 2019. [Zhilyaev S.Yu., Platonova T.F., Alekseeva O.S., Nikitina E.R., Demchenko I.T. Adaptive mechanisms of baroreflectory regulation of the cardiovascular system in extreme hyperoxia. J. evol. biochem. and physiol. 55 (5): 365-371. 2019.]
Demchenko I.T., Zhilyaev S.Y., Moskvin A.N., Kri-vchenko A.I., Piantadosi C.A., Allen B.W. Baroreflex-mediated cardiovascular responses to hyperbaric oxygen. J. Appl. Physiol. (1985) 115 (6): 819–828. 2013. https://doi.org/10.1152/japplphysiol.00625.2013
Stamler J.S., Jia L., Eu J.P., McMahon T.J., Demchenko I.T., Bonaventura J., Gernert K., Piantadosi C.A. Blood flow regulation by S-nitrosohemoglobin in the physiological oxygen gradient. Science. 276 (5321): 2034–2037. 1997. https://doi.org/10.1126/science.276.5321.2034
Oury T.D., Ho Y.S., Piantadosi C.A., Crapo J.D. Extracellular superoxide dismutase, nitric oxide, and central nervous system O2 toxicity. Proc. Natl. Acad. Sci. USA. 89 (20): 9715–9719. 1992. https://doi.org/10.1073/pnas.89.20.9715
Demchenko I.T., Boso A.E., Bennett P.B., Whorton A.R., Piantadosi C.A. Hyperbaric oxygen reduces cerebral blood flow by inactivating nitric oxide. Nitric Oxide. 4 (6): 597–608. 2000. https://doi.org/10.1006/niox.2000.0313
Жиляев С.Ю., Москвин А.Н., Платонова Т.Ф., Гуцаева Д.Р., Чурилина И.В., Демченко И.Т. Гипероксическая вазоконстрикция в головном мозгу реализуется путем инактивации оксида азота супероксидными анионами. Росс. физиол. ж. 88 (5): 553-559. 2002. [Zhilyaev S.Yu., Moskvin A.N., Platonova T.F., Gutsaeva D.R., Demchenko I.T., Churilina I.V. Hyperoxic vasoconstriction in the brain is mediated by inactivation of nitric oxide by superoxide anions. Neurosci. Behav. Physiol. 33 (8): 783–787. 2003.] https://doi.org/10.1023/a:1025145331149
Demchenko I.T., Moskvin A.N., Krivchenko A.I., Pian-tadosi C.A., Allen B.W. Nitric oxide-mediated central sympathetic excitation promotes CNS and pulmonary O2 toxicity. J. Appl. Physiol. 112 (11): 1814–1823. 2012. https://doi.org/10.1152/japplphysiol.00902.2011
U'Prichard D.C., Snyder S.H. Distinct α-noradrenergic receptors differentiated by binding and physiological relationship. Life Sci. 24: 79–88. 1979.
Fischer W., Lasek R., Mü ller M. Anticonvulsant effects of propranolol and their pharmacological modulation. Pol. J. Pharmacol. Pharm. 37 (6): 883–896. 1985.
Mohan A., Nathiya S., Raja A. Anticonvulsant effect of propranolol in maximum electro shock method induced convulsions in rats. J. Pharm. Res. 12 (4): 656–659. 2018.
Louis W.J., Papanicolaou J., Summers R.J., Vajda F.J.E. Role of central beta-adrenoceptors in the control of pentylenetetrazol-induced convulsions in rats. Br. J. Pharmacol. 75 (3): 441–446. 1982. https://doi.org/10.1111/j.1476-5381.1982.tb09159.x
Fischer W. Anticonvulsant profile and mechanism of action of propranolol and its two enantiomers. Seizure. 11 (6): 285–302. 2002. https://doi.org/10.1053/seiz.2001.0644
Anlezark G., Horton R., Meldrum B. The anticonvulsant action of the (–)- and (+)-enantiomers of propranolol. J. Pharm. Pharmacol. 31 (7): 482–483. 1979. https://doi.org/10.1111/j.2042-7158.1979.tb13563.x
Eugene A.R., Nicholson W.T. The Brain and Propranolol Pharmacokinetics in the Elderly. Brain. 6 (1–4): 5–14. 2015.
Dahlgren N., Ingvar M., Siesjo B.K. Effect of Propranolol on Local Cerebral Blood Flow under Normocapnic and Hypercapnic Conditions. J. Cereb. Blood Flow Metab. 1 (4): 429–436. 1981. https://doi.org/10.1038/jcbfm.1981.47
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


