Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 3, стр. 257-271
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ОСЦИЛЛЯТОРНОЙ АКТИВНОСТИ МОЗГА ОБЕЗЬЯН MACACA MULATTA
А. К. Хараузов 1, *, М. А. Климук 1, В. А. Пономарев 2, Л. Е. Иванова 1, Д. Н. Подвигина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
* E-mail: harauzov@infran.ru
Поступила в редакцию 24.10.2020
После доработки 31.01.2021
Принята к публикации 01.02.2021
Аннотация
Хорошо известно, что ритмическая световая стимуляция способна изменять электрическую активность мозга человека и животных. Причем реакция мозга на определенные частоты мельканий значительно превышает отклики на соседние частоты. Это явление связывают с эффектом резонанса и в качестве доказательства приводят совпадение одного из максимумов в профиле реакции на вспышки с частотой альфа-ритма. Однако другие частоты, вызывающие увеличенную реакцию на вспышки, не находят отражения в виде доминирующих осцилляций в электроэнцефалограмме. Цель данного исследования заключалась в поиске взаимосвязи между локальными максимумами в профиле реакции на вспышки разной частоты и доминирующими осцилляциями мозга, регистрируемыми в электрокортикограмме (ЭКоГ) обезьян без стимуляции.
Исследование было проведено на четырех самцах обезьян Macaca mulatta. У трех животных максимальные реакции вызывали вспышки с частотой 8 и 16 Гц, в то время как у одного примата наблюдали пики на частоте 8 Гц и в диапазоне 22–30 Гц. Первый максимум в профиле реакции на ритмическую фотостимуляцию совпадал с доминирующим ритмом, регистрируемым у обезьян в покое в затылочных и теменных областях – 8–10 Гц. Второй максимум на частоте 16 Гц совпал с доминирующим ритмом в ЭКоГ одного примата, когда он был в состоянии эмоционального возбуждения, что может объяснить резонансную природу увеличения ответов в этом частотном диапазоне.
Полученные данные говорят о том, что доминирующие ритмы мозга, в том числе и скрытые ритмы, выявляемые только с помощью ритмической фотостимуляции, могут совпадать по частоте у обезьян и человека. Обсуждаются нейронные механизмы избирательной чувствительности нейронных сетей к различным частотам фотостимуляции.
ВВЕДЕНИЕ
Ритмические осцилляции являются фундаментальным и определяющим свойством нейронной активности у человека и животных. Они сложным образом взаимодействуют с ритмами внутренней и внешней среды посредством феномена навязывания ритма или вовлечения нейронов, который привлекает все большее внимание из-за предполагаемой роли во множестве сенсорных и когнитивных процессов [1]. В электрофизиологических исследованиях на человеке [2, 3], обезьянах [4, 5] и кошках [6] было показано, что реакция мозга на ритмическую световую стимуляцию изменяется неравномерно с изменением частоты стимуляции. Зависимость величины ответа от частоты стимуляции, или профиль реакции на вспышки, характеризуется локальными максимумами, предположительно отражающими эффект резонанса, когда частота внешнего воздействия совпадает с частотой внутренних осцилляций мозга, обычно выявляемых в спектре ЭЭГ как доминирующие ритмы.
Гипотеза о резонансной природе фотодинамической реакции была высказана более семидесяти лет назад [2], а затем была принята и экспериментально подтверждена многими исследователями. В основном сообщается об увеличении электрофизиологических реакций в ответ на вспышки с частотой около 10 Гц, соответствующей частоте альфа-ритма, доминирующего в ЭЭГ взрослого человека [7–9]. Однако встречаются электрофизиологические свидетельства существования еще как минимум двух локальных максимумов в профиле реакции на ритмическую световую стимуляцию. В основном они встречаются в бета- и гамма- частотном диапазоне, причем конкретные значения частот не всегда совпадают в разных исследованиях [3, 10, 11]. По нашим данным, прямых соответствий между этими локальными максимумами и доминирующими ритмами в ЭЭГ человека или животных до сих пор не обнаружено.
В настоящее время считается, что дифференцированная работа разных нейронных цепей в головном мозге происходит на разных конкретных частотах; поэтому увеличенная реакция на определенные частоты вспышек демонстрирует способность ритмической световой стимуляции выявлять и подчеркивать резонанс скрытых нейронных осцилляторов, имеющих узкополосную частотную настройку, и межнейронных источников синхронизации [7]. В недавних исследованиях электрической активности, регистрируемой непосредственно с поверхности мозга (электрокортикограмма, ЭКоГ), были зафиксированы осцилляции с частотой 16 Гц в моторной и соматосенсорной коре обезьяны в состоянии покоя [12]. В наших экспериментах в этом же частотном диапазоне был зафиксирован выраженный пик в спектре ЭКоГ обезьяны, находящейся в состоянии эмоционального возбуждения, вызванного просмотром видео [13]. Поэтому логично предположить, что на этой частоте световой стимуляции может быть зафиксирована резонансная реакция в мозге обезьяны.
Таким образом, целью нашего исследования было выявление взаимосвязи между локальными максимумами в профиле реакции на вспышки разной частоты и доминирующими ритмами мозга, регистрируемыми в ЭКоГ обезьян без стимуляции, причем не только в альфа-диапазоне, но и на более высоких частотах. Для этого необходимо тщательно проанализировать резонансные частоты в мозге обезьян с помощью широкого диапазона частот мелькания вспышек и сопоставить полученные данные со спектральными характеристиками ЭКоГ, записанной в отсутствие стимуляции, в разных условиях – в покое и в состоянии эмоционального возбуждения. Профиль реакции мозга на световую стимуляцию разной частоты оценивали с помощью усреднения так называемых устойчивых вызванных потенциалов, отражающих синхронизированную активность нейронов, занятых в обработке зрительного сигнала.
Выбранный метод регистрации биоэлектрической активности мозга является аналогом регистрации ЭЭГ и вызванных потенциалов у человека. Он наиболее подходит для наших целей, так как обладает высоким временным разрешением и, помимо исследовательских целей, применяется в клинической практике, в частности для выявления фотопароксизмальных реакций. Учитывая, что обезьяны являются наиболее близкими к человеку животными по анатомо-физиологическим характеристикам, информацию об электрических процессах в мозге обезьян можно до некоторой степени экстраполировать на людей. Поэтому, помимо фундаментального значения данного вопроса для понимания принципов функционирования человеческого мозга, информация о резонансных частотах важна для создания безопасной визуальной среды в современных условиях проживания человека.
МАТЕРИАЛЫ И МЕТОДИКА
Подготовка животных к эксперименту
Исследовали электрическую активность головного мозга у четырех обезьян Macaca mulatta, в возрасте от 7 до 15 лет, средний возраст на момент исследования составлял 10 лет. Все обезьяны с рождения содержались в виварии Института физиологии им. И.П. Павлова РАН. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтического комитета Института физиологии им. И.П. Павлова РАН.
Каждому животному перед операцией по вживлению электродов были проведены сканирование головного мозга методом магнитно-резонансной томографии и сканирование костей черепа методом компьютерной томографии. На основе томографических данных планировали размещение поверхностных электродов таким образом, чтобы они равномерно охватывали все основные области мозга.
Операции проводили под общим наркозом, используя сочетание препаратов Золетил (в среднем 4.13 мг/кг/ч) и Рометар 2% (0.01 мг/кг/ч). Голову животного фиксировали в стереотаксическом аппарате. Электроды крепили к кости над затылочной, теменной, центральной и лобной областями мозга, по центральной линии, в левом и правом полушарии, по аналогии с международной системой размещения электродов для регистрации ЭЭГ человека “10-20” (рис. 1). Референтный электрод помещали под кожу в загривок. Заземляющий электрод прикрепляли к кости в области вертекса.
В качестве электродов использовали титановые микровинты для краниопластики, которыми крепили к поверхности черепа медные позолоченные пластинки, к которым были припаяны отводящие провода с тефлоновой изоляцией. Длину каждого микровинта подбирали на основе данных о толщине кости черепа, полученных с помощью компьютерной томографии, для каждого животного, в данном участке. Таким образом, микровинты полностью находились в кости, а их концы располагались на расстоянии менее 1 мм от твердой мозговой оболочки. Такая схема позволяла отводить электрические сигналы непосредственно от поверхности мозга животного, что, по сути, являлось регистрацией электрокортикограммы (ЭКоГ) с более высоким пространственным и временным разрешением по сравнению с обычной ЭЭГ, регистрируемой со скальпа [12, 14]. Каждый электрод в месте крепления изолировали с помощью стоматологического цемента. Отводящие провода собирали в пучок в области макушки для последующего подключения к усилителю. После чего проводили ушивание мягких тканей головы, формируя кольцо вокруг пучка проводов, за которым впоследствии проводили постоянный асептический уход. По окончании всех электрофизиологических экспериментов обезьяну направляли на повторное сканирование костей черепа с помощью компьютерной томографии для верификации положения электродов на черепе. После чего проводили операцию по удалению электродов и остатков цемента из головы животного. Затем, после периода реабилитации, животное возвращали в общий виварий.
Стимуляция, регистрация и анализ биоэлектрической активности
На 5–7-й день послеоперационного восстановления и адаптации к приматологическому креслу начинали эксперименты по регистрации ЭКоГ в покое и вызванных потенциалов на вспышки. Животные находились в приматологическом кресле в темном помещении во время световой стимуляции, а во время регистрации ЭКоГ в покое, без стимуляции – при постоянной освещенности 300 лк. Световую стимуляцию осуществляли с помощью стандартного светодиодного стимулятора “Мицар-фото-02”, расположенного перед головой животного на расстоянии 2 м. Продолжительность каждой вспышки яркостью 30 кандел/м2 составляла 10 мс.
Всего использовали 21 частоту мелькания вспышек – от 2 до 42 Гц с шагом 2 Гц. Стимуляция начиналась после трехминутной адаптации к темноте с начальной частоты 2 Гц, которая сменялась следующей частотой 4 Гц, затем 6 Гц и так далее по возрастанию. Во время стимуляции движения головы животного ограничивали таким образом, чтобы она была направлена в сторону вспышки. Регистрацию движений глаз не проводили, поэтому, для повышения достоверности данных, стимуляция каждой частотой длилась довольно долго – 3 мин, а каждый полный эксперимент повторяли более 10 раз в отдельные дни.
Электрические потенциалы с поверхности мозга поступали на многоканальный усилитель “Мицар-ЭЭГ 202” с частотой дискретизации 2 кГц. Сопротивление электродов составляло 1–10 кОм. Регистрацию и анализ ЭКоГ осуществляли с помощью программы WinEEG (автор В.А. Пономарев). Электрокортикограмму фильтровали в полосе частот от 1 до 500 Гц. Удаление артефактов, связанных с движениями, осуществляли в автоматическом режиме на основе амплитудного порога, который подбирали для каждого животного эмпирически, путем многократного выполнения процедуры автоматического удаления артефактов с последующим визуальным анализом.
Изменения в ЭКоГ, вызываемые ритмической световой стимуляцией, выявляли с помощью анализа так называемых устойчивых вызванных потенциалов (steady-state evoked potentials). Для каждой частоты стимуляции усредняли участки ЭКоГ длительностью 1 с таким образом, что начало выбранного интервала совпадало с моментом включения первой вспышки в каждой из эпох записи ЭЭГ. В результате усреднения спонтанные колебания электрического потенциала подавлялись, и выделялись синхронные с фотостимуляцией по фазе осцилляции ЭЭГ, соответствующие частоте предъявления вспышек. Мощность этих осцилляций была выбрана нами для оценки величины отклика зрительной системы на вспышки света. Для этого вычисляли мощность синусоидальных составляющих усредненного сигнала ЭКоГ на частотах ритмической стимуляции, что позволяло исключить эффект “растекания” мощности по соседним спектральным отсчетам.
Электрокортикограмму в состоянии покоя регистрировали у бодрствующих приматов в течение 15–20 мин без каких-либо задач и отвлекающих стимулов. Особое внимание уделяли оценке состояния бодрствования – если животное во время регистрации начинало дремать, что отражалось в появлении низкочастотных колебаний в ЭКоГ, такие участки удаляли из записи. Регистрацию электрической активности в покое повторяли у каждого животного более 10 раз в разные дни, что в сумме давало около 3 ч записи.
Для изучения влияния эмоционального возбуждения на осцилляторную активность мозга приматов у трех животных записывали ЭКоГ во время просмотра видео про своих сородичей, обитающих в дикой природе. Использовали документальные фильмы компании BBC, которые предъявляли с экрана компьютера, расположенного на расстоянии 1 м от головы животного. Для повышения достоверности выявляемых изменений в ритмической активности мозга эксперименты с просмотром фильмов повторяли более 10 раз в разные дни. Длительность каждой записи, как и в условиях покоя, составляла 15–20 мин.
После исключения двигательных артефактов для каждого животного были рассчитаны Фурье-спектры полученной ЭКоГ. Для этого весь анализируемый интервал разбивали на полуперекрывающиеся эпохи, длительностью 4 сек. Для подавления просачивания энергии через боковые максимумы каждый отрезок сглаживался временным окном Ханна. Затем, с помощью “быстрого преобразования Фурье”, вычисляли спектр мощности (периодограмму). Статистическую значимость выявляемых закономерностей подтверждали с помощью двухстороннего t-критерия Стьюдента для зависимых или независимых выборок в зависимости от ситуации. За порог достоверности принимали гипотезы с вероятностью ошибки менее 5%.
РЕЗУЛЬТАТЫ
В состоянии покоя у всех четырех обезьян в спектрах ЭКоГ выделялись пики на частоте 8–10 Гц, которые были максимально выражены в теменных и затылочных отведениях. В центральных и лобных отведениях эти пики имели значительно меньшую амплитуду, либо пропадали совсем. Каких-либо дополнительных доминирующих осцилляций в центральных и лобных областях у обезьян без стимуляции выявлено не было.
У животного № 2 наблюдали второй пик в спектре на частоте около 20 Гц, преимущественно локализованный в теменных областях. Это была единственная обезьяна, у которой в ЭКоГ регистрировали два выраженных ритма, локализованных в различных областях и возникающие в разное время. На рис. 2 представлен фрагмент ЭКоГ животного № 2, в котором видны так называемые веретена осцилляций, длительностью 600 и более мс, с частотой 8 и 20 Гц. Видно, что появление этих ритмов не совпадает по времени и по локализации. Первый ритм с преобладающей частотой 8 Гц наиболее отчетливо проявлялся на канале Oz, и по нашим наблюдениям, вероятность его возникновения возрастала, когда обезьяна была более спокойна, расслаблена. Второй ритм чаще всего наблюдали в отведениях Р3 и Р4, частота его варьировала от 18 до 21 Гц, что отражалось в более широком пике в спектре (см. рис. 3). По нашим наблюдениям, этот ритм больше соответствовал состоянию сосредоточенности, когда животное что-нибудь рассматривало, прислушивалось и т.п. Хотя, как следует из рис. 2, оба ритма могут сменять друг друга по нескольку раз за 5–6 сек измерения.
Рис. 2.
Пример ЭКоГ примата № 2, находящегося в состоянии покоя. Цифрами показана частота некоторых осцилляций.
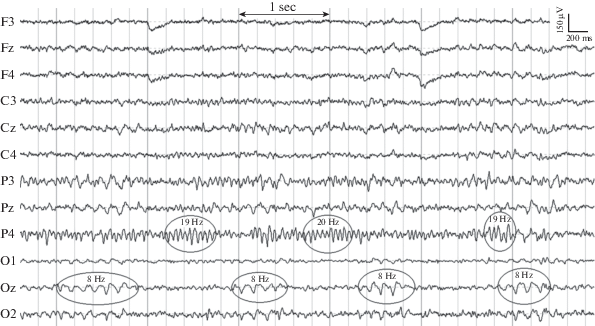
Рис. 3.
Спектры ЭКоГ, регистрируемой в центре теменной области (электрод Pz, серая линия) и в центре затылочной области (электрод Oz, черная линия) у животных № 1, № 2, № 3 и № 4 в покое. Цифрами указана частота доминирующих осцилляций.
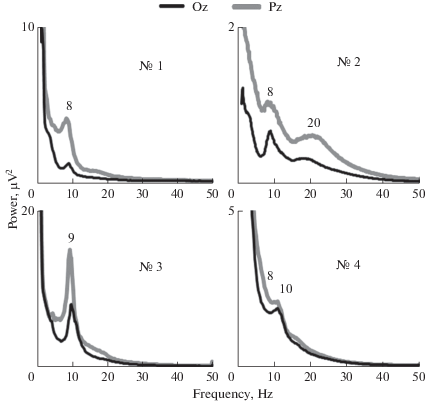
Усредненные по всем измерениям спектры ЭКоГ представлены на рис. 3. Для каждого животного показаны результаты измерения в центре теменной и затылочной области (каналы Pz и Oz соответственно). Как видно на рисунке, частота пиков в диапазоне 8–10 Гц не зависит от места отведения, меняется только их амплитуда, что предполагает существование общего источника осцилляторной активности, расположение которого относительно регистрирующих электродов немного различается у некоторых животных. Так, если рассматривать величину этих пиков без учета постоянной составляющей (например, как размах между максимумом в центре пика и ближайшим минимумом слева от пика), то у приматов № 1 и № 3 пик 8–10 Гц локализован ближе к теменной области, у животного № 4 он распределен между затылочной и теменной областью, а у животного № 2 этот пик более выражен в затылочной области.
Как уже упоминалось выше, у примата № 2 в спектре отчетливо проявляется второй пик с максимумом частоты в районе 20 Гц. Несмотря на то что осцилляции на этих частотах чаще всего наблюдали в латеральных теменных отведениях (каналы Р3 и Р4), этот пик хорошо виден и в центре теменной области (канал Рz), но гораздо слабее прослеживается в центре затылочной области (канал Oz).
Во время показа фильмов про макак, животные № 1 и № 3 не проявили особого интереса к видео, и в электрической активности их мозга изменений не наблюдали. В то время как примат № 4, по кличке Юпидер, эмоционально реагировал на предъявляемое видео. Он внимательно смотрел за происходящим на экране, издавал коммуникативные звуки, гримасничал, и по поведению примата было очевидно, что он испытывает сильное эмоциональное возбуждение. Эмоциональное возбуждение, вызываемое просмотром фильма, приводило к снижению мощности пика на частоте 10 Гц и появлению в спектре нового пика на частоте 16 Гц. Наиболее выражены эти изменения были в теменной области.
На рис. 4a представлены усредненные спектры ЭКоГ теменной области у примата № 4 за все время регистрации в состоянии покоя и за все время просмотра фильма. Следует отметить, что мощность для всех частот в спектре, зарегистрированном у обезьяны при просмотре фильма, была примерно в два раза ниже, чем в состоянии покоя (см. левую и правую шкалу на рис. 4а). Особенно это отличие выражено в области низких частот, что отражается в изменении общего наклона спектра.
Рис. 4.
(a) – Спектры ЭКоГ, регистрируемой у животного № 4 в центре теменной области в покое (черная линия) и в состоянии эмоционального возбуждения (серая линия). (b) – увеличенный участок спектра ЭКоГ, регистрируемой во время просмотра видео, содержащий пик на частоте 16 Гц. Штриховкой указан способ оценки площади этого пика.
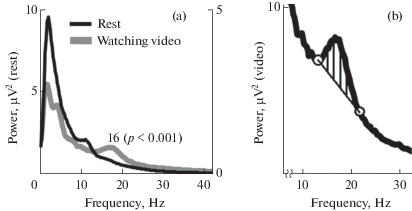
Мощность ЭКоГ, также как и форма спектров мощности значительно зависела от условий эксперимента. При этом на спектрах мощности ЭКоГ наблюдались хорошо выраженные отдельные пики, величина которых также зависела от условий эксперимента. Предположим, что ЭКоГ представляет собой суперпозицию нескольких сигналов (компонент). Допустим, что некоторое подмножество этих компонент в сумме имеет спектр мощности, представляющий собой монотонно убывающую функцию, причем суммарная мощность этих компонент зависит от условий. Кроме того, имеются другие компоненты, сигналы которых отражаются в пиках на спектре мощности. Учитывая то, что мощность первых компонент может зависеть от условий, непосредственное сравнение спектров мощности не позволяет оценить статистическую значимость зависимости мощности вторых компонент от вида выполняемой обезьяной деятельности. Но если также предположить, что первые и вторые компоненты взаимно некоррелированы, тогда имеется возможность приблизительно оценить величину мощности последних, вычислив площадь заштрихованных областей, показанных на рис. 4b, для каждого спектра отдельно, и выполнить статистическое сравнение этих величин при разных условиях.
Для того чтобы вычислить площадь пика в спектре на частоте 16 Гц, сначала вычисляли суммарную мощность в диапазоне 13–22 Гц, ограничивающем данный пик. Затем из полученного результата вычитали среднее значение мощности на границах этого окна – на частотах 13 и 22 Гц (пустые кружки на рис. 4b), умноженное на число гармоник в указанном диапазоне. Сравнение результатов измерений площади этого пика в покое, полученных за все дни экспериментов (n = 33) со значениями, полученными во время просмотра фильма (n = 23), показало, что значения различаются с высокой степенью достоверности (р < 0.001; двусторонний t-критерий Стьюдента для независимых выборок).
Во время просмотра обезьяной фильма частота этого пика была стабильна в разные дни проведения экспериментов и составляла около 16 Гц. При этом мы не наблюдали других максимумов в диапазоне 10–16 Гц. Поэтому в данном случае уместно говорить именно о появлении нового пика на частоте 16 Гц, а не об увеличении частоты осцилляций с 10 до 16 Гц. В противном случае мы бы наблюдали более широкий пик за счет увеличения ритмической активности на промежуточных частотах этого диапазона, в зависимости от степени эмоционального возбуждения.
Ритмическая световая стимуляция приводила к появлению в спектре мощности электрокортикограммы пиков, соответствующих частоте стимуляции, наряду с которыми наблюдали дополнительные пики, кратные этой частоте. Локализованы все пики преимущественно в затылочных областях. На рис. 5a представлены примеры спектров ЭКоГ затылочной области у животного № 1 во время стимуляции вспышками с различной частотой. Видно, что основная мощность ответа содержится в первой гармонике, соответствующей частоте стимуляции, величина остальных гармоник существенно меньше.
Рис. 5.
Примеры спектров ЭКоГ (а) и устойчивых вызванных потенциалов (b) в ответ на периодическую световую стимуляцию. Животное № 1. Отведение от центра затылочной области (электрод Oz).
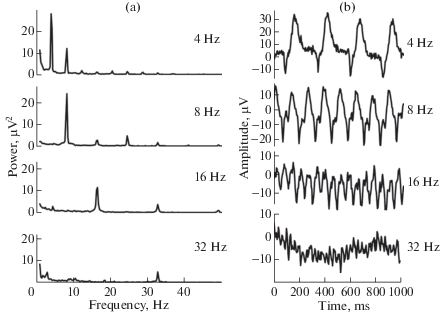
На рис. 5b показаны примеры устойчивых вызванных потенциалов, усредненных в ответ на предъявление вспышек с той же частотой, что на рис. 5а, для того же животного. Все ответы имеют периодическую форму в зависимости от частоты стимуляции, однако они далеки от чистой синусоиды, что согласуется с наличием в спектрах дополнительных гармоник. За величину ответа принимали амплитуду первой гармоники вызванного потенциала, соответствующей частоте стимуляции. Это значение более точно отражает отклик зрительной системы на вспышки, чем амплитуда первой гармоники в спектре, поскольку вызванные потенциалы синхронизированы по времени со вспышками, соответственно, они менее подвержены влиянию артефактов или ритмов, не связанных со стимуляцией [15].
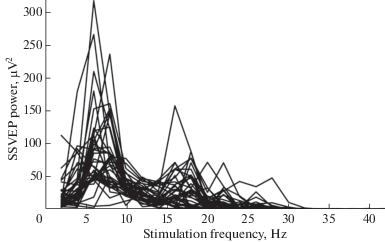
По результатам каждого эксперимента анализировали зависимость мощности первой гармоники устойчивых вызванных потенциалов от частоты стимуляции, что представляло собой профиль реакции зрительной системы на предъявление вспышек с разной частотой. На рис. 6 представлено 36 профилей реакции, полученных в центре затылочной области у животного № 1 в разные дни. Каждая линия – результат одного эксперимента. Как видно, мощность ответа сильно варьирует от эксперимента к эксперименту, но форма зависимости достаточно устойчива. У данного животного можно выделить два локальных максимума: первый возникает при частоте стимуляции 6 и 8 Гц, второй наблюдается на частотах 16 и 18 Гц. Отметим, что точная частота, вызывающая максимальный отклик, может меняться день ото дня. Например, во втором резонансном диапазоне максимум чаще всего наблюдается на 16 или 18 Гц, реже встречается максимум на 20 и на 22 Гц. По мере увеличения частоты стимуляции вероятность регистрации максимального ответа снижается. Таким образом, можно говорить об увеличении вероятности возникновения резонансной реакции в двух диапазонах частот 6–8 Гц и 16–18 Гц. Этим объясняется необходимость большого количества повторений одного и того же эксперимента.
Рис. 6.
Зависимости мощности первой гармоники устойчивых вызванных потенциалов от частоты фотостимуляции, полученные на животном № 1 в разные дни эксперимента. (n = 36; электрод Oz).
На рис. 7 представлены усредненные профили реакции, полученные в 36 экспериментах, проведенных на животном № 1. Показаны все электроды, расположенные в лобных, центральных, теменных и затылочных областях. Наибольшие отклики предсказуемо наблюдали в затылочных отведениях (электроды O1, Oz и О2), расположенных над областями зрительной коры. По мере удаления от затылочной области мощность ответов на вспышки постепенно снижалась, что отражено в различиях шкал по оси ординат на рис. 7.
Рис. 7.
Усредненные за 36 опытов зависимости мощности первой гармоники устойчивых вызванных потенциалов от частоты фотостимуляции. Животное № 1. Расположение графиков на рисунке примерно соответствует локализации электродов на черепе. Планки погрешности – ошибка среднего.
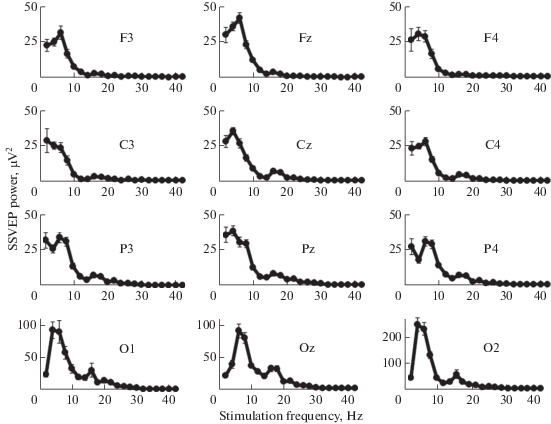
Повторяющихся межполушарных различий в профиле реакции не наблюдали. У данного животного мощность ответов на все частоты стимуляции в затылочной области правого полушария была примерно в два раза выше, чем в левом полушарии или в центральном затылочном отведении (см. шкалу ординат в канале О2 на рис. 7). Однако на других обезьянах такие различия не повторялись. Даже если на левом или правом электродах ответы иногда были сильнее, чем на центральных электродах, их зависимости от частоты стимуляции были менее стабильными, поэтому для дальнейшего анализа мы выбрали центральные электроды, расположенные в затылочной области.
Результаты, полученные на четырех животных, показали, что их профили реакции имеют по крайней мере два локальных максимума в ответах на световую стимуляцию разной частоты (рис. 8). Статистическая значимость этих максимумов была подтверждена с помощью t-критерия для зависимых выборок – в каждом отдельном эксперименте мы сравнили максимальные ответы (отмечены пустыми кружками) с ответами на предшествующие частоты (отмечены пустыми треугольниками). Первый резонансный эффект мы наблюдали в затылочной области у животных № 1, № 2 и № 3 в ответ на стимуляцию с частотой 8 ± 2 Гц. Животное № 4 показало такой же локальный максимум на частоте 8 Гц, но не на затылочном, а на соседнем теменном электроде (на рисунке обозначен серой линией). Второй резонансный пик наблюдался у животных № 1, № 3 и № 4 при частоте стимуляции 16 ± 2 Гц. У животного № 2 наблюдалось усиление ответов в гораздо более высоком и широком частотном диапазоне – с 22 до 30 Гц, а локальный минимум ответов на частоте 20 Гц совпал со вторым пиком в спектре ЭКоГ, полученной в покое, без стимуляции (см. рис. 3). У животного № 4 мы также наблюдали небольшое увеличение ответов в диапазоне частот 26–28 Гц с максимумом на частоте 26 Гц. Однако это увеличение не достигло порога статистической значимости (р = 0.18 при сравнении с ответами на вспышки 22 Гц).
Рис. 8.
Усредненные зависимости мощности первой гармоники устойчивых вызванных потенциалов от частоты фотостимуляции у четырех животных. Для всех обезьян показаны результаты затылочного электрода (канал Oz, черные линии). Дополнительно, у животного № 4 приведен результат теменного отведения (канал Pz, серая линия). Цифрами указаны частоты локальных максимумов. Пустые кружки означают частоты стимуляции, ответ на которые значимо больше, чем на соседние частоты слева, обозначенные пустыми треугольниками (t-тест для зависимых выборок, p < 0.05, n – число измерений). Планки погрешности – ошибка среднего.
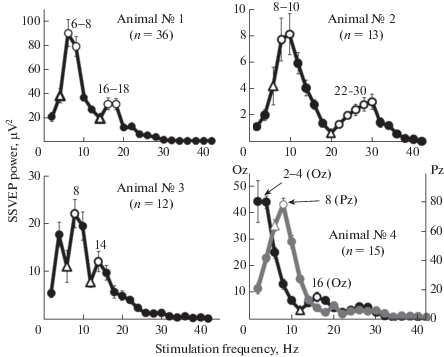
Полученные результаты обобщены в таб. 1, где указаны значения частот доминирующих пиков в спектрах ЭКоГ, наблюдаемых у обезьян без стимуляции, в состоянии покоя (и у примата № 4 во время просмотра фильма). Также указаны частоты предъявления вспышек, вызывающих максимальные реакции зрительной системы, регистрируемые с помощью вызванных потенциалов. Для удобства частоты разделены на три диапазона, в которых мы регистрировали резонансные эффекты.
Таблица 1.
Частоты доминирующих осцилляций в спектрах ЭКоГ, полученных без стимуляции, и значения локальных максимумов в профилях реакции на световую стимуляцию
| № примата | Диапазон | |||||
|---|---|---|---|---|---|---|
| 6–10 Гц | 14–18 Гц | 20–30 Гц | ||||
| Покой | Вспышки | Покой | Вспышки | Покой | Вспышки | |
| № 1 | 8 | 6–8 | – | 16–18 | – | – |
| № 2 | 8 | 8–10 | – | – | 20 | 22–30 |
| № 3 | 9 | 8 | – | 14 | – | – |
| № 4 | 10 | 8 | 16 (фильм) | 16 | – | 26 (р = 0.18) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенных экспериментов было показано, что величина вызванных изменений в электрокортикограмме обезьян в ответ на ритмическую световую стимуляцию неравномерно зависит от частоты предъявления вспышек. У большинства обследованных животных максимальные реакции вызывали вспышки с частотой 8 и 16 Гц, в то время как у одного животного наблюдали пики на частоте 8 Гц и в диапазоне 22–30 Гц. Первый максимум в профиле реакции на ритмическую фотостимуляцию совпал с частотным диапазоном доминирующих осцилляций, регистрируемых у обезьян в покое (8–10 Гц). Второй максимум на частоте 16 Гц совпал с доминирующим ритмом в ЭКоГ только одного примата, когда он был в состоянии эмоционального возбуждения.
Профили реакции на вспышки, полученные в наших экспериментах, согласуются с результатами исследований на человеке, проведенных Д. Риганом и соавт. и обобщенных в книге [3]. На основании электрофизиологических и психофизических экспериментов Д. Риган выделяет три функциональных подсистемы в мозге человека, различающихся частотными настройками. Первая, низкочастотная, подсистема настроена на частоты мелькания вспышек около 10 Гц. Вторая, среднечастотная, подсистема максимально активируется при предъявлении вспышек с частотой 16 Гц. Третья, высокочастотная, система настроена на частоты в диапазоне 40–50 Гц. На основе различий в топографическом распределении ответов по скальпу, в латентных периодах, чувствительности к цвету вспышек, делается вывод о различной нейрофизиологической природе этих трех подсистем. Сопоставляя получаемые на человеке данные с результатами анализа нейронной активности латерального коленчатого тела таламуса у обезьян, Риган относит первые две подсистемы к деятельности мелкоклеточного проводящего пути в зрительной системе (Parvo-канал). Третья, высокочастотная, система предположительно отражает активность крупноклеточного проводящего пути (Magno-канал), ее свойства мы не изучали, так как тестируемый диапазон частот был ограничен 42 Гц.
Если существование первого резонансного пика в диапазоне 8–10 Гц не вызывает сомнений и было многократно подтверждено [7–9], то относительно пика на частоте 16 Гц в литературе имеются разногласия. Помимо работ Ригана, подтверждение существования резонансного пика в области 16 Гц мы находим в более поздних электрофизиологических исследованиях на человеке – при стимуляции вспышками с частотой 15 Гц [16], и на обезьяне – в области 16 Гц [17]. Однако в работе [10] сообщалось о существовании резонансных пиков у человека на частотах световой стимуляции 10, 20, 40 и 80 Гц, что не согласуется с упомянутыми выше результатами. На наш взгляд, данное расхождение вызвано низкой разрешающей способностью определения максимумов в последней работе. Так, в усредненном профиле реакции на рис. 6 в работе [10] максимальные пики наблюдаются на частотах около 10, 14 и 18 Гц. Следующий по величине пик наблюдается на частоте 37–38 Гц, но при этом в подписи к рисунку утверждается, что резонансные пики выражены на частотах 10, 20 и 40 Гц. Поэтому, на наш взгляд, приведенные в данной статье значения частот свыше 10 Гц следует трактовать с осторожностью.
Соответствие первого локального максимума в профиле реакции на вспышки и частоты доминирующего ритма мозга в покое (альфа-ритма) было обнаружено у человека еще в сороковые годы [18], и с тех пор не подвергается сомнению [7, 9]. Если допустить резонансную природу этого явления, мы должны наблюдать корреляцию между индивидуальными значениями доминирующих частот и соответствующими максимумами в профиле реакции на ритмическую фотостимуляцию. В наших исследованиях это не удалось показать из-за относительно небольших индивидуальных различий в значениях пиковых частот – все значения находились в районе 8 ± 2 Гц, и оценивать корреляцию было нецелесообразно.
Поиск корреляций у человека между индивидуальной частотой альфа-ритма и индивидуальными максимумами ответов на вспышки в диапазоне 8–12 Гц также не увенчался успехом [8], вероятно, по тем же причинам, что и в наших экспериментах. Однако в работе [4] удалось показать, что частоты вспышек, вызывающие максимальный отклик зрительной коры, совпадают с доминирующими частотами в ЭЭГ макак разного возраста. У обезьян на втором месяце жизни частота доминирующего ритма мозга составляла 5–6 Гц и по мере взросления животного увеличивалась до 8–10 Гц. Вероятно, именно разброс от 5 до 10 Гц в частоте доминирующего ритма у обезьян разного возраста позволил установить соответствие с максимальными ответами на вспышки. Поэтому можно предположить, что выявляемый пик на частоте 8 Гц имеет резонансную природу, т.е. при совпадении частоты вспышек с внутренним ритмом мозга происходит существенное усиление ответа, что выражается в увеличении амплитуды навязанного ритма в ЭКоГ.
Нейрофизиологическая природа резонансных реакций в настоящее время продолжает обсуждаться [1, 8, 19]. Согласно одной гипотезе, существование скрытых нейронных осцилляций, как потенциальных резонаторов, возможно на уровне отдельных нейронов за счет подпороговых колебаний мембранного потенциала [20, 21]. Другая гипотеза (не исключающая первую) предполагает, что в основе резонансного усиления ответов лежат динамические свойства нейронных сетей за счет возбудительных и тормозных синаптических взаимодействий [20, 22].
Впервые подпороговые осцилляции мембранного потенциала нейрона были обнаружены в энториальной коре крысы – деполяризация мембраны постоянным током вызывала синусоидальные колебания потенциала в диапазоне частот 5–12 Гц со средним значением 8 Гц [23]. Позднее подпороговые осцилляции мембранного потенциала были обнаружены в других структурах мозга, на разных частотах, а также показана тесная связь между колебаниями мембранного потенциала и резонансными эффектами в экспериментах in vitro [20, 24, 25]. В настоящее время считается, что резонансные эффекты на уровне осцилляций мембранного потенциала могут обеспечивать синхронизацию активности отдельных нейронов за счет способности модулировать частоту потенциалов действия, а также служат для детекции и усиления слабых сигналов (см. обзор [19]).
Ключевую роль в генерации ритмической активности на уровне нейронных сетей играет взаимодействие корковых и таламических нейронов. При этом в таламокортикальных нейронах наблюдается пачечная активность, периодичность которой зависит от уровня деполяризации их мембраны и соответствует частотам осцилляций в диапазоне 2–13 Гц [26–28]. Предполагается, что переход от спокойного бодрствования к сонному состоянию, сопровождающийся сменой альфа-ритма (8–12 Гц) тета-ритмом (4–7 Гц), определяется частотой следования пачек импульсов в таламокортикальных нейронах [28]. Следует отметить, однако, что тета-ритм может также генерироваться в гиппокампе, что связано с процессами запоминания [29].
Осцилляции на более высоких частотах в бета- и гамма- диапазоне генерируются в основном более локальными нейронными сетями, предположительно за счет взаимодействия возбудительных пирамидальных нейронов и тормозных интернейронов коры головного мозга [19, 30]. Так, на срезах соматосенсорной коры крысы фармакологическое повышение возбудимости нейронов приводило к появлению осцилляций на двух частотах: около 40 Гц (в слое 2 коры) и около 25 Гц (в слое 5 коры). Снижение глутаматэргического возбуждения на тех же срезах приводило к исчезновению указанных осцилляций и появлению нового ритма с частотой около 15 Гц [31].
Частота осцилляций обратно пропорциональна размеру нейронной сети, что может быть обусловлено увеличением количества синапсов и, соответственно, временных задержек, в сетях большого размера [32, 33]. Так, в работе [33] резонансная частота зависела от размера мелькающего паттерна из точек – чем больше размер паттерна (соответственно, размер нейронной сети, кодирующей изображение), тем ниже частота мелькания, вызывающая максимальный ответ зрительной коры. Учитывая распространенное мнение, что синхронная активность нейронов необходима для объединения отдельных фрагментов изображения (теория связывания [34]), C.A. Lea-Carnall и соавт. высказывают предположение, что резонансные явления в коре не просто следствие осцилляторных свойств нейронов, а необходимый механизм, обеспечивающий восприятие объекта как единое целое.
Приведенные примеры не охватывают всего разнообразия осцилляторных механизмов мозга, а имеющиеся у нас средства регистрации биоэлектрической активности не позволяют однозначно судить о функциональной роли выявленных резонансных эффектов. Однако на основе различий в частоте локальных максимумов можно сделать следующее предположение о взаимосвязи резонансных реакций. Исходя из имеющихся данных о наличии доминирующей осцилляции в мозге обезьяны на частоте 8 Гц, следует, что каждая вспышка при стимуляции с частотой 8 Гц совпадает с определенной фазой внутреннего ритма (например, с появлением каждой пачки спайков в таламокортикальном нейроне), что, по определению, вызывает резонансное усиление ответа. В случае если фазы внутреннего и внешнего ритма одной частоты не совпадают друг с другом, фаза нейронных осцилляций сдвигается, подстраиваясь под фазу внешнего ритма (так называемый эффект сброса фазы – см. обзор [35]).
Соответственно, стимуляция другими частотами, не совпадающими по времени с появлением пачек нейронных разрядов, не будет вызывать резонанс. Однако при стимуляции с частотой 16 Гц, каждая вторая вспышка будет совпадать с каждой условной пачкой спайков, следующей с частотой 8 Гц. Это должно привести к резонансному усилению ответа, но не такому мощному, как при стимуляции вспышками с частотой 8 Гц, что мы и наблюдаем у животных № 1, № 3 и № 4.
Следуя указанной логике, при внутренней частоте осцилляций 8 Гц, третий резонансный максимум должен наблюдаться на частоте вспышек 24 Гц – тогда каждая третья вспышка совпадет по времени с каждой пачкой разрядов в таламокортикальном нейроне. В наших экспериментах незначительное увеличение ответов в предсказанном диапазоне, при частотах стимуляции 24–28 Гц, мы наблюдали у животного № 4. А у животного № 2 регистрировали достоверное увеличение ответов на вспышки с частотой 22–30 Гц (см. рис. 8). Отметим, что животное № 2 было единственное в нашем исследовании, у которого в спокойном состоянии в ЭКоГ доминировали два ритма – с частотами 8 и 20 Гц. Примечательно, что именно на вспышки с частотой 20 Гц у примата № 2 мы наблюдали снижение мощности ответа, т.е. проявлялся антирезонансный эффект. Причину такого исключения на частоте 20 Гц еще предстоит изучить.
Подтверждение нашей гипотезе о кратности резонансных частот находим в томографических исследованиях на человеке [36]. С помощью метода функциональной магнитно-резонансной томографии (фМРТ) было показано, что изменение уровня оксигенации крови (BOLD-сигнала, отражающего активность нейронов) в первичной зрительной коре человека нелинейно зависит от частоты световой стимуляции. В профиле реакции BOLD-сигнала на вспышки выявили три значимых локальных максимума: при частотах стимуляции 8, 16 и 24 Гц, т.е. все значения, кратные 8 Гц, что предполагает единый механизм резонансных реакций на данных частотах.
Отсутствие в наших экспериментах различий в локализации амплитуды вызванных потенциалов при стимуляции вспышками разной частоты говорит в пользу существования единого генератора активности, регистрируемой в ЭкоГ приматов. У всех животных максимальные резонансные реакции наблюдали в затылочных отведениях, расположенных над областями первичной зрительной коры. Поэтому из описанных выше потенциальных источников ритмической активности наиболее вероятным кандидатом на роль резонатора на частотах 8 и 16 Гц является нейронная сеть, объединяющая нейроны латерального коленчатого тела таламуса и первичной зрительной коры.
Однако в литературе встречаются свидетельства существования различных механизмов резонансных реакций в зависимости от частоты стимуляции. Так, в сравнительных электрофизиологических и томографических исследованиях на человеке [11] было показано отсутствие корреляции между амплитудой вызванных потенциалов и величиной BOLD-сигнала в ответ на вспышки с частотами 6–12 Гц, но при стимуляции вспышками в диапазоне частот 14–46 Гц эти показатели начинали изменяться синхронно. На основе полученных данных A. Bayram и соавт. заключают, что резонансные явления, наблюдаемые в альфа-диапазоне, имеют принципиально иную природу по сравнению с ответами на вспышки более высоких частот. В отличие от альфа-диапазона, предположительно отражающего таламокортикальные реверберации, осцилляции в бета- и гамма диапазонах требуют взаимодействия локальных тормозных и возбуждающих интернейронов, что приводит к увеличению метаболических потребностей мозга, отражающемуся в увеличении BOLD-сигнала [11].
В связи с этим особый интерес вызывает появление у одной обезьяны, находящейся в состоянии эмоционального возбуждения, выраженных осцилляций в бета- диапазоне. Частота обнаруженного ритма (16 Гц) совпала со вторым локальным максимумом в профиле реакции на вспышки. Однако эти осцилляции были локализованы в теменных областях, в то время как максимальные реакции на вспышки фиксировали в затылочных отведениях.
В литературе пока не встречаются данные о совпадении доминирующих осцилляций в ЭЭГ или ЭКоГ в бета- диапазоне с максимальными ответами на ритмическую фотостимуляцию. В принципе, в ЭЭГ здорового человека в покое доминирует лишь один альфа-ритм. Остальные осцилляции в мозге бодрствующего человека, такие как бета- и гамма- ритмы, обычно не выделяются в спектре как отдельные пики, и их номинальные границы довольно широкие. Однако в недавнем исследовании на макаке в состоянии покоя были зарегистрированы выраженные осцилляции на частоте 16 Гц [12]. С помощью метода независимого компонентного анализа, примененного к данным с большого количества субдуральных электродов, было показано существование трех различных генераторов этой активности. Их расположение перекрывало первичную моторную и сенсомоторную кору и захватывало лобные области мозга.
Существование различных источников генерации одного ритма может объяснить совпадение частоты осцилляций в бета- диапазоне с резонансными частотами в наших экспериментах. Судя по различиям в локализации, мы наблюдали два разных процесса, однако совпадение частот допускает, что обнаруженная ритмическая активность и резонансная реакция на частоте 16 Гц могут быть опосредованно связаны между собой. Учитывая, что ритмическая активность с частотой 16 Гц была обнаружена в различных областях коры, включая теменную (по нашим данным), сенсомоторную и лобную кору (по данным [12]), можно предположить, что нейроны в других областях коры, в том числе и в зрительной коре, также имеют предпочтение к осцилляции на данной частоте. Тогда альтернативным объяснением резонансных реакций на вспышки с частотой 16 Гц может быть совпадение стимуляции с частотной настройкой нейронов зрительной коры, являющихся своего рода скрытыми нейронными осцилляторами.
В любом случае, вне зависимости от того, вызывается ли резонанс на вспышки с частотой 16 Гц пачечной активностью в таламокортикальных сетях на частоте 8 Гц, или же связан с частотной настройкой нейронов зрительной коры на 16 Гц, наши данные указывают на функциональную значимость периодической световой стимуляции с этой частотой. О возможных резонансных эффектах на частоте 16 Гц говорят некоторые клинические исследования на пациентах, склонных к эпилептическим припадкам [37–39]. Во всех этих работах указывается, что эпилептический ответ на фотостимуляцию наиболее часто провоцируется вспышками с частотой стимуляции около 16 Гц. Так, в исследовании [37] на 170 фоточувствительных пациентах было показано, что диапазон опасных частот для таких больных довольно широк: вспышки в диапазоне частот 13–21 Гц вызывали фотопароксизмальный ответ у более чем 80% пациентов, при этом максимум распределения приходился на частоту 16 Гц.
Приведенные данные говорят о том, что доминирующие ритмы мозга, в том числе и скрытые ритмы, выявляемые только с помощью ритмической фотостимуляции, во многом совпадают у обезьян и человека. Наши экспериментальные данные подтверждают пока еще немногочисленные литературные свидетельства о существовании скрытых осцилляций нейронов на частотах, близких к 16 Гц. В определенных условиях они могут быть выявлены в текущей электрокортикограмме обезьяны, но отсутствуют в спектре ЭЭГ человека как отдельный, выраженный ритм.
Список литературы
Lakatos P., Gross J., Thut G. (2019) A New Unifying Account of the Roles of Neuronal Entrainment. Current biology: CB 29 (18), R890–R905. https://doi.org/10.1016/j.cub.2019.07.075
Walter V.J., Walter W.G. (1949) The central effects of rhythmic sensory stimulation. Electroencephalography and clinical neurophysiology 1 (1):57–86.
Regan D. (1989) Human brain electrophysiology: Evoked potentials and evoked magnetic fields in science and medicine. New York. Elsevier.
María I. Robert de Ramírez de Arellano (1961). Maturational changes in the electroencephalogram of normal monkeys. Experimental Neurology 3 (2): 209–224. https://doi.org/10.1016/0014-4886(61)90071-1
Nakayama K., Mackeben K. (1982) Steady state visual evoked potentials in the alert primate. Vision Research 22 (10): 1261–1271. https://doi.org/10.1016/0042-6989(82)90138-9
Rager G., Singer W. (1998) The response of cat visual cortex to flicker stimuli of variable frequency. Eur J Neurosci 10 (5): 1856–1877. https://doi.org/10.1046/j.1460-9568.1998.00197.x
Lazarev V.V., Simpson D.M., Schubsky B.M., Deazevedo L.C. (2001) Photic driving in the electroencephalogram of children and adolescents: harmonic structure and relation to the resting state. Braz J Med Biol Res 34 (12): 1573–1584. https://doi.org/10.1590/s0100-879x2001001200010
Birca A., Carmant L., Lortie A., Lassonde M. (2006) Interaction between the flash evoked SSVEPs and the spontaneous EEG activity in children and adults. Clin Neurophysiol 117 (2): 279–288. https://doi.org/10.1016/j.clinph.2005.10.001
Spaak E., de Lange F.P., Jensen O. (2014) Local entrainment of α oscillations by visual stimuli causes cyclic modulation of perception. J Neurosci 34 (10): 3536–3544. https://doi.org/doi:10.1523/JNEUROSCI.4385-13.2014
Herrmann C.S. (2001) Human EEG responses to 1–100 Hz flicker: resonance phenomena in visual cortex and their potential correlation to cognitive phenomena. Exp Brain Res 137 (3–4): 346–353. https://doi.org/10.1007/s002210100682
Bayram A., Bayraktaroglu Z., Karahan E., Erdogan B., Bilgic B., Ozker M., Kasikci I., Duru A.D., Ademoglu A., Oztürk C., Arikan K., Tarhan N., Demiralp T. (2011) Simultaneous EEG/fMRI analysis of the resonance phenomena in steady-state visual evoked responses. Clin EEG Neurosci 42 (2): 98–106. https://doi.org/10.1177/155005941104200210
Hindriks R., Micheli C., Bosman C.A., Oostenveld R., Lewis C., Mantini D., Fries P., Deco G. (2018) Source-reconstruction of the sensorimotor network from resting-state macaque electrocorticography. Neuroimage 181: 347–358. https://doi.org/10.1016/j.neuroimage.2018.06.010
Ivanova L.E., Podvigina D.N., Varovin I.A., Harauzov A.K. (2019) Electrophysiological indices of emotional arousal in monkeys. Neural networks and neurotechnologies. Saint-Petersburg. BBM. 72–75.
Hacker C.D., Snyder A.Z., Pahwa M., Corbetta M., Leuthardt E.C. (2017) Frequency-specific electrophysiologic correlates of resting state fMRI networks. Neuroimage 149: 446–457. https://doi.org/10.1016/j.neuroimage.2017.01.054
Kirasirova L., Bulanov V., Ossadtchi A., Kolsanov A., Pyatin V., Lebedev M.A. (2020) P300 Brain-Computer Interface With a Reduced Visual Field. Front Neurosci 14: 604629. https://doi.org/10.3389/fnins.2020.604629
Pastor M.A., Artieda J., Arbizu J., Valencia M., Masdeu J.C. (2003) Human cerebral activation during steady-state visual-evoked responses. J Neurosci 23 (37): 11621–116217. https://doi.org/10.1523/JNEUROSCI.23-37-11621.2003
Salelkar S., Ray S. (2020) Interaction between steady-state visually evoked potentials at nearby flicker frequencies. Sci Rep 10 (1): 5344. https://doi.org/10.1038/s41598-020-62180-y
Toman J. (1941) Flicker potentials and the alpha rhythm in man. J Neurophysiology 4 (1): 51–61. https://doi.org/10.1152/jn.1941.4.1.51
Wang X.J. (2010) Neurophysiological and computational principles of cortical rhythms in cognition. Physiological reviews 90 (3): 1195–1268. https://doi.org/10.1152/physrev.00035.2008
Hutcheon B., Yarom Y. (2000) Resonance, oscillation and the intrinsic frequency preferences of neurons. Trends Neurosci 23 (5): 216–222. https://doi.org/10.1016/s0166-2236(00)01547-2
Buzsáki G., Draguhn A. (2004) Neuronal oscillations in cortical networks. Science (New York, N.Y.) 304 (5679): 1926–1929. https://doi.org/10.1126/science.1099745
Lea-Carnall C.A., Montemurro M.A., Trujillo-Barreto N.J., Parkes L.M., El-Deredy W. (2016) Cortical Resonance Frequencies Emerge from Network Size and Connectivity. PLoS Comput Biol 12 (2). https://doi.org/10.1371/journal.pcbi.1004740
Alonso A., Llinás R.R. (1989) Subthreshold Na+-dependent theta-like rhythmicity in stellate cells of entorhinal cortex layer II. Nature 342 (6246): 175–177.
Lampl I., Yarom Y. (1993) Subthreshold oscillations of the membrane potential: a functional synchronizing and timing device. J Neurophysiol 70: 2181–2186.
Llinás R., Grace A., Yarom Y. (1991) In vitro neurons in mammalian cortical layer 4 exhibit intrinsic oscillatory activity in the 10- to 50-Hz frequency range. Proc Natl Acad Sci USA 88: 897–901.
Hughes S.W., Lorincz M., Cope D.W., Blethyn K.L., Kekesi K.A., Parri H.R. (2004) Synchronized oscillations at alpha and theta frequencies in the lateral geniculate nucleus. Neuron 42 (2): 253–268.
Lorincz M.L., Crunelli V., Hughes S.W. (2008) Cellular dynamics of cholinergically-induced alpha (8–13 Hz) rhythms in sensory thalamic nuclei in vitro. J Neurosci 28: 660–671.
Hughes S.W., Crunelli V. (2005) Thalamic mechanisms of EEG alpha rhythms and their pathological implications. Neuroscientist. 11 (4): 357–372.
Buzsáki G., Moser E.I. (2013) Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat Neurosci 16 (2): 130–138. https://doi.org/10.1038/nn.3304
Whittington M.A., Traub R.D., Kopell N., Ermentrout B., Buhl E.H. (2000) Inhibition-based rhythms: experimental and mathematical observations on network dynamics. Int J Psychophysiol 38 (3): 315–336.
Roopun A.K., Kramer M.A., Carracedo L.M., Kaiser M., Davies C.H., Traub R.D., Kopell N.J., Whittington M.A. (2008) Period concatenation underlies interactions between gamma and beta rhythms in neocortex. Front Cell Neurosci 2: 1. https://doi.org/10.3389/neuro.03.001.2008
Koppell N., Ermentrout G.B., Whittington M.A., Traub R.D. (2000) Gamma rhythms and beta rhythms have different synchronization properties. PNAS USA 97: 1867–1872.
Lea-Carnall C.A., Montemurro M.A., Trujillo-Barreto N.J., Parkes L.M., El-Deredy W (2016) Cortical Resonance Frequencies Emerge from Network Size and Connectivity. PLoS computational biology 12 (2): e1004740. https://doi.org/10.1371/journal.pcbi.1004740
Gray C.M., König P., Engel A.K., Singer W. (1989) Oscillatory responses in cat visual cortex exhibit inter-columnar synchronization which reflects global stimulus properties. Nature 338 (6213): 334–337.
Voloh B., Womelsdorf T. (2016) A Role of Phase-Resetting in Coordinating Large Scale Neural Networks During Attention and Goal-Directed Behavior. Frontiers in systems neuroscience 10:18. https://doi.org/10.3389/fnsys.2016.00018
Emir U.E., Bayraktaroglu Z., Ozturk C., Ademoglu A., Demiralp T. (2008) Changes in BOLD transients with visual stimuli across 1–44 Hz. Neurosci Lett 436 (2): 185–188. https://doi.org/10.1016/j.neulet.2008.03.021
Harding G.F., Harding P.F. (1999) Televised material and photosensitive epilepsy. Epilepsia 40 (4): 65–69. https://doi.org/10.1111/j.1528-1157.1999.tb00909.x
Lytovchenko T.A. (2017) Reflex (Stimulus-Sensitive) Epilepsy (Clinical Lecture for Neurologists, Psychiatrists, Pediatric Neurologists and Psychiatrists, Family Doctors). International neurological journal 7 (85): 49–55. https://doi.org/10.22141/2224-0713.7.85.2016.86917
Faught E. (2004) Attack of the pocket monsters: no lasting effects. Epilepsy currents 4 (5): 198–199. https://doi.org/10.1111/j.1535-7597.2004.04511.x
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии