Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 4, стр. 310-319
ВЛИЯНИЕ НАНОЧАСТИЦ НА ОСНОВЕ ОКСИДА ЖЕЛЕЗА, МОДИФИЦИРОВАННЫХ РАЗЛИЧНЫМИ ОБОЛОЧКАМИ, НА ГЕНЕРАЦИЮ АКТИВНЫХ ФОРМ КИСЛОРОДА СТИМУЛИРОВАННЫМИ КЛЕТКАМИ КРОВИ ЧЕЛОВЕКА В УСЛОВИЯХ IN VITRO
Я. Г. Торопова 1, *, М. Н. Горшкова 1, Д. С. Моторина 1, Д. В. Королев 1, Ю. А. Скорик 1, 2, Г. А. Шульмейстер 1, Е. Ю. Подъячева 1, А. Я. Багров 3
1 ФГБУ “НМИЦ им. В.А. Алмазова” Минздрава России
Санкт-Петербург, Россия
2 ФГБУН Институт высокомолекулярных соединений Российской академии наук
Санкт-Петербург, Россия
3 ФГБУН Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: yana.toropova@mail.ru
Поступила в редакцию 19.02.2021
После доработки 24.03.2021
Принята к публикации 03.04.2021
Аннотация
Среди всего многообразия отдельный интерес представляют наночастицы на основе оксида железа ввиду наличия магнитных свойств, возможности придания им необходимых физико-химических свойств, а также модификации их поверхности биосовместимыми, биоактивными материалами, лигандами и антителами. Важным аспектом, определяющим возможность и спектр клинического применения наночастиц, является профиль биосовместимости. Учитывая опосредованный активными формами кислорода (АФК) механизм в реализации токсического эффекта наночастиц, особое внимание на этапе их разработки для биомедицинских применений должно уделяться оценке их безопасности с позиции развития окислительного стресса. В связи с этим в данной работе было изучено дозозависимое влияние наночастиц магнетита (МНЧ), модифицированных различными оболочками (на основе полилактида, полисахарида и альбумина), на генерацию АФК, стимулированными клетками крови человека, а также на динамику индуцированного окислительного гемолиза эритроцитов. Установлено, что МНЧ с оболочкой из полилактида, альбумина и полисахарида в диапазоне всех используемых концентраций (0.1–2.0 мг/мл) в условиях всего периода инкубации (0–180 мин) не влияют на кинетику хемилюминесцентного ответа, обеспечивая при этом однонаправленное, но различное по выраженности снижение максимальной интенсивности индуцированной хемилюминесценции и суммарной выработки АФК. Все виды исследуемых наночастиц в ряду концентраций 1.0–2.0 мг/мл обеспечивают дозозависимое усиление данного влияния. В условиях индуцированной генерации АФК различные оболочки МНЧ не обусловливают изменения оказываемых эффектов, регулируя лишь их интенсивность. Максимальным эффектом обладают МНЧ с оболочкой из полилактида.
ВВЕДЕНИЕ
Наноматериалы обладают целым рядом свойств, обусловливающих их пригодность для широкого спектра биомедицинских применений. Наночастицы характеризуются наноразмерностью (от 1 до 100 нм) и большой площадью поверхности, которые в значительной степени определяют их уникальные физико-химические свойства. На сегодняшний день большое количество наночастиц находится на стадии разработки [1–3], в то время как их отдельные виды уже используются в клинической практике или находятся на стадии клинических испытаний [4, 5]. Среди всего многообразия отдельный интерес представляют наночастицы на основе оксида железа ввиду наличия магнитных свойств, возможности придания им необходимых для обеспечения конкретного биологического эффекта физико-химических свойств за счет изменений условий синтеза, а также модификации их поверхности биосовместимыми, биоактивными материалами, лигандами и антителами [6, 7]. Кроме того, магнитные свойства наноразмерного оксида железа обусловливают их многофункциональность, поскольку определяют возможность их нагрева для обеспечения магнитной гипертермии, применяющейся для деструктивного воздействия на опухоль [8], а также возможность управления их накоплением в определенных участках тела с помощью приложенного внешнего магнитного поля в рамках обеспечения адресной доставки лекарственных средств [9]. Сочетание диагностических свойств [10] с возможностью обеспечения адресной доставки лекарств позволяет рассматривать наночастицы магнетита (МНЧ) в качестве перспективных агентов для тераностики, предполагающих совмещение терапевтического воздействия с отслеживанием результатов лечения [11].
Ключевым аспектом, определяющим возможность и спектр клинического применения наночастиц, является профиль биосовместимости, характеризующий характер и выраженность взаимодействия наночастиц с биологическими структурами на уровне клеток, тканей и органов. С учетом ключевой роли опосредованного активными формами кислорода (АФК) механизма в реализации токсического эффекта наночастиц, особое внимание на этапе их разработки для биомедицинских применений должно уделяться оценке их безопасности с позиции развития окислительного стресса [12]. Известно, что биологический эффект наночастиц определяется множеством факторов, среди которых можно выделить размер, форму, характеристику поверхности, а также наличие оболочки и ее качественный состав [13].
Ранее в условиях in vitro и in vivo было показано ингибирующее время- и дозозависимое влияние МНЧ с немодифицированной поверхностью и покрытых различными оболочками, на выработку свободных радикалов. Полученные результаты позволили предполагать вероятность связывания указанными наночастицами АФК, а также возможную взаимосвязь эффекта с качественным составом оболочки наночастиц [14, 15]. Между тем в другой работе [16] было показано, что МНЧ с различными оболочками обеспечивают усиление выработки АФК клетками цельной крови.
Для того, чтобы составить представление о возможных ингибирующих эффектах наночастиц оксида железа, модифицированных различными оболочками, в отношении генерации АФК, необходимо изучить их эффекты в условиях стимулированной выработки АФК с сопоставлением полученных результатов с характеристиками наночастиц, их дозой, а также длительностью воздействия.
Целью данной работы явилось сравнительное изучение дозозависимого влияния МНЧ с различными оболочками на динамику генерации АФК стимулированными клетками крови человека, а также на динамику гемолиза эритроцитов в условиях индуцированного окислительного стресса. Для модификации поверхности МНЧ были выбраны оболочки на основе сложного полиэфира молочной кислоты, поликонденсированной глюкозы и на основе сывороточного альбумина. Выбор оболочек обусловлен относительной изученностью, биоразлагаемостью и степенью биосовместимости данных полимеров, позволяющих использовать их в медицинских целях, в том числе и в качестве средства адресной доставки лекарств за счет включения последних в состав оболочки [17–19].
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись МНЧ с оболочками на основе сложного полиэфира молочной кислоты (полилактид), на основе поликонденсированной глюкозы (полисахарид) и на основе альбумина (МНЧ + полилактид, МНЧ + полисахарид и МНЧ + альбумин соответственно). Синтез МНЧ описан в работе [20]. Модификацию поверхности МНЧ различными оболочками осуществляли описанными ранее методами [16, 21, 22]. Гидродинамический радиус, индекс полидисперсности (PDI) и электрокинетический потенциал (ζ-потенциал) наночастиц исследовался методами динамического и электрофоретического рассеяния света на приборе Photocor Compact-Z (Photocor, Россия).
Опытные группы были сформированы в соответствии с исследуемыми наночастицами: МНЧ + полилактид, МНЧ + полисахарид и МНЧ + альбумин. Группами контроля являлись образцы крови с добавлением эквивалентного объема физиологического раствора (ФР). Объем выборки в каждой экспериментальной группе составил 8 образцов. Для оценки дозозависимости исследуемые виды МНЧ изучали в концентрациях 0.2, 1.0 и 2.0 мг/мл.
Генерацию АФК и выраженность индуцированного окислительного гемолиза эритроцитов в условиях воздействия модифицированных различными оболочками МНЧ проводили в условиях in vitro в соответствии с Хельсинкской Декларацией Всемирной медицинской ассоциации (1964, 2013 ред.) с использованием свежей гепаринизированной цельной крови человека, полученной от некурящих мужчин в возрасте 20–35 лет.
Генерацию АФК изучали с помощью метода индуцированной люминолзависимой клеточной хемилюминесценции (ХЛ) на хемилюминометре Lum-1200 (ДИСофт, Россия), позволяющей определить степень связывания наночастицами АФК, генерируемых клетками крови при их стимуляции зимозаном.
Предварительно были подготовлены растворы люминола (1 мМ) и зимозана (2.0 мг/мл). Для каждого вида МНЧ готовили инкубационную взвесь: к 100 мкл крови при постоянном перемешивании добавляли 100 мкл раствора МНЧ. Полученную взвесь инкубировали при комнатной температуре при постоянном перемешивании на возвратно-поступательном шейкере (Heidolph Instruments GmbH & Co KG, Германия) при 200 об/мин.
С целью измерения ХЛ каждого образца к 100 мкл инкубационной взвеси добавляли 700 мкл раствора Хэнкса и 100 мкл раствора люминола, после чего в каждую кювету добавляли 100 мкл опсонизированного зимозана с дальнейшей регистрацией показателей индуцированной ХЛ в течение 30 мин.
Оценивали следующие показатели: интегральные значения интенсивности ХЛ (Sind), характеризующие суммарный синтез АФК за 30 мин исследования; время достижения максимальной интенсивности ХЛ (Xmax), характеризующее скорость развития ХЛ-реакции; максимальную интенсивность свечения (Imax), отражающую максимальный уровень синтеза АФК [23]. Из регистрируемых значений ХЛ вычитали фоновое свечение хемилюминометра. Регистрация данных проходила в формате записи последовательно измеряемых значений интенсивности ХЛ и отображалась в виде графиков в программе PowerGraph.
Изучение выраженности индуцированного окислительного гемолиза эритроцитов проводили с помощью спектрофотометра SQ-2802S (UNICO, США) на взвеси изолированных эритроцитов, отделенных от плазмы и других форменных элементов крови посредством центрифугирования в режиме 10 мин при 2800 об/мин. Изолированные эритроциты троекратно промывали в 0.9% физиологическом растворе. Полученную эритроцитарную массу разбавляли забуференным физиологическим раствором (0.15 М натрия хлорида и 0.01 М натрий-фосфатного буферного раствора, рН 7.4) до получения конечной взвеси. К полученной взвеси добавляли гипохлорит натрия (NaOCl) в концентрации 250 мМ. В опытных группах сразу после добавления индуктора окислительного гемолиза осуществляли помещение в инкубационную взвесь исследуемых видов МНЧ (1:1 по отношению к объему взвеси). Для оценки количества освобожденного гемоглобина осуществляли измерение оптической плотности полученных образцов (λ = 540 нм) на спектрофотометре UNICO-2802S (UNICO SYS, США) на следующих дискретных точках: 5 мин после добавления индуктора (исходный уровень), через 60 и 180 мин индукции окислительного стресса [14] при постоянном перемешивании на возвратно-поступательном шейкере (Heidolp, Германия) (200 об/мин) и комнатной температуре.
В качестве позитивного контроля выступали образцы со 100%-ным гемолизом, индуцированным добавлением 0.01% раствора додецилсульфата натрия при соотношении образец: реагент 1 : 10. За негативный контроль принимали образцы с добавлением 0.9% физиологического раствора.
Коэффициент гемолиза (КГ) рассчитывали с использованием уравнения:
КГ, % = (ОПОП – ОПНК)/(ОППК – ОПНК) * 100%,
где ОП – оптическая плотность (λ = 540 нм), нк – негативный контроль, пк – позитивный контроль, оп – опытный образец.
За контрольные принимались значения, полученные после добавления в инкубационную среду NaOCl при отсутствии воздействия МНЧ. Регистрацию изучаемых параметров в каждом образце на каждой дискретной точке осуществляли в троекратных повторах.
Статистическую обработку экспериментальных данных проводили с помощью программы “GraphPadPrism 8”. Проверку гипотезы о равенстве средневыборочных величин в нескольких зависимых выборках проводили методами дисперсионного анализа для повторных измерений, в независимых выборках – с использованием критерия Манна–Уитни. Данные представлены в виде среднего значения ± стандартная ошибка среднего (М ± SEM). Статистически значимыми считали различия при уровне значимости р < 0.05.
Ограничения данной работы:
В настоящем исследовании не производилась оценка изменений физико-химических характеристик наночастиц до и после нанесения оболочек, а также в условиях их инкубации с цельной кровью человека.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Основные физико-химические характеристики МНЧ (морфология, гидродинамический радиус и ζ-потенциал) изучены нами в предыдущей работе [16] и для удобства обобщены в табл. 1.
Таблица 1.
Характеристика наночастиц магнетита, покрытых различными оболочками [16]
| Вид наночастиц | Форма | Средний гидро- динамический радиус, нм | PDI | ζ- потенциал МНЧ, покрытых оболочками, мВ |
|---|---|---|---|---|
| МНЧ + полилактид | Сферическая | 122 ± 38* | 0.10 | –0.1 ± 2.7 |
| МНЧ + полисахарид | Сферическая | 66 ± 19 | 0.08 | –21.4 ± 0.9 |
| МНЧ + альбумин | Сферическая | 192 ± 58* | 0.09 | 4.0 ± 2.2 |
По данным электронной микроскопии [16] все виды исследуемых МНЧ характеризуются сферической формой. МНЧ с оболочкой из альбумина и полилактида обладают близким к нулю электрокинетическим потенциалом, тогда как МНЧ с оболочкой из полисахарида характеризуется значительным отрицательным ζ-потенциалом. По-видимому, это связано со значительным количеством концевых карбоксильных групп, образовавшихся в результате синтеза полисахарида из глюкозы гидротермальным методом [22]. Методом динамического светорассеяния показано, что во всех случаях распределение частиц по размеру является мономодальным, при этом гидродинамический радиус МНЧ + полисахарид был в 2–3 раза меньше по сравнению с образцами МНЧ + полилактид и МНЧ + альбумин. PDI во всех случаях был менее 0.1 (табл. 1), что свидетельствует о достаточно узком распределении МНЧ по размеру.
Динамика параметров индуцированной ХЛ цельной крови в условиях воздействия МНЧ с различными оболочками в концентрациях 0.2, 1.0 и 2.0 мг/л отражена в табл. 2.
Таблица 2.
Динамика интенсивности индуцированной ХЛ цельной крови в условиях воздействия МНЧ с различными оболочками в концентрациях 0.2, 1.0 и 2.0 мг/мл
| Концентрация МНЧ, мг/мл | Вид МНЧ | Время инкубации, мин/Incubation time, min | ||
|---|---|---|---|---|
| 5 | 60 | 180 | ||
| Xmax, с | ||||
| 0.2 | МНЧ + полилактид | 926 ± 102 | 940 ± 118 | 1041 ± 39 |
| МНЧ + альбумин | 852 ± 88 | 835 ± 50 | 717 ± 154 | |
| МНЧ + полисахарид | 938 ± 115 | 893 ± 106 | 1137 ± 202 | |
| 1.0 | МНЧ + полилактид | 1008 ± 115 | 866 ± 102 | 1008 ± 137 |
| МНЧ + альбумин | 859 ± 45 | 828 ± 108 | 819 ± 57 | |
| МНЧ + полисахарид | 886 ± 60 | 1147 ± 134 | 957.00 ± 26 | |
| 2.0 | МНЧ + полилактид | 967 ± 43 | 1159 ± 150 | 981 ± 88 |
| МНЧ + альбумин | 725 ± 81 | 816 ± 92 | 849 ± 127 | |
| МНЧ + полисахарид | 967 ± 92 | 1015 ± 126 | 855 ± 127 | |
| 0 | Контроль | 783 ± 56 | 948 ± 141 | 831 ± 112 |
| Imax, имп/с | ||||
| 0.2 | МНЧ + полилактид | 9 ± 3 | 3,4 ± 0.8*/## | 2.7 ± 0,6***/## |
| МНЧ + альбумин | 12 ± 5 | 9,5 ± 1.4$$$ | 19 ± 6$$$ | |
| МНЧ + полисахарид | 15 ± 5 | 13 ± 5$$$ | 10 ± 5$$ | |
| 1.0 | МНЧ + полилактид | 7 ± 5 | 1.3 ± 0.2***/### | 1.8 ± 0,5***/### |
| МНЧ + альбумин | 7.9 ± 1,7 | 9.1 ± 1.8$$$ | 10.0 ± 1.7$$$ | |
| МНЧ + полисахарид | 7 ± 2 | 4.4 ± 1.6$ | 4.6 ± 1.1$ | |
| 2.0 | МНЧ + полилактид | 5 ± 3* | 0.8 ± 0.3***/###/@ | 1.4 ± 0.2***/###/@ |
| МНЧ + альбумин | 5.5 ± 1.4* | 3.3 ± 0.7***/@ | 3.8 ± 0.9***/@ | |
| МНЧ + полисахарид | 5.0 ± 1.2*/@@@ | 5 ± 2*/@ | 3.4 ± 1.1***/@@@ | |
| 0 | Контроль | 15 ± 6 | 11 ± 5 | 13 ± 5 |
| Sind, о.е. | ||||
| 0.2 | МНЧ + полилактид | 11197 ± 3873 | 4331 ± 1024*** | 3364 ± 766*** |
| МНЧ + альбумин | 15299 ± 5990 | 17615 ± 4912 | 27727 ± 9497 | |
| МНЧ + полисахарид | 18086 ± 5106 | 15755 ± 5840 | 12977 ± 6101 | |
| 1.0 | МНЧ + полилактид | 8584 ± 5759 | 1635 ± 326*** | 2258 ± 602*** |
| МНЧ + альбумин | 10620 ± 2157 | 11812 ± 2315 | 13285 ± 1919 | |
| МНЧ + полисахарид | 9731 ± 2814 | 5397 ± 1977* | 5955 ± 1317* | |
| 2.0 | МНЧ + полилактид | 6304 ± 3698 | 988 ± 360*** | 1695 ± 305*** |
| МНЧ + альбумин | 7054 ± 1655 | 4263 ± 938***/$$ | 5097 ± 1188***/$ | |
| МНЧ + полисахарид | 6535 ± 3608 | 6128 ± 2873*/$$$ | 4284 ± 1341***/$ | |
| 0 | Контроль | 20600 ± 8446 | 15507 ± 6490 | 16096 ± 6165 |
Примечание: *p < 0.05, **p < 0.001, ***p < 0.0001 – по сравнению с контролем. #p < 0.05, ##p < 0..001, ###p < 0.0001 – по сравнению с исходными значениями в данной группе. $p < 0.05, $$p < 0.001, $$$p < 0.0001 – по сравнению со значениями в группе МНЧ + + полилактид в аналогичной концентрации и на аналогичной точке. @p < 0.05, @@p < 0.001, @@@p < 0.0001 – по сравнению с данным видом МНЧ в минимальной концентрации на аналогичной точке.
Время достижения максимальной интенсивности свечения индуцированной ХЛ (Xmax), характеризующее скорость развития “респираторного взрыва” и отражающее специфический ответ фагоцитов на стимул (зимозан), во всех исследуемых группах при использовании всего диапазона концентраций (0.2–2.0 мг/мл) МНЧ в динамике эксперимента оставалось на уровне исходных значений (p > 0.05 по сравнению с исходным, между группами). Данный факт косвенно свидетельствует об отсутствии влияния всех видов МНЧ на скорость образования АФК.
Максимальная интенсивность ХЛ, отражающая максимальный уровень синтеза АФК, в группе контроля на всех этапах эксперимента не изменялась, оставаясь на уровне исходных значений (p > 0.05 по сравнению с исходным). Добавление в инкубационную среду всех видов МНЧ в диапазоне концентраций 0.2–1.0 мг/мл не обеспечивало изменения Imax через 5 мин после воздействия. На фоне влияния указанных концентраций МНЧ + полилактид через 60 мин инкубации отмечалось достоверное снижение данного показателя (относительно контрольных значений, а также значений в группах с воздействием МНЧ + альбумин и МНЧ + полисахарид), сохраняющееся к моменту окончания эксперимента (180 мин инкубации). При использовании всех исследуемых видов МНЧ в максимальных концентрациях (2.0 мг/мл) через 5 мин их воздействия отмечалось достоверное равнозначное снижение максимальной интенсивности свечения относительно контрольных значений, сохраняющееся на всех этапах эксперимента. Максимальным эффектом в отношении снижения показателя Imax обладали МНЧ с оболочкой из полилактида.
Интегральное значение интенсивности индуцированной ХЛ (Sind), отражающее суммарный синтез АФК, в группе контроля в динамике эксперимента не претерпевало изменений. На фоне 5-минутного воздействия всех видов МНЧ во всем диапазоне концентраций (0.2–2.0 мг/мл) данный показатель не изменялся относительно контрольных значений. При использовании МНЧ + полилактид через 60 мин инкубации отмечалось достоверное снижение данного показателя относительно контрольных значений, сохраняющееся к 180-й минуте воздействия. Данный эффект отмечался при использовании всех концентраций МНЧ + полилактид и характеризовался дозозависимостью – увеличение концентрации обусловливало более выраженное снижение суммарного синтеза АФК. МНЧ с оболочками из полисахарида и альбумина в концентрации 2.0 мг/мл через 60 мин воздействия также обеспечивали снижение Sind, которое характеризовалось меньшей выраженностью по сравнению с МНЧ + полилактид.
Динамика индуцированного окислительного гемолиза в условиях воздействия различных концентраций (0.2–2.0 мг/мл) исследуемых видов МНЧ представлена на рис. 1.
Рис. 1.
Коэффициент гемолиза в динамике 180-минутного воздействия МНЧ с различными оболочками. (a) Концентрация всех видов МНЧ 0.2 мг/мл; (b) Концентрация всех видов МНЧ 1.0 мг/мл; (c) Концентрация всех видов МНЧ 2.0 мг/мл. Примечание: *p < 0.05 – по сравнению с контролем; @p < 0.05 – по сравнению со значениями в группе МНЧ + + полилактид в аналогичной концентрации и на аналогичной точке; #p < 0.05 – по сравнению с исходными значениями в данной группе.
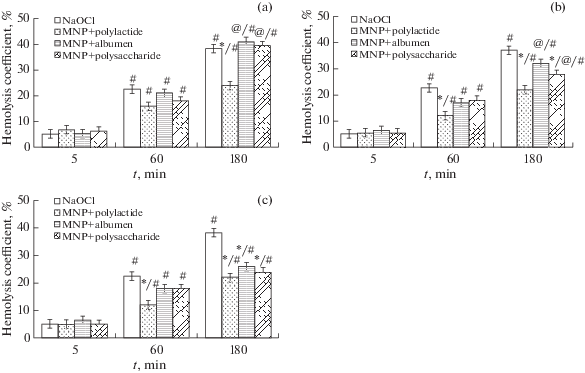
При воздействии NaClO в динамике эксперимента наблюдалось увеличение КГ. Так, через 60 мин после добавления NaClO в инкубационную среду данный показатель составил 22%, тогда как на момент окончания эксперимента – 38%.
Минимальные концентрации (0.2 мг/мл) МНЧ с оболочками из полисахарида и альбумина не обусловливали изменений КГ относительно контрольных значений. В условиях 180-минутного воздействия МНЧ + полилактид в концентрации 0.2 мг/мл отмечалось снижение КГ относительно контрольных значений на 29.2% (после 60 мин инкубации) и 36% (после 180 мин инкубации).
При использовании МНЧ в концентрации 1.0 мг/мл динамика КГ значимо не менялась относительно таковой при использовании минимальных концентраций МНЧ. Максимальное снижение ГК относительно контрольных значений обеспечивали МНЧ + полилактид – на 49% (после 60 мин) и на 40% после 180 мин инкубации. МНЧ с оболочкой из полисахарида в указанной концентрации через 180 мин воздействия обеспечивали защитный эффект в отношении окислительного гемолиза – ГК в данной группе на момент окончания эксперимента оказался на 8% ниже относительно контрольных значений.
При использовании всех видов МНЧ в максимальных концентрациях (2.0 мг/мл) через 180 мин их воздействия отмечалось равнозначное снижение ГК (31–41%) относительно контрольного уровня.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время магнитные наночастицы оксида железа рассматриваются как перспективные материалы для решения широкого спектра биомедицинских задач. Поверхностная модификация магнитных наночастиц позволяет не только повысить их биосовместимость, но и придать им необходимые для конкретного планируемого клинического использования свойства (например, обеспечение дозирования лекарственного препарата за счет его контролируемого высвобождения с поверхности наночастиц, тропности к конкретным органам-мишеням и т.д.). При этом качественный состав оболочки в значительной степени определяет биологические эффекты наночастиц [13]. С учетом ключевой роли АФК-опосредованного механизма в реализации их токсического эффекта, в настоящем исследовании изучали дозозависимое влияние МНЧ, модифицированных различными оболочками (на основе полилактида, полисахарида и альбумина), на генерацию АФК стимулированными клетками крови человека, а также на динамику индуцированного окислительного гемолиза эритроцитов.
Установлено, что МНЧ с оболочкой из полилактида, альбумина и полисахарида в диапазоне всех используемых концентраций (0.1–2.0 мг/мл) в условиях всего периода инкубации (0–180 мин) не влияют на кинетику хемилюминесцентного ответа, обеспечивая при этом однонаправленное, но различное по выраженности снижение максимальной интенсивности индуцированной ХЛ и суммарной выработки АФК. Все виды исследуемых МНЧ в ряду концентраций 1.0–2.0 мг/мл обеспечивают дозозависимое усиление данного влияния. Максимальным эффектом при этом обладают МНЧ + полилактид. Полученные данные позволяют предполагать наличие антиоксидатного эффекта у исследуемых видов МНЧ в условиях индуцированного окислительного стресса, различающегося по степени выраженности в зависимости от качественного состава оболочки МНЧ и их физических характеристик. В пользу данного предположения свидетельствуют результаты, полученные при изучении влияния МНЧ на изолированные эритроциты, находящиеся в условиях окислительного стресса. Так, показано, что МНЧ с оболочками из полисахарида и альбумина в диапазоне концентраций 0.2–1.0 мг/мл не влияют на степень индуцированного окислительного гемолиза. При этом увеличение концентрации данных видов МНЧ (2.0 мг/мл) при 180-минутном воздействии обеспечивает защитный эффект в виде снижения индуцированного окислительного гемолиза. МНЧ с оболочкой из полилактида во всем диапазоне используемых концентраций (0.2–20 мг/мл) обеспечивают снижение степени окислительного гемолиза эритроцитов.
Следует отметить, что в условиях индуцированной генерации АФК различные оболочки МНЧ не обусловливают изменения их оказываемых эффектов, регулируя лишь их интенсивность. Максимальным эффектом при этом обладают МНЧ с оболочкой из полилактида.
Большое количество работ свидетельствует о том, что наночастицы оксида железа за счет высокой реакционной способности обеспечивают увеличение выработки АФК, что может рассматриваться, с одной стороны, как один из ключевых механизмов токсичности данного вида наночастиц, а с другой стороны, может являться основой для их АФК-опосредованного воздействия на опухолевую ткань с целью лечения [24–27]. При этом продемонстрировано, что покрытие наночастиц оболочками может способствовать снижению их реакционной способности [28]. Однако, полученные в ходе настоящего исследования результаты согласуются с представлением отдельных авторов о возможности наночастиц оксида железа обеспечивать антиоксидантный эффект. Так, в отдельных работах показана антиоксидантная активность наночастиц оксида железа [29], а также зависимость выраженности данного эффекта от характеристик наночастиц (в частности, от размера) [30]. В связи с этим составленное в ходе экспериментальных исследований представление о влиянии МНЧ на выработку АФК может явиться основой для определения спектра их клинического использования.
Полученные в ходе настоящей работы данные имеют некоторое расхождение с результатами, полученными ранее авторами при оценке непосредственного влияния вышеуказанных видов наночастиц на генерацию АФК клетками крови в условиях отсутствия воздействия АФК-индуцирующих стимулов. Так, Я.Г. Тороповой и соавт. было показано [16], что МНЧ с оболочкой из полисахарида обеспечивали дозозависимое повышение генерации АФК, в то время как МНЧ с оболочкой из полилактида не влияли на их выработку. В то же время МНЧ с оболочкой из альбумина при используемой концентрации 0.2 мг/мл повышали генерацию АФК, при этом при увеличении концентрации данного вида МНЧ эти изменения нивелировались. Полученные данные позволили предполагать, что отсутствие воздействия МНЧ с оболочкой из полилактида на генерацию АФК обусловлено не их способностью к связыванию свободных радикалов, а их АФК-токсическим эффектом, реализующимся за счет индукции выработки большого количества АФК, приводящего к быстрому расходованию антиоксидантной емкости крови и окислительной модификации ее компонентов. Итогом данных событий могла явиться неспособность антиоксидантных систем редуцировать дальнейшее развитие окислительного стресса, что, в свою очередь, предположительно, обусловливало гибель клетки и ее неспособность к генерации АФК [16]. Принимая во внимание данное предположение, можно предполагать, что описанные разночтения обусловлены различными экспериментальными условиями. Вероятно, оказываемые эффекты МНЧ в отношении генерации АФК (а следовательно, и их потенциальная АФК-опосредованная токсичность) определяются не только такими общеизвестными факторами, как физико-химические характеристики наночастиц, их доза, длительность воздействия, но и условиями, в которых исходно находятся клетки-мишени для воздействия наночастиц. Полученные данные позволяют рекомендовать при разработке подходов к биомедицинскому использованию МНЧ в дополнение к стандартным тестам, посвященным оценке безопасности и эффективности МНЧ проведение комплексной оценки характера оказываемых воздействий МНЧ в отношении генерации АФК в условиях, отражающих основные звенья патогенеза конкретного заболевания, при котором планируется использование МНЧ. Так, условия, при которых проводилось изучение влияния МНЧ на генерацию АФК нативными клетками крови, отражают физиологический ответ клеток на воздействие МНЧ. В частности, в данных условиях МНЧ с оболочкой из полилактида проявляют АФК-опосредованную токсичность. В то же время в условиях воздействия МНЧ на клетки крови, уже находящиеся в условиях окислительного стресса, тот же вид МНЧ обеспечивает снижение генерации АФК. Можно предполагать, что реализация данного эффекта обеспечивается высвобождением ионов железа при постепенной частичной деградации магнитного материала, концентрация которых является достаточной для разложения гидроперекисей [31]. При этом различия по выраженности оказываемых эффектов МНЧ с различными оболочками в отношении снижения генерации АФК в условиях индуцированного окислительного стресса обусловлены различиями в интенсивности их биодеградации. С другой стороны, нельзя исключать и влияние МНЧ на образование АФК клетками, находящимися в условиях окислительного стресса [14].
Список литературы
Yaqoob A.A., Ahmad H., Parveen T., Ahmad A., Oves M., Ismail I.M.I., Qari H.A., Umar K., Mohamad Ibrahim M.N. (2020) Recent Advances in Metal Decorated Nanomaterials and Their Various Biological Applications: A Review. Front Chem 8: 1–23. https://doi.org/10.3389/fchem.2020.00341
Filipczak N., Pan J., Yalamarty S.S.K., Torchilin V.P. (2020) Recent advancements in liposome technology. Adv Drug Deliv Rev 156: 4–22. https://doi.org/10.1016/j.addr.2020.06.022
Zahin N., Anwar R., Tewari D., Kabir M.T., Sajid A., Mathew B., Uddin M.S., Aleya L., Abdel-Daim M.M. (2020) Nanoparticles and its biomedical applications in health and diseases: special focus on drug delivery. Environ Sci Pollut Res 27: 19151–19168. https://doi.org/10.1007/s11356-019-05211-0
Anselmo A.C., Mitragotri S. (2019) Nanoparticles in the clinic: An update. Bioeng Transl Med 4: 1–16. https://doi.org/10.1002/btm2.10143
Monk B.J., Herzog T.J., Wang G., Triantos S., Maul S., Knoblauch R., Mcgowan T., Shalaby W.S.W., Coleman R.L. (2019) Gynecologic Oncology A phase 3 randomized, open-label, multicenter trial for safety and ef fi cacy of combined trabectedin and pegylated liposomal doxorubicin therapy for recurrent ovarian cancer. Gynecol Oncol. https://doi.org/10.1016/j.ygyno.2019.12.043
Srivastava V., Gusain D., Sharma Y.C. (2015) Critical Review on the Toxicity of Some Widely Used Engineered Nanoparticles. Ind Eng Chem Res 54: 6209–6233.
Zhu N., Ji H., Yu P., Niu J., Farooq M.U., Akram M.W., Udego I.O., Li H., Niu X. (2018) Surface modification of magnetic iron oxide nanoparticles. Nanomaterials 8: 1–27. https://doi.org/10.3390/nano8100810
Grüttner C., Müller K., Teller J., Westphal F. (2013) Synthesis and functionalisation of magnetic nanoparticles for hyperthermia applications. Int J Hyperth 29: 777–789. https://doi.org/10.3109/02656736.2013.835876
Gholami A., Mousavi S.M., Hashemi S.A., Chiang W., Parvin N. (2020) Current trends in chemical modifications of magnetic nanoparticles for targeted drug delivery in cancer chemotherapy. Drug Metab Rev 0: 1–20. https://doi.org/10.1080/03602532.2020.1726943
Vallabani N.V.S., Singh S. (2018) Recent advances and future prospects of iron oxide nanoparticles in biomedicine and diagnostics. 3 Biotech 8: 1–23. https://doi.org/10.1007/s13205-018-1286-z
Kalash R.S., Lakshmanan V.K., Cho C.-S., Park I.-K. (2016) Theranostics. In book Biomaterials Nanoarchitectonics.– Elsevier Inc. 197–215.
Manke A., Wang L., Rojanasakul Y. (2013) Mechanisms of nanoparticle-induced oxidative stress and toxicity. Biomed Res Int 2013 . https://doi.org/10.1155/2013/942916
Singh N., Jenkins G.J.S., Asadi R., Doak S.H. (2010) Potential toxicity of superparamagnetic iron oxide nanoparticles (SPION). Nano Rev 1: 5358. https://doi.org/10.3402/nano.v1i0.5358
Торопова Я.Г., Печникова Н.А., Зелинская И.А., Королев Д.В., Гареев К.Г., Маркитантова А.С., Богушевская В.Д., Поволоцкая А.В., Маньшина А.А. (2018) Изучение гемосовместимости магнитных наночастиц магнетита и композитных частиц магнетита-кремнезема in vitro. Бюл сиб мед 17: 157–167. [Toro-pova Ya.G., Pechnikova N.A., Zelinskaya I.A., Korolev D.V., Gareev K.G., Markitantova A.S., Bogushevskaya V.D., Povolotskaya A.V., Manshina A.A. (2018) Study of hemocompatibility of magnetic magnetite nanoparticles and composite magnetite-silica particles in vitro. Bul sib med 17: 157–167. (In Russ)]. https://doi.org/10,20538/1682-0363-2018-3-157-167
Toropova Y.G., Motorina D.S., Gorshkova M.N., Gareev K.G., Korolev D.V., Muzhikyan A.A. (2020) The effect of intravenous administration to rats of magnetite nanoparticles with various shells on the functional state and morphology of the endothelium and on antioxidant status. Transl Med 7: 52–64. https://doi.org/10.18705/2311-4495-2020-7-2-52-64
Торопова Я.Г., Моторина Д.С., Зелинская И.А., Королев Д.В., Шульмейстер Г.А., Скорик Ю.А. (2021) Генерация активных форм кислорода клетками цельной крови человека при воздействии наночастиц на основе оксида железа, покрытых различными оболочками. Бюллетень экспериментальной биологии и медицины 171: 95–99. [Toropova Y.G., Motorina D.S., Zelin-skaya I.A., Korolev D.V., Shulmeister G.A., Skorik Y.A. (2021) Generation of reactive oxygen species by human whole blood cells when exposed to iron oxide nanoparticles coated with various membranes. Bulletin of Experimental Biology and Medicine 171: 95–99. (In Russ)].
DeStefano V., Khan S., Tabada A. (2020) Applications of PLA in modern medicine. Eng Regen 1: 76–87. https://doi.org/10.1016/j.engreg.2020.08.002
Varanko A., Saha S., Chilkoti A. (2020) Recent trends in protein and peptide-based biomaterials for advanced drug delivery. Adv Drug Deliv Rev 156: 133–187. https://doi.org/10.1016/j.addr.2020.08.008
Wang K., Liu M., Mo R. (2020) Polysaccharide-Based Biomaterials for Protein Delivery. Med Drug Discov 7: 100031. https://doi.org/10.1016/j.medidd.2020.100031
Toropova Y.G., Golovkin A.S., Malashicheva A.B., Korolev D.V., Gorshkov A.N., Gareev K.G., Afonin M.V., Galagudza M.M. (2017) In vitro toxicity of FemOn, FemOn-SiO2 composite, and SiO2-FemOn core-shell magnetic nanoparticles. Int J Nanomedicine 12: 593–603. https://doi.org/10.2147/IJN.S122580
Гареев К.Г., Пугач В.С., Евреинова Н.В., Наумышева Е.Б., Панов М.Ф., Королев Д.В. (2017) Разработка методов поверхностной модификации магнитных наночастиц защитной оболочкой из сахаридов. Биотехносфера 3: 76–81. [Gareev K.G., Pugach V.S., Evreinova N.V., Naumysheva E.B., Panov M.F., Korolev D.V. (2017) Development of methods for surface modification of magnetic nanoparticles with a protective shell of saccharides. Biotechnosphere 3: 76–81. (In Russ)].
Zorin V.N., Naumisheva E.B., Postnov V.N., Evreinova N.V., Gareev K.G., Korolev D.V. (2018) Magnetic nanoparticles for medical application with a coating deposited with various methods. J Phys Conf Ser 1124. https://doi.org/10.1088/1742-6596/1124/3/031009
Dogadin S.A., Dudina M.A., Savchenko A.A., Man’kovskii V.A., Gvozdev I.I. (2017) Respiratory burst activity in neutrophilic granulocytes in the onset of Graves’ disease. Probl Endokrinol (Mosk) 63: 4–8 . https://doi.org/10.14341/probl20176314-8
Dayem A.A., Hossain M.K., Lee S. Bin, Kim K., Saha S.K., Yang G.M., Choi H.Y., Cho S.G. (2017) The role of reactive oxygen species (ROS) in the biological activities of metallic nanoparticles. Int J Mol Sci 18: 1–21. https://doi.org/10.3390/ijms18010120
Patil U.S., Adireddy S., Jaiswal A., Mandava S., Lee B.R., Chrisey D.B. (2015) In vitro/in vivo toxicity evaluation and quantification of iron oxide nanoparticles. IntJMolSci, 16: 24417–24450.
Sundarraj K., Raghunath A., Panneerselvam L., Perumal E. (2017) Iron oxide nanoparticles modulate heat shock proteins and organ specific markers expression in mice male accessory organs. Toxicol Appl Pharmacol 317: 12–24.
Mai T., Hilt J.Z. (2017) Magnetic nanoparticles: reactive oxygen species generation and potential therapeutic applications. J Nanoparticle Res 19: 253. https://doi.org/10.1007/s11051-017-3943-2
Wydra R.J., Rychahou P.G., Evers B.M., Anderson K.W., Dziubla T.D., Hilt J.Z. (2015) The role of ROS generation from magnetic nanoparticles in an alternating magnetic field on cytotoxicity. Acta Biomater 25: 284–290. https://doi.org/10.1016/j.actbio.2015.06.037
Tuzun B.S., Fafal T., Tastan P., Kivcak B., Yelken B.O., Kayabasi C., Susluer S.Y., Gunduz C. (2020) Structural characterization, antioxidant and cytotoxic effects of iron nanoparticles synthesized using Asphodelus aestivus Brot. aqueous extract. Green Process Synth 9: 153–163. https://doi.org/10.1515/gps-2020-0016
Paul S., Saikia J.P., Samdarshi S.K., Konwar B.K. (2009) Investigation of antioxidant property of iron oxide particlesby 1′-1′ diphenylpicryl-hydrazyle (DPPH) method. J Magn Magn Mater 321: 3621–3623. https://doi.org/10.1016/j.jmmm.2009.07.004
Proskurnina E.V., Polimova A.M., Sozarukova M.M., Prudnikova M.A., Ametov A.S., Vladimirov Y.A. (2016) Kinetic Chemiluminescence as a Method for Oxidative Stress Evaluation in Examinations of Patients with Type 2 Diabetes Mellitus. Bull Exp Biol Med 161: 131–133. https://doi.org/10.1007/s10517-016-3362-x
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


