Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 4, стр. 344-360
ОСОБЕННОСТИ РАСПРЕДЕЛЕНИЯ КАЛЬРЕТИНИН-ИММУНОПОЗИТИВНЫХ НЕЙРОНОВ В ПОЯСНИЧНОМ ОТДЕЛЕ СПИННОГО МОЗГА КОШКИ (FELIS CATUS)
А. А. Вещицкий 1, П. Е. Мусиенко 1, 2, 3, Н. С. Меркульева 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Институт трансляционной биомедицины СПбГУ
Санкт-Петербург, Россия
3 Клиника детской хирургии и ортопедии, НИИФ МЗ РФ
Санкт-Петербург, Россия
* E-mail: mer-natalia@yandex.ru
Поступила в редакцию 30.01.2021
После доработки 15.04.2021
Принята к публикации 21.04.2021
Аннотация
Многообразие нейронных сетей ЦНС определяется, в том числе, гетерогенностью популяций нейронов в ее составе. В качестве маркеров нейронов разных морфотипов могут выступать кальций-связывающие белки, среди которых одним из наиболее распространенных является кальретинин. В настоящей работе с помощью непрямого иммуногистохимического метода были маркированы кальретинин-иммунопозитивные нейронные популяции поясничных сегментов спинного мозга кошки. В исследовании было выявлено 19 морфотипов нейронов, имеющих строгую посегментную и ламинарную локализацию, сделана попытка сопоставления предполагаемой функции этих нейронов с данными литературы. Среди выявленных морфотипов три локализуются в пластине I и соответствуют нейронам, участвующим в передаче болевой и температурной информации. В пластине II обнаружены клетки одного морфотипа, на которых сходятся болевые афференты. Три типа пучковых нейронов, передающих информацию от периферических механо- и ноцицепторов в супраспинальные структуры, представлены в пластинах III–IV. Пластины V–VI характеризуются функционально разными нейронами пяти морфотипов: интернейронами ядер Кларка и аналогичной зоны каудальных поясничных сегментов, на которые сходится проприоцептивная информация; нейронами на латеральной границе между белым и серым веществом, отвечающими на болевые и тактильные сигналы, и двумя типами неупорядоченно распределенных вставочных, пучковых или проприоспинальных клеток, получающих разнородные афферентные сигналы от мышечных веретен. В пластинах VII–VIII выявлены два типа симпатических преганглионарных нейронов (в интермедиолатеральном и интеркалированном ядрах), интернейроны Реншоу и три типа разноразмерных дисперсно распределенных мультиполярных клеток, определение функции для которых является затруднительным. В пластине IX, представленной мотонейронными пулами, иммунопозитивных нейронов не обнаружено. Вокруг центрального канала в пластине X локализованы редкие нейроны, функция для которых, в силу малого числа их морфологических признаков, не определена.
ВВЕДЕНИЕ
В эукариотической клетке ионы кальция выступают в качестве вторичного мессенджера, обеспечивающего регуляцию важнейших внутриклеточных процессов, реализация которых возможна за счет работы кальций-связывающих белков [1]. В нейронах и их отростках содержится несколько типов кальций-связывающих белков, отличающихся скоростью связывания ионов кальция (см. обзор [2]). Некоторые из этих типов белков экспрессируются конкретными элементами центральной и периферической нервной системы. Так, в спинном мозге парвальбумин маркирует систему проприоцептивной чувствительности (псевдоуниполярные нейроны дорзальных ганглиев [3, 4], восходящие пути дорзального канатика [5], волокна и нейроны ядер Кларка [6]), а также популяцию тормозных Ia-интернейронов промежуточного серого вещества [7], кальбиндин – тормозные клетки Реншоу [8], комиссуральные V1 интернейроны [7], интернейроны дорзальных рогов и промежуточного серого вещества, получающие разномодальные периферические и супраспинальные сигналы [9], а также специфичные популяции нейронов висцерального отдела нервной системы – преганглионарные клетки интермедиолатерального ядра (ИМЛ) [10], кальцинеурин – ограниченное число популяции альфа-мотонейронов, обеспечивающих иннервацию быстрых мышечных волокон [11] и т.д. Таким образом, иммуногистохимическая визуализация кальций-связывающих белков является эффективным средством функционального картирования нервной системы.
Одним из наиболее распространенных среди кальций-связывающих белков является также кальретинин (CR), экспрессирующийся в нейронах коры больших полушарий [12], мозжечка [13], таламуса [14], чувствительных ганглиев [15], спинного мозга [5, 16] и т.д. В силу своих молекулярных особенностей данный кальций-связывающий белок в зависимости от концентрации ионов кальция в нейроне может выступать в качестве быстрого или медленного буфера (см. обзор [2]), а также модулировать возбудимость клетки [17].
Спинальный нейрональный аппарат играет ключевую роль в генерации локомоторной активности [18], управлении позой тела, баланса при активном передвижении [19], интегративном висцеральном и сенсомоторном контроле [20, 21]. При различного рода нейродегенеративных заболеваниях спинного мозга происходит нарушение и утеря этих функций. При этом нейроны, экспрессирующие разные кальций-связывающие белки, обладают разной резистентностью к воздействию патологических факторов (см. обзор [22]): например, при болезни Альцгеймера сохраняются нейроны, экспрессирующие кальретинин, но не кальбиндин; и наоборот, при боковом амиотрофическом склерозе именно экспрессирующие кальретинин нейроны повреждаются в первую очередь [23]. Таким образом, существует необходимость в идентификации и систематизации нейронных популяций, экспрессирующих разные кальций-связывающие белки, для понимания того, на какие именно нейронные сети и каким образом могут влиять те или иные нейродегенеративные заболевания спинного мозга.
Целью настоящего исследования является выявление разнообразия возможных морфотипов нервных клеток, экспрессирующих кальций-связывающий белок CR, в пределах поясничного утолщения спинного мозга кошки – классического объекта исследования сенсомоторных сетей.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено в соответствии с требованиями Директивы Совета Европейского Парламента по защите животных, используемых для экспериментальных и других научных целей (2010/63EU) и с одобрения Комиссии по этике Института физиологии им. И.П. Павлова РАН (протокол № 5/3 от 28.01.17). В работе использованы образцы поясничного отдела спинного мозга от 6 нормально пигментированных взрослых кошек (весом 2.5–3.5 кг). Все животные, за исключением одного, были предварительно децеребрированны и участвовали в нейрофизиологическом эксперименте, описанном в работах [24, 25]. Данный подход был использован с целью гуманного использования экспериментальных животных в ряде нейроморфологических исследований [16, 26].
Подготовка гистологического материала. Через 4–5 ч после децеребрации экспериментальных объектов под глубоким наркозом (5% изофлюран) проводили транскардиальную перфузию. Промывку сосудов от форменных элементов крови осуществляли физиологическим раствором (0.9% натрия хлорид, 700–800 мл/кг, pH 7.4, 25°C), фиксацию тканей – 4%-ным раствором параформальдегида на 0.01 М фосфатном буфере (pH 7.4, 600–700 мл/кг, 25°C). После перфузии спинной мозг извлекали из позвоночника и последовательно выдерживали в 20 и 30% растворах сахарозы до погружения. Деление спинного мозга на сегменты (L1–L7) проводили, ориентируясь на дорзальные корешки [27]. На замораживающем микротоме (Reichert, Германия) изготавливали поперечные срезы толщиной 50 мкм.
Иммуногистохимия. Выявление CR проводили с помощью непрямого иммуногистохимического метода на свободно плавающих срезах. В начале выполнения протокола и между всеми процедурами срезы промывали в 0.01 М фосфатно-солевом буфере 3 раза по 10 мин. Демаскировку антигенов проводили в 1% NaBH4 в течение 15 мин [28]. Активность эндогенной пероксидазы блокировали путем получасовой инкубации в 0.3% H2O2. Неспецифическое связывание антител подавляли 5% нормальной сывороткой козы (NGS, Vector Labs, Великобритания) (90 мин). Затем, не промывая, срезы инкубировали в течение 72 ч при +4°С в растворе первичных моноклональных антител мыши к CR (MAB1568, Millipore, США, разведение 1:1000) с добавлением 5% нормальной сыворотки козы и консерванта 0.01% NaN3. Затем срезы инкубировали в растворе биотинилированных вторичных антител антимышь (1:600, Vector Laboratories, Великобритания) в течение 24 ч. К раствору вторичных антител также добавляли 5% нормальную сыворотку козы и 0.1% NaN3. Затем срезы инкубировали в авидин-биотиновом комплексе с пероксидазой (ABC Elite system, Vector Labs, Великобритания) в течение 1 ч. Визуализацию пероксидазной реакции осуществляли с помощью раствора, содержащего 1% DAB (хромоген 3,3’-диаминобензидин), 10% NiNH4SO4 и 0.03% H2O2. После промывки в дистиллированной воде срезы монтировали на желатинизированные предметные стекла, высушивали, подвергали обезвоживанию в спиртах восходящей концентрации (2 × 70%, 2 × 96%, 2 × 100%) и просветлению в ксилоле, после чего заключали в монтирующую среду (Bio Mount HM, Италия). Для выявления специфичности антител несколько срезов спинного мозга подвергали стандартному иммуногистохимическому протоколу, но исключали этап добавления первичных или вторичных антител. В таком случае срезы спинного мозга были лишены иммунопозитивной метки.
Цифровая обработка и анализ гистологического материала. Получение цифровых изображений срезов с выявленными антигенами проводили на компьютерной установке, оснащенной световым микроскопом Olympus СX31 (Olympus Corporation, Япония; увеличение объектива ×10), свободно распространяемым программным комплексом digiCamControl и камерой Nikon (D3200, Nikon Corporation, Япония). В нервной системе CR экспрессируется исключительно в нейронах [29, 30], поэтому иммунопозитивные клетки, у которых на срезе не визуализировались отростки, тоже были взяты в анализ. Подсчет площади сомы иммунопозитивных нейронов, корректировку контраста и яркости изображений проводили в свободном программном комплексе Fiji [31]. Деление серого вещества на пластины проводили вручную на основе атласа спинного мозга кошки [32]. Классификацию иммунопозитивных нейронов осуществляли на основе особенностей формы (оценка формы производилась визуально) и размера сомы, типа отхождения отростков (если они визуализируются), локализации клеток. В зависимости от формы сомы (для клеток без отростков) нейроны делили на овальные, округлые и плоские; в зависимости от типа отхождения иммунопозитивных отростков (при их наличии) – на веретеновидные (клетки с двумя биполярно отходящими отростками) и мультиполярные (клетки с тремя и более отростками). К нейронам мелкого размера относили клетки площадью до 200 мкм2, среднего – 200–450 мкм2, крупного – более 450 мкм2 в соответствии с делением, представленным в работе [16]. Среднее число ± стандартное отклонение (SD) нейронов в пластине или группе пластин и в сегменте и средняя площадь сомы ± SD для нейронов каждого морфотипа анализировали в программе Prism 8.0 (GraphPad Software, США). Различия средней площади для каждого типа нейронов, находящихся в наименьшем и наибольшем по своей площади сегментах, оценивали по коэффициенту С, вычисляемому путем деления средней площади нейронов одного типа в наиболее каудальном для данного типа сегменте поясничного отдела (CAA) на среднюю площадь нейронов этого типа в наиболее ростральном для данного типа сегменте (RAA) (рис. 1, a 2). Данный коэффициент наглядно показывает, наблюдается ли изменение площади сомы каждого типа нейронов в зависимости от площади серого вещества.
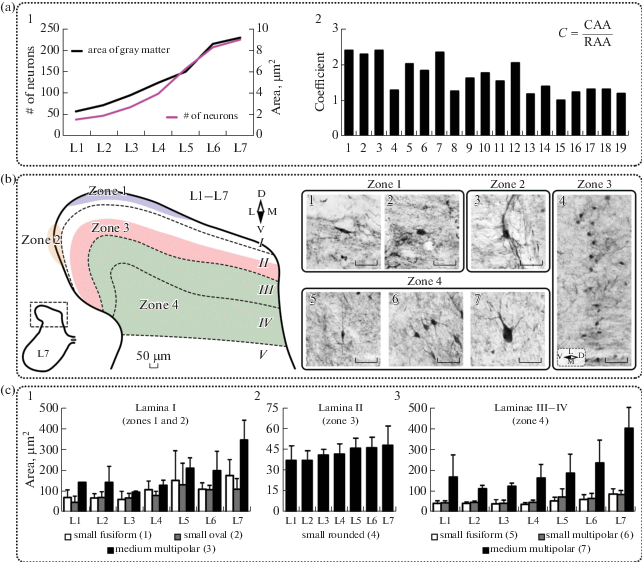
Рис. 1.
Общие характеристики и распределение CR+ нейронов в дорзальном роге спинного мозга кошки. (a) – особенности распределения CR+ нейронов: 1 – отношение между средней площадью серого вещества и средним числом CR+ нейронов; 2 – коэффициент отношения средней площади CR+ нейронов каждого типа (номера типов см. табл. 1), где C – коэффициент, CAA – средняя площадь нейронов одного типа в наиболее каудальном для данного типа сегменте поясничного отдела, RAA – средняя площадь нейронов одного типа в наиболее ростральном для данного типа сегменте поясничного отдела. Значения представлены как среднее + SD. (b) – типы нейронов и их локализация: 1 – мелкие веретеновидные нейроны пластины I; 2 – мелкие овальные нейроны пластины I; 3 – средние мультиполярные нейроны пластины I; 4 – мелкие округлые нейроны пластины II; 5 – мелкие веретеновидные нейроны пластин III–IV; 6 – мелкие мультиполярные нейроны пластин III–IV; 7 – средние мультиполярные нейроны пластин III–IV. Черной штриховой линией обозначены границы пластин серого вещества. Римскими цифрами обозначены номера пластин. Разными цветами и арабскими цифрами обозначены зоны локализации нейронов. Латинскими буквами D, V, M, L обозначены стороны среза (соответственно, дорзальная, вентральная, медиальная, латеральная). Калибровочный маркер на всех изображениях равен 50 мкм. (c) – площадь CR+ нейронов разных морфотипов: 1 – площадь нейронов пластины I; 2 – площадь нейронов пластины II; 3 – площадь нейронов пластин III–IV. Значения представлены как среднее + SD.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В сером веществе поясничных сегментов спинного мозга кошки выявлены нейроны, экспрессирующие кальций-связывающий белок CR. Число кальретинин-иммунопозитивных (CR+) нейронов зависит от сегмента спинного мозга: градуально увеличивается в рострокаудальном направлении, достигая максимума в сегментах L6 и L7 (рис. 1, a 1). При этом среднее число нейронов в сегменте согласуется с площадью серого вещества – увеличению общей площади серого вещества соответствует увеличение числа CR+ нейронов (рис. 1, a 1).
CR+ нейроны представлены большим разнообразием морфотипов (табл. 1) и локализуются во всех пластинах (по Рекседу [32]) серого вещества; при этом разные типы CR+ нейронов имеют четкие границы зон своей локализации в пределах как одной, так и нескольких пластин, что отражено на рисунках и далее по тексту.
Таблица 1.
Типы CR+ нейронов поясничного отдела спинного мозга
| № | Пластины | Сегменты | Локализация | Тип нейронов | Площадь, мкм2 | Рисунок |
|---|---|---|---|---|---|---|
| 1 | I | L1–L7 | Центральная часть | Мелкие веретеновидные | 116 ± 42 n = 120 |
1, b 1 |
| 2 | I | L1–L7 | Рядом с трактом Лиссауэра | Мелкие овальные | 101 ± 41 n = 109 |
1, b 2 |
| 3 | I | L1–L7 | Латеральная поверхность дорзального рога | Средние мультиполярные | 223 ± 104 n = 42 |
1, b 3 |
| 4 | II | L1–L7 | Преимущественно в IIi | Мелкие округлые | 43 ± 7 n = 3001 |
1, b 4 |
| 5 | III–IV | L1–L7 | – | Мелкие веретеновидные | 54 ± 10 n = 564 |
1, b 5 |
| 6 | III–IV | L1–L7 | – | Мелкие мультиполярные | 60 ± 12 n = 616 |
1, b 6 |
| 7 | III–IV | L1–L7 | – | Средние мультиполярные | 215 ± 64 n = 282 |
1, b 7 |
| 8 | V–VI | L1–L4 | Ядра Кларка | Мелкие овальные | 85 ± 19 n = 918 |
2, a 1 |
| 9 | V–VI | L5–L7 | Граница пластин VI, VII и X | Мелкие плоские | 75 ± 18 n = 332 |
2, a 2 |
| 10 | V–VI | L1–L7 | Латеральная граница между белым и серым веществом | Средние мультиполярные | 284 ± 99 n = 208 |
2, a 5 |
| 11 | V–VI | L1–L7 | – | Мелкие мультиполярные | 104 ± 23 n = 1363 |
2, a 3 |
| 12 | V–VI | L1–L7 | – | Средние мультиполярные | 316 ± 44 n = 549 |
2, a 4 |
| 13 | VII–VIII | L1–L4 | Интермедиолатеральное ядро | Мелкие мультиполярные | 178 ± 62 n = 764 |
3, a 1 |
| 14 | VII–VIII | L3–L4 | Дорзальная граница пластины VII | Средние мультиполярные | 324 ± 66 n = 96 |
3, a 2 |
| 15 | VII–VIII | L5–L7 | Вентральная граница пластины VII | Средние овальные | 371 ± 58 n = 404 |
3, a 6 |
| 16 | VII–VIII | L1–L7 | – | Мелкие мультиполярные | 173 ± 17 n = 1536 |
3, a 3 |
| 17 | VII–VIII | L1–L7 | – | Средние мультиполярные | 374 ± 31 n = 1224 |
3, a 4 |
| 18 | VII–VIII | L1–L7 | – | Крупные мультиполярные | 925 ± 74 n = 842 |
3, a 5 |
| 19 | X | L1–L7 | – | Мелкие овальные | 93 ± 27 n = 235 |
2, a 6 |
Распределение CR+ нейронов в дорзальных рогах спинного мозга
Пластина I
В пластине I каждой половины среза спинного мозга визуализируется до 3 CR+ нейронов. Среди них выявлены: 1) мелкие веретеновидные, 2) мелкие овальные, 3) средние мультиполярные.
Клетки первого типа (веретеновидные) характеризуются вытянутой вдоль кривизны дорзального рога сомой малого размера (площадь 116 ± 42 мкм2) (рис. 1, b 1). В отростках нейронов данного типа иммунопозитивная реакция отсутствует. Локализуются преимущественно в центральной части пластины I, иногда более латерально – ближе к тракту Лиссауэра (зона 1 на рис. 1, b).
Клетки второго типа (овальные) имеют округлую форму и малый размер сомы (площадь 101 ± 41 мкм2) (рис. 1, b 2). Метка в отростках отсутствует. Локализуются преимущественно в дорзолатеральной части пластины I – в области тракта Лиссауэра (зона 1 на рис. 1, b).
Клетки третьего типа имеют мультиполярную форму и значительно более крупную сому (площадь 223 ± 104 мкм2) (рис. 1, b 3). Данные нейроны в пределах пластины I локализуются в наиболее латеральной части дорзального рога – на границе с пластиной II (зона 2 на рис. 1, b). Отростки данных нейронов, направленные параллельно кривизне дорзального рога, также иммунопозитивны.
У всех трех типов нейронов площадь сомы увеличивается от сегмента к сегменту (рис. 1, c 1); таким образом, нейроны пластины I в сегменте L7 по средней площади сомы крупнее более чем в два раза нейронов в сегменте L1 (рис. 1, a 2).
Пластина II
В пластине II выявлен один тип CR+ нейронов, имеющих округлую сому малого размера (площадь 43 ± 7 мкм2) (рис. 1, b 4). Располагаются клетки цепочкой, преимущественно во внутренней части пластины (подслое IIi) (зона 3 на рис. 1, b). Иногда, в более каудальных сегментах, данные нейроны формируют скопления, однако, упорядоченной кластеризации таких скоплений не обнаружено. Размер сомы от сегмента к сегменту значительно не меняется (рис. 1, a 2; рис. 1, c 2). Отростки практически не видны, иногда визуализируются единичные биполярно отходящие в дорзальном и вентральном направлении.
Пластины III–IV
В пластинах III и IV (зона 4 на рис. 1, b) выявлены три морфотипа CR+ нейронов, локализующихся без какой-либо упорядоченности: 1) мелкие веретеновидные, 2) мелкие мультиполярные, 3) средние мультиполярные.
Веретеновидные нейроны имеют овальную форму (рис. 1, b 5) и малый размер сомы (площадь 54 ± 10 мкм2), который от сегмента к сегменту значительно не варьирует (рис. 1, a 2; рис. 1, c 3). Биполярно отходящие от сомы отростки ориентированны перпендикулярно кривизне дорзального рога.
Мультиполярные нейроны пластин III–IV формируют две популяции клеток, существенно отличающихся по размерам. У более многочисленной популяции мелких нейронов (60 ± 12 мкм2) имеются 3–4 CR+ отростка, отходящих от сомы в разные стороны (рис. 1, b 6). Размер сомы от сегмента к сегменту увеличивается, достигая максимума в L7 (рис. 1, a 2; рис. 1, c 3). Более крупные (215 ± ± 64 мкм2) мультиполярные нейроны пластин III–IV имеют несколько разнонаправленных отростков (рис. 1, b 7). Средний размер сомы в сегментах L1–L6 существенно не меняется (рис. 1, c 3), однако в сегменте L7 площадь клеток данного типа значительно больше, чем в остальных: отношение средней площади нейронов данного типа в сегменте L7 к нейронам того же типа в L1 равно 2.4 (рис. 1, a 2).
Распределение CR+ нейронов в промежуточном сером веществе спинного мозга
Пластины V–VI
В пластинах V и VI выявлено 5 морфотипов CR+ нейронов: 1) мелкие овальные, 2) мелкие плоские, 3) средние мультиполярные, 4) мелкие мультиполярные, 5) крупные мультиполярные.
В ядрах Кларка, локализованных в пределах поясничного отдела в медиальной части пластин V–VI сегментов L1–L4 (зона 1 на рис. 2, a), выявлены мелкие (85 ± 19 мкм2) овальные нейроны (рис. 2, a 1), площадь сомы которых в разных сегментах сходна (рис. 1, a 2; рис. 2, b 1). Некоторые из них имеют 1–3 CR+ отростка.
Рис. 2.
Распределение CR+ нейронов в промежуточном сером веществе спинного мозга кошки. (a) – типы нейронов и их локализация: 1 – мелкие овальные нейроны ядер Кларка; 2 – мелкие плоские нейроны на границе пластин VI, VII и X в сегментах L5–L7; 3 – мелкие мультиполярные нейроны пластин V–VI; 4 – средние мультиполярные нейроны пластин V–VI; 5 – средние мультиполярные нейроны на латеральной границе между серым и белым веществом пластин V–VI; 6 – мелкие овальные нейроны пластины X. Черной штриховой линией обозначены границы пластин серого вещества. Римскими цифрами обозначены номера пластин. Разными цветами и арабскими цифрами обозначены зоны локализации нейронов. Латинскими буквами D, V, M, L обозначены стороны среза (соответственно, дорзальная, вентральная, медиальная, латеральная). Калибровочный маркер на всех изображениях равен 100 мкм. (b) – площадь CR+ нейронов разных морфотипов: 1 – мелких овальных нейронов ядер Кларка; 2 – площадь мелких плоских нейронов, локализованных в сегментах L5–L7 на границе пластин VI, VII и X; 3 – площадь мелких мультиполярных нейронов пластин V–VI; 4 – площадь средних мультиполярных нейронов пластин V–VI; 5 – площадь средних мультиполярных нейронов, локализованных на латеральной границе между серым и белым веществом пластин V–VI; 6 – площадь мелких овальных нейронов пластины X. Значения представлены как среднее + SD.
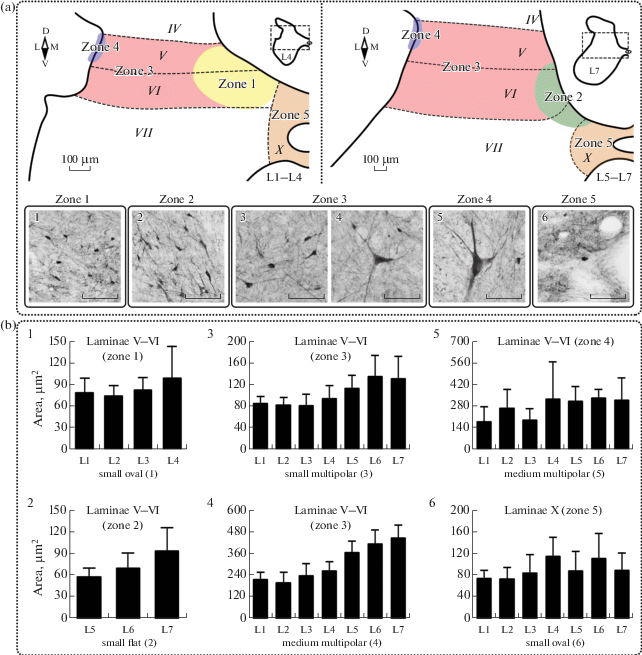
В аналогичных ядрам Кларка областях сегментов L5–L7 (зона 2 на рис. 2, а) выявлены нейроны мелкого размера (75 ± 18 мкм2), для которых характерна уплощенная вытянутая форма (рис. 2, a 2). Размер сомы в сегментах L5–L6 отличается незначительно и увеличивается в сегменте L7 (рис. 1, a 2; рис. 2, b 2).
На латеральной границе между серым и белым веществом (зона 4 на рис. 2, a) локализованы средние по размеру (284 ± 99 мкм2) вытянутые вдоль кривизны шейки дорзального рога нейроны (рис. 2, a 5). Закономерных изменений площади сомы в разных сегментах не наблюдается (рис. 2, b 5). От тела этих нейронов в дорзовентральном направлении отходит множество иммунопозитивных отростков.
В остальной части пластин V–VI (зона 3 на рис. 2, a) всех поясничных сегментов выявлены неупорядоченно распределенные мультиполярные нейроны малого (104 ± 23 мкм2) (рис. 2, a 3) и среднего (316 ± 44 мкм2) размера (рис. 2, a 4). Для обоих типов клеток происходит постепенный прирост площади сомы в более каудальных сегментах (рис. 1, a 2; рис. 2, b 3; рис. 2, b 4).
Пластина X
В пластине X (зона 5 на рис. 2, a) выявлены редкие мелкие (93 ± 27 мкм2) CR+ нейроны овальной формы (рис. 2, a 6), лишенные различимых отростков. Закономерных тенденций изменения площади сомы этих клеток по сегментам не обнаружено – для всех сегментов их площадь составляет около 80 мкм2 и только в сегментах L4 и L6 в среднем приближается к 120 мкм2, однако в силу высоких разбросов данные различия не достоверны (рис. 2, b 6).
Распределение CR+ нейронов в вентральных рогах спинного мозга
Пластины VII–VIII
В пластинах VII и VIII выявлено 6 морфотипов CR+ нейронов: 1) мелкие мультиполярные (в боковых рогах), 2) средние мультиполярные, 3) средние овальные, 4) мелкие мультиполярные, 5) средние мультиполярные, 6) крупные мультиполярные.
В интермедиолатеральных ядрах (ИМЛ, IML; зона 1 на рис. 3, a) боковых рогов сегментов L1–L4 выявлены группы CR+ нейронов малого размера (178 ± 62 мкм2), имеющих во всех сегментах сходную площадь сомы (рис. 3, b 1). Нейроны данного типа характеризуются разной формой: округлой, плоской или мультиполярной (рис. 3, a 1). Редко видны множественные отходящие отростки, иммунопозитивные только у основания; иногда толстые CR+ отростки выходят из ИМЛ достаточно глубоко в белое вещество перпендикулярно серому.
Рис. 3.
Распределение CR+ нейронов в вентральном роге спинного мозга кошки. (a) – типы нейронов и их локализация: 1 – мелкие мультиполярные нейроны интермедиолатерального ядра (ИМЛ); 2 – средние мультиполярные нейроны на дорзальной границе пластины VII; 3 – мелкие мультиполярные нейроны пластин VII–VIII; 4 – средние мультиполярные нейроны пластин VII–VIII; 5 – крупные мультиполярные нейроны пластин VII–VIII; 6 – средние овальные нейроны на вентральной границе между пластинами VII, VIII и мотонейронными пулами. Черной штриховой линией обозначены границы пластин серого вещества. Римскими цифрами обозначены номера пластин. Разными цветами и арабскими цифрами обозначены зоны локализации нейронов. Латинскими буквами D, V, M, L обозначены стороны среза (соответственно, дорзальная, вентральная, медиальная, латеральная). Калибровочный маркер на всех изображениях равен 100 мкм. (b) – площадь CR+ нейронов разных морфотипов: 1 – площадь мелких мультиполярных нейронов ИМЛ; 2 – площадь средних мультиполярных нейронов на дорзальной границе пластины VII; 3 – площадь мелких мультиполярных нейронов пластин VII–VIII; 4 – площадь средних мультиполярных нейронов пластин VII–VIII; 5 – площадь крупных мультиполярных нейронов пластин VII–VIII; 6 – площадь средних овальных нейронов на вентральной границе между пластинами VII, VIII и мотонейронными пулами. Значения представлены как среднее + SD.
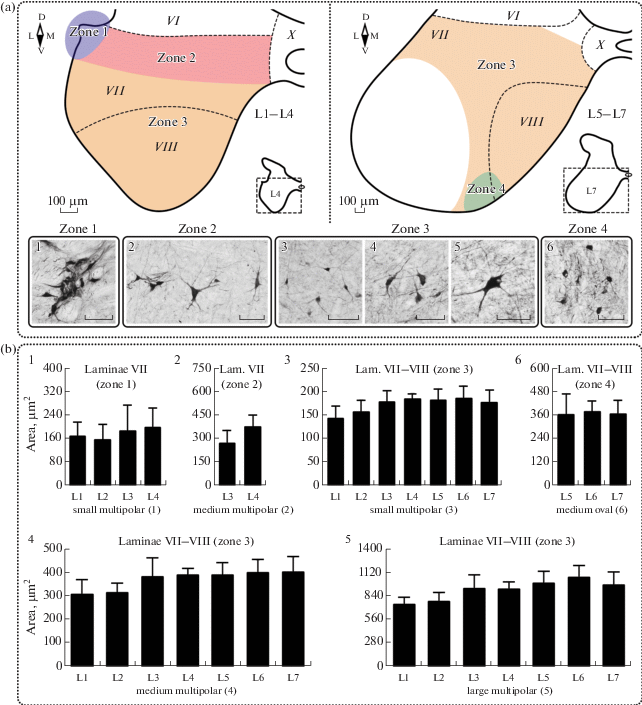
В сегментах L3–L4 вдоль дорзальной границы пластины VII (зона 2 на рис. 3, a) выявлены пучки CR+ волокон, идущих от ИМЛ к интермедиомедиальному ядру. Вдоль данных волокон располагаются несколько средних по размеру (324 ± 66 мкм2) мультиполярных CR+ нейронов (рис. 3, a 2). Площадь этих нейронов несколько больше в сегменте L4 (рис. 3, b 2).
На вентральной границе между пластинами VII, VIII и мотонейронными пулами (зона 4 на рис. 3, a) в сегментах L5–L7 выявлены средние по размеру (371 ± 58 мкм2) CR+ нейроны преимущественно овальной формы, по всем признакам схожие с клетками Реншоу (рис. 3, a 6). Размер сомы данных нейронов для всех сегментов одинаков (рис. 3, b 6).
В остальной части пластин VII и VIII (зона 3 на рис. 3, a) локализуются мелкие, средние и крупные мультиполярные CR+ нейроны; нами не выявлено какой бы то ни было системности в их распределении.
Площадь сомы мелких мультиполярных клеток (рис. 3, a 3) составляет 173 ± 17 мкм2. Достоверно значимых различий в площади нейронов во всех исследуемых сегментах не обнаружено (рис. 3, b 3).
Площадь сомы средних по размеру мультиполярных клеток (рис. 3, a 4) составляет 374 ± 31 мкм2 и существенно не варьирует во всех исследуемых сегментах (рис. 3, b 4). Каждый нейрон имеет от 3 до 6 отростков.
Крупные мультиполярные (925 ± 74 мкм2) CR+ нейроны (рис. 3, a 5) имеют множество иммунопозитивных отростков. Площадь сомы существенно не варьирует, и в более ростральных сегментах (L1–L2) несколько меньше, чем в остальных (рис. 3, b 5). Некоторые клетки по своей морфологии напоминают альфа-мотонейроны, при этом обладают менее выраженной иммунопозитивной реакцией.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день морфологическая классификация спинного мозга не полна, более того, отсутствует прямое соответствие между морфологической и функциональной классификациями. В соответствии с этим в обсуждении мы будем опираться на обе классификации: морфологическую и функциональную – для дорзальных рогов, и только на функциональную – для промежуточного серого вещества и вентральных рогов.
Пластина I
Нейроны пластины I обеспечивают проводниковую функцию различной кожной чувствительности (болевой, температурной, ощущения зуда) в супраспинальные структуры [33]. Выделяют 4 типа нейронов пластины I: веретеновидные, мультиполярные, плоские и пирамидные [34]. Известно, что разные морфотипы связаны с конкретным видом передаваемых сигналов [35].
В пластине I нами были выявлены 3 типа CR+ нейронов: 1) мелкие веретеновидные, 2) мелкие овальные, 3) средние мультиполярные (рис. 1, b).
Как видно из графика 1 на рис. 1, c, нейроны первого (веретеновидные) и второго (овальные) типа сходны по размерам. Учитывая и схожую зону локализации этих клеток (зона 1 на рис. 1, b), мы не исключаем, что данные нейроны могут относиться к одному типу, вероятно, веретеновидных клеток, которые по-разному ориентированы в пространстве. В связи с этим данные клетки на срезах могут выглядеть веретеновидными или овальными без видимых отростков. В пользу этого факта говорят и литературные данные, согласно которым среди всех известных морфотипов нейронов пластины I у кошки [16] и крысы [5, 15] иммунопозитивны к CR только веретеновидные. Клетки данного морфотипа активируются болевыми сигналами в ответ на щипание кожи и/или ее нагрев [35] и экспрессируют ГАМК и динорфин [36].
Другой тип CR+ нейронов пластины I, выявленный в настоящем исследовании, представлен мультиполярными клетками (рис. 1, b 3). В работе [16] R. Anelli и C.J. Heckman, проанализировав у кошки популяцию CR+ нейронов пластины I сегмента L7, данный тип клеток отдельно не фиксируют (выделяют только веретеновидные), однако допускают, что выявленные ими круглые нейроны без иммунопозитивных отростков могут относиться к типу мультиполярных нейронов. Учитывая выявленную в нашем исследовании редкость данных нейронов (обнаружено 42 клетки на 210 срезах), полагаем в работе [16] мультиполярные нейроны с хорошо различимыми CR+ отростками могли отсутствовать на взятых в анализ срезах единственного исследованного сегмента L7. Функционально мультиполярные нейроны пластины I представлены достаточно широко [35], поэтому выявленные в настоящей работе мультиполярные нейроны могут быть унимодальными (специфически реагирующими на один из типов воздействия: холод, тепло, щипание, боль) или полимодальными. Среди медиаторов для данного морфотипа клеток характерна экспрессия ГАМК [36].
Пластина II
Основными функциями нейронов пластины II являются передача и модуляция соматосенсорной (болевой, тактильной и температурной) информации [33]. Согласно современной классификации нейронов, в пластине II выделяют 5 типов клеток: островковые, центральные, медио-латеральные, радиальные и вертикальные [37]. Главным морфологическим признаком для каждого типа нейронов является вид отхождения и ветвления дендритного древа [38]. Как было показано в нашем исследовании, CR не выявляется в отростках нейронов пластины II, а форма сомы всех типов клеток схожа (рис. 1, b 4), поэтому при сопоставлении морфотипов мы можем полагаться только на преимущественную локализацию разных популяций нейронов в пределах пластины II. Из морфологического описания клеток пластины II, представленного в работе [37], следует, что наибольшее сходство выявленные в нашем исследовании CR+ клетки имеют с центральными нейронами, располагающимися преимущественно во внутреннем слое пластины II. Данный тип клеток делится в свою очередь на тормозные (ГАМК-ергические) и возбуждающие (глутамат-ергические) [38], а иннервация обеспечивается C-волокнами [39]. Некоторые центральные нейроны пластины II также экспрессируют кальбиндин [9], парвальбумин [5] и соматостатин [38].
Изучению функций CR+ нейронов пластины II посвящено множество современных работ. K.M. Smith и соавт., используя методы оптогенетики, выборочно активировали сети нейронов, экспрессирующих CR, и доказали их участие в инициации возбуждающих сигналов, напрямую передаваемых на пучковые нейроны пластины I, обеспечивая усиление болевой афферентации [40]. В работе [41] было показано, что CR+ нейроны пластины II участвуют в формировании аллодинии, вызванной в результате развития кожных воспалительных процессов. В исследовании G. Gatto и соавт. [42], посвященному картированию дорзальных рогов на предмет поиска интернейронов, участвующих в реализации разных рефлекторных реакций, было показано, что возбуждающие CR+ нейроны пластины II являются одним из типов клеток, обеспечивающих реализацию чесательного рефлекса.
Пластины III–IV
Пластины III и IV схожи между собой по цитоархитектонике и содержат пучковые и вставочные нейроны [41]. Пучковые нейроны принимают и обеспечивают дальнейшую передачу в супраспинальные структуры тактильных [43] и болевых сигналов [44]; вставочные нейроны представлены множеством популяций возбуждающих и тормозных клеток, участвующих в обработке механосенсорной информации и отличающихся по морфологическим, физиологическим и синаптическим свойствам [45].
В пластинах III–IV нами были выявлены три морфотипа CR+ нейронов: 1) мелкие веретеновидные, 2) мелкие мультиполярные, 3) средние мультиполярные (рис. 1, b).
Известно, что тактильная информация от механорецепторов поступает на клетки одного из подтипов пучковых клеток – вертикальные нейроны, описанные в работе [46]. Данные клетки по своей морфологии схожи с выявленными в нашем исследовании мелкими веретеновидными CR+ нейронами (рис. 1 b, 5). Нейроны двух других описанных морфотипов (мелкие и средние мультиполярные; рис. 1, b 6; рис. 1, b 7) напоминают изученные M. Naim и соавт. пучковые клетки, обеспечивающие передачу болевой информации и аксоны которых участвуют в формировании спиноталамического тракта [47]. Однако эти клетки могут относиться и к одной из популяций тормозных интернейронов, коэкспрессирующих транскрипционный фактор PAX2 [41], необходимый для дифференциации ГАМК-ергических нейронов [48].
Пластины V–VI
На сегодняшний день не существует четкой морфологической классификации нейронов пластин V и VI, однако по функциям их разделяют на пучковые, проприоспинальные и вставочные [33]. Создание данной классификации усложнено еще и тем, что обе пластины негомогенны и делятся на латеральную и медиальную части, которые имеют свои особенности для каждой из пластин [32].
В настоящей работе в пластинах V–VI выявлено 5 морфотипов CR+ нейронов: 1) мелкие овальные, 2) мелкие плоские, 3) средние мультиполярные, 4) мелкие мультиполярные, 5) крупные мультиполярные (рис. 2, a).
Мелкие овальные CR+ нейроны были визуализированы в ядрах Кларка (рис. 2, a 1), которые у кошки расположены в медальной части пластины VI грудных и первых ростральных (L1–L4) поясничных сегментов [49]. Данные ядра относятся к проприоцептивной системе спинного мозга: в них сходятся сенсорные волокна Ia и II типа от мышечных веретен и Ib типа – от сухожилий, а также локализованы нейроны второго порядка, аксоны которых дают начало части дорзального спинно-мозжечкового тракта, передающего проприоцептивную информацию в мозжечок [50]. В ядрах Кларка выделяют три класса нейронов, хорошо различимых по размеру и форме: 1) мелкие (треугольные и мультиполярные), 2) средние (веретеновидные и мультиполярные), 2) крупные (мультиполярные) [51]. Учитывая размер выявленных в настоящем исследовании CR+ клеток, полагаем, они относятся к мелким или средним мультиполярным нейронам ядер Кларка. Данные клетки в силу своих размеров изучены значительно слабее класса крупных нейронов, аксоны которых дают начало спинно-мозжечковому тракту [52]. Предполагается, что более мелкие нейроны являются вставочными, имеющими локальные связи между собой, клетками других пластин (V, VI, VII и X) и афферентными волокнами [51, 52]. При этом стоит отметить, что у мышей CR экспрессируется у 40% нейронов, аксоны которых принимают участие в формировании дорзального спинно-мозжечкового тракта [53]. Y. Fu и соавт. не отмечают размер данных нейронов, поэтому мы можем предположить, что некоторые мелкие/средние нейроны ядер Кларка являются не вставочными, а пучковыми, принимающими участие в формировании спинно-мозжечкового тракта.
В более каудальных поясничных сегментах (L5–L7) в аналогичных ядрам Кларка зонам серого вещества нами были выявлены мелкие плоские CR+ нейроны (рис. 2, a 2). Известно, что у грызунов [54, 55] и некоторых приматов [54, 56] помимо ранее описанных ядер Кларка в спинном мозге локализуются иные прецеребеллярные ядра, также являющиеся источником восходящих путей в мозжечок. У кошки за пределами анатомических границ ядер Кларка характерное для некоторых других видов поясничное прецеребеллярное ядро не визуализируется. В настоящем исследовании у кошки в сегментах L5–L7 в областях предположительной локализации поясничных прецеребеллярных ядер наблюдаются скопления CR+ нейронов, близких по морфологии к мелким овальным нейронам ядер Кларка. Мы полагаем, данные клетки могут являться составной частью проприоцептивной системы. В пользу данного предположения говорят результаты исследований, в которых указывается, что в обозначенных зонах локализуются интернейронные популяции, на клетки которых сходятся афференты I и II типа [57], а также локализуются нейроны, принимающие участие в формировании дорзального спинно-мозжечкового тракта, но не организованные в виде ядра [58].
На латеральной границе между серым и белым веществом пластины V, которая характеризуется наличием множества миелинизированных волокон и в результате чего имеет ретикулярный вид [32], выявлены средние мультиполярные CR+ нейроны (рис. 2, a, 5 ). Такие же клетки описываются в другой работе на кошке [16], где отмечается, что данные нейроны не коэкспрессируют кальбиндин и парвальбумин. В исследованиях на крысе [5, 15], несмотря на описанное большое число CR+ нейронов в пластинах V–VI, не выявлен особый тип клеток на границе белого и серого вещества ни в одном из отделов спинного мозга. Ретикулярная часть латеральной половины пластины V у кошки характеризуется схождением висцеральных афферентов [59] и волокон от симпатических преганглионарных нейронов [60], а также локализацией мультирецептивных нейронов, реагирующих на болевые и тактильные стимулы [61].
В остальных областях пластин V–VI нами были выявлены дисперсно распределенные мелкие и средние мультиполярные CR+ нейроны (рис. 2, a 3; рис. 2, a 4). Данная зона характеризуется большим разнообразием функционально разнородных клеток [33]. У кошки в обозначенной зоне поясничных сегментов локализуются: 1) дорзальная часть популяции интернейронов, принимающих участие в реализации олигосинаптического кожного рефлекса (в сегментах L4-S1) [62], 2) интернейроны, на которых сходятся окончания волокон, идущих от мышечных веретен по афферентам типа Ia [63] и 3) типа II (в сегментах L6–L7) [64]. Стоит отметить, что описанные интернейронные популяции представлены в пластинах V–VI лишь частично и в большей степени локализуются в пластине VII. Таким образом, некоторая часть популяции CR+ нейронов может быть задействована в работе локомоторных сетей, путем проецирования афферентной информации к соответствующим мотонейронным пулам. С другой стороны, пластины V–VI содержат множество пучковых и проприоспинальных нейронов [65], что свидетельствует о том, что приходящая проприоспинальная информация, помимо мотонейронных пулов, может поступать и на нейроны иных спинальных сегментов и супраспинальных структур.
Пластины VII–VIII
Большая часть серого вещества представлена пластинами VII и VIII, вариабельными по своим границам в разных сегментах и занимающими почти все пространство промежуточного серого вещества (за счет пластины VII) и вентральных рогов [32], в связи с чем данные пластины характеризуются большим морфологическим и функциональным разнообразием локализованных в них нейронов. Четкой классификации нейронов пластин VII–VIII, как и для пластин V–VI, на настоящий момент нет [33].
В боковых рогах сегментов L1–L4 на границе между пластинами VI и VII выявлены мелкие мультиполярные (реже овальные и плоские) CR+ нейроны. Данная зона в обозначенных сегментах у кошки характеризуется локализацией ИМЛ, состоящего из преганглионарных симпатических нейронов, отвечающих за контроль автономной деятельности внутренних органов [60]. Согласно работе [66], в зависимости от локализации нервных клеток и их морфотипа, ИМЛ делится на две зоны: 1) в сером веществе – nucleus intermediolateralis pars principali и 2) в белом веществе – nucleus intermediolateralis pars funicularis. Судя по расположению выявленных нейронов и их морфологическому разнообразию, CR экспрессируется нейронами в обеих зонах ИМЛ, однако согласно исследованию [67] – не всеми. Помимо кошки, CR+ нейроны в ИМЛ описаны у крысы [5] и мармозеток [56]. Нейроны ИМЛ синтезируют множество различных веществ: ацетилхолин, энкефалин, окситоцин, соматостатин и др. [33], однако работ, в которых была бы показана их коэкспрессия с CR, не обнаружено.
В сегментах L3–L4 вдоль дорзальной границы пластины VII выявлены пучки CR+ волокон и средних мультиполярных нейронов, идущих между ядрами ИМЛ и ИММ. В данной зоне локализуется интеркалированное ядро, состоящее из преганглионарных симпатических нейронов [60]. Данное ядро локализуется у кошки в сегментах T1–L5 [68]. Учитывая выявленную в настоящем исследовании узкую зону локализации CR+ нейронов ИК, полагаем, в данном ядре CR экспрессируется строго определенной популяцией клеток, локализованных в сегментах L3–L4. Полагаем, этой популяцией могут выступать нейроны, описанные в исследовании [69], в котором было показано, что в промежуточном сером веществе медиальнее ИМЛ у кошки именно в сегментах L3–L4 локализуются симпатические преганглионарные нейроны, иннервирующие работу кишечника.
В каудальных поясничных сегментах (L5–L7) на границе пластин VII, VIII и X (мотонейронными пулами) выявлены средние по размеру CR+ нейроны овальной формы (рис. 3 a, 6). Зона локализации данных нейронов совпадает с областью залегания интернейронов Реншоу, обеспечивающих посредством возвратного торможения механизм стабилизации частоты разрядки α-мотонейронов [70, 71]. Известно, что для многих видов млекопитающих в качестве маркера клеток Реншоу используется другой кальций-связывающий белок кальбиндин [8]. Однако данные клетки экспрессируют также парвальбумин и CR [7, 16]. При этом у кошки, в отличие от грызунов, только часть популяции клеток Реншоу экспрессирует кальбиндин (47%) [8], другая часть этой популяции коэкспрессирует CR и парвальбумин [16]. Предполагается, что кальций-связывающие белки могут в разных комбинациях экспрессироваться в отдельных популяциях клеток Реншоу, например, отличающихся по типу используемого медиатора (ГАМК или глицина) [16].
Остальные области пластин VII–VIII содержат в себе огромное число функционально разнородных нейронов: 1) пучковых – идущих к множеству супраспинальных структур [72], 2) проприоспинальных – соединяющих разные половины (комиссуральные) и сегменты спинного мозга [72, 73], 3) вставочных – на которых сходится супраспинальная и афферентная информация и пр. [74]. Все три типа мультиполярных CR+ нейронов в данных пластинах не имеют какой-либо конкретной локализации, кластеризации и других признаков, по которым можно было бы отнести их к конкретной функционально однородной популяции клеток. Полагаем, это станет возможным при использовании методов множественного иммуномечения.
Пластина IX
Пластина IX представлена главным образом мотонейронами. Известно, что у более примитивных классов хордовых (рыб [75, 76], земноводных [77] и пресмыкающихся [78]) кальций-связывающие белки, в том числе и CR, экспрессируются соматическими мотонейронами. В настоящем исследовании в мотонейронах CR не был выявлен, что согласуется с данными, полученными на кошке [16] и других представителях млекопитающих: мышах [7], крысах [5, 15] и мармозетках [56].
Пластина X
По форме сомы в пластине X выделяют несколько типов нейронов: овальные, веретеновидные, пирамидные, звездчатые и мультиполярные [63]. На основе выполняемой функции определены по меньшей мере три класса нервных клеток: преганглионарные парасимпатические [79], пучковые [80] и участвующие в локомоторном контроле (в частности, модуляции работы мотонейронов) [81].
В настоящей работе в пластине X поясничных сегментов выявлены редкие мелкие овальные CR+ нейроны (рис. 2, a 6). Наши данные согласуются с исследованиями на кошке [16] и крысе [5, 15], в которых также описаны мелкие и средние CR+ нейроны, лишенные иммунопозитивной реакции в отростках. При этом данные клетки не коэкспрессируют другие кальций-связывающие белки: кальбиндин и парвальбумин [16]. R. Anelli и C.J. Heckman [16] также отмечают затруднение в определении предполагаемой функции для данных нейронов в силу малого числа отличающих их морфологических признаков.
Согласно собственным данным на кошке [21] и литературным данным на крысе [5, 15], CR более широко представлен в пластине X в крестцовых сегментах (и в последних поясничных для крысы), где маркирует парасимпатические преганглионарные нейроны дорзальной серой комиссуры, расположенной над центральным каналом и обеспечивающей регуляцию деятельности тазовых органов [82]. Однако данные нейроны существенно отличаются по морфологии, локализации и числу от выявленных в настоящем исследовании CR+ нейронов пластины X поясничных сегментов и, по всей видимости, представляют собой отдельную популяцию CR+ нейронов.
Согласно полученным результатам, иммунопозитивные к кальретинину нейроны верхних пластин дорзальных рогов соответствуют определенным морфофункциональным типам: в пластине I – веретеновидным и мультиполярным нейронам, в пластинах II–III – центральным нейронам. Мы также обсуждаем соответствие между выявленными иммунопозитивными к кальретинину нейронами остальных пластин и функциональной классификацией нейронов спинного мозга. Настоящая работа является частью исследования, посвященного изучению морфофункциональной организации спинного мозга млекопитающих.
Список литературы
Islam Md.S. (2020) Calcium Signaling: From Basic to Bedside. In: Islam MdS (ed) Calcium Signaling. Springer International Publishing, Cham, pp 1–6.
Schwaller B. (2009) The continuing disappearance of “pure” Ca2+ buffers. Cellular and Molecular Life Sciences 66: 275–300. https://doi.org/10.1007/s00018-008-8564-6
Antal M., Freund T.F., Polgár E. (1990) Calcium-binding proteins, parvalbumin- and calbindin-D 28k-immunoreactive neurons in the rat spinal cord and dorsal root ganglia: A light and electron microscopic study. Journal of Comparative Neurology 295: 467–484.
Walters M.C., Sonner M.J., Myers J.H., Ladle D.R. (2019) Calcium imaging of parvalbumin neurons in the dorsal root ganglia. eNeuro 6:. https://doi.org/10.1523/ENEURO.0349-18.2019
Ren K., Ruda M.A. (1994) A comparative study of the calcium-binding proteins calbindin-D28K, calretinin, calmodulin and parvalbumin in the rat spinal cord. Brain Research Reviews 19: 163–179. https://doi.org/10.1016/0165-0173(94)90010-8
Hantman A.W., Jessell T.M. (2010) Clarke’s column neurons as the focus of a corticospinal corollary circuit. Nature Neuroscience 13: 1233–1239. https://doi.org/10.1038/nn.2637
Alvarez F.J., Jonas P.C., Sapir T., Hartley R., Berrocal M.C., Geiman E.J., Todd A.J., Goulding M. (2005) Postnatal phenotype and localization of spinal cord V1 derived interneurons. Journal of Comparative Neurology 493: 177–192. https://doi.org/10.1002/cne.20711
Carr P.A., Alvarez F.J., Leman E.A., W. Fyffe R.E. (1998) Calbindin D28k expression in immunohistochemically identified Renshaw cells. NeuroReport 9: 2657–2661. https://doi.org/10.1097/00001756-199808030-00043
Merkulyeva N., Veshchitskii A., Makarov F., Gerasimenko Y., Musienko P. (2016) Distribution of 28 kDa calbindin-Immunopositive neurons in the cat spinal cord. Frontiers in Neuroanatomy 9: 1–13. https://doi.org/10.3389/fnana.2015.00166
Grkovic I., Anderson C.R. (1997) Calbindin D28K-immunoreactivity identifies distinct subpopulations of sympathetic pre- and postganglionic neurons in the rat. Journal of Comparative Neurology 386: 245–259. https://doi.org/10.1002/(SICI)1096-9861(19970922)386:2<245::AID-CNE6>3.0.CO;2-1
Strack S., Wadzinski B.E., Ebner F.F. (1996) Localization of the calcium/calmodulin-dependent protein phosphatase, calcineurin, in the hindbrain and spinal cord of the rat. Journal of Comparative Neurology 375: 66–76. https://doi.org/10.1002/(SICI)1096-9861(19961104)375:1<66::AID-CNE4>3.0.CO;2-M
Wonders C.P., Anderson S.A. (2006) The origin and specification of cortical interneurons. Nature Reviews Neuroscience 7: 687–696. https://doi.org/10.1038/nrn1954
Winsky L., Kuźnicki J. (1995) Distribution of calretinin, calbindin D28k, and parvalbumin in subcellular fractions of rat cerebellum: effects of calcium. Journal of Neurochemistry 65: 381–388. https://doi.org/10.1046/j.1471-4159.1995.65010381.x
Münkle M.C., Waldvogel H.J., Faull R.L.M. (2000) The distribution of calbindin, calretinin and parvalbumin immunoreactivity in the human thalamus. Journal of Chemical Neuroanatomy 19: 155–173. https://doi.org/10.1016/S0891-0618(00)00060-0
Ren K., Ruda M.A., Jacobowitz D.M. (1993) Immunohistochemical localization of calretinin in the dorsal root ganglion and spinal cord of the rat. Brain Research Bulletin 31: 13–22. https://doi.org/10.1016/0361-9230(93)90004-U
Anelli R., Heckman C.J. (2005) The calcium binding proteins calbindin, parvalbumin, and calretinin have specific patterns of expression in the gray matter of cat spinal cord. Journal of Neurocytology 34: 369–385. https://doi.org/10.1007/s11068-006-8724-2
Camp A.J., Wijesinghe R. (2009) Calretinin: Modulator of neuronal excitability. The International Journal of Biochemistry & Cell Biology 41: 2118–2121. https://doi.org/10.1016/j.biocel.2009.05.007
Gerasimenko Y., Roy R.R., Edgerton V.R. (2008) Epidural stimulation: Comparison of the spinal circuits that generate and control locomotion in rats, cats and humans. Experimental Neurology 209: 417–425. https://doi.org/10.1016/j.expneurol.2007.07.015
Musienko P., Courtine G., Tibbs J.E., Kilimnik V., Sa-vochin A., Garfinkel A., Roy R.R., Edgerton V.R., Gerasimenko Y. (2012) Somatosensory control of balance during locomotion in decerebrated cat. Journal of Neurophysiology 107: 2072–2082. https://doi.org/10.1152/jn.00730.2011
Edgerton V.R., Courtine G., Gerasimenko Y.P., Lavrov I., Ichiyama R.M., Fong A.J., Cai L.L., Otoshi C.K., Tillakaratne N.J.K., Burdick J.W., Roy R.R. (2008) Training locomotor networks. Brain Research Reviews 57: 241–254. https://doi.org/10.1016/j.brainresrev.2007.09.002
Merkulyeva N., Lyakhovetskii V., Veshchitskii A., Bazhenova E., Gorskii O., Musienko P. (2019) Activation of the spinal neuronal network responsible for visceral control during locomotion. Experimental Neurology 320: 112986. https://doi.org/10.1016/j.expneurol.2019.112986
Fairless R., Williams S.K., Diem R. (2019) Calcium-binding proteins as determinants of central nervous system neuronal vulnerability to disease. International Journal of Molecular Sciences 20: 2146. https://doi.org/10.3390/ijms20092146
Morrison B.M., Janssen W.G.M., Gordon J.W., Morrison J.H. (1998) Light and electron microscopic distribution of the AMPA receptor subunit, GluR2, in the spinal cord of control and G86R mutant superoxide dismutase transgenic mice. Journal of Comparative Neurology 395: 523–534. https://doi.org/10.1002/(SICI)1096-9861(19980615)395:4<523::AID-CNE8>3.0.CO;2-3
Merkulyeva N., Veshchitskii A., Gorsky O., Pavlova N., Zelenin P.V., Gerasimenko Y., Deliagina T.G., Musienko P. (2018) Distribution of spinal neuronal networks controlling forward and backward locomotion. The Journal of Neuroscience 38: 4695–4707. https://doi.org/10.1523/JNEUROSCI.2951-17.2018
Merkulyeva N., Lyakhovetskii V., Veshchitskii A., Gorskii O., Musienko P. (2021) Rostrocaudal distribution of the C-Fos-immunopositive spinal network defined by muscle activity during locomotion. Brain Sciences 11: 69. https://doi.org/10.3390/brainsci11010069
Zhang M., Broman J. (1998) Cervicothalamic tract termination: a reexamination and comparison with the distribution of monoclonal antibody Cat-301 immunoreactivity in the cat. Anatomy and Embryology 198: 451–472. https://doi.org/10.1007/s004290050196
Shkorbatova P.Y., Lyakhovetskii V.A., Merkulyeva N.S., Veshchitskii A.A., Bazhenova E.Y., Laurens J., Pavlo-va N.V., Musienko P.E. (2019) Prediction algorithm of the cat spinal segments lengths and positions in relation to the vertebrae. The Anatomical Record 302: 1628–1637. https://doi.org/10.1002/ar.24054
Eldred W.D., Zucker C., Karten H.J., Yazulla S. (1983) Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. Journal of Histochemistry and Cytochemistry 31: 285–292. https://doi.org/10.1177/31.2.6339606
Rogers J.H. (1987) Calretinin: a gene for a novel calcium-binding protein expressed principally in neurons. Journal of Cell Biology 105: 1343–1353. https://doi.org/10.1083/jcb.105.3.1343
Andressen C., Blümcke I., Celio M.R. (1993) Calcium-binding proteins: selective markers of nerve cells. Cell and Tissue Research 271: 181–208. https://doi.org/10.1007/BF00318606
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.-Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. (2012) Fiji: an open-source platform for biological-image analysis. Nature Methods 9: 676–682. https://doi.org/10.1038/nmeth.2019
Rexed B. (1954) A cytoarchitectonic atlas of the spinal cord in the cat. Journal of Comparative Neurology 100: 297–379. https://doi.org/10.1002/cne.901000205
Heise C., Kayalioglu G. (2009) Cytoarchitecture of the Spinal Cord. In: Watson C., Paxinos G., Kayalioglu G. (eds) The Spinal Cord. Academic Press, San Diego, pp. 64–93.
Craig A.D., Zhang E.T., Blomqvist A. (2002) Association of spinothalamic lamina I neurons and their ascending axons with calbindin-immunoreactivity in monkey and human. PAIN 97: 105–115. https://doi.org/10.1016/S0304-3959(02)00009-X
Han Z.-S., Zhang E.-T., Craig A.D. (1998) Nociceptive and thermoreceptive lamina I neurons are anatomically distinct. Nature Neuroscience 1: 218–225. https://doi.org/10.1038/665
Lima D., Avelino A., Coimbra A. (1993) Morphological characterization of marginal (Lamina I) neurons immunoreactive for substance P, enkephalin, dynorphin and gamma-aminobutyric acid in the rat spinal cord. Journal of Chemical Neuroanatomy 6: 43–52. https://doi.org/10.1016/0891-0618(93)90006-P
Grudt T.J., Perl E.R. (2002) Correlations between neuronal morphology and electrophysiological features in the rodent superficial dorsal horn. The Journal of Physiology 540: 189–207. https://doi.org/10.1113/jphysiol.2001.012890
Yasaka T., Tiong S.Y.X., Hughes D.I., Riddell J.S., Todd A.J. (2010) Populations of inhibitory and excitatory interneurons in lamina II of the adult rat spinal dorsal horn revealed by a combined electrophysiological and anatomical approach. Pain 151: 475–488. https://doi.org/10.1016/j.pain.2010.08.008
Todd A.J. (2010) Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience 11: 823–836. https://doi.org/10.1038/nrn2947
Smith K.M., Browne T.J., Davis O.C., Coyle A., Boyle K.A., Watanabe M., Dickinson S.A., Iredale J.A., Gradwell M.A., Jobling P., Callister R.J., Dayas C.V., Hughes D.I., Graham B.A. (2019) Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife 8: e49190. https://doi.org/10.7554/eLife.49190
Peirs C., Williams S.-P.G., Zhao X., Arokiaraj C.M., Ferreira D.W., Noh M., Smith K.M., Halder P., Corrigan K.A., Gedeon J.Y., Lee S.J., Gatto G., Chi D., Ross S.E., Goulding M., Seal R.P. (2021) Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the Injury. Neuron 109 :73-90.e7. https://doi.org/10.1016/j.neuron.2020.10.027
Gatto G., Bourane S., Ren X., Di Costanzo S., Fenton P.K., Halder P., Seal R.P., Goulding M.D. (2021) A functional topographic map for spinal sensorimotor reflexes. Neuron 109: 91-104.e5. https://doi.org/10.1016/j.neuron.2020.10.003
Willis W.D., Coggeshall R.E. (2004) Functional Organization of Dorsal Horn Interneurons. In: Willis W.D., Coggeshall R.E. (eds) Sensory Mechanisms of the Spinal Cord: Volume 1 Primary Afferent Neurons and the Spinal Dorsal Horn. Springer US, Boston, MA, pp 271–388. https://doi.org/10.1007/978-1-4615-0035-3_7
Al-Khater K.M., Todd A.J. (2009) Collateral projections of neurons in laminae I, III, and IV of rat spinal cord to thalamus, periaqueductal gray matter, and lateral parabrachial area. Journal of Comparative Neurology 515: 629–646. https://doi.org/10.1002/cne.22081
Abraira V.E., Kuehn E.D., Chirila A.M., Springel M.W., Toliver A.A., Zimmerman A.L., Orefice L.L., Boyle K.A., Bai L., Song B.J., Bashista K.A., O’Neill T.G., Zhuo J., Tsan C., Hoynoski J., Rutlin M., Kus L., Niederkofler V., Watanabe M., Dymecki S.M., Nelson S.B., Heintz N., Hughes D.I., Ginty D.D. (2017) The cellular and synaptic architecture of the mechanosensory dorsal horn. Cell 168: 295-310.e19. https://doi.org/10.1016/j.cell.2016.12.010
Maxwell D.J., Fyffe R.E.W., Rethelyi M. (1983) Morphological properties of physiologically characterized lamina III neurones in the cat spinal cord. Neuroscience 10: 1–22. https://doi.org/10.1016/0306-4522(83)90076-3
Naim M., Spike R.C., Watt C., Shehab S.A.S., Todd A.J. (1997) Cells in laminae III and IV of the rat spinal cord that possess the Neurokinin-1 receptor and have dorsally directed dendrites receive a major synaptic input from tachykinin-containing primary afferents. Journal of Neuroscience 17: 5536–5548. https://doi.org/10.1523/JNEUROSCI.17-14-05536.1997
Larsson M. (2017) Pax2 is persistently expressed by GABAergic neurons throughout the adult rat dorsal horn. Neuroscience Letters 638: 96–101. https://doi.org/10.1016/j.neulet.2016.12.015
Merkul’eva N.S., Veshchitskii A.A., Shkorbatova P.Yu., Shenkman B.S., Musienko P.E., Makarov F.N. (2017) Morphometric characteristics of the dorsal nuclei of Clarke in the rostral segments of the lumbar part of the spinal cord on cats. Neuroscience and Behavioral Physiology 47: 851–856. https://doi.org/10.1007/s11055-017-0481-4
Vega J.A., Cobo J. (2021) Structural and biological basis for proprioception. Proprioception. https://doi.org/10.5772/intechopen.96787
Loewy A.D. (1970) A study of neuronal types in Clarke’s column in the adult cat. Journal of Comparative Neurology 139: 53–79. https://doi.org/10.1002/cne.901390104
Burke R.E., Rudomin P. (2011) Spinal neurons and synapses. In: Comprehensive physiology. American cancer society, pp 877–944. https://doi.org/10.1002/cphy.cp010124
Fu Y., Sengul G., Paxinos G., Watson C. (2012) The spinal precerebellar nuclei: Calcium binding proteins and gene expression profile in the mouse. Neuroscience Letters 518: 161–166. https://doi.org/10.1016/j.neulet.2012.05.002
Snyder R.L., Faull R.L.M., Mehler W.R. (1978) A comparative study of the neurons of origin of the spinocerebellar afferents in the rat, Cat and squirrel monkey based on the retrograde transport of horseradish peroxidase. Journal of Comparative Neurology 181: 833–852. https://doi.org/10.1002/cne.901810409
Olude M.A., Idowu A.O., Mustapha O.A., Olopade J.O., Akinloye A.K. (2015) Spinal cord studies in the African Giant Rat (Cricetomys gambianus, Waterhouse). Nigerian journal of physiological sciences 30: 25–32
Watson C., Sengul G., Tanaka I., Rusznak Z., Tokuno H. (2015) The spinal cord of the common marmoset (Callithrix jacchus). Neuroscience Research 93: 164–175. https://doi.org/10.1016/j.neures.2014.12.012
Hongo T., Jankowska E., Ohno T., Sasaki S., Yamashita M., Yoshida K. (1983) The same interneurones mediate inhibition of dorsal spinocerebellar tract cells and lumbar motoneurones in the cat. The Journal of Physiology 342: 161–180. https://doi.org/10.1113/jphysiol.1983.sp014845
Matsushita M., Hosoya Y., Ikeda M. (1979) Anatomical organization of the spinocerebellar system in the cat, as studied by retrograde transport of horseradish peroxidase. Journal of Comparative Neurology 184: 81–105. https://doi.org/10.1002/cne.901840106
Kuo D.C., Nadelhaft I., Hisamitsu T., Groat W.C. de (1983) Segmental distribution and central projectionsof renal afferent fibers in the cat studied by transganglionic transport of horseradish peroxidase. Journal of Comparative Neurology 216: 162–174. https://doi.org/10.1002/cne.902160205
Morgan C., Groat W.C. de, Nadelhaft I. (1986) The spinal distribution of sympathetic preganglionic and visceral primary afferent neurons that send axons into the hypogastric nerves of the cat. Journal of Comparative Neurology 243: 23–40. https://doi.org/10.1002/cne.902430104
Ritz L.A., Greenspan J.D. (1985) Morphological features of lamina V neurons receiving nociceptive input in cat sacrocaudal spinal cord. Journal of Comparative Neurology 238: 440–452. https://doi.org/10.1002/cne.902380408
Moschovakis A.K., Solodkin M., Burke R.E. (1992) Anatomical and physiological study of interneurons in an oligosynaptic cutaneous reflex pathway in the cat hindlimb. Brain Research 586: 311–318. https://doi.org/10.1016/0006-8993(92)91641-Q
Brown A.G., Fyffe R.E. (1978) The morphology of group Ia afferent fibre collaterals in the spinal cord of the cat. The Journal of Physiology 274: 111–127. https://doi.org/10.1113/jphysiol.1978.sp012137
Riddell J.S., Hadian M. (2000) Interneurones in pathways from group II muscle afferents in the lower–Lumbar segments of the feline spinal cord. The Journal of Physiology 522: 109–123. https://doi.org/10.1111/j.1469-7793.2000.t01-2-00109.xm
Molenaar I., Kuypers H.G.J.M. (1978) Cells of origin of propriospinal fibers and of fibers ascending to supraspinal levels. A HRP study in cat and rhesus monkey. Brain Research 152: 429–450. https://doi.org/10.1016/0006-8993(78)91102-2
Deuschl G. Illert M. (1981) Cytoarchitectonic organization of lumbar preganglionic sympathetic neurons in the cat. Journal of the Autonomic Nervous System 3: 193–213. https://doi.org/10.1016/0165-1838(81)90063-1
Edwards S.L., Anderson C.R., Southwell B.R., McAllen R.M. (1996) Distinct preganglionic neurons innervate noradrenaline and adrenaline cells in the cat adrenal medulla. Neuroscience 70: 825–832. https://doi.org/10.1016/S0306-4522(96)83019-3
Anderson C.R., Keast J.R., McLachlan E.M. (2009) Spinal Autonomic Preganglionic Neurons: the visceral efferent system of the spinal cord. In: Watson C., Paxinos G., Kayalioglu G. (eds) The Spinal Cord. Academic Press, San Diego, pp 115–129
Baron R., Janig W., McLachlan E.M. (1985) The afferent and sympathetic components of the lumbar spinal outflow to the colon and pelvic organs in the cat. III. The colonic nerves, incorporating an analysis of all components of the lumbar prevertebral outflow. Journal of Comparative Neurology 238: 158–168. https://doi.org/10.1002/cne.902380204
Renshaw B. (1946) Central effects of centripetal impulses in axons of spinal ventral roots. Journal of Neurophysiology 9: 191–204. https://doi.org/10.1152/jn.1946.9.3.191
Alvarez F.J., Benito-Gonzalez A., Siembab V.C. (2013) Principles of interneuron development learned from Renshaw cells and the motoneuron recurrent inhibitory circuit. Annals of the New York Academy of Sciences 1279: 22–31. https://doi.org/10.1111/nyas.12084
Matsushita M. (1999) Projections from the lowest lumbar and sacral-caudal segments to the cerebellar nuclei in the rat, studied by anterograde axonal tracing. Journal of Comparative Neurology 404: 21–32. https://doi.org/10.1002/(SICI)1096-9861(19990201)404:1<21::AID-CNE2>3.0.CO;2-7
Moran-Rivard L., Kagawa T., Saueressig H., Gross M.K., Burrill J., Goulding M. (2001) Evx1 Is a postmitotic determinant of V0 interneuron identity in the spinal cord. Neuron 29: 385–399. https://doi.org/10.1016/S0896-6273(01)00213-6
Jankowska E. (2013) Spinal Interneurons. In: Pfaff DW (ed) Neuroscience in the 21st Century: From Basic to Clinical. Springer, New York, NY, pp 1063–1099. https://doi.org/10.1113/jphysiol.2012.248740
Morona R., Northcutt R.G., González A. (2010) Immunohistochemical localization of calbindin-D28k and calretinin in the spinal cord of Lungfishes. Brain, Behavior and Evolution 76: 198–210. https://doi.org/10.1159/000321326
Berg E.M., Bertuzzi M., Ampatzis K. (2018) Complementary expression of calcium binding proteins delineates the functional organization of the locomotor network. Brain Structure and Function 223: 2181–2196. https://doi.org/10.1007/s00429-018-1622-4
Morona R., Moreno N., López J.M., González A. (2006) Immunohistochemical localization of calbindin-D28k and calretinin in the spinal cord of Xenopus laevis. Journal of Comparative Neurology 494: 763–783. https://doi.org/10.1002/cne.20836
Morona R., López J.M., González A. (2006) Calbindin-D28k and calretinin immunoreactivity in the spinal cord of the lizard Gekko gecko: Colocalization with choline acetyltransferase and nitric oxide synthase. Brain Research Bulletin 69: 519–534. https://doi.org/10.1016/j.brainresbull.2006.02.022
Deuchars S.A., Lall V.K. (2015) Sympathetic preganglionic neurons: properties and inputs. Comprehensive Physiology 5: 829–869. https://doi.org/10.1002/cphy.c140020
Kayalioglu G., Robertson B., Kristensson K., Grant G. (1999) Nitric oxide synthase and interferon-gamma receptor immunoreactivities in relation to ascending spinal pathways to thalamus, hypothalamus, and the periaqueductal grey in the rat. Somatosensory & Motor Research 16: 280–290. https://doi.org/10.1080/08990229970348
Bertrand S., Cazalets J.-R. (2002) The respective contribution of lumbar segments to the generation of locomotion in the isolated spinal cord of newborn rat. European Journal of Neuroscience 16: 1741–1750. https://doi.org/10.1046/j.1460-9568.2002.02233.x
De Groat W.C., Yoshimura N. (2010) Changes in afferent activity after spinal cord injury. Neurourology and Urodynamics 29: 63–76. https://doi.org/10.1002/nau.20761
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


