Журнал эволюционной биохимии и физиологии, 2021, T. 57, № 5, стр. 380-391
ВЛИЯНИЕ СОЛЕЙ АЗИДА, ФТОРИДА, ОРТОВАНАДАТА И ЭДТА НАТРИЯ НА ЭКТО-АТФАЗНУЮ АКТИВНОСТЬ ЭРИТРОЦИТОВ СКОРПЕНЫ (SCORPAENA PORCUS L.) И МОРСКОЙ ЛИСИЦЫ (RAJA CLAVATA L.)
Ю. А. Силкин 1, *, Е. Н. Силкина 1, М. Ю. Силкин 1
1 Карадагская научная станция им. Т.И. Вяземского – природный заповедник РАН – филиал Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Институт биологии южных морей имени А.О. Ковалевского РАН”
Феодосия, Россия
* E-mail: ysilkin@mail.ru
Поступила в редакцию 15.04.2021
После доработки 23.05.2021
Принята к публикации 29.05.2021
Аннотация
Исследовали влияние солей азида, фторида, ортованадата и ЭДТА натрия на экто-АТФазную активность эритроцитов скорпены (Scorpaena porcus L.) и морской лисицы (Raja clavata L.). Показано, что в ответ на воздействие миллимолярных (мМ) концентраций выбранных биохимических агентов выявлены значительные различия гидролитической активности экто-АТФаз плазматической мембраны эритроцитов хрящевых и костистых рыб. Так, экто-АТФаза эритроцитов морской лисицы была практически нечувствительна к действию азида натрия. Напротив, экто-АТФаза эритроцитов скорпены была чувствительна к действию азида натрия, который при 20 мМ концентрации на 65% блокировал активность фермента. Фермент эритроцитов ската сохранял значительную активность (37%) при высоких (60 мМ) концентрациях фторида натрия, а экто-АТФаза эритроцитов скорпены при этой концентрации блокировалась почти полностью. ЭДТА выступал как модификатор активности экто-АТФазы морской лисицы: при концентрации его до 6 мМ активно блокировался гидролиз АТФ (на 58%), а при более высоких концентрациях происходила стимуляция (до 20%) активности экто-АТФазы. Увеличение концентрации ЭДТА (до 12 мМ) в суспензиях эритроцитов скорпены постоянно стимулировало ингибиторный эффект комплексона (до 52% от контроля). Ортованадат слабо блокировал активность экто-АТФаз эритроцитов исследованных рыб. Указанные различия отражают большую толерантность экто-АТФазы эритроцитов морской лисицы, к действию взятых в опыты химических реагентов по сравнению со скорпеной. Отсутствие ингибирующего эффекта азида натрия на экто-АТФазу эритроцитов морской лисицы позволяет предположительно отнести эту экто-НТФДазу к семейству экто-НТФДаз 2-го типа, тогда как экто-НТФДаза эритроцитов скорпены к экто-НТФДазам 1-го типа,
Хорошо известно, что эритроциты позвоночных выделяют АТФ во внеклеточное пространство либо в виде патологического или физиологического ответа на деформацию и стресс [1]. Установлено, что АТФ и другие макроэргические фосфаты пурин-пиримидиновой природы, взаимодействуя с P2X и P2Y рецепторами, являются важными регуляторами межклеточных коммуникаций. Выделенная, внеклеточная АТФ и другие макроэргические фосфаты разрушаются в крови рыб за счет активности экто-нуклеотидаз эритроцитов и других экто-ферментов клеток кровеносной системы. Поэтому экто-нуклеотидазы являются основными регуляторами уровня выделенных эритроцитами в плазму крови межклеточных медиаторов и обеспечивают «выключение» сигнала, вызванного взаимодействием сигнальной молекулы и рецептора [2]. Наши ранние исследования свойств экто-нуклеотидаз эритроцитов скорпены (Scorpaena porcus L.) и ската – морской лисицы (Raja clavata L.) показали, что фермент имел высокую ферментативную активность (6.4 и 3.0 ммоль Фн/мин/мл эритроцитов соответственно). Экто-АТФаза была наделена широкой субстратной специфичностью, имела широкий диапазон рН оптимума, требовала для проявления своей максимальной активности присутствия двухвалентных катионов Ca2+ или Mg2+ [3, 4]. Все найденные ранее свойства указывали на то, что экто-нуклеотидаза эритроцитов рыб относится к ферментам семейства Е-типа, которые часто в литературе называют экто-АТФазами, экто-апиразами, нуклеозидтрифосфат-дифосфо-гидролазами (НТФДазы). Ингибиторный анализ является важным инструментом исследования свойств ферментов. В отношении экто-нуклеотидаз это особенно актуально, так как поиск специфических ингибиторов позволит упорядочить классификацию энзимов, выявить особенности их строения. В прикладном аспекте, как показали недавние исследования, это может иметь выходы на полезные терапевтические эффекты. Так, НТФДазы эритроцитов и других форменных элементов отвечают за уровень нуклеозиддифосфатов в плазме крови и тем самым регулируют тромборегуляторную функцию крови и функцию сосудистого тонуса. Изменение внеклеточных нуклеотидов и аденозина может увеличивать или уменьшать активность P1 и P2 рецепторов и тем самым открывает перспективу использования различных веществ в качестве имунномоделирующих, противораковых агентов, а также лечения расстройств сердечно-сосудистой и нервной системы. Многие патогенные организмы содержат экто-АТФазы, которые за счет влияния на внеклеточную концентрацию АТФ способны нарушать иммунные ответы хозяина. Поэтому экто-АТФазы патогенных организмов являются привлекательными мишенями для воздействия на них лекарственных средств [5]. Е-АТФазы по способности подвергаться воздействию миллимолярных концентраций азида натрия (NaN3) были разделены на два подсемейства: чувствительные и нечувствительные к действию ингибитора [6]. Азид является хорошо известным ингибитором митохондриальной АТФазы и цитохром с оксидазы [7]. В связи с этим важно было понять наличие влияния NaN3 на активность экто-нуклеотидаз эритроцитов рыб и действие выбранных реагентов на другие энергетические пути в клетке. В этих исследованиях мы попытались оценить влияние на активность экто-АТФазы эритроцитов рыб фторида (NaF) и ортованадата (Na3VO4) натрия, которые, как известно, являются ингибиторами гликолиза. Важной характеристикой фермента является изучение воздействия на его активность ЭДТА динатриевой соли, которая осуществляет связывание двухвалентных катионов, необходимых для процесса ферментативного гидролиза АТФ. Таким образом, в задачи настоящего исследования входило изучение влияния на активность экто-АТФаз эритроцитов рыб азида, фторида, ортованадата и ЭДТА натрия.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследованиях использовали два вида рыб – скат, морская лисица (Raja clavata L.) и скорпена (Scorpaena porcus L.). Рыб отлавливали в прибрежной акватории Карадагской бухты (Юго-восточный Крым), используя для поимки скатов донные снасти с крючками, а для скорпены – донные сети. Отловленных рыб помещали в бассейны с морской водой с искусственной аэрацией. Скаты содержались в бассейне объемом 25 000 л, а скорпена – в бассейнах 1000 л. Забор крови проводили после недельной аклимации рыб в бассейнах. У ската кровь отбирали пункцией сердца, а у скорпены – пункцией хвостовой вены. Условия содержания рыб и все процедуры по отбору образцов соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации, международным, национальным и/или институциональным принципам. Отобранную кровь сразу помещали в охлажденный физиологический раствор в соотношении 1:20. Состав физиологического раствора для ската (мМ): 220 NaCl + 400 мочевина + 10 Трис НCl + 5 Ед/мл гепарин (рН = 7.3–7.4); для скорпены (мМ): 180 NaCl + 10 Трис НCl + 5 Ед/мл гепарин (рН = 7.3–7.4). Эритроциты от надосадочной жидкости отделяли путем центрифугирования на центрифуге К-23 (Германия) в течение 10 мин при относительном центробежном ускорении ротора (RCF – relative centrifugal field) 377–671 g и температуре +4оС . Надосадочную жидкость отсасывали, а полученные клетки разводили до гематокрита (Ht) = 0.05–0.07, полученную суспензию клеток использовали в экспериментах.
Для изучения воздействия биохимических агентов инкубацию подготовленных суспензий эритроцитов скорпены и ската проводили в средах с конечной концентрацией (мМ): азида натрия (NaN3) – 2.5, 5, 10, 15, 20; фторида натрия (NaF) – 10, 20, 30, 40, 50, 60; ЭДТА – 2, 4, 6, 8, 10; ортованадата натрия (Na3VO4) – 1, 2, 3, 4, 5.
Для определения активности экто-АТФазы в цельных эритроцитах использовали методику А. Казеннова и соавт. [8]. Инкубационная среда для определения активности экто-АТФазы эритроцитов скорпены содержала в конечной концентрации (мМ) следующие ингредиенты: 125 NaCl + + 5 KCl + 6 MgCl2 + 50 Трис-HCl, рН 7,4; для эритроцитов ската: 400 мочевина + 135 NaCl + 5 KCl + + 6 MgCl2 + 50 Трис-HCl, рН 7, 4. В инкубационных пробирках смешивали 0.1 мл инкубационной среды, 0.1 мл Н2О (контроль) или 0.1 мл раствора ингибитора, 0.1 мл раствора АТФ-Na2 до концентрации 0.5 мМ. Реакцию запускали добавлением 0.1 мл суспензии эритроцитов. Температура инкубации в стандартных условиях и при определении кинетических констант составляла +20°С. Реакцию останавливали добавлением 0.2 мл 20%-ной ТХУ. Затем пробы центрифугировали в течение 5 мин при RCF = 1958 g. В надосадочной жидкости по модифицированному А. Казенновым и М. Масловой [9] методу Чена и соавт. [10] определяли содержание неорганического фосфата, по накоплению которого судили об активности фермента. Активность экто-АТФазы выражали в нмоль Фн/мин/мкл упакованных клеток. При сравнении эффективности ингибиторного воздействия для каждого действующего вещества рассчитывали концентрацию 50% ингибирования активности экто-АТФазы эритроцитов рыб (I50). Для удобства сравнительного анализа воздействия выбранных солей на экто-АТФазную активность эритроцитов рыб все графики выполнены с использованием процентного изменения активности фермента относительно активности физиологического оптимума энзима (контроль).
Во всех экспериментах использовали стандартные методы статистической обработки результатов. Все результаты представлены в виде x ± Sx. Достоверность различий определяли с помощью критерия Стьюдента. Различия считались достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты проведенных исследований представлены в табл. 1 и на рис. 1–4. Как видно в табл. 1 и на рис. 1 азид натрия (NaN3) по-разному воздействовал на активность экто-АТФазы эритроцитов у скорпены и морской лисицы. У скорпены при нарастании концентрации ингибитора активность фермента падала примерно пропорционально величине действующей концентрации. На графике это падение имело вид практически прямой линии с максимумом снижения активности на 65% от исходной, при действующей концентрации азида в 20 мМ (рис. 1). Концентрация ингибитора (NaN3), при которой активность экто-АТФазы эритроцитов скорпены составляла половину от ее контрольного уровня (I50), оказалfсь равной 15 мМ (табл.1).
Рис. 1.
Динамика изменения активности экто-НТФДазы эритроцитов рыб (%) при воздействии мМ концентраций азида натрия (NaN3).
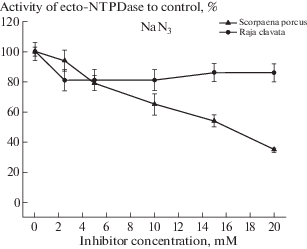
Таблица 1.
Влияние различных ингибиторов на активность экто-АТФазы эритроцитов скорпены и морской лисицы
| Вид | Ингибитор | Концентрация ингибитора (мМ) |
Активность (нмольФн/мин/мкл) |
Активность в (%) к контролю | Число опытов | I50 (мМ) |
|---|---|---|---|---|---|---|
| СКОРПЕНА (SCORPAENA PORCUS L.) | NaN3 (азид натрия) | 0 (контроль) | 4.8 ± 0.3 | 100 ± 6 | 7 | 15 |
| 2.5 | 4.5 ± 0.3 | 94 ± 7 | 7 | |||
| 5 | 3.8 ± 0.2 | 79 ± 5 | 7 | |||
| 10 | 3.1 ± 0.2* | 65 ± 7 | 7 | |||
| 15 | 2.6 ± 0.1* | 54 ± 4 | 7 | |||
| 20 | 1.7 ± 0.02* | 35 ± 1 | 7 | |||
| NaF (фторид натрия) | 0 (контроль) | 4.8 ± 0.3 | 100 ± 6 | 7 | 37 | |
| 10 | 4.6 ± 0.2 | 96 ± 4 | 5 | |||
| 20 | 3.1 ± 0.2 | 65 ± 6 | 6 | |||
| 30 | 2.1 ± 0.05* | 44 ± 2 | 6 | |||
| 40 | 1.7 ± 0.04* | 35 ± 2 | 6 | |||
| 50 | 1.0 ± 0.03* | 21 ± 3 | 6 | |||
| 60 | 0.3 ± 0.01* | 6 ± 3 | 6 | |||
| ЭДТА | 0 (контроль) | 4.8 ± 0.3 | 100 ± 6 | 7 | 12 | |
| 2 | 4.7 ± 0.3 | 98 ± 4 | 7 | |||
| 4 | 3.8 ± 0.2 | 79 ± 3 | 7 | |||
| 6 | 3.2 ± 0.2 | 67 ± 6 | 7 | |||
| 8 | 2.9 ± 0.1* | 60 ± 3 | 7 | |||
| 10 | 2.7 ± 0.1* | 56 ± 4 | 7 | |||
| 12 | 2.3 ± 0.08* | 48 ± 3 | 7 | |||
| Na3VO4 (ортованадат натрия) | 0 (контроль) | 5.0 ± 0.2 | 100 ± 4 | 7 | ||
| 1 | 4.9 ± 0.3 | 98 ± 6 | 7 | |||
| 2 | 4.8 ± 0.1 | 96 ± 2 | 7 | |||
| 3 | 4.3 ± 0.1 | 86 ± 2 | 7 | |||
| 4 | 4.4 ± 0.2 | 88 ± 5 | 7 | |||
| 5 | 4.7 ± 0.1 | 94 ± 2 | 7 | |||
| МОРСКАЯ ЛИСИЦА (RAJA CLAVATA L.) | NaN3 (азид натрия) | 0 (контроль) | 3.7 ± 0.1 | 100 ± 3 | 7 | – |
| 2.5 | 3.0 ± 0.2 | 81 ± 7 | 7 | |||
| 5 | 3.0 ± 0.2 | 81 ± 7 | 7 | |||
| 10 | 3.0 ± 0.2 | 81 ± 7 | 7 | |||
| 15 | 3.2 ± 0.2 | 86 ± 6 | 7 | |||
| 20 | 3.2 ± 0.2 | 86 ± 6 | 7 | |||
| NaF (фторид натрия) | 0 (контроль) | 3.8 ± 0.2 | 100 ± 6 | 7 | 51 | |
| 10 | 3.6 ± 0.05 | 95 ± 1 | 7 | |||
| 20 | 3.2 ± 0.1 | 84 ± 3 | 7 | |||
| 30 | 2.4 ± 0.1 | 63 ± 4 | 7 | |||
| 40 | 2.0 ± 0.1* | 53 ± 5 | 7 | |||
| 50 | 1.6 ± 0.1* | 42 ± 6 | 7 | |||
| 60 | 1.4 ± 0.1* | 37 ± 7 | 7 | |||
| ЭДТА | 0 (контроль) | 3.9 ± 0.2 | 100 ± 5 | 7 | 4 | |
| 2 | 3.6 ± 0.2 | 92 ± 6 | 5 | |||
| 4 | 1.95 ± 0.1* | 50 ± 5 | 5 | |||
| 6 | 1.65 ± 0.1* | 42 ± 6 | 5 | |||
| 8 | 1.9 ± 0.1* | 49 ± 5 | 5 | |||
| 10 | 2.1 ± 0.1* | 54 ± 5 | 5 | |||
| 12 | 2.4 ± 0.1 | 62 ± 4 | 5 | |||
| Na3VO4 (ортованадат натрия) | 0 (контроль) | 3.4 ± 0.2 | 100 ± 6 | 5 | ||
| 1 | 2.9 ± 0.1 | 85 ± 3 | 5 | |||
| 2 | 2.6 ± 0.1 | 77 ± 4 | 5 | |||
| 3 | 2.5 ± 0.1 | 74 ± 4 | 5 | |||
| 4 | 2.5 ± 0.1 | 74 ± 4 | 5 | |||
| 5 | 2.4 ± 0.1 | 71 ± 4 | 5 |
У морской лисицы ингибирующий эффект азида (на 19%) отмечен только на фоне добавления начальной концентрации (2.5 мМ) агента. Дальнейшее увеличение концентрации NaN3 не приводило к изменению активности экто-АТФазы эритроцитов ската (рис. 1), что свидетельствовало об отсутствии чувствительности фермента к этому реагенту.
Ингибирующий эффект фторида натрия (NaF) на экто-АТФазную активность эритроцитов скорпены имел нелинейный характер (рис. 2). Незначительное снижение (на 4%) активности фермента при 10 мМ концентрации фторида сменялось его стремительным падением при увеличении его концентрации. Наиболее значительное снижение уровня активности фермента наблюдалось при концентрации фторида в 20 и 30 мМ (65% и 44% от исходного уровня соответственно). Дальнейшее увеличение концентрации реагента приводило к замедлению падения активности фермента. При 40 мМ концентрации NF уровень активности фермента составлял 35% от контрольного уровня, а при 50 мМ концентрации активность экто-АТФазы не превышала 21%. При 60 мМ концентрации фторида натрия активность энзима составляла всего 6% от исходного уровня, что свидетельствовало о высокой эффективности ингибирующего воздействия NaF (рис. 2).
Рис. 2.
Динамика изменения активности экто-НТФДазы эритроцитов рыб (%) при воздействии мМ концентраций фторида натрия (NaF).
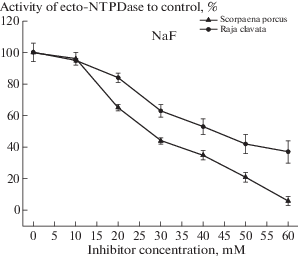
Влияние NaF на активность экто-АТФазы эритроцитов морской лисицы имело сходные черты с его воздействием на активность экто-фермента эритроцитов скорпены. Однако в эритроцитах ската падение активности фермента под действием фторида было менее стремительным. Так, при 30 мМ концентрации фторида снижение активности экто-АТФазы составляло 37% от контрольного уровня, а при 60 мМ концентрации реагента активность фермента снижалась на 63%. Остаточная активность экто-АТФазы эритроцитов морской лисицы при 60 мМ концентрации NF была в 6 раз выше, чем у скорпены и составляла 37% от контрольного уровня (рис. 2, табл. 1). На более высокую ингибирующую активность фторида натрия в отношении экто-АТФазы эритроцитов скорпены указывает его I50 (37 мМ), что почти в 1.4 раза меньше, чем I50 для эритроцитов морской лисицы (51 мМ) (табл. 1).
Воздействие ЭДТА на активность экто-ферментов у исследованных костистых и хрящевых рыб также имело свои особенности. При возрастании концентрации ЭДТА до 6 мМ комплексон вызывал торможение активности экто-АТФазы эритроцитов как у скорпены, так и у морской лисицы (табл. 1, рис. 3). Однако ингибирующий эффект ЭДТА у эритроцитов морской лисицы был более выражен и, уже при 4 мМ концентрации ЭДТА, активность фермента снижалась на 50% от контрольного уровня. В эритроцитах скорпены при нарастании концентрации ингибитора от 2 до 12 мМ снижение активности происходило медленнее и 50% ингибирование (I50) наступало при концентрации ингибитора в 12 мМ. В отличие от скорпены у морской лисицы, начиная с 8 мМ концентрации ЭДТА, происходило увеличение активности фермента, который к 12 мМ уровню реагента составлял 62% от контроля (рис. 3). Таким образом, у морской лисицы ЭДТА в зависимости от действующей концентрации вызывал как ингибирование, так и стимулирование активности экто-АТФазы плазматической мембраны ее эритроцитов. У скорпены подобный эффект не наблюдался.
Рис. 3.
Динамика изменения активности экто-НТФДазы эритроцитов рыб (%) при воздействии мМ концентраций ЭДТА.

Результаты действия ортованадата натрия представлены в табл. 1 и на рис. 4. Как видно из представленных данных действие ортованадата на активность экто-АТФазы эритроцитов скорпены подобно действию ЭДТА на экто-фермент красных клеток крови морской лисицы (рис. 3). При низких концентрациях (1–3 мМ) ортованадат вызывал слабое ингибирование фермента, максимум активности которого составлял 86% при 3 мМ концентрации этого реагента. При дальнейшем увеличении концентрации Na3VO4 (4 и 5 мМ) наблюдалась стимуляция активности экто-АТФазы, которая на фоне 5 мМ концентрации ортованадата натрия составляла 94% от исходного уровня.
Рис. 4.
Динамика изменения активности экто-НТФДазы эритроцитов рыб (%) при воздействии мМ концентраций ортованадата натрия (Na3VO4).
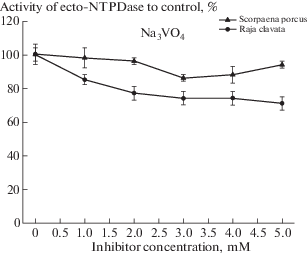
Ортованадат в эритроцитах морской лисицы, по мере возрастания его концентрации, также как и у скорпены, слабо ингибировал экто-АТФазную активность. Максимум ингибиторного эффекта при 5 мМ концентрации ортованадата составлял 29% и был несколько выше у морской лисицы, чем у скорпены (24%). Ортованадат натрия у морской лисицы не вызывал повышения активности при высоких концентрациях в среде инкубации и не выступал как модификатор экто-нуклеотидазы ската (рис. 4, табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Азид натрия является хорошо известным ингибитором митохондриальной АТФазы (F1 Fo) типа с I50 ≈ 0.04 мкм [7]. Так как NaN3 ингибирует и водорастворимую АТФазу (F1), был сделан вывод о том, что местом связывания ингибитора является F1 субъединица фермента, часто называемая фактором сопряжения. Точный механизм взаимодействия ингибитора с фактором сопряжения неизвестен, однако считается, что азид действует через механизм стабилизации неактивной формы фермента – ${\text{F}}_{1}^{*}$ . АДФ . Mg [11]. Для определения в гомогенатах тканей активности АТФаз V- и P- типа, в реакционную смесь включают азид натрия (1–5 мМ) для подавления митохондриальной активности в препаратах. В 1962 г. Джонесу и Эрнстеру при исследовании микросомальных препаратов печени крыс удалось выявить еще одну азидингибируемую АТФазу, не связанную с митохондриальным комплексом гепатоцитов [12]. Эта АТФаза отличалась по своим биохимическим свойствам от АТФазы (F1 Fo), она была наделена широкой субстратной специфичностью и, кроме АТФ, могла гидролизовать и другие нуклеозидтрифосфаты (НТФ) и некоторые нуклеозиддифосфаты (НДФ), поэтому получила название НТФДифосфогидролаза (НТФДаза). Важным отличием найденной НТФДазы было то, что концентрация азида натрия, необходимая для полумаксимального ингибирования активности фермента, была в мМ диапазоне, что на порядок было больше концентрации NaN3, необходимой для I50 АТФазы (F1 Fo). Доказательства того, что ингибированная азидом АТФаза встроена в плазматическую мембрану с наружной ее стороны, были получены в 90-х годах прошлого века [13]. В настоящее время известно, что АТФазы, активный центр которых, находится на поверхности мембраны, составляют одно семейство Е-АТФаз (Е – обозначает экто). Эти АТФазы характеризуются широкой субстратной специфичностью, необходимостью присутствия, для проявления активности ионов двухвалентных катионов Ca2+ или Mg2+ и практически полным отсутствием чувствительности к действию специфических ингибиторов АТФаз V и F –типа [14]. Трудности исследования экто-АТФаз обусловлены их высокой чувствительностью к инактивации детергентами. Поэтому попытки выделения экто-НТФДаз из мембран клеток часто заканчивались неудачами и только в 1992 г. гликопротеин фермента, из поперечных канальцев мышечных волокон кролика, был успешно очищен в чистом виде [15]. Дальнейшие исследования позволили выявить четыре экто-нуклеозид-трифосфат/дифосфогидролазы (НТФДаз), которые были разделены на подсемейства с порядковыми номерами 1, 2, 3 и 8 (НТФДаза 1, НТФДаза 2, НТФДаза 3, НТФДаза 8) [16]. В литературе нами не найдено примеров выделения чистых препаратов экто-НТФДаз из эритроцитов рыб, других позвоночных животных и человека.
Экто-НТФДазы хрящевых и костистых рыб демонстрировали разную чувствительность к действию мМ концентраций азида натрия (рис. 1). Экто-НТФДаза морской лисицы была малочувствительна к действию азида, в то время как экто-АТФаза скорпены ингибировалась под действием азида, демонстрируя довольно высокие значения I50 = 15 мМ (табл. 1). Исходя из полученных данных, ввиду того что НТФДазы – 2-го типа других клеток вообще были нечувствительны к действию мМ концентраций азида натрия [17], экто-НТФДазы скорпены и морской лисицы могут быть отнесены к разным подсемействам. Экто-НТФДаза скорпены к экто-НТФДазам – 1-го типа, а морской лисицы – к экто-НТФДазам – 2-го типа. Линейный ход кривой ингибирования экто-НТФДазы эритроцитов скорпены азидом натрия свидетельствовал о том, что ингибирование фермента носит дозозависимый характер. Возрастающая концентрация ингибитора пропорционально тормозила ферментативную активность экто-АТФазы, что свидетельствовало о достаточно высокой ингибирующей активности азида в отношении экто-НТФДазы скорпены. Экто-НТФДаза эритроцитов ската проявляла высокую устойчивость к действию ингибитора и при возрастании его концентрации до 20 мМ, фермент стабильно сохранял активность на уровне 86% (см. табл. 1 и рис. 1). Причины такой стабильности неизвестны, но можно предположить, что активный центр экто-НТФДазы эритроцитов морской лисицы отличается от экто-фермента скорпены и возможно его устройство обеспечивает толерантность к присутствию высоких концентраций азида натрия.
Фторид натрия достаточно эффективно ингибировал работу экто-АТФаз эритроцитов рыб при I50 = 37 мМ – для скорпены и I50 = 51 мМ – для морской лисицы (табл. 1). Поэтому фторид натрия можно отнести к высокоактивным ингибиторам [18], способным при мМ концентрациях блокировать работу экто-НТФДаз в эритроцитах рыб. Ход кривых ингибирования экто-НТФДаз у морской лисицы и скорпены имеют сходный характер. Тем не менее, ингибирование фермента у скорпены, при аналогичных условиях, было более значимым и при 60 мМ концентрации NaF активность энзима, блокировалась полностью (на 94%) (см. рис. 2).
Фторид натрия в мМ концентрациях является эффективным блокатором многих ферментов, включая и АТФазы [19]. Специальных исследований по определению механизма ингибирования фторидом натрия экто-НТФДаз нами в литературе найдено не было. Однако известно, что соединения фтора обладают высоким сродством к ионам ряда металлов и в частности к иону Ca2+. Известно, что все экто-АТФазы функционируют в присутствии двухвалентных катионов Mg2+ или Ca2+. Можно предположить, что хотя магний и не образует стабильных комплексов с фторид-ионом, но он может взаимодействовать с ним [20], вызывая изменение фермент-субстратного комплекса в виде ингибиторного эффекта. Кроме того, ионы фтора способны связываться с функциональными группами аминокислотных остатков в активном центре ферментов, что также вызывает их ингибирование. Таким же путем ингибируются активности Na+ K+ – АТФазы и ряда других фосфатаз [19]. Как показали исследования Н.И. Агалаковой и Г.П. Гусева [20], воздействие фторида натрия индуцирует апоптоз эритроцитов крыс. Как полагают исследователи, активация гибели эритроцитов происходит за счет увеличения внутриклеточной концентрации Ca2+, которую провоцирует фторид в результате активации неселективных Ca2+-проницаемых каналов и ингибирования активности мембранной Ca2+АТФазы. Кроме того, цитозольный Ca2+ вызывал, за счет активации Ca2+ активируемых-K+-каналов, резкое падение внутриклеточной концентрации ионов К+. Вместе с потерей K+ происходил выход, осмотически связанной воды и сморщивание клеток, что в конечном счете приводило к гибели эритроцитов крыс.
Ингибиторный эффект in vitro высоких концентраций фторида натрия антиоксидантных (супероксиддисмутаза, каталаза, глутатионпероксидаза) ферментов показан на эритроцитах человека [21]. Отмечено дозозависимое ингибирование активностей указанных выше антиоксидантных ферментов, что вызывало рост активных форм кислорода (АФК) и формирование реакции окислительного стресса на мембранах и во внутриклеточном пространстве эритроцитов. Как полагают J. Gutiérrez-Salinas и соавт. [22], это приводит к перекисному окислению липидов мембран, повреждению белковых макромолекул на поверхности и внутри клеток, падению энергетического метаболизма. Доказательством падения энергетического обмена в эритроцитах является наблюдаемое снижение внутриклеточной концентрации АТФ и АДФ под воздействием NaF [23]. Падение энергетического заряда эритроцитов обусловлено блокированием NaF-енолазы – одного из ключевых ферментов гликолиза. [24]. Однако в настоящее время получены данные о том, что енолаза не всегда является мишенью фторида [25]. Согласно современной гипотезе, гликолиз тормозится в результате внутриклеточного подкисления, которое возникает в процессе окислительного стресса индуцированного высокими концентрациями фторида натрия [26]. Кроме этого, фторид натрия дезорганизует работу митохондрий, вызывая падение мембранного потенциала и образования гигантской поры в их наружной мембране [27]. Это приводит к набуханию матрикса, разрыву наружной мембраны и выходу из митохондрий цитохрома с. Все это тормозит работу дыхательной цепи, подавляет синтез АТФ и, в конечном счете, ведет к развитию апоптоза и гибели клеток [28]. Таким образом, воздействие фторида натрия на эритроциты рыб носит многовекторный характер, последствие которого выражается в необратимом падении активности экто-НТФДаз на фоне оксидативного стресса, внутриклеточного энергетического коллапса и, в конечном счете – гибели клеток.
Ортованадат натрия (Na3VO4) относится к соединению с широким спектром действия на различные ферменты живой клетки. Считается, что среди многочисленных неорганических солей пятивалентный ванадий является наиболее токсичным [29]. Показано, что ортованадат (VO43–) в эритроцитах снижал скорость гликолиза, ингибируя активность глицеральдегид-3фосфатдегидрогеназы [30]. Ванадат проявлял нейротоксичные свойства, блокируя в нейронах работу холинэстеразы и Ca2+, Mg2+ АТФазы [31]. В почечных канальцах ванадат ингибировал Na+, K+-АТФазу, что приводило к отеку и натрийурии [32]. Также ванадат является эффективным ингибитором экто-АТФаз эпителия куриного яйцевода [6] и поэтому использование его в настоящем исследовании можно считать вполне обоснованным. В наших исследованиях действие ортованадата на экто-НТФДазу эритроцитов рыб выражалось в незначительном снижении активности фермента (рис. 3, табл. 1). Ферментативный ответ экто-АТФазы эритроцитов морской лисицы был более выражен и его активность, после воздействия в 2 мМ концентрации, падала на 25%, оставаясь на этом уровне вне зависимости от последующего увеличения действующей концентрации ортованадата. Максимальный ингибиторный эффект на активность экто-АТФазы эритроцитов скорпены наблюдался при 3 мМ концентрации реагента, а дальнейшее увеличение действующей концентрации ортованадата приводило к стимуляции активности фермента. Такое действие ортованадата можно рассматривать как модификацию активности фермента, а сам ортованадат следует рассматривать как модификатор активности экто-АТФазы, а не только как ее ингибитор. Эффекты, которые показывает ванадий, при воздействии на ферменты многообразны и зависят от типа ткани, собственных свойств фермента и даже концентрации ванадата [33]. Механизм действия ванадата на активность АТФаз до конца не расшифрован. Полагают, что тетраэдрический анион ванадата подобен фосфатному аниону и поэтому ванадат может взаимодействовать с различными физиологическими субстратами, с которыми функционирует анион фосфата. В общих чертах, ванадатная и фосфатная группы по своей тетраэдрической морфологии очень похожи сферическим распределением заряда во внешней сфере. Однако чистый ионный заряд этих ионов при рН, близкому к 7.0, отличается, что может приводить к различным взаимодействиям с электрофильными группами в активном центре АТФаз. Существуют и другие различия, основным из которых является восприимчивость ванадата к (одноэлектронному) восстановлению, вследствие наличия низколежащих d орбиталей и координационных чисел больше 4, обычно 5 или 6. Следствием этого является генерация пяти- или шестикоординатных анионов, фиксации ванадата координацией к функциональным группам, обеспечиваемым аминокислотными боковыми цепями белков [34] Таким образом, ванадат структурно может выступать конкурентом в занимаемых фосфором местах, в активных центрах ферментов и других местах. Кроме того, ванадат может связываться с АДФ и другими макроэргическими соединениями и тем самым влиять на активность АТФаз через модификацию захватываемых ими субстратов [35].
ЭДТА (этилендиаминтетрауксусная кислота и ее динатриевая соль) относится к малотоксичным анионитам и ее главное свойство – образование устойчивых водорастворимых комплексов с ионами металлов. Экто-НТФДазы в качестве субстрата используют двухкомпонентный Mg2+(Ca2+)-АТФ [11]. ЭДТА-Na2 препятствует формированию металл-нуклеозид-трифосфатного комплекса и тем самым является ингибирующим фактором, способным блокировать гидролиз экто-ферментами макроэргических фосфатов. ЭДТА была использована в качестве мощного ингибитора поверхностных НТФДаз еще в самом раннем периоде изучения экто-энзимов. Так, в 1957 г. Т.В. Венкстерну и В.А. Энгельгардту [36] при помощи 1 мМ ЭДТА удалось полностью блокировать экто-АТФазу эритроцитов голубя и доказать, что взрывной характер гидролиза гомогенатов эритроцитов птицы, обусловлен активностью именно этого фермента. Ими было подчеркнуто, что действие ЭДТА носит обратимый характер и добавление Mg2+ или Са2+ на фоне блокатора полностью восстанавливало активность экто-АТФазы.
В наших экспериментах ЭДТА был малоэффективным ингибитором и вызывал частичное блокирование (40–50%) активности фермента в эритроцитах рыб даже при 12 мМ концентрации. Эта концентрация на порядок превышала концентрацию комплексона, использованного в опытах на эритроцитах голубя (рис. 4, табл. 1). В экспериментах с эритроцитами скорпены для ЭДТА константа ингибирования (I50) составляла 12 мМ, что совпало с максимальной концентрацией реагента использованной в этих экспериментах. В отношении экто-НТФДазы эритроцитов морской лисицы ингибиторный эффект ЭДТА наблюдался только при низких концентрациях блокатора (2, 4, 6 мМ). При 6 мМ концентрации ЭДТА активность фермента снижалась максимально (на 58%). Константа ингибирования (I50) для этой части кривой составляла 4 мМ (рис. 4). При более высоких концентрациях (8, 10, 12 мМ) наблюдалась реверсивная активация активности экто-НТФДазы, которая постепенно возрастала на 20% (табл. 1) и I50 для этой части кривой составляла 9 мМ. В данном случае ЭДТА выступал как модифицирующий агент. Причины активации активности экто-АТФазы эритроцитов морской лисицы неизвестны. Однако присутствие ЭДТА способно вызывать активацию Са2+ АТФазы мембран эритроцитов человека. По мнению Вольфа [37] эти изменения могут происходить в результате «частичной денатурации» фермента под действием комплексона. Ингибиторный эффект ЭДТА у морской лисицы заканчивался, когда концентрация ингибитора и концентрация присутствующего в среде инкубации Mg2+ выравнивались до эквимолекулярных значений. У скорпены последующее наращивание концентрации ингибитора вызывало лишь незначительное понижение активности фермента. При таких концентрациях ЭДТА в среде инкубации уже не должно было бы быть свободных двухвалентных катионов. Тем не менее экто-НТФДаза исследованных рыб продолжала сохранять активность на уровне 50–60%. Эти результаты свидетельствовали в пользу особых способностей экто-НТФДаз эритроцитов рыб. Можно полагать, что экто-НТФДазы эритроцитов рыб способны функционировать в условиях дефицита двухвалентных катионов, что маловероятно, или иметь их внутриклеточные резервы, при выходе которых из эритроцитов в окружающее пространство они способны поддерживать активность поверхностных АТФаз. Такие возможности у эритроцитов есть. Еще в 1969 г. при изучении движения Ca2+ через мембрану эритроцитов человека было установлено наличие активной экструзии Са2+ из эритроцитов, что может поддерживать или даже активировать активность Mg2+, Ca2+- АТФазы [38]. Согласно современным исследованиям, механизм экструзии опосредован мощным трансмембранным кальциевым насосом, который способен быстро удалять кальций из цитозольного пространства эритроцитов [39]. Нельзя не отметить важность и мембранного Са2+. Высокие концентрации ЭДТА могут удалить все двухвалентные катионы из инкубационной среды суспензии эритроцитов, но не могут удалить мембраносвязанный кальций [40], что может обеспечивать поддержание активности экто-АТФаз.
Полученные в наших исследованиях эффекты необходимо рассматривать как интегральный ответ активности экто-НТФДазы эритроцитов рыб ввиду многовекторности действий выбранных реагентов. С этим связаны трудности интерпретаций полученных результатов при работе с суспензиями цельных эритроцитов. Как уже указывалось выше, в доступной нам литературе ссылок на выделение из плазматических мембран эритроцитов позвоночных и получение чистых препаратов экто-НТФДаз нами не найдено. При выделении экто-НТФДаз из других клеток исследователи сталкиваются с трудностями, связанными с очень большой чувствительностью экто-АТФаз к действию детергентов и других агентов, применяемых для дезинтеграции мембраны. Под действием этих веществ поверхностно-локализованные АТФазы распадаются на фрагменты с потерей активности [41]. Местом приложения для выбранных ингибиторов являются не только активный центр и белковая молекула экто-фермента, не только катионы металлов, но и энергетика эритроцитов в целом. Блокирование гликолиза и дыхания митохондриального комплекса эритроцитов посредством ингибирования ключевых ферментов и дезинтеграции функционирования митохондриального матрикса приводит к существенному снижению энергетического потенциала эритроцитов и может оказывать влияние на работу экто-НТФДаз.
Полученные результаты позволяют сделать вывод о том, что экто-НТФДазы эритроцитов хрящевых и костистых рыб существенно различаются по резистентности к действию выбранных биохимических агентов. Экто-НТФДаза эритроцитов морской лисицы обладает большей устойчивостью к выбранным нами реагентам. Возможно, причины такой устойчивости обусловлены наличием особой толерантности эритроцитов хрящевых рыб к высоким концентрациям мочевины (у морской лисицы около 400 мМ), которую они накапливают в плазме крови для поддержания осмотического равновесия с окружающей средой. Во всяком случае, это требует особых конструктивных решений на молекулярном уровне ввиду того, что мочевина для остальных эритроцитов позвоночных является сильнейшим ядом, и даже небольшие сбои в фильтрующей системе почек ведут к катастрофическим последствиям. Отсутствие ингибирующего эффекта азида натрия на экто-АТФазу эритроцитов морской лисицы позволяет предположительно отнести эту экто-НТФДазу к семейству экто-НТФДаз 2-го типа, тогда как экто-НТФДаза эритроцитов скорпены к экто-НТФДазам 1-го типа. Функциональное назначение экто-АТФаз плазматических мембран эритроцитов рыб не установлено, но присутствие постоянно высоких концентраций АТФ [42] в плазме крови рыб и высокие значения удельной активности экто-ферментов рыб [3, 4] свидетельствуют о значимой роли этих АТФаз в физиологии эритроцитов и кровотока в целом.
Список литературы
Barnstock G (2015) Blood cells: an historical account of the roles of purinergic signaling. Purinergic Signalling 11: 411–434. https://doi.org/10.1007/s11302-015-9462-7
Yegutkin GG (2014) Enzymes involved in metabolism of extracellular nucleotides and nucleosides: Functional implications and measurement of activities. Crit. Rev. Biochem. Mol. Biol 49 (6): 473–497. https://doi.org/10.3109/10409238.2014.953627
Silkin YuA, Silkina EN, Silkin MYu (2017) The dynamics of heat production in erythrocytes of the scorpion fish (Scorpaena porcus Linnaeus, 1758). In vitro 43(2):164–170. https://doi.org/10.1134/S1063074017020092
Silkin YA, Silkina EN (2017) The study of bioenergetic characteristics of the red blood cells of Black Sea fish the common stingray (Dasyatis pastinaca L.) and Black scorpionfish (Scorpaena porcus L.) Biophysics 62 (3): 434–439. https://doi.org/10.1134/S0006350917030204
al-Rashida M, Iqbal J (2014) Therapeutic potentials of ecto-nucleoside triphosphate diphosphohydrolase, ecto-nucleotide pyrophosphatase/phophodiesterase, ecto-5'-nucleotidase and alkaline phosphatase inhibitors. Medicinal Research Reviews 34(4):703–743. https://doi.org/10.1002/med.21302
Knowles A, Nagy AK (1999) Ingibition of an ecto-ATP-diphosphohydrolase by azide. Eur. J. Biochem 262: 349–357. https://doi.org/10.1046/j.1432-1327.1999.00389.x
Pullman ME, Penefsky HS, Datta A, Racker E (1960) Partial resolution of the enzymes catalyzing oxidative phosphorylation. I. Purification and properties of soluble dinitrophenol-stimulated adenosine triphosphatase. J. Biol. Chem. 235: 3322–329.
Казеннов АМ, Маслова МН, Савина ГВ (1984) Сравнительная характеристика свойств Na+, K+- АТФазы эритроцитов человека и карпа Cyprinos carpio. Ж. эвол. биохим. и физиол. 20 (2): 167–173. [Kazen-nov AM, Maslova MN, Savina GV (1984) Sravnitel’naya harakteristika svojstv Na+, K+- ATFazy eritrocitov cheloveka i karpa Cyprinos carpio. J Evol Biochem Physiol 20 (2): 167–173. (in Russ)].
Казеннов АМ, Маслова МН (1980) Особенности активации детергентами Na,K-аденозинтрифосфатазы головного мозга позвоночных. Ж. эвол. биохим. и физиол. 16 (50): 430–436. [Kazennov A.M., Maslo-va M.N. (1980) Osobennosti aktivacii detergentami Na,K-adenozintrifosfatazy golovnogo mozga pozvonochnyh. J Evol Biochem Physiol 16 (50): 430–436.(in Russ)].
Chen PS, Jr, Toribara TY, Warner H (1956) Microdetermination of phosphorus Anal. Chem, 28: 1756–1758.
Vasilyeva E.V., Minkov I.B., Fitin A.F., Vinogradov A.D. (1982) Kinetic mechanism of mitochondrial adenosine triphosphatase. Inhibition by azide and activation by sulphite. Biochem. J. 202: 15–23. https://doi.org/10.1042/bj2020009
Ernster L, Jones LC (1962) Study of the nucleoside tri- and diphosphatase activities of rat liver microsomes. J. Cell Biol. 15: 563–577. https://doi.org/10.1083/jcb.15.3.563
Strobel RS, Nagy AK, Knowles AF, Buegel J, Rosenberg MO (1996) Chicken oviductal ecto-ATP-diphosphohydrolase. Purification and characterization. J. Biol. Chem. 271: 16232–16331. https://doi.org/10.1074/jbc.271.27.16323
Plesner L (1995) Ecto-ATPases: identities and functions. Int. Rev. Cytol. 158:141–214. https://doi.org/10.1016/s0074-7696(08)62487-0
Treuheit MJ, Vaghy PL, Kirley TL (1992) Mg2+-ATPase from rabbit skeletal muscle transverse tubules is a 67-kilodalton glycoprotein. J. Biol. Chem. 267:11777–11782.
Kukulski F, Levesque SA, Lavoie EG, Lecka J, Bi-gonnesse F, Knowles AF, Robson3 SC, Kirley TL, Sevigny J (2005) Comparative hydrolysis of P2 receptor agonists by NTPDases 1, 2, 3 and 8. Purinergic Signalling 1: 193–204. https://doi.org/10.1007/s11302-005-6217-x
Knowles AF, Li C (2006) Molecular cloning and characterization of expressed human ecto-nucleoside triphosphate diphosphohydrolase 8 (E-NTPDase 8) and its soluble extracellular domain. Biochemistry 45:7323–7333. https://doi.org/10.1021/bi052268e
Barbier O, Arreola-Mendoza L, Del Razo ML (2010) Molecular mechanisms of fluoride toxicity. Chemico-Biological Interactions 188: 319–333. https://doi.org/10.1016/j.cbi.2010.07.011
Adamek E, Pawiowska-Gyral K, Bober K (2005) In vitro and in vivo effects of fluoride ions on enzyme activity. Ann. Acad. Med. Stetin 51 (2): 69–85.
Agalakova NI, Gusev GP (2011) Fluoride-induced death of rat erythrocytes in vitro. Toxicology In Vitro 25: 1609–1618. https://doi.org/10.1016/j.tiv.2011.06.006
Antonny B, Bigay J, Chabre M (1990) A novel magnesium-dependent mechanism for the activation of transducin by fluoride. FEBS Letters 268 (1): 277–280. https://doi.org/10.1016/0014-5793(90)81027-l
Gutiérrez-Salinas J, García-Ortíz L, Morales Gon-zález JA, Hernández-Rodríguez S, Ramírez-García S, Núñez-Ramos NR, Madrigal-Santillán E (2013) In vitro effect of sodium fluoride on malondialdehyde concentration and on superoxide dismutase, catalase, and glutathione peroxidase in human erythrocytes. Scientific World Journal 2013: 864–718. https://doi.org/10.1155/2013/864718
Suska M (2001) The effect of sodium fluoride on the adenine nucleotide pool in erythrocytes of Wistar rats. Int. J. Occup. Med. Environ. Health. 14 (4): 369–373. PMID: 11885920
Qin J, Chai G, Brewer JM, Lovelace LL, Lebioda L (2006) Fluoride inhibition of enolase: crystal structure and thermodynamics. Biochem. 45: 793–800. https://doi.org/ 558shttps://doi.org/10.1021/bi051
Liao Y, Chen J, Brandt BW et al. (2015) Identification and functional analysis of genome mutations in a fluoride-resistant Streptococcus mutans strain. PLOS ONE 10.: e0122630. https ://doi. org/ al.pone.01226 30https://doi.org/10.1371/journ
Gambino R, Piscitelli J, Ackattupathil TA et al. (2009) Acidification of blood is superior to sodium fluoride alone as an inhibitor of glycolysis. Clin. Chem. 55: 1019–1021. https ://doi.org/ hem.2008.12170 7https://doi.org/10.1373/clinc
Izquierdo-Vega JA, Sánchez-Gutiérrez M, Del Razo ML (2008) Decreased in vitro fertility in male rats exposed to fluoride-induced oxidative stress damage and mitochondrial transmembrane potential loss. Toxicology and Applied Pharmacology 230 (3): 352–357.https://doi.org/10.1016/j.taap.2008.03.008
Anuradha CD, Kanno S, Hirano S 2001) Oxidative damage to mitochondria is a preliminary step to caspase-3 activation in fluoride-induced apoptosis in HL-60 cells. Biol. Med. 31 (3): 367–373. https://doi.org/10.1016/s0891-5849(01)00591-3
Sugiyama H, Matsugo S, Misu H et al. (2013) Regulation of the physiological effects of peroxidovanadium (V) complexes by the electronicnature of ligands. J. Inorg. Biochem. 121: 66–76. https://doi.org/10.1016/j.jinorgbio.2012.12.014
Benabe JE, Echegoyen LA, Pastrana B, Martinez-Maldonado M (1987) Mechanism of inhibition of glycolysis by vanadate. J. Biol. Chem. 262 (20): 9555–9560. PMID: 3036865
Robinson JD (1981) Vanadate inhibition of brain (Ca2+ Mg2+)-ATPase. Neurochem. Res. 6 (3): 225–232. https://doi.org/10.1007/BF00964038
Barceloux DG (1999) Vanadium. J. Toxicol. Clin. Toxicol. 37 (2): 265–278. https://doi.org/10.1081/clt-100102425
Treviño S, Díaz A, Sánchez-Lara E, Sanchez-Gaytan BL, Perez-Aguilar JM, González-Vergara E (2019) Vanadium in Biological Action: Chemical, Pharmacological Aspects, and Metabolic Implications in Diabetes Mellitus. Biological Trace Element Research 188: 68–98. https://doi.org/10.1007/s12011-018-1540-6
Turner TL, Nguyen VH, McLauchlan CC, Dymon Z, Dor-sey BM, Hooker JD, Jones MA (2012) Inhibitory effects of decavanadate on several enzymes and Leishmania tarentolae in vitro. J Inorg. Biochem. 108: 96–104. https://doi.org/10.1016/j.jinorgbio.201109.009
Korbecki J, Baranowska-Bosiacka I, Gutowska I, Chlubek D (2012) Biochemical and medical importance of vanadium compounds. Acta Biochim. Pol. 59 (2): 195–200. PMID: 22693688
Венкстерн ТВ, Энгельгардт ВА (1957) Аспространение экто-аденозилполифосфатазы и характеристика некоторых ее свойств. Биохимия 22 (5): 911–916. [Venkstern TV, Engelhardt VA (1957) Distribution of ecto-adenosinpolyphosphatase and characteristics of certain of its properties. Biochim. 22 (5): 911–916 (in Russ)].
Wolf HU (1972) Effects of Ethylenediaminetetra-acetate and Deoxycholate on Kinetic Constants of the Calcium Ion-Dependent Adenosine Triphosphatase of Human Erythrocyte Membranes. Biochem. J. 130: 311–314. https://doi.org/10.1042/bj1300311
Schatzman HJ, Vincenzi FF (1969) Calcium movements across the membrane of human red cells. J. Physiol. 201 (2): 369–395. https://doi.org/10.1113/jphysiol.1969.sp008761
Bogdanova A, Makhro A, Wang J, Lipp P, Kaestner L (2013) Calcium in red blood cells – a perilous balance. Int. J. Mol. Sci. 14 (5): 9848–9872. https://doi.org/10.3390/ijms14059848
Durriti-Cubria M, Seifen E, Schmidt HL (1967) Calcium content and uptake by erythrocyte stomata. Hoppe Seilerz Z. Physiol. Chem. 348 (8): 1043–1046. PMID: 4233216
Christoforidis S, Papamarcaki T, Galaris D, Kellner R, Tsolas O (1995) Purification and properties of human placental ATP diphosphohydrolase. Eur. J. Biochem. 234: 66–74. https://doi.org/10.1111/j.1432-1033.1995.066_c.x
Jensen FB, Agnisola C, Novak I (2009) ATP release and extracellular nucleotidase activity in erythrocytes and coronary circulation of rainbow trout. Comparative Biochemistry and Physiology Part A 152: 351–356. https://doi.org/10.1016/j.cbpa.2008.11.007
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


