Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 61-68
АКТИВНОСТЬ ПИЩЕВАРИТЕЛЬНЫХ ФЕРМЕНТОВ У АМЕРИКАНСКИХ НОРОК (NEOVISON VISON) ПРИ ОТБОРЕ НА АГРЕССИВНОЕ И РУЧНОЕ ПОВЕДЕНИЕ
С. Н. Калинина 1, 2, *, В. А. Илюха 1, О. В. Трапезов 3, 4, А. В. Морозов 1, Л. И. Трапезова 3, М. А. Некрасова 3, 5, М. А. Степанова 3, 5, Е. А. Сысоева 5
1 Институт биологии Карельского научного центра РАН, ФИЦ “КарНЦ РАН”
Петрозаводск, Россия
2 Петрозаводский государственный университет
Петрозаводск, Россия
3 Федеральный исследовательский центр Институт цитологии и генетики СО РАН
Новосибирск, Россия
4 Новосибирский государственный университет
Новосибирск, Россия
5 Новосибирский государственный аграрный университет
Новосибирск, Россия
* E-mail: cvetnick@yandex.ru
Поступила в редакцию 04.10.2021
После доработки 10.11.2021
Принята к публикации 11.11.2021
- EDN: QMJKXI
- DOI: 10.31857/S0044452922010028
Аннотация
Селекция животных по оборонительной реакции на человека лежит в основе одомашнивания видов и приводит к перестройкам нервной и гормональной систем регуляции многих функций организма, в том числе пищеварительной. Целью исследования являлось изучение активности пищеварительных ферментов (амилазы, липазы и протеаз) в поджелудочной железе, двенадцатиперстной и тощей кишке у американских норок (Neovison vison) двух поведенческих типов – агрессивного и “ручного”. Результаты нашего исследования позволяют предположить, что плейотропное действие генов, контролирующих поведение, также вовлечено в регуляцию активности пищеварительных ферментов у американских норок. Несмотря на одинаковый рацион, агрессивные животные по сравнению с “ручными” характеризовались более высокой активностью протеаз и липазы, тогда как у “ручных” норок преобладает амилолитический профиль активности пищеварительных ферментов. Дискриминантный анализ подтвердил различия по исследованным показателям между агрессивными и “ручными” норками, но не между двумя группами агрессивных животных. Выявленные нами различия в профиле активности пищеварительных ферментов могут быть связаны с мутациями генов ферментов, а также с опосредованным действием гормонов, задействованных в стресс-реактивности.
Происходящий на протяжении всей истории человечества искусственный отбор животных с желаемыми для человека свойствами неизбежно приводит к перестройкам нервной и гормональной систем регуляции физиологических функций организма [1, 2]. Генетическая селекция животных по оборонительной реакции на человека лежит в основе одомашнивания видов, которые представляют собой крайне интересные модели для исследования человеческого поведения, в том числе и агрессивного. Объектами в этих исследованиях обычно служат серебристо-черные лисицы, крысы и мыши [3–6].
Агрессия – это эволюционно древняя и консервативная форма поведения, нацеленная на добычу пищи, собственную защиту, защиту территории, а также успешное размножение [7]. “Ручное” поведение характеризуется толерантностью к присутствию человека и хэндлингу [3], а также, в некоторых случаях, наличием исследовательского интереса [1]. Генетическая база и нейрофизиологические механизмы как агрессии, так и “прирученности” схожи у разных видов животных [2, 7]. Поскольку в основе этих двух типов поведения лежит разная реакция животных на новые и угрожающие стимулы, изменения физиологических функций в ходе отбора принято связывать с активностью гипоталамо-гипофизарно-надпочечниковой (ГГНС) и симпато-адреналовой систем [3, 6].
Животные разных поведенческих типов демонстрируют целый набор физиологических и/или морфологических черт, которые у “ручных” особей объединяются в понятии “доместикационный синдром” (снижение реактивности гормональной реакции на стресс, появление белых пятен, скручивание хвоста и укорочение черепа) [1, 2], а у агрессивных животных проявляются в активации ГГНС, увеличении массы надпочечников и уровня тестостерона [4, 6, 7].
Процесс пищеварения крайне важен для роста, развития и размножения животных, поскольку обеспечивает организм энергией и необходимыми питательными веществами. Для повышения эффективности пищеварения в ходе адаптации к различным факторам среды желудочно-кишечный тракт (ЖКТ) и функция пищеварения могут претерпевать такие изменения, как увеличение размера кишечника, экспрессии генов пищеварительных ферментов и активности последних. Поскольку в процессе одомашнивания некоторых видов происходило изменение их рациона на более питательный и легко усвояемый, пищеварительная функция подверглась перестройкам [8, 9]. Для домашней кошки Felis catus по сравнению с дикой европейской F. silvestris характерна бóльшая длина кишечника, необходимая для увеличения времени переваривания пищи с меньшим содержанием белка [8]. В ходе доместикации собак мутациям подверглись гены, которые играют ключевую роль в переваривании крахмала и метаболизме липидов [9]. Разводимые на зверофермах песцы, енотовидные собаки и лисицы имеют тенденцию к повышению усвоения энергии пищи по сравнению с особями того же вида, живущими в дикой природе [10]. Тем не менее, влияние искусственного отбора на морфологию и физиологию ЖКТ изучено недостаточно.
Удобным объектом для исследования физиологических функций у млекопитающих разных поведенческих типов является американская норка Neovison vison Shreber, 1777 (Carnivora, Mustelidae), вид разводится в неволе уже около 100 лет с целью получения ценного меха. В промышленных популяциях норок существует полиморфизм по оборонительной реакции на человека, что позволяет классифицировать животных по типам поведения (агрессивные и “ручные”). Ранее было показано, что селекция норок на оборонительную реакцию на человека сопровождается изменениями окраски, роста и развития, метаболизма нейромедиаторов (серотонина и катехоламинов) в мозге, стресс-реактивности и функциональной активности репродуктивной системы [11]. Данные о влиянии типа поведения на активность пищеварительных ферментов в доступной нам литературе отсутствуют.
В связи с вышесказанным возникает необходимость в более детальном исследовании взаимосвязей между функционированием пищеварительной системы и типом поведения американских норок, что важно для понимания особенностей регуляции работы ЖКТ животных. Поскольку процессы переваривания и всасывания пищи происходят, в основном, в тонком отделе кишечника, а эффективность переваривания пищи во многом зависит от активности пищеварительных ферментов, целью исследования являлось изучение активности амилазы, липазы и протеаз в поджелудочной железе, двенадцатиперстной и тощей кишке у американских норок двух типов поведения (агрессивное и “ручное”).
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтического комитета ИБ КарНЦ РАН (протокол № 2021-02-01). Лабораторные исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Объекты исследования
В эксперименте были задействованы самцы американской норки Neovison vison (n = 40, возраст – 11 мес, генотип – Standard dark brown (+/+)) клеточного разведения, содержавшиеся на экспериментальной звероферме ИЦиГ СО РАН. Рацион был составлен в соответствии с рекомендуемыми для этого вида нормами. Согласно методике hand catch test [12] проводилось тестирование зверей на оборонительную реакцию на человека (агрессия, страх, ручное поведение). Каждый тип поведения соотносился со значениями на условной шкале, где “0” обозначает реакцию страха, отрицательные значения индекса (от –4 до –1) свидетельствуют об агрессивном поведении, а положительные (от +1 до +6) – о ручном. В данном исследовании использовали 4 группы норок (по n = 10), характеризовавшихся агрессивным (группы “–3” и “–2”) и ручным (группы “+3” и “+6”) типами реакции на человека. Качественные различия в поведении животных этих групп состоят в следующем. Группа “–3” отличается активным нападением вне укрытия; звери из группы “–2” атакуют исследователя из укрытия. Со стороны животных из группы “+3” наблюдается активный контакт с человеком (когда человек открывает дверцу клетки, звери приподнимаются на ноги, опираются лапками на дверцу, тянутся мордочкой к рукам, внутри клетки они интенсивно обнюхивают и исследуют руки человека, нередко опираются на них лапками). Группа “+6” характеризуется уникальным ручным поведением, которое возникает de novo и никогда не встречается среди норок в исходной популяции, не затронутой специальным отбором по поведению. Звери сами проявляют активность по отношению к человеку и исследуют его руки. Норки были подвергнуты эвтаназии согласно рекомендациям и протоколу [13].
Определение активности пищеварительных ферментов
Для оценки ферментного статуса ЖКТ в поджелудочной железе, 12-перстной кишке и тощей кишке спектрофотометрически определяли активность следующих ферментов: α-амилазы – по убыли крахмала по методу Смита и Роя в модификации, липазы – по приросту глицерина при гидролизе трибутирина, общую протеолитическую активность (ОПА) – по приросту тирозина при гидролизе гемоглобина по методу Ансона в модификации Николаевской, как описано ранее [14]. Активность ферментов выражали в мкмоль продуктов гидролиза (для амилазы – в мг крахмала), образующихся за 1 мин в пересчете на 1 г ткани.
Статистическая обработка данных
Полученные данные обрабатывали общепринятыми статистическими методами, используя пакеты программ MS Excel и Statgraphics. Для сравнения показателей между группами применяли непараметрический критерий (U) Манна–Уитни. Для оценки влияния факторов “тип поведения”, “отдел ЖКТ” использовали однофакторный дисперсионный анализ (ANOVA). Также применяли дискриминантный анализ. Статистически значимыми считали различия с р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования представлены на рис. 1–4. Топография и профиль активности пищеварительных ферментов ЖКТ в значительной степени зависели от типа поведения норок (ANOVA: p < 0.05) (рис. 1–3).
Рис. 1.
Общая протеолитическая активность (ОПА) в поджелудочной железе (a), двенадцатиперстной (b) и тощей (c) кишке у агрессивных и ручных норок.
Обозначения: Оси: TPA, µmol*min/g tissue – ОПА, мкмоль*мин/г ткани; Groups of animals
– группы животных; Рисунок: (+) – среднее, ( – ) – медиана, □ – 25–75%,  – статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).
– статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).
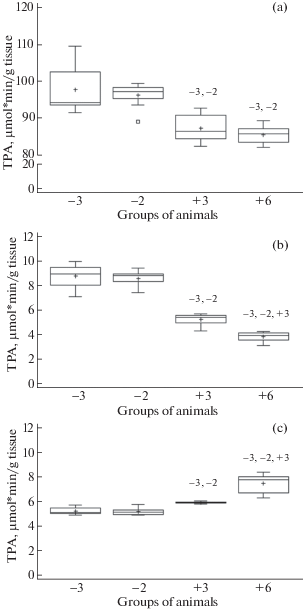
Рис. 2.
Активность амилазы в поджелудочной железе (a), двенадцатиперстной (b) и тощей (c) кишке у агрессивных и ручных норок.
Обозначения: Оси: Amylase activity, mg*min/g tissue – активность амилазы, мг*мин/г
ткани; Groups of animals – группы животных; Рисунок: (+) – среднее, ( – ) – медиана,
□ – 25–75%,  – статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).
– статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).
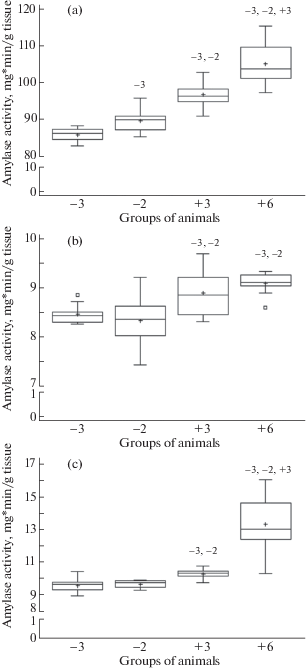
Рис. 3.
Активность липазы в поджелудочной железе (a), двенадцатиперстной (b) и тощей (c) кишке у агрессивных и ручных норок.
Обозначения: Оси: Lipase activity, µmol*min/g tissue – активность амилазы, мкмоль*мин/г
ткани; Groups of animals – группы животных; Рисунок: (+) – среднее, (– ) – медиана,
□ – 25–75%,  – статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).
– статистический диапазон, x – выпадающие варианты, в каждой группе n = 10; –3, –2, +3 – различия достоверны по сравнению с соответствующей группой (критерий
Манна–Уитни: р < 0.05).

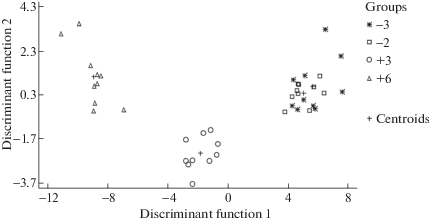
Рис. 4.
Расположение экспериментальных групп животных для пула исследованных показателей в отделах ЖКТ норок на плоскости двух дискриминантных функций.
Обозначения: Оси: Discriminant Function 1, 2 – дискриминантные функции 1 и 2;
Легенда: Groups of animals – группы животных; Centroids – центроиды.
Особенности топографии активности исследованных ферментов у норок состояли в следующем. У особей двух поведенческих типов активность амилазы и липазы и ОПА у ручных норок снижались в ряду “поджелудочная железа–тощая кишка–двенадцатиперстная кишка”, тогда как ОПА у норок-агрессоров – в ряду “поджелудочная железа–двенадцатиперстная кишка–тощая кишка” (рис. 1–3).
Агрессивные животные по сравнению с “ручными” характеризовались более высокой ОПА в поджелудочной железе и двенадцатиперстной кишке и более низкой – в тощей кишке (рис. 1). Степень проявления агрессивного поведения не отразилась на ОПА исследованных тканей: этот показатель не различался между группами “–3” и “–2”. Тем не менее, среди норок ручного типа поведения группа “+6” отличалась от группы “+3” более высокой ОПА в тощей кишке и более низкой в двенадцатиперстной кишке.
Активность амилазы в исследованных отделах ЖКТ была выше у “ручных” норок по сравнению с агрессивными животными (рис. 2). В поджелудочной железе животных активность фермента увеличивалась с усилением степени проявления доместикационного поведения и со снижением агрессивности. Однако не обнаружено достоверных различий в активности амилазы между двумя группами агрессивных норок в двенадцатиперстной и тощей кишках, и между двумя группами ручных животных в двенадцатиперстной кишке.
Активность липазы у агрессивных норок в поджелудочной железе и двенадцатиперстной кишке была выше, чем у “ручных” (рис. 3). Не обнаружено различий в активности липазы в исследованных отделах ЖКТ между норками с агрессивным поведением. Группа “+3” характеризовалась более высокой активностью липазы, чем группа “+6” во всех отделах. В тощей кишке у норок из группы “+6” отмечена самая низкая активность липазы, показатель между остальными группами не различался.
В ходе пошагового дискриминантного анализа были выявлены следующие наиболее информативные показатели: ОПА в поджелудочной железе, двенадцатиперстной и тощей кишке, активность амилазы в тощей кишке и активность липазы в поджелудочной железе (рис. 4). Модель является статистически значимой (F(15,8) = 27.83, p < 0.001) и позволила корректно классифицировать 82.5% случаев. Для интерпретации межгрупповых различий были построены дискриминантные функции, являющиеся линейной комбинацией дискриминантных переменных. Функции статистически значимы (хи-квадрат1 = 165.84, p < 0.001; хи-квадрат2 = 38.72, p < 0.001). Изучение расположения экспериментальных групп для показателей активности пищеварительных ферментов на плоскости двух главных компонент достаточно четко выявляет влияние типа поведения норок на исследуемые показатели (рис. 4). Две группы агрессивных животных занимали близкое положение и перекрывались. По изученным показателям корректно были классифицированы 80% норок из группы “–2” и лишь 50% норок из группы “–3”. Группы “ручных” норок были удалены друг от друга и от агрессивных животных, занимали отдельные, различимые позиции и не перекрывались.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В дополнение к предыдущим исследованиям влияния агрессивного и доместикационного поведения на физиологические функции организма млекопитающих [6, 7] мы обнаружили коррелированный ответ со стороны пищеварительной системы американских норок на отбор по поведению. Несмотря на одинаковый рацион как у агрессивных, так и у “ручных” норок, топография и профиль активности пищеварительных ферментов ЖКТ в значительной степени зависели от типа поведения животных.
Паттерны развития экзокринной части поджелудочной железы и мембраны щеточной каймы энтероцитов являются видоспецифичными и детерминируются генетически, хотя в некоторой степени модулируются диетой и гормонами [15]. Логично предположить, что селекция американских норок по оборонительной реакции на человека затронула не только нервную и гуморальную регуляцию активности пищеварительных ферментов, но, вероятно, и гены, кодирующие эти ферменты.
Поскольку при прохождении вдоль кишечника состав химуса меняется, активность пищеварительных ферментов неодинакова в разных отделах тонкой кишки [15]. Ранее было показано, что сдвиги ферментативной активности в проксимальном или в дистальном направлении в тонкой кишке американских норок наблюдаются при повышении в диете животных уровня белков или углеводов соответственно [14]. Особенности топографии активности исследованных ферментов у норок двух поведенческих типов касались только активности протеаз. Несмотря на одинаковый рацион у всех исследуемых животных, у агрессивных особей по сравнению с “ручными” гидролиз белков эффективнее осуществляется в двенадцатиперстной, а не в тощей кишке, т.е. в проксимальном, а не в более дистальном отделе тонкого кишечника. Остальные показатели (активность амилазы и липазы) у норок всех групп и ОПА у “ручных” норок снижались в ряду “поджелудочная железа–тощая кишка–двенадцатиперстная кишка”.
Одним из механизмов физиологической адаптации к составу рациона для млекопитающих является дифференцированный синтез пищеварительных ферментов, гидролизующих белки, углеводы или липиды [16]. “Гипотеза адаптивной модуляции” предполагает, что активность пищеварительных ферментов коррелирует с концентрацией субстрата в рационе животного, что позволяет полностью переваривать доступные питательные вещества, избегая при этом затрат энергии на “ненужные” ферменты [16]. Однако несмотря на одинаковый рацион у норок двух поведенческих типов, агрессивные животные по сравнению с “ручными” характеризовались более высокой ОПА в поджелудочной железе и двенадцатиперстной кишке и более низкой – в тощей кишке.
Указанные различия в активности протеаз могут быть связаны с тем, что агрессивные животные генетически ближе к дикому типу американских норок. Вид считается облигатным хищником (“гиперхищником”) из-за более высокой потребности в белковой пище [17]. Несмотря на небольшую длину кишечника и быстрое прохождение пищи по нему (3–4 ч), норка эффективно усваивает большое количество протеина [18, 19]. Значительная часть белка пищи (в виде аминокислот) у хищников далее вовлекается в процесс глюконеогенеза для удовлетворения потребностей мозга и других тканей в глюкозе [17]. Вероятно, отбором на доместикационное поведение были затронуты гены протеолитических ферментов, что привело к более низкой ОПА у “ручных” животных по сравнению с агрессивными.
Различия в активности протеаз у норок двух поведенческих типов также могут быть связаны с гормональной регуляцией активности пищеварительных ферментов. У агрессивных животных других видов (крыс, обезьян) наблюдаются более высокие уровни кортикостероидов [4, 6]. Кортизол играет важную роль в регуляции метаболизма аминокислот аргинина и глутамина в энтероцитах за счет механизма, опосредованного глюкокортикоидными рецепторами [20]. Показано, что глюкокортикоиды стимулируют и ускоряют постнатальное развитие гидролаз мембраны щеточной каймы энтероцитов тонкого кишечника у норок, а также лабораторных грызунов и свиней [21].
Одним из генов-мишеней действия отбора в процессе доместикации животных является ген панкреатической α-амилазы (AMY2B), который имеет различное количество копий у человека и других видов млекопитающих (собак, мышей и т.д.) [9, 22]. Вариация количества копий генов является источником генетической изменчивости, которая подвергается отбору в процессе одомашнивания и адаптации к окружающей среде [9]. Увеличение количества копий AMY2B у одомашненных животных по сравнению с их дикими предковыми видами способствует более эффективному перевариванию крахмала за счет повышения активности амилазы [9, 22]. Ранее было показано, что у норок клеточного содержания активность амилазы в плазме крови в три раза выше, чем у диких норок, отловленных в природе, что, очевидно, объясняется высокой долей углеводов в промышленных кормах [23].
В нашем исследовании ручные норки характеризовались более высокой активностью амилазы в исследованных отделах ЖКТ по сравнению с агрессивными животными. В поджелудочной железе активность фермента увеличивалась с увеличением степени проявления доместикационного поведения и со снижением агрессивности. Известно, что активность амилазы поджелудочной железы увеличивается при повышении доли крахмала в пище и снижается при высоком содержании жиров [24]. В гормональную регуляцию активности амилазы вовлечены такие гормоны, как адреналин, глюкагон и тироксин, которые вызывают ее снижение у взрослых крыс [25]. Более низкая активность амилазы у агрессивных норок может объясняться активацией симпато-адреналовой системы, а также секрецией глюкокортикоидов и глюкагона при действии стрессовых факторов [25]. С помощью ГГНС и симпато-адреналовой систем реализуется стресс-реактивность с участием кортикостероидов и катехоламинов надпочечников: низкоагрессивные мыши показали более высокое и продолжительное увеличение уровня кортикостерона в плазме, вызванное стрессом, по сравнению с агрессивными мышами [5].
Отмечают, что помимо генов, участвующих в переваривании крахмала, в ходе доместикации собак мутациям подверглись гены, задействованные в метаболизме липидов [9]. В нашем исследовании активность липазы в поджелудочной железе и двенадцатиперстной кишке была выше у агрессивных, чем у “ручных” норок.
Степень проявления как агрессивного, так и доместикационного поведения, у норок имеет качественные различия, что дает возможность исследовать изменения физиологических функций животных на разных ступенях эволюционных преобразований. В нашем исследовании агрессивные норки из групп “–3” и “–2” различались только по активности амилазы в поджелудочной железе: менее агрессивные особи (группа “-2”) характеризовались более высоким показателем. Среди групп норок с доместикационным поведением (группы “+3” и “+6”) различия касались активности амилазы поджелудочной железы и тощей кишки, активности липазы во всех исследованных отделах ЖКТ и ОПА двенадцатиперстной и тощей кишки. Норки из группы “+6”, обладающие чертами поведения, возникшими de novo, характеризовались более высокой активностью амилазы и более низкими активностями липазы и протеаз, чем особи из группы “+3”. Дискриминантный анализ показал, что группы “ручных” норок удалены друг от друга и от агрессивных животных, занимают отдельные, различимые позиции и не перекрываются.
ЗАКЛЮЧЕНИЕ
Результаты нашего исследования позволяют предположить, что плейотропное действие генов, контролирующих поведение, также вовлечено в регуляцию активности пищеварительных ферментов у американских норок. Агрессивные особи по сравнению с “ручными” характеризуются более высокой активностью протеаз и липазы, у “ручных” норок преобладает амилолитический профиль активности пищеварительных ферментов. В связи с тем, что регуляция пищеварения млекопитающих зависит не только от состава рациона, но и осуществляется нервными и гуморальными механизмами, которые подвержены изменениям в ходе искусственного отбора, исследование физиологии ЖКТ у агрессивных и “ручных” животных способствует расширению знаний о физиологических особенностях этих поведенческих типов. Выявленные нами различия в профиле активности пищеварительных ферментов у норок агрессивного и доместикационного типов поведения могут быть связаны с мутациями генов ферментов, а также с опосредованным действием гормонов, задействованных в стресс-реактивности.
Список литературы
Trapezov OV (2000) Behavioural polymorphism in defensive behaviour towards man in farm raised mink (Mustela vison Schreber, 1777). Scientifur 24: 103–109.
Wilkins AS, Wrangham RW, Fitch WT (2014) The “domestication syndrome” in mammals: a unified explanation based on neural crest cell behavior and genetics. Genetics 197(3): 795–808. https://doi.org/10.1534/genetics.114.165423
Belyaev DK (1979) Destabilizing selection as a factor in domestication. J Heredity 70: 301–308.
Giammanco M, Tabacchi G, Giammanco S, Di Majo D, La Guardia M (2005) Testosterone and aggressiveness. Med Sci Monitor 11 (4): RA136–RA145.
Veenema AH, Cremers TI, Jongsma ME, Steenbergen PJ, de Boer SF, Koolhaas JM (2005) Differences in the effects of 5-HT 1A receptor agonists on forced swimming behavior and brain 5-HT metabolism between low and high aggressive mice. Psychopharmacology 178 (2): 151–160. https://doi.org/10.1007/s00213-004-2005-5
Albert FW, Shchepina O, Winter C, Römpler H, Teupser D, Palme R, Ceglarek U, Kratzsch J, Sohr R, Trut LN, Thiery J, Morgenstern R, Plyusnina L, Schöneberg T, Pääbo S (2008) Phenotypic differences in behavior, physiology and neurochemistry between rats selected for tameness and for defensive aggression towards humans. Hormones and Behavior 53 (3): 413–421. https://doi.org/10.1016/j.yhbeh.2007.11.010
Eusebi PG, Sevane N, O’Rourke T, Pizarro M, Boeckx C, Dunner S (2021) Gene expression profiles underlying aggressive behavior in the prefrontal cortex of cattle. BMC Genomics 22 (1): 1–14. https://doi.org/10.1186/s12864-021-07505-5
Kitchener AC (1998) The Scottish wildcat – a cat with an identity crisis? British Wildlife 9: 232–242.
Axelsson E, Ratnakumar A, Arendt M, Maqbool K, Webster MT, Perloski M, Liberg O, Arnemo JM, Hedhammarå LK (2013) The genomic signature of dog domestication reveals adaptation to a starch-rich diet. Nature 495: 360–364. https://doi.org/10.1038/nature11837
Gugolek A, Strychalski J, Konstantynowicz M, Zwolinski C (2014) Comparative analysis of nutrient digestibility and nitrogen retention in wild and farmed canids. Ann Animal Sci 14 (2): 307–314. https://doi.org/10.2478/aoas-2014-0002
Kulikov AV, Bazhenova EY, Kulikova EA, Fursenko DV, Trapezova LI, Terenina EE, Mormede P, Popova NK, Trapezov OV (2016) Interplay between aggression, brain monoamines and fur color mutation in the American mink. Genes, Brain and Behavior 15 (8): 733–740. https://doi.org/10.1111/gbb.12313
Trapezov OV (2000) Behavioural polymorphism in defensive behaviour towards man in farm raised mink (Mustela vison Schreber, 1777). Scientifur 24 (2): 103–109.
Fitzhugh DC, Parmer A, Shelton LJ, Sheets JT (2008) A comparative analysis of carbon dioxide displacement rates for euthanasia of the ferret. Lab Anim (NY) 37: 81–86. https://doi.org/10.1038/laban0208-81
Oleinik VM (1995) Distribution of digestive enzyme activities along intestine in blue fox, mink, ferret and rat. Comp Biochem Physiol A 112 (1): 55–58.
Sangild PT, Elnif J (1996) Intestinal hydrolytic activity in young mink (Mustela vison) develops slowly postnatally and exhibits late sensitivity to glucocorticoids. J Nutr 126 (9): 2061–2068. https://doi.org/10.1093/jn/126.9.2061
Kohl KD, Ciminari ME, Chediack JG, Leafloor JO, Karasov WH, McWilliams SR, Caviedes-Vidal E (2017) Modulation of digestive enzyme activities in the avian digestive tract in relation to diet composition and quality. J Comp Physiol B 187: 339–351. https://doi.org/10.1007/s00360-016-1037-6
Eisert R (2011) Hypercarnivory and the brain: protein requirements of cats reconsidered. J Comp Physiol B 181 (1): 1–17. https://doi.org/10.1007/s00360-010-0528-0
Skrede A, Berge GM, Storebakken T, Herstad O, Aarstad KG, Sundstøl F (1998) Digestibility of bacterial protein grown on natural gas in mink, pigs, chicken and Atlantic salmon. Anim Feed Sci Technol 76 (1–2): 103–116. https://doi.org/10.1016/S0377-8401(98)00208-9
Buddington RK, Malo C, Sangild PT, Elnif J (2000) Intestinal transport of monosaccharides and amino acids during postnatal development of mink. Am J Physiol Regul Integr Comp Physiol 279: R2287–R2296. https://doi.org/10.1152/ajpregu.2000.279.6.R2287
Flynn NE, Wu G (1997) Enhanced metabolism of arginine and glutamine in enterocytes of cortisol-treated pigs. Am J Physiol Gastrointest Liver Physiol 272: G474–G480. https://doi.org/10.1152/ajpgi.1997.272.3.G474
Elnif J, Buddington RK, Hansen NE, Sangild PT (2006) Cortisol increases the activities of intestinal apical membrane hydrolases and nutrient transporters before weaning in mink (Mustela vison). J Comp Physiol B 176 (3): 233–241. https://doi.org/10.1007/s00360-005-0044-9
Pajic P, Pavlidis P, Dean K, Neznanova L, Romano RA, Garneau D, Daugherity E, Globig A, Ruhl S, Gokcumen O (2019) Independent amylase gene copy number bursts correlate with dietary preferences in mammals. Elife 8: e44628. https://doi.org/10.7554/eLife.44628
Свечкина ЕБ, Тютюнник НН (2007) Изменение в ходе промышленной доместикации активности пищеварительных ферментов у различных генотипов американской норки (Mustela vison Schreber, 1777). Информац вестник ВОГиС 11(1): 99–108. [Svechkina EB, Tjutjunnik NN (2007) Izmenenie v hode promyshlennoj domestikacii aktivnosti pishhevaritel’nyh fermentov u razlichnyh genotipov amerikanskoj norki (Mustela vison Schreber, 1777). Informac Vestnik VOGiS 11 (1): 99–108. (In Russ.)]
Corring T (1980) The adaptation of digestive enzymes to the diet: its physiological significance. Reprod Nurr Devel 20: 1217–1235. https://doi.org/10.1051/rnd:19800713
Harada E, Kato S (1982) Influence of adrenaline, glucagon, hydrocortisone, thyroxine, or insulin administration on pancreatic exocrine secretion in rats. Jpn J Vet Sci 44: 589–596.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


