Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 51-60
СРАВНИТЕЛЬНОЕ ИЗУЧЕНИЕ СТЕРОИДОГЕННОГО ЭФФЕКТА 5-АМИНО-N-трет-БУТИЛ-2-(МЕТИЛТИО)-4-(3-(НИКОТИНАМИДО)ФЕНИЛ)ТИЕНО[2,3-d]-ПИРИМИДИН-6-КАРБОКСАМИДА И ХОРИОНИЧЕСКОГО ГОНАДОТРОПИНА ПРИ РАЗЛИЧНЫХ СПОСОБАХ ВВЕДЕНИЯ САМЦАМ КРЫС
А. М. Степочкина 1, 2, А. А. Бахтюков 1, К. В. Деркач 1, В. Н. Сорокоумов 1, 2, А. О. Шпаков 1, *
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 05.11.2021
После доработки 15.11.2021
Принята к публикации 15.11.2021
- EDN: MPBXPI
- DOI: 10.31857/S0044452922010077
Аннотация
Для коррекции андрогенного дефицита необходимы разработка новых агонистов рецептора лютеинизирующего гормона (ЛГР) и оценка их стероидогенного эффекта при различной продолжительности и способах введения в сравнении с хорионическим гонадотропином человека (ХГЧ), “золотым стандартом” активаторов стероидогенеза. Целью исследования было изучить эффект аллостерического ЛГР-агониста 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (TP03) при однократном и пятидневном внутрибрюшинном, подкожном и пероральном введении самцам крыс в сравнении с внутрибрюшинно или подкожно вводимым ХГЧ. Исследовали уровни тестостерона и экспрессию генов ЛГР и ферментов стероидогенеза. Предварительно определяли и в дальнейшем использовали дозы TP03 и ХГЧ, вызывавшие 65–75% максимального стероидогенного эффекта. При однодневном и пятидневном внутрибрюшинном введении TP03 (20 мг/кг) более эффективно стимулировал продукцию тестостерона, чем при подкожном и пероральном введении. Пятидневное внутрибрюшинное (но не подкожное) введение TP03 повышало интратестикулярную экспрессию генов ЛГР и холестерин-транспортирующего белка StAR, катализирующего скорость-лимитирующую стадию стероидогенеза. Подкожное введение ХГЧ (20 МЕ/крысу) было эффективнее, чем внутрибрюшинное введение, и значительно повышало экспрессию гена дегидрогеназы 17β, катализирующей синтез андростендиона. Оба способа введения ХГЧ снижали экспрессию гена ЛГР. В отличие от ХГЧ стероидогенный эффект TP03 при пятидневном введении сохранялся. Сделан вывод о том, что стероидогенный эффект TP03 наиболее выражен при внутрибрюшинном введении, а в случае ХГЧ при подкожном введении, и это ассоциировано с различным влиянием препаратов на экспрессию стероидогенных ферментов.
Важнейшими регуляторами репродуктивных функций у человека и млекопитающих являются лютеинизирующий гормон (ЛГ) и его гомолог – хорионический гонадотропин человека (ХГЧ). Они осуществляют свои эффекты на клетки-мишени посредством связывания с внеклеточным доменом рецептора ЛГ. После связывания с гонадотропином рецептор ЛГ взаимодействует с различными типами гетеротримерных G-белков (Gs, Gq/11, Gi/o) и β-аррестинами [1]. У мужчин снижение продукции ЛГ и ослабление чувствительности к нему рецептора ЛГ становятся причинами гипогонадизма, андрогенного дефицита и бесплодия [2, 3]. Для стимуляции стероидогенной функции семенников обычно применяют препараты гонадотропинов (ЛГ, ХГЧ) или используют агонисты гонадолиберина, гипоталамического рилизинг-фактора гонадотропинов [4, 5]. Однако оба подхода имеют существенные недостатки, что обусловлено десенситизацией рецепторов ЛГ в результате длительного воздействия фармакологических доз гонадотропинов и нарушением функционирования гонадной оси вследствие истощения выброса гонадотропинов в ответ на стимуляцию агонистами гонадолиберина. У гонадотропиновой терапии имеется ряд побочных эффектов, вызванных структурными различиями между коммерческими препаратами гонадотропинов и эндогенными гонадотропинами [6, 7]. Применение заместительной терапии андрогенами по механизму отрицательной обратной связи подавляет активность гонадной оси, способно индуцировать рост андроген-зависимых опухолей и может привести к бесплодию [3].
Одной из альтернатив гонадотропинам являются аллостерические агонисты рецептора ЛГ [8, 9], в том числе, разработанные нами производные тиено[2,3-d]-пиримидина [10–14]. Они взаимодействуют с аллостерическим сайтом, локализованным внутри трансмембранного домена рецептора [8]. Если в случае связывания рецептора ЛГ с гонадотропинами стабилизируется несколько активных конформаций, то при его связывании с аллостерическими агонистами стабилизируется преимущественно одна из них, в которой рецептор активирует только один тип G-белка или β-аррестина, тем самым запуская определенный внутриклеточный каскад. Так, показано, что соединение Org43553 и разработанные нами тиено[2,3-d]-пиримидины TP01 и TP03 через Gs-белки стимулируют фермент аденилатциклазу и цАМФ-зависимые пути, но слабо или вовсе не влияют на Gq/11-белки и кальциевые пути [8, 11]. В то же время стимулирующие эффекты ЛГ и ХГЧ в отношении различных типов G-белков не являются высокоселективными, хотя известно, что ХГЧ в большей степени стимулирует Gs-белки [1].
При использовании аллостерических агонистов важным является выбор оптимального пути доставки препарата. Для тиено[2,3-d]-пиримидиновых производных при изучении их стероидогенного эффекта у крыс, как правило, применяют внутрибрюшинный (в/б) способ введения [8, 10, 11], в то время как подкожное (п/к) введение практически не используют. Учитывая устойчивость и хорошую всасываемость в желудочно-кишечном тракте, тиено[2,3-d]-пиримидины могут быть введены перорально, что невозможно в случае гонадотропинов, и это является их важным преимуществом перед гонадотропинами [9, 10]. В случае гонадотропинов (ХГЧ) используют как подкожный (п/к), так и внутримышечный способы введения, причем оба этих метода считают биоэквивалентными [15]. В условиях эксперимента чаще применяют п/к инъекции ХГЧ, но также, хотя и ограниченно, используют в/б введение [16–18]. При этом в/б введение ХГЧ мало изучено, хотя подобные исследования представляют интерес в аспекте сравнения эффективности и биодоступности препаратов гонадотропинов и тиено[2,3-d]-пиримидиновых производных, вводимых в основном в/б способом. В этой связи следует отметить, что сравнительные исследования стероидогенных эффектов низкомолекулярных агонистов рецептора ЛГ и гонадотропинов и их влияния на экспрессию стероидогенных белков при различных способах введения ранее не проводились.
Целью исследования было изучить стероидогенный эффект разработанного нами аллостерического агониста 5-амино-N-трет-бутил-2-(метилсульфанил)-4-(3-(никотинамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (TP03) при его однократном и пятидневном в/б, п/к и пероральном введении самцам крыс в сравнении с в/б или п/к вводимым ХГЧ, который в настоящее время является “золотым стандартом” среди активаторов стероидогенеза. В случае однократного введения TP03 и ХГЧ оценивали динамику изменения уровня тестостерона в течение 5 ч после введения. В случае пятидневного введения оценивали динамику изменения уровня тестостерона, а в конце эксперимента оценивали экспрессию генов, кодирующих рецептор ЛГ и основные ферменты стероидогенеза.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов были взяты трехмесячные самцы крыс Wistar, которых содержали на стандартном рационе со свободным доступом к пище и воде. Все процедуры проводили в соответствии с правилами, разработанными и утвержденными Комитетом по биоэтике ИЭФБ РАН (15.02.2018 г.), и требованиями, изложенными в документах “European Communities Council Directive 1986” (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Синтез TP03 осуществляли путем ацилирования 5-амино-4-(3-аминофенил)-N-трет-бутил-2-(метилсульфанил)тиено[2,3-d]-пиримидин-6-карбоксамида, как описано ранее [11]. Для этого 1.0 эквивалент ацилируемого агента смешивали с 1.1 эквивалента никотиновой кислоты, 1.1 эквивалента гексафторфосфата 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксида и 1.2 эквивалента N,N-диизопропилэтиламина в сухом N,N-диметилформамиде. Реакцию проводили в течение 5 ч при комнатной температуре, целевые продукты очищали с помощью перекристаллизации из этанола и адсорбционной колоночной хроматографии. Структуру TP03 подтверждали с помощью 1H-ЯМР и 13С-ЯМР спектроскопии, используя спектрометр Bruker Avance III 400 (“Bruker”, Германия), и данных масс-спектрометрии, используя спектрометр micrOTOF (“Bruker”, Германия). Молекулярная масса TP03 составила 515.1301 (рассчитанная масса для иона [M+Na+] составила 515.1294).
Для оценки стероидогенного эффекта самцам крыс однократно или в течение 5 дней вводили TP03 в диметилсульфоксиде (ДМСО) и ХГЧ (“Московский эндокринологический завод”, Россия) в физиологическом растворе. Препараты вводили ежедневно в 11.00 в/б, п/к (в область левой лопатки), в случае TP03 также перорально. Контрольным животным вместо препаратов в те же сроки и в тех же объемах в/б, п/к или перорально вводили ДМСО или физиологический раствор. Поскольку по результатам предварительных экспериментов оба растворителя при различных способах введения не оказывали значимого влияния на уровни тестостерона, то в основных экспериментах в качестве контрольных групп использовали крыс с в/б введением ДМСО (обработка TP03) и п/к введением физиологического раствора (обработка ХГЧ). В основном эксперименте в каждой группе было по пять животных. При этом сначала крысам ТП03, ХГЧ и их растворители вводили однократно, а через неделю отдыха соответствующим группам животных те же препараты вводили в течение пяти дней. Тем самым, в общей сложности в экспериментах использовали 35 животных, которых распределили на 7 групп.
Для исследования были выбраны дозы TP03 и ХГЧ, при которых, по результатам предварительных экспериментов по изучению зависимости “доза-эффект” (табл. 1), повышение уровня тестостерона составило 65–75% от максимального. При однократном введении концентрацию тестостерона в крови оценивали до (10.00) и через 1 ч (11.00), 3 ч (13.00) и 5 ч (15.00) после введения препаратов, при пятидневном введении за день до введения препаратов (13.00) и ежедневно через 3 ч после введения (13.00). Образцы крови забирали из хвостовой вены с предварительной местной анестезией крыс с помощью 2%-ного раствора лидокаина из расчета 2–4 мг/кг. Уровень тестостерона определяли с помощью набора “Тестостерон-ИФА” (“Алкор-Био”, Россия) и спектрофотометра “Anthos Absorbance Reader 2020” (Австрия). В конце эксперимента (на 5-й день через 3 ч после введения препарата) крыс наркотизировали, используя ингаляцию 4–5%-ным (v/v) изофлураном, и забирали у них семенники для оценки экспрессии генов.
Таблица 1.
Уровни тестостерона до и через 1, 3 и 5 ч после однократного внутрибрюшинного, подкожного и перорального введения различных доз TP03 и однократного подкожного и внутрибрюшинного введения различных доз ХГЧ самцам крыс Wistar
| До | Через 1 ч | Через 3 ч | Через 5 ч | AUC | |
|---|---|---|---|---|---|
| К, ДМСО, в/б | 14.74 ± 0.87 | 17.52 ± 2.09 | 17.99 ± 1.76 | 16.66 ± 1.85 | 70.2 ± 5.9 |
| TP03 10, в/б | 14.87 ± 2.05 | 26.28 ± 2.25 | 37.03 ± 3.54 | 37.85 ± 4.20 | 138.2 ± 12.7* |
| TP03 15, в/б | 17.04 ± 3.03 | 34.57 ± 3.67 | 56.58 ± 6.06 | 58.34 ± 3.46 | 206.1 ± 18.1* |
| TP03 25, в/б | 15.64 ± 1.85 | 41.95 ± 6.00 | 72.76 ± 6.45 | 75.68 ± 8.43 | 263.2 ± 23.5* |
| TP03 50, в/б | 15.83 ± 2.63 | 41.34 ± 4.46 | 79.36 ± 6.95 | 76.79 ± 4.92 | 276.9 ± 22.9* |
| К, ДМСО, п/к | 16.53 ± 1.72 | 17.89 ± 2.88 | 16.91 ± 1.74 | 16.25 ± 2.80 | 68.0 ± 8.9 |
| TP03 10, п/к | 17.05 ± 1.39 | 17.58 ± 2.32 | 22.63 ± 2.55 | 24.88 ± 3.67 | 87.7 ± 10.6 |
| TP03 15, п/к | 16.66 ± 3.79 | 17.70 ± 3.06 | 27.31 ± 3.65 | 29.70 ± 4.95 | 102.0 ± 14.2 |
| TP03 25, п/к | 13.59 ± 2.43 | 15.69 ± 2.76 | 28.80 ± 3.48 | 32.21 ± 3.51 | 105.5 ± 11.5 |
| TP03 50, п/к | 16.96 ± 2.26 | 20.16 ± 2.48 | 29.75 ± 3.18 | 32.51 ± 2.63 | 112.2 ± 11.0* |
| К, ДМСО, пер. | 12.09 ± 1.49 | 13.78 ± 1.95 | 15.09 ± 1.98 | 14.85 ± 2.27 | 58.8 ± 7.1 |
| TP03 15, п/о | 14.44 ± 1.49 | 14.35 ± 1.70 | 18.27 ± 1.08 | 22.17 ± 1.70 | 73.1 ± 3.5 |
| TP03 25, п/о | 15.49 ± 2.01 | 15.58 ± 2.10 | 24.58 ± 3.68 | 33.58 ± 2.34 | 98.3 ± 10.7 |
| TP03 50, п/о | 12.86 ± 2.14 | 16.03 ± 2.82 | 31.46 ± 2.78 | 44.32 ± 2.89 | 123.3 ± 6.9* |
| TP03 75, п/о | 13.97 ± 2.81 | 15.78 ± 2.53 | 33.00 ± 4.39 | 46.44 ± 4.59 | 128.2 ± 15.2* |
| К, физ. р-р, п/к | 15.55 ± 1.70 | 17.16 ± 2.17 | 16.53 ± 2.53 | 14.37 ± 2.16 | 64.6 ± 9.3 |
| ХГЧ 5, п/к | 11.61 ± 1.90 | 24.58 ± 4.62 | 42.97 ± 5.23 | 43.69 ± 5.81 | 154.2 ± 17.2* |
| ХГЧ 10, п/к | 14.82 ± 2.42 | 44.90 ± 4.66 | 86.96 ± 9.08 | 79.41 ± 7.20 | 298.2 ± 25.6* |
| ХГЧ 20, п/к | 12.68 ± 1.94 | 70.04 ± 6.69 | 111.86 ± 11.19 | 107.89 ± 9.53 | 401.7 ± 35.0* |
| ХГЧ 50, п/к | 15.79 ± 2.11 | 80.32 ± 8.45 | 148.57 ± 12.50 | 124.23 ± 9.18 | 501.6 ± 37.8* |
| ХГЧ 100, п/к | 16.98 ± 2.16 | 87.56 ± 8.23 | 152.31 ± 17.78 | 114.45 ± 10.26 | 506.6 ± 43.9* |
| К, физ. р-р, в/б | 13.98 ± 1.06 | 15.01 ± 2.38 | 14.31 ± 1.30 | 12.37 ± 1.08 | 56.0 ± 5.4 |
| ХГЧ 5, в/б | 15.71 ± 3.73 | 20.26 ± 2.57 | 49.22 ± 5.72 | 60.81 ± 5.33 | 179.5 ± 17.9* |
| ХГЧ 10, в/б | 13.56 ± 1.66 | 24.11 ± 2.10 | 67.78 ± 10.14 | 64.63 ± 4.95 | 224.3 ± 23.7* |
| ХГЧ 20, в/б | 13.14 ± 1.89 | 37.83 ± 2.87 | 80.78 ± 10.58 | 80.79 ± 6.41 | 280.2 ± 29.1* |
| ХГЧ 50, в/б | 17.04 ± 1.94 | 63.14 ± 5.88 | 96.95 ± 12.25 | 84.03 ± 10.69 | 341.1 ± 39.2* |
| ХГЧ 100, в/б | 15.41 ± 2.23 | 79.39 ± 4.19 | 94.46 ± 6.36 | 89.29 ± 7.75 | 357.6 ± 21.6* |
Примечание. * – различия между значением AUC в группе с обработкой препаратами и таковым в соответствующем контроле статистически значимы при p < 0.05. Во всех группах n = 5. Крыс использовали повторно, с интервалом отдыха между обработками не менее 5 дней, начиная с введения ДМСО, физиологического раствора или низких доз препаратов, но не более трех последовательных обработок. После в/б и п/к введения ТП03 в дозах 25 или 50 мг/кг, перорального введения ТП03 в дозах 50 и 75 мг/к и в/б и п/к введения ХГЧ в дозах 20, 50 и 100 МЕ/крысу повторную обработку не проводили. В общей сложности в экспериментах использовали 60 крыс, которых распределили на 12 групп. Значения представлены как M ± SEM.
Экспрессию мРНК для гена Lhr, кодирующего рецептор ЛГ, и для генов Star, Cyp11a1, Cyp17a1, Hsd3b и Hsd17b, кодирующих холестерин-транспортирующий белок StAR, цитохромы Р450scc и Р450-17α и 3β-гидростероиддегидрогеназы 3β и 17β соответственно, осуществляли с помощью ПЦР в реальном времени. Для этого из семенников выделяли тотальную РНК с помощью реагента ExtractRNA (“Evrogen”, Россия). Обратную транскрипцию проводили с помощью набора MMLV RT Kit (“Evrogen”, Россия), экспрессию оценивали с помощью амплификатора 7500 Real-Time PCR System (“Thermo Fisher Scientific Inc.”, США). Для оценки экспрессии генов целевых белков использовали следующие праймеры: Lhr – CTGCGCTGTCCTGGCC (For), CGACCTCATTAAGTCCCCTGAA (Rev); Star – AAGGCTGGAAGAAGGAAAGC (For), CACCTGGCACCACCTTACTT (Rev); Cyp11a1 – TATTCCGCTTTGCCTTTGAG (For), CACGATCTCCTCCAACATCC (Rev); Hsd3b – AGGCCTGTGTCCAAGCTAGTGT (For), CTCGGCCATCTTTTTGCTGTAT (Rev); Cyp17a1 – CATCCCCCACAAGGCTAAC (For), TGTGTCCTTGGGGACAGTAAA (Rev); Hsd17b – CCTTTGGCTTTGCCATGAGA (For), CAATCCATCCTGCTCCAACCT (Rev), структура которых была описана ранее [19]. Подбор праймеров осуществляли с помощью программы Primer BLAST NCBI (https://www.ncbi.nlm.nih.gov/tools/primer-blast/), а также на основе данных литературы. В качестве референсных использовали гены Actb и Gapdh, кодирующие β-актин и глицеральдегидфосфатдегидрогеназу. Результаты анализировали с помощью метода ΔΔСt и программного обеспечения 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ рассчитывали по отношению к контрольной группе, получавшей в течение 5 дней ДМСО (в/б).
Статистический анализ проводили с помощью программы “Microsoft Office Excel 2007”. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента. Статистически значимыми считали отличия при уровне значимости p < 0.05. Данные представляли как M ± SEM.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Основываясь на зависимости “доза-эффект” для различных способов введения препаратов были выбраны дозы 20 мг/кг для в/б и п/к введения, доза 40 мг/кг для перорального введения TP03 и доза 20 МЕ/крысу для в/б и п/к введения ХГЧ. В этих дозах достигался 65–75% от максимального стероидогенного эффекта препарата при соответствующем способе введения (табл. 1).
При однократном введении показано, что в случае TP03 наиболее эффективным было в/б введение, в то время как п/к и пероральный способы были сопоставимыми и по максимальному стероидогенному эффекту, и по значениям AUC1–5(ч), представляющим интегрированную площадь под кривой “концентрация тестостерона (нМ)-время(ч)” (табл. 2). При п/к и пероральном введении стимулирующий эффект TP03 запаздывал по сравнению с таковым при в/б введении (табл. 2). В случае ХГЧ п/к введение было более эффективным, позволяя уже через 1 ч после введения препарата достичь значительного повышения уровня тестостерона. Значение AUC1–5(ч) для п/к введения на 30% превышало таковое при в/б введении гонадотропина (табл. 2).
Таблица 2.
Уровни тестостерона до и через 1–5 ч после однократного внутрибрюшинного (20 мг/кг), подкожного (20 мг/кг) и перорального (40 мг/кг) введения TP03 и однократного подкожного (20 МЕ/крысу) и внутрибрюшинного (20 МЕ/крысу) введения ХГЧ самцам крыс Wistar
| до | Через 1 ч | Через 3 ч | Через 5 ч | AUC1–5(ч) | |
|---|---|---|---|---|---|
| К1, ДМСО, в/б | 14.74 ± 0.87 | 17.52 ± 2.09 | 17.99 ± 1.76 | 16.66 ± 1.85 | 70.2 ± 5.9 |
| TP03, в/б | 14.21 ± 1.54 | 36.82 ± 2.87 a | 65.57 ± 6.44 a | 65.93 ± 4.30 a | 233.9 ± 19.1 b |
| TP03, п/к | 17.37 ± 2.40 | 18.23 ± 2.58 | 29.55 ± 2.49 a | 32.74 ± 4.62 a | 110.1 ± 9.4 b |
| TP03, пер | 13.17 ± 2.11 | 15.62 ± 2.60 | 30.56 ± 3.04 a | 38.79 ± 3.47 a | 115.5 ± 11.0 b |
| К2, физ.р-р, п/к | 15.55 ± 1.70 | 17.16 ± 2.17 | 16.53 ± 2.53 | 14.37 ± 2.16 | 64.6 ± 9.3 |
| ХГЧ, п/к | 13.61 ± 1.68 | 73.41 ± 5.96 a | 118.26 ± 13.08 a | 113.68 ± 10.91 a | 423.6 ± 36.1 b |
| ХГЧ, в/б | 14.96 ± 2.10 | 36.36 ± 6.13 a | 88.34 ± 8.44 a | 92.83 ± 8.67 a | 305.9 ± 30.3 b |
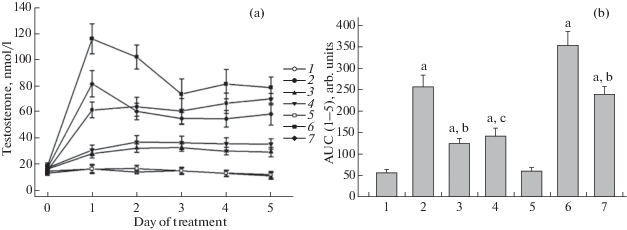
Введение препаратов в течение 5 дней также показало более высокую эффективность в/б введения TP03 по сравнению с п/к и пероральным введением и п/к введения ХГЧ по сравнению с в/б введением. На это указывают как динамика изменения уровня тестостерона в крови животных, так и значения AUC1–5(д), представляющие собой интегрированную площадь под кривой “концентрация тестостерона (нМ)-время(дни)” (рис. 1).
Рис. 1.
Уровни тестостерона в крови (a) и значения AUC1–5(д) (b) при внутрибрюшинном, подкожном и пероральном введении TP03 и подкожном и внутрибрюшинном введении ХГЧ в течение пяти дней самцам крыс Wistar.
Обозначения: 1 – контроль-1, ДМСО, в/б; 2 – TP03, 20 мг/кг, в/б; 3 – TP03, 20 мг/кг, п/к; 4 – TP03, 40 мг/кг, перорально; 5 – контроль-2, физиологический раствор, п/к; 6 – ХГЧ, 20 МЕ/крысу, п/к; 7 – ХГЧ, 20 МЕ/крысу, в/б.
На рисунке 1b: a – различия между группами с обработкой препаратами и соответствующими контролями статистически значимы при p < 0.05; b – различия между в/б и п/к введением статистически значимы при p < 0.05; с – различия между в/б и пероральным введением статистически значимы при p < 0.05. n = 5. M ± SEM.
Далее исследовали влияние TP03 и ХГЧ на экспрессию гена Lhr, кодирующего рецептор ЛГ, а также на экспрессию генов Star, Cyp11a1, Cyp17a1, Hsd3b и Hsd17b, кодирующих холестерин-транспортирующий StAR-белок, и стероидогенные ферменты – цитохромы Р450scc и Р450-17α и гидростероиддегидрогеназы-3β и -17β соответственно. Было выявлено не только различие между эффектами TP03 и ХГЧ на экспрессию исследуемых генов, но и влияние на них способа доставки препарата. Так, TP03 при в/б введении повышал экспрессию гена Lhr, а при п/к и пероральном введении практически не влиял на нее. В то же время ХГЧ при обоих исследованных способах доставки значимо снижал экспрессию гена рецептора ЛГ (табл. 3). Все препараты, хотя и в различной степени, повышали экспрессию гена Star, но различия с контролем были статистически значимы только для обоих способов введения ХГЧ и в/б введения TP03 (табл. 3). При в/б введении TP03 повышал экспрессию гена Cyp17a, а при п/к – экспрессию гена Hsd17b. При пероральном способе введения, несмотря на выраженный стероидогенный эффект, ТП03 не оказывал заметного влияния на экспрессию генов, кодирующих стероидогенные ферменты (табл. 3). При п/к введении ХГЧ в среднем в 6 раз повышал экспрессию генов обоих цитохромов, в то время как при в/б введении гонадотропин в значительной степени повышал экспрессию гена Hsd17b и в меньшей степени экспрессию генов Cyp11a и Cyp17a (табл. 3).
Таблица 3.
Экспрессия генов рецептора ЛГ и стероидогенных белков в семенниках самцов крыс после их обработки с помощью TP03 и ХГЧ в течение пяти дней
| Lhr | Star | Cyp11a | Hsd3b | Cyp17a | Hsd17b | |
|---|---|---|---|---|---|---|
| К1, ДМСО, в/б | 1.00 ± 0.12 | 1.03 ± 0.05 | 1.03 ± 0.08 | 1.04 ± 0.09 | 1.00 ± 0.05 | 1.00 ± 0.06 |
| TP03, в/б | 2.45 ± 0.39 a | 3.38 ± 0.36 a | 0.91 ± 0.11 | 0.92 ± 0.07 | 2.20 ± 0.30 a | 1.26 ± 0.11 |
| TP03, п/к | 0.95 ± 0.22 b | 1.69 ± 0.24 b | 1.51 ± 0.20 | 0.98 ± 0.08 | 1.12 ± 0.16 b | 2.16 ± 0.38 a |
| TP03, пер | 1.36 ± 0.23 | 1.58 ± 0.22 b | 1.05 ± 0.10 | 0.90 ± 0.06 | 1.25 ± 0.12 b | 0.90 ± 0.06 b |
| К2, физ.р-р, п/к | 1.05 ± 0.11 | 1.02 ± 0.09 | 1.14 ± 0.11 | 1.11 ± 0.11 | 0.95 ± 0.04 | 1.11 ± 0.12 |
| ХГЧ, п/к | 0.43 ± 0.10 a | 2.82 ± 0.34 a | 6.22 ± 0.77 a | 1.61 ± 0.19 | 6.42 ± 0.59 a | 0.67 ± 0.14 a |
| ХГЧ, в/б | 0.30 ± 0.10 a | 2.55 ± 0.33 a | 2.47 ± 0.20 ab | 1.54 ± 0.14 | 1.84 ± 0.30 ab | 4.67 ± 0.51 ab |
Примечание. Образцы ткани взяты через 3 ч после последнего введения препаратов. a – различия между группами с обработкой препаратами и соответствующими контролями статистически значимы при p < 0.05; b – различия между в/б введением ТП3 и п/к или пероральным введением ТП03, а также между п/к и в/б введением ХГЧ статистически значимы при p < 0.05. n = 5. M ± SEM.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами данные указывают на то, что низкомолекулярный аллостерический агонист TP03 в наибольшей степени повышает уровень тестостерона при его в/б введении самцам крыс, как при однократном введении, так и в течение 5 дней. П/к и пероральный способы введения в этом отношении были менее эффективными, причем снижался не только максимальный и суммарный (AUC) стероидогенный эффект TP03, но и отмечалось отставание, в сравнении с в/б введением, в динамике развития этого эффекта. Причиной этого, как мы полагаем, является то, что гидрофобный по природе тиено[2,3-d]-пиримидин сравнительно медленно поступает в кровь при п/к и пероральном введении и в меньших количествах достигает основных мишеней своего действия – тестикулярных клеток Лейдига, в которых осуществляются все стадии синтеза тестостерона. Следует отметить, что, несмотря на сниженную эффективность стероидогенного эффекта TP03, пероральный способ введения имеет большие перспективы, поскольку позволяет избежать инъекционных способов введения препарата, что расширяет сферу его применения в фармакологии. Устойчивость в желудочно-кишечном тракте и способность всасываться в кровь при пероральном введении являются значимыми преимуществами тиено[2,3-d]-пиримидиновых производных перед гонадотропинами, которые могут вводиться только инъекционным путем.
Как известно, ХГЧ широко применяют для лечения гипогонадотропного гипогонадизма у мужчин [5] и индукции созревания ооцитов и обеспечения поддержания лютеиновой фазы в ходе in vitro фертилизации у женщин [20], причем вводят его либо п/к, либо внутримышечно [15]. При осуществлении контролируемой индукции овуляции в последние годы также апробируют внутриматочное введение ХГЧ [21]. Несмотря на то, что изначально традиционным путем введения ХГЧ считали внутримышечные инъекции, п/к способ в настоящее время считают предпочтительным, поскольку он обеспечивает желаемый клинический эффект с меньшими неудобствами для пациента и не уступает внутримышечному по эффективности [15]. В/б введение ХГЧ в медицине не используют, но этот способ нашел применение при изучении физиологических эффектов гонадотропина в экспериментах на животных, в том числе при исследовании его стероидогенного эффекта [16–18], а также наиболее широко применяется для введения низкомолекулярных агонистов рецепторов гонадотропинов [8, 10, 11].
Нами показано, что при п/к введении ХГЧ его стимулирующий эффект на уровень тестостерона существенно превосходит таковой при в/б введении, о чем свидетельствуют более высокие значения AUC1–5(ч) и AUC1–5(д) и более выраженный максимальный стероидогенный эффект гонадотропина. При этом в случае п/к введения значимый подъем уровня тестостерона отмечается уже через 1 ч после введения гонадотропина, составляя 57% от такового через 3 ч после п/к введения. В то же время, как при в/б введении подъем уровня тестостерона через 1 ч составляет всего 29% от такового через 3 ч, что указывает на более медленное поступление препарата к клеткам Лейдига (табл. 2).
Выявленные нами различия в динамике и эффективности стероидогенного эффекта TP03 и ХГЧ при различных способах введении ассоциированы и с различиями их влияния на экспрессию стероидогенных ферментов и рецептора ЛГ. Необходимо отметить, что такой сравнительный анализ был проведен впервые как для низкомолекулярных агонистов рецептора ЛГ, так и для ХГЧ. Поскольку исследование проводили на 5-й день эксперимента, после длительной активации рецептора ЛГ и всей системы тестикулярного стероидогенеза, то различия в экспрессии, как мы полагаем, могут быть обусловлены не столько эффективностью действия самих агонистов рецептора ЛГ, сколько функционированием всей системы обратных связей, контролирующих экспрессию белков, вовлеченных в стероидогенез. В результате были выявлены следующие факты.
Несмотря на то, что в конце эксперимента уровни тестостерона в крови крыс при их обработке TP03 и ХГЧ были сопоставимыми, экспрессия гена, кодирующего рецептор ЛГ, в семенниках животных менялась разнонаправленно. В случае TP03 при всех способах введения она не снижалась, а при в/б введении даже повышалась, в то время как в случае п/к и в/б инъекций ХГЧ экспрессия гена Lhr отчетливо снижалась. Эти данные указывают на то, что одной из причин ослабления стероидогенного эффекта при длительном введении ХГЧ, независимо от способа доставки препарата, является снижение количества рецепторов ЛГ, и это можно рассматривать как результат запуска системы отрицательных обратных связей, индуцированных как высокими концентрациями гонадотропина, так и повышенным уровнем тестостерона [22]. TP03 не оказывает подобного эффекта, что во многом объясняет стабильность его стероидогенного эффекта во времени. Ранее нами было показано, что сохранение или даже усиление экспрессии ЛГ является характерной чертой для различных тиено[2,3-d]-пиримидиновых производных при их длительном в/б введении самцам крыс, и в норме, и при патологии [19, 23, 24].
Транспортный белок StAR катализирует скорость-лимитирующую стадию стероидогенеза – перенос холестерина в митохондрии, где осуществляются начальные стадии синтеза стероидных гормонов [25]. При этом TP03 при в/б введении и ХГЧ при обоих изученных способах введения в значительной степени стимулировали экспрессию гена этого белка (табл. 3), что характерно для активаторов стероидогенеза. В случае п/к и перорального введения TP03 стимулирующие эффекты этого агониста на экспрессию гена Star были выражены значительно слабее, и это было ассоциировано с менее выраженными стимулирующим эффектом TP03 на продукцию тестостерона (рис. 1, табл. 3).
Цитохромы Р450scc и Р450-17α катализируют превращение холестерина в прегненолон (Р450scc) и превращение прогестерона сначала в 17-оксипрогестерон, а затем в андростендион (Р450-17α) [26]. Экспрессия генов, кодирующих эти цитохромы, в значительной степени повышалась при пятитидневном п/к введении ХГЧ, в то время как в/б введение ХГЧ влияло на нее в существенно меньшей степени. Довольно неожиданным является различие в соотношении экспрессии гена Cyp17a цитохрома Р450-17α и гена Hsd17b дегидрогеназы 17β, катализирующей заключительную стадию стероидогенеза – превращение андростендиона в тестостерон, при различных способах введения ХГЧ. Так, при п/к введении экспрессия Cyp17a повышалась в шесть раз, а экспрессия Hsd17b, напротив, имела тенденцию к снижению (соотношение значений RQ для Cyp17a/Hsd17b составило 9.58), в то время как при в/б введении на фоне слабо выраженного повышения экспрессии Cyp17a отмечали значительное повышение экспрессии Hsd17b (соотношение Cyp17a/Hsd17b составило 0.39). Такое варьирование экспрессии, вероятно, обусловлено различиями в динамике синтеза и накопления различных прекурсоров тестостерона в ходе длительной стимуляции стероидогенеза.
В отличие от ХГЧ, TP03 при всех вариантах введения сравнительно слабо влиял на экспрессию генов стероидогенных ферментов, и лишь в сравнительно небольшой степени повышал экспрессию гена Cyp17a цитохрома Р450-17α в случае в/б введения и гена дегидрогеназы 17β в случае п/к введения. Эти данные указывают на то, что TP03, обеспечивая сравнимый с ХГЧ стероидогенный эффект, не вызывает гиперактивации экспрессии генов всех ключевых стероидогенных ферментов, которая сохраняется на уровне, близком к таковому в контроле. Это свидетельствует о том, что повышение продукции тестостерона, вызываемое низкомолекулярным агонистом, обеспечивается путем поддержания высокого уровня активности стероидогенных ферментов и не требует повышения их экспрессии.
Нами показано, что в случае ХГЧ п/к способ введения более предпочтителен в сравнении с в/б введением, на что указывает более выраженный стероидогенный эффект п/к введенного гонадотропина. Выявленные различия, как мы полагаем, обусловлены различной биодоступностью ХГЧ при п/к и в/б введении и различиями в паттерне генной экспрессии цитохрома Р450-17α и дегидрогеназы 17β, катализирующих заключительные стадии тестикулярного стероидогенеза. В случае гидрофобного по природе тиено[2,3-d]-пиримидинового производного TP03, действующего на аллостерический сайт рецептора ЛГ, в/б введение оказалось намного более эффективным, чем п/к и пероральное введение. Это указывает на то, что интерес, с точки зрения фармакологии, в случае TP03 могут представлять в/б введение, а также пероральное, как наиболее удобный и естественный способ доставки лекарственных препаратов. Показано также, что, в отличие от гонадотропина, обработка животных с помощью TP03 приводит к устойчивому во времени (при пятидневном введении) стероидогенному эффекту, умеренно влияя на экспрессию генов стероидогенеза и не снижая экспрессию рецептора ЛГ в семенниках, что может свидетельствовать в пользу сохранения чувствительности семенников к эндогенным гонадотропинам.
Список литературы
Riccetti L, De Pascali F, Gilioli L, Potì F, Giva LB, Marino M, Tagliavini S, Trenti T, Fanelli F, Mezzullo M, Pagotto U, Simoni M, Casarini L (2017) Human LH and hCG stimulate differently the early signalling pathways but result in equal testosterone synthesis in mouse Leydig cells in vitro. Reprod Biol Endocrinol 15: 2. https://doi.org/10.1186/s12958-016-0224-3
Kaprara A, Huhtaniemi IT (2018) The hypothalamus-pituitary-gonad axis: Tales of mice and men. Metabolism 86: 3–17. https://doi.org/10.1016/j.metabol.2017.11.018
Fink J, Schoenfeld BJ, Hackney AC, Maekawa T, Horie S (2021) Human chorionic gonadotropin treatment: a viable option for management of secondary hypogonadism and male infertility. Expert Rev Endocrinol Metab 16: 1–8. https://doi.org/10.1080/17446651.2021.1863783
Rastrelli G, Vignozzi L, Maggi M (2016) Different Medications for Hypogonadotropic Hypogonadism. Endocr Dev 30: 60–78. https://doi.org/10.1159/000439332
Swee DS, Quinton R (2019) Managing congenital hypogonadotrophic hypogonadism: a contemporary approach directed at optimizing fertility and long-term outcomes in males. Ther Adv Endocrinol Metab 10: 2042018819826889. https://doi.org/10.1177/2042018819826889
Fournier T (2016) Human chorionic gonadotropin: Different glycoforms and biological activity depending on its source of production. Ann Endocrinol (Paris) 77: 75–81. https://doi.org/10.1016/j.ando.2016.04.012
Hershko Klement A, Shulman A (2017) hCG Triggering in ART: An Evolutionary Concept. Int J Mol Sci 18: 1075. https://doi.org/10.3390/ijms18051075
van Koppen CJ, Zaman GJ, Timmers CM, Kelder J, Mosselman S, van de Lagemaat R, Smit MJ, Hanssen RG (2008) A signaling-selective, nanomolar potent allosteric low molecular weight agonist for the human luteinizing hormone receptor. Naunyn Schmiedebergs Arch Pharmacol 378: 503–514. https://doi.org/10.1007/s00210-008-0318-3
Nataraja SG, Yu HN, Palmer SS (2015) Discovery and development of small molecule allosteric modulators of glycoprotein hormone receptors. Front Endocrinol (Lausanne) 6: 142. https://doi.org/10.3389/fendo.2015.00142
Derkach KV, Dar’in DV, Lobanov PS, Shpakov AO (2014) Intratesticular, intraperitoneal, and oral administration of thienopyrimidine derivatives increases the testosterone level in male rats. Dokl Biol Sci 459: 326–329. https://doi.org/10.1134/S0012496614060040
Derkach KV, Dar’in DV, Bakhtyukov AA, Lobanov PS, Shpakov AO (2016) In vitro and in vivo studies of functional activity of new low molecular weight agonists of the luteinizing hormone receptor. Biochemistry (Moscow) Suppl Ser A: Membrane and Cell Biology 10: 294–300. https://doi.org/10.1134/ S1990747816030132
Derkach KV, Legkodukh AS, Dar’in DV, Shpakov AO (2017) The stimulating effect of thienopyrimidines structurally similar to Org 43553 on adenylate cyclase activity in the testes and on testosterone production in male rats. Cell Tissue Biol 11: 73–80. https://doi.org/10.1134/S1990519X17010035
Shpakov AO, Dar’in DV, Derkach KV, Lobanov PS (2014) The stimulating influence of thienopyrimidine compounds on the adenylyl cyclase systems in the rat testes. Dokl Biochem Biophys 456: 104–107. https://doi.org/10.1134/S1607672914030065
Bakhtyukov AA, Derkach KV, Dar’in DV, Sorokoumov VN, Shpakov AO (2020) Differential stimulation of testicular steroidigenesis by orthosteric and allosteric agonists of luteinizing hormone receptor. J Evol Biochem Physiol 56: 439–450. https://doi.org/10.1134/S0022093020050075
Jin J, Zhu L, Chen M, Xu H, Wang H, Feng X, Zhu X, Zhou Q (2015) The optimal choice of medication administration route regarding intravenous, intramuscular, and subcutaneous injection. Patient Prefer Adherence 9: 923–942. https://doi.org/10.2147/PPA.S87271
Sreenivasulu G, Senthilkumaran B, Sridevi P, Rajakumar A, Rasheeda MK (2012) Expression and immunolocalization of 20β-hydroxysteroid dehydrogenase during testicular cycle and after hCG induction, in vivo in the catfish, Clarias gariepinus. Gen Comp Endocrinol 175: 48–54. https://doi.org/10.1016/j.ygcen.2011.09.002
Movsas TZ, Weiner RL, Greenberg MB, Holtzman DM, Galindo R (2017) Pretreatment with Human Chorionic Gonadotropin Protects the Neonatal Brain against the Effects of Hypoxic-Ischemic Injury. Front Pediatr 5: 232. https://doi.org/10.3389/fped.2017.00232
Nikmahzar E, Jahanshahi M, Elyasi L, Saeidi M, Babakordi F, Bahlakeh G (2019) Human chorionic gonadotropin attenuates amyloid-β plaques induced by streptozotocin in the rat brain by affecting cytochrome c-ir neuron density. Iran J Basic Med Sci 22: 166–172. https://doi.org/10.22038/ijbms.2018.31412.7569
Bakhtyukov AA, Derkach KV, Gureev MA, Dar’in DV, Soro-koumov VN, Romanova IV, Morina IYu, Stepochkina AM, Shpakov AO (2020) Comparative study of the steroidogenic effect of human chorionic gonadotropin and thieno[2,3-d]pyrimidine-based allosteric agonist of luteinizing hormone receptor in young adult, aging and diabetic male rats. Int J Mol Sci 21: 7493. https://doi.org/10.3390/ijms21207493
Lawrenz B, Coughlan C, Fatemi HM (2019) Individualized luteal phase support. Curr Opin Obstet Gynecol 31: 177–182. https://doi.org/10.1097/GCO.0000000000000530
Gao M, Jiang X, Li B, Li L, Duan M, Zhang X, Tian J, Qi K (2019) Intrauterine injection of human chorionic gonadotropin before embryo transfer can improve in vitro fertilization-embryo transfer outcomes: a meta-analysis of randomized controlled trials. Fertil Steril 112: 89–97. https://doi.org/10.1016/j.fertnstert.2019.02.027
Althumairy D, Zhang X, Baez N, Barisas G, Roess DA, Bousfield GR, Crans DC (2020) Glycoprotein G-protein Coupled Receptors in Disease: Luteinizing Hormone Receptors and Follicle Stimulating Hormone Receptors. Diseases 8: 35. https://doi.org/10.3390/diseases8030035
Bakhtyukov AA, Derkach KV, Romanova IV, Sorokoumov VN, Sokolova TV, Govdi AI, Morina IYu, Perminova AA, Shpakov AO (2021) Effect of low-molecular-weight allosteric agonists of the luteinizing hormone receptor on its expression and distribution in rat testes. J Evol Biochem Physiol 57: 208–220. https://doi.org/10.1134/S0022093021020034
Derkach KV, Romanova IV, Bakhtyukov AA, Morina IYu, Dar’in DV, Sorokoumov VN, Shpakov AO (2021) Effect of a low-molecular-weight allosteric agonist of the luteinizing hormone receptor on the functional state of the testes in aging and diabetic rats. Bull Exp Biol Med 171: 81–86.https://doi.org/10.1007/s10517-021-05177-5
Miller WL (2007) Steroidogenic acute regulatory protein (StAR), a novel mitochondrial cholesterol transporter. Biochim Biophys Acta 1771:663–676. https://doi.org/10.1016/j.bbalip.2007.02.012
Zirkin BR, Papadopoulos V (2018) Leydig cells: formation, function, and regulation. Biol Reprod 99: 101–111. https://doi.org/10.1093/biolre/ioy059
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


