Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 34-42
РОЛЬ LIMK1 ДОФАМИНОВЫХ И СЕРОТОНИНОВЫХ НЕЙРОНОВ В СТАБИЛЬНОСТИ ГЕНОМА, ОБУЧЕНИИ И ПАМЯТИ У ДРОЗОФИЛЫ ПРИ СТРЕССОРНОЙ РЕАКЦИИ НА ОСЛАБЛЕНИЕ ГЕОМАГНИТНОГО ПОЛЯ
А. В. Медведева 1, А. В. Реброва 2, Е. С. Заломаева 1, 2, С. К. Тураева 2, Е. А. Никитина 1, 2, Е. В. Токмачева 1, С. А. Васильева 2, Б. Ф. Щеголев 1, Е. В. Савватеева-Попова 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
Санкт-Петербург, Россия
* E-mail: esavvateeva@mail.ru
Поступила в редакцию 09.07.2021
После доработки 10.10.2021
Принята к публикации 27.10.2021
- EDN: HMCRCG
- DOI: 10.31857/S0044452922010041
Аннотация
Работа продолжает цикл исследований эволюционной связи механизмов формирования стрессорной реакции и когнитивных функций, начатых в 1959 г. М.Е. Лобашевым и В.Б. Савватеевым. Изучается роль LIMK1, ключевого фактора нейропластичности, дофаминовых и серотониновых нейронов в стабильности генома, обучении и памяти дрозофилы в норме и при развитии стрессорной реакции организма в ослабленном статическом магнитном поле Земли (ОСМП). Показано, что низкий уровень LIMK1 способствует обучению, но не формированию среднесрочной памяти, в то же время стрессорное воздействие восстанавливает способность к обучению и формированию памяти у линии с повышенным содержанием LIMK1. Выявлены межлинейные различия частоты двухцепочечных разрывов ДНК (ДЦР) и увеличение уровня ДЦР после ОСМП. Полученные данные демонстрируют роль дофаминовых и серотониновых нейронов не только в когнитивных функциях, но и как мишени действия ОСМП при развитии стрессорной реакции.
Исследования М.Е. Лобашева и В.Б. Савватеева, опубликованные в монографии 1959 г. “Физиология суточного ритма животных” [1], о расширении адаптивных возможностей организма при тренировке свойств высшей нервной деятельности путем образования пищевых условных рефлексов, положили начало изучению взаимосвязи между нейропластичностью и развитием стрессорных реакций. Было показано, что формирование условной связи способствует адаптации к рестриктивным, а также стрессорным звуковым (частота 800‒850 Гц, сила звука 107 дб) раздражителям и изменению функционирования нервной системы [1]. В настоящее время экспериментально доказано наличие общих механизмов, лежащих в основе формирования адаптивных процессов – стрессорной реакции и обучения. В частности, выявлена роль белка теплового шока БТШ70 в формировании памяти, помимо его важной роли в фолдинге и деградации белков. В экспериментах с использованием различного числа копий гена hsp70 у самцов дрозофилы показано, что для обучения и формирования краткосрочной и долгосрочной памяти в парадигме условно-рефлекторного подавления ухаживания необходим низкий конститутивный уровень БТШ70. Проведенные транскриптомные исследования подтвердили, что самцы, различающиеся по числу копий hsp70, демонстрируют дифференциальную экспрессию нескольких групп генов, вовлеченных в спаривание, участвующих в формировании и консолидации памяти, включая цАМФ-каскад передачи сигналов. Показано, что транскрипционный фактор, который индуцирует экспрессию hsp70 и других генов теплового шока, играет центральную роль в синаптической пластичности и консолидации памяти [2]. Все это приводит к выводу о совместном эволюционировании механизмов стрессорной реакции и формировании памяти.
В лаборатории нейрогенетики Института физиологии им. И.П. Павлова РАН была создана модель синдрома Уильямса на дрозофиле с мутационным повреждением гена CG1848 LIM-киназы 1 – agnostic (agnts3) [3]. LIMK1 за счет наличия в структуре двух доменов LIM и домена PDZ, обеспечивающих белок-белковое взаимодействие, участвует в клеточной сигнализации и “узнает” белки семейств рецепторов и ионных каналов [4]. Помимо этого, LIMK1 фосфорилирует фактор деполимеризации актина – кофилин и таким образом контролирует баланс между мономерным и полимерным актином, что определяет его функции в цитоплазме и ядре. Актин непосредственно взаимодействует с комплексами ремоделирования хромосом, транскрипционными факторами и РНК-полимеразами, регулируя транскрипционный выход клетки [5]. Мутация по этому гену agnts3 при пермиссивной температуре нарушает обучение и память при условно-рефлекторном подавлении ухаживания у самцов, тогда как при рестриктивной температуре эти показатели восстанавливаются до уровня дикого типа [6]. Аналогичный эффект, восстанавливающий обучение и память мутанта agnts3, был получен нами при воздействии ослабленного статического магнитного поля Земли (ОСМП) [7], при этом отмечено, что именно ремоделирование актинового цитоскелета является мишенью действия ОСМП. Как предложенный И.П. Павловым метод оценки выработки пищевого условного рефлекса по слюноотделению позволил вывести науки о мозге из области теософии, так и ошеломляющие, ломающие традиционные убеждения, открытия последних лет, переводят рассуждения о действии магнитных полей (МП) из категории осмеиваемого в плоскость простых и четких экспериментов, в первую очередь с использованием нашей модели на дрозофиле. При изучении магнитотаксиса у бактерий Magnetospirillum magneticum, способных двигаться вдоль магнитного поля Земли в поисках подходящей среды обитания, обнаружена уникальная внутриклеточная органелла магнитосома. Она образована упорядоченными цепями кристаллов Fe3O4 или Fe3S4, встроенных в мембрану за счет магнитосома-ассоциированных белков (magnetosome-associated proteins, MAPs) актинового цитоскелета. Как и F-актин эукариот, эти белки образуют высоко-динамичные филаментозные структуры как in vivo, так и in vitro. Их известно 28, они высоко консервативны от прокариот до эукариот, делеции генов, кодирующих MAPs, приводят к потере магнитотаксиса. Как и у эукариот, MAPs вовлечены в процессы обеспечения морфологии и подвижности клетки, клеточного деления и расхождения хромосом [8, 9]. Ключевой фермент ремоделирования актинового цитоскелета LIM-киназа 1 (LIMK1), фосфорилируя кофилин, маленький белок 21Д, определяет баланс между мономерным и полимерным актином. Кофилин – фактор переноса актина в ядро для непосредственного взаимодействия с комплексами ремоделирования хромосом при формировании 3D-архитектуры ядра. Кроме того, кофилин – биосенсор стрессорных воздействий, сопрягающих актиновый цитоскелет и митохондрии. Поэтому его рассматривают как функциональный узел клеточной биологии, а нейродегенеративные заболевания (НДЗ) – болезнь Паркинсона (БП), болезнь Альцгеймера (БА), болезнь Хантингтона (БХ) и другие называют “кофилинопатиями” [3].
Указанный выше факт, что делеции генов, кодирующих MAPs, приводят к потере магнитотаксиса, описывает основной метод познания нейрофизиологии и биомедицины – противопоставление “норма” – “патология” и генетики “все или ничего”, т.е. мутант-дикий тип. Поэтому следует начинать с “патологии”, а не “нормы”, в случае изучения воздействий магнитного поля Земли – это подразумевает его экранирование или ослабление, т.е. “отсутствие действия” и не предполагает перебор всех факторов его влияния в современной среде обитания человека. Поэтому согласно современным воззрениям, экранирование статического магнитного поля (СМП) является “стрессорным воздействием” [10]. Влияние экранирования СМП описано и нами ранее [11].
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования служили трансгенные Gal4 и UAS линии дрозофилы, представленные в биобанке Bloomington Drosophila Stock Center (США), а также в биоколлекции Института физиологии им. И.П. Павлова РАН (ЦКП “Биоколлекция ИФ РАН для исследования интегративных механизмов деятельности нервной и висцеральных систем”).
В качестве линий Gal4 – #7009 – w[1118]; P{w[+mC]=Ddc-GAL4.L}Lmpt[4.36] (экспрессирует GAL4 в дофаминергических и серотонинергических нейронах под контролем Ddc). Ассоциированные гены: Ddc (регулятор), Lmpt, GAL4, w. Геномная карта: 3L (73D3-73D6).
В качестве линии UAS использовали линию #26294 – y[1] v[1]; P{y[+t7.7] v[+t1.8]=TRiP.JF02063}attP2 (под промотором UAS – последовательность RNAi, вызывающая деградацию LIMK1; экспрессирует dsRNA для RNAi LIMK1 (FBgn0283712) под контролем UAS в векторе VALIUM10). Ассоциированные гены: limk1 (RNAi), UAS (регулятор), y, v. Геномная карта: Chr 3, 68A4, 3L:11070538.
Второй UAS линией (для TRiP RNAi линий) служила #36303 – y[1] v[1]; P{y[+t7.7]=CaryP}attP2 (генетический фон идентичен 26294, конструкция UAS-RNAi отсутствует). Ассоциированные гены: v, y. Геномная карта: Chr 3, 68A4, 3L:11070538.
В системе бинарного скрещивания Gal4-UAS (#7009 х #26294) в дофаминовых нейронах происходила интерференция иРНК гена limk (в тексте линия обозначается DopLIMK-), во второй линии (#7009 х #36303) экспрессия гена limk не подавлялась (в дальнейшем- DopLIMK+).
В качестве простых животных моделей в экспериментах использовали мутантные линии дрозофилы с коротким жизненным циклом, дешевым содержанием и отсутствием законодательных ограничений.
Для экранирования магнитного поля Земли совместно с ФГУ ЦНИИ КМ “Прометей” была изготовлена цилиндрическая камера, покрытая экранирующим материалом из аморфного магнитомягкого сплава АМАГ 172. Конструкция съемной крышки цилиндра с аналогичным покрытием позволяет избежать появления “магнитных дыр” в экране. Величина индукции статического МП Земли в Колтушах составляет 50 мкТл. Коэффициент экранирования по постоянной составляющей магнитного поля равен 35 (величина индукции МП внутри камеры составляет 1.4 мкТл, снаружи – 50 мкТл). Особенности физического моделирования ослабленного статического МП Земли описаны ранее [11].
Для изучения влияния ОСМП на характер хромосомных перестроек экранирование МП Земли проводили на стадии личинок 3-го возраста, отбирая их по физиологическому критерию активного перемещения по стенкам пробирок. Чтобы оценить влияние стресс-фактора на способность к обучению и формированию среднесрочной памяти, воздействию подвергали 5-ти суточных самцов в течение 12 ч. Во всех вариантах эксперимента применяли интактный контроль (без воздействия).
Анализ перестроек анафазных хромосом клеток нервного ганглия личинок дрозофилы. Анафазный анализ осуществляли с использованием давленых препаратов нервных ганглиев, окрашенных 4%-ным ацетоорсеином. Для каждой особи вычисляли частоту перестроек – отношение числа анафаз с перестройками к общему числу анафазных клеток в нервном ганглии личинки. Кроме того, вычисляли профиль перестроек каждого типа – мостов, фрагментов и отставших хромосом. Для этого рассчитывали отношение числа каждого из типов перестроек к общему числу аберрантных анафаз. Для обработки результатов вычислений применяли двухфакторный рандомизационный анализ. На каждую экспериментальную точку было проанализировано до 30 особей.
Иммунохимический анализ ДЦР в клетках нервных ганглиев личинок дрозофилы. Иммунохимическое окрашивание производили согласно протоколу, разработанному для нервных ганглиев личинок дрозофилы [12]. Использовали маркерные для ДЦР антитела к модифицированному гистону Ser137-фосфо-H2Av (Rabbit anti-Other Histone H2AvD Polyclonal Antibody-P08985 (MBS4157014) product datasheet at MyBioSource). Ядра окрашивали DAPI (1.2 μg/ml на PBS).
Фокальные срезы анализировали в ЦКП “Конфокальная микроскопия” Института физиологии им. И.П. Павлова РАН на лазерном сканирующем микроскопе LSM 710 Carl Zeiss.
Для оценки способности к обучению и формированию среднесрочной памяти самцов применяли методику условно-рефлекторного подавления ухаживания. Метод основан на естественных стимулах полового поведения дрозофилы, в настоящее время называется “парадигмой отвержения”, “rejection paradigm”. Исчерпывающе описан в последних [2] и первоначальных исследованиях [13]. Суть состоит в том, что достигший половой зрелости к 5-му дню жизни самец, но до того в результате индивидуального содержания не имевший сексуального опыта, после 30 мин опыта отвержения оплодотворенной самкой (тестирование краткосрочной и среднесрочной памяти) перестает ухаживать за новой, тестерной самкой.
Исследования проводили на взрослых 5-суточных самцах при температуре 22 ± 0.5 °С в первой половине дня. В качестве объектов ухаживания для самцов обеих линий использовали 5-суточных самок линии Сanton-S, оплодотворенных за 1 сутки до эксперимента.
В ходе эксперимента самца тестируемой линии, не имеющего опыта полового поведения, помещали в экспериментальную камеру диаметром 15 мм и высотой 5 мм, изготовленную из оргстекла, вместе с оплодотворенной 5-суточной самкой CS. Этограмму поведения самца регистрировали в течение 300 с, фиксируя продолжительность отдельных элементов ухаживания (ориентация и преследование, вибрация, попытка копуляции), а также время выполнения элементов, не связанных с ухаживанием (побежка, прининг, покой). Для анализа данных использовали специально разработанные компьютерные программы [13].
Оценку способности к обучению и формированию среднесрочной памяти проводили через разные интервалы времени: сразу после тренировки проводили анализ способности к обучению, через 3 ч оценивали среднесрочную память. В каждой группе тестировали не менее 20 пар мух. Для каждого самца вычисляли индекс ухаживания (ИУ), т.е. время ухаживания самца за самкой, выраженное в процентах от общего времени наблюдения.
Статистическую обработку результатов проводили при помощи рандомизационного анализа (р < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ИССЛЕДОВАНИЯ
Функционирование нейронов тесно связано с активностью LIMK1. Этот фермент, регулируя баланс мономерного и полимерного актина, участвует в синаптической передаче, пластичности и формировании памяти. Актин регулирует транскрипционный выход нейромедиатора (взаимодействуя с комплексами ремоделирования хромосом, транскрипционными факторами и РНК-полимеразами) [5], а также обеспечивает внутриклеточный трафик, интернализацию и рециклирование дофаминового транспортера [14]. Следовательно, подавление LIMK1 в дофаминовых нейронах отразится как на динамике дофамина, так и функционировании актинового цитоскелета.
Анафазный анализ перестроек хромосом клеток нервного ганглия личинок в норме и при стрессорном воздействии ОСМП
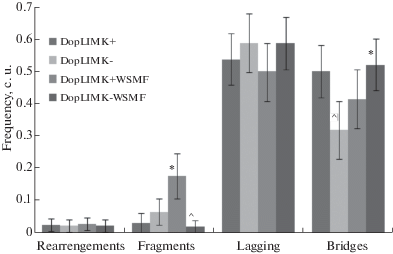
На рис. 1 представлены данные анафазного метода регистрации перестроек хромосом во время митотического деления клеток нервного ганглия. В линии без подавления LIMK1 – DopLIMK+ при стрессорном воздействии наблюдается резкое увеличение частоты фрагментов, что позволяет полагать ДЦР мишенью действия ОСМП. Снижение экспрессии гена limk1 в дофаминовых нейронах приводит к достоверному уменьшению профиля мостов в анафазе митоза клеток нервного ганглия личинок дрозофилы. При этом стрессорное воздействие вызывает увеличение частоты мостов.
Рис. 1.
Сравнительный анализ частоты и профиля хромосомных перестроек в клетках нервного ганглия личинок Droso-phila melanogaster линий DopLIMK- (Gal4-UAS (#7009 × #26294), в дофаминовых нейронах подавлена экспрессия гена limk) и DopLIMK+ (Gal4-UAS (#7009 х #36303), экспрессия гена limk не подавлена) в норме и при действии ОСМП. ^ – достоверные межлинейные различия, р < 0.05; * – достоверные различия от уровня перестроек в норме, р < 0.05.
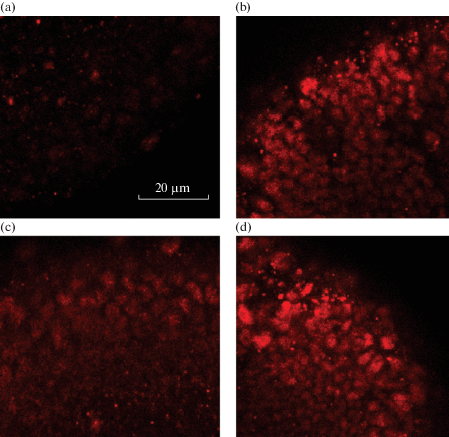
Полученные результаты подкрепляются данными конфокальной микроскопии при иммунохимическом исследовании ДЦР в нервных ганглиях личинок дрозофилы с помощью антител к маркерному модифицированному гистону Ser137-фосфо-H2Av. Как показано на рис. 2, уровень свечения ядер линии DopLIMK- слабее, чем в контрольной линии, что отражает низкий уровень ДЦР, который визуализируется в достоверно низком профиле мостов в анафазе. После стрессорного воздействия ОСМП уровень свечения возрастает у DopLIMK-, что отражается на увеличении количества мостов. У линии DopLIMK+ высокий уровень ДЦР после стрессорного воздействия реализуется в достоверном повышении профиля фрагментов при падении числа мостов.
Рис. 2.
Иммунохимический анализ двухцепочечных разрывов в нервных ганглиях личинок дрозофилы с помощью антител к маркерному модифицированному гистону Ser137-фосфо-H2Av. (a) Изображение ядер нервного ганглия линии DopLIMK- без стрессорного воздействия. (b) Изображение ядер нервного ганглия линии DopLIMK- после стрессорного воздействия ОСМП. (c) Изображение ядер нервного ганглия линии DopLIMK+ без стрессорного воздействия. (d) Изображение ядер нервного ганглия линии DopLIMK+ после стрессорного воздействия ОСМП.
Можно предположить, что хромосомный аппарат клеток нервного ганглия подвержен влиянию как со стороны дофамина, так и актинового цито-скелета. Рассмотрим это более подробно:
а) Оксидативный стресс является естественной частью метаболизма дофамина и сопутствует таким заболеваниям, как болезнь Альцгеймера, болезнь Паркинсона и шизофрения. Избыток активных форм кислорода (АФК) сопровождается вредными побочными эффектами, такими как окисление липидов, разобщение цепи переноса электронов или повреждение ДНК, что в конечном итоге приводит к гибели клеток [15].
Известно, что катехоламины, L-DOPA и дофамин могут индуцировать повреждения ДНК, активируя редокс-активные металлы, например, медь. Катехоламины обладают способностью восстанавливать Cu (II) до Cu (I) и участвовать в окислительно-восстановительном цикле меди. Предполагается, что катехоламины образуют тройной комплекс с ДНК и Cu (II), облегчая окислительно-восстановительный цикл меди и генерируя АФК, что, в свою очередь, может приводить к разрывам ДНК [15]. При стрессорном воздействии ОСМП происходит накопление АФК в клетках с аэробным дыханием [16]. По-видимому, этим и объясняется увеличение частоты фрагментов и мостов в анафазе деления нейронов при ОСМП.
б) Можно выделить два возможных способа регуляции целостности хромосомного аппарата каскадом ремоделирования актинового цитоскелета. Во-первых, обнаружена локализация LIMK1 в центросоме митотически делящейся клетки. Фосфорилирование LIMK1 регулирует цитоплазматические функции динеина (партнерного белка LIMK1) в отношении транспорта центросомных белков [17]. При гиперактивности динеина у почкующихся дрожжей наблюдаются чрезмерное движение митотического веретена и увеличение частоты двухцепочечных разрывов ДНК [18]. Во-вторых, динамика цитоскелета влияет на репарацию ДНК. Показано, что перемещение районов ДЦР в субъядерный домен для репарации ДНК осуществляется посредством полимеризованного актина. Инактивация механизмов релокации поврежденных участков хромосом приводит к дефектам репарации и нестабильности генома [19]. Таким образом, целостность генетического аппарата соблюдается при балансе двойственных функций каскада ремоделирования актина. С одной стороны, активностью гена limk1 может быть обусловлен высокий профиль мостов у DopLIMK+ по сравнению с линией DopLIMK-. С другой стороны, при действии ОСМП наличие редокс-чувствительных сайтов у ГТФаз Rho и актина создает возможность регулирования соответствующих каскадов свободными радикалами [20]. Результатом изменения уровня LIMK1 может стать деполимеризация актиновых филаментов и, соответственно, дефекты репарации, приводящие к увеличению частоты мостов и фрагментов у изучаемых линий.
Оценка способности к обучению и формированию среднесрочной памяти самцов дрозофилы в норме и при стрессорном воздействии ОСМП
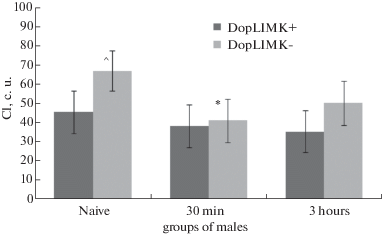
На рис. 3 представлены данные по обучению и формированию памяти у самцов изучаемых линий в нормальных условиях. Изначально низкий ИУ линии DopLIMK+ не изменился сразу и через 3 ч после 30 мин тренировки, что свидетельствует о дефекте способности к обучению и формированию среднесрочной памяти. Оказалось, что низкий уровень LIMK1 в дофаминовых нейронах (линия DopLIMK-) способствует увеличению активности ухаживания, приводит к нормализации способности к обучению (падение индекса ухаживания), но не влияет на формирование среднесрочной памяти.
Рис. 3.
Сравнительный анализ индекса ухаживания самцов Drosophila melanogaster линий DopLIMK- (Gal4-UAS (#7009 х #26294), в дофаминовых нейронах подавлена экспрессия гена limk) и DopLIMK+ (Gal4-UAS (#7009 х #36303), экспрессия гена limk не подавлена) в нормальных условиях. ^ – достоверные межлинейные различия, р<0.05; * – достоверные отличия от уровня наивных самцов, р < 0.05.
Показатели ИУ после стрессирующего воздействия ОСМП представлены на рис. 4. У линии DopLIMK+ достоверно увеличился ИУ наивных самцов, после 30 мин тренировки с оплодотворенной самкой ИУ упал и сохранился на том же уровне через 3 ч. Таким образом, воздействие ОСМП повлияло на процессы обучения и формирования среднесрочной памяти. У линии с низким содержанием LIMK1 наблюдали падение ИУ наивных самцов, однако после 30 мин тренировки ИУ достоверно снизился, что свидетельствует о способности к обучению самцов DopLIMK- после ОСМП. Через 3 ч ИУ увеличился и достоверно не отличался от уровня наивных самцов. ОСМП не повлияло на формирование памяти линии DopLIMK-.
Рис. 4.
Сравнительный анализ индекса ухаживания самцов Drosophila melanogaster линий DopLIMK- (Gal4-UAS (#7009 х #26294), в дофаминовых нейронах подавлена экспрессия гена limk) и DopLIMK+ (Gal4-UAS (#7009 х #36303), экспрессия гена limk не подавлена) после стрессорного воздействия ОСМП. ^ – достоверные межлинейные различия, р < 0.05; * – достоверные отличия от уровня наивных самцов ОСМП, р < 0.05.

Таким образом, полученные данные подтвердили результаты предыдущих исследований – мишенью действия ОСМП является каскад ремоделирования актина и, как показала настоящая работа, LIMK1 дофаминовых нейронов.
Интересно сопоставить полученные данные с результатами аналогичного исследования, проведенного в нашей лаборатории, но с использованием другой, более изученной модели синдрома Уильямса – мутанта по гену для LIMK1 – agnts3 [6]. Уникальность данной модели состоит в том, что повышение и снижение уровня LIMK1 достигаются температурным воздействием с последующим изменением когнитивного профиля, без использования конструктов, влияющих на обучение и память. Для agnts3 в норме характерен повышенный уровень LIMK1, сопровождаемый дефектами обучения и памяти, а также локомоторной активности. Сходными свойствами обладает линия DopLIMK+. После ТШ и воздействия ОСМП наблюдаются падение уровня LIMK1 у agnts3 и восстановление когнитивных функций до уровня линии дикого типа Canton S [21]. Таким образом, снижение уровня LIMK1 приводит к восстановлению способности к обучению и формирования памяти, что характерно и для линии DopLIMK-, но не относится к среднесрочной памяти. В работе Г.А. Захарова показано, что при воздействии ОСМП у agnts3 наблюдается падение уровня LIMK1 и БТШ70 [21]. Там же впервые и обосновано положение о том, что сравнение действия теплового шока и воздействия ОСМП выявляют, что воздействие ОСМП может сопровождаться оксидативным стрессом, подтверждается и в работах других исследователей [22].
Интересно, что у линии DopLIMK+ (аналог agnts3) в норме наблюдается низкий уровень ухаживания, который увеличивается после ОСМП, возможно, за счет падения LIMK1, с чем связано и восстановление когнитивных показателей. Воздействие ОСМП на когнитивные функции, по-видимому, обусловлено как регуляцией уровня LIMK1 свободными радикалами редокс-чувствительных сайтов ГТФаз Rho [20], так и влиянием низкого уровня БТШ70 на обучение и формирование памяти [2].
Таким образом, воздействие ОСМП выявило участие дофамин- и серотонинергических нейронов в формировании стрессорной реакции организма, при том, что литературные данные свидетельствуют об участии дофамина в “системе вознаграждения”, в мотивации и внимании, лежащих в основе поведенческой реакции на важные события, будь то отталкивающие или привлекающие стимулы [23]. Также показана роль уровня LIMK1 дофамин- и серотонинергических нейронов в стрессорном ответе, как на геномном, так и на поведенческом уровнях. В связи с этим представляется неслучайным участие БТШ в организации актинового цитоскелета и гомодимеризации LIMK1 [24]. Все вышесказанное свидетельствует в пользу гипотезы об эволюционной связи механизмов, ответственных за развитие стрессорных реакций и реализацию когнитивных процессов – обучения и памяти.
Но еще более неожиданным открытием, нежели обнаружение магнитосом, стало вскрытие общих механизмов регуляции циркадного ритма и магниторецепции. И произошло оно именно с использованием дрозофилы. Ссылки на предшествующие работы приведены в обзоре 2021 г. [25]. Суть в том, что белки-криптохромы (CRYs) выполняют функции рецепторов голубого света, вовлеченных во многие физиологические процессы практически у всех представителей животного царства. В последние годы они стали наиболее вероятными кандидатами участия в зависимой от освещенности, меняющейся соответственно времени года, магниторецепции. CRYs животных подразделяются на несколько типов: тип 1 – насекомые, тип 2 – млекопитающие, тип 4 – птицы, рыбы, черепахи. Что важно – типы 1 и 2 являются регуляторами циркадного ритма. Что еще более важно – на дрозофиле показано, что эффекты магнитного поля Земли (в нашем случае – их экранирование) наблюдаются тогда, когда изменения поля осуществляются в темную фазу суток. В нашем случае, коль скоро физиологические проявления дрозофилы жесточайшим образом зависимы от циркадного ритма, 12-часовое экранирование магнитного поля Земли осуществляли именно в это время, освещение в помещениях для разведения и опытов на дрозофиле автоматически выключается в 20 ч, включается в 8 ч утра. Karki N. и соавт. особо указывают на то, что CRY-зависимые от магнитного поля эффекты наблюдаются у дрозофилы – это спайковая активность нейронов, локомоторная активность и поведение в Т-образных лабиринтах. Как минимум, этот набор проявлений и предопределяет совокупный результат феномена условно-рефлекторного подавления ухаживания у дрозофилы.
Список литературы
Лобашев МЕ, Савватеев ВБ (1959) Физиология суточного ритма животных. – М.; Л.: Наука. [Lobashev ME, Savvateev VB (1959) Fiziologija sutochnogo ritma zhivotnyh. – M.; L.: Nauka (In Russ)].
Zatsepina OG, Nikitina EA, Shilova VY, Chuvakova LN, Sorokina S, Vorontsova JE, Tokmacheva EV, Funikov SY, Rezvykh AP, Evgen’ev MB (2021) Hsp70 affects memory formation and behaviorally relevant gene expression in Drosophila melanogaster. Cell Stress and Chaperones 26 (3): 575–594. https://doi.org/10.1007/s12192-021-01203-7
Nikitina EA, Medvedeva AV, Zakharov GA, Savvateeva-Popova EV (2014) The Drosophila agnostic locus: involvement into formation of cognitive defects in William’s syndrome. Acta Naturae 6 (2): 53–61. https://doi.org/10.32607/20758251-2014-6-2-53-61
Медведева АВ, Молотков ДА, Никитина ЕА, Попов АА, Карагодин ДА, Баричева ЕМ, Савватеева-Попова ЕВ (2008) Системная регуляция генетических и цитогенетических процессов сигнальным каскадом ремоделирования актина: локус agnostic дрозофилы. Генетика 44 (6): 669–681 [Medvedeva AV, Molotkov DA, Nikitina EA, Popov AV, Karagodin DA, Baricheva EM, Savvateeva-Popova EV (2008) Systemic regulation of genetic and cytogenetic processes by a signal cascade of actin remodeling: locus agnostic in Drosophila. Russ J Genetics 44 (6): 771–783.] (In Russ).https://doi.org/10.1134/S1022795408060069.
Misu S, Takebayashi M, Kei M (2017) Nuclear actin in development and transcriptional reprogramming. Front Genet 8: 27. https://doi.org/10.3389/fgene.2017.00027
Никитина ЕА, Каминская АН, Молотков ДА, Попов АВ, Савватеева-Попова ЕВ (2014) Влияние теплового шока на поведение ухаживания, звукопродукцию и обучение в сопоставлении с содержанием LIMK1 в мозге самцов Drosophila melanogaster с измененной структурой гена limk1. Журнал эволюционной биохимии и физиологии 50 (2): 137–146 [Nikitina EA, Kaminskaya AN, Molotkov DA, Savvateeva-Popova EV, Popov AV (2014) Effect of heat shock on courtship behavior, sound production, and learning in comparison with the brain content of limk1 in Drosophila melanogaster males with altered structure of the limk1 gene Journal of Evolutionary Biochemistry and Physiology 50 (2): 154–166].https://doi.org/10.1134/S0022093014020082.
Vasilieva SA, Tokmacheva EV, Medvedeva AV, Ermilova AA, Nikitina EA, Shchegolev BF, Surma SV, Savvateeva-Popova EV (2020) The role of parental origin of chromosomes in the instability of the somatic genome in Drosophila brain cells and memory trace formation in norm and stress. Cell and Tissue Biology 14 (3): 178–189. https://doi.org/10.1134/S1990519X20030074
Toro-Nahuelpan M, Müller FD, Klumpp S, Plitzko JM, Bramkamp M, Schüler D (2016) Segregation of prokaryotic magnetosomes organelles is driven by treadmilling of a dynamic actin-like MamK filament. BMC Biol. 14 (1): 88. https://doi.org/10.1186/s12915-016-0290-1
McCausland HC, Komeili A (2020) Magnetic genes: Studying the genetics of biomineralization in magnetotactic bacteria. PLoS Genet 16 (2): e1008499. https://doi.org/10.1371/journal.pgen.1008499
Erdmann W, Idzikowski B, Kowalski W, Szymański B, Kosicki JZ, Kaczmarek L (2017) Can the tardigrade Hypsibius dujardini survive in the absence of the geomagnetic field? PLoS One 12 (9): e0183380. https://doi.org/10.1371/journal.pone.0183380
Никитина ЕА, Медведева АВ, Герасименко МС, Проников ВС, Сурма СВ, Щеголев БФ, Савватеева-Попова ЕВ (2017) Ослабленное магнитное поле Земли: влияние на транскрипционную активность генома, обучение и память у Dr. melanogaster. Журнал высшей нервной деятельности им. И.П. Павлова 67 (2): 246–256. [Nikitina ЕА, Мedvedeva AV, Ge-rasimenko MS, Pronikov VS, Surma SV, Shchegolev BF, Savvateeva-Popova EV (2017) Weakened geomagnetic field: impact on transcriptional activity of the genome, learning and memory formation in Dr. melanogaster. Zhurnal VND 67 (2): 246–256.]. https://doi.org/10.7868/S0044467717020101.
Wu JS, Luo L (2006) A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc 1: 2110–2115. .https://doi.org/10.1038/nprot.2006.336
Kamyshev NG, Iliadi KG, Bragina JV (1999) Drosophila conditioned courtship: Two ways of testing memory. Learn Mem Cold Spring Harb 6: 1–20.
Trouillon R, Ewing AG (2014) Actin controls the vesicular fraction of dopamine released during extended kiss and run exocytosis. ACS Chem Biol 21; 9 (3): 812–20.https://doi.org/10.1021/cb400665f
Rehmani N, Zafar A, Arif H, Hadi SM, Wani AA (2017) Copper-mediated DNA damage by the neurotransmitter dopamine and L-DOPA: A pro-oxidant mechanism. Oxicol In Vitro 40: 336–346. https://doi.org/10.1016/j.tiv.2017.01.020
Spivak IM, Kuranova ML, Mavropulo-Stolyarenko GR, Surma SV, Shchegolev BF, Stefanov VE (2016) Response to extremely weak static magnetic fields. Biophysics 61 (3): 435–439.
Ou S, Tan MH, Weng T, Li HY, Koh CG (2018) LIM kinase1 regulates mitotic centrosome integrity via its activity on dynein light intermediate chains. Open Biol. 8:170202. https://doi.org/10.1098/rsob.170202
Estrem C, Moore JK (2020) Help or hindrance: how do microtubule-based forces contribute to genome damage and repair? Current Genetics 66: 303–311. https://doi.org/10.1007/s00294-019-01033-2
Caridi CP, Plessner M, Grosse R, Chiolo I (2019) Nuclear actin filaments in DNA repair dynamics. Nat Cell Biol 21 (9): 1068–1077. https://doi.org/10.1038/s41556-019-0379-1
Heo J (2011) Redox control of GTPases: from molecular mechanisms to functional significance in health and disease. Antioxid. Redox Signal 14: 689–724. https://doi.org/10.1089/ars.2009.2984
Захаров ГА (2012) Молекулярно-генетические исследования роли компонентов сигнального каскада ремоделирования актина в генезисе поведенческих нарушений Drosophila melanogaster. Автореф. канд. дис. СПб. [Zaharov G.A. (2012) Molekuljarno-geneticheskie issledovanija roli komponentov signal’nogo kaskada remodelirovanija aktina v genezise povedencheskih narushenij Drosophila melanogaster. Avtoref kand dis SPb (In Russ)].
Coballase-Urrutia E, Navarro L, Ortiz JL, Verdugo-Díaz L, Gallardo JM, Hernández ME, Estrada-Rojo F (2018) Static Magnetic Fields Modulate the Response of Different Oxidative Stress Markers in a Restraint Stress Model Animal Biomed Res Int 2018: 3960408. https://doi.org/10.1155/2018/3960408
Pruessner JC, Champagne F, Meaney MJ, Dagher A (2004) Dopamine release in response to a psychological stress in humans and its relationship to early life maternal care: a positron emission tomography study using raclopride. J Neurosci 24 (11): 2825–2831. https://doi.org/10.1523/JNEUROSCI.3422-03.2004
Li R, Soosairajah J, Harari D, Citri A, Price J, Ng HL, Morton CJ, Parker MW, Yarden Y, Bernard O (2006) Hsp90 increases LIM kinase activity by promoting its homo-dimerization. FASEB J 20 (8):1218–20. https://doi.org/10.1096/fj.05-5258fje
Karki N, Vergish S, Zoltowski BD (2021) Cryptochromes: Photochemical and structural insight into magnetoreception. Protein Sci 30 (8): 1521–1534. https://doi.org/10.1002/pro.4124
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


