Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 24-33
СООТНОШЕНИЕ ВОЗБУДИТЕЛЬНЫХ И ТОРМОЗНЫХ СИНАПТИЧЕСКИХ ПРОЦЕССОВ В АНТИНОЦИЦЕПТИВНОМ ЯДРЕ RAPHE MAGNUS НА МОДЕЛИ БОЛЕЗНИ ПАРКИНСОНА В УСЛОВИЯХ ПРОТЕКЦИИ ГИДРОКОРТИЗОНОМ
М. В. Погосян 1, М. Э. Овсепян 1, М. А. Даниелян 1, Л. Э. Амбарцумян 1, Л. П. Манукян 1, Дж. С. Саркисян 1, *
1 Институт физиологии им. Л.А. Орбели НАН РА
Ереван, Армения
* E-mail: johnsarkissyan@gmail.com
Поступила в редакцию 08.10.2021
После доработки 04.11.2021
Принята к публикации 05.11.2021
- EDN: DQRJYV
- DOI: 10.31857/S0044452922010065
Аннотация
При нейродегенеративных болезнях, чаще при болезни Паркинсона (БП), в нейродегенерацию вовлекаются антиноцицептивные центры, что сопровождается постоянной болью, не снимаемой наркотическими веществами. В 3 сериях экспериментов на 13 белых беспородных крысах проведен анализ импульсной активности 390 одиночных нейронов Raphe magnus nucleus (RMG) при высокочастотной стимуляции (ВЧС) Рeriaqueductal gray matter (PAG) в норме, на ротеноновой модели БП и с протекцией гидрокортизоном. На основе программного математического анализа усредненной степени частотной выраженности постстимульных депрессорных и возбудительных синаптических эффектов на модели БП выявлено резкое превышение тетанических и посттетанических возбудительных эффектов. При этом многократно уменьшилось количество нейронов, отвечающих аналогичными депрессорными cинаптическими реакциями, а с увеличением таковых – отвечающих возбудительными. Отмеченное является результатом чрезмерной возбудимости. В условиях воздействия гидрокортизона депрессорные синаптические реакции резко повысились со значительным повышением количества вовлеченных в них нейронов. Это является свидетельством нейтрализации возбудительных реакций, с естественным уменьшением последних. С учетом выявленного нами в предыдущих исследованиях протекторного назначения депрессонных реакций очевиден эффект гидрокортизона. Более того, на модели БП в нейронах RMG при ВЧС PAG показано выраженное (3- и 5-кратное) увеличение престимульной частоты активности, предшествующей депрессорным постстимульным синаптическим эффектам. В условиях протекции гидрокортизоном получено значительное (7- и 9-кратное и более) снижение частоты престимульной импульсной активности, предшествующей возбудительным постстимульным проявлениям активности, что явно свидетельствует в пользу протекции. Постстимульная частота активности нейронов RMG, на модели БП, сопровождаемая возбудительными синаптическими эффектами намного (7- и 5-кратно и более) превысила норму, что также свидетельствует о громадном повышении возбудимости нейронов. В условиях протекции произошло мощное (18.3- и 17.7-кратное) снижение постстимульной частоты импульсной активности нейронов RMG на модели БП, сопровождаемой возбудительными постстимульными эффектами. Следует полагать успешный протекторный эффект гидрокортизона.
Понимание эволюции механизмов и поведения, важных для боли, начинает появляться в результате широкомасштабных исследований клеточных механизмов и поведенческих реакций, связанных с активацией ноцицепторов и повреждением тканей, воспалением и экологическим контекстом этих реакций у различных видов, в особенности у грызунов и людей [1]. В последние годы механизмам боли при нейродегенеративных болезнях (НБ) начали уделять серьезное внимание [2], в то время как терапевтическая стратегия ограничивается симптоматическими средствами без оценки механизмов [3]. Механизм боли продолжает оставаться сложным и связанным с патологическими изменениями в структурах мозга, вовлекаемых в ноцицептивные механизмы. Необходимо дальнейшее серьезное изучение механизмов ее формирования для организации доступной терапевтической стратегии [4]. Болезнь Паркинсона (БП), будучи прогрессирующей нейродегенеративной болезнью, затрагивает болевой процесс на многих уровнях, от периферических структур до высших центров [4]. Некоторые из этих структур рано поражаются при БП, как, например, большое ядро шва (raphe magnus nucleus –RMG), участок эндогенной болевой тормозной системы в ростро-вентральном продолговатом мозге [5]. RMG следует отметить среди структур, играющих важную роль в модуляции спинальной ноцицептивной передачи, наряду с околоводопроводным серым веществом (Periaqueductal gray matter – PAG) и голубым пятном (Locus Coeruleus – LC). К тому же RMG воспринимает проекции от PAG [6]. Эти структуры участвуют в нисходящей регуляции анти-ноцицептивных путей путем торможения ноцицептивных стимулов от нейронов дорзального рога [7, 8]. Нарушение в этих тормозящих боль структурах, как правило, вызывает более выраженное ощущение боли [9, 6].
В данной работе исследовали клеточные механизмы активации ноцицепторов на примере соотношения возбудительных и депрессорных синаптических ответов одиночных нейронов RMG при стимуляции PAG, с целью оценки механизмов их поражения на модели болезни Паркинсона, индуцированной односторонним введением ротенона и в условиях протекции гирдрокортизоном.
МЕТОДЫ ИССЛЕДОВАНИЯ
Проведены электрофизиологические исследования на 13 белых беспородных крысах (230±30 г): интактных (n = 3), на ротеноновой модели БП, индуцированной унилатеральным введенем ротенона, и выдержанных до опыта 4 нед (n = 4), и в условиях протекции гидрокортизоном (по 14 инъекций через день в дозе 1.25 мг/кг, 0.1%) (n = 6). Введение ротенона осуществляли в условиях нембуталового наркоза (40 мг/кг, в/б) из расчета 12 мкг в 0.5 мкл Димексида (со скоростью 1 мкл/мин) в “medial forebrain bundle” по координатам стереотаксического атласа [10] (AP+0.2; L±1.8; DV+8 мм). Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями руководства ARRIVE [11]. В стереотаксическом аппарате производили трепанацию черепа от брегмы до лямбды и вскрывали твердую мозговую оболочку. Стеклянные микроэлектроды с диаметром кончика 1–2 мкм, заполненные 2M NaCl, вводили в RMG согласно стереотаксическим координатам (AP-11.6; L+0.2; DV+10.3 мм) для экстраклеточной регистрации спайковой активности одиночных нейронов (рис. 1). Осуществляли высокочастотную стимуляцию (ВЧС) PAG вольфрамовыми электродами посредством прямоугольных толчков тока длительностью – 0.05 мс, амплитудой 0.12–0.18 мВ, силой тока 0.32 мА и частотой 100 Гц в течение 1 с, согласно стереотаксическим координатам (AP-4.92; L+0.3; DV+5.7 мм). Операции осуществляли на наркотизированных животных (уретан 1.2 г/кг в/б), зафиксированных в стереотаксическом аппарате.
Рис. 1.
Схема эксперимента по раздражению PAG и отведению из RMG. Стереотаксическое изображение пункта отведения нейронной активности – (a), зоны стимуляции – (b) и характерного потенциала действия – (c).

Активность проявлялась в виде тетанической потенциации (ТП) и депрессии (ТД) с последующей посттетанической потенциацией (ПТП) и депрессией (ПТД) различной латентности, выраженности и длительности. Проводили программный математический анализ одиночной спайковой активности 390 нейронов. Пре- и постстимульные проявления активности, а также значения фоновой импульсной активности оценивали оn-line регистрацией и программным математическим анализом, позволяющим селекцию спайков амплитудной дискриминацией с выводом “растеров” перистимульного спайкинга нейронов, построением гистограмм суммы и диаграмм усредненной частоты спайков. Производили далее многоуровневую статистическую обработку в отдельности для пре- и постстимульного отрезков времени и периода ВЧС. Для сравниваемых групп спайкинга нейрональной активности, а также произвольно выбранных измерений в отдельном нейроне, строили суммированные и усредненные перистимульные (РЕТН Average) гистограммы и гистограммы частоты (Frequency Average) с вычислением средней частоты спайков. Однородность двух независимых выборок контролировалась t-критерием Стьюдента. С целью повышения статистической достоверности перистимульных изменений межспайковых интервалов использовали также непараметрический двухвыборочный критерий Манна–Уитни Вилкоксона (Wilcoxon–Mann–Whitney test) [12], оценивающий однородность двух независимых выборок. Так как число регистрируемых спайков было достаточно велико (до нескольких сотен спайков за 10–20-секундный интервал после действия стимула), использовалась разновидность указанного теста – z-тест, определяющий его асимптотическую нормальность. Учет критических значений в сравнении с таковыми нормального распределения при уровнях значимости 0.05, 0.01 и 0.001 (для различных испытаний) показывает, что в большинстве случаев спайкинга нейрональной активности при ВЧС статистически значимое изменение достигало как минимум уровня 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Производили экстраклеточную регистрацию спайковой активности одиночных нейронов RMG в норме (122 нейрона, n = 3), на модели БП (149 нейронов, n = 4) и с протекцией гидрокортизоном (119 нейронов, n = 6). Посредством анализа на основе усредненного количества спайков (PETH), с пересчетом в межимпульсные интервалы и частоты в Гц (Frequency Average), были обнаружены cледующие изменения нейрональной активности.
В нейронах RMG в ответ на ВЧС PAG тетаническая депрессия в обеих последовательностях (ТД ПТД и ТД ПТП) в норме определялась порядка 1.66- и 2.0-кратного занижения престимульной активности соответственно (рис. 2a, группы А, B). Тетаническая потенциация, сопровождаемая посттетанической потенциацией и депрессией (ТП ПТП и ТП ПТД), выявлялась в пределах 1.1- и 1.14-кратного превышения престимульной активности (рис. 2b, группы А, B). В нейронах RMG при ВЧС PAG тетаническая депрессия на модели БП определялась в пределах 1.8- и 2.0-кратного снижения престимульной активности в обеих последовательностях соответственно (рис. 2c, группы А, B), а тетаническая потенциация исчислялась порядка 3.33- и 2.66-кратного превышения престимульной активности в обеих последовательностях (рис. 2d, группы А, B). Что же касается депрессорных постстимульных проявлений активности нейронов RMG при ВЧС PAG, то при наличии почти одинаковых значений, в сравнении с нормой, общее количество нейронов, сопровождаемых депрессорными реакциями, на ротеноновой модели многократно уменьшилось. Очевидно чрезмерное синаптическое возбуждение, содействующее повышению частоты пре- и постстимульной активности в обеих последовательностях, характерное для нейродегенеративного поражения RMG. Наконец, в нейронах RMG при ВЧС PAG, в условиях воздействия гидрокортизона, ТД в обеих депрессорных последовательностях достигала, соответственно, 10.5- и 13.0-кратного снижения престимульной активности (рис. 2e, группы А, B), а ТП в соответствующих возбудительных постстимульных последовательностях исчислялась порядка лишь 3.0- и 1.25-кратного превышения престимульной активности (рис. 1f, группы А, B).
Рис. 2.
Усредненные перистимульные (РЕТН Average) гистограммы и гистограммы частоты (Frequency Average) депрессорных, депрессорно-возбудительных (a, c, e, Группы А, B) и возбудительных, возбудительно-депрессорных постстимульных проявлений активности нейронов RMG (b, d, f, Группы А, B) при ВЧС (100 Гц, 1 с) PAG в норме. (a, b), на модели БП (c, d) и в условиях воздействия гидрокортизона (e, f). Для групп указано количество испытаний (n).

Иными словами, при фактическом отсутствии разницы в постстимульных депрессорных реакциях, в нейронах RMG между нормой и патологией (1.66 и 2.0 против 1.8 и 2.0), резкий сдвиг имел место в постстимульных проявлениях активности (1.10 и 1.14 против 3.33 и 2.66), в то время как после воздействия гидрокортизона депрессорные реакции резко повышались в сравнении с БП (10.5 и 13.0 против 1.8 и 2.0). К тому же количество эффектов, вовлеченных в депрессорные реакции, также значительно повысилось в условиях протекции, достигнув 56 и 53. Очевиден протекторный эффект гидрокортизона с успешной нейтрализацией таковых возбудительных – 67 и 65, с естественным уменьшением количества последних до 5 и 5 (рис. 2d, f, группы А, B).
При оценке относительной степени выраженности вышеотмеченных депрессорных и возбудительных постстимульных эффектов, на примере диаграмм усредненной частоты спайков, выведенных на основе растеров пре- и постстимульных депрессорных, депрессорно-возбудительных, возбудительных и возбудительно-депрессорных проявлений спайковой активности нейронов в норме, на модели БП, и в условиях протекции, с указанием средних цифровых значений в реальном времени 20 сек до и после стимуляции, включая время ВЧС, получены дисковые диаграммы для более наглядного представления степени выраженности в частотном отображении (и в %) экспериментальных данных на рис. 6 (на основе рис. 3–5), которые привели к следующему выводу. Значения тетанической депрессии в депрессорной и депрессорно-возбудительной последовательности и уровни тетанической потенциации в возбудительной и возбудительно-депрессорной последовательности нейронов RMG на ВЧС PAG в норме достигали 1.51- и 1.40-кратного снижения (рис. 3, 4; 6 части a, b), 1.30- и 1.29-кратного превышения (рис. 3, 4; 6 части c, d), в сравнении с престимульным уровнем активности соответственно. Как видно, указанные значения отличались незначительно, что свидетельствует о фактическом балансе депрессорных и возбудительных постстимульных проявлений активности исследуемых нейронов. Значения тетанической депрессии в депрессорной и депрессорно-возбудительной последовательности и уровни тетанической потенциации в возбудительной и возбудительно-депрессорной последовательности нейронов RMG на ВЧС PAG, в сравнении с престимульным уровнем активности на модели БП, отличались достаточно (2.00- и 1.31- против 3.12- и 2.54-кратного, для депрессорных и возбудительных эффектов соответственно) (рис. 3, 4; 6 части a–d), что указывает на превалирование возбудительных постстимульных проявлений активности над депрессорными (порядка 1.56- и 2.0-кратного. Наконец, в нейронах RMG при ВЧС PAG значения тетанической депрессии в депрессорной и депрессорно-возбудительной последовательности и уровни тетанической потенциации в возбудительной и возбудительно-депрессорной последовательности, в сравнении с престимульным уровнем активности на модели БП в условиях протекции, исчислялись в пределах 5.06- и 8.96-кратного занижения и 1.39- и 1.29-кратного превышения престимульной активности (рис. 5; 6 части a–d). Иными словами, с учетом лишь кратности измерений сравнительных показателей указанных постстимульных эффектов в патологии, в сравнении с таковыми в условиях протекции, в депрессорной последовательности имело место увеличение тетанической депрессии (5.06 и 8.96 против 2.0 и 1.31 на модели БП, т.е. 2.53 и 6.84-кратно и против 1.51 и 1.40 в норме, т.е. 3.35 и 6.40-кратно), и уменьшение тетанической потенциации в возбудительной и в возбудительно-депрессорной последовательности (1.39 и 1.29 на модели БП с протекцией, против 3.12 и 2.54-кратного на модели БП без протекции, т.е. 2.24- и 2.07-кратно) и с приближением к норме (1.39 и 1.29 против 1.30 и 1.28-кратного).
Рис. 3.
Гистограммы суммы спайков пре- и постстимульных тетанических депрессорных проявлений активности ТД ПТД (a), в сочетании с посттетаническими возбудительными – ТД ПТП (b), возбудительных – ТП ПТП (c), сопровождаемых депрессорными (d), нейронов RMG, вызванных на ВЧС PAG в норме, в реальном времени 20 сек (до и после стимуляции). Растеры активности – детальный анализ произвольно избранных одиночных нейронов из данной группы. Диаграммы частоты спайков, представленных в гистограммах, с усредненными значениями (М) для временных отрезков до (BE – before event), на время тетанизации (TT – time tetanization) и после стимуляции (PE – post event). Справа от диаграмм – количество испытаний (n).
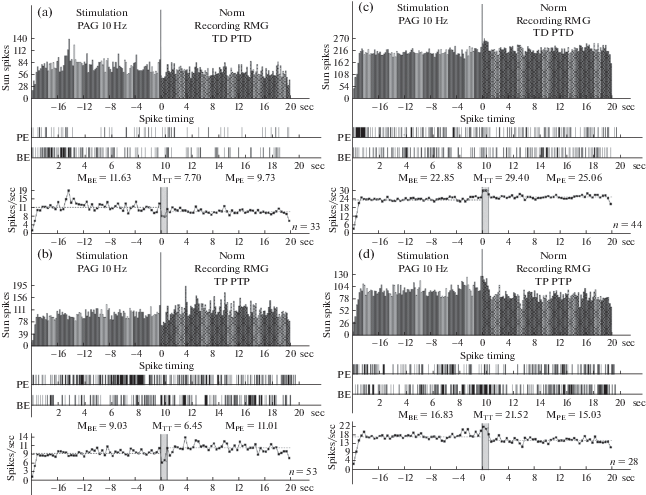
Рис. 4.
Гистограммы суммы спайков пре- и постстимульных тетанических депрессорных проявлений активности ТД ПТД (a), в сочетании с посттетаническими возбудительными – ТД ПТП (b), возбудительных – ТП ПТП (c), сопровождаемых депрессорными (d), нейронов RMG, вызванных на ВЧС PAG на модели БП, в реальном времени 20 сек (до и после стимуляции). Растеры активности на a–d– детальный анализ произвольно избранных одиночных нейронов из данной группы. Справа от диаграмм – количество испытаний (n).
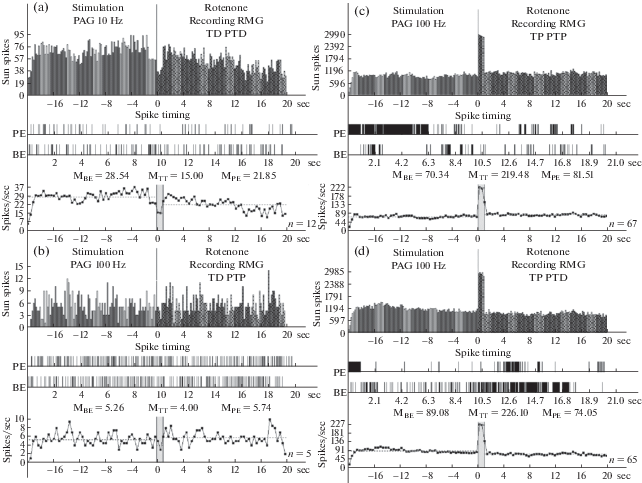
Рис. 5.
Гистограммы суммы спайков пре- и постстимульных тетанических депрессорных проявлений активности ТД ПТД (a), в сочетании с посттетаническими возбудительными – ТД ПТП (b), возбудительных – ТП ПТП (c), сопровождаемых депрессорными (d), нейронов RMG, вызванных при ВЧС PAG на модели БП в условиях протекции гидрокортизоном, в реальном времени 20 сек (до и после стимуляции). Растеры активности на a–d – детальный анализ произвольно избранных одиночных нейронов из данной группы. Справа от диаграмм – количество испытаний (n).
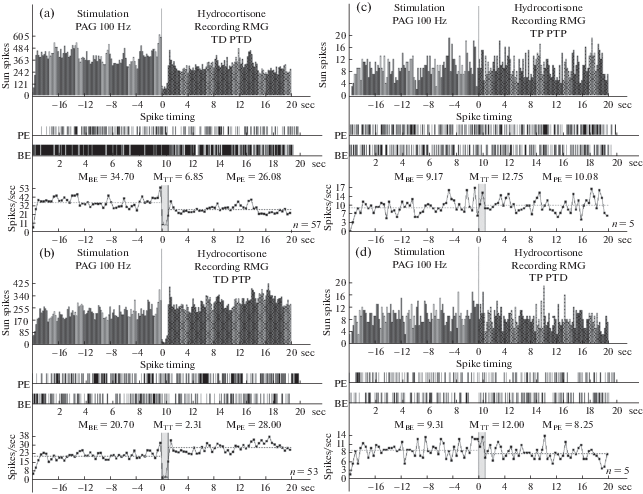
Рис. 6.
Процентное и цифровое соотношение степени выраженности (по усредненной частоте) (a–d), депрессорных (ТД ПТД), депрессорно-возбудительных возбудительных (ТД ПТП), возбудительных (ТП ПТП) и возбудительно-депрессорных (ТП ПТД) постстимульных эффектов в одиночных нейронах RMG при ВЧС PAG, а также частоты престимульной (e–h) и постимульной (i–l) активности, предшествуемых и сопровождаемых указанными проявлениями постстимульной активации, в норме, на ротеноновой модели БП и в условиях протекции гидрокортизоном.
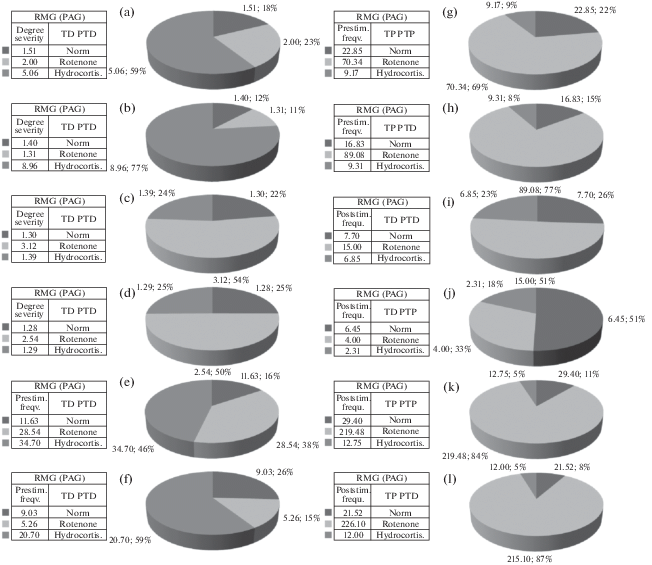
Интересная картина была обнаружена при сравнении частоты пре- и постстимульной активности нейронов RMG при ВЧС PAG в указанных экспериментальных условиях. Престимульная частота активности, предшествующая депрессорным эффектам в норме и на модели БП, достигала кратных значениий 11.63, 9.03 и 28.54, 5.26 соответственно, а предшествуемая возбудительными последовательностями в норме и патологии 22.85, 16.83 и 70.34, 89.08 соответственно (рис. 3, 4; 6e–h). Престимульная частота активности в нейронах RMG, предшествующая депрессорным и возбудительным последовательностям в условиях протекции, исчислялась в пределах 34.70, 20.70, 9.17 и 9.31, соответственно, по сравнению с 11.63, 9.03, 22.85, 16.83 в норме и 28.54, 5.26, 70.34, 89.08 в патологии без протекции (рис. 3–5; 6e–h).
Иными словами, в патологии, по сравнению с нормой, престимульная частота активности, предшествующая депрессорным постстимульным эффектам, повысилась и понизилась 2.45- и 1.71-кратно, а таковая частота активности, предшествующая возбудительным, в обеих случаях повысилась и более значительно (3.07- и 5.30-кратно). В условиях протекции, в сравнении с патологией, имело место очевидное превышение престимульной частоты, предшествующей депрессорным постстимульным проявлениям активности, в пределах 1.21- и 4.03-кратного, а таковая предшествующая возбудительным претерпела значительное снижение порядка 7.67 и 9.57 соответственно, что явно свидетельствует в пользу протекции, более чем успешно справляющейся с чрезмерно повышенной токсической синаптической возбудимостью.
Что же касается постстимульной частоты активности нейронов RMG, то в норме, будучи сопровождаемой депрессорными и возбудительными постстимульными эффектами, она достигала 7.70, 6.45, 29.40 и 21.52, а на модели БП – 15.0, 4.0, 219.48 и 226.10 (рис. 3, 4; 6i–l). Иными словами, на модели БП частоты активности нейронов RMG, сопровождаемая депрессорными реакциями, превысила норму 2.05-кратно и снизилась 1.61-кратно, соответственно, и намного превысилась порядка 7.46- и 10.50-кратно, сопровождаемая возбудительными эффектами. Таким образом, имело место мощное повышение частоты постстимульной активности, свидетельствующее опять, как и в случае престимульной частоты, о чрезмерном синаптическом возбуждении (рис. 3, 4; 6i–l). Наконец, в условиях протекции произошло фактическое приближение депрессорной постстимульной активности к норме (6.85 против 7.70, 2.31 против 6.45) и резкое снижение постстимульной частоты на модели БП, сопровождаемой возбудительными эффектами (12.75 против 219.48 и 12.00 против 226.10, т.е. 17.21- и 18.84-кратно), с приближением к норме (29.40 и 21.52), что свидетельствует об успешном протекторном эффекте гидрокортизона (рис. 3–5; 6i–l).
Несмотря на интенсивные исследования путей, передающих боль, недостаточно внимания уделялось тем из них, которые участвуют в восприятии боли и ее модуляции, т.е. антиноцицептивным, важным компонентом которых являются RMG и PAG. Необходима оценка механизмов боли [3, 4]. Интерес к изучению соотношения возбудительных и депрессорных (тормозных) синаптических процессов в отмеченных антиноцицептивных структурах в норме диктуется необходимостью оценки их поражения в условиях НБ, что в настоящее время весьма актуально, поскольку нет доступной терапевтической стратегии для подавления нестерпимой хронической боли, в частности при БП, в которой среди самых частых немоторных сенсорных отклонений ей принадлежит особое место [4]. Что касается клеточно-молекулярных механизмов повреждений, вызываемых ротеноном, и связи этих нарушений с патологическими изменениями, развивающимися при БП, то следует отметить следующее. Ротенон, на основании которого получена нами модель БП и которому повящено настоящее исследование, содействует дегенерации нигростриатного дофаминергического пути, избирательному окислительному повреждению стриатного тела и образованию убиквитин- и α-синуклеин позитивных включений в нигральных клетках, которые сходны с тельцами Леви при БП [13]. К тому же ротеноном индуцированная модель воспроизводит большинство патогенетических механизмов БП, в том числе, формирование нейрональных включений и окислительный стресс [14, 15]. Наконец, на ротеноновой модели получены расстройства, нарушения в эмоционально-чувственной сфере, которые, как известно, являются важнейшими немоторными проявлениями БП [14]. Вместе с LC, RMG, вовлекается в аффективное и когнитивно-оценочное измерение боли, болевую память и автономные ответы [4]. Хотя точные патогенетические механизмы, приводящие к гибели клеток при БП, не вполне понятны, известен ряд факторов, включающих митохондриальную дисфункцию, окислительный стресс, эксайтотоксичность, дисфункцию убиквитин-протеасомного пути и апоптоз. В отличие от других моделей, ротенон воспроизводит большинство симптомов расстройства движений и гистопатологические особенности БП (в частности, образования телец Леви) и является мощным ингибитором митохондриального дыхания, а последние эпидемиологические исследования показали важную роль ротенона и других пестицидов в развитии спорадического паркинсонизма у населения сельской местности [16]. Согласно другим данным, при системном введении лишь около 20% введенного ротенона попадает в головной мозг, а 80% обусловливает периферическую токсичность внутренних органов крыс [17]. Но токсическое действие на внутренние органы исчезает при стереотаксическом введении ротенона [18], что собственно и было использовано в настоящем исследовании. В заключение, ротеноновые модели на крысах являются моделями, наиболее приближенными к патогенезу болезни БП у человека, в отличие от других нейротоксических моделей, что важно в эволюционном аспекте возможности оценки патологических отклонений и протекции, тождественных для животных и людей [1]. Как было отмечено выше, из ротеноновых моделей in vivo наиболее адекватными являются модели со стереотаксическим и интрацеребральным введением ротенона в черное вещество среднего мозга, что собственно и было использовано в настоящем исследовании. Таким образом, на модели БП выявлено мощное превышение возбудимости постстимульных синаптических процессов в RMG при ВЧС PAG, являющееся неизбежным результатом БП. Следует полагать ее аналог эксайтотоксичности при НБ, возникающей в качестве компенсаторной реакции на снижение возбуждения в результате гибели нейронов, повреждающей их сверхактивацией глутаматных NMDA- и AMPA-рецепторов [19], тем самым вызывая апопотоз нейронов и последующую гибель [20, 21]. В целом эксайтотоксичность сопровождается нарушением кальциевой буферизации, генерацией свободных радикалов, активацией митохондриальной проницаемости и вторичной эксайтотоксичностью [22]. Отмеченное, согласно нашему предыдущему сообщению, свидетельствует о необходимости углубления, в условиях нейродегенерации, депрессорных эффектов, несущих протекторную нагрузку и снижающих чрезмерные возбудительные реакции [23].
Список литературы
(2019) Evolution of mechanisms and behaviour important for pain. Phil. Trans R Soc B 374 (1785): 20190275. https://doi.org/10.1098/rstb.2019.0275
Broen MPG, Braaksma MM, Patijn N, Weber WEJ (2012) Prevalence of pain in Parkinson’s disease: a systematic J. review using the modified QUADAS tool. Movement Disorders 27 (4): 480–484. https://doi.org/10.1002/mds.24054
de Tommaso M, Arendt-Nielsen L, Defrin R (2016) Pain in Neurodegenerative Disease: Current Knowledge and Future Perspectives. Behav Neurol 2016 (1): 1–14. https://doi.org/10.1155/2016/7576292
Ramiro-González M, Fernández-de-las-Peñas C (2013) Pain in Parkinson disease: A review of the literature. Parkinsonism & Related Disorders 19 (3): 285–294. https://doi.org/10.1016/j.parkreldis.2012.11.009
Millan MJ (2002) Descending control of pain. Prog Neurobiol. 66: 355–474. https://doi.org/10.1016/s0301-0082(02)00009-6
Hornung J-P (2012) In The Human Nervous System (Third Edition).
Kuraishi Y, Fukui K, Shiomi H (1978) Microinjection of opioids into the nucleus reticularis gigantocellularis of the rat: analgesia and increase in the normetanephrine level in the spinal cord. Biochem Pharmacol 27: 2756–2758. https://doi.org/10.1016/0006-2952(78)90054-0
Gebhart GF (2004) Descending modulation of pain Neurosci Biobehav Rev. 27: 729–737. https://doi.org/10.1016/j.neubiorev.2003.11.008
Scherder E, Wolters E, Polman C (2005) Pain in Parkinson’s disease and multiple sclerosis: its relation to the medial and lateral pain systems. Neurosci Biobehav Rev 29: 1047–1105. https://doi.org/10.1016/j.neubiorev.2005.03.001
Paxinos G, Watson C (2005) The rat brain in stereotaxic coordinates. Elsevier, Academic Press, 5th ed.
Kilkenny C, Browne W, Cuthill IC, Emerson M, Alt-man DG (2010) Animal research: Reporting in vivo experiments: The ARRIVE guidelines 06 July. https. doi.org/https://doi.org/10.1371/journal.pbio.1000412
Орлов АИ (2004) Прикладная статистика. [Orlov AI (2004) Prikladnaya statistika (In Russ)].
Schmidt W, Alam MJ (2006) Controversies on new animal models of Parkinson’s disease pro and con: the rotenone model of Parkinson’s disease (PD). J Neural Transmis Suppl 70: 273–276.
Hoglinger GU, Oertel WH, Hirsch EC (2006) The rotenone model of parkinsonism – the five years inspection. J Neural Transmis Suppl 70: 269–723.
Воронков ДН, Худоерков РМ, Доведова ЕЛ (2013) Изменения нейроглиального взаимодействия в нигростриатных структурах мозга при моделировании дисфункции дофаминовой системы. Журн неврол и психиатрии им. C.C. Корсакова 113 (7): 47–55 [Voronkov DN, Hudoerkov RM, Dovedova EL (2013) Izmeneniya nejroglial’nogo vzaimodejstviya v nigrostriatnyh strukturah mozga pri modelirovanii disfunkcii dofaminovoj sistemy. ZHurnal nevrologii i psihiatrii im. C.C. Korsakova 113 (7): 47–55 (In Russ)]
Panov A, Dikalov S, Shalbuyeva N (2005) Rotenone Model of Parkinson Disease. Multiple brain mitochondria dysfunctions after short term systemic rotenone intoxication. J Biol Chem 280 (51): 42026–44203. https://doi.org/10.1074/jbc.M508628200
Lapointe N, St-Hilaire M, Martinoli M-G (2004) Rotenone induces nonspecific central nervous system and systemic toxicity. FASEB J 18: 717–719. https://doi.org/10.1096/fj.03-0677fje
Xiong N, Huang J, Zhang Z (2009) Stereotaxical Infusion of Rotenone: A Reliable Rodent Model for Parkinson’s Disease. PLoS ONE. 4 (11): 1–11. https://doi.org/10.1371/journal.pone.000787
Matthew RH, Heather LS, Peter RD (2004) Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease. NCI. 45 (5): 583–595. https://doi.org/10.1016/j.neuint.2004.03.007
Lucas DR, Newhouse JP (1957) The toxic effect of sodium L-glutamate on the inner layers of the retina. AMA Arch Ophthalmol 58 (2): 193–201. https://doi.org/10.1001/archopht.1957.00940010205006
Olney JW (1969) Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate. Science 164 (3880): 719–721. https://doi.org/10.1126/science.164.3880.719
Xiao-xia D, Yang W, Zheng-hong Q (2009) Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmacol Sinica 30: 379–387.
Саркисян ДжС, Погосян МВ, Даниелян МА, Степанян АЮ, Варданян АВ (2018) Назначение депрессорных синаптических процессов в условиях специфической нейродегенеративной патологии и протекции. LAP LAMBERT Academic Publishing RU. 2018. [Sarkissian JS, Poghosyan MV, Danielyan MA, Stepanyan HY, Vardanyan AV (2018) The assign of depressor synaptic processes in condition of specific neurodegenerative pathology and protection. LAP LAMBERT Academic Publishing RU (In Russ.].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


