Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 3-23
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КЛЕТКАХ ПЕРИНЕВРИЯ: ОСОБЕННОСТИ ПРОИСХОЖДЕНИЯ, СТРУКТУРА И ФУНКЦИИ
Е. С. Петрова 1, *, Е. А. Колос 1
1 Федеральное государственное бюджетное научное учреждение “Институт экспериментальной медицины”
Санкт-Петербург, Россия
* E-mail: iempes@yandex.ru
Поступила в редакцию 23.10.2021
После доработки 11.11.2021
Принята к публикации 11.11.2021
- EDN: RVABGG
- DOI: 10.31857/S0044452922010053
Аннотация
Целью настоящей обзорной статьи явилось обобщение современных представлений о клетках одной из оболочек периферического нерва – периневрия. Актуальность темы связана с недостатком фундаментальных знаний об участии этих клеток в восстановлении поврежденных нервных проводников, а также с необходимостью выяснения молекулярных механизмов стимуляции регенерации нервов после повреждений. В обзоре представлены данные последних лет о морфофункциональных особенностях периневрия, о происхождении клеток периневрия в фило- и онтогенезе, о молекулярных особенностях регуляции гемато-неврального барьера. Подчеркивается уникальность онтогенетического происхождения периневрия. Дана характеристика иммуногистохимических маркеров, используемых для идентификации клеток периневрия. Описаны особенности периневрия спинномозговых ганглиев и корешков спинного мозга.
Периневрий является одной из оболочек нерва и состоит из клеток, обладающих рядом морфофункциональных особенностей, отличающих его от других структур в организме животных и человека. Актуальность исследования клеток периневрия связана с недостатком фундаментальных знаний об их участии в восстановлении поврежденных нервных проводников, а также с необходимостью выяснения молекулярных механизмов стимуляции регенерации нервов после повреждений. Несмотря на высокую способность периферических нервных волокон к регенерации, полного функционального восстановления нерва после травмы с помощью разработанных хирургических способов не всегда удается достичь [1, 2]. Успешность применяемых в клинической практике методов нейропластики и шовной техники зависит от степени поврежденности нервного проводника. В настоящее время активно ведется поиск новых методов оценки степени поражения нервных проводников и способов стимуляции их регенерации [1–5]. Для разработки и совершенствования этих способов необходимо изучение молекулярных механизмов, которые регулируют репаративные процессы в поврежденном нерве, и взаимоотношения клеток, обеспечивающих эндоневральный гомеостаз и функционирование гемато-неврального барьера.
Исследования морфофункциональных особенностей нервов в норме и после повреждения проводятся в течение многих десятилетий, начиная с классических работ английского гистолога Августа Валлера (1816–1870) и испанского нейробиолога Сантьяго Рамон-и-Кахаля (1852–1934). Результаты исследований последних лет, выполненные с применением иммуногистохимических методов, электронной, конфокальной и флуоресцентной микроскопии, вестерн-блота, ПЦР и др., обобщены в ряде монографий и обзоров [2, 6–12]. Особое внимание в современных работах уделяется глиальным элементам ПНС – шванновским клеткам (ШК) [8, 11, 13, 14]. Менее изученными остаются другие клеточные элементы нерва, в частности, периневральные клетки, которые, наряду со ШК, участвуют в создании необходимого для роста и регенерации аксонов микроокружения. Обобщение имеющихся в современной научной литературе данных о клетках периневрия, их происхождении в фило- и онтогенезе, реакции на повреждение и их регенеративного потенциала явилось целью настоящего обзора.
ОБОЛОЧКИ НЕРВА
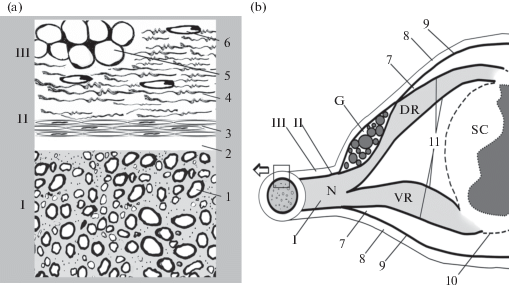
Оболочки, создающие микроокружение, обеспечивающее нормальное функционирование нервного волокна (эпиневрий, периневрий и эндоневрий), описаны еще в девятнадцатом веке. Они являются продолжением твердой, паутинной и мягкой мозговых оболочек соответственно [15, 16]. В современных зарубежных исследованиях их порой называют не оболочками, а частями или слоями нервных проводников [17]. Термин “оболочки” объясняет тонкую структуру нерва (рис. 1а). Отдельные нервные волокна, окруженные шванновскими клетками, находятся в эндоневрии. Среди них имеются миелиновые и немиелиновые волокна. Пучки таких волокон окружает периневральная оболочка. Нервный ствол, состоящий из нескольких пучков нервных волокон, с внешней стороны окружен эпиневрием [7, 9, 10].
Рис. 1.
Схема оболочек нерва (а) и спинномозговых корешков (b). I – эндоневрий; II – периневрий; III – эпиневний; 1 – нервное волокно; 2 – субпериневральное пространство; 3 – базальная мембрана; 4 – коллагеновое волокно; 5 – жировая клетка; 6 – кровеносный сосуд; 7 – субарахноидальный угол; 8 – твердая мозговая оболочка; 9 – паутинная мозговая оболочка; 10 – мягкая мозговая оболочка; 11 – оболочки корешков; SC – спинной мозг; G – спинномозговой ганглий; DR – дорзальный корешок; VR – вентральный корешок; N – нерв. Модификация схем [46, 49] c использованием собственных препаратов.
Эндоневрий содержит помимо нервных волокон, шванновских клеток, капилляров и отдельных артериол с небольшим числом перицитов, тучные клетки, резидентные макрофаги, фибробласты и коллагеновые волокна, состоящие из коллагена I и III типов, которые продуцируются фибробластами и шванновскими клетками [18]. Кровеносные сосуды проникают в эндоневрий из эпиневральной внешней оболочки через периневрий, обретая окружение из слоя периневральных клеток [15]. Механическую прочность нервного ствола обеспечивают коллагеновые волокна. Процентное соотношение клеток эндоневрия таково: 10% составляют фибробласты, 2–9% – макрофаги, небольшое количество тучных клеток, остальные клетки относятся к периферической глии – миелинизирующим и немиелинизирующим ШК [18]. Сосуды эндоневрия в большинстве своем не иннервируются. Важно отметить, что эндотелиальные клетки сосудов эндоневрия соединяются между собой плотными контактами и участвуют, наряду с клетками периневрия, в формировании специфического гемато-неврального барьера [9, 19].
Эпиневрий является наружной соединительнотканной оболочкой нервного ствола и содержит фибробласты, тучные клетки, жировую клетчатку, большое количество коллагеновых (коллаген 1 типа) и эластических волокон, кровеносные и лимфатические сосуды [9, 20]. На всем протяжении нерва эпиневрий имеет различную толщину, так как жировая клетчатка, входящая в его состав, наблюдается в определенных участках в виде островков, а не сплошным слоем по всей длине. Жировая ткань защищает нервные пучки от сдавливания. Показано, что уменьшение количества жировой клетчатки в эпиневрии при общем истощении приводит к развитию параличей [18]. Эпиневральная оболочка позволяет нерву сохранять некоторую подвижность, удлиняться и укорачиваться в незначительной степени. Кровеносные сосуды эпиневрия являются достаточно проницаемыми. Разного диаметра эпиневральные артериальные и венозные сосуды образуют анастомозы, формируя сосудистую сеть, которая связана с крупными артериями и венами, проходящими вдоль нервного ствола. Сосуды эпиневрия богато иннервируются: cимпатические адренергические и пептидергические нервные терминали обеспечивают их тонус, сужение и расширение [9]. В иннервации оболочек нерва участвуют тонкие немиелинизированные аксоны, выходящие из эндоневрия нервного ствола (nervi nervorum) [9, 21]. В эпиневрии присутствуют несвязанные с сосудами nervi nervorum, выявляемые с помощью иммуногистохимических реакций на кальцитонин (CGRP) и периферин [21]. Лимфатические сосуды эпиневрия имеют связь с регионарными лимфатическими узлами. Следует отметить, что лимфатические сосуды имеются только в эпиневрии, в других структурах нерва они отсутствуют [9, 18]. Проникая сквозь периневральную оболочку, сосуды эпиневрия формируют сосудистую сеть внутренней оболочки нервного ствола – эндоневрия.
Сложные нервы, состоящие из чувствительных и двигательных волокон и связанные с большой зоной иннервации, по поверхности эпиневральной оболочки покрыты параневрием. Это соединительнотканная структура, располагающаяся между нервом и мышцами [22]. В его состав в большом количестве входят жировая клетчатка и коллагеновые волокна. В работах последних лет параневрий часто называют “циркумневрий” (circumneurium) [22]. Проблема изучения параневрия по ряду причин является очень актуальной и имеет высокую практическую значимость [22–25]. Во-первых, она связана с выяснением процессов, происходящих внутри и снаружи нервного ствола после хирургических вмешательств или интраневральных инъекций. Во врачебной практике важно изучать распространение местных анестетиков, используемых в анестезиологии, а также последствия непреднамеренных интраневральных инъекций [26]. Во-вторых, изменения, происходящие в параневрии, могут приводить к дегенеративным процессам в самом нервном стволе.
Все оболочки нерва и параневрий структурно и функционально связаны между собой. Средняя оболочка нервного ствола – периневрий, отличается рядом морфофункциональных особенностей, не свойственных другим оболочкам нерва.
ОСОБЕННОСТИ КЛЕТОК ПЕРИНЕВРИЯ
Первые светооптические исследования. Анализ результатов исследований строения нервных проводников и их оболочек, которые были выполнены в девятнадцатом веке и в более ранний период, приводится в ряде обзорных статей и монографий [17, 27–29]. Первые гистологические описания периневральной оболочки связаны с исследованиями нескольких ученых: немецким анатомом Фридрихом Густавом Якобом Генле (1809–1885), шведскими исследователями Эрнстом Акселем Генриком Кеем (1832–1901) и Магнусом Густавом Ретциусом (1842–1919) и французским гистологом Луи Антуаном Ранвье (1835–1922). В разные годы в литературе можно было встретить различные названия периневральной оболочки, например, “слой Генле”, “оболочка Ранвье”, “нейротелий”, “перилемма” и др. Ранвье, исследуя три оболочки нервных проводников, назвал их следующим образом: внутрипучковая ткань, ламинарная оболочка и перифасцикулярная ткань. Термины “эндо-, пери- и эпиневрий”, которые используются в нейробиологии по сегодняшний день, были введены Кеем и Ретциусом.
Исследования середины прошлого века, сделанные на нескольких видах позвоночных животных [15, 30], продемонстрировали, что периневральная оболочка окружает как общие нервные стволы, так и их отделы, нервные пучки периферических нервов. Было показано, что она состоит из уплощенных клеток, которые располагаются в несколько слоев. В те же годы было доказано, что оболочки нерва обладают барьерной функцией [27].
Периневральная оболочка нервов у разных животных имеет некоторые особенности. Она подробно изучена у рыб, находящихся на разных эволюционных уровнях: у хрящевых пластиножаберных (акула, Ginglymostoma cirratum) и у костных (Danio rerio). Установлено, что периневрий акулы состоит всего из трех слоев клеток [30]. У зебраданио (Danio rerio или Zebrafish) периневральная оболочка обнаруживает структурное сходство с периневрием млекопитающих. На зебраданио было показано, что в эмбриогенезе периневральные клетки-предшественники у личинок рыб мигрируют из вентрального отдела развивающегося спинного мозга [31, 32]. У земноводных, в частности, у лягушки в отличие от млекопитающих, для которых описано 4–5 слоев периневральных клеток [15], и человека, у которого число слоев составляет от 8 до 18 [10] (по некоторым данным – до двадцати), периневрий не является ламинарной структурой и состоит из двух слоев, окрашивающихся на гистологических препаратах по методу Маллори в разные цвета [27]. Морфология периневрия у птиц имеет сходство с периневрием у млекопитающих. Исследования седалищного нерва, проведенные на куриных эмбрионах и цыплятах, показали, что особенности периневрия, свойственные взрослой особи, формируется у цыплят в возрасте 10–20 сут [33]. Следует отметить, что в литературе отсутствуют работы, обобщающие данные об эволюционных закономерностях развития периневрия в филогенезе. Имеются лишь отдельные работы, посвященные сравнению структур параневрия (циркумневрия) у животных разных таксономических групп [24, 34].
Исследование ультраструктуры клеток периневрия. Более подробно структура периневральной оболочки у разных животных и человека была изучена с помощью применения электронной микроскопии и метода замораживания-скалывания [6, 7, 10, 18, 35]. Было установлено, что периневрий, окружающий нервный пучок, состоит из нескольких слоев уплощенных клеток, между которыми располагаются коллагеновые волокна соединительной ткани. Каждый слой представлен клетками полигональной формы, плотно связанными друг с другом специфическими контактами. Количество слоев периневральных клеток зависит от толщины пучка [17]. У человека в седалищном нерве число слоев периневральных клеток варьирует от 8 до 18 [10], а толщина периневральной оболочки достигает 20 мкм. Ламинарное строение периневрия, описанное ранее в работах, выполненных на светооптическом уровне, было подтверждено и детализировано в исследованиях, проведенных с применением электронной микроскопии. Было установлено, что каждый слой периневральных клеток с двух сторон окружен базальной мембраной. Между слоями периневральных клеток наряду с коллагеновыми (IV тип) волокнами (диаметром от 675 до 765 нанометров) присутствуют белки экстрацеллюлярного матрикса: фибронектин, ламинин, а также гликозаминогликаны [36, 37]. Ядра клеток периневрия, как правило, имеют уплощенную форму, как и сами клетки. Электронномикроскопические исследования периневральных клеток позволили выявить в их цитоплазме актин-содержащие структуры, имеющие сходство с актиновыми филаментами гладкомышечных клеток [18]. Функция этих структур в периневральных клетках не совсем ясна. Предположительно они обеспечивают сократительные свойства периневральной оболочки, служат для сохранения формы нервного пучка и позволяют ее менять при повреждении. Возможно также, что благодаря перистальтическим движениям клетки периневрия способствуют перемещению эндоневральной жидкости вдоль нервных пучков.
Между соседними периневральными клетками в пределах слоя базальные мембраны отсутствуют, клетки соединяются плотными контактами. Они образуются путем инвагинации выступов краевой части цитоплазмы соседних клеток, образуя связь по типу “замка” [7]. Исследования методом замораживания-скалывания продемонстрировали, что плотные контакты гораздо более распространены в периневрии, чем показывают исследования на ультратонких срезах [18]. Встречаются и редкие щелевые контакты, свидетельствующие о наличии активного диффузионного барьера. Показано, что такие контакты более характерны для ранних периодов онтогенеза, поэтому незрелые нервы оказываются более чувствительными к токсинам и инфекционным агентам [18]. Электронно-микроскопически во внешних слоях периневрия обнаруживаются интрацитоплазматические пиноцитозные везикулы и кавеолы [10, 18]. Периневральные клетки способны поглощать путем пиноцитоза и транспортировать из эндоневрального пространства различные вещества.
Между периневрием и эндоневрием располагается субпериневральное пространство, заполненное слабо базофильным гомогенным матриксом, в состав которого входят гликозаминогликаны [38]. В нем также содержатся тонкие коллагеновые волокна и кровеносные сосуды, участвующие в формировании эндоневрального кровеносного микроциркуляторного русла. Предположительно субпериневральное пространство обеспечивает гомеостаз и молекулярный транспорт [38].
Как отмечалось ранее, периневрий связан с паутинной (арахноидальной) оболочкой спинного мозга (СМ). По мере удаления нерва от оболочек спинного мозга в дистальном направлении увеличивается количество нервных пучков, и периневральная оболочка становится все тоньше. Ее окончание на дистальном конце зависит от типа волокна. В немиелинизированных волокнах периневрий исчезает в области нервных терминалей.
В миелиновых нервных волокнах эта оболочка заканчивается вблизи нервно-мышечных синапсов на расстоянии 1–1.5 мм [17]. Заканчиваясь вблизи нервных окончаний, периневрий постепенно изменяется. Он теряет базальные мембраны и плотные контакты, и нервные волокна оказываются окруженными только скоплением одиночных фибробластов.
В некоторых инкапсулированных сенсорных окончаниях периневральные клетки не исчезают, а входят в состав их капсул. Это характерно для телец Руффини и телец Фатера-Пачини, а также подобных им телец Тимофеева, которые встречаются в организме человека в поздний пренатальный и ранний постнатальный периоды [39]. Показано, что в инкапсулированных сенсорных окончаниях периневрий представлен сплошным внешним, но не внутренним слоем. Так, с помощью иммуногистохимического исследования доказано, что внешние слои капсулы тельца Пачини, действительно, являются производными периневральных клеток, тогда как клетки внутренних слоев экспрессируют белок S100+ и Leu-7+ и, следовательно, происходят из шванновских клеток [40].
Структура периневрия неоднородна. Pinã-Oviedo и Ortiz-Hidalgo [17] выделяют в нем три зоны: внутреннюю зону, которая отделена от эндоневрия субпериневральным пространством и образована одним слоем периневральных клеток, для которых характерны межклеточные соединения – интердигитации и плотные контакты; промежуточную зону, состоящую из нескольких слоев клеток (их количество зависит от размера нервного пучка, и колеблется от 3 до 15 концентрических слоев (шириной от 5 до 20 мкм)) и внешнюю зону, переходную между периневрием и эпиневрием. Третья зона имеет не слоистую структуру, а состоит из нескольких широких пучков коллагена, сходных с пучками коллагена в эпиневрии [17]. В современной отечественной гистологической номенклатуре выделены две части периневрия: “эпителиоидная часть (pars epitheloidea)” и “волокнистая часть (pars fibrosa)” [41].
Особенности периневрия корешков спинного мозга и спинномозговых ганглиев. Периневральная оболочка характерна не только для нервов, но и для корешков спинного мозга и ганглиев, где ее строение имеет ряд особенностей. Передний корешок спинного мозга сформирован из аксонов двигательных нейронов. Задний корешок состоит из отростков чувствительных нейронов, расположенных в спинномозговых ганглиях. Их оболочки защищают нервные волокна корешков только от химических и механических воздействий, но не от деформации и растяжения, поскольку недостаточно эластичны. В отличие от оболочек нерва, они также не подходят для наложения швов [42]. Область корешков СМ является переходной зоной между ПНС и ЦНС. Особенности перехода мозговых оболочек СМ в оболочки нервов до настоящего момента выяснены не полностью. Пограничная зона между ЦНС и ПНС также требует дальнейших исследований [43].
Вне субарахноидального пространства вентральные и дорзальные корешки СМ обладают тремя типичными оболочками, характерными для периферических нервов: эпиневрием, периневрием и эндоневрием. В области субарахноидального угла эпиневрий периферического нерва переходит в твердую мозговую оболочку спинного мозга (рис. 1, b). Эндоневрий остается неизменным до области контакта корешков со спинным мозгом. В области субарахноидального угла структура периневральной оболочки нерва претерпевает значительные изменения [44, 45]. В этой зоне внешняя часть периневральной оболочки нерва проходит между твердой мозговой оболочкой СМ и паутинной оболочкой СМ, и паутинная оболочка СМ сливается с наружными периневральными слоями корешков [42, 44, 45]. Внутренние же слои периневрия в составе оболочки корешков СМ достигают ЦНС. Электронно-микроскопическое исследование взаимного расположения оболочек нерва и оболочек спинного мозга [46] показало, что внутренние слои оболочки корешка напоминают периневрий нервного ствола. Внешняя же часть этой оболочки структурно напоминает паутинную, а в некоторых местах – мягкую, мозговую оболочку [42, 46]. Типичная оболочка корешка СМ крысы состоит из трех или четырех слоев уплощенных клеток, причем клетки внутренних слоев содержат большое количество пиноцитозных пузырьков и цитоплазматических вакуолей. В отличие от периневрия нервного ствола в корешке спинного мозга базальные мембраны могут иметь прерывистую структуру [46]. В корешках вблизи спинного мозга периневральные клетки постепенно утрачивают базальную мембрану, уменьшается число коллагеновых волокон, клетки становятся похожими на клетки менинготелия, уплощенные клетки, образующие выстилки мозговых оболочек [7].
Взаимосвязь субарахноидального пространства с эндоневрием спинномозгового корешка и периферического нерва мало изучена. Ранее считалось, что клетки периневрия отделяют корешки СМ от субарахноидального пространства, и благодаря этому прямое сообщение между субарахноидальным пространством и эндоневрием отсутствует [47]. В настоящее время в исследованиях с применением различных трейсеров установлено, что спинномозговая жидкость (СМЖ) субарахноидального пространства распространяется вдоль всех нервов, и может транспортировать различные антигены [48]. Некоторые исследователи предполагают, что зона входа и выхода корешков СМ может являтся местом контакта субарахноидального пространства с эндоневрием корешков и является местом контакта эндоневральной жидкости и СМЖ [49]. По-прежнему остается невыясненным вопрос о том, как осуществляется ток СМЖ: через периневральное пространство между слоями периневрия [33], через периневральное пространство между периневрием и эпиневрием [48, 50] или непосредственно через эндоневрий [49, 51].
Актуальность решения этого вопроса связана с проблемой проникновения патогенов в органы ЦНС. Исследования, выполненные на черепных и спинномозговых нервах, показали, что наряду с гематогенным путем проникновения существует периневральная инвазия ряда патогенов и патологических опухолевых клеток [52–55]. Считается также, что связь субпериневрального пространства со СМЖ субарахноидального пространства обеспечивает проникновение в головной и спинной мозг лекарственных препаратов.
Относительно капсулы вегетативных и спинномозговых ганглиев известно, что она состоит из двух частей. Внутренняя часть является эквивалентом периневрия периферических нервов, а внешняя представляет собой расширенный эпиневрий, содержащий коллагеновые волокна и фибробласты [56]. Экспериментальное применение трейсеров (пероксидазы хрена и ферритина) показало, что внутренняя часть оболочки верхнего шейного ганглия у крыс и мышей, состоящая из нескольких слоев периневральных клеток, формирует барьер, сходный с гемато-невральным барьером нерва [57]. При этом кровеносные сосуды ганглия оказываются более проницаемыми, чем эндоневральные сосуды нерва. Среди них встречаются фенестрированные капилляры. Показано, что пероксидаза хрена (но не крупные молекулы ферритина) проходит через такие сосуды и присутствует в периваскулярных макрофагах.
Cогласно современным представлениям, каждый слой периневральных клеток чувствительных ганглиев, как и периневрий нервных проводников, ограничен базальными мембранами с обеих сторон, клетки каждого слоя имеют множество плотных контактов и десмосом и немногочисленные щелевые контакты [58]. Между клеточными слоями расположены внеклеточные пространства, содержащие коллаген. Периневрий спинномозговых ганглиев состоит из большего числа клеток, чем периневрий нерва. Например, у крысы, кошки, кролика в периневрии ганглия имеется 7–11 слоев клеток, в то время как в седалищном нерве – до 5. Кроме того, сами слои периневрия оказываются более толстыми, чем слои периневральных клеток в нерве [7].
Исследование периневрия с применением иммуногистохимических маркеров. Новый этап в изучении морфофункциональных особенностей периневрия начался с появлением современных иммуногистохимических методов исследования, которые позволяют идентифицировать разные типы клеток благодаря визуализации их специфических белковых молекул. В настоящее время для исследования структур периферической нервной системы (нервных сплетений, волокон, терминалей, нейронов и глиальных клеток) широко применяется множество нейрональных и глиальных маркеров [12, 59–61]. Число же иммуногистохимических маркеров для идентификации клеток периневрия невелико.
Иммуногистохимические исследования показали, что клетки периневрия экспрессируют белок промежуточных филаментов соединительных тканей виментин, переносчик глюкозы-1 (GLUT-1), антиген эпителиальных мембран (EMA) и не содержат свойственный ШК белок S100 и маркеры нервных клеток – белки нейрофиламентов [17].
Как отмечалось ранее, перекрывающиеся полигональные клетки периневрия связаны плотными контактами. Специфические белки, входящие в состав этих контактов, и используются в качестве маркеров для периневральных клеток. Методом непрямой иммунофлуоресценции и иммуноэлектронной микроскопии показано, что в периневрии нерва млекопитающих и человека экспрессируются белки плотных контактов – клаудины, ZO-1 и окклюдин [62].
Клаудины – молекулы межклеточной адгезии, располагающиеся в области плотных клеточных контактов, участвуют в сохранении клеточного гомеостаза, в передаче межклеточных сигналов и в организации цитоскелета [63]. Клаудин-1 (Cldn1) экспрессируется в периферической и центральной нервной системе как основной белок гемато-неврального барьера и гемато-энцефалического барьера (ГЭБ). Исследования периферических нервов показали высокую экспрессию Cldn1 в периневрии периферических нервов, а также в насечках Шмидта-Лантермана и мезаксоне [64]. При повреждении седалищного нерва крысы путем наложения лигатуры экспрессия маркеров Cldn1, Cldn5 и других белков плотных контактов снижается [65]. С помощью внутривенного и локального введения азокрасителя синего Эванса (Evans blue) было установлено, что гемато-невральный барьер при этом нарушается, а его восстановление происходит только через неделю [65]. Отмечено, что при травме спинномозгового ганглия такой закономерности не наблюдается [66].
В нервной системе млекопитающих отмечены видовые отличия в наличии определенных клаудинов. Кроме того, с помощью применения ПЦР в реальном времени показано, что клаудин-11 экспрессируется в клетках центральной нервной системы, а клаудин-19 более специфичен для периферической нервной системы. Клаудин-19 идентифицирован в периневрии, а также – в ШК в области мезаксона [64, 67]. В спинномозговом ганглии этот белок присутствует в зоне концентрации отростков чувствительных нейронов [66]. Значение клаудинов очень велико: у нокаутных мышей с дефицитом клаудина-19 наблюдается нарушение нормальной проводимости седалищного нерва [64, 68].
Белок плотных контактов ZO-1, образующий комплексы с Cldn1, окклюдином и цитоскелетным актином, является неотъемлемой частью гемато-неврального барьера и экспрессируется не только в периневрии, но и в стенках эндоневральных кровеносных сосудов. При иммуногистохимическом окрашивании на ZO-1 наблюдается отчетливый зигзагообразный узор, при невропатии четкость этого узора теряется [69]. В седалищном нерве мыши и человека описана экспрессия белка ZO-1 также в миелинизирующих шванновских клетках [64].
Окклюдин – интегральный белок с молекулярной массой 65 кДа, состоящий из четырех доменов. N-концевой и С-концевой участки молекулы окклюдина расположены на внешней поверхности цитоплазматической мембраны. Окклюдин выполняет регуляторную функцию и связан с другими белками плотных контактов [70]. Окклюдин экспрессируется в периневрии периферических нервов, в эндотелиальных клетках эндоневральных сосудов, а также в насечках Шмидта-Лантерманна и мезаксоне миелинизирующих шванновских клеток [64]. Показана колокализация окклюдина с другим белком плотных контактов – трицеллулином [67].
Такие, свойственные клеткам периневрия структурные белки цитоскелета, как талин и винкулин участвуют в формировании контактов периневральных клеток с другими клеточными элементами и межклеточным матриксом через интегриновые рецепторы. Установлено, что количество талина снижается в периневрии при диабете [71].
В иммуногистохимических исследованиях периневрия, наряду с маркерами клеточных контактов, используются белки межклеточного пространства. Как отмечалось ранее, между периневральными клетками располагаются базальные мембраны, в состав которых входит коллаген IV типа. Использование двойного маркирования с применением антител к коллагену IV типа и к Cldn1 (и другим белкам плотных контактов) позволило изучить эмбриональное развитие периневральных оболочек седалищного нерва человека [62]. Иммуногистохимическое выявление ламинина и белков-интегринов также используется в исследованиях периневральной оболочки [72]. Установлено, что в условиях культивирования in vitro все изоформы ламинина могут экспрессиваться как клетками периневрия, так и эндоневральными фибробластами. При этом отмечено, что в условиях in vivo эти типы клеток экспрессируют его разные изоформы: для периневрия характерны цепи A, B2 и S; для эндоневральных фибробластов – цепи B1, B2, M и S [17].
В качестве иммуногистохимического маркера клеток периневрия в сочетании с реакцией на окклюдин или ламинин применяли также реакцию на белок клеточных контактов коннексин 43 [73].
Некоторые авторы считают, что помимо Cldn1, лучшими маркерами периневрия являются EMA и GLUT-1 [17]. EMA принадлежит к гетерогенному семейству высокогликозилированных трансмембранных белков, которые первоначально были обнаружены на поверхности эпителиальных клеток молочной железы, и которые также присутствуют в клетках практически всех эпителиальных опухолей. Установлено, что этот белок содержится в цитоплазме клеток периневрия, паутинной и мягкой оболочек мозга в норме. Белок GLUT-1 относится к группе транспортеров глюкозы и обнаруживается во многих типах клеток. Показано, что GLUT-1 встречается во всех зонах периневрия, а также в эндотелии эндоневральных кровеносных сосудов. Распределение GLUT-1 изучали в ПНС и ЦНС молодых и старых животных в норме, используя иммуногистохимические методы, гибридизацию in situ и перфузию с применением синего Эванса [74]. Показано, что в ранние сроки после рождения GLUT-I в периневрии не экспрессируется и появляется лишь у взрослых животных в периневральной оболочке нервов, спинномозговых корешков, в капсуле ганглиев задних корешков, а также в мягкой мозговой оболочке. Для человека отмечено, что на ранних стадиях онтогенеза в периневрии плода GLUT-1 отсутствует, и экспрессируется в достаточном количестве для визуализации с 22–26-й недели беременности [75, 76]. После травмы нерва его количество уменьшается и восстанавливается в процессе регенерации [74, 77].
На сегодняшний день исследования с применением иммуногистохимического выявления описанных белков в ряду позвоночных выполнены, главным образом, на периневрии лабораторных животных (у крыс и мышей). Отсутствуют данные о наличии и особенностях маркеров клеток периневрия у представителей других видов животных.
Таким образом, исследование клеток периневрия с помощью применения классических гистологических методов окраски и электронной микроскопии показало их структурное сходство у разных позвоночных животных и человека. Отмечается усложнение структуры периневрия в ряду земноводные–млекопитающие, выражающееся в увеличении слоев периневральных клеток. В доступной литературе отсутствуют работы, посвященные другим закономерностям развития периневральной оболочки в филогенезе. Отсутствие таких работ может быть связано с тем, что до сих пор вопрос о принадлежности периневральных клеток к какому-то определенному типу ткани является дискуссионным. В 1876 г. Кей и Ретциус нашли сходство клеток, образующих оболочку, окружающую нервные пучки, с эндотелиальными и назвали их “эндотелиально-подобными”. Ранвье, описав ламинарность периневрия, подчеркнул, что каждая его пластинка состоит из “фибриллярной стромы и эндотелия”. Действительно, структура клеток той части периневрия, которая непосредственно граничит с эндоневрием, имеет сходство с эндотелием микрососудов эндоневрия [78]. Наблюдается также сходство в структуре межклеточных соединений периневральных клеток и эндотелиоцитов. В то же время ламинарное строение периневрия и чередование между клетками плотных (zonula occludens) и адгезивных контактов (zonula adherens) характерны для эпителиальных тканей. В связи с этим в исследованиях, выполненных в середине прошлого века, периневрий относили к эпителиальным тканям [15], позднее, в 80-е годы, его называли “эпителиоморфной” структурой [7], а периневральные клетки “эпителиоидными клетками нейротелия” [79]. В исследованиях, выполненных in vitro, подчеркивается эпителиальный рост клеток периневрия [80]. Одни исследователи называют клетки периневрия модифицированными фибробластами [18, 81], другие – эпителиоидными миофибробластами [19]. В современных работах периневральные клетки нередко относят к клеткам периферической глии [75, 82–84]. Таким образом, вопрос о природе и происхождении клеток периневрия до сих пор обсуждается. Изучение развития периневрия в эмбриогенезе отчасти проливает свет на этот вопрос.
РАЗВИТИЕ ПЕРИНЕВРИЯ В ЭМБРИОГЕНЕЗЕ
Развитие клеток периневрия в онтогенезе изучалось на эмбрионах птиц [33] и грызунов [7] и плодах человека [62, 72, 76, 85]. Показано, что на начальном этапе эмбрионального развития разделение нервных волокон на пучки осуществляется рыхло расположенными фибробластами. Позднее наблюдается созревание периневральной оболочки в нерве, т.е. формирование характерных плотных контактов между клетками и базальных мембран между слоями периневральных клеток. Этот процесс совпадает с началом миелинизации аксонов.
Электронно-микроскопические исследования, выполненные на крысах [7], показали, что на 10–11-е сутки пренатального развития вокруг эмбриональных закладок периферических нервов и спинномозговых ганглиев периневральные оболочки отсутствуют. На 15-е сутки эмбриогенеза, в период, когда растущие аксоны вступают во взаимоотношения с предшественниками ШК, на поверхности развивающихся нервов и ганглиев появляются уплощенные клетки. Вокруг них концентрируются коллагеновые волокна. На 18-е сутки развития, когда в развивающихся нервных стволах крысы появляются отдельные миелинизированные волокна, на периферии уже имеется 1–2 слоя предшественников периневральных клеток. Они имеют сильно уплощенные цитоплазму и ядро и соединяются между собой плотными контактами. Через 2–3 нед после рождения структура периневрия сходна с периневрием взрослых животных. Через месяц после рождения периневрий начинает выполнять барьерную функцию [86, 87].
Du Plessis и соавт. [33] при исследовании формирования периневрия у курицы выделили три фазы в его развитии. Ранний период, когда эмбриональный периневрий лишь начинает организовываться, второй период, включающий в себя дифференцировку и образование многослойной структуры, и третий – фаза созревания, которая связана с формированием барьера. Авторы подчеркивают, что дифференцировка периневрия происходит в период активной пролиферации нейролеммоцитов (шванновских клеток) и тесно связана с развитием комплексов аксон-нейролеммоцит. Проследив дифференцировку периневрия на всех стадиях развития курицы, авторы установили, что периневральные клетки имеют мезенхимальное происхождение, а не образуются из ШК, как предполагалось ранее. Было показано, что на дифференциацию клеток периневрия из клеток окружающей мезенхимы могут оказывать влияние факторы, выделяемые растущими аксонами и нейролеммоцитами. На 17-е сутки развития в периневрии образуются базальные мембраны, и на этом же сроки формируются кровеносные сосуды в области эндоневрия. Этот срок авторы считают началом формирования гемато-неврального барьера. Однако свойственная взрослому организму периневральная ламинарная структура и особенная ультраструктура периневральных клеток наблюдаются только у десятидневных цыплят.
Становление периневрия у эмбрионов и плодов человека изучали с использованием разных методов (электронной микроскипии, иммуногистохимии, вестерн-блотинга) [62, 72, 76, 85]. Было установлено, что базальные мембраны в развивающемся седалищном и большеберцовом нерве формируются сначала вокруг шванновских клеток (уже на 11-й неделе) и только в период с 17-й по 35‑ю неделю постепенно образуются вокруг периневральных клеток, плотные межклеточные контакты появляются в периневрии на 14-й неделе развития, экспрессия GLUT-1 – в период с 22-й по 26‑ю неделю. Показано, что в период от 11-й до 35‑й недели диаметр седалищного нерва плодов возрастает. Это объясняется увеличением диаметра пучков, что в свою очередь связано с началом миелинизации аксонов и увеличением количества эндоневрального внеклеточного матрикса. В эти сроки тонкие перегородки, отходящие от периневрия в эндоневральное пространство, подразделяют пучки на более мелкие. Ядра клеток периневрия в этот срок имеют уплощенную форму, сходную с ядрами периневральных клеток взрослых. По мере развития наблюдается постепенное увеличение количества слоев клеток в периневрии.
Исследование появления в эмбриогенезе седалищного нерва человека белков плотных контактов Cldn1 и Cldn3, ZO-1 и окклюдина [62] показало, что первым экспрессируется Cldn1, который уже на 11‑й неделе плода идентифицируется в периневрии, образуя интенсивный точечный рисунок. Cldn3 и окклюдин показали более рассеянную точечную маркировку периневральной оболочки. ZO-1 очевидно определялся к 35-й неделе развития. Таким образом, в работах этих исследователей показано, что периневральный барьер в развивающихся периферических нервах созревает в эмбриогенезе достаточно поздно, в третьем триместре. В более ранний период барьер остается проницаемым.
Относительно происхождения клеток периневрия в эмбриогенезе в литературе нет единого мнения. В качестве источников развития периневрия приводятся клетки следующих эмбриональных зачатков: нервного гребня и эктомезенхимы, мезенхимы (мезодермы) и нервной трубки.
Происхождение из клеток нервного гребня. Первоначально считалось, что клетки периневрия имеют нейральное происхождение и образуются из клеток нервного гребня [29]. Нервный гребень в эмбриогенезе позвоночных животных формируется из дорзальной части нервной трубки. Нейральные стволовые клетки нервного гребня (NCSCs) являются мультипотентными и дают начало многим нервным и ненервным структурам [88–90]. В настоящее время показано, что некоторые производные нервного гребня, например, предшественники ШК сохраняют свойство мультипотентности и после рождения и могут дифференцироваться в клетки не только нейральной, но и мезенхимной природы [91]. Относительно клеток периневрия нет полной ясности о возможности его происхождения из NCSCs. Так, Joseph и соавт. [92] изучали развитие периферического нерва, используя технологию Cre-Lox рекомбинации для отслеживания судьбы мигрирующих клеток. Они установили, что в развивающемся нерве из NCSCs дифференцируются, главным образом, шванновские клетки (более 75%) и фибробласты эндоневрия. Авторы подчеркивают, что ни клетки периневрия, ни перициты, ни эндотелиальные клетки не образуются из NCSCs. Однако в сводной таблице результатов исследования отмечено, что небольшая часть периневральных клеток (около 3%) в той его части, которая непосредственно прилежит к эндоневрию, может иметь происхождение из NCSCs.
Anderson и соавт. [83] для доказательства происхождения периневрия из клеток нервного гребня поставили оригинальные эксперименты с использованием трехмерной модели развивающегося нерва. Спинномозговые ганглии эмбрионов крысы культивировали в капиллярном альгинатном геле (Capgel ™). Эксплантаты ганглиев, помещенные в Capgel, сохраняли жизнеспособность в течение 35 сут и состояли из нейронов и клеток-сателлитов. Аксоны клеток ганглия врастали в параллельные капилляры диаметром 30–50 мкм. На внутреннюю поверхность гелевых капилляров наносили ламинин – белок внеклеточного матрикса, способствующий росту аксонов. Аксоны чувствительных нейронов прорастали через капилляры на расстояние 1 см в виде пучков. Исследование динамики формирования такого пучка позволило выявить, что наряду с аксонами и шванновскими клетками в капилляре формировались уплощенные клетки, располагающиеся по периферии пучка. С помощью иммуногистохимических методов было показано, что эти клетки содержали клаудин-1, маркер зрелого периневрия GLUT-1 и маркер базальных мембран – коллаген IV типа. По мнению авторов, поскольку культуры состояли только из эксплантата спинального ганглия, клетки которого имеют происхождение из нервного гребня, вполне вероятно, что, по крайней мере, некоторые клетки образованного периневрия в этой системе также происходят из клеток нервного гребня.
Известно, что из клеток нервного гребня образуется некоторая часть мезенхимы, которая называется эктомезенхимой. В некоторых зарубежных исследованиях ее называют мезоэктодермой [93, 94]. Из клеток эктомезенхимы образуются адипоциты, хондроциты, остеоциты, гладкомышечные клетки, перициты, кожные фибробласты лица и многие другие клеточные типы [95, 96]. Ранее считалось, что эктомезенхима дает начало оболочкам головного и спинного мозга, а также периневральной оболочке. В настоящее время установлено, что оболочки головного мозга происходят из клеток краниального отдела нервного гребня, в то время как оболочки спинного мозга имеют мезодермальное происхождение [43, 90]. Это свойство распространяется и на периневрий: часть его клеток образуется из эктомезенхимы (т.е. являются производными нервного гребня), а другая часть имеет мезодермальное происхождение.
Происхождение из мезодермы. О мезодермальном (мезенхимном) происхождении клеток периневрия свидетельствуют результаты исследований, выполненных in vitro. По данным некоторых авторов при длительном культивировании клетки периневрия приобретают морфологические особенности, присущие фибробластам, и становятся фибробластоподобными [97, 98]. Однако при сравнении периневральных клеток с фибробластами Kusenas [29] справедливо замечает, что они имеют значительные отличия от последних. Например, они окружены базальной мембраной с двух сторон, а фибробласты – лишь с одной. Кроме того, они соединяются друг с другом с помощью плотных контактов, образуя характерные слои, что не свойственно фибробластам ни в каких органах. Автор подчеркивает еще одну особенность клеток периневрия: одна единственная периневральная клетка может окружать маленький пучок аксонов, что не характерно для фибробластов. Тем не менее в оригинальных исследованиях [99], выполненных in vitro, показана тесная взаимосвязь фибробластов (точнее их предшественников) с периневральными клетками. При культивировании полученных из надкостницы черепа эмбриональных фибробластов совместно со шванновскими клетками и сенсорными нейронами [99] было установлено, что вокруг формирующихся в эксплантатах нервных пучков образуется оболочка, подобная периневрию. Задача авторов состояла в определении, из каких клеток этой культуры может формироваться периневрий: из ШК (производных нервного гребня) или из фибробластов (клеток мезодермальной природы). Для этого поочередно метили ретровирусом ШК и фибробласты. Было показано, что формирующиеся периневральные клетки содержали метку только в том случае, если предварительно мечеными были фибробласты, но не ШК. Следовательно, клетки периневрия в созданных условиях in vitro дифференцировались из фибробастов, а не из ШК или их предшественников.
Еще одним доказательством мезодермального происхождения клеток периневрия служат тельца Рено. Эти цилиндрические или округлые структуры, описанные французским врачом Жозефом Луи Рено (1844–1917) еще в девятнадцатом веке, образуются из внутреннего слоя периневрия путем его инвагинации в эндоневрий [17, 100]. Тельца Рено встречаются в периферических нервах человека и животных (чаще у лошадей и ослов), и их число увеличивается при компрессионных и ряде других невропатий. В составе телец Рено содержатся типичные структурные компоненты соединительной ткани: фибробласты, гликозаминогликаны, базальные мембраны и эластические волокна. Иммуногистохимически доказано, что тельца Рено имеют положительную иммуногистохимическую реакцию на маркеры периневрия EMA и GLUT-1 и отрицательную реакцию на маркер ШК белок S100.
Доказательством мезодермального происхождения клеток периневрия могут служить результаты современных исследований по разработке новых технологий для стимуляции регенерации периферических нервных проводников с использованием стволовых клеток (нейральных стволовых/прогениторных клеток, мезенхимных стволовых клеток, полученных из разных источников, стволовых клеток волосяных фолликулов и др.) [см. обзоры: 101–103]. Используя разные способы оценки степени восстановления нерва (поведенческие тесты, электрофизиологические методы изучения проводимости, гистоморфометрический анализ), показано, что такая терапия, действительно, может способствовать регенерации нерва реципиента. Эти исследования имеют не только важное прикладное значение, но и позволяют выявить дифференцировочный потенциал пересаженных клеток, развивающихся в условиях измененного микроокружения. Некоторые исследователи в качестве экспериментальной клеточной терапии применяют стволовые клетки нервного гребня [104–106]. Установлено, что большинство пересаженных клеток дифференцируется в ШК и экспрессирует специфические для этих клеток маркеры (S100β, GFAP) [104, 105]. В некоторых работах показано, что часть пересаженных клеток нервного гребня могут дифференцироваться не только в S100β+ шванновские клетки, но и в FSP1+ фибробласты и CD31+ эндотелиоциты растущих кровеносных сосудов [104]. При этом отсутствуют работы, в которых было бы показано, что из пересаженных стволовых клеток нервного гребня образуются клетки периневрия. При использовании же в качестве клеточной терапии поврежденного нерва мезенхимных стволовых клеток костного мозга показано, что часть из них способна мигрировать в периневрий крысы-реципиента и дифференцироваться в периневральные клетки [107, 108]. Этот факт свидетельствует в пользу того, что хотя бы часть клеток периневрия может иметь мезодермальное происхождение.
Происхождение из нейроэктодермы. При исследовании миграции предшественников периневральных клеток в эмбриогенезе у рыб данио было установлено, что эти клетки берут начало из вентральной области формирующегося спинного мозга и мигрируют на периферию вместе с ростом аксонов вентрального корешка [32, 109]. Установлено также, что миграцию и дальнейшую дифференцировку предшественников регулируют Notch-зависимые сигнальные пути [32].
Оказалось, что у рыбок данио периневрий двигательного нерва состоит из Nkx2.2a-содержащих клеток, производных ЦНС [31, 109]. Недавно это было еще раз подтверждено в работе, посвященной исследованию глиальных клеток зоны выхода двигательного нерва, выполненных с использованием трансгенной модели Zebrabow (Brainbow-конструкция, инструмент мультиспектральной маркировки клеток, разработанный для отслеживания и анализа клонов) [84]. На этой модели было доказано, что определенная популяция глиальных клеток нервных корешков СМ, которая происходит из Nkx2.2а+ предшественников вентрального домена спинного мозга, в процессе эмбриогенеза мигрирует из ЦНС. Такая субпопуляция периферической глии центрального происхождения формирует периневрий вдоль двигательных нервов.
В настоящее время установлено, что не только у рыб, но и у млекопитающих часть периневральных клеток происходит из Nkx2.2-иммунопозитивных предшественников, располагающихся в эмбриональном спинном мозге [82]. С использованием трансгенных мышей было установлено, что на E15.5 Nkx2.2+ клетки присутствуют в непосредственной близости к α-тубулин-содержащим аксонам двигательных нейронов на периферии. Кроме того, отмечено, что у нокаутных мышей, лишенных Nkx2.2, наблюдаются дефекты периневрия. Было сделано заключение о том, что часть клеток периневрия вентрального корешка происходит из предшественников Nkx2.2+, располагающихся в вентральной области спинном мозге (вероятно, p3 домен предшественников). Происходящие из клеток ЦНС периневральные клетки покидают спинной мозг через формирующуюся зону выхода переднего корешка и объединяются со своими периферически-генерируемыми аналогами, образуя непрерывную оболочку вокруг двигательных нервов [43]. Важно отметить, что такие клетки характерны только для периневрия вентрального корешка аксонов мотонейронов, а происхождение периневральных клеток заднего корешка остается неизвестным [29].
Таким образом, периневрий является уникальной структурой, клетки которой могут происходить в онтогенезе из разных эмбриональных зачатков [29, 82, 83, 110]. Тем не менее у разных видов животных и человека периневрий и его составляющие имеют сходную структуру, что обусловлено выполнением этими клетками сходных функций.
ФУНКЦИИ ПЕРИНЕВРИЯ
Защитная функция. Одной из функций оболочек нервов является механическая защита нервных волокон, поскольку нервные проводники постоянно подвергаются механическим нагрузкам из-за изменений положения тела, особенно конечностей. Структура нервов и их оболочек позволяет контролировать локальную среду нервных волокон и модулировать физические нагрузки [37]. Нервы обладают способностью выдерживать растяжение и сжатие, скольжение (экскурсию) и компрессию [111]. Изменения биомеханических свойств нервов изучали при разных условиях: при различном позиционировании конечностей, во время движений, в позднем онтогенезе, а также при патологии (сахарном диабете) [111]. Показано, что периневрий модулирует внешнее влияние, защищая нерв от механического повреждения, и обеспечивает его механическую прочность [17]. Это отражается на его структуре: наибольшая толщина периневральной оболочки (т.е. наибольшее число слоев клеток в ее составе) наблюдается у нервов, испытывающих наибольшую нагрузку, а также в местах разветвления нервных стволов [37]. Вероятно, одним из приспособлений к механическим нагрузкам, наблюдаемым при осуществлении движений и изменении положения тела, является ультраструктурное содержание в цитоплазме периневральных клеток сократительных филаментов и везикул [18, 112].
Периневрий выполняет также защитную иммунологическую функцию. Его клетки экспрессируют ряд белков-регуляторов системы комплимента. К ним относятся ингибиторы системы комплемента (C1IHN и C4b-связывающий белок), ингибиторы мембраноатакующего комплекса комплемента (гликопротеин CD59) и фактор ускорения распада комплемента DAF [113, 114].
Поддержание гомеостаза нерва. Клетки периневрия, соединенные плотными контактами, и эндотелиоциты капилляров эндоневрия создают необходимую для функционирования нервных волокон окружающую среду и помогают поддерживать необходимое давление эндоневральной жидкости – 2–3 мм рт.ст. [17, 37]. При нарушении капилляров вследствие травмы наблюдается изменение давления эндоневральной жидкости, что ведет к гиперфузии, ишемии, повреждению шванновских клеток и аксонов. Удаление лишней жидкости происходит очень медленно, поскольку в эндоневрии отсутствуют лимфатические сосуды [37].
Барьерная функция. Гисто-гематические барьеры описаны в различных органах, к ним относятся гемато-энцефалический, гемато-офтальмический, гемато-тестикулярный и другие. В формировании гисто-гематических барьеров любого органа принимают участие клеточные и неклеточные составляющие: эндотелиоциты, перициты, базальные мембраны, перикапиллярное пространство, клетки самих органов [115]. Барьерная функция периневральной оболочки периферических нервных проводников была выявлена во второй половине прошлого века [30, 47, 116]. Гемато-невральный барьер, имеющий место в органах ПНС, некоторые авторы называют также “blood-nerve interface” [49]. В настоящее время установлено, что главными компонентами гемато-неврального барьера в органах ПНС являются внутренние слои периневрия, контролирующие поток элементов интерстициальной жидкости между эпиневрием и эндоневрием, и эндоневральные микрососуды, которые контролируют проникновение из кровотока в эндоневральное пространство ионов, растворенных питательных веществ, воды, макромолекул и лейкоцитов [19, 66]. Эндоневральное пространство простирается от спинномозгового корешка до периферических нервных окончаний и защищено от проникновения веществ, которые могут нарушать или блокировать нервную проводимость, а также от проникновения потенциальных канцерогенов [17].
Исследования степени проницаемости периневрального барьера с использованием ферритина [117] или пероксидазы хрена [118, 119] показали, что трейсерные молекулы не способны проникать через периневрий или достигают только наиболее поверхностного его слоя [118]. По мнению A.P. Mizisin и A. Weerasuriya , высокая избирательность периневрального барьера связана с тем, что эта структура является многослойной [38]. Тем не менее по проницаемости нервно-тканевой барьер ПНС уступает ГЭБ. Наиболее проницаемым периневральный барьер оказывается в области нервных окончаний, где может происходить проникновение относительно крупных молекул в аксоплазму, и в местах проникновения эпиневральных сосудов, проходящих через периневрий в эндоневрий [17, 38, 49]. Кроме того, барьер отсутствует в дорзальных корешках спинного мозга и в некоторых вегетативных ганглиях [17]. Отсутствие ламинарного периневрия, а следовательно и периневрального барьера, характерно для ганглиев нервных сплетений, располагающихся в стенках органов желудочно-кишечного тракта.
Актуальность исследования молекулярных механизмов регуляции проницаемости гемато-неврального барьера обусловлена тем, что его нарушение приводит к серьезным заболеваниям. Основное внимание ученых уделяется эндотелиальной составляющей гемато-неврального барьера. Показано, что плотные контакты между эндотелиоцитами кровеносных сосудов эндоневрия образованы такими же белками, как контакты между соседними периневральными клетками, это окклюдин, клаудин-5, белки ZO-1 и ZO-2 [120]. Исследования последних лет, проведенные на культурах эндотелиоцитов эндоневрия, позволили идентифицировать 133 молекулы межклеточного соединительного комплекса эндотелиальных клеток эндоневрия человека. В условиях in situ в эндотелии эндоневральных микрососудов икроножного нерва человека идентифицированы такие белки, как катенин α1 (CTNNA1), кадгерин-5 (CHD5), кадгерин-6 (CDH6), Cldn4, Cldn5, протокадгерин-1, везатин [121]. Используя конфокальную лазерную микроскопию, установлено, что Cldn4 связан с плотными контактами гемато-неврального барьера, CDH5 – с адгезивными контактами. Белки ZO-1 и Cldn5 идентифицируются как каркасные белки, которые связывают мембраны эндотелиальных клеток с цитоскелетом [19].
Современные данные, полученные в работах, выполненных на моделях in vitro и in situ, позволяют выдвинуть ряд гипотез о влиянии на проницаемость гемато-неврального барьера шванновских клеток, перицитов и других структурных элементов нервных проводников. Так, эндотелиальные клетки сосудов эндоневрия обладают рецепторами к ростовым и нейротрофическим факторам (глиальному нейротрофическому фактору (GDNF; GFRα1), фактору роста эндотелия сосудов, основному фактору роста фибробластов, трансформирующему фактору роста-β [120], которые синтезируются клетками эндоневрия: нейролеммоцитами, перицитами, тучными клетками, фибробластами. Существует гипотеза о регуляции проницаемости гемато-неврального барьера синтезирующими GDNF шванновскими клетками через RET тирозинкиназа-митоген-активируемая протеинкиназа (MAPK) путь [122], предполагается, что ШК, вырабатывая GDNF, оказывают влияние на формирование гемато-неврального барьера в период онтогенеза, GDNF также индуцирует специализацию периневральных клеток [19]. Функционирование гемато-неврального барьера обеспечивают белки-переносчики (509 транскриптов), среди них GLUT-1, переносчик монокарбоксилата-1, транспортер креатина и др. [120].
Для нормальной работы гемато-неврального барьера важен водный баланс эндоневрия, регуляцию которого осуществляют аквапорины – интегральные мембранные протеины, формирующие поры в мембранах клеток (AQP1, AQP3 и AQP11) [120]. Выработка AQP1 осуществляется не только эндотелиоцитами и перицитами, но и клетками периневральной оболочки. Отмечено участие в регуляции барьерной функции нерва иммунокомпетентных клеток, однако этот вопрос требует дальнейших исследований.
При повреждении нервных проводников происходит нарушение гемато-неврального барьера и изменение функции эндотелиальных клеток микрососудов эндоневрия [66, 123]. Показано, что разрушение сосудистого барьера вызывает дисфункция сигнального пути Hedgehog уже через час после травмы, это приводит к изменению экспрессии Cldn5 и других молекул [124]. Moreau и соавт. [123], используя модель хронического сдавливания нерва, показали, что в нарушении гемато-неврального барьера также участвует сигнальный путь Wnt/b-катенин во взаимодействии с активацией toll-подобного рецептора 4 (TLR4). Установлено, что к хроническому нарушению гемато-неврального барьера после повреждения нерва приводит активация пути Wnt/b-катенин и торможение передачи сигналов Hedgehog в эндотелии микрососудов эндоневрия. Важно отметить, что нарушение проницаемости наблюдается до проникновения в поврежденный нерв макрофагов в процессе валлеровской дегенерации. Изменение синтеза белка адгезивных контактов кадгерина и одновременное подавление синтеза белков плотных контактов Cldn-1, Cldn-5 и окклюдина предшествуют инфильтрации иммунных клеток и токсичных молекул при локальном воспалении и развитии нейропатической боли.
Метаболическая функция. Периневрий является метаболически активной структурой [18, 62]. Большое количество базальных мембран в его составе обеспечивает высокую избирательность проникновения в эндоневрий из эпиневрия различных молекул [75]. Одним из способов транспортировки необходимых молекул через периневрий является трансцитоз (эндо- и экзоцитоз в одной и той же клетке, характерен для клеток уплощенной формы, например, эндотелиоцитов [125]). Для доказательства факта прохождения макромолекул через периневральную оболочку путем трансцитоза применяли методы авторадиографии, электронной микроскопии и молекулярные трейсеры [62, 126, 127].
Морфогенетическая функция. В процессе эмбрионального развития клетки-предшественники формирующихся периферических нервов (предшественники нейронов, шванновских клеток, эндоневральных фибробластов и периневральных клеток) находятся в тесных взаимоотношениях. Показано, что на развитие и дифференцировку периневрия в эмбриогенезе оказывают влияние ШК. Установлено, что дифференциация клеток периневрия, формирование характерной для него ламинарной структуры, образование гемато-неврального барьера обусловлены сигнальной молекулой “desert hedgehog” (Dhh), которая экспрессируется шванновскими клетками [128, 129]. Оказалось, что клетки периневрия в свою очередь тоже влияют на развитие и функционирование ШК. Показано, что генетическое удаление периневральных клеток на ранней стадии развития приводит к затруднению в развитии ШК и к дефектам двигательных нервов [109]. Взаимодействие периневральных клеток со ШК на разных этапах развития двигательных нервов продемонстрировано на нокаутных животных с нарушением сигналов Notch [32, 82]. Установлено, что клетки периневрия необходимы не только для выживания и дифференцировки ШК, но и для осуществления ими миелинизации аксонов [32].
Морфогенетическая функция периневрия в онтогенезе проявляется также в период выхода аксонов развивающихся мотонейронов на периферию [31]. На границе между ЦНС и ПНС клетки периневрия выполняют функции, сходные с клетками пограничной “шапочки” (boundary caps cells): они препятствуют миграции тел предшественников мотонейронов за пределы ЦНС, контролируют барьер, участвуют в регуляции направленности аксонов [82, 130].
Участие в регенерации нерва. Как отмечалось ранее, структурные изменения периферических нервных проводников при репаративной регенерации впервые описаны в классических нейробиологических исследованиях А. Валлера и С. Рамон-и-Кахаля. Позднее с помощью электронной микроскопии были выяснены ультраструктурные особенности изменений, происходящих в нервных проводниках после повреждения. Большое число исследований показало, что неотъемлемыми участниками процессов дегенерации и восстановления нервных волокон являются ШК, которые после травмы подвергаются дедифференцировке, пролиферируют, вырабатывают ростовые факторы, белки внеклеточного матрикса и цитокины, обеспечивая рост регенерирующих аксонов [см. обзоры: 2, 11, 131, 132]. Меньше внимания уделяется реакции на повреждение нерва клеток периневрия.
На модели повреждения большеберцового нерва кролика показано, что клетки периневрия в ответ на повреждение отделяются друг от друга и от своих базальных мембран и приобретают морфологию фибробластов. Затем они окружают маленькие пучки регенерирующих аксонов, восстанавливая свою структуру [81].
При изучении периневрия в дистальном сегменте диафрагмального нерва мыши после передавливания было показано, что в первую неделю после повреждения (в период валлеровской дегенерации) часть периневральных клеток выглядела гипертрофированной [33]. Многие клетки пролиферировали, фигуры митозов наблюдались в течение одной недели. В цитоплазме периневральных клетках определялись внутриклеточные микрополости, что связано с увеличением пиноцитозных пузырьков. Ближайшие к эндоневрию периневральные клетки содержали липидные капли, количество которых со временем увеличивалось.
Для изучения реакции периневрия на травму нерва была разработана удобная модель, называемая “периневральным окном” [134]. Эта модель позволяет исследовать реакцию нерва на ограниченное периневральное повреждение, которое приводит к демиелинизации близлежащих нервных волокон и к нарушению проводимости нерва [47]. Имеются данные о том, что на регенеративные потенции периневрия влияет микроокружение: так, при трансплантации сегмента нерва в поврежденный спинномозговой корешок, периневрий не регенерирует, в то время, как при трансплантации сегмента корешка в нерв наблюдается его регенерация [47, 135].
В исследованиях последних лет на модели лазерной аксотомии нерва у зебрафиш показано, что одними из первых (наряду со ШК) клетками, реагирующими на повреждение, оказываются клетки периневрия. Они образуют “мост”, соединяющий проксимальный и дистальный сегменты нервного ствола еще до начала фрагментации аксонов в дистальном конце [29, 136].
По современным данным репаративная регенерация периневрия связана с белками межклеточных соединений, количество которых снижается после травмы, наблюдается подавление синтеза Cldn1, Cldn5, ZO-1 и других белков клеточных контактов [66, 137]. Показано, что через 7 сут после травмы нерва восстанавливается иммунореактивность к окклюдину и ZO-1. Только через 21 сут наблюдается восстановление иммунореактивности к коннексину 43. Отмечено, что восстановление щелевых соединений задерживается по сравнению с восстановлением плотных контактов [137].
Исследование молекулярных механизмов регенерации нервов показало, что несмотря на то, что периневральные клетки во время онтогенетического развития нервов активно используют передачу сигналов Notch, этот механизм отсутствует при репаративной регенерации [32].
Регенеративный потенциал периневральных клеток можно проследить при анализе работ, выполненных на клиническом материале патологии нерва. Показано, что клетки периневрия способны пролиферировать и образовывать доброкачественные и злокачественные опухоли (периневриомы) [17, 138]. Кроме того, они входят в состав таких гетерогенных опухолей, как нейрофибромы, шванномы и злокачественные опухоли оболочек нерва. Для идентификации периневральных клеток в нейрофибромах, в состав которых входят также ШК и фибробласты, применяют иммуногистохимическое выявление Cldn1, EMA, GLUT-1 и других маркеров периневрия [139, 140]. Установлено, что в нейрофибромах локализация клеток периневрия не является случайной, периневрий формируется вокруг рудиментарных нервных пучков [139]. Это свидетельствует о том, что как и в онтогенезе, образование периневральных клеток происходит под влиянием формирующихся нервных волокон и окружающих их ШК. Предполагается, что при нейрофиброматозе-1 нарушение клеточных контактов между периневральными клетками приводит к нарушению их барьерной функции и проникновению из окружающих тканей в периневрий факторов роста и цитокинов, которые стимулируют пролиферацию и опухолевый рост клеток периневрия [139].
Фагоцитарная функция. Фагоцитоз является важнейшим клеточным процессом для периферических нервных проводников после их повреждения. В ответ на травму в дистальном сегменте нерва наблюдаются процессы валлеровской дегенерации, включающие в себя разрушение аксонов и их миелиновых оболочек. Для осуществления последующей регенерации нервных волокон необходимо очищение эндоневрия от продуктов распада аксонов и миелина, которое осуществляется, главным образом, макрофагами гематогенного происхождения [141]. Кроме того, в процессе фагоцитирования продуктов распада миелина участвуют резидентные макрофаги и ШК [11, 142]. В отдельных работах было показано, что клетки периневрия также могут принимать участие в этом процессе [136, 141, 143]. Это демонстрируют результаты исследований, выполненных на разных экспериментальных моделях (при холодовом поражении, введении ЛПС, передавливании нерва зажимом и др.) [143]. Высказываются предположения о трансформации клеток периневрия в макрофаги при их участии в фагоцитозе [7]. В работах, выполненных с помощью электронной микроскопии, на некоторых электронограммах, приводимых авторами, можно видеть клетки периневрия с характерными для фагоцитирующих клеток вакуолями [141] и липидными каплями [143] в цитоплазме. Правда, есть предположение, что это могут быть мигрирующие при повреждении нерва из эндоневрия в эпиневрий, макрофаги [18]. Вопрос о фагоцитарной функции периневральных клеток требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Настоящая обзорная статья охватывает круг вопросов, связанных с особенностями одной из оболочек нервных стволов – периневральной. В обзоре обобщены имеющиеся в литературе данные о структуре и функциях клеток периневрия, об их происхождении в фило- и онтогенезе, реакции на повреждение, возможные способы идентификации этих клеток с помощью иммуногистохимических реакций. Анализ имеющейся научной литературы показал, что несмотря на то, что оболочки нерва исследуются в течение нескольких десятилетий, многие вопросы, касающиеся структурных и функциональных особенностей периневрия, по-прежнему, остаются нерешенными. Так, имеется недостаточно информации об эволюционных закономерностях развития периневрия. Показано, что в ряду позвоночных животных периневральная оболочка является универсальной структурой, свойственной любым нервам. В ряду земноводные–млекопитающие наблюдается усложнение ее структуры, что выражается в увеличении слоев периневральных клеток. Электронно-микроскопически показано, что ультраструктурные особенности периневральной оболочки сходны у представителей разных видов. При этом исследования периневральной оболочки с применением современных иммуногистохимических методов осуществлены лишь у человека и лабораторных животных, и практически не проводились у представителей других видов. Вероятно, это связано с тем, что селективные иммуногистохимические маркеры, свойственные только клеткам периневрия, не найдены. Большинство антигенов, с помощью которых проводится иммуногистохимическая идентификация периневральных клеток, являются белками плотных контактов.
Углубленные исследования структуры периневрия с применением современных методов и с использованием экспериментальных моделей in vitro и in vivo позволили расширить представление о периневрии как о защитной оболочке и прояснить некоторые регуляторные механизмы гемато-неврального барьера. При анализе имеющихся в литературе данных выяснилось, что клетки периневрия осуществляют не только механическую и барьерную функции, но и иммунологическую защиту нерва, принимают участие в регуляции метаболических процессов, играют важную морфогенетическую роль в раннем онтогенезе, а также принимают активное участие в репаративной регенерации нервных проводников.
В настоящем обзоре представлены имеющиеся в современной литературе данные о морфофункциональных особенностях клеток периневральной оболочки корешков спинного мозга и ганглиев в сравнении с периневрием нервного ствола. Проанализированы доказательства о происхождении клеток периневрия в онтогенезе из различных эмбриональных зачатков. На разных экспериментальных моделях было показано, что периневрий в эмбриогенезе может происходить из клеток нервного гребня, мезодермы и нейроэктодермы. Долгое время вопрос о происхождении периневрия считался дискуссионным и противоречивым. Сегодня многие исследователи пришли к заключению, что периневрий – уникальная структура, состоящая из клеток, сходных структурно и функционально, но имеющих разное происхождение. Пока неясно, от чего зависит, из какого эмбрионального зачатка образуется периневрий разных нервов, корешков и ганглиев, и имеются ли отличительные особенности гистобластических потенций клеток, формирующихся из разных зачатков. Опубликованные данные за последние несколько лет свидетельствуют о том, что клетки периневрия вентральных корешков образуются из нейроэктодермы и могут, в связи с этим, относиться к периферической глии. При этом отсутствуют представления об источнике происхождения периневральных клеток дорзального корешка. Дальнейшие исследования, направленные на выяснение особенностей происхождения этих клеток у млекопитающих и человека, могут привести к пересмотру представлений о происхождении периферической глии. Проанализировав имеющиеся в литературе доказательства происхождения клеток периневрия из разных эмбриональных зачатков, можно заключить, что периневрий состоит из разных популяций клеток. Все изложенное свидетельствует о необходимости продолжения углубленных исследований в этом направлении.
Одной из наиболее важных функций периневрия является его участие в формировании гемато-неврального барьера. Наряду с эндотелиоцитами микрососудов эндоневрия периневрий участвует в создании микросреды, благоприятной для роста и развития нервных волокон, и в сохранении эндоневрального гомеостаза. В настоящее время имеется недостаточно сведений о молекулярных механизмах регуляции этого барьера. Практически отсутствуют данные о формировании гемато-неврального барьера у представителей разных видов животных. Возможно, сравнительное исследование молекулярных механизмов регуляции гемато-неврального барьера в будущем позволит выявить совершенствование механизмов функционирования этого барьера в эволюции.
Следует отметить, что изучение гемато-неврального барьера имеет важное практическое значение. Показано, что нарушение барьерной функции предваряет развитие травматических и метаболических невропатий, а также опухолей. В связи с этим понимание молекулярных механизмов регуляции гемато-неврального барьера будет способствовать дальнейшим разработкам новых терапеврических подходов для лечения хронических периферических невропатий и невропатической боли.
Список литературы
Берснев ВП, Хамзаев РИ, Борода ЮИ (2009) Результаты эпиневрального шва седалищного нерва. Вестник хирургии им. И.И. Грекова 168 (1): 61–63 [Bersnev VP, Hamzaev RI, Boroda JuI (2009) Rezul’taty jepinevral’nogo shva sedalishhnogo nerva. Vestnik hirurgii im. I.I. Grekova 168 (1): 61–63 (In Russ)].
Щаницын ИН, Иванов АН, Бажанов СП, Нинель ВГ, Пучиньян ДМ, Норкин ИА (2017) Cтимуляция регенерации периферического нерва: современное состояние, проблемы и перспективы. Успехи физиол наук 48 (3): 92–112 [ Shchanitsyn IN, Ivanov AN, Bazhanov SP, Ninel VG, Puchin’jan DM, Norkin IA (2017) Stimulation of peripheral nerve regeneration: current status, problems and perspectives. Uspekhi fiziologicheskih nauk 48 (3): 92–112 (In Russ)].
Shchudlo NA, Borisova IV, Shchudlo MM (2013) Morphometric assessment of the effectiveness of post-traumatic regeneration of peripheral nerves using single and repeated courses of electrostimulation. Neurosci and Behav Physiol 43 (9): 1097–1101. https://doi.org/10.1007/s11055-013-9855-4
Литвиненко ИВ, Одинак ММ, Живолупов СА, Булатов АР, Рашидов НА, Бардаков СН (2018) Клинико-инструментальные характеристики травматических поражений периферических нервов конечностей. Вестник Рос Военно-мед акад 3 (63): 50–56 [Litvinenko IV, Odinak MM, Zhivolupov SA, Bulatov AR, Rashidov NA, Bardakov SN (2018) Clinical and instrumental characteristics of traumatic lesions of peripheral nerves of limbs. Vestnik Rossiyskoy Voyenno-meditsinskoy akademii 3 (63): 50–56 (In Russ)].
Ништ АЮ, Чирский ВС, Фомин НФ (2019) Морфологические основы восстановления двигательной иннервации при травмах периферических нервов. Журн анатомии и гистопатол 8 (4): 66–73 [Nisht AYu, Chirskii VS, Fomin NF. (2019) Morphological foundations of restoration of motor innervation in injuries of peripheral nerves. J Anatomy and Histopathology 8 (4): 66–73 (In Russ)].https://doi.org/10.18499/2225-7357-2019-8-4-66-73
Pannese E (1981) The satellite cells of the sensory ganglia. Adv Anat Embryol Cell Biol 65: 1–111. https://doi.org/10.1007/978-3-642-67750-2
Ноздрачев АД, Чумасов ЕИ (1999) Периферическая нервная система. СПб: Наука [Nozdrachev AD, Chumasov EI (1999) Perifericheskaja nervnaja sistema. SPb: Nauka (In Russ)].
Челышев ЮА, Сайткулов КИ (2000) Развитие, фенотипическая характеристика и коммуникации шванновских клеток. Успехи физиол наук 31 (3): 54–69 [Chelyshev Yu.A., Saitkulov K.I. Development, phenotypic characteristics and communication of Schwann cells (2000) Uspekhi fiziologicheskih nauk 31 (3): 54–69 (In Russ)].
Zochodne DW (2008) Neurobiology of peripheral nerve regeneration. Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, Sao Paulo: Cambridge University Press.
Reina MA, Arriazu R, Collier CB, Sala-Blanch X, Izquierdo L, de Andrés J (2013) Electron microscopy of human peripheral nerves of clinical relevance to the practice of nerve blocks. A structural and ultrastructural review based on original experimental and laboratory data. Rev. Esp Anestesiol Reanim 60 (10): 552–562. https://doi.org/10.1016/j.redar.2013.06.006
Petrova ES (2019)Current views on Schwann cells: development, plasticity, functions. J Evol Biochem Phys 55: 433–447. https://doi.org/10.1134/S0022093019060012
Чумасов ЕИ, Колос ЕА, Петрова ЕС, Коржевский ДЭ (2020) Иммуноморфология периферической нервной системы. СПб: СпецЛит [Chumasov EI, Kolos EA, Petrova ES, Korzhevskij DE (2020) Immunomorfologiya perifericheskoj nervnoj sistemy. SPb: SpecLit (In Russ)]
Bhatheja K, Field J (2006) Schwann cells: origins and role in axonal maintenance and regeneration. Int J Biochem Cell Biol 38: 1995–1999. https://doi.org/10.1016/j.biocel.2006.05.007
Salzer JL (2015) Schwann cell myelination. Cold Spring Harb. Perspect Biol. 7 (8): a020529. https://doi.org/10.1101/cshperspect.a020529
Shanthaveerappa TR, Bourne GH (1966) Perineural epithelium: a new concept of its role in the integrity of the peripheral nervous system. Science 154 (3755): 1464–1467.
Kundalić B, Ugrenović S, Jovanović I, Stefanović N, Petrović V, Kundalić J, Stojanović V, Živković V, Antić V (2014) Morphometric analysis of connective tissue sheaths of sural nerve in diabetic and nondiabetic patients. Biomed Res Int: 870930. https://doi.org/10.1155/2014/870930
Pinã-Oviedo S, Ortiz-Hidalgo C (2008) The normal and neoplastic perineurium. A review Adv Anat Pathol 15:147–164. https://doi.org/10.1097/PAP.0b013e31816f8519
Berthold C-H, Fraher JP, King RHM, Rydmark M (2005) Microscopic anatomy of the peripheral nervous system, in Peripheral Neuropathy, PJ Dyck and PK Thomas Eds, Elsevier Health Sciences: 35–91.
Ubogu EE (2020) Biology of the human blood-nerve barrier in health and disease. Exp Neurol 328: 113272. https://doi.org/10.1016/j.expneurol.2020.113272
Barros CS, Franco SJ, Müller U (2011) Extracellular matrix: functions in the nervous system. Cold Spring Harb Perspect Biol 3 (1): a005108. https://doi.org/10.1101/cshperspect.a005108
Bove GM, Light AR (1995) Calcitonin Gene-Related peptide and peripherin immunoreactivity in nerve sheaths. Somatosensory and Motor Research 12 (1): 49–57. https://doi.org/10.3109/08990229509063141
Reina MA, Boezaart AP, Tubbs RS, Zasimovich Y, Fernández-Domínguez M, Fernández P, Sala-Blanch X (2019) Another (internal) epineurium: beyond the anatomical barriers of nerves. Clin Anat 33 (2): 199–206. https://doi.org/10.1002/ca.23442
Sala-Blanch X, Reina MA, Ribalta T, Prats-Galino A (2013) Sciatic nerve structure and nomenclature: epineurium to paraneurium: is this a new paradigm? Reg Anesth Pain Med 38 (5): 463–465. https://doi.org/10.1097/AAP.0b013e3182a1b6c5
Затолокина МА (2016) Морфогенез изменений параневральных соединительнотканных структур периферических нервов в эволюционном аспекте. Курск: КГМУ [Zatolokina M.A. (2016) Morfogenez izmenenij paranevral’nyh soedinitel’notkannyh struktur perifericheskih nervov v jevoljucionnom aspekte. Kursk: KGMU (In Russ)].
Murthy NK, Spinner RJ (2020) Letter to the editor: the paraneurium (circumneurium) and its clinical implications with benign and malignant nerve lesions. Clin Anat. Online ahead of print. https://doi.org/10.1002/ca.23639
Reina MA, Boezaart A, Nin OC, Zasimovich Y, Sala-Blanch X (2020) Yet another perineural layer: so what? Reg Anesth Pain Med 45 (6):483–484. https://doi.org/10.1136/rapm-2019-100765
Krnjevic K (1954) The connective tissue of the frog sciatic nerve. Q J Exp Physiol Cogn Med Sci 39 (1): 55–72. https://doi.org/10.1113/expphysiol.1954.sp001048
Marani E, Lakke EAJF Peripheral Nervous System In: JK Mai and G Paxinos The human nervous system. Elsevier, Amsterdam 2012: 82–140
Kucenas S (2015) Perineurial glia. Cold Spring Harb Perspect Biol 7 (6): a020511. https://doi.org/10.1101/cshperspect.a020511
Shanthaveerappa TR, Bourne GH (1963) Demonstration of perineural epithelium in whale and shark peripheral nerves. Nature197: 702–703. https://doi.org/10.1038/197702a0
Kucenas S, Takada N, Park HC, Woodruff E, Broadie K, Appel B (2008) CNS-derived glia ensheath peripheral nerves and mediate motor root development. Nat Neurosci 11:143–151. https://doi.org/10.1038/nn2025
Binari LA, Lewis GM, Kucenas S (2013) Perineurial glia require Notch signaling during motor nerve development but not regeneration. J Neurosci 33 (10):4241–4252. https://doi.org/10.1523/JNEUROSCI.4893-12.2013
Du Plessis DG, Mouton YM, Muller CJ, Geiger DHJ (1996) An ultrastructural study of the development of the chicken perineurial sheath. Anat: 189 (Pt 3): 631–641.
Server A, Reina MA, Boezaart AP, Prats-Galino A, Esteves Coelho M, Sala-Blanch X (2018) Microanatomical nerve architecture of 6 mammalian species: Is trans-species translational anatomic extrapolation valid? Reg Anesth Pain Med 43 (5):496–501. https://doi.org/10.1097/AAP.0000000000000772
Чумасов ЕИ (1975) О структуре периневрия периферической нервной системы. Арх анатомии гистологии и эмбриологии 68 (4): 29–34 [Chumasov EI (1975) On the structure of the perineurium of the peripheral nervous system. Arch of Anatomy, Histology and Embryology 68 (4): 29–34 (In Russ)].
Takebe K, Nio-Kobayashi Y, Takanashi-Iwanaga H, Iwanaga T (2006) Histochemical demonstration of a monocarboxylate transporter in the mouse perineurium with special reference to GLUT1. Biomedical Res 29 (6): 297–306. https://doi.org/10.2220/biomedres.29.297
Topp KS, Boyd BS (2012) Peripheral nerve: from the microscopic functional unit of the axon to thebiomechanically loaded macroscopic structure. J Hand Ther 25 (2): 142–151; quiz 152. https://doi.org/10.1016/j.jht.2011.09.002
Должиков АА, Должикова ИН (2018) Периневрий периферических нервов: фундаментальные и прикладные вопросы его морфологии и функций. Актуальные проблемы гуманитарных и естественных наук 9: 54–62. [Dolzhikov AA, Dolzhikova IN (2018) Perinevrij perifericheskih nervov: fundamental’nye i prikladnye voprosy ego morfologii i funkcij. Aktual’nye problemy gumanitarnyh i estestvennyh nauk 9: 54–62 (In Russ)].
Dixon JS, Jen PY, Gosling JA (1998) Immunohistochemical characteristics of human paraganglion cells and sensory corpuscles associated with the urinary bladder. A developmental study in the male fetus, neonate and infant. J Anat 192 (3): 407–415. https://doi.org/10.1046/j.1469-7580.1998.19230407.x
Vega JA, Del Valle ME, Haro JJ, Naves FJ, Calzada B, Uribelarrea R (1994) The inner-core, outer-core and capsule cells of the human Pacinian corpuscles: an immunohistochemical study. Eur J Morphol 32 (1): 11–18.
Terminologia histological. Международные термины по цитологии и гистологии человека с официальным списком русских эквивалентов (2009) Под ред. ВВ Банина, ВЛ Быкова. М.: ГЭОТАР-Медиа [Terminologia histological. Mezhdunarodnye terminy po citologii i gistologii cheloveka s oficial’nym spiskom russkih ekvivalentov (2009) Pod red. VV Banina, VL Bykova. M.: GEOTAR-Media (In Russ)].
Matejčík V, Haviarová Z, Kuruc R, Šteňo A, Šteňo J (2019) The composition and structure of peripheral nerves. In: Intraspinal Variations of Nerve Roots. Springer, Cham: 3–13.
Suter TACS, Jaworski A (2019) Cell migration and axon guidance at the border between central and peripheral nervous system. Science 365 (6456): eaaw8231. https://doi.org/10.1126/science.aaw8231
Andres KH (1967) On the fine structure of the arachnoidea and dura mater of mammals. Z Zellforsch Mikrosk Anat 79 (2): 272–295.
McCabe JS, Low FN (1969) The subarachnoid angle: an area of transition in peripheral nerve. Anat Rec 164 (1):15–33. https://doi.org/10.1002/ar.1091640102
Haller FR, Low FN (1971) The fine structure of the peripheral nerve root sheath in the subarachnoid space in the rat and other laboratory animals. Am J Anat 131 (1): 1–19. https://doi.org/10.1002/aja.1001310102
Умовист МН, Чайковский ЮБ Современные представления о строении и функции оболочек нерва (1987) Архив анатомии, гистологии и эмбриологии 1: 98–96 [Umovist MN, Tchaikovsky YB Modern concepts of the structure and function of the nerve sheaths (1987) Archive of anatomy, histology and embryology 1: 98–96 (In Russ)].
Bechter K, Schmitz B (2014) Cerebrospinal fluid outflow along lumbar nerves and possible relevance for pain research: case report and review. Croat Med J 55 (4): 399–404. https://doi.org/10.3325/cmj.2014.55.399
Mizisin AP, Weerasuriya A (2011) Homeostatic regulation of the endoneurial microenvironment during development, aging and in response to trauma, disease and toxic insult. Acta Neuropathol 121 (3): 291–312. https://doi.org/10.1007/s00401-010-0783-x
Pettersson CA (1993) Sheaths of the spinal nerve roots. Permeability and structural characteristics of dorsal and ventral spinal nerve roots of the rat. Acta Neuropathol 85 (2): 129–137. https://doi.org/10.1007/BF00227759
Zakharov A, Papaiconomou C, Djenic J, Midha R, Johnston M (2003) Lymphatic cerebrospinal fluid absorption pathways in neonatal sheep revealed by subarachnoid injection of Microfil. Neuropathol Appl Neurobiol 29 (6): 563–573. https://doi.org/10.1046/j.0305-1846.2003.00508.x
Frater JL, Hall GS, Procop GW (2001) Histologic features of zygomycosis: emphasis on perineural invasion and fungal morphology. Arch Pathol Lab Med 125 (3): 375–378. https://doi.org/10.1043/0003-9985(2001)125<0375:HFOZ>2.0.CO;2
Dando SJ, Mackay-Sim A, Norton R, Currie BJ, St John JA, Ekberg JA, Batzloff M, Ulett GC, Beacham IR (2014) Pathogens penetrating the central nervous system: infection pathways and the cellular and molecular mechanisms of invasion. Clin Microbiol Rev 27 (4): 691–726. https://doi.org/10.1128/CMR.00118-13
Schmitt M, Neubauer A, Greiner J, Xu X, Barth TF, Bechter K (2011) Spreading of acute myeloid leukemia cells by trafficking along the peripheral outflow pathway of cerebrospinal fluid. Anticancer Res 31 (6): 2343–2345.
Brown IS (2016) Pathology of perineural spread. J Neurol Surg B Skull Base 77 (2): 124–130. https://doi.org/10.1055/s-0036-1571837
Reale E, Luciano L, Spitznas M (1976) Freeze-fracture aspects of the perineurium of spinal ganglia. J Neurocytol 5: 385–394. https://doi.org/10.1007/BF01181646
Arvidson B (1979) A study of the perineurial diffusion barrier of a peripheral ganglion. Acta Neuropathol 46 (1-2):139–144. https://doi.org/10.1007/BF00684815
Weerasuriya A, Mizisin AP (2011) The blood-nerve barrier: structure and functional significance. Methods Mol Biol 686: 149–173. https://doi.org/10.1007/978-1-60761-938-3_6
Masliukov PM, Emanuilov AI, Madalieva LV, Moiseev KY, Bulibin AV, Korzina MB, Porseva VV, Korobkin AA, Smirnova VP (2014) Development of nNOS-positive neurons in the rat sensory and sympathetic ganglia. Neuroscience 256: 271–281. https://doi.org/10.1016/j.neuroscience.2013.10.013
Nikolaev SI, Gallyamov AR, Mamin GV, Chelyshev YuA (2014) Poly (ε-caprolactone) nerve conduit and local delivery of VEGF and FGF2 genes stimulate neuroregeneration. Bull Exp. Biol Med 157 (1): 155–158. https://doi.org/10.1007/s10517-014-2513-1
Емануйлов АИ, Маслюков ПМ, Ноздрачев АД (2019) Симпатическая иннервация сердца в раннем постнатальном онтогенезе. Рос физиол журнал им. И.М. Сеченова 105 (9): 1133–1141. [Emanuylov AI, Maslyukov PM, Nozdrachev AD (2019) Sympathetic innervation of the heart in early postnatal ontogenesis. Russian Journal of Physiology 105 (9): 1133–1141 (In Russ)]. https://doi.org/10.1134/S086981391909005X
Pummi KP, Heape AM, Grenman RA, Peltonen JT, Peltonen SA (2004) Tight junction proteins ZO-1, occludin, and claudins in developing and adult human perineurium. J Histochem Cytochem 52 (8): 1037–1046. https://doi.org/10.1369/jhc.3A6217.2004
Tsukita S, Tanaka H, Tamura A (2019) The claudins: from tight junctions to biological systems.Trends Biochem Sci 44 (2):141–152. https://doi.org/10.1016/j.tibs.2018.09.008
Alanne MH, Pummi K, Heape AM, Grenman R, Peltonen J, Peltonen S (2009) Tight junction proteins in human Schwann cell autotypic junctions. J Histochem Cytochem 57 (6): 523–529. https://doi.org/10.1369/jhc.2009.951681
Hirakawa H, Okajima S, Nagaoka T, Takamatsu T, Oyamada M (2003) Loss and recovery of the blood-nerve barrier in the rat sciatic nerve after crush injury are associated with expression of intercellular junctional proteins. Exp Cell Res 284 (2): 196–210. https://doi.org/10.1016/s0014-4827(02)00035-6
Lux TJ, Hu X, Ben-Kraiem A, Blum R, Chen JT, Rittner HL (2020) Regional differences in tight junction protein expression in the blood-DRG barrier and their alterations after nerve traumatic injury in rats . Int J Mol Sci: 21 (1). pii: E270. https://doi.org/10.3390/ijms21010270
Sauer RS, Krug SM, Hackel D, Staat C, Konasin N, Yang S, Niedermirtl B, Bosten J, Günther R, Dabrowski S, Doppler K, Sommer C, Blasig IE, Brack A, Rittner HL (2014) Safety, efficacy, and molecular mechanism of claudin-1-specific peptides to enhance blood-nerve-barrier permeability. J Control Release 185: 88–98. https://doi.org/10.1016/j.jconrel.2014.04.029
Miyamoto T, Morita K, Takemoto D, Takeuchi K, Kitano Y, Miyakawa T, Nakayama K, Okamura Y, Sasaki H, Miyachi Y, Furuse M, Tsukita S (2005) Tight junctions in Schwann cells of peripheral myelinated axons: a lesson from claudin-19-deficient mice. J Cell Biol 169 (3): 527–538. https://doi.org/10.1083/jcb.200501154
Reinhold AK, Schwabe J, Lux TJ, Salvador E, Rittner HL (2018) Quantitative and microstructural changes of the blood-nerve barrier in peripheral neuropathy. Front Neurosci 12: 936. https://doi.org/10.3389/fnins.2018.00936.eCollection 2018
Ando-Akatsuka Y, Saitou M, Hirase T, Kishi M, Sakakibara A, Itoh M, Yonemura S, Furuse M, Tsukita S (1996) Interspecies diversity of the occludin sequence: cDNA cloning of human, mouse, dog, and rat-kangaroo homologues. J Cell Biol 133 (1): 43–47. https://doi.org/10.1083/jcb.133.1.43
Mazzeo A, Rodolico C, Monici MC, Migliorato A, Aguennouz M, Vita G (1997) Perineurium talin immunoreactivity decreases in diabetic neuropathy. J Neurol Sci 1997 146 (1): 7–11. https://doi.org/10.1016/s0022-510x(96)00285-7
Jaakkola S, Savunen O, Halme T, Uitto J, Peltonen J 1993 Basement membranes during development of human nerve: Schwann cells and perineurial cells display marked changes in their expression profiles for laminin subunits and beta 1 and beta 4 integrins. J. Neurocytol. 22 (3): 215–230. https://doi.org/10.1007/BF01246360
Nagaoka T, Oyamada M, Okajima S, Takamatsu T (1999) Differential expression of gap junction proteins connexin26, 32, and 43 in normal and crush-injured rat sciatic nerves. Close relationship between connexin43 and occludin in the perineurium. J Histochem Cytochem 47 (7): 937–948. https://doi.org/10.1177/002215549904700711
Stark B, Carlstedt T, Cullheim S, Risling M (2000) Developmental and lesion-induced changes in the distribution of the glucose transporter Glut-1 in the central and peripheral nervous system. Exp Brain Res 131 (1):74–84. https://doi.org/10.1007/s002219900300
Muona P, Sollberg S, Peltonen J, Uitto J (1992) Glucose transporters of rat peripheral nerve. Differential expression of GLUT1 gene by Schwann cells and perineural cells in vivo and in vitro. Diabetes 41: 1587–1596. https://doi.org/10.2337/diab.41.12.1587
Muona P, Jaakkola S, Salonen V, Peltonen J (1993) Expression of glucose transporter 1 in adult and developing human peripheral nerve. Diabetologia 36: 133–140. https://doi.org/10.1007/BF00400694
Tserentsoodol N, Shin BC, Koyama H, Suzuki T, Takata K (1999) Immunolocalization of tight junction proteins, occludin and ZO-1, and glucose transporter GLUT1 in the cells of the blood-nerve barrier. Arch Histol Cytol 62 (5):459–469. https://doi.org/10.1679/aohc.62.459
Takebe K, Nio-Kobayashi J, Takahashi-Iwanaga H, Iwanaga T (2008) Histochemical demonstration of a monocarboxylate transporter in the mouse perineurium with special reference to GLUT1. Biomed Res 29 (6): 297–306. https://doi.org/10.2220/biomedres.29.297
Achtstätter T, Fouquet B, Rungger-Brändle E, Franke WW 1989 Cytokeratin filaments and desmosomes in the epithelioid cells of the perineurial and arachnoidal sheaths of some vertebrate species. Differentiation. 40 (2): 129–149. https://doi.org/10.1111/j.1432-0436.1989.tb00822.x
Kovalenko VL, Shevtsov VI, Shchudlo MM, Shchudlo NA (2000) Reactive properties of epi- and perineurium: experimental and morphological basis for nerve suture technique. Bul Exp Biol Med 130 (2): 793–797. https://doi.org/10.1007/BF02766098
Thomas PK, Bhagat S (1978) The effect of extraction of the intrafascicular contents of peripheral nerve trunks on perineurial structure. Acta Neuropathol (Berl) 43: 135–141. https://doi.org/10.1007/BF00685008
Clark JK, O’Keefe A, Mastracci TL, Sussel L, Matise MP, Kucenas S (2014) Mammalian Nkx2.2+ perineurial glia are essential for motor nerve development. Dev Dyn 243 (9): 1116–1129. https://doi.org/10.1002/dvdy.24158
Anderson WA, Willenberg AR, Bosak AJ, Willenberg BJ, Lambert S Use of a capillary alginate gel (CapgelTM) to study the three-dimensional development of sensory nerves reveals the formation of a rudimentary perineurium. J Neurosci Methods 2018. 305: 46–53. https://doi.org/10.1016/j.jneumeth.2018.05.003
Fontenas L, Kucenas S (2021) Spinal cord precursors utilize neural crest cell mechanisms to generate hybrid peripheral myelinating glia. Elife 10: e64267. https://doi.org/10.7554/eLife.64267
Peltonen S, Alanne M, Peltonen J (2013) Barriers of the peripheral nerve. Tissue Barriers 1:e24956. https://doi.org/10.4161/tisb.24956
Sima A, Sourander P (1973) The effect of perinatal undernutrition on perineurial diffusion barrier to exogenous protein. An experimental study on rat sciatic nerve. Acta Neuropathol 24 (3): 263–272. https://doi.org/10.1007/BF00687596
Sima A, Sourander P (1974) The permeability of perineurium to peroxidase after early undernutrition. An ultrastructural study on rat sciatic nerve. Acta Neuropathol28 (1): 15–23. https://doi.org/10.1007/BF00687514
Le Douarin NM (1986) Cell line segregation during peripheral nervous system ontogeny. Science 231: 1515–1522
Le Douarin NM, Dupin E (2012) The neural crest in vertebrate evolution. Curr Opin Genet Dev 22 (4): 381–389. https://doi.org/10.1016/j.gde.2012.06.001
Etchevers HC, Dupin E, Le Douarin NM (2019) The diverse neural crest: from embryology to human pathology. Development 146 (5): dev169821. https://doi.org/10.1242/dev.169821
Petersen J, Adameyko I (2017) Nerve-associated neural crest: peripheral glial cells generate multiple fates in the body. Curr Opin Genet Dev 45: 10–14. https://doi.org/10.1016/j.gde.2017.02.006
Joseph NM, Mukouyama YS, Mosher JT, Jaegle M, Crone SA, Dormand E-L, Lee K-F, Meijer D, Anderson DJ, Morrison SJ (2004) Neural crest stem cells undergo multilineage differentiation in developing peripheral nerves to generate endoneurial fibroblasts in addition to Schwann cells . Development 131 (22): 5599–5612. https://doi.org/10.1242/dev.01429
Dupin E, Sommer L (2012) Neural crest progenitors and stem cells: from early development to adulthood. 366 (2012) 83–95. https://doi.org/10.1016/j.ydbio.2012.02.035
Le Douarin NM, Dupin E (2018) The “beginnings” of the neural crest. Dev Biol 444 (1): S3-S13. https://doi.org/10.1016/j.ydbio.2018.07.019
Graham A (2003) The neural crest. Curr Biol 13 (10): R381–384. https://doi.org/10.1016/s0960-9822 (03)00315-4
Graham A, Begbie J, McGonnell I (2004) Significance of the cranial neural crest. Dev Dyn 229 (1): 5–13. https://doi.org/10.1002/dvdy.10442
Чумасов ЕИ (1976) Морфология периневрия в органотипической культуре чувствительных ганглиев. В кн: Тканевая биология. Тарту. С. 79–82 [ Chumasov EI (1976) Morfologiya perinevriya v organotipicheskoj kul’ture chuvstvitel’nyh gangliev. V kn: Tkanevaya biologiya Tartu 79–82 (In Russ)].
Чумасов ЕИ, Коновалов ГВ (1977) Морфология нервной ткани в культуре. Культура нервной ткани. М. Медицина: 63–127. [Chumasov EI, Konovalov GV (1977) Morfologiya nervnoj tkani v kul’ture. Kul’tura nervnoj tkani. M. Medicina: 63–127 (In Russ)].
Bunge MB, Wood PM, Tynan LB, Bates ML, Sanes JR (1989) Perineurium originates from fibroblasts: Demonstration in vitro with a retroviral marker. Science 243: 229–231. https://doi.org/10.1126/science.2492115
Kazamel M, Boes CJ (2017) Renaut Corpuscles or Peripheral Nerve Infarcts? A Historical Overview. Can J Neurol Sci 44 (2): 184–189. https://doi.org/10.1017/cjn.2016.406
Петрова ЕС (2012) Применение стволовых клеток для стимуляции регенерации поврежденного нерва. Цитология 54 (7): 525–540. [Petrova E.S. (2012) The use of stem cells to stimulate the regeneration of the damaged nerve. Tsitologiya 54 (7): 525–540 (In Russ).
Petrova ES (2015) Injured nerve regeneration using cell-based therapies: current challenges. Acta Naturae 7 (3 (26)): 38–47. https://doi.org/10.32607/20758251-2015-7-3-38-47
Petrova ES (2018) Differentiation potential of mesenchymal stem cells and stimulation of nerve regeneration. Russ J Development Biol 49 (4): 193–205. https://doi.org/10.1134/S1062360418040033
Huang CW, Huang WC, Qiu X, Fernandes Ferreira da Silva F, Wang A, Patel S, Nesti LJ, Poo MM, Li S (2017) The differentiation stage of transplanted stem cells modulates nerve regeneration. Sci Rep 7 (1): 17401. https://doi.org/10.1038/s41598-017-17043-4
Du J, Zhen G, Chen H, Zhang S, Qing L, Yang X, Lee G., Mao HQ, Jia X (2018) Optimal electrical stimulation boosts stem cell therapy in nerve regeneration. Biomaterials 181: 347–359. https://doi.org/10.1016/j.biomaterials.2018.07.015
Xia B, Chen G, Zou Y, Yang L, Pan J, Lv Y (2019) Low-intensity pulsed ultrasound combination with induced pluripotent stem cells-derived neural crest stem cells and growth differentiation factor 5 promotes sciatic nerve regeneration and functional recovery. J Tissue Eng Regen Med 13 (4): 625–636. https://doi.org/10.1002/term.2823
Petrova E, Isaeva E, Kolos E, Korzhevskii D (2018) Allogeneic bone marrow mesenchymal stem cells in the epineurium and perineurium of the recipient rat. Biol Communicat 63 (2): 123–132. https://doi.org/10.21638/spbu03.2018.205
Petrova ES, Kolos EA, Korzhevskii DE (2021) Changes in the thickness of rat nerve sheaths after single subperineural administration of rat bone marrow mesenchymal stem cells. Bull Exp Biol Med 4. https://doi.org/10.1007/s10517-021-05267-4
Kucenas S, Wang WD, Knapik EW, Appel B (2009) A selective glial barrier at motor axon exit points prevents oligodendrocyte migration from the spinal cord. J Neurosci 29: 15187–15194. https://doi.org/10.1523/JNEUROSCI.4193-09.2009
Lunn ER, Scourfield J, Keynes RJ, Stern CD (1987). The neural tube origin of ventral root sheath cells in the chick embryo. Development 101: 247–254
Boyd BS, Gray AT, Dilley A, Wanek L, Topp KS (2012) The pattern of tibial nerve excursion with active ankle dorsiflexion is different in older people with diabetes mellitus. Clin Biomech (Bristol, Avon) 27 (9): 967–971. https://doi.org/10.1016/j.clinbiomech.2012.06.013
Ross MH, Reith EJ (1989) Perineurium: Evidence for contractile elements. Science 165: 604–606. https://doi.org/10.1126/science.165.3893.604
De Jonge RR, Vreijling JP, Meintjes A, Kwa MS, van Kampen AH, van Schaik IN, Baas F (2003) Transcriptional profile of the human peripheral nervous system by serial analysis of gene expression. Genomics 82 (2): 97–108. https://doi.org/10.1016/s0888-7543(03)00124-1
De Jonge RR, van Schaik IN, Vreijling JP, Troost D, Baas F (2004) Expression of complement components in the peripheral nervous system. Hum Mol Genet 13 (3): 295–302. https://doi.org/10.1093/hmg/ddh029
Погорелов ЮВ (2001) Гистогематические барьеры В кн.: Руководство по гистологии. Т. I. СПб: СпецЛит. С. 465–494 [Pogorelov YV (2001) Gistogematicheskie bar’ery V kn.: Rukovodstvo po gistologii. T. I. SPb: SpecLit. 465–494 (In Russ)].
Burkel WE (1967) The histological fine structure of perineurium. Anat Rec 158 (2):177–189. https://doi.org/10.1002/ar.1091580207
Hall SM, Williams PL (1971) The distribution of electron-dense tracers in peripheral nerve fibres. J Cell Sci. 8 (2):541–555.
Klemm H (1970) The perineurium: a diffusion barrier for peroxidase in epineurial and endoneurial application. Z Zellforsch Mikrosk Anat108 (3): 431–445.
Olsson Y, Reese TS (1971) Permeability of vasa nervorum and perineurium in mouse sciatic nerve studied by fluorescence and electron microscopy. J Neuropathol Exp Neurol 30 (1):105–119. https://doi.org/10.1097/00005072-197101000-00011
Palladino SP, Helton ES, Jain P, Dong C, Crowley MR, Crossman DK, Ubogu EE (2017) The Human Blood-Nerve Barrier Transcriptome. Sci Rep 7 (1): 17477. https://doi.org/10.1038/s41598-017-17475-y
Ouyang X, Dong C, Ubogu EE (2019) In situ molecular characterization of endoneurial microvessels that form the blood-nerve barrier in normal human adult peripheral nerves. J Peripher Nerv Syst 24 (2):195–206. https://doi.org/10.1111/jns.12326
Dong C, Ubogu EE (2018) GDNF enhances human blood-nerve barrier function in vitro via MAPK signaling pathways. Tissue Barriers 6 (4):1–22. https://doi.org/10.1080/21688370.2018.1546537
Moreau N, Mauborgne A, Couraud PO, Romero IA, Weksler BB, Villanueva L Pohl M, Boucher Y (2017) Could an endoneurial endothelial crosstalk between Wnt/β-catenin and Sonic Hedgehog pathways underlie the early disruption of the infra-orbital blood-nerve barrier following chronic constriction injury? Mol Pain 13:1744806917727625. https://doi.org/10.1177/1744806917727625
Moreau N, Mauborgne A, Bourgoin S, Couraud PO, Romero IA, Weksler BB, Villanueva L, Pohl M, Boucher Y (2016) Early alterations of Hedgehog signaling pathway in vascular endothelial cells after peripheral nerve injury elicit blood-nerve barrier disruption, nerve inflammation, and neuropathic pain development. Pain 157 (4): 827–839. https://doi.org/10.1097/j.pain.0000000000000444
Быков ВЛ (2007) Цитология и общая гистология. Санкт-Петербург: Сотис. [Bykov V.L. (2007) Citologija i obshhaja gistologija. Sankt-Peterburg: Sotis (In Russ)].
Oldfors A, Johansson BR (1979) Barriers and transport properties of the perineurium. An ultrastructural study with 125I-labeled albuminin and horseradish peroxidase in normal and protein-deprived rats. Acta Neuropathol 47 (2):139–143. https://doi.org/10.1007/BF00717037
Oldfors A (1981) Permeability of the perineurium of small nerve fascicles: an ultrastructural study using ferritin in rats. Neuropathol Appl Neurobiol 7 (3):183–194. https://doi.org/10.1111/j.1365-2990.1981.tb00088.x
Parmantier E, Lynn B, Lawson D, Turmaine M, Namini SS, Chakrabarti L, McMahon AP, Jessen KR, Mirsky R (1999) Schwann cell-derived Desert hedgehog controls the development of peripheral nerve sheaths. Neuron 23 (4): 713–724. https://doi.org/10.1016/s0896-6273(01)80030-1
Jung J, Frump D, Su J, Wang W, Mozaffar T, Gupta R (2015) Desert hedgehog is a mediator of demyelination in compression neuropathies. Exp Neurol 271: 84–94. https://doi.org/10.1016/j.expneurol.2015.04.014
Fontenas L, Kucenas S (2017) Livin’ on the edge: glia shape nervous system transition zones. Curr Opin Neurobiol 47:44–51. https ://doi.org/https://doi.org/10.1016/j.conb.2017.09.008
Chen ZL, Yu WM, Strickland S (2007) Peripheral regeneration. Annu ReNeurosci 30: 209–233. https://doi.org/10.1146/annurev.neuro.30.051606.094337
Monk KR, Feltri ML, Taveggia C (2015) New insights on Schwann cell development. Glia 63: 1376–1393 https://doi.org/10.1002/glia.22852
Ohara S, Takahashi H, Ikuta F (1986) Ultrastructural alterations of perineurial cells in the early stage of Wallerian degeneration. Lab Invest 54 (2): 213–221.
Spencer PS, Weinberg HJ, Raine CS, Prineas JW (1975) The perineurial window – a new model of focal demyelination and remyelination. Brain Res 96: 323–329. https://doi.org/10.1016/0006-8993(75)90742-8
Radek A, Thomas PK, King RH (1986) Perineurial differentiation in interchange grafts of rat peripheral nerve and spinal root. J Anat 147: 207–217.
Lewis GM, Kucenas S (2014) Perineurial glia are essential for motor axon regrowth following nerve injury. J Neurosci 34 (38):12762–12777. https://doi.org/10.1523/JNEUROSCI.1906-14.2014
Ohta M, Okajima S, Hirakawa H, Tokunaga D, Fujiwara H, Oda R, Kobashi H, Hirata M, Kubo T (2005) Expression of tight and gap junctional proteins in the perineurial window model of the rat sciatic nerve. Int J Neurosci 115 (10):1469–1481. https://doi.org/10.1080/00207450591001871
Toyoda T, Ochiai K, Ohashi K, Tomioka Y, Kimura T, Umemura T (2005) Multiple perineuriomas in chicken (Gallus gallus domesticus). Vet Pathol 42 (2):176–183. https://doi.org/10.1354/vp.42-2-176
Pummi KP, Aho HJ, Laato MK, Peltonen JT, Peltonen SA (2006) Tight junction proteins and perineurial cells in neurofibromas. J Histochem Cytochem 54 (1): 53–61. https://doi.org/10.1369/jhc.5A6671.2005
Shelekhova KV, Danilova AB, Michal M, Kazakov DV (2008) Hybrid neurofibroma-perineurioma: an additional example of an extradigital tumor. Ann Diagn Pathol 12 (3): 233–234. https://doi.org/10.1016/j.anndiagpath.2008.02.012
Gibson JD (1979) The origin of the neural macrophage: a quantitative ultrastructural study of cell population changes during Wallerian degeneration. J Anat 129 (1): 1–19.
Hirata K, Kawabuchi M (2002) Myelin phagocytosis by macrophages and nonmacrophages during Walleriandegeneration. Microsc Res Tech 57: 541–547. https://doi.org/10.1002/jemt.10108
De la Motte DJ, Hall SM, Allt G (19 75) A study of the perineurium in peripheral nerve pathology. Acta Neuropathol 33 (3): 257–270. https://doi.org/10.1007/BF00688398
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


