Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 219-231
ВОССТАНАВЛИВАЮЩИЙ ЭФФЕКТ КОМБИНИРОВАННОГО ИНТРАНАЗАЛЬНОГО ВВЕДЕНИЯ ИНСУЛИНА И С-ПЕПТИДА НА ГОРМОНАЛЬНЫЙ СТАТУС И ГИПОТАЛАМИЧЕСКИЙ СИГНАЛИНГ В МОДЕЛИ КРАТКОСРОЧНОГО ТЯЖЕЛОГО СТРЕПТОЗОТОЦИН-ИНДУЦИРОВАННОГО ДИАБЕТА У САМЦОВ КРЫС
К. В. Деркач 1, А. А. Бахтюков 1, Н. Е. Басова 1, И. И. Зорина 1, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 14.02.2022
После доработки 16.03.2022
Принята к публикации 22.03.2022
- EDN: VYOZVM
- DOI: 10.31857/S0044452922030020
Аннотация
Уже на ранних стадиях тяжелого сахарного диабета 1-го типа (СД1), для которого характерны сильно выраженный инсулиновый дефицит, острая гипергликемия и гиперфагия, возникают нарушения инкретинового и адипокинового статуса и эндокринные дисфункции, меняется гипоталамическая регуляция. Это во многом обусловлено дефицитом инсулина в мозге, вследствие чего применение интраназально вводимого инсулина (ИВИ), компенсирующего его недостаток, способно предотвратить ряд негативных последствий СД1. Поскольку при СД1 также отмечается дефицит С-пептида проинсулина, способного усиливать эффекты инсулина, то представляется перспективным использовать совместное введение ИВИ с интраназально вводимым С-пептидом (ИСП). Целью работы было изучить влияние 7-дневного лечения крыс с непродолжительным СД1, вызванным высокой дозой стрептозотоцина (65 мг/кг), с помощью ИВИ (20 мкг/крысу/день), в том числе совместно с ИСП (36 мкг/крысу/день), на уровни гормонов и инкретинов в крови и на экспрессию гипоталамических генов, кодирующих факторы пищевого поведения, рецепторы инсулина, лептина, серотонина и дофамина, а также регуляторы митохондриальной динамики и апоптоза. Лечение ИВИ и его комбинацией с ИСП нормализовали повышенные при СД1 уровни глюкагоноподобного пептида-1 (ГПП-1) и грелина и увеличивали сниженные при СД1 уровни лютеинизирующего и тиреотропного гормонов, тиреоидных гормонов, не влияя на уровень тестостерона. Одним из механизмов этого было повышение в гипоталамусе экспрессии анорексигенных генов, кодирующих меланокортиновый рецептор 4-го типа и про-опиомеланокортин, снижение генной экспрессии орексигенного нейропептида Y и нормализация экспрессии генов, ответственных за митохондриальную динамику (Mfn-1, Mfn-2, Drp-1), апоптоз (Bcl-2) и аутофагию (Beclin-1). Монотерапия с ИВИ была менее эффективной, в то время как монотерапия ИСП практически не влияла на оцениваемые показатели. Таким образом, лечение комбинацией ИВИ с ИСП и, в меньшей степени, одним ИВИ нормализует уровни ГПП-1 и грелина, восстанавливает уровень лютеинизирующего гормона и гормональные показатели тиреоидной системы у самцов крыс с краткосрочным тяжелым СД1, что обусловлено, в том числе, нормализацией гипоталамической сигнализации.
Начальные стадии сахарного диабета 1-го типа (СД1) характеризуются постепенным нарастанием симптоматики инсулиновой недостаточности без явных изменений глюкозного гомеостаза. Однако после снижения уровня инсулина ниже определенного критического уровня стремительно развивается сильно выраженная гипергликемия, что может привести к кетоацидотической коме и необратимым изменениям в органах и тканях, в том числе в ЦНС. Для изучения острого СД1 обычно используют модель стрептозотоцин-индуцированного диабета, для чего грызунам однократно вводят высокие дозы стрептозотоцина (СТЗ, 60–70 мг/кг для 2–3-месячных крыс), что приводит к резкому ослаблению у них инсулин-продуцирующей функции β-клеток поджелудочной железы. При такой модели СД1, наряду с системным инсулиновым дефицитом, развивается острая недостаточность инсулина в мозге, поскольку его единственным источником является инсулин, поступающий из крови через гематоэнцефалический барьер. Следует отметить, что инсулиновая сигнальная система широко представлена в гипоталамусе и других структурах мозга. Она контролирует не только функционирование интегративных нейрональных сетей, но также метаболизм, инсулиновую чувствительность и различные системы организма, включая эндокринную [1–3].
Устранить недостаток инсулина в мозге можно путем его подкожных инъекций (классическая инсулиновая терапия) или доставкой гормона непосредственно в мозг – с помощью интрацеребровентрикулярного введения, которое в условиях клиники неприменимо [4], или с помощью интраназального введения, когда инсулин по аксональным путям беспрепятственно поступает в обонятельную луковицу и затем в гипоталамус и другие отделы мозга [4–6]. Лечение СД1 интраназально вводимым инсулином (ИВИ) имеет практическое значение, поскольку позволяет предотвратить диабетическую энцефалопатию и когнитивный дефицит, а также улучшить энергетический обмен и эндокринные функции, которые зависят в том числе и от активности инсулиновой системы мозга [7, 8]. Следует отметить, что в клинике в настоящее время ИВИ применяется для лечения болезни Альцгеймера и других когнитивных расстройств, в том числе ассоциированных с СД1 и постоперационными состояниями [9–12]. Экспериментальные и доклинические исследования показывают его эффективность для предотвращения нейродегенерации, в том числе при ишемических поражениях головного мозга [13], а также демонстрируют индуцированное длительным введением инсулина улучшение эндокринных функций, нарушенных при диабете [7].
Биосинтез инсулина в β-клетках включает стадию сайт-специфичного расщепления молекулы проинсулина, в ходе которого, наряду с инсулином, генерируется С-пептид. Он необходим для правильной сшивки A- и B-цепей инсулина с помощью межмолекулярных дисульфидных связей, а также образует гетероолигомерные комплексы с инсулином, обеспечивая сохранение его активности, по крайней мере, до секреции в кровоток [14–16]. Имеются свидетельства, что С-пептид играет самостоятельную роль в регуляции физиологических процессов, действуя через собственную сигнальную систему, хотя природа рецептора для него не выяснена [17]. Предполагают также, что С-пептид образует комплексы с инсулином и после секреции в кровоток, обеспечивая его защиту от протеолитических ферментов, в том числе инсулиндеградирующего фермента. Кроме того, С-пептид облегчает диссоциацию инсулина из его комплексов, повышая эффективность его взаимодействия с инсулиновым рецептором. Все это делает актуальным применение комплексов инсулина с С-пептидом при устранении системного инсулинового дефицита при СД1, в том числе в ЦНС [18–20].
Применение различных молярных соотношений С-пептида и инсулина при их интраназальном введении диабетическим крысам показало, что оптимальным является соотношение 3: 1 или близкие к нему [21–23]. Однако исследования проводили на моделях длительного мягкого или среднетяжелого СД1, когда функции С-пептида и инсулина состояли в отсроченной компенсации уже установившегося инсулинового дефицита в ЦНС, в то время как возможность компенсации острого дефицита инсулина на начальных стадиях тяжелого СД1 не была исследована. Такая компенсация имеет большое значение для устранения или ослабления ранней, порой очень тяжелой симптоматики стремительно развивающегося СД1, и позволяет выяснить эффективность превентивного восстановления инсулинового сигналинга в мозге в условиях нарастающего дефицита инсулина в ЦНС.
Целью работы было изучить влияние семидневного введения ИВИ и интраназально вводимого С‑пептида (ИСП) и их комбинации на массу тела, уровни инсулина, лептина и инкретинов в крови, гормональные показатели, характеризующие статус репродуктивной и тиреоидной систем, а также на экспрессию гипоталамических генов, кодирующих компоненты пептидергических и моноаминергических систем, орексигенные и анорексигенные факторы, регуляторы митохондриальной динамики и апоптоза у самцов крыс с непродолжительной моделью тяжелого СД1. СД1 вызывали высокой дозой СТЗ (65 мг/кг), и лечение начинали через 7 дней после инъекции СТЗ. Совместное введение ИВИ и ИСП сравнивали с монотерапией этими препаратами, используя ИВИ и ИСП в тех же дозах. Выбор для исследования инсулина, лептина и инкретинов обусловлен не только их важной ролью в регуляции энергетического обмена, но и участием в контроле функций эндокринной системы [24–28]. В свою очередь, исследование функционального состояния гипоталамических сигнальных систем и факторов, определяющих выживаемость и активность гипоталамических нейронов, вызвано определяющей ролью гипоталамуса в контроле гипоталамо-гипофизарной-гонадной и -тиреоидной систем.
МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали самцов крыс линии Вистар в возрасте 2–2.5 месяца, которых содержали в стандартных условиях вивария, на стандартном рационе (сухая кормовая смесь) и со свободным доступом к воде и пище. Все процедуры по уходу и использованию животных осуществляли в полном соответствии с требованиями Этического комитета Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (протокол № 3/02-2020), European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Индукция сахарного диабета 1-го типа. СД1 вызывали в/б введением крысам СТЗ (“Sigma”, США), растворенного в 0.1 М натрий-цитратном буфере (pH 4.5), в дозе 65 мг на кг массы тела животного. Спустя 7 дней после инъекции СТЗ отбирали крыс с постпрандиальным уровнем глюкозы выше 20 ммоль/л. Уровень глюкозы оценивали в цельной крови с помощью тест-полосок “One Touch Ultra” (США) и глюкометра. Случайным образом формировали 4 группы диабетических крыс (в каждой по 6 животных): диабет без лечения (Д), диабет с лечением ИВИ в суточной дозе 20 мкг/крысу (ДИ), ИСП в суточной дозе 36 мкг/крысу (ДС) и совместно ИВИ и ИСП в тех же дозах (ДИС). Продолжительность лечения составила 7 дней, препараты растворяли в 0.1 М натрий-цитратном буфере (pH 4.5) и вводили ежедневно в 10.00. Контрольные крысы (К) в те же сроки и в том же объеме получали растворитель. На протяжении эксперимента определяли количество потребляемого стандартного корма (пересчитывали в ккал/крыса/день). На шестой день эксперимента у животных забирали образцы крови, взятой под местным наркозом (2%-ный раствор лидокаина, 2–4 мг/кг) из хвостовой вены, для оценки уровня тиреоидных гормонов, тестостерона и тиреотропного гормона (ТТГ). На седьмой день эксперимента за 1 ч до выведения животных из опыта (12.00) забирали кровь для оценки уровней инсулина, лептина, глюкагоноподобного пептида-1 (ГПП-1), грелина и лютеинизирующего гормона (ЛГ). У каждого животного отбирали около 700‒800 мкл крови, что позволяло получить 240‒280 мкл сыворотки, необходимой для измерения концентрации гормонов. Перед забоем также определяли содержание гликированного гемоглобина (HbA1c), являющегося интегральным показателем выраженности гипергликемии, для чего использовали набор Multi Test HbA1c System (“Polymer Technology Systems”, США). В конце эксперимента крыс наркотизировали (хлоральгидрат, 400 мг/кг, в/б), декапитировали и забирали образцы гипоталамуса для изучения экспрессии генов.
Измерение уровня инсулина, лептина, инкретинов и гликопротеиновых гипофизарных гормонов. Уровни инсулина, лептина, ГПП-1, грелина, ЛГ и ТТГ в крови оценивали с помощью иммуноферментных наборов “Rat Insulin ELISA” (“Mercodia”, Швеция), “ELISA for Leptin, Rat”, “ELISA for GLP-1, Rat”, “ELISA for Ghrelin, Rat” и “ELISA for LH, Rat” (“Cloud-Clone Corp.”, США), “ELISA, Rat TSH” (“Cusabio Biotech. Co., Ltd.”, Китай). Уровни свободного (fT4) и общего тироксина (tT4), свободного (fT3) и общего трийодтиронина (tT3) оценивали с помощью наборов фирмы “Иммунотех” (Россия), уровень тестостерона – с помощью набора “Тестостерон ИФА” (“Алкор-Био”, Россия).
Измерение экспрессии гипоталамических генов. Экспрессию генов в образцах гипоталамуса оценивали с помощью количественной ПЦР с обратной транскрипцией, для чего из ткани гипоталамуса выделяли тотальную РНК с помощью TRIzol Reagent (США), как описано ранее [29]. Для получения кДНК использовали коммерческий набор “MMLV RT Kit” (“Евроген”, Россия). Амплификацию осуществляли в смеси, содержащей 10 нг обратно транскрибированного продукта, по 0.4 мкМ прямого и обратного праймеров, среду “qPCRmix-HS SYBR+LowROX” (“Евроген”, Россия). Амплификационный сигнал детектировали с помощью прибора “7500 Real-Time PCR System” (“Thermo Fisher Scientific Inc.”, США). Для оценки экспрессии генов, кодирующих митофузины-1 (Mfn-1) и -2 (Mfn-2), митохондриальный белок DRP-1 (Drp-1), регулятор аутофагии BECLIN-1 (Beclin-1), проапоптотический белок BAX (Bax), антиапоптотический белок BCL-2 (Bcl-2), меланокортиновые рецепторы 3-го и 4-го типов (Mc3r, Mc4r), про-опиомеланокортин (ПОМК) (Pomc), агути-подобный пептид (Agrp), нейропептид Y (Npy), дофаминовые рецепторы 1-го (D1r) и 2-го типов (D2r), серотониновые рецепторы 1B- (Htr1b) и 2C-подтипов (Htr2c), инсулиновый (Insr) и лептиновый рецепторы (Lepr), протеинфосфотирозинфосфатазу 1B (Ptp1b), использовали праймеры, приведенные в табл. 1. Ген 18S rRNA использовали как референсный. Данные рассчитывали с помощью метода delta-delta Ct, как описано ранее [29].
Таблица 1.
Прямые и обратные праймеры, использованные для изучения экспрессии генов гипоталамических белков у контрольных и диабетических крыс
| Ген | Прямой праймер | Обратный праймер |
|---|---|---|
| Mfn-1 | CTGGTGGAGATACAGGGCTAC | ACAGCATTGCGTTGATGACA |
| Mfn-2 | ATGTCAAAGGGTACCTGTCCA | CAATCCCAGATGGCAGAACTT |
| Drp-1 | GCTCAGTGCTGGAAAGCCTA | ACTCCATTTTCTTCTCCTGTTGT |
| Beclin-1 | TTCAAGATCCTGGACCGAGTGAC | AGACACCATCCTGGCGAGTTTC |
| Bax | TAGCAAACTGGTGCTCAAGG | TCTTGGATCCAGACAAGCAG |
| Bcl-2 | TAGCAAACTGGTGCTCAAGG | TCTTGGATCCAGACAAGCAG |
| Mc3r | CAGCACATGGATAATATCTTCGACTCT | GGCAATGGCCAGGAGGTT |
| Mc4r | TGGGTGTCATAAGCCTGTTGG | GCGTCCGTGTCCGTACTG |
| Pomc | AGGACCTCACCACGGAAAG | GTCAAGGGCTGTTCATCTCC |
| Agrp | TGAAGAAGACAGCAGCAGACC | TGAAGAAGCGGCAGTAGCAC |
| Npy | ACCAGGCAGAGATATGGCAAGA | GGACATTTTCTGTGCTTTCTCTCATTA |
| D1r | ACATCTGGGTAGCCTTTGACATC | TACCTGTCCACGCTGATCACG |
| D2r | GCAGCAGTCGAGCTTTCAGA | CGCCTGTTCACTGGGAAACT |
| Htr1b | TCCGGGTCTCCTGTGTACGT | GGCGTCTGAGACTCGCACTT |
| Htr2c | CGAGTCCGTTTCTCGTCTAGCT | TTGGCCTATGCTTGCAGGTA |
| Insr | CTGGAGAACTGCTCGGTCATT | GGCCATAGACACGGAAAAGAAG |
| Lepr | GCATGCAGAATCAGTGATATTTGG | CAAGCTGTATCGACACTGATTTCTTC |
| Ptp1b | CAACCGAGGAGGAACAAAAGG | CAGTCTGTCAGTGAAAACATACCCG |
| 18S rRNA | GGACACGGACAGGATTGACA | ACCCACGGAATCGAGAAAGA |
Статистический анализ экспериментальных данных. Для статистической обработки полученных данных использовали программу “Microsoft Office Excel 2007”, результаты представляли как M ± SEM. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, статистически значимыми считали различия при p <0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела и жировой ткани, глюкозный гомеостаз и уровни гормонов и инкретинов в крови диабетических крыс и влияние лечения ИВИ и ИСП
Масса тела и жировой ткани (эпидидимального и абдоминального жира) у диабетических крыс была значимо снижена в сравнении с контрольной группой (табл. 2). Потребление пищи, оцениваемое в килокалориях, в группе Д было повышено, что свидетельствует о развитии гиперфагии. У диабетических крыс были в значительной степени повышены уровни постпрандиальной глюкозы и гликированного гемоглобина (HbA1c), что указывает на тяжелую форму гипергликемии. Уровни инсулина и лептина в группе Д в значительной степени снижались, в случае инсулина в 5 раз, что свидетельствует о развитии острого инсулинового дефицита, характерного для тяжелой формы стрептозотоцинового СД1. Лечение диабетических крыс ИВИ и ИСП не влияло на массу тела и жировой ткани, показатели глюкозного гомеостаза и уровень инсулина. При этом лечение ИВИ или совместно ИВИ и ИСП значимо снижало потребление пищи и в небольшой степени повышало уровень лептина, хотя различия с группой Д в этом случае не были значимыми.
Таблица 2.
Масса тела и жировой ткани, потребление пищи, уровни глюкозы, гликированного гемоглобина, инсулина, лептина, ГПП-1, грелина, ЛГ и ТТГ в крови крыс с краткосрочным СД1 и влияние на эти показатели лечения ИВИ и ИСП
| Показатель | К | Д | ДИ | ДС | ДИС |
|---|---|---|---|---|---|
| Масса тела, г | 315.2 ± 7.8 | 283.8 ± 5.8 a | 285.2 ± 9.5 a | 291.5 ± 7.6 | 287.8 ± 7.8 a |
| Масса жира, г* | 7.8 ± 0.3 | 5.7 ± 0.4 a | 5.8 ± 0.4 a | 6.2 ± 0.3 a | 5.8 ± 0.3 a |
| Потребление пищи, ккал/крыса/день** | 59.2 ± 1.7 | 78.2 ± 2.1 a | 67.3 ± 2.1 a,b | 73.3 ± 1.0 a,c | 66.2 ± 3.3 b |
| Глюкоза, мМ | 4.9 ± 0.2 | 23.4 ± 1.6 a | 21.7 ± 2.0 a | 24.5 ± 1.4 a | 22.7 ± 1.3 a |
| HbA1c, % | 4.4 ± 0.2 | 7.0 ± 0.3 a | 6.5 ± 0.3 a | 6.8 ± 0.3 a | 6.5 ± 0.3 a |
| Инсулин, нг/мл | 0.81 ± 0.09 | 0.16 ± 0.04 a | 0.18 ± 0.05 a | 0.19 ± 0.04 a | 0.20 ± 0.05 a |
| Лептин, нг/мл | 2.73 ± 0.21 | 1.24 ± 0.17 a | 1.69 ± 0.19 a | 1.47 ± 0.19 a | 1.71 ± 0.22 a |
| ГПП-1, пг/мл | 28.3 ± 1.3 | 37.4 ± 2.2 a | 33.2 ± 1.6 a | 38.9 ± 2.0 a | 29.1 ± 1.7 b |
| Грелин, нг/мл | 1.27 ± 0.12 | 2.12 ± 0.21 a | 1.79 ± 0.14 a | 2.00 ± 0.23 a | 1.52 ± 0.19 |
| ЛГ, нг/мл | 2.21 ± 0.21 | 1.13 ± 0.14 a | 1.94 ± 0.24 b | 1.44 ± 0.16 a | 2.08 ± 0.25 b |
| ТТГ, мкМЕ/мл | 0.76 ± 0.09 | 0.40 ± 0.06 a | 0.86 ± 0.10 b | 0.54 ± 0.07 c | 1.15 ± 0.09a,b |
Различия с группами К (a), Д (b) и ДИ (с) статистически значимы при p <0.05. Данные представлены как M ± SEM, n = 6. * – масса жира включает сумму масс абдоминального и эпидидимального жира. ** – рассчитывали в течение 6 дней лечения (исключая последний день эксперимента, когда осуществляли декапитацию животных).
У диабетических крыс отмечали значимое повышение уровней ГПП-1 и грелина в крови. Лечение с помощью комбинации ИВИ и ИСП приводило к снижению уровней инкретинов. У диабетических крыс снижались уровни ЛГ и ТТГ, что указывает на нарушение функций гонадной и тиреоидной осей на гипоталамическом и (или) гипофизарном уровнях. Лечение ИВИ и комбинацией ИВИ и ИСП нормализовало уровни гормонов, причем в группе ДИС отмечали повышение уровня ТТГ выше такового в контроле. Монотерапия ИСП лишь в небольшой степени влияла на уровни ЛГ и ТТГ, хотя и смягчала дефицит этих гормонов.
Уровни тиреоидных гормонов и тестостерона в крови диабетических крыс и влияние лечения ИВИ и ИСП
Изучение уровней тиреоидных гормонов и андрогенного статуса показало, что при остром СД1 уровни тиреоидных гормонов и тестостерона достоверно снижались (рис. 1). ИВИ нормализовал уровень свободного тироксина (fT4), в то время как комбинация ИВИ и ИСП нормализовала уровни всех тиреоидных гормонов, причем в случае fT4, tT4 и tT3 различия с группой Д были статистически значимыми. Монотерапия ИСП в отношении восстановления тиреоидного статуса не была эффективной. На уровень тестостерона в крови диабетических крыс все варианты лечения ИВИ и ИСП не влияли.
Рис. 1.
Уровни тиреоидных гормонов и тестостерона у самцов крыс с краткосрочным СД1 и влияние на них ИВИ и ИСП. (a) – свободный тироксин (fT4), (b) – общий тироксин (tT4), (c) – свободный трийодтиронин (fT3), (d) – общий трийодтиронин (tT3), (e) – тестостерон. Обозначения групп: C (К) – контроль; D (Д) – диабет без лечения; DI (ДИ) – диабет с лечением интраназально вводимым инсулином в суточной дозе 20 мкг/крысу; DC (ДС) – диабет с лечением интраназально вводимым C-пептидом в суточной дозе 36 мкг/крысу; DIC (ДИС) – комбинированное лечение интраназально вводимыми инсулином и C-пептидом в тех же дозах. Различия с группами К (a) и Д (b) статистически значимы при p <0.05. Данные представлены как M ± SЕМ, n = 6.

Экспрессия гипоталамических генов у диабетических крыс и влияние лечения ИВИ и ИСП
В гипоталамусе исследовали экспрессию нескольких групп генов. Первая группа кодировала белки, ответственные за биогенез митохондрий – митофузины-1 и -2 (Mfn-1, Mfn-1), белок BECLIN-1, регулирующий аутофагию (Beclin-1), а также проапототический белок BAX (Bax) и антиапоптотический белок BCL-2 (Bcl-2). Вторая группа генов кодировала гены, ответственные за регуляцию пищевого поведения, в том числе меланокортиновые рецепторы 3-го и 4-го типов (Mc3r, Mc4r), про-опиомеланокортин (ПОМК), прекурсор анорексигенных меланокортиновых пептидов (Pomc), орексигенные факторы – нейропептид Y и агути-подобный пептид (Npy, Agrp). Третья группа включала как гены, кодирующие рецепторы биогенных аминов – дофамина (D1r, D2r) и серотонина (Htr1b, Htr2c), так и гены, кодирующие рецепторы инсулина (Insr) и лептина (Lepr) и негативный регулятор инсулинового и лептинового сигналинга – тирозиновую фосфатазу 1B (Ptp1b).
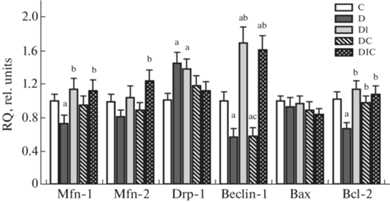
При СД1 снижалась экспрессия генов митофузина-1 и белков BECLIN-1 и BCL-2 (рис. 2). Лечение ИВИ и комбинацией ИВИ и ИСП ее нормализовало, в случае BECLIN-1 повышало экспрессию выше ее уровня в контроле. ИСП достоверно повышал только экспрессию гена Bcl-2. У животных с СД1 возрастала экспрессия гена белка DRP-1. Лечение ИВИ ее не меняло, в то время как ИСП отдельно или совместно с ИВИ снижали экспрессию гена Bcl-2 до уровня, не отличающегося от такового у контрольных животных.
Рис. 2.
Экспрессия мРНК для белков, вовлеченных в регуляцию митохондриальной динамики, аутофагии и апоптоза в гипоталамусе крыс с краткосрочным острым СД1 и влияние ИВИ и ИСП. Представлена экспрессия генов митофузинов-1 (Mfn-1) и -2 (Mfn-2), а также белков DRP-1 (Drp-1), BECLIN-1 (Beclin-1), BAX (Bax) и BCL-2 (Bcl-2). Обозначения групп: C (К) – контроль; D (Д) – диабет без лечения; DI (ДИ) - диабет с лечением интраназально вводимым инсулином в суточной дозе 20 мкг/крысу; DC (ДС) – диабет с лечением интраназально вводимым C-пептидом в суточной дозе 36 мкг/крысу; DIC (ДИС) – комбинированное лечение интраназально вводимыми инсулином и C-пептидом в тех же дозах. Различия с группами К (a), Д (b) и ДИ (c) статистически значимы при p <0.05. Данные представлены как M ± SЕМ, n = 6.
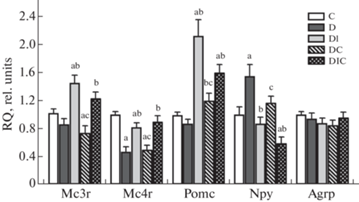
В гипоталамусе диабетических крыс, по сравнению с контролем, была снижена экспрессия гена Mc4r и повышена экспрессия гена Npy (рис. 3). Лечение ИВИ и совместно ИВИ и ИСП нормализовало экспрессию этих генов. У крыс с СД1 экспрессия Mc3r и Pomc не отличалась от контроля, тогда как введение ИВИ, одного или в сочетании с ИСП, повышало экспрессию этих генов. Комбинированная терапия также вызывала значимое снижение экспрессии гена нейропептида Y не только в сравнении с группой Д, но и с контролем. Монотерапия ИСП повышала только экспрессию гена Pomc.
Рис. 3.
Влияние СД1 и лечения ИВИ и ИСП на экспрессию мРНК меланокортиновых рецепторов и факторов, определяющих пищевое поведение, в гипоталамусе крыс. Представлена экспрессия генов меланокортиновых рецепторов 3-го (Mc3r) и 4-го типов (Mc4r), про-опиомеланокортина (Pomc), нейропептида Y (Npy) и агути-подобного пептида (Agrp). Обозначения групп: C (К) – контроль; D (Д) – диабет без лечения; DI (ДИ) – диабет с лечением интраназально вводимым инсулином в суточной дозе 20 мкг/крысу; DC (ДС) – диабет с лечением интраназально вводимым C-пептидом в суточной дозе 36 мкг/крысу; DIC (ДИС) – комбинированное лечение интраназально вводимыми инсулином и C-пептидом в тех же дозах. Различия с группами К (a), Д (b) и ДИ (c) статистически значимы при p <0.05. Данные представлены как M ± SЕМ, n = 6.
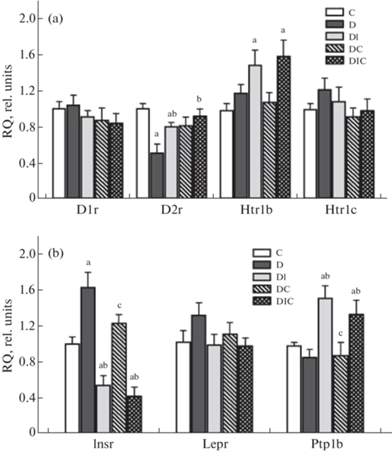
У крыс с СД1 экспрессия гена D1r, кодирующего дофаминовый рецептор 1-го типа, не менялась, в то время как экспрессия гена D2r, кодирующего дофаминовый рецептор 2-го типа, снижалась в 2 раза (рис. 4). Оба препарата, отдельно или совместно, восстанавливали экспрессию гена D2r, но не влияли на экспрессию гена D1r, в результате чего сниженное при СД1 отношение D2r/D1r нормализовалось у животных, получавших препараты. Экспрессия генов Htr1b и Htr2c при СД1 не менялась. Лечение ИВИ и совместно ИВИ и ИСП не влияло на экспрессию Htr2c, но повышало экспрессию гена Htr1b по сравнению с контролем. При СД1, в условиях системного дефицита инсулина, экспрессия инсулинового рецептора в гипоталамусе повышалась и значимо снижалась в группах с обработкой ИВИ, в среднем в 2 раза ниже ее уровня в контроле. Монотерапия ИСП не влияла на экспрессию гена инсулинового рецептора. При СД1 экспрессия гена Ptp1b не менялась, тогда как ИВИ (один и в комбинации с ИСП) ее повышал. Экспрессия гена лептинового рецептора во всех группах существенно не менялась.
Рис. 4.
Влияние СД1 и лечения ИВИ и ИСП на экспрессию мРНК рецепторов дофамина, серотонина, инсулина и лептина, а также протеинфосфотирозинфосфатазы 1B в гипоталамусе крыс. (a) – экспрессия генов дофаминовых рецепторов 1-го (D1r) и 2-го типов (D2r) и серотониновых рецепторов 1B- (Htr1b) и 2C-подтипов (Htr2c), (b) – экспрессия генов инсулинового (Insr) и лептинового рецепторов (Lepr) и протеинфосфотирозинфосфатазы (Ptp1b). Обозначения групп: C (К) – контроль; D (Д) – диабет без лечения; DI (ДИ) – диабет с лечением интраназально вводимым инсулином в суточной дозе 20 мкг/крысу; DC (ДС) – диабет с лечением интраназально вводимым C-пептидом в суточной дозе 36 мкг/крысу; DIC (ДИС) – комбинированное лечение интраназально вводимыми инсулином и C-пептидом в тех же дозах. Различия с группами К (a), Д (b) и ДИ (c) статистически значимы при p <0.05. Данные представлены как M ± SЕМ, n = 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для тяжелого краткосрочного СД1, в отличие от длительно текущих, легких или среднетяжелых форм СД1, характерны быстро нарастающие дефицит инсулина, гипергликемия, а также снижение массы тела и жировой ткани, несмотря на сильно выраженную гиперфагию. Нами показано, что, наряду с дефицитом инсулина, в крови крыс с СД1 снижался уровень лептина и повышались уровни ГПП-1 и грелина. Снижение уровня лептина обусловлено истощением запасов жировой ткани, секретирующей лептин [30]. Основной причиной повышения уровня ГПП-1, продуцируемого L-клетками кишечника, является характерная для СД1 гиперфагия, поскольку увеличение объема пищи, поступающей в желудок и контактирующей с L‑клетками в кишечнике, стимулирует секрецию ГПП-1 в кровь. Повышение уровня ГПП-1, обладающего мощным инсулинотропным действием на панкреатические β-клетки [31], можно рассматривать как компенсаторный механизм, направленный на восстановление инсулин-продуцирующей функции β-клеток, что показано при диабетической патологии у человека [32]. Об ослаблении продукции лептина и гиперсекреции ГПП-1 при СД1 сообщали в своих работах и другие авторы [33–36].
Обнаруженное нами повышение уровня грелина у крыс с СТЗ-индуцированным СД1 может быть важным фактором, способствующим регенерации β-клеток в условиях их повреждения СТЗ. Так, имеются данные, что грелин предотвращает апоптоз панкреатических клеток, повышая их выживаемость [37]. Повышение уровня грелина в крови может быть следствием нарушения инсулин-продуцирующей функции β-клеток. Установлено, что повышение уровня инсулина у здоровых людей приводит к значительному снижению уровня постпрандиального грелина, в то время как в условиях инсулинового дефицита при СД1 уровень грелина остается значимо повышенным [38]. Повышение уровня грелина на ранних стадиях СД1 было описано и в ряде экспериментальных исследований [39–41].
У крыс с СД1 комбинация ИВИ и ИСП существенно не влияла на уровни инсулина и лептина в крови, сниженные при СД1, но нормализовала уровни ГПП-1 и грелина. Это было ассоциировано с ослаблением гиперфагии в группе ДИС. Вопрос о том, как вызываемая комбинацией ИВИ и ИСП активация инсулиновой системы в мозге (гипоталамусе) ослабляет орексигенные влияния грелина на периферии, остается открытым и требует дальнейших исследований. Отсутствие влияния монотерапии ИСП на уровни инкретинов указывает на ключевую роль в этом инсулина мозга. В то же время ИСП-индуцированное усиление влияния ИВИ на гиперфагию и уровни ГПП-1 и грелина в крови свидетельствует в пользу потенцирования С-пептидом инсулинового сигналинга в мозге. Это может быть обусловлено способностью С-пептида повышать эффективность взаимодействия инсулина с его рецепторами, дестабилизируя олигомерные комплексы инсулина [14–16].
В крови диабетических крыс были снижены уровни гликопротеиновых гипофизарных гормонов – ЛГ и ТТГ, что указывает на снижение активности гипоталамо-гипофизарной системы. При СД1 также ослаблялся синтез андрогенов и тиреоидных гормонов. Эти данные согласуются с результатами других авторов и ранее полученными нами данными о том, что у самцов крыс с различными по тяжести и более продолжительными моделями СД1 уровни ЛГ [42, 43] и ТТГ [44, 45], тестостерона [19, 46, 47] и тиреоидных гормонов [7, 44, 45, 48] были также снижены.
Нами установлено, что ИВИ нормализовал уровень ТТГ в крови и, тем самым, восстанавливал уровни тиреоидных гормонов у диабетических крыс, причем совместное применение с ИСП приводило к усилению его эффекта. Это согласуется с ранее полученными данными о том, что обработка здоровых крыс и животных с длительным, умеренно выраженным СД1 с помощью ИВИ также приводит к устойчивому и значимому повышению уровня ТТГ [7]. В настоящем исследовании было также показано, что ИВИ и ИВИ совместно с ИСП повышают уровень ЛГ в крови диабетических крыс. Ранее влияние ИВИ на продукцию ЛГ при СД1 не было исследовано. Имеется лишь одно клиническое исследование, в котором было изучено влияние однократно введенного ИВИ (40 МЕ) на уровень ЛГ в крови у здоровых мужчин и мужчин с СД2 [49]. Dhindsa и соавт. не выявили значимых изменений в уровне ЛГ после обработки ИВИ. Однако необходимо принимать во внимание, что обработка проводилась однократно, а уровень ЛГ у пациентов с СД2 был повышен в сравнении со здоровыми пациентами, а не снижен, как в случае СД1 [49].
Повышение продукции ТТГ и ЛГ при их дефиците в условиях СД1, как мы полагаем, обусловлено стимулирующим эффектом ИВИ на гипоталамические тиролиберин- и гонадолиберин-экспрессирующие нейроны. Имеются данные о том, что инсулин в паравентрикулярных ядрах гипоталамуса повышает продукцию тиролиберина, рилизинг-фактора ТТГ путем стимуляции меланокортиновых путей и ингибирования нейронов, экспрессирующих нейропептид Y и агути-подобный пептид [50, 51], негативные регуляторы синтеза тиролиберина [52, 53]. Сходные механизмы показаны для стимуляции продукции гонадолиберина, рилизинг-фактора гонадотропинов [54–56]. Нами показано, что ИВИ и его комбинация с ИСП повышали экспрессию генов Pomc, Mc4r и Mc3r, вовлеченных в позитивную регуляцию экспрессии гипоталамических рилизинг-факторов гонадотропинов и ТТГ, и снижали повышенную при СД1 экспрессию гена нейропептида Y, негативного регулятора гонадолиберина и тиролиберина. Так, в группе Д соотношение Npy/Pomc составило 1.78, в то время как в группах ДИ и ДИС – 0.41 и 0.37 соответственно. Это указывает на то, что ИВИ смещает соотношение экспрессии нейропептида Y и ПОМК в пользу последнего, стимулирующего продукцию гипоталамических рилизинг-факторов.
Нами обнаружено, что оба варианта терапии с ИВИ приводят к снижению экспрессии гена инсулинового рецептора, повышенной в условиях характерного для СД1 системного инсулинового дефицита, что обусловлено длительной активацией инсулиновой системы мозга при интраназальном введении гормона. Необходимо отметить, что повышение экспрессии инсулиновых рецепторов в гипоталамусе диабетических крыс согласуется как с нашими результатами о двукратном повышении специфического связывания инсулина с синаптосомальными мембранами, выделенными из мозга крыс со стрептозотоциновым СД1 [57], так и с данными других авторов о повышении инсулин-стимулированного фосфорилирования инсулиновых рецепторов в гиппокампе крыс с СД1 [58]. Наряду с этим, в обеих группах с введением ИВИ выявлено значимое повышение экспрессии гена фосфатазы 1B, негативного регулятора инсулинового сигналинга. Активность этого фермента зависит от степени активации инсулиновой сигнальной системы и повышается в условиях длительной ее стимуляции инсулином [59, 60]. Эти данные свидетельствуют о том, что при введении СД1 крысам ИВИ, в том числе в сочетании с ИСП, инсулин непосредственно поступает к гипоталамическим нейронам и стимулирует в них инсулиновую сигнальную систему.
Необходимо отметить, что монотерапия ИСП слабо влияла на уровни ЛГ, ТТГ, тиреоидных гормонов и тестостерона. Это указывает на то, что сигнальные пути С-пептида непосредственно не вовлечены в контроль продукции тиролиберина и гонадолиберина. При этом некоторое усиление восстанавливающего эффекта ИВИ при его комбинированном применении с ИСП на тиреоидный статус (значимое повышение уровней tT3 и tT4 в группе ДИС в сравнении с контролем), как и в случае инкретинов, может быть обусловлено повышением доступности инсулина для его рецепторов вследствие облегчения диссоциации инсулиновых комплексов в присутствии С-пептида [14–16].
Одним из механизмов восстановления экспрессии компонентов гипоталамических сигнальных систем, включая нормализацию соотношения дофаминовых рецепторов 1-го и 2-го типов, может быть нейропротекторный эффект ИВИ, который ранее был продемонстрирован нами и другими авторами [13, 61, 62], в том числе при диабетической патологии [63]. Этот эффект был выявлен и в настоящем исследования в отношении тяжелого краткосрочного СД1, на что указывает восстановление экспрессии генов митохондриальных белков, а также нормализация соотношения проапоптотического белка BAX к антиапоптотическому белку BCL-2. Так, соотношение экспрессии генов Bax и Bcl-2 в гипоталамусе диабетических крыс составило 1.38, а в группах ДИ и ДИС оно снизилось до 0.85 и 0.78 соответственно, что может указывать на ослабление апоптотических процессов в гипоталамических нейронах. ИВИ восстанавливал сниженную при СД1 экспрессию белка BECLIN-1, ответственного за индукцию аутофагии. В этой связи необходимо отметить, что аутофагия в мозге является одним из механизмов, защищающих нейроны от апоптоза [64]. Наряду с этим в группе ДИС отмечали восстановление экспрессии генов, кодирующих митофузины (Mfn-1, Mfn-2), и снижение экспрессии гена Drp-1, повышенной при СД1, что свидетельствует о нормализации биогенеза митохондрий, и в целом согласуется с нашими данными, полученными при изучении влияния комбинированной терапии ИВИ и ИСП на крыс с длительным среднетяжелым СД1 [63]. Обработка крыс одним С-пептидом частично восстанавливала соотношение Bax и Bcl-2, но почти не влияла на экспрессию генов митохондриальных белков и BECLIN-1.
Таким образом, впервые показан восстанавливающий эффект недельной терапии ИВИ и его комбинацией с ИСП на гормональный статус и экспрессию генов, кодирующих компоненты гипоталамических сигнальных систем у самцов крыс с краткосрочным тяжелым СД1. Показано частичное восстановление уровней лептина, ГПП-1, грелина, гипофизарных гликопротеиновых гормонов (ЛГ, ТТГ), а также тиреоидных гормонов при лечении диабетических крыс ИВИ и комбинацией ИВИ и ИСП, что указывает на ИВИ-индуцированное улучшение функций гипоталамо-гипофизарной и инкретиновой систем и нормализацию тиреоидного статуса, нарушенных при краткосрочном СД1. Одним из механизмов восстанавливающего действия ИВИ и его комбинации с ИСП является нормализация экспрессии гипоталамических факторов, ответственных за аппетит, и восстановление экспрессии генов, ответственных за снижение апоптоза, стимуляцию аутофагии и повышение выживаемости нейронов.
Список литературы
Shpakov AO, Derkach KV, Berstein LM (2015) Brain signaling systems in the Type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Sci OA 1: FSO25. https://doi.org/10.4155/fso.15.23
Milstein JL, Ferris HA (2021) The brain as an insulin-sensitive metabolic organ. Mol Metab 52: 101234. https://doi.org/10.1016/j.molmet.2021.101234
Scherer T, Sakamoto K, Buettner C (2021) Brain insulin signalling in metabolic homeostasis and disease. Nat Rev Endocrinol 17: 468–483. https://doi.org/10.1038/s41574-021-00498-x
Rhea EM, Salameh TS, Banks WA (2019) Routes for the delivery of insulin to the central nervous system: A comparative review. Exp Neurol 313: 10–15. https://doi.org/10.1016/j.expneurol.2018.11.007
Dholakia J, Prabhakar B, Shende P (2021) Strategies for the delivery of antidiabetic drugs via intranasal route. Int J Pharm 608: 121068. https://doi.org/10.1016/j.ijpharm.2021.121068
Hallschmid M (2021) Intranasal insulin. J Neuroendocrinol 33: e12934. https://doi.org/10.1111/jne.12934
Derkach KV, Bogush IV, Berstein LM, Shpakov AO (2015) The Influence of Intranasal Insulin on Hypothalamic-Pituitary-Thyroid Axis in Normal and Diabetic Rats. Horm Metab Res 47: 916–924. https://doi.org/10.1055/s-0035-1547236
Derkach KV, Ivantsov AO, Chistyakova OV, Sukhov IB, Buzanakov DM, Kulikova AA, Shpakov AO (2017) Intranasal Insulin Restores Metabolic Parameters and Insulin Sensitivity in Rats with Metabolic Syndrome. Bull Exp Biol Med 163: 184–189. https://doi.org/10.1007/s10517-017-3762-6
Craft S, Raman R, Chow TW, Rafii MS, Sun CK, Rissman RA, Donohue MC, Brewer JB, Jenkins C, Harless K, Gessert D, Aisen PS (2020) Safety, Efficacy, and Feasibility of Intranasal Insulin for the Treatment of Mild Cognitive Impairment and Alzheimer Disease Dementia: A Randomized Clinical Trial. JAMA Neurol 77: 1099–1109. https://doi.org/10.1001/jamaneurol.2020.1840
Badenes R, Qeva E, Giordano G, Romero-García N, Bilotta F (2021) Intranasal Insulin Administration to Prevent Delayed Neurocognitive Recovery and Postoperative Neurocognitive Disorder: A Narrative Review. Int J Environ Res Public Health 18: 2681. https://doi.org/10.3390/ijerph18052681
Gaddam M, Singh A, Jain N, Avanthika C, Jhaveri S, De la Hoz I, Sanka S, Goli SR (2021) A Comprehensive Review of Intranasal Insulin and Its Effect on the Cognitive Function of Diabetics. Cureus 13: e17219. https://doi.org/10.7759/cureus.17219
Hallschmid M (2021) Intranasal Insulin for Alzheimer’s Disease. CNS Drugs 35: 21–37. https://doi.org/10.1007/s40263-020-00781-x
Zakharova IO, Bayunova LV, Zorina II, Sokolova TV, Shpakov AO, Avrova NF (2021) Insulin and α-Tocopherol Enhance the Protective Effect of Each Other on Brain Cortical Neurons under Oxidative Stress Conditions and in Rat Two-Vessel Forebrain Ischemia/Reperfusion Injury. Int J Mol Sci 22: 11768. https://doi.org/10.3390/ijms222111768
Jörnvall H, Lindahl E, Astorga-Wells J, Lind J, Holmlund A, Melles E, Alvelius G, Nerelius C, Mäler L, Johansson J (2010) Oligomerization and insulin interactions of proinsulin C-peptide: Threefold relationships to properties of insulin. Biochem Biophys Res Commun 391: 1561–1566. https://doi.org/10.1016/j.bbrc.2009.12.125
Nerelius C, Alvelius G, Jörnvall H (2010) N-terminal segment of proinsulin C-peptide active in insulin interaction/desaggregation. Biochem Biophys Res Commun 403: 462–467. https://doi.org/10.1016/j.bbrc.2010.11.058
Landreh M, Johansson J, Wahren J, Jörnvall H (2014) The structure, molecular interactions and bioactivities of proinsulin C-peptide correlate with a tripartite molecule. Biomol Concepts 5: 109–118. https://doi.org/10.1515/bmc-2014-0005
Landreh M, Jörnvall H (2021) Biological activity versus physiological function of proinsulin C-peptide. Cell Mol Life Sci 78: 1131–1138. https://doi.org/10.1007/s00018-020-03636-2
Derkach KV, Shpakova EA, Bondareva VM, Shpakov AO (2018) The effect of intranasal administration of proinsulin C-peptide and its C-terminal fragment on metabolic parameters in rats with streptozotocin diabetes. J Evol Biochem Physiol 54: 242–245. https://doi.org/10.1134/S0022093018030092
Derkach KV, Bondareva VM, Shpakov AO (2019) Regulatory effects of intranasal C-peptide and insulin on thyroid and androgenic status of male rats with moderate type 1 diabetes mellitus. J Evol Biochem Physiol 55: 493–496. https://doi.org/10.1134/S0022093019060073
Washburn RL, Mueller K, Kaur G, Moreno T, Moustaid-Moussa N, Ramalingam L, Dufour JM (2021) C-Peptide as a Therapy for Type 1 Diabetes Mellitus. Biomedicines 9: 270. https://doi.org/10.3390/biomedicines9030270
Derkach KV, Bondareva VM, Shpakov AO (2018) Coadministration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Advances in Gerontology 8: 139–146. https://doi.org/10.1134/S2079057018020030
Derkach KV, Bondareva VM, Perminova AA, Shpakov AO (2019) C-peptide and insulin during combined intranasal administration improve the metabolic parameters and activity of the adenylate cyclase system in the hypothalamus, myocardium, and epididymal fat of rats with type 2 diabetes. Cell Tissue Biol 13: 228–236.https://doi.org/10.1134/S1990519X19030039
Derkach KV, Perminova AA, Buzanakov DM, Shpakov AO (2019) Intranasal Administration of Proinsulin C-Peptide Enhances the Stimulating Effect of Insulin on Insulin System Activity in the Hypothalamus of Diabetic Rats. Bull Exp Biol Med 167: 351–355. https://doi.org/10.1007/s10517-019-04525-w
Khan SM, Hamnvik OP, Brinkoetter M, Mantzoros CS (2012) Leptin as a modulator of neuroendocrine function in humans. Yonsei Med J 53: 671–679.https://doi.org/10.3349/ymj.2012.53.4.671
Jensterle M, Janez A, Fliers E, DeVries JH, Vrtacnik-Bokal E, Siegelaar SE (2019) The role of glucagon-like peptide-1 in reproduction: from physiology to therapeutic perspective. Hum Reprod Update 25: 504–517. https://doi.org/10.1093/humupd/dmz019
Cena H, Chiovato L, Nappi RE (2020) Obesity, Polycystic Ovary Syndrome, and Infertility: A New Avenue for GLP-1 Receptor Agonists. J Clin Endocrinol Metab 105: e2695–2709. https://doi.org/10.1210/clinem/dgaa285
Al-Hussaniy HA, Alburghaif AH, Naji MA (2021) Leptin hormone and its effectiveness in reproduction, metabolism, immunity, diabetes, hopes and ambitions. J Med Life 14: 600–605. https://doi.org/10.25122/jml-2021-0153
Schalla MA, Stengel A (2021) The Role of the Gastric Hormones Ghrelin and Nesfatin-1 in Reproduction. Int J Mol Sci 22: 11059. https://doi.org/10.3390/ijms222011059
Derkach K, Zakharova I, Zorina I, Bakhtyukov A, Romanova I, Bayunova L, Shpakov A (2019) The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One 14: e0213779. https://doi.org/10.1371/journal.pone.0213779
Kelesidis T, Kelesidis I, Chou S, Mantzoros CS (2010) Narrative review: the role of leptin in human physiology: emerging clinical applications. Ann Intern Med 152: 93–100. https://doi.org/10.7326/0003-4819-152-2-201001190-00008
Aulinger BA, Vahl TP, Wilson-Pérez HE, Prigeon RL, D’Alessio DA (2015) β-Cell Sensitivity to GLP-1 in Healthy Humans Is Variable and Proportional to Insulin Sensitivity. J Clin Endocrinol Metab 100: 2489–2496.https://doi.org/10.1210/jc.2014-4009
Nauck MA, Heimesaat MM, Orskov C, Holst JJ, Ebert R, Creutzfeldt W (1993) Preserved incretin activity of glucagon-like peptide 1 [7–36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest 91: 301–307. https://doi.org/10.1172/JCI116186
Gülen S, Dinçer S (2007) Effects of leptin on oxidative stress in healthy and Streptozotocin-induced diabetic rats. Mol Cell Biochem 302: 59–65.https://doi.org/10.1007/s11010-007-9426-5
Romero MJ, Lucas R, Dou H, Sridhar S, Czikora I, Mosieri EM, Rick FG, Block NL, Sridhar S, Fulton D, Weintraub NL, Bagi Z, Schally AV (2016) Role of growth hormone-releasing hormone in dyslipidemia associated with experimental type 1 diabetes. Proc Natl Acad Sci U S A 113: 1895–1900.https://doi.org/10.1073/pnas.1525520113
Cruz B, Flores RJ, Uribe KP, Espinoza EJ, Spencer CT, Serafine KM, Nazarian A, O’Dell LE (2019) Insulin modulates the strong reinforcing effects of nicotine and changes in insulin biomarkers in a rodent model of diabetes. Neuropsychopharmacology 44: 1141–1151. https://doi.org/10.1038/s41386-018-0306-3
Kralova E, Marusakova M, Hadova K, Krenek P, Klimas J (2021) Dapagliflozin elevates plasma high-density lipoprotein levels and influences visceral fat gene expression in streptozotocin-induced diabetes mellitus. J Pharm Pharmacol 73: 778–784. https://doi.org/10.1093/jpp/rgab005
Bando M, Iwakura H, Ariyasu H, Koyama H, Hosoda K, Adachi S, Nakao K, Kangawa K, Akamizu T (2013) Overexpression of intraislet ghrelin enhances β-cell proliferation after streptozotocin-induced β-cell injury in mice. Am J Physiol Endocrinol Metab 305: E140–E148. https://doi.org/10.1152/ajpendo.00112.2013
Murdolo G, Lucidi P, Di Loreto C, Parlanti N, De Cicco A, Fatone C, Fanelli CG, Bolli GB, Santeusanio F, De Feo P (2003) Insulin is required for prandial ghrelin suppression in humans. Diabetes 52: 2923–2927. https://doi.org/10.2337/diabetes.52.12.2923
Gelling RW, Overduin J, Morrison CD, Morton GJ, Frayo RS, Cummings DE, Schwartz MW (2004) Effect of uncontrolled diabetes on plasma ghrelin concentrations and ghrelin-induced feeding. Endocrinology 145: 4575–4582. https://doi.org/10.1210/en.2004-0605
Ariga H, Imai K, Chen C, Mantyh C, Pappas TN, Takahashi T (2008) Does ghrelin explain accelerated gastric emptying in the early stages of diabetes mellitus? Am J Physiol Regul Integr Comp Physiol 294: R1807–R1812. https://doi.org/10.1152/ajpregu.00785.2007
Luvuno M, Mbongwa HP, Khathi A (2016) The effects of Syzygium aromaticum-derived triterpenes on gastrointestinal ghrelin expression in streptozotocin-induced diabetic rats. Afr J Tradit Complement Altern Med 13: 8–14. https://doi.org/10.21010/ajtcam.v13i4.2
Bestetti G, Locatelli V, Tirone F, Rossi GL, Müller EE (1985) One month of streptozotocin-diabetes induces different neuroendocrine and morphological alterations in the hypothalamo-pituitary axis of male and female rats. Endocrinology 117: 208–216. https://doi.org/10.1210/endo-117-1-208
Stoyanovitch AG, Johnson MA, Clifton DK, Steiner RA, Fraley GS (2005) Galanin-like peptide rescues reproductive function in the diabetic rat. Diabetes 54: 2471–2476. https://doi.org/10.2337/diabetes.54.8.2471
van Haasteren GA, Sleddens-Linkels E, van Toor H, Klootwijk W, de Jong FH, Visser TJ, de Greef WJ (1997) Possible role of corticosterone in the down-regulation of the hypothalamo-hypophysial-thyroid axis in streptozotocin-induced diabetes mellitus in rats. J Endocrinol 153: 259–267. https://doi.org/10.1677/joe.0.1530259
Ige AO, Chidi RN, Egbeluya EE, Jubreel RO, Adele BO, Adewoye EO (2019) Amelioration of thyroid dysfunction by magnesium in experimental diabetes may also prevent diabetes-induced renal impairment. Heliyon 5: e01660. https://doi.org/10.1016/j.heliyon.2019.e01660
Pontes DA, Fernandes GS, Piffer RC, Gerardin DC, Pereira OC, Kempinas WG (2011) Ejaculatory dysfunction in streptozotocin-induced diabetic rats: the role of testosterone. Pharmacol Rep 63: 130–138. https://doi.org/10.1016/s1734-1140(11)70407-8
Guo Z, Yan X, Wang L, Wu J, Jing X, Liu J (2016) Effect of Telmisartan or Insulin on the Expression of Adiponectin and its Receptors in the Testis of Streptozotocin-Induced Diabetic Rats. Horm Metab Res 48: 404–412. https://doi.org/10.1055/s-0042-101549
Bestetti GE, Reymond MJ, Perrin IV, Kniel PC, Lemarchand-Béraud T, Rossi GL (1987) Thyroid and pituitary secretory disorders in streptozotocin-diabetic rats are associated with severe structural changes of these glands. Virchows Arch B Cell Pathol Incl Mol Pathol 53: 69–78. https://doi.org/10.1007/BF02890227
Dhindsa S, Chemitiganti R, Ghanim H, Santiago E, Haider A, Chaar N, Mok M, McKee A, Dandona P (2018) Intranasal Insulin Administration Does Not Affect LH Concentrations in Men with Diabetes. Int J Endocrinol 2018: 6170154. https://doi.org/10.1155/2018/6170154
McCarty MF (1995) Central insulin may up-regulate thyroid activity by suppressing neuropeptide Y release in the paraventricular nucleus. Med Hypotheses 45: 193–199. https://doi.org/10.1016/0306-9877(95)90068-3
Kouidhi S, Clerget-Froidevaux MS (2017) Integrating Thyroid Hormone Signaling in Hypothalamic Control of Metabolism: Crosstalk Between Nuclear Receptors. Int J Mol Sci 19: 2017. https://doi.org/10.3390/ijms19072017
Fekete C, Kelly J, Mihály E, Sarkar S, Rand WM, Légrádi G, Emerson CH, Lechan RM (2001) Neuropeptide Y has a central inhibitory action on the hypothalamic-pituitary-thyroid axis. Endocrinology 142: 2606–2613. https://doi.org/10.1210/endo.142.6.8207
Fekete C, Sarkar S, Rand WM, Harney JW, Emerson CH, Bianco AC, Lechan RM (2002) Agouti-related protein (AGRP) has a central inhibitory action on the hypothalamic-pituitary-thyroid (HPT) axis; comparisons between the effect of AGRP and neuropeptide Y on energy homeostasis and the HPT axis. Endocrinology 143: 3846–3853. https://doi.org/10.1210/en.2002-220338
Oghbaei H, Fattahi A, Hamidian G, Sadigh-Eteghad S, Ziaee M, Mahmoudi J (2021) A closer look at the role of insulin for the regulation of male reproductive function. Gen Comp Endocrinol 300: 113643. https://doi.org/10.1016/j.ygcen.2020.113643
Shpakov AO (2021) Improvement Effect of Metformin on Female and Male Reproduction in Endocrine Pathologies and Its Mechanisms. Pharmaceuticals (Basel) 14: 42. https://doi.org/10.3390/ph14010042
Bano R, Shamas S, Khan SUH, Shahab M (2022) Inverse age-related changes between hypothalamic NPY and KISS1 gene expression during pubertal initiation in male rhesus monkey. Reprod Biol 22: 100599. https://doi.org/10.1016/j.repbio.2021.100599
Chistyakova OV, Sukhov IB, Loshkareva ML, Shipilov VN, Bondareva VM, Shpakov AO (2012) Initial stages of the insulin signaling system in the brain of rats with experimental diabetes mellitus. Bull Exp Biol Med 153: 25–28. https://doi.org/10.1007/s10517-012-1634-7
King MR, Anderson NJ, Liu C, Law E, Cundiff M, Mixcoatl-Zecuatl TM, Jolivalt CG (2015) Activation of the insulin-signaling pathway in sciatic nerve and hippocampus of type 1 diabetic rats. Neuroscience 303: 220–228. https://doi.org/10.1016/j.neuroscience.2015.06.060
Vieira MN, Lyra E, Silva NM, Ferreira ST, De Felice FG (2017) Protein Tyrosine Phosphatase 1B (PTP1B): A Potential Target for Alzheimer’s Therapy? Front Aging Neurosci 9: 7. https://doi.org/10.3389/fnagi.2017.00007
Dodd GT, Xirouchaki CE, Eramo M, Mitchell CA, Andrews ZB, Henry BA, Cowley MA, Tiganis T (2019) Intranasal Targeting of Hypothalamic PTP1B and TCPTP Reinstates Leptin and Insulin Sensitivity and Promotes Weight Loss in Obesity. Cell Rep 28: 2905–2922.e5. https://doi.org/10.1016/j.celrep.2019.08.019
Roque PS, Hooshmandi M, Neagu-Lund L, Yin S, Yousefpour N, Sato H, Sato T, Nakadate Y, Kawakami A, Tahmasebi S, Ribeiro-da-Silva A, Gkogkas CG, Prager-Khoutorsky M, Schricker T, Wykes L, Khoutorsky A (2021) Intranasal insulin rescues repeated anesthesia-induced deficits in synaptic plasticity and memory and prevents apoptosis in neonatal mice via mTORC1. Sci Rep 11: 15490. https://doi.org/10.1038/s41598-021-94849-3
Xu LB, Huang HD, Zhao M, Zhu GC, Xu Z (2021) Intranasal Insulin Treatment Attenuates Metabolic Distress and Early Brain Injury After Subarachnoid Hemorrhage in Mice. Neurocrit Care 34: 154–166. https://doi.org/10.1007/s12028-020-01011-4
Derkach KV, Zorina II, Zakharova IO, Basova NE, Bakhtyukov AA, Shpakov AO (2020) The Influence of Intranasally Administered Insulin and C-peptide on AMP-Activated Protein Kinase Activity, Mitochondrial Dynamics and Apoptosis Markers in the Hypothalamus of Rats with Streptozotocin-Induced Diabetes. J Evol Biochem Physiol 56: 207–217. https://doi.org/10.1134/S0022093020030035
Guan ZF, Zhou XL, Zhang XM, Zhang Y, Wang YM, Guo QL, Ji G, Wu GF, Wang NN, Yang H, Yu ZY, Zhou HG, Guo JC, Liu YC (2016) Beclin-1- mediated autophagy may be involved in the elderly cognitive and affective disorders in streptozotocin-induced diabetic mice. Transl Neurodegener 5: 22. https://doi.org/10.1186/s40035-016-0070-4
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


