Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 209-218
ВИТАМИН D3 ИНГИБИРУЕТ ФАГОЦИТАРНУЮ АКТИВНОСТЬ АСТРОЦИТОВ МОЗГА КРЫСЫ В ПЕРВИЧНОЙ КУЛЬТУРЕ
Т. В. Соколова 1, *, М. П. Рычкова 1, Н. Е. Басова 1, М. Г. Ефимова 1, **
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: sokolt1956@mail.ru
** E-mail: yefimova3@gmail.com
Поступила в редакцию 16.02.2022
После доработки 31.03.2022
Принята к публикации 01.04.2022
- EDN: GLNRJN
- DOI: 10.31857/S0044452922030068
Аннотация
Дефицит витамина D3 рассматривают в качестве фактора риска при развитии нейродегенеративных заболеваний, сопровождающихся повышенным образованием апоптотических субстратов. В ткани мозга млекопитающих первичным сенсором апоптотических субстратов являются астроглиальные клетки, обладающие фагоцитарной активностью. В настоящей работе был изучен вопрос о влиянии витамина D3 в составе коммерческих препаратов “ДЕТРИМЕД D3” и “Витамин D3 2000МЕ” на фагоцитарную активность астроцитов мозга крысы в первичной культуре. Впервые установлено, что витамин D3 является мощным природным ингибитором фагоцитарной активности астроцитов. Предварительная инкубация астроцитов с 10 мкМ витамина D3 приводила к снижению фагоцитарной активности астроцитов (в 1.9 и 3.5 раза по отношению к контролю, при использовании препаратов “ДЕТРИМЕД D3” и “Витамин D3 2000МЕ” соответственно). Этот эффект сопровождался достоверным истощением активного расщепляющего компартмента астроцитов, к которому относятся компоненты эндо-лизосомальной системы (на 31% по сравнению с контролем). Результаты проведенного исследования могут быть использованы в клинической практике для корректировки существующих стратегий лечения c применением витамина D3 у пациентов, страдающих нейродегенеративными заболеваниями, сопровождающимися накоплением апоптотических субстратов.
Витамин D3 (холекальциферол) является плейо-тропным гормоноподобным соединением, ответственным за регуляцию гомеостаза ионов кальция в организме. Кроме этого, витамин D3 вовлечен в процессы дифференцировки различных типов клеток, обладает иммуномодулирующей активностью, а также способностью ингибировать пролиферацию различных типов нормальных и раковых клеток [1].
Доставка витамина D3 клеткам различных тканей осуществляется с помощью витамин-D связывающего белка (DBP), который синтезируется в печени и секретируется в кровоток [2]. DBP также выявляется в цереброспинальной жидкости, но в меньших концентрациях по сравнению с плазмой крови [3]. DBP структурно сходен с альбумином, который, как полагают, также способен участвовать в связывании витамина D3 [1]. Незначительное количество витамина D3, не связанного с DBP, поступает в клетки путем диффузии [1], однако основная доля комплекса витамин D3-DBP доставляется путем эндоцитоза, опосредованного белками кавеолином и мегалином (caveolin-, megalin-mediated endocytosis) [4]. После диссоциации комплекса витамин D3-DBP, DBP расщепляется, а холекальциферол гидроксилируется до его биологически активного метаболита 1α,25(OH)2D3 с помощью белка CYP27B1, принадлежащего семейству цитохромов P450 [1].
Два типа высокоаффинных рецепторов витамина D (VDR, vitamin D-receptor), а именно ядерный (nVDR) и мембранный (mVDR) опосредуют геномный и внегеномный ответ клетки соответственно. При этом nVDR является ядерным лиганд-зависимым фактором транскрипции, который в комплексе с активной формой витамина D3 (1α,25(OH)2D3) регулирует экспрессию более чем 900 генов, в то время как mVDR обеспечивает быстрый ответ клетки за счет запуска различных каскадов клеточной сигнализации [1]. Полагают, что в большинстве случаев ответ клетки на воздействие витамина D3 представляет собой сочетанный эффект активации ядерного и мембранного рецепторов.
В современной литературе широко обсуждается роль витамина D3 в ЦНС. Рецепторы витамина D3 обнаружены в нейрональных и глиальных клетках мозга млекопитающих в эмбриональный, ранний и поздний постнатальный периоды. При этом обнаруживается сходство в распределении VDR у экспериментальных животных и человека [5]. VDR детектируются в гиппокампе, коре головного мозга и лимбической системе человека и животных, а также ольфакторном, зрительном и слуховом центрах мозга [5], что свидетельствует о значимости витамина D3 для реализации процессов обучения и памяти, а также для осуществления сенсорных функций.
Недавние исследования показали, что мембранный и ядерный рецепторы витамина D3, а также CYP27B1-белок, ответственный за конверсию витамина D3 в его биологически активную форму, экспрессируются в астроцитах мозга [6]. Астроциты являются наиболее многочисленными клетками нейроглии, количество которых достигает 40% от общей популяции клеток головного мозга [7]. Астроциты отвечают за реализацию многообразных функций в ЦНС. Так, они создают специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов, участвуют в формировании гематоэнцефалического барьера, осуществляют опорную, трофическую и секреторную функции. Кроме этого, астроциты являются непрофессиональными фагоцитами мозга. К числу последних, согласно общепринятой терминологии [8], относятся клетки негематопоэтического происхождения. Это отличает астроциты от микроглиальных клеток мозга, имеющих гематопоэтическое происхождение и относящихся к профессиональным фагоцитам. За счет фагоцитарной активности астроцитов происходит ликвидация синапсов в развивающемся и зрелом мозге [9]. Кроме этого, астроциты принимают участие в удалении апоптотических субстратов, возникающих в ходе старения, а также при различных патологических состояний ЦНС. Своевременное и полное удаление апоптотических субстратов необходимо для поддержания тканевого гомеостаза, а также для того, чтобы исключить возникновение аутоиммунных реакций в ответ на внутриклеточные антигены, высвобождающиеся из поврежденных и/или апоптотических клеток [10]. Фагоцитарная активность астроцитов опосредуется двумя рецепторными белками плазматической мембраны: MEGF10 (Multiple EGF-Like Domains 10) и рецепторной тирозинкиназой MERTK (Mer proto-oncogene Tyrosine Kinase) [11], последней отводится ключевaя роль в удалении миелиновых обломков, образующихся в ходе естественных процессов обновления миелина [12]. Нарушение процесса удаления/расщепления миелина наблюдается при состоянии острой демиелинизации, характерной для рассеянного склероза [13].
Ряд авторов полагают, что применение высоких доз витамина D3 способствует замедлению развития рассеянного склероза, а также других нейродегенеративных заболеваний (болезни Альцгеймера и Паркинсона), сопровождающихся возникновением апоптотических субстратов в ЦНС [6, 14]. Однако накопленные экспериментальные данные не позволяют установить четкую корреляцию между уровнем витамина D3 и развитием/течением нейродегенеративного состояния. Более того, в некоторых случаях показано, что достаточное количество витамина D3 отягощает течение патологического процесса [14].
Учитывая вышеизложенное, а также принимая во внимание важную роль астроцитов в поддержании тканевого гомеостаза в ЦНС, цель настоящей работы составило выяснение вопроса о возможной роли витамина D3 в процессе удаления апоптотических субстратов астроглиальными клетками мозга. Задачами настоящего исследования явилось изучение влияния различных коммерческих препаратов витамина D3 на эффективность фагоцитоза апоптотических субстратов астроцитами мозга крысы в первичной культуре.
МЕТОДЫ ИССЛЕДОВАНИЯ
Первичная культура астроглии
Астроциты выделяли из мозга новорожденных крыс по методу [15]. Клетки культивировали в среде DMEM (Биолот, Россия), содержащей 10% инактивированной фетальной сыворотки теленка (Биолот, Россия) и антибиотики (пенициллин G 50 Ед/мл и стрептомицин 50 мкг/мл, Биолот Россия). Культивирование производили в чашках Петри (Ø3.5 cм, Orange scientific) или в 24-луночных планшетах (Orange scientific) в течение 7–9 дней при 37°С и 5% CO2 до достижения 75%-ной конфлюентности. О жизнеспособности клеток судили по окрашиванию Trypan Blue (Биолот, Россия), способному проникать через поврежденные клеточные мембраны.
Субстраты фагоцитоза
В качестве апоптотического субстрата фагоцитоза использовали фракцию наружных сегментов палочек (НСП) сетчатки крысы, которую выделяли по модифицированному методу [16]. Конъюгацию препаратов НСП с флуоресцеин-изотиоцианатом (FITC, Merck, Германия) осуществляли, как нами было описано ранее [17]. Клетки промывали фосфатно-солевым раствором, рН 7.4 (PBS), после чего инкубировали в среде DMEM, содержащей 2% инактивированной фетальной сыворотки теленка, и добавляли субстраты фагоцитоза в соотношении 1: 10 (клетка/субстрат фагоцитоза; подсчет клеток и фрагментов НСП проводили с использованием камеры Фукса–Розенталя).
В предварительных исследованиях нашей лаборатории был детально изучен процесс фагоцитоза апоптотических субстратов различного типа астроцитами мозга крысы в первичной культуре и исследованы кинетические характеристики этого процесса [18]. При этом нами было установлено, что в качестве субстрата апоптотического типа может быть использована изолированная фракция НСП крыс. Действительно, в процессе фагоцитоза НСП распознаются и поглощаются астроцитами мозга с кинетическими параметрами, которые сопоставимы с таковыми, характерными для захвата и поглощения апоптотических нейронов. Поэтому в настоящей работе в качестве субстрата фагоцитоза мы использовали изолированную фракцию НСП, а стандартное время инкубации астроцитов мозга с апоптотическим субстратом составило 3 ч.
Обработка клеток коммерческими препаратами витамина D3
Использовали 2 типа коммерческих препаратов: капли “ДЕТРИМЕД D3” (водный раствор; ООО “Медикал горизон”, Армения) и капсулы “Витамин D3 2000МЕ” (масляный раствор в капсулах; Gross Hertz; ООО “Миролла”, Россия). Диапазон тестируемых концентраций витамина D3 составлял от 0.1 до 100 мкМ; время предынкубации с препаратами составляло 1 и 24 ч. После инкубации клеток с указанными препаратами в культуральную среду, содержащую витамин D3, добавляли конъюгат FITC-НСП и инкубировали клетки в течение 3 ч. По окончании инкубации производили оценку фагоцитарной и лизосомальной активности астроцитов (см. ниже).
Анализ фагоцитарной активности астроцитов мозга
После окончания инкубации с НСП излишки субстрата отмывали охлажденным PBS и проводили фиксацию клеток в течение 3–5 мин в 4%-ном параформальдегиде, приготовленном на PBS. После промывки препаратов раствором PBS проводили окраску ядер 0.001%-ным раствором Hoechst 33258/PBS (Serva, Германия). Результаты опытов оценивали с помощью флуоресцентного микроскопа Zeiss Imager.A1, Axio (Германия), оснащенного цифровой камерой AxioCamMRc (Zeiss, Германия). При оценке фагоцитарной активности клетки фотографировали и оценивали 2 параметра: 1) общее количество субстрата, взаимодействующего с клетками (субстрат, связанный фагоцитом + субстрат, поглощенный фагоцитом), 2) субстрат, поглощенный фагоцитом (далее в тексте мы будем использовать эти обозначения как параметр 1 и параметр 2). В случае параметра 1 мы производили подсчет площади, занимаемой субстратом фагоцитоза (зеленое окрашивание), и относили его к числу ядер клеток (синее окрашивание). В случае параметра 2 оценивали количество клеток, содержащих флуоресцентный субстрат в перинуклеарной области (субстрат, поглощенный фагоцитом) в % к общему числу клеток в препарате. Для количественного анализа для каждой точки в эксперименте использовали 2 параллельных стекла. На каждом стекле проводили фотофиксацию 15 случайно выбранных полей, содержащих суммарно до 1500 клеток. Всего было проведено 3–5 независимых экспериментов. Необходимые расчеты проводили с использованием программного обеспечения ImageJ (NIH, США).
Оценка активного расщепляющего компартмента астроцитов мозга
Оценку активного расщепляющего компартмента астроцитов мозга проводили по методу [19] с модификациями. При этом использовали метод флуоресцентной микроскопии, а также проводили количественную оценку методом флуоресцентной фотометрии. По окончании инкубации клеток с апоптотическими субстратами производили промывку раствором PBS, далее добавляли 50 мкМ лизосомотропного агента монодансилкадаверина (D4008, Sigma-Aldrich), приготовленного на PBS, pH 7.4, и инкубировали клетки в течение 10 мин при 37о С. После инкубации клетки промывали 4 раза раствором PBS, после чего либо лизировали клетки раствором 10 мМ Tris-HCl, pH 8.0, содержащего 0.1% Triton X-100, либо анализировали на флуоресцентном микроскопе и фотографировали с помощью камеры (см. выше). О количестве внутриклеточного монодансилкадаверина (MDC) судили по данным флуоресцентной фотометрии (при длинах волн возбуждения и эмиссии 365 и 525 нм соответственно), которую осуществляли с использованием планшетного ридера CLARIOstar Plus (BMG Labtech, Германия). Полученные величины относили к содержанию ДНК. Для этого в каждую пробу добавляли раствор бромистого этидия (EtBr, конечная концентрация 0.2 мкМ) и считывали флуоресценцию (длина волны возбуждения и эмиссии 530 и 590 нм соответственно). Для количественного анализа для каждой точки в эксперименте использовали 4 параллельных пробы, содержащих до 500 000 клеток каждая. Расчетная величина для каждой пробы представляла собой соотношение MDC/EtBr. Всего было проведено 3 независимых эксперимента.
Статистическая обработка результатов
Во всех опытах статистическую обработку результатов осуществляли на основании однофакторного дисперсионного анализа (ANOVA), применяя тест для множественных сравнений Бонферрони. Предварительно была проведена проверка выборок на нормальность распределения при помощи теста Шапиро–Уилка (GraphPadPrism (SanDiego, США)). Данные таблиц и гистограмм представлены в виде среднего значения ± ошибка среднего (M ± SEM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Длительная инкубация с витамином D3 приводит к снижению фагоцитарной активности астроцитов мозга крысы в первичной культуре
В первой серии опытов мы оценили фагоцитарную активность астроцитов мозга в присутствии коммерческих препаратов витамина D3: “ДЕТРИМЕД D3” (водный раствор) и “Витамин D3 2000МЕ” (масляный раствор). Поскольку в литературе полагают, что ответ клеток на воздействие витамина D3 представляет собой сочетанный эффект от активации ядерного и мембранного рецепторов, в первой серии опытов время предварительной инкубации астроцитов с препаратами витамина D3 составило 24 ч, после чего к клеткам добавляли субстрат фагоцитоза. Диапазон тестируемых концентраций витамина D3 в коммерческих препаратах варьировал в пределах от 0.1 до 100 мкМ.
Результаты опытов приведены на рис. 1. Из данных рисунка следует, что в обоих случаях инкубация астроцитов с витамином D3 приводила к снижению числа клеток, содержащих флуоресцентный субстрат в перинуклеарной области (рис. 1a,b). Статистическая обработка данных показала, что общее количество флуоресцентного субстрата в клетках, прошедших предварительную инкубацию с коммерческими препаратами витамина D3 (параметр 1), не претерпевает достоверных изменений по сравнению с контролем при концентрации витамина D3 в препаратах от 0.1 до 100 мкМ (масляный раствор) и от 0.1 до 10 мкМ (водный раствор) (табл. 1).
Рис. 1.
Фагоцитарная активность астроцитов мозга крысы в первичной культуре, прошедших предварительную инкубацию с коммерческими препаратами витамина D3. (а, а') – контрольные препараты астроцитов мозга после инкубации с конъюгатом НСП-FITC. (a') получен с помощью наслоения на панель (а) снимка клеток в проходящем свете для визуализации их контура. (b, b') – препараты астроцитов мозга крысы, подвергнутых предварительной инкубации с препаратом “Витамин D3 2000МЕ” (масляный раствор) и далее проинкубированных с конъюгатом НСП-FITC. (b') получен с помощью наслоения на панель (b) снимка клеток в проходящем свете для визуализации их контура. (c, с') – препараты астроцитов мозга крысы, подвергнутых предварительной инкубации с препаратом “ДЕТРИМЕД D3” (водный раствор) и далее проинкубированных с конъюгатом НСП-FITC. (с') получен с помощью наслоения на панель (с) снимка клеток в проходящем свете для визуализации их контура. (d, e, f) – количественная оценка фагоцитарной активности астроцитов мозга крысы (параметр 2), прошедших предварительную инкубацию с препаратами “Витамин D3 2000МЕ” (масляный раствор) (d) и “ДЕТРИМЕД D3” (водный раствор) (e) в течение 24 ч и с препаратом “Витамин D3 2000МЕ” (масляный раствор) в течение 1 ч (f). ** – различия достоверны при р < 0.001; * – различия достоверны при р < 0.05. Стрелками отмечены конъюгаты НСП-FITC в перинуклеарной области астроцитов, звездочками отмечены конъюгаты НСП-FITC на периферии клеток. По вертикальной оси (d, е, f) отложена фагоцитарная активность клеток (параметр 2 (%)). По горизонтальной оси отложена концентрация холекальциферола (мкМ) в коммерческих препаратах обоих типов.

Таблица 1.
Общее количество апоптотического субстрата (связанный + поглощенный) в астроцитах мозга крысы (параметр 1) при различном времени предварительной инкубации с препаратами “Витамин D3 2000МЕ” (масляный раствор) и “ДЕТРИМЕД D3” (водный раствор)
| Время инку-бации (ч) | Контроль (+ НСП) | + НСП + витамин D3 (мкМ) (масляный раствор) | + НСП + витамин D3 (мкМ) (водный раствор) | ||||
|---|---|---|---|---|---|---|---|
| 24 | 145.3 ± 21.1 (n = 56) |
0.1 мкМ | 1 мкМ | 10 мкМ | 100 мкМ | 1 мкМ | 10 мкМ |
| 123.9 ± 20.5 (n = 13) |
168.9 ± 45.5 (n = 17) |
173.6 ± 17.2 (n = 45) |
211.1 ± 30.9 (n = 25) |
189.2 ± 41.8 (n = 31) |
187.4 ± 42.7 (n = 11) |
||
| 1 | 153.6 ± 17.5 (n = 55) |
– | 111.3 ± 17.5 (n = 19) |
85.0 ± 19.3* (n = 47) |
122.6 ± 16.6 (n = 15) |
– | – |
В то же время оценка числа астроцитов, содержащих флуоресцентный субстрат в перинуклеарной области, выявила достоверное снижение этого параметра по сравнению с контролем при концентрациях витамина D3 от 0.1 до 100 мкМ в случае использования препарата “Витамин D3 2000МЕ” (масляный раствор) и от 1 до 10 мкМ в случае использования препарата “ДЕТРИМЕД D3” (водный раствор) (рис. 1d, e). При этом эффект препарата “ДЕТРИМЕД D3” был выражен несколько сильнее, чем у препарата “Витамин D3 2000МЕ”. Так, при концентрации 10 мкМ витамина D3 (водный раствор) количество клеток, содержащих флуоресцентный субстрат в перинуклеарной области, снижалось в 3.5 раза по сравнению с контролем (22.4 ± 2.1% (n = 50) контроль; 6.4 ± 0.8% (n = 56) ДЕТРИМЕД D3), в то время как в случае масляного раствора в 1.9 раза соответственно (19.9 ± 1.2% (n = 80) контроль; 10.4 ± 1.0% (n = 76) “Витамин D3 2000МЕ”). Следует специально отметить, что при оценке влияния препарата “Витамин D3 2000МЕ” на фагоцитарную активность астроцитов в качестве контроля мы использовали очищенное масло подсолнечника, которое производитель препарата указывает в качестве растворителя. Согласно нашим данным (рис. 1d), при инкубации астроцитов с маслом подсолнечника наблюдалась тенденция к снижению общего количества флуоресцентного субстрата (параметр 1). В то же время производитель препарата “ДЕТРИМЕД D3” не указывает состав соответствующего растворителя и/или эмульгатора, поэтому в данном случае в контрольные пробы добавляли эквивалентное количество раствора PBS. В связи с вышесказанным, в последующих опытах для оценки влияния витамина D3 на фагоцитарную активность астроцитов мозга крысы основное внимание уделялось препарату “Витамин D3 2000МЕ”.
Кратковременная инкубация с витамином D3 приводит к снижению фагоцитарной активности астроцитов мозга крысы в первичной культуре
В следующей серии опытов мы оценили влияние кратковременной инкубации астроцитов мозга крысы с коммерческим препаратом “Витамин D3 2000МЕ” (масляный раствор) на фагоцитарную активность клеток. Во всех опытах время инкубации астроцитов с витамином D3 составляло 1 ч, после чего к клеткам добавляли препараты НСП. Результаты, полученные в этой серии опытов, представлены на рис. 1 и в табл. 1. Как следует из данных, приведенных на рис. 1f, кратковременная инкубация с препаратом “Витамин D3 2000МЕ” также вызывала достоверное снижение фагоцитарной активности астроцитов при всех изученных концентрациях препарата. Наибольший эффект наблюдали при концентрациях витамина D3 10 и 100 мкМ по отношению к контролю (6.7 ± 0.6%, n = 99; 3.6 ± 0.6%, n = 30 и 15.4% ± 1.0%, n = 154 соответственно). Таким образом, выраженность ингибирующего эффекта витамина D3 на фагоцитарную активность астроцитов в результате предварительной 1- и 24-часовой инкубации клеток с препаратом “Витамин D3 2000МЕ” примерно одинакова (рис. 1d, e, f). Однако в отличие от предыдущей серии опытов в данном случае мы наблюдали достоверное снижение общего количества флуоресцентного субстрата в клетках, прошедших предварительную инкубацию с препаратом “Витамин D3 2000МЕ” при концентрации 10 мкМ, и тенденцию к снижению при концентрациях 1 и 100 мкМ (параметр 1) (табл. 1). Эти данные могут свидетельствовать в пользу того, что кратковременная инкубация с витамином D3 влияет на процесс распознавания и/или связывания апоптотического субстрата астроглиальными клетками мозга.
Фагоцитарная активность астроцитов сопровождается истощением активного расщепляющего компартмента клеток
В результате процесса фагоцитоза субстрат, поглощенный клеткой-фагоцитом, подвергается расщеплению с участием лизосомальных протеаз. В большинстве случаев в ответ на поступление субстрата количество лизосом в фагоцитарной клетке пропорционально возрастает, что обеспечивает эффективную деградацию поглощенного субстрата кислыми гидролазами [20–22]. Однако известно, что для астроцитов мозга характерна низкая способность к расщеплению поглощенного субстрата [23]. В связи с этим в следующей серии опытов представляло интерес изучить вопрос об относительном количестве/динамике лизосом в астроцитах, реализующих фагоцитоз апоптотических субстратов в присутствии и/или в отсутствие витамина D3.
В этих целях мы использовали лизосомотропный агент монодансилкадаверин (MDC). MDC применяют для оценки так называемого активного расщепляющего компартмента (active degradative compartment) в клетках различных типов [19]. Как правило, при добавлении к живым клеткам MDC распределяется в перинуклеарной области, в соответствии с внутриклеточной локализацией лизосом [23]. На рис. 2 приведены результаты типичного опыта по распределению MDC в контрольных препаратах астроцитов мозга и после добавления субстратов фагоцитоза. Как следует из данных рисунка, действительно, в контрольных препаратах лизосомотропный агент MDC распределен в перинуклеарной области астроцитов [23]. При этом обращает на себя внимание одинаковый размер частиц, окрашенных MDC. Однако в результате инкубации с препаратами НСП распределение и размеры этих частиц меняются. Наблюдается сдвиг частиц к периферии клетки, а размеры флуоресцентных частиц перестают быть однородными. Последнее может свидетельствовать о процессе слияния лизосом с первичной фагосомой, содержащей захваченный субстрат. Кроме этого, в результате инкубации с НСП, в астроцитах мозга выявляется тенденция к снижению общего количества частиц, окрашенных MDC.
Рис. 2.
Распределение монодансилкадаверина (MDC) в контрольных препаратах астроцитов мозга крысы в первичной культуре и после инкубации с апоптотическим субстратом. (a, a') – контрольные препараты астроцитов мозга крысы. (a') получен с помощью наслоения на панель (а) снимка клеток в проходящем свете для визуализации их контура. (b, b') – контрольные препараты астроцитов мозга после инкубации с конъюгатом НСП-FITC. (b') получен с помощью наслоения на панель (b) снимка клеток в проходящем свете для визуализации их контура. Стрелками отмечено распределение MDC на периферии клеток. N – ядро клетки.

Инкубация с витамином D3 препятствует истощению активного расщепляющего компартмента астроцитов
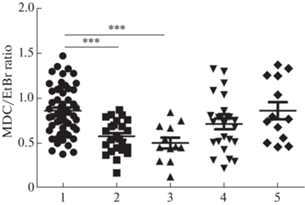
Для того, чтобы провести количественную оценку наблюдаемого феномена и выявить влияние витамина D3, в следующей серии опытов мы применили метод флуоресцентной фотометрии. Полученные результаты сведены в рис. 3. Из данных рисунка следует, что в результате фагоцитоза НСП количество лизосом в астроцитах мозга достоверно снижается (на 31% по сравнению с контролем). В то же время в клетках, прошедших предварительную инкубацию с витамином D3 (препарат “Витамин D3 2000МЕ” (масляный раствор), количество расщепляющего компартмента не отличается от такового, характерного для контроля. Полученные в этой серии опытов результаты согласуются с данными предыдущих разделов работы о способности витамина D3 блокировать доставку апоптотического субстрата во внутриклеточный компартмент астроцита. Снижение количества субстрата, предназначенного для расщепления в цитоплазме астроцитов, препятствует истощению активного расщепляющего компартмента клеток.
Рис. 3.
Соотношение MДК/БЭ в астроцитах мозга крысы после инкубации с апоптотическим субстратом в присутствии и в отсутствие витамина D3 (препараты “Витамин D3 2000МЕ” (масляный раствор) и “ДЕТРИМЕД D3” (водный раствор). 1 – контроль, 2 – НСП, 3 – НСП + витамин D3 1 мкМ (масляный раствор), 4 – НСП + витамин D3 10 мкМ (масляный раствор), 5 – НСП + витамин D3 10 мкМ (водный раствор). Время инкубации астроцитов мозга с препаратами витамина D составляло 1 ч; *** – различия достоверны при р < 0.001.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему времени накоплены многочисленные экспериментальные данные, свидетельствующие о важности витамина D3 для развития и нормального функционирования ЦНС. Однако вопрос о роли витамина D3 при различных нейродегенеративных состояниях ЦНС остается открытым. В настоящем исследовании нами было впервые изучено влияние препаратов витамина D3 на процесс удаления апоптотических субстратов астроцитами мозга крысы в первичной культуре. Нами были протестированы коммерческие препараты витамина D3 “ДЕТРИМЕД D3” (водный раствор) и “Витамин D3 2000МЕ” (масляный раствор) и установлено, что в условиях in vitro эти препараты являются мощными ингибиторами фагоцитарной активности астроцитов мозга крысы в отношении апоптотических субстратов.
Инкубация с витамином D3 в составе препаратов “ДЕТРИМЕД D3” и “Витамин D3 2000МЕ” приводила к резкому снижению поглощения апоптотического субстрата астроцитами мозга, что выражалось в уменьшении количества фрагментов НСП в перинуклеарной области астроцитов. Обращает на себя внимание тот факт, что этот эффект проявлялся как в результате короткой (1 ч) инкубации с витамином D3, так и при длительной инкубации (24 ч). Однако выраженность ингибирующего эффекта была выше при использовании короткой инкубации, что свидетельствует в пользу вовлечения мембранного рецептора витамина D3 в реализацию ответа астроцита на воздействие экзогенного холекальциферола. В этом плане наши результаты согласуются с данными литературы о том, что воздействие витамина D3 на астроциты мозга не приводит к изменению мРНК или экспрессии белка MERTK – основного рецептора, ответственного за поглощение апоптотических субстратов и миелиновых обломков клетками астроглии [24]. Это составляет принципиальное отличие непрофессиональных фагоцитов астроцитов от микроглии – клеток гематопоэтического происхождения, являющихся профессиональными фагоцитами мозга [8]. В последних инкубация с витамином D3 также приводит к снижению фагоцитарной активности, но за счет активации ядерного рецептора, приводящего к снижению экспрессии MERTK [24].
Совокупность полученных нами результатов, а также данных литературы позволяет полагать, что в ответ на воздействие витамина D3 в ткани мозга происходит снижение фагоцитарной активности обоих типов фагоцитарных клеток. При этом по времени ответа реакция астроцитов предшествует таковой, характерной для микроглии, поскольку не предполагает изменения экспрессии основного рецепторного белка MERTK. Таким образом, в отношении фагоцитарного ответа, реакция астроцитов на соответствующие стимулы опережает реакцию микроглии. Действительно, в случае фагоцитоза миелиновых обломков показано, что именно астроциты являются первичными сенсорами, запускающими процесс фагоцитоза, после чего происходит вторичная мобилизация микроглиальных клеток и инфильтрация макрофагов и Т-клеток в места локального повреждения миелиновой оболочки [25, 26].
Несмотря на быструю мобилизацию астроцитов в ответ на появление апоптотических субстратов, способность этих клеток поддерживать фагоцитарную активность, по-видимому, является ограниченной во времени, что обусловливает последующее вовлечение профессиональных фагоцитов в реализацию фагоцитарной функции. Так, недавно показано, что астроциты проявляют относительно слабую лизосомальную активность [23], в связи с чем поглощенный субстрат накапливается в цитоплазме, но не подвергается полной деградации. В то же время для профессиональных фагоцитов мозга микроглиальных клеток характерна высокая лизосомальная активность [23].
Согласно нашим результатам, фагоцитоз апоптотических субстратов действительно сопровождается истощением так называемого активного расщепляющего компартмента астроцитов, к которому относят компоненты эндо-лизосомальной системы, распознающиеся лизосомотропным агентом MDC. Действительно, в процессе фагоцитоза фрагментов НСП астроцитами мозга мы наблюдали достоверное уменьшение интенсивности флуоресцентного сигнала MDC на 31% по сравнению с контролем. Истощение расщепляющего компартмента не выявлялось в препаратах астроцитов, прошедших предварительную инкубацию с витамином D3 (10 мкМ). Этот результат полностью согласуется с нашими данными о способности холекальциферола блокировать поглощение апоптотических субстратов астроглиальными клетками мозга крысы.
Молекулярный механизм, посредством которого витамин D3 приводит к снижению поглощения апоптотического субстрата астроцитами мозга, требует дополнительного исследования. В настоящий момент наибольший интерес представляют данные о способности витамина D3 ингибировать протеинкиназу mTOR [27, 28], играющую важную роль в регуляции процессов роста и пролиферации клеток, а также аутофагии. Ингибирование mTOR приводит к активации аутофагии – лизосом-зависимого процесса расщепления разнообразных компонентов клетки. При этом установлено, что в непрофессиональных фагоцитах, таких как клетки пигментного эпителия глаза, клетки гранулозы фолликулов, клетки Сертоли семенников, активация аутофагии приводит к резкому снижению фагоцитарной активности за счет конкуренции обоих процессов за расщепляющий компартмент [29–31]. В связи с вышесказанным нельзя исключить, что снижение фагоцитарной активности астроцитов, прошедших предварительную инкубацию с витамином D3, может быть обусловлена активацией аутофагии. В пользу этой гипотезы свидетельствует и истощение активного расщепляющего компартмента, которое выявляется в клетках различных типов в течение нескольких часов, последующих за активацией аутофагии [32].
Таким образом, результаты, полученные в настоящей работе, позволяют заключить, что в условиях in vitro оба коммерческих препарата витамина D3, а именно, “ДЕТРИМЕД D3” и “Витамин D3 2000МЕ”, оказывают мощный ингибиторный эффект на фагоцитарную активность астроцитов, препятствуя поглощению апоптотических субстратов этими клетками. Однако степень выраженности эффекта была выше у водного препарата витамина D3. Последнее, по-видимому, обусловлено присутствием эмульгатора, за счет которого витамин D3 встроен в липофильные мицеллы, взаимодействующие с мембраной клеток и обеспечивающие эффективную внутриклеточную доставку холекальциферола. Что касается масляного раствора, то в данном случае можно полагать, что в доставке витамина D3 астроцитам мозга крысы принимает участие DBP и/или альбумин. Действительно, в нашей экспериментальной системе in vitro, DBP и альбумин присутствуют в фетальной сыворотке теленка, входящей в состав среды культивации астроцитов.
Оба исследованных коммерческих препарата применяются в клинической практике для компенсации дефицита витамина D3, который, как полагают, является фактором риска для развития нейродегенеративных заболеваний [33]. Действительно, в клинических исследованиях установлено, что патологические состояния ЦНС, такие как рассеянный склероз, болезни Альцгеймера и Паркинсона, сопровождаются относительным дефицитом витамина D3. Однако добавление препаратов витамина D3 в рацион пациентов, страдающих болезнями Альцгеймера и Паркинсона, не оказывает нейропротекторного действия [34]. Более того, в некоторых случаях применение витамина D3 отягощает течение патологического процесса [14]. В этом плане данные, полученные в настоящей работе, могут пролить свет на механизм неблагоприятного воздействия холекальциферола на течение нейродегенеративных заболеваний, сопровождающихся избыточным образованием апоптотических субстратов. Действительно, ингибирование процесса поглощения апоптотических субстратов и обломков миелина астроцитами не только препятствует поддержанию тканевого гомеостаза, но также может блокировать мобилизацию микроглиальных клеток, происходящую в ответ на запуск фагоцитоза в первичных сенсорах апоптотических субстратов – астроглиальных клетках мозга.
ЗАКЛЮЧЕНИЕ
Полное и своевременное удаление апоптотических субстратов является необходимым условием для поддержания гомеостаза во всех тканях организма. В ткани мозга млекопитающих первичным сенсором апоптотических субстратов являются астроглиальные клетки мозга. Выяснение вопросов о способах регуляции фагоцитарной активности астроцитов может способствовать выработке новых стратегий для лечения нейродегенеративных заболеваний, сопровождающихся появлением субстратов апоптотического типа.
Список литературы
Sirajudeen S, Shah I, Al Menhali A (2019) A Narrative Role of Vitamin D and Its Receptor: With Current Evidence on the Gastric Tissues. Int J Mol Sci 20: 3832. https://doi.org/10.3390/ijms20153832
Bouillon R, Schuit F, Antonio L, Rastinejad F (2020) Vitamin D Binding Protein: A Historic Overview. Front Endocrinol 10: 910. https://doi.org/10.3389/fendo.2019.00910
Smolders J, Moen SM, Damoiseaux J, Huitinga I, Holmøy T (2011) Vitamin D in the healthy and inflamed central nervous system: access and function. J Neurol Sci 311: 37–43. https://doi.org/10.1016/j.jns.2011.07.033
Zlokovic BV, Martel CL, Matsubara E, McComb JG, Zheng G, McCluskey RT, Frangione B, Ghiso J (1996) Glycoprotein 330/megalin: probable role in receptor-mediated transport of apolipoprotein J alone and in a complex with Alzheimer disease amyloid beta at the blood-brain and blood-cerebrospinal fluid barriers. Proc Natl Acad Sci U S A 93: 4229–4234. https://doi.org/10.1073/pnas.93.9.4229
Gáll Z, Székely O (2021) Role of Vitamin D in Cognitive Dysfunction: New Molecular Concepts and Discrepancies between Animal and Human Findings. Nutrients 13: 3672. https://doi.org/10.3390/nu13113672
Jiao KP, Li SM, Lv WY, Jv ML, He HY (2017) Vitamin D3 repressed astrocyte activation following lipopolysaccharide stimulation in vitro and in neonatal rats. Neuroreport 28: 492–497. https://doi.org/10.1097/WNR.0000000000000782
Jung YJ, Chung WS (2018) Phagocytic Roles of Glial Cells in Healthy and Diseased Brains. Biomol Ther (Seoul) 26: 350–357. https://doi.org/10.4062/biomolther.2017.133
Rabinovitch M (1995) Professional and non-professional phagocytes: an introduction. Trends Cell Biol 5: 85–87. https://doi.org/10.1016/s0962-8924(00)88955-2
Lee JH, Kim JY, Noh S, Lee H, Lee SY, Mun JY, Park H, Chung WS (2021) Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis. Nature 590: 612–617. https://doi.org/10.1038/s41586-020-03060-3
Itoh M, Yano A, Li X, Miyamoto K, Takeuchi Y (1999) Limited uptake of foreign materials by resident macrophages in murine ovarian tissues. J Reprod Immunol 43: 55–66. https://doi.org/10.1016/S0165-0378(99)00004-2
Chung WS, Clarke L, Wang G, Stafford BK, Sher A, Chakraborty C, Joung J, Foo LC, Thompson A, Chen C, Smith SJ, Barres BA (2013) Astrocytes mediate synapse elimination through MEGF10 and MERTK pathways. Nature 504: 394–400. https://doi.org/10.1038/nature12776
Healy LM, Perron G, Won SY, Michell-Robinson MA, Rezk A, Ludwin SK, Moore CS, Hall JA, Bar-Or A, Antel JP (2016) MerTK Is a Functional Regulator of Myelin Phagocytosis by Human Myeloid Cells. J Immunol 196: 3375–3384. https://doi.org/10.4049/jimmunol.1502562
Franklin RJM, Ffrench-Constant C (2008) Remyelination in the CNS: from biology to therapy. Nat Rev Neurosci 9: 839e855. https://doi.org/10.1038/nrn2480
Koduah P, Paul F, Dörr JM (2017) Vitamin D in the prevention, prediction and treatment of neurodegenerative and neuroinflammatory diseases. EPMA J 8: 313–325. https://doi.org/10.1007/s13167-017-0120-8
Hamprecht B, Loffler F (1985) Primary glial cultures as a model for studying hormone action. Methods Enzymol 109: 341–345. https://doi.org/10.1016/0076-6879(85)09097-8
Militante JD, Lombardini JB (2000) Stabilization of calcium uptake in rat rod outer segments by taurine and ATP. Amino Acids 19: 561–570. https://doi.org/10.1007/s007260070006
Yefimova MG, Messaddeq N, Harnois T, Meunier AC, Clarhaut J, Noblanc A, Weickert JL, Cantereau A, Philippe M, Bourmeyster N, Benzakour O (2013) A chimerical phagocytosis model reveals the recruitment by Sertoli cells of autophagy for the degradation of ingested illegitimate substrates. Autophagy 9: 653–666. https://doi.org/10.4161/auto.23839
Соколова ТВ, Васильев ДС, Рычкова МП, Аврова НФ, Ефимова МГ (2020) Фагоцитоз апоптотических субстратов сопровождается пролиферацией астроглиальных клеток мозга крыс в первичной культуре. Журн эвол биохим физиол 56: 81–84. [Sokolova TV, Vasilyev DS, Rychkova MP, Avrova NF, Yefimova MG (2020) Phagocytosis of Apoptotic Substrates Is Accompanied by Proliferation of Cultured Rat Primary Astrocytes. J Evol Biochem Physiol 56: 81–84. (In Russ)]. https://doi.org/10.1134/S0022093020010111
Vázquez CL, Colombo MI (2009) Assays to assess autophagy induction and fusion of autophagic vacuoles with a degradative compartment, using monodansylcadaverine (MDC) and DQ-BSA. Methods Enzymol 452: 85–95. https://doi.org/10.1016/S0076-6879(08)03606-9
LaVail MM (1976) Rod outer segment disk shedding in rat retina: relationship to cyclic lighting. Science194: 1071–1074. https://doi.org/10.1126/science.982063
Chemes H (1986) The phagocytic function of Sertoli cells: a morphological, biochemical, and endocrinological study of lysosomes and acid phosphatase localization in the rat testis. Endocrinology 119: 1673–1681. https://doi.org/10.1210/endo-119-4-1673
Yefimova MG, Lefevre C, Bashamboo A, Eozenou C, Burel A, Lavault MT, Meunier AC, Pimentel C, Veau S, Neyroud AS, Jaillard S, Jégou B, Bourmeyster N, Ravel C (2020) Granulosa cells provide elimination of apoptotic oocytes through unconventional autophagy-assisted phagocytosis. Hum Reprod 35: 1346–1362. https://doi.org/10.1093/humrep/deaa097
Lööv C, Mitchell CH, Simonsson M, Erlandsson A (2015) Slow degradation in phagocytic astrocytes can be enhanced by lysosomal acidification. Glia 63: 1997–2009. https://doi.org/10.1002/glia.22873
Clarke J, Yaqubi M, Futhey NC, Sedaghat S, Baufeld C, Blain M, Baranzini S, Butovsky O, Antel J, White JH, Healy LM (2020) Vitamin D Regulates MerTK-Dependent Phagocytosis in Human Myeloid Cells. J Immunol 205: 398–406. https://doi.org/10.4049/jimmunol.2000129
Ponath G, Ramanan S, Mubarak M, Housley W, Lee S, Sahinkaya FR, Vortmeyer A, Raine CS, Pitt D (2017) Myelin phagocytosis by astrocytes after myelin damage promotes lesion pathology. Brain 140: 399–413. https://doi.org/10.1093/brain/aww298
Damisah EC, Hill RA, Rai A, Chen F, Rothlin CV, Ghosh S, Grutzendler J (2020) Astrocytes and microglia play orchestrated roles and respect phagocytic territories during neuronal corpse removal in vivo. Sci Adv 6: eaba 3239. https://doi.org/10.1126/sciadv.aba3239
Lisse TS, Hewison M (2011) Vitamin D: a new player in the world of mTOR signaling. Cell Cycle10: 1888–1889. https://doi.org/10.4161/cc.10.12.15620
Al-Hendy A, Diamond MP, Boyer TG, Halder SK (2016) Vitamin D3 Inhibits Wnt/β-Catenin and mTOR Signaling Pathways in Human Uterine Fibroid Cells. J Clin Endocrinol Metab 101: 1542–1551. https://doi.org/10.1210/jc.2015-3555
Kim JY, Zhao H, Martinez J, Doggett TA, Kolesnikov AV, Tang PH, Ablonczy Z, Chan CC, Zhou Z, Green DR, Ferguson TA (2013) Noncanonical autophagy promotes the visual cycle. Cell 154: 365–376. https://doi.org/10.1016/j.cell.2013.06.012
Muniz-Feliciano L, Doggett TA, Zhou Z, Ferguson TA (2017) RUBCN/rubicon and EGFR regulate lysosomal degradative processes in the retinal pigment epithelium (RPE) of the eye. Autophagy 13: 2072–2085. https://doi.org/10.1080/15548627.2017.1380124
Yefimova MG, Ravel C, Rolland AD, Bourmeyster N, Jégou B (2021) MERTK-Mediated LC3-Associated Phagocytosis (LAP) of Apoptotic Substrates in Blood-Separated Tissues: Retina, Testis, Ovarian Follicles. Cells 10: 1443. https://doi.org/10.3390/cells10061443
Xu H, Ren D (2015) Lysosomal physiology. Annu Rev Physiol 77: 57–80. https://doi.org/10.1146/annurev-physiol-021014-071649
Chai B, Gao F, Wu R, Dong T, Gu C, Lin Q, Zhang Y (2019) Vitamin D deficiency as a risk factor for dementia and Alzheimer’s disease: an updated meta-analysis. BMC Neurol 19: 284. https://doi.org/10.1186/s12883-019-1500-6
Janjusevic M, Gagno G, Fluca AL, Padoan L, Beltrami AP, Sinagra G, Moretti R, Aleksova A (2022) The peculiar role of vitamin D in the pathophysiology of cardiovascular and neurodegenerative diseases. Life Sci 289: 120193. https://doi.org/10.1016/j.lfs.2021.120193
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


