Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 171-187
ВЗАИМОСВЯЗЬ ОКИСЛИТЕЛЬНОГО МЕТАБОЛИЗМА И ЭПИГЕНЕТИЧЕСКОЙ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНОВ В УСЛОВИЯХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКИ
К. А. Шарло 1, *, И. Д. Львова 1, Б. С. Шенкман 1
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: sharlokris@gmail.com
Поступила в редакцию 16.02.2022
После доработки 14.03.2022
Принята к публикации 14.03.2022
- EDN: ZCLZJD
- DOI: 10.31857/S0044452922030056
Аннотация
Широко известно, что как в реальных, так и в моделируемых условиях микрогравитации происходит снижение уровня окислительного метаболизма в скелетных мышцах человека и животных. В последние годы стало известно, что одним из последствий снижения уровня окислительного метаболизма в тканях может являться изменение эпигенетического статуса некоторых генов, а также накоплены данные, позволяющие предположить важную роль эпигенетического контроля экспрессии ряда генов в развитии негативных изменений, происходящих с мышцей в условиях реальной или моделируемой микрогравитации. Обзор посвящен анализу и систематизации данных о состоянии окислительного метаболизма и эпигенетического контроля экспрессии генов в скелетных мышцах в условиях функциональной разгрузки, рассмотрению молекулярных взаимосвязей между ключевыми регуляторами окислительного метаболизма и эпигенетическими модификациями и формулированию гипотезы о роли окислительного метаболизма в эпигенетическом блокировании экспрессии ряда генов, определяющих медленный, устойчивый к утомлению фенотип мышечных волокон.
Функциональное состояние скелетных мышц в условиях микрогравитации привлекало внимание исследователей, начиная с первых полетов человека в Космос. Техническая возможность устранить гравитационный стимул, действующий на все живые организмы на Земле, начиная с момента их возникновения, раскрыла перед исследователями перспективы развития новой отрасли науки, гравитационной физиологии. Данная отрасль науки посвящена изучению роли гравитационных сил в развитии различных биологических процессов. Гравитационная физиология скелетных мышц, помимо теоретического, имеет и важное практическое значение. Уже в первые часы космического полета у космонавтов снижается тонус скелетных мышц, что сопровождается снижением максимальной силы мышечного сокращения. В дальнейшем эти изменения усугубляются и сопровождаются мышечной атрофией и повышенной утомляемостью, причем возврат мышечных функций в норму требует длительного времени после возвращения космонавтов на Землю. Разработка методов профилактики подобных нарушений необходима для успешного освоения космического пространства.
С развитием гравитационной физиологии скелетных мышц стало понятным, что часть эффектов, вызываемых отсутствием влияния гравитационной силы Земли, можно получить и в земных условиях. Более того, часть нарушений функций скелетных мышц в условиях прекращения или снижения активности мышц и/или уровня механической нагрузки мышц на Земле вызваны теми же регуляторными изменениями и реализуются посредством тех же молекулярных механизмов, что и нарушения, развивающиеся в условиях космического полета. Таким образом, исследование эффектов моделируемой гравитационной разгрузки (функциональной разгрузки) скелетных мышц позволяет получать данные о реакции мышц на ряд факторов космического полета и разрабатывать меры профилактики негативных изменений. Более того, достижения гравитационной физиологии скелетных мышц, включая данные, полученные в условиях космического полета, можно использовать в лечении и реабилитации после периодов функциональной разгрузки мышц.
К настоящему моменту достаточно хорошо изучены ряд функционально значимых протеинкиназ и их воздействие на ряд транскрипционных факторов, регулирующих экспрессию генов в условиях функциональной разгрузки скелетных мышц. Известны, по меньшей мере, некоторые транскрипционные факторы, регулирующие их протеинкиназы, а также вторичные мессенджеры, регулирующие активность этих протеинкиназ, реализующие активацию протеолиза, снижение уровня синтеза белка и снижение доли мышечных волокон медленного (устойчивого к утомлению) типа в условиях функциональной разгрузки скелетных мышц. Куда меньше известно об эпигенетических механизмах регуляции экспрессии генов при различных вариантах функциональной разгрузки скелетных мышц. Большинство исследований, в которых описывается эпигенетическое состояние некоторых генов в данных условиях, посвящено исключительно описанию эпигенетических модификаций гистонов или ДНК промотора одного или нескольких генов, и не описывает физиологические механизмы, регуляцию или же функциональную значимость этих эпигенетических модификаций.
В данном обзоре впервые выдвигается и формулируется гипотеза о функциональной взаимосвязи между таким широко известным явлением, как снижение уровня окислительного метаболизма в скелетных мышцах при их функциональной разгрузке и повышением уровня репрессорных эпигенетических модификаций на промоторах ряда генов, экспрессия которых необходима для поддержания медленного, устойчивого к утомлению фенотипа волокон скелетных мышц. Также в данном обзоре систематизируются данные о состоянии ключевых регуляторов окислительного метаболизма в скелетных мышцах при разных сроках и разных вариантах функциональной разгрузки и приводятся гипотезы о причинах снижения уровня окислительного метаболизма в данных условиях.
Стоит отметить, что в этом обзоре не рассматривается связь структурных и функциональных изменений митохондрий с ростом мышечной утомляемости в условиях функциональной разгрузки, несмотря на то, что эта взаимосвязь представляет собой отдельную важную научную проблему. Такие исследования требуют отдельного объемного рассмотрения. Также здесь не рассматриваются гипотезы о связи митохондрий и атрофии при функциональной разгрузке, так как на эту тему существует достаточное количество обзоров хорошего качества [1, 2].
ЧАСТЬ I. МИТОХОНДРИИ ПРИ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ
Структурные и функциональные изменения митохондрий
Исследования параметров метаболизма в условиях реальной или моделируемой микрогравитации проводились, начиная со второй половины XX века. Данные, полученные в условиях функциональной разгрузки различной длительности, свидетельствуют как о снижении функции митохондрий, так и о снижении содержания ряда ферментов окислительного метаболизма и митохондриальной ДНК. После 10-суточного вывешивания крыс в камбаловидной мышце было обнаружено 40%-ное снижение активности цитратсинтазы, 50%-ное снижение активности цитохромоксидазы и 30%-ное снижение активности 3-гидроксиацил-коА-дегидрогеназы. При этом снижения активности сукцинатдегидрогеназы и лактатдегидрогеназы в этом эксперименте обнаружено не было [3]. В исследовании с 5-недельным вывешиванием крыс в камбаловидной мышце также было детектировано снижение активности 3-гидроксиацил-коА-дегидрогеназы и цитратсинтазы, но не лактатдегидрогеназы, а также на 19% было снижено максимальное потребление кислорода экспериментальными животными [4]. После 7-суточного вывешивания крыс в m. soleus и m. gastrocnemius обнаружено достоверное снижение активности цитратсинтазы [5, 6], после трех недель вывешивания в камбаловидной мышце крысы также снижается активность сукцинатдегидрогеназы [7]. Однако в другой работе в камбаловидной мышце крысы было обнаружено значительное увеличение активности цитратсинтазы после 14 и 28 суток вывешивания [8], и в ряде работ в условиях вывешивания и космического полета различной длительности в мышечных волокнах наблюдалась активация сукцинатдегидрогеназы [9]. В эксперименте с оценкой дыхательной функции отдельных митохондриальных комплексов после 4-недельного вывешивания крыс было показано, что в наибольшей степени снижается активность I комплекса дыхательной цепи, однако достоверные изменения были показаны только для митохондрий, выделенных из m. gastrocnemius экспериментальных животных [10]. Из вышеперечисленных экспериментальных данных следует, что активность ферментов цикла Кребса в условиях функциональной разгрузки (по крайней мере на некоторых стадиях) изменяется не согласованно: часть ферментов увеличивают свою активность в сравнении с контролем, тогда как другая часть инактивируется. В пользу этого обобщения свидетельствуют данные о содержании различных интермедиатов цикла Кребса в условиях 7-суточного вывешивания в камбаловидной мышце крыс [11]. Если бы инактивация ферментов цикла Кребса происходила согласованно, то наблюдалось бы пропорциональное снижение содержания всех интермедиатов цикла Кребса. Однако в данной работе не было обнаружено достоверных отличий в уровне лактата, цитрата и пирувата в сравнении с контролем, но было достоверно снижено содержание альфа-кетоглутарата, фумарата и малата [11]. Это неравномерное изменение содержания интермедиатов может объясняться разнонаправленными изменениями активности ферментов цикла Кребса.
Тем не менее стоит отметить, что при анализе активности митохондриальных ферментов на поперечных срезах мышц на результат значительно влияет степень атрофии мышечных волокон [12, 13]. При этом известно, что мышечные волокна медленного типа в условиях вывешивания задних конечностей атрофируются значительно сильнее, чем волокна быстрого типа: таким образом, незначительные или отсутствующие изменения активности митохондриальных ферментов в мышцах медленного типа при функциональной разгрузке могут быть связаны с более быстрым уменьшением площади поперечного сечения волокон по сравнению с падением содержания митохондриальных ферментов на некоторых стадиях функциональной разгрузки [13]. Однако этот факт не объясняет разнонаправленное изменение активностей ферментов цикла Кребса в волокнах одного и того же типа.
Изменения в функционировании митохондрий наблюдаются уже на ранних сроках функциональной разгрузки. В исследовании с 3-суточным вывешиванием мышей было показано, что уже на этом сроке достоверно снижается дыхательная активность комплексов I и II митохондрий мышц задних конечностей, что сопровождается повышением содержания H2O2 в мышечных волокнах, а также снижается уровень экспрессии генов, кодирующих компоненты дыхательной цепи и участвующих в окислении жирных кислот, причем эти изменения появляются раньше, чем снижение содержания митохондриальных белков и ДНК. Повышенный уровень генерации H2O2 митохондриями наблюдался и на 7-е и 14-е сутки вывешивания в камбаловидной мышце мышей [14]; по-видимому, повышение уровня активных форм кислорода (АФК) в мышцах при разгрузке наблюдается уже на самых ранних сроках – в частности, в работе Gorza и соавт. было детектировано повышение уровня АФК в камбаловидной мышце уже после 6 ч вывешивания задних конечностей крыс [15]. Gomez-Cabrera и соавт. полагают, что нарушения функционирования митохондрий играют решающую роль в накоплении АФК в мышцах при функциональной разгрузке, однако не исключено, что АФК накапливаются в том числе и за счет изменения работы NOX (НАДФН-оксидаз), а также дерегуляции работы синтазы оксида азота; относительная роль разных механизмов в накоплении АФК при функциональной разгрузке изучена недостаточно [16]. В эксперименте с иммобилизацией задних конечностей крыс было показано, что потребление кислорода митохондриями в m. gastrocnemius резко снижается – более, чем в два раза уже после первых суток воздействия, а в дальнейшем продолжает снижаться уже в более медленном темпе [17]. Тем не менее в одной работе было обнаружено повышение дыхательной активности комплекса I, комплексов I и II и разобщенного митохондриального дыхания, наряду со снижением активности цитратсинтазы в m. vastus lateralis после 4-суточной постельной гипокинезии [18]. Из этих данных можно сделать вывод, что в условиях функциональной разгрузки нарушение функций митохондрий происходит раньше, чем снижается содержание митохондриальных белков и ДНК. Таким образом, нельзя исключать, что нарушение функций митохондрий на первом этапе функциональной разгрузки скелетных мышц может вносить вклад в инактивацию биогенеза митохондрий и активацию митофагии, происходящие на более поздних этапах данного процесса.
Помимо функциональных изменений происходят и количественные изменения в содержании митохондриальных белков и ДНК. После трех суток функциональной разгрузки и далее нарушение функций митохондрий сопровождается снижением содержания митохондриальных белков и ДНК, причем этот эффект наблюдается и для наземной, и для космической функциональной разгрузки для различных мышц. В камбаловидной мышце крыс уже после двух недель вывешивания снижается как количество ферментов дыхательной цепи, так и содержание митохондриальной ДНК [19]. В условиях 30-суточного вывешивания крыс в m. gastrocnemius и m. tibialis anterior происходит достоверное снижение содержания ряда белков комплексов дыхательной цепи, в m. gastrocnemius этот процесс сопровождается также снижением содержания митохондриальной ДНК [20]. У человека снижение содержания митохондриальных ферментов и снижение транскрипции генов, ассоциированных с активностью митохондрий, наблюдается в m. vastus lateralis после 10 дней постельной гипокинезии [14, 21]. Снижение дыхательной активности митохондрий происходит и после 12-дневного одностороннего вывешивания ноги (ULLS) в m. tibialis [22]. После 6-суточного космического полета в m. triceps brachii крыс было обнаружено значительное снижение активности цитохром С оксидазы, однако ее содержание не изменялось, как и содержание некоторых ферментов цикла Кребса [23], а после 30-суточного космического полета с помощью метода протеомного анализа было показано снижение содержания компонентов дыхательной цепи митохондрий в камбаловидной мышце мышей [24].
Отдельно стоит рассмотреть морфологические изменения, происходящие при разных моделях и на разных сроках функциональной разгрузки. После 14-суточного космического полета в камбаловидной мышце макак-резусов наблюдалось незначительное снижение объемной плотности митохондрий в субсарколемальной области, тогда как в m. vastus lateralis наблюдалось значительное снижение объемной плотности митохондрий как в субсарколеммальной, так и в центральной зоне [25]. После 60-суточной постельной гипокинезии в камбаловидной мышце человека в субсарколеммальной зоне волокон достоверно снижалась объемная плотность митохондрий [26], а после 120-суточной антиортостатической гипокинезии объемная плотность митохондрий снижалась и в центральной, и в субсарколеммальной зоне [12]. После 5-недельного вывешивания крыс в камбаловидной мышце происходит снижение объемной плотности субсарколеммальных митохондрий и повышение объемной плотности интермиофибриллярных митохондрий, при этом их общая объемная плотность не изменяется [27]. Причины более интенсивного снижения объемной плотности митохондрий в субсарколеммальной зоне остаются неясными. Одно из спекулятивных соображений состоит в том, что в центральной зоне, где основное потребление АТФ связано с работой миофибрилл, их инактивация вызывает в начальный период разгрузки интенсивное накопление АТФ, что приводит к дефосфорилированию АМПК и соответственно к торможению как митофагии, так и биогенеза рибосом. В периферической зоне, напротив, потребление АТФ снижается менее интенсивно, что может способствовать более интенсивной динамике процессов расщепления (fission) и слияния (fusion) митохондрий.
Причины снижения содержания митохондрий и нарушения их функций
Причины нарушения функций митохондрий (снижение активности митохондриальных ферментов наряду с активацией генерирования АФК), а также причины снижения содержания митохондриальных белков и ДНК до сих пор остаются слабо изученными. Очевидной предпосылкой к нарушению функций митохондрий при функциональной разгрузке является прекращение активности мышцы, мгновенно происходящее, в частности, в камбаловидной мышце при устранении опорного стимула [28]. Отсутствие электрической активности мышцы приводит к накоплению макроэргических фосфатов и гликогена, к инактивации АМФ-зависимой протеинкиназы (АМПК), а также к инактивации Na,K-АТФазы, деполяризации сарколеммы и избыточному накоплению ионов кальция в миоплазме [29–33]. Накопление макроэргических фосфатов и инактивация АМПК в камбаловидной мышце происходят уже на первые сутки функциональной разгрузки и сохраняются как минимум до третьих суток [30, 34, 35], тогда как избыточное накопление кальция в миоплазме камбаловидной мышцы начинается, по-видимому, со вторых суток функциональной разгрузки и сохраняется как минимум в течение следующих двух недель [36, 37].
Накопление ионов кальция в миоплазме, с одной стороны, способствует активации работы ряда ферментов дыхательной цепи и цикла Кребса, но, с другой стороны, способствует генерации АФК [38]. Роль блокирования сократительной активности в нарушении функций митохондрий скелетных мышц была убедительно показана в работе 2017 г. Karam и соавт.: после 24-часовой денервации в митохондриях волокон m. flexor digitorium brevis был детектирован сигнал флуоресцентного зонда, активирующегося в ответ на эмиссию митохондриальных АФК. Повышение содержания кальция в миоплазме в этом эксперименте сопровождалось соответствующим повышением кальция внутри митохондрий, как и усилением генерации АФК. При этом восстановление сократительной активности путем электростимуляции предотвращало генерацию митохондриями АФК [39]. На основании этого Karam и соавт. делают вывод о том, что нарушение кальциевого гомеостаза играет ключевую роль в накоплении АФК на самом раннем сроке инактивации мышцы. Стоит отметить, что митохондриальные АФК способны приводить к окислению и открытию рианодиновых каналов саркоплазматического ретикулума. Это способствует “утечке” кальция из саркоплазматического ретикулума и дальнейшему повышению содержания кальция в сарколемме [40, 41]. К сожалению, роль этого процесса в условиях функциональной разгрузки не изучалась. В нашей лаборатории механическая стимуляция опорных зон стопы (поддерживающая активность камбаловидной мышцы) на фоне 7-суточного вывешивания предотвратила снижение содержания митохондриальной ДНК и транскрипции мРНК генов ряда комплексов дыхательной цепи митохондрий. [42]. Тем не менее оценки митохондриальных функций и уровня АФК в этой работе не проводилось.
Помимо непосредственно внутримитохондриального кальция, нарушение функций митохондрий может вызывать и кальций-зависимая активация протеаз кальпаинов на фоне пониженного содержания NO (эндогенного ингибитора кальпаинов) [43], приводящая к разрушению цитоскелетных белков. В частности, известно, что разрушение, отсутствие или мутации десмина приводят к масштабному нарушению функций митохондрий и снижению содержания митохондриальной ДНК и белков в камбаловидной мышце [44, 45]. На фоне функциональной разгрузки кальпаин-зависимое разрушение десмина происходит на раннем сроке (1-е–3-и сутки) [46, 47]. В связи с этим стоит отметить, что трансфекция гена кальпастатина, эндогенного ингибитора кальпаина в волокна диафрагмы предотвращала как накопление АФК, так и снижение функций митохондрий, на фоне 12-часовой искусственной вентиляции легких [48]. Общая схема сигнальных процессов, регулирующих объем и функциональное состояние митохондрий на начальных этапах функциональной разгрузки, представлена на рис. 1.
Рис. 1.
Сигнальные процессы, регулирующие функции митохондрий на начальном этапе функциональной разгрузки. ROS – активные формы кислорода, VDAC – потенциал-зависимый анионный канал внешней митохондриальной мембраны, MCU – митохондриальный кальциевый унипортер, DHPR- дигидропиридиновые каналы, ETC – электрон-транспортная цепь, AMPK – АМФ-зависимая протеинкиназа.
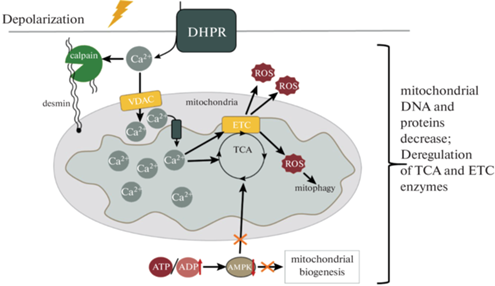
Деполяризация сарколеммы на раннем этапе функциональной разгрузки скелетных мышц приводит к активации DHPR и накоплению кальция в миоплазме. Кальций поступает внутрь митохондрий, что приводит к генерации ROS и активации митофагии. Также кальций активирует кальпаины, что приводит к разрушению десминового цитоскелета мышечного волокна. Параллельно с этим из-за роста соотношения АТФ к АДФ инактивируется АМПК, что приводит к инактивации биогенеза митохондрий. Одновременно с этим накопление ROS и рост соотношения АТФ к АДФ приводят к дерегуляции ферментов цикла Кребса.
Накопление макроэргических фосфатов в условиях функциональной разгрузки блокирует активность АМПК, которая является основным регулятором как уровня биогенеза, так и “контроля качества” митохондрий за счет координации их биогенеза и митофагии [49]. В одном исследовании было показано, что введение β-GPA приводит как к снижению содержания фосфокреатина, так и к восстановлению активности цитратсинтазы в скелетных мышцах [50]. Тем не менее исследования роли накопления макроэргических фосфатов и инактивации AMPK на функции и содержание митохондрий при функциональной разгрузке не проводилось. Стоит отметить, что повышенное содержание макроэргических фосфатов и последующая инактивация АМПК наблюдается лишь на первом этапе функциональной разгрузки (1-е–3-и сутки). В дальнейшем содержание АТФ в камбаловидной мышце становится ниже контрольных значений, а активность АМПК к 7-м суткам возвращается к контрольному уровню, а после 14 суток вдвое превышает контрольные показатели [51, 52], что, однако, не сопровождается соответствующим увеличением содержания митохондриальных белков и ДНК, и экспрессии генов, связанных с функционированием митохондрий.
Состояние сигнальных путей, контролирующих биогенез, митофагию и динамику митохондрий в условиях функциональной разгрузки мышц
Несмотря на почти полное отсутствие информации о триггерах нарушения функций митохондрий и снижения содержания митохондриальных белков, было выполнено много исследований, описывающих состояние регуляторных путей, контролирующих биогенез митохондрий, митофагию, а также митохондриальную динамику при различных моделях функциональной разгрузки.
В целом в условиях функциональной разгрузки скелетных мышц снижается уровень биогенеза митохондрий и активируется митофагия. При этом в большинстве случаев снижается как уровень экспрессии регуляторов митохондриального слияния (fusion), так и расщепления митохондриальной сети (fission).
Содержание мРНК ключевого регулятора биогенеза митохондрий PGC-1α в камбаловидной мышце грызунов снижается уже на третьи сутки вывешивания [53], эта же ситуация сохраняется на 7-, 21- и 28-е сутки [19, 54–57]. После 28 сут вывешивания в камбаловидной мышце крыс снижается экспрессия мРНК ряда факторов инициации и элонгации транскрипции митохондриальных белков (гены Taco1 и Tufm) [54]. После 14-суточного вывешивания в m. gastrocnemius мышей также снижается экспрессия PGC-1α и его близкого гомолога PGC-1β, наряду с фактором транскрипции митохондриальных генов TFAM [19]. Снижение экспрессии PGC-1α происходит и при других вариантах функциональной разгрузки: в m. tibialis anterior мышей при 14-суточной иммобилизации [58], в m. gastrocnemius при 11-суточном космическом полете и в камбаловидной мышце при 30-суточном космическом полете мышей [59]. У человека снижение экспрессии мРНК PGC-1α происходит после 10 дней постельной гипокинезии в мышце vastus lateralis [60], после 5-недельного одностороннего вывешивания ноги в m. vastus lateralis [61], а также в камбаловидной мышце после 3-суточной и 21-суточной “сухой” иммерсии (неопубликованные данные нашей лаборатории). Тем не менее исследование камбаловидной мышцы двух астронавтов после 6-месячного космического полета показало увеличение экспрессии мРНК PGC-1α: впрочем, авторы этого исследования связывают свои результаты с эффективностью профилактических мер, предпринимавшихся на протяжении полета [62].
Стоит отметить, что наряду со снижением экспрессии PGC-1α и его генов-мишеней в некоторых работах также было описано снижение экспрессии ряда других регуляторов биогенеза митохондрий, таких как ERRα и Perm1. В частности, снижение экспрессии ERRα наблюдалось после 28-суточного вывешивания в камбаловидной мышце крыс и после 21-суточного вывешивания в m. gastrocnemius (несмотря на то, что в последней работе также описано увеличение экспрессии PGC-1α при вывешивании, при снижении экспрессии его генов-мишеней) [54, 57, 63]. Снижение экспрессии мРНК Perm1 наблюдалось после 3‑, 7- и 14-суточного вывешивания в камбаловидной мышце мышей [14], после 21-суточной постельной гипокинезии в m. vastus lateralis [64] и после 21-суточной “сухой” иммерсии в камбаловидной мышце у человека (неопубликованные данные нашей лаборатории). Белок Perm1 способен активировать биогенез митохондрий у человека и грызунов, и его экспрессия повышается при выполнении упражнений на выносливость, тем не менее, о его молекулярных регуляторах пока ничего неизвестно [65].
В последние годы был идентифицирован один из молекулярных механизмов, регулирующий экспрессию PGC-1α в условиях вывешивания крыс: в 2017 г. Theeuwes и соавт. показали, что при 14-суточном вывешивании мышей-нокаутов по гену киназы гликогенсинтазы GSK-3β в m. gastrocnemius не происходит снижения уровня экспрессии PGC-1α, как и снижения содержания ряда белков дыхательной цепи митохондрий [19]. В 2020–2021 гг. в нашей лаборатории было показано, что в камбаловидной мышце крыс при 7-суточном вывешивании с введением донора оксида азота L-аргинина не происходит как активации GSK-3β, так и снижения экспрессии мРНК PGC-1α [55]. При фармакологическом ингибировании GSK-3β при 7-суточном вывешивании крыс в их камбаловидной мышце также не происходит снижения содержания PGC-1α, TFAM1 и содержания митохондриальной ДНК [66]. Также мы показали, что поддержание опорной афферентации путем механической стимуляции опорных зон стопы предотвращает активацию GSK-3β при 7-суточной функциональной разгрузке в камбаловидных мышцах крыс, и эффект опорной стимуляции на содержание митохондриальной ДНК аналогичен эффекту фармакологической инактивации GSK-3β [42, 66]. Таким образом, мы показали, что, когда в отсутствие опоры при разгрузке мышц задних конечностей в камбаловидной мышце крыс снижается уровень оксида азота, происходит активация GSK-3β. Это ведет к снижению экспрессии PGC-1α и снижению содержания митохондриальной ДНК. Тем не менее маловероятно, что GSK-3β является единственным регулятором экспрессии PGC-1α в условиях функциональной разгрузки: в частности, по данным ряда исследований, GSK-3β активирована лишь на ранних сроках функциональной разгрузки, и с восстановлением ЭМГ камбаловидной мышцы активность GSK-3β возвращается к контрольным значениям, что, однако, не сопровождается восстановлением уровня биогенеза митохондрий [51, 67].
Данные по состоянию процессов митофагии в условиях функциональной разгрузки несколько более противоречивы, чем данные о регуляторах биогенеза митохондрий. После 28 сут вывешивания крыс в m. gastrocnemius было обнаружено снижение маркеров митофагии (BNIP3, Фосфо-Ser-65-Parkin) наряду с увеличением содержания маркеров аутофагии [54]. Однако при 3-суточном вывешивании задних конечностей мышей в их m. gastrocnemius было обнаружено повышение мРНК и белков маркеров митофагии BNIP3 и BNIP3L-II, наряду со снижением содержания FUNDC и PARK2 [68]. При одно-, двух- и трехсуточном вывешивании мышей в динамике изменений параметров накопления АФК, митофагии, слияния и расщепления митохондрий были обнаружены значительные различия в зависимости от пола животных и исследуемой мышцы [69]. При этом при двухнедельной иммобилизации m. tibialis anterior мышей было обнаружен достоверный рост маркеров митофагии (Beclin-1, Bnip3, PINK1, parkin, Mul1 и LC3II/LC3) [70]. При 7-суточной односторонней иммобилизации ноги у человека в m. vastus lateralis также было обнаружено повышение уровня экспрессии BNIP3L [68]. При этом Rosa-Caldwell и соавт. считают, что повышение уровня митофагии происходит лишь на раннем этапе функциональной разгрузки, вслед за повышением уровня генерации АФК митохондриями, а на более поздних этапах митофагия инактивируется, приходя в равновесие с уровнем биогенеза митохондрий [54]. Стоит отметить, что недавно была показана роль AMPK, локализованной на внешней мембране митохондрий, в активации митофагии, вызываемой снижением уровня соотношения АДФ к АТФ – однако роль этого процесса в условиях функциональной разгрузки неясна [71]. К сожалению, измерение уровня митофагии, как и параметров митохондриальной динамики, проводится лишь косвенными методами, путем измерения уровней содержания различных белков-участников процесса митофагии, слияния или расщепления митохондриальной сети, при этом относительная роль различных компонентов в данном процессе, как и уровень их активности, остаются неизвестными.
В большинстве случаев при различных вариантах функциональной разгрузки в скелетных мышцах млекопитающих снижается экспрессия как компонентов слияния митохондрий, так и компонентов расщепления митохондриальной сети [1]. В нашей лаборатории была исследована экспрессия мРНК показателей митохондриальной динамики в камбаловидной мышце крыс после 7-суточного вывешивания: мы обнаружили снижение как параметров слияния митохондрий (Mfn1, Mfn2, OPA1), так и показателей расщепления сети митохондрий (Drp1, Fis1) [42]. После 28-суточного вывешивания крыс в их m. gastrocnemius не было обнаружено снижения OPA1, Mfn1 и Mfn2, в то время как экспрессия Fis1 и Drp1 была снижена [54]. При иммобилизации в m. tibialis anterior мышей было обнаружено снижение Mfn2 после 2- и 3-недельного воздействия, в случае 3 нед сопровождавшееся повышением экспрессии Fis1, при этом Drp1 и OPA1 не менялись на протяжении эксперимента [72]. Снижение содержания Mfn-2 наблюдалось и после 4‑суточной постельной гипокинезии у человека в m. vastus lateralis [18], однако после 10-дневной постельной гипокинезии в medialis vastus lateralis человека не наблюдалось каких-либо изменений в показателях митохондриальной динамики [73]. С учетом того факта, что гены, кодирующие белки Mfn-2, как и Mfn-1 являются генами-мишенями PGC-1α [74], можно предположить, что снижение этих показателей слияния митохондрий обусловлено инактивацией PGC-1α; тем не менее, полная картина изменений митохондриальной динамики в условиях функциональной разгрузки мышц до сих пор не составлена.
ЧАСТЬ II. ВЗАИМОСВЯЗЬ ЭПИГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И ОКИСЛИТЕЛЬНОГО МЕТАБОЛИЗМА В КЛЕТКАХ МЛЕКОПИТАЮЩИХ. ЭПИГЕНЕТИЧЕСКИЕ МОДИФИКАЦИИ В УСЛОВИЯХ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКИ СКЕЛЕТНЫХ МЫШЦ
Эпигенетическая регуляция экспрессии генов представляет собой огромную и быстро развивающуюся область знаний, причем часто открытие каких-либо посттрансляционных модификаций гистонов или модификаций ДНК происходит значительно раньше, чем выявляются физиологическое значение и механизмы регуляции этих модификаций. Более того, большое количество данных, описывающих те или иные эпигенетические механизмы, получены на клеточных культурах, соответственно их роль в различных тканях и при различных физиологических воздействиях все еще остается неизвестной. В данном разделе мы кратко опишем основные эпигенетические механизмы, для которых выявлена взаимосвязь с теми или иными параметрами окислительного метаболизма как в скелетных мышцах, так и в других тканях, и рассмотрим молекулярные механизмы этих взаимосвязей. В первую очередь к этим механизмам относятся ацетилирование гистонов и метилирование СpG-островков ДНК. Мы не будем рассматривать метилирование гистонов, так как в отличие от метилирования CpG-островков, которое однозначно является репрессорной модификацией, и ацетилирования гистонов, которое однозначно является активирующей модификацией, эффект метилирования гистонов зависит от конкретного аминокислотного остатка, который был метилирован, а также от состояния соседних аминокислотных остатков; помимо этого, мы не обнаружили в литературе четкой взаимосвязи между метилированием гистонов и уровнем окислительного метаболизма в клетках млекопитающих.
Метилирование CpG-островков: регуляция, взаимосвязь с окислительным метаболизмом, состояние при функциональной разгрузке
В геноме млекопитающих метилирование ДНК происходит путем переноса метильной группы с S‑аденозилметионина на пятый атом углерода в молекуле цитозина, что приводит к образованию 5'-метилцитозина. Этот процесс осуществляется классом ферментов ДНК-метилтрансфераз (Dnmt). У млекопитающих экспрессируются четыре фермента Dnmt: Dnmt1, Dnmt3A, Dnmt3B и Dnmt3L, причем последняя не обладает метилтрансферазной активностью и регулирует работу двух других Dnmt3 [75]. Считается, что Dnmt1 осуществляет метилирование второй цепи ДНК при воспроизведении паттерна метилирования во время клеточного деления, в то время как Dnmt3 метилирует ДНК de novo в ответ на различные физиологические стимулы [75]. Деметилирование ДНК может происходить двумя путями. Один из них – это замена аминогруппы цитозина на карбонильную группу ферментом AID/APOBEC, что приводит к образованию тимина и последующей эксцизионной репарации непарного G/T дуплекса тимин-ДНК-гликозилазой. Второй путь осуществляется транслоказами ten-eleven (TET) путем окисления метильной группы метилцитозина и его превращения в 5'-гидроксиметилцитозин, а затем в 5'-формилцитозин или в 5'-карбонилцитозин [76, 77]. Окисленный нуклеотид затем также удаляет и заменяет на цитозин фермент тимин-ДНК-гликозилаза (TGA) [78]. В клетках млекопитающих обнаружено три транслоказы TET – TET1, TET2 и TET3. Равновесие между активностью TET и Dnmt необходимо для поддержания стабильного уровня метилирования цитозинов в геноме.
В среднем в геноме человека метилировано не более одного процента цитозиновых нуклеотидов. Большинство метилированных цитозинов находится перед гуанидиновыми нуклеотидами, в так называемых CpG-островках – участках ДНК длиной около 1000 н п, обогащенных GC-повторами [79]. Около 70% промоторов генов млекопитающих содержат CpG-островки [80]. Метилирование цитозинов на CpG-островках приводит к ухудшению связывания промоторных участков с транскрипционными факторами, что ведет к блокированию экспрессии генов [81]. Также есть данные о том, что Dnmt взаимодействуют с гистондеацетилазами, что приводит к деацетилированию гистонов на промоторах генов с повышенной активностью Dnmt на них и к еще большему снижению уровня экспрессии данных генов [82]. Помимо метилирования CpG-островков на промоторах генов, существуют данные о метилировании не СpG-нуклеотидов, метилировании в не-промоторных областях генов, а также о метилировании цитозинов митохондриального генома, однако функции этих модификаций пока неясны и, по-видимому, имеют разный эффект в зависимости от локализации метилированного нуклеотида, конкретного гена и конкретной ткани [81, 83–85], Необходимо отметить, что различные Dnmt, по-видимому, специфичны к различному набору генов и по-разному регулируются в ответ на различные физиологические стимулы, что позволяет настраивать паттерн экспрессии генов в соответствии текущим потребностям клетки: таким образом, изучение общего направления уровней метилирования всех генов в тех или иных физиологических условиях не дает никакой информации ни о причинах, ни о последствиях таких изменений с точки зрения молекулярных механизмов [78].
Регуляция метилирования CpG-островков происходит за счет координации работы Dnmt и TET. Их регуляция может осуществляться как путем посттрансляционных модификаций данных ферментов, так и путем изменения содержания кофакторов, необходимых для их работы. Ключевым кофактором TET1-3 является альфа-кетоглутарат, один из интермедиатов цикла Кребса, тогда как сукцинат ингибирует работу данных ферментов [86]. В частности, было показано, что активация АМФ-зависимой протеинкиназы способствует накоплению альфа-кетоглутарата в жировой ткани за счет активации изоцитратдегидрогеназы 2, что ведет к деметилированию промотора гена Prdm16, фактора образования бурого жира [87]. АМPK также способна напрямую фосфорилировать остаток серина 99 TET2, стабилизируя его [88]. В культуре миобластов C2C12 АМПК-зависимое фосфорилирование TET2 необходимо для экспрессии регулятора пролиферации миобластов Pax7 [89]. АФК также могут оказывать влияние на функционирование TET, окисляя его второй кофактор, двухвалентные ионы железа [90].
Регуляция Dnmt также может осуществляться как за счет регуляции содержания кофакторов, так и за счет посттрансляционных модификаций. Для работы Dnmt необходимо высокое соотношение уровня S-аденозилметионина к S-аденозилгомоцистенину (SAM: SAH). SAM необходим для работы Dnmt, в то время как SAH ингибирует их активность. АМПК способна активировать работу гидроксиметилтрансферазы 2, синтезирующей SAM, и ингибировать S-аденозилгомоцистеин-гидролазу путем активации экспрессии ингибиторной микро-РНК let-7 [91]. Тем не менее также показано, что АМPK фосфорилирует остаток серина 730 молекулы Dnmt1, что инактивирует этот фермент и способствует деметилированию промоторов генов-регуляторов окислительного метаболизма PGC-1α, Tfam, NRF1, NRF2, UCP2 и UCP3 [92], хотя в гепатоцитах активация АМПК способствует транслокации Dnmt1 в митохондрии и гиперметилированию митохондриального гена ND6 [93]. Таким образом, мы видим, что АМПК может активировать как деметилирование, так и метилирование ДНК в зависимости от конкретного гена и ткани.
Исследования метилирования ДНК в скелетных мышцах в условиях функциональной разгрузки немногочисленны. Было показано, что при микрогравитации повышается метилирование промоторов генов, необходимых для дифференциации миобластов [94]. При иммобилизации камбаловидной мышцы мышей в течение 7 сут повышался уровень метилирования на промоторе nNOS, что сопровождалось снижением экспрессии этого гена [95]. После 10 дней постельной гипокинезии в m. vastus lateralis в промоторе PGC-α было обнаружено увеличение уровня метилирования одного из исследованных СpG-островков, но не двух других [96]. После 7-суточного вывешивания в камбаловидной мышце крыс было обнаружено увеличение уровня метилирования СpG-островков на промоторе PGC-α [42]. Стоит отметить, что в скелетных мышцах человека были обнаружены отличия в уровне метилирования ДНК как промоторов, так и интронов генов между быстрыми и медленными волокнами: в быстрых волокнах ДНК генов, экспрессирующихся преимущественно в медленных волокнах, была гиперметилирована; зеркальная ситуация наблюдалась в случае медленных волокон и генов, экспрессия которых характерна для быстрых волокон [97]. С учетом того факта, что при функциональной разгрузке происходит трансформация волокон скелетных мышц из “медленного” типа в “быстрый”, не исключено, что эта трансформация сопровождается соответствующими изменениями паттерна метилирования ДНК. Какими же причинами может объясняться повышение уровня метилирования СpG-островков на промоторах ряда генов в условиях функциональной разгрузки?
Одной из таких причин может являться изменение содержания альфа-кетоглутарата в тканях мышц при функциональной разгрузке. В единственном исследовании, описывающим содержание альфа-кетоглутарата при 7-суточном вывешивании, в камбаловидной мышце мыши было детектировано его значительное снижение относительно контрольных значений [11]. В нашей лаборатории на этом же сроке вывешивания в камбаловидной мышце крыс был детектирован повышенный уровень метилирования CpG-островков на промоторе PGC-1α, при этом механическая стимуляция опорных зон стопы частично предотвращала этот эффект [42]. Следует также отметить, что метилирование промотора PGC-1α напрямую зависит от активности АМПК [92]. В описываемом эксперименте фосфорилирование АМПК не различалось между контрольными группами, однако известно, что на более ранних сроках вывешивания опорная механическая стимуляция предотвращает снижение уровня фосфорилирования АМПК, и таким образом, наблюдаемый эффект опорной стимуляции на уровень CpG метилирования на 7-е сутки может быть опосредован воздействием опорной стимуляции ранее, на 1-е–3-и сутки эксперимента [53].
Таким образом, на основании этих данных можно сформулировать следующую гипотезу: нарушение функционирования митохондрий на раннем сроке функциональной разгрузки приводит к рассогласованию работы электрон-транспортной цепи и ферментов цикла Кребса (о чем мы упоминали в первой части обзора). Это ведет, помимо других эффектов, к снижению содержания альфа-кетоглутарата в мышечных волокнах; недостаток альфа-кетоглутарата, основного субстрата для работы транслоказ TET, приводит к гиперметилированию промоторов ряда генов, экспрессия которых характерна для активной мышцы. В частности, такая регуляция может работать для ряда генов, которые регулируются промоторным CpG-метилированием (таких как гены, кодирующие белки PGC-1α, Tfam, NRF1, MyHC I, nNOS) [92, 95]. Одновременно с этим за счет накопления макроэргических фосфатов в разгруженной мышце происходит инактивация АМПК, АМПК перестает ингибировать Dnmt1, и это ведет к гиперметилированию CpG-островков промоторов ряда генов, способствующих реализации окислительного метаболизма, в частности, PGC-1α, к снижению уровня биогенеза митохондрий и к дальнейшему снижению содержания альфа-кетоглутарата, что приводит к стабилизации гиперметилирования.
Ацетилирование гистонов: регуляция, взаимосвязь с окислительным метаболизмом, состояние при функциональной разгрузке
Ацетилирование гистонов происходит путем переноса ацетильной группы с молекулы ацетил-КоА на остаток лизина гистонов [98]. Ацетильная группа несет отрицательный заряд и таким образом ослабляет взаимодействие между положительно заряженным гистоном и отрицательно заряженной ДНК: это повышает доступность ДНК для транскрипционных факторов и РНК-полимеразы. Таким образом, ацетилирование гистонов представляет собой активирующую эпигенетическую модификацию [99]. Ацетилирование гистонов у млекопитающих осуществляют три класса гистон-ацетилтрансфераз – GNAT, MYST и p300/CBP [100]. Деацетилируют гистоны гистондеацетилазы (HDAC), они делятся на четыре класса: HDACI, HDACII, сиртуины (NAD+-зависимые гистон-деацетилазы, SIRT) и HDAC11. В скелетной мышце ряд сиртуинов принимает участие в активации окислительного метаболизма, тогда как HDAC IIa подавляют экспрессию PGC-1α и медленной изоформы тяжелых цепей миозина [101].
В скелетной мышце наиболее хорошо изученной является регуляция HDAC IIa, в частности, HDAC4 и 5. Активность гистондеацетилаз класса IIa регулируется за счет нуклео-цитоплазматического траффика, в частности, экспорту HDAC4 из мышечных ядер способствует ее фосфорилирование CaMK II, АМПК и PDK1 [102, 103]. Одновременно с этим активность АМПК может способствовать накоплению эндогенного ингибитора HDAC I и HDACII 2-гидроксибутирата [104]. Тем не менее АМПК способствует активации ряда деацетилаз SIRT [105]. Очевидно, что, как и в случае с эпигенетическими модификациями ДНК, эффект АМПК на уровень ацетилирования гистонов зависит от конкретного гена и ткани организма.
Активация p300/CBP в мышечных клетках может происходить за счет фосфорилирования и стабилизации молекулы p300 со стороны Akt [106], фосфорилирование со стороны МАП-киназы p38, напротив, способствует протеолизу молекулы p300 [107]. Отдельно следует отметить, что АМПК, инактивирующая ядерный импорт HDAC класса IIa, также фосфорилирует и ингибирует фермент ацетил-коА-карбоксилазу, способствуя тем самым накоплению ацетил-КоА, кофермента, необходимого для работы гистонацетилтрансфераз. На ряде культур раковых клеток было показано, что активация АМПК приводит к повышению уровня ацетилирования как гистонов, так и ряда других белков [108]. АМПК также способна активировать ацетилтрансферазу HAT-1, что приводит к увеличению уровня ацетилирования гистонов на промоторах генов-регуляторов окислительного метаболизма PGC-1α, Tfam, NRF1, NRF2, UCP2 и UCP3 [92].
В условиях функциональной разгрузки уже после первых суток вывешивания в камбаловидной мышце крыс происходит значительное накопление HDAC4 в ядерной фракции, одновременно со снижением активности АМПК и инактивацией экспрессии медленной изоформы ТЦМ, при этом фармакологическая активация АМПК или фармакологическое ингибирование HDAC4 приводят к предотвращению снижения экспрессии мРНК медленной изоформы ТЦМ [30, 109]. Таким образом, снижение фосфорилирования АМПК на первых сутках вывешивания приводит к накоплению в миоядрах HDAC4, что вносит вклад в снижение уровня экспрессии мРНК медленной изоформы ТЦМ.
Накопление HDAC4 в мышечных ядрах наблюдалось и после 10-суточной иммобилизации в m. gastrocnemius крыс [110]. После трех суток вывешивания в камбаловидной мышце крыс также были обнаружены накопление в миоядрах HDAC1 и снижение содержания p300. Ингибирование HDAC1 предотвращало увеличение экспрессии мРНК Atrogin-1 и снижение содержания p300 [111]. После 7 сут вывешивания крыс в миоядрах камбаловидных мышц наблюдаются снижение содержания p300 и увеличение содержания HDAC4, причем восстановление опорной афферентации предотвращает оба эти эффекта, как и снижение экспрессии медленной изоформы ТЦМ [112]. После 10 дней вывешивания в камбаловидной мышце крыс наблюдаются деацетилирование гистонов H3 на промоторе медленной изоформы ТЦМ и повышенное ацетилирование гистонов на промоторах изоформ ТЦМ IId/x и IIB [113]. Соответственно HDAC классов IIa и I активируются как минимум на некоторых этапах функциональной разгрузки скелетных мышц, что сопровождается соответствующими эпигенетическими изменениями на промоторах ряда генов. Схема взаимосвязей между функционированием митохондрий и эпигенетической регуляцией представлена на рис. 2.
Рис. 2.
Взаимосвязи метилирования ДНК и ацетилирования гистонов с ферментами окислительного метаболизма в скелетной мышце. SAM – S-аденозилметионин, SAH – S-аденозилгомоцистеин, АМПК – АМФ-зависимая протеинкиназа, Dnmt – ДНК-метилтрансферазы.

Рост соотношения АТФ к АДФ в скелетной мышце ведет к инактивации АМПК, что, с одной стороны, может вести к увеличению соотношения SAM: SAH и активации Dnmt3a и 3b, а с другой стороны, блокирует активность Dnmt1, что может способствовать инактивации биогенеза митохондрий. Инактивация AMПК также способствует блокированию транслоказ TET. Инактивации ТЕТ способствует и снижение уровня альфа-кетоглутарата, интермедиата цикла Кребса. Параллельно с этим инактивация АМПК способствует снижению содержания ацетил-КоА, субстрата для работы гистонацетилтрансфераз.
ЗАКЛЮЧЕНИЕ
Потенциальная связь снижения уровня окислительного метаболизма и изменения паттерна эпигенетических модификаций при функциональной разгрузке скелетных мышц
Известно, что уже после первых суток функциональной разгрузки скелетных мышц в миоплазме происходит накопление макроэргических фосфатов, которое сопровождается инактивацией АМПК. АМПК способна контролировать ряд эпигенетических модификаций, включая метилирование СpG-островков и ацетилирование гистонов на промоторах генов, принимающих непосредственное участие в регуляции фенотипа мышечных волокон и их метаболизма. Одновременно с инактивацией АМПК развивается и нарушение функций митохондрий, которое, помимо прочих эффектов, приводит к рассогласованию активности ферментов цикла Кребса и снижению содержания в мышечных волокнах основного субстрата транслоказ TET альфа-кетоглутарата. Таким образом, не исключено, что наблюдаемое на некоторых этапах функциональной разгрузки мышц эпигенетическое блокирование экспрессии генов (таких как NOS1, PPARCG1α, myh7) вызвано инактивацией АМПК и снижением содержания альфа-кетоглутарата. Относительный вклад этих двух явлений в эпигенетическое блокирование экспрессии конкретных генов, как и регуляторные взаимосвязи между инактивацией АМПК и нарушением функций митохондрий, еще предстоит исследовать.
ВЫВОД
В данном обзоре было рассмотрено состояние митохондрий при различных моделях функциональной разгрузки скелетных мышц и проанализированы исследования, посвященные особенностям эпигенетического состояния ряда генов, экспрессия которых необходима для поддержания окислительного, устойчивого к утомлению фенотипа мышечных волокон. По итогам изложенного можно заключить, что нарушение функций митохондрий на ранних этапах функциональной разгрузки мышц приводит к рассогласованию работы ферментов дыхательной цепи и цикла Кребса, что сопровождается изменениями относительного содержания интермедиатов цикла Кребса и накоплением АФК. Одновременно с этим происходит накопление макроэргических фосфатов, вызванное инактивацией мышц, и инактивация АМПК. Эти изменения должны неизбежно вести к изменениям в уровне CpG-метилирования ДНК и ацетилирования гистонов, поскольку интермедиаты цикла Кребса и АМПК регулируют работу ферментов, реализующих эти модификации. Ряд работ, посвященных анализу эпигенетического статуса некоторых генов в условиях функциональной разгрузки, показывает, что репрессорные модификации ДНК и гистонов характерны для генов медленной изоформы тяжелых цепей миозина, нейрональной NO-синтазы и PGC1-α. Таким образом, не исключено, что именно нарушения функционирования митохондрий ведут к эпигенетическим изменениям и снижению уровней экспрессии этих генов.
Список литературы
Memme JM, Slavin M, Moradi N, Hood DA (2021) Mitochondrial Bioenergetics and Turnover during Chronic Muscle Disuse. Int J Mol Sci 22 (10): 5179.https://doi.org/10.3390/ijms22105179
Romanello V, Sandri M (2021) The connection between the dynamic remodeling of the mitochondrial network and the regulation of muscle mass. Cell Mol Life Sci 78 (4): 1305–1328. https://doi.org/10.1007/s00018-020-03662-0
Ohira Y, Yasui W, Kariya F, Wakatsuki T, Nakamura K, Asakura T, Edgerton VR (1994) Metabolic adaptation of skeletal muscles to gravitational unloading. Acta Astronaut 33: 113–117.
Desplanches D, Mayet MH, Sempore B, Flandrois R (1987) Structural and functional responses to prolonged hindlimb suspension in rat muscle. J Appl Physiol (1985) 63 (2): 558–563. https://doi.org/10.1152/jappl.1987.63.2.558
Hirayama Y, Nakanishi R, Maeshige N, Fujino H (2017) Preventive effects of nucleoprotein supplementation combined with intermittent loading on capillary regression induced by hindlimb unloading in rat soleus muscle. Physiol Rep 5 (4).https://doi.org/10.14814/phy2.13134
Fell RD, Steffen JM, Musacchia XJ (1985) Effect of hypokinesia-hypodynamia on rat muscle oxidative capacity and glucose uptake. Am J Physiol 249 (3 Pt 2): R308–R312. https://doi.org/10.1152/ajpregu.1985.249.3.R308
Nagatomo F, Fujino H, Kondo H, Suzuki H, Kouzaki M, Takeda I, Ishihara A (2011) PGC-1alpha and FOXO1 mRNA levels and fiber characteristics of the soleus and plantaris muscles in rats after hindlimb unloading. Histol Histopathol 26 (12): 1545–1553. https://doi.org/10.14670/HH-26.1545
Fitts RH, Brimmer CJ, Heywood-Cooksey A, Timmerman RJ (1989) Single muscle fiber enzyme shifts with hindlimb suspension and immobilization. Am J Physiol 256 (5 Pt 1): C1082–C1091. https://doi.org/10.1152/ajpcell.1989.256.5.C1082
Ohira T, Kawano F, Ohira T, Goto K, Ohira Y (2015) Responses of skeletal muscles to gravitational unloading and/or reloading. J Physiol Sci 65 (4): 293–310. https://doi.org/10.1007/s12576-015-0375-6
Yajid F, Mercier JG, Mercier BM, Dubouchaud H, Prefaut C (1998) Effects of 4 wk of hindlimb suspension on skeletal muscle mitochondrial respiration in rats. J Appl Physiol (1985) 84 (2): 479–485. https://doi.org/10.1152/jappl.1998.84.2.479
Zhang X, Trevino MB, Wang M, Gardell SJ, Ayala JE, Han X, Kelly DP, Goodpaster BH, Vega RB, Coen PM (2018) Impaired Mitochondrial Energetics Characterize Poor Early Recovery of Muscle Mass Following Hind Limb Unloading in Old Mice. J Gerontol A Biol Sci Med Sci 73 (10): 1313–1322. https://doi.org/10.1093/gerona/gly051
Шенкман БС, Матвеева ОА, Мазин МГ, Немировская ТЛ, Киселева ЕВ, Козловская ИБ (2003) Пластичность клеточных и тканевых структур m. soleus человека в условиях длительной гипокинезии. Биол мембр 20 (1): 77–86. [Shenkman BS, Matveyeva OA, Mazin MG, Nemirovskaya TL, Kiseleva YEV, Kozlovskaya IB (2003) Plasticity of cellular and tissue structures m. human soleus under conditions of prolonged hypokinesia. Biol membr 20 (1): 77–86. (In Russ)].
Шенкман Б, Виноградова О, Мазин М, Киселева Е, Белозерова И, Немировская Т, Трушева Т, Тихомиров Е (2003) Физиологическая стоимость физической нагрузки и объем митохондрий рабочих мышц у людей в условиях длительной гипокинезии. Эффекты резистивных локальных нагрузок. Физиология человека 29 (2): 75–80. [Shenkman B, Vinogradova O, Mazin M, Kiseleva Ye, Belozerova I, Nemirovskaya T, Trusheva T, Tikhomirov Ye (2003) Physiological cost of physical activity and mitochondrial volume of working muscles in humans under conditions of prolonged hypokinesia. Effects of resistive local load. Human Pysiol 29 (2): 75–80. (In Russ)].
Trevino MB, Zhang X, Standley RA, Wang M, Han X, Reis FCG, Periasamy M, Yu G, Kelly DP, Goodpaster BH, Vega RB, Coen PM (2019) Loss of mitochondrial energetics is associated with poor recovery of muscle function but not mass following disuse atrophy. Am J Physiol Endocrinol Metab 317 (5): E899–E910. https://doi.org/10.1152/ajpendo.00161.2019
Lechado ITA, Vitadello M, Traini L, Namuduri AV, Gastaldello S, Gorza L (2018) Sarcolemmal loss of active nNOS (Nos1) is an oxidative stress-dependent, early event driving disuse atrophy. J Pathol 246 (4): 433–446. https://doi.org/10.1002/path.5149
Gomez-Cabrera MC, Arc-Chagnaud C, Salvador-Pascual A, Brioche T, Chopard A, Olaso-Gonzalez G, Vina J (2020) Redox modulation of muscle mass and function. Redox Biol 35: 101531. https://doi.org/10.1016/j.redox.2020.101531
Max SR (1972) Disuse atrophy of skeletal muscle: loss of functional activity of mitochondria. Biochem Biophys Res Commun 46 (3): 1394–1398. https://doi.org/10.1016/s0006-291x(72)80130-x
Larsen S, Lundby AM, Dandanell S, Oberholzer L, Keiser S, Andersen AB, Haider T, Lundby C (2018) Four days of bed rest increases intrinsic mitochondrial respiratory capacity in young healthy males. Physiol Rep 6 (18): e13793. https://doi.org/10.14814/phy2.13793
Theeuwes WF, Gosker HR, Langen RCJ, Verhees KJP, Pansters NAM, Schols A, Remels AHV (2017) Inactivation of glycogen synthase kinase-3beta (GSK-3beta) enhances skeletal muscle oxidative metabolism. Biochim Biophys Acta Mol Basis Dis 1863 (12): 3075–3086. https://doi.org/10.1016/j.bbadis.2017.09.018
Liu J, Peng Y, Cui Z, Wu Z, Qian A, Shang P, Qu L, Li Y, Liu J, Long J (2012) Depressed mitochondrial biogenesis and dynamic remodeling in mouse tibialis anterior and gastrocnemius induced by 4-week hindlimb unloading. IUBMB Life 64 (11): 901–910. https://doi.org/10.1002/iub.1087
Standley RA, Distefano G, Trevino MB, Chen E, Na-rain NR, Greenwood B, Kondakci G, Tolstikov VV, Kiebish MA, Yu G, Qi F, Kelly DP, Vega RB, Coen PM, Goodpaster BH (2020) Skeletal Muscle Energetics and Mitochondrial Function Are Impaired Following 10 Days of Bed Rest in Older Adults. J Gerontol A Biol Sci Med Sci 75 (9): 1744–1753. https://doi.org/10.1093/gerona/glaa001
Bilet L, Phielix E, van de Weijer T, Gemmink A, Bosma M, Moonen-Kornips E, Jorgensen JA, Schaart G, Zhang D, Meijer K, Hopman M, Hesselink MKC, Ouwens DM, Shulman GI, Schrauwen-Hinderling VB, Schrauwen P (2020) One-leg inactivity induces a reduction in mitochondrial oxidative capacity, intramyocellular lipid accumulation and reduced insulin signalling upon lipid infusion: a human study with unilateral limb suspension. Diabetologia 63 (6): 1211–1222. https://doi.org/10.1007/s00125-020-05128-1
Connor MK, Hood DA (1998) Effect of microgravity on the expression of mitochondrial enzymes in rat cardiac and skeletal muscles. J Appl Physiol (1985) 84 (2): 593–5–98. https://doi.org/10.1152/jappl.1998.84.2.593
Tascher G, Brioche T, Maes P, Chopard A, O’Gorman D, Gauquelin-Koch G, Blanc S, Bertile F (2017) Proteome-wide Adaptations of Mouse Skeletal Muscles during a Full Month in Space. J Proteome Res 16 (7): 2623–2638. https://doi.org/10.1021/acs.jproteome.7b00201
Mazin MG, Kiselyova EV, Nemirovskaya TL, Shenkman BS (2000) Ultrastructure of skeletal muscles of rhesus monkeys after spaceflight. J Gravit Physiol 7 (1): S59–S62.
Shenkman BS, Nemirovskaya TL, Belozerova IN, Mazin MG, Matveeva OA (2002) Mitochondrial adaptations in skeletal muscle cells in mammals exposed to gravitational unloading. J Gravit Physiol 9 (1): 159–162.
Desplanches D, Kayar SR, Sempore B, Flandrois R, Hoppeler H (1990) Rat soleus muscle ultrastructure after hindlimb suspension. J Appl Physiol (1985) 69 (2): 504–508. https://doi.org/10.1152/jappl.1990.69.2.504
Shenkman BS (2020) How Postural Muscle Senses Disuse? Early Signs and Signals. Int J Mol Sci 21 (14).https://doi.org/10.3390/ijms21145037
Ingalls CP, Warren GL, Armstrong RB (1999) Intracellular Ca2+ transients in mouse soleus muscle after hindlimb unloading and reloading. J Appl Physiol (1985) 87 (1): 386–390. https://doi.org/10.1152/jappl.1999.87.1.386
Vilchinskaya NA, Mochalova EP, Nemirovskaya TL, Mirzoev TM, Turtikova OV, Shenkman BS (2017) Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J Physiol 595 (23): 7123–7134. https://doi.org/10.1113/JP275184
Kravtsova VV, Matchkov VV, Bouzinova EV, Vasiliev AN, Razgovorova IA, Heiny JA, Krivoi, II (2015) Isoform-specific Na,K-ATPase alterations precede disuse-induced atrophy of rat soleus muscle. Biomed Res Int 2015 (720172. https://doi.org/10.1155/2015/720172
Krivoi II, Kravtsova VV, Altaeva EG, Kubasov IV, Prokof’ev AV, Drabkina TM, Nikol’skii EE, Shenkman BS (2008) [Decrease in the electrogenic contribution of Na,K-ATPase and resting membrane potential as a possible mechanism of calcium ion accumulation in filaments of the rat musculus soleus subjected to the short-term gravity unloading]. Biofizika 53 (6): 1051–1057.
Henriksen EJ, Tischler ME (1988) Time course of the response of carbohydrate metabolism to unloading of the soleus. Metabolism 37 (3): 201–208.
Vilchinskaya NA, Mirzoev TM, Lomonosova YN, Kozlovskaya IB, Shenkman BS (2015) Human muscle signaling responses to 3-day head-out dry immersion. J Musculoskelet Neuronal Interact 15 (3): 286–293.
Zaripova KA, Kalashnikova EP, Kostrominova TY, Shenkman BS, Nemirovskaya TL (2021) Role of Pannexin 1 ATP-Permeable Channels in the Regulation of Signaling Pathways during Skeletal Muscle Unloading. Int J Mol Sci 22 (19): 10444. https://doi.org/10.3390/ijms221910444
Ingalls CP, Wenke JC, Armstrong RB (2001) Time course changes in [Ca2+]i, force, and protein content in hindlimb-suspended mouse soleus muscles. Aviat Space Environ Med 72 (5): 471–476.
Shenkman BS, Nemirovskaya TL (2008) Calcium-dependent signaling mechanisms and soleus fiber remodeling under gravitational unloading. J Muscle Res Cell Motil 29 (6–8): 221–230. https://doi.org/10.1007/s10974-008-9164-7
Li A, Yi J, Li X, Zhou J (2020) Physiological Ca(2+) Transients Versus Pathological Steady-State Ca(2+) Elevation, Who Flips the ROS Coin in Skeletal Muscle Mitochondria. Front Physiol 11 595800. https://doi.org/10.3389/fphys.2020.595800
Karam C, Yi J, Xiao Y, Dhakal K, Zhang L, Li X, Manno C, Xu J, Li K, Cheng H, Ma J, Zhou J (2017) Absence of physiological Ca(2+) transients is an initial trigger for mitochondrial dysfunction in skeletal muscle following denervation. Skelet Muscle 7 (1): 6. https://doi.org/10.1186/s13395-017-0123-0
Andersson DC, Betzenhauser MJ, Reiken S, Meli AC, Umanskaya A, Xie W, Shiomi T, Zalk R, Lacampagne A, Marks AR (2011) Ryanodine receptor oxidation causes intracellular calcium leak and muscle weakness in aging. Cell Metab 14 (2): 196–207. https://doi.org/10.1016/j.cmet.2011.05.014
Matecki S, Dridi H, Jung B, Saint N, Reiken SR, Scheuermann V, Mrozek S, Santulli G, Umanskaya A, Petrof BJ, Jaber S, Marks AR, Lacampagne A (2016) Leaky ryanodine receptors contribute to diaphragmatic weakness during mechanical ventilation. Proc Natl Acad Sci U S A 113 (32): 9069–9074. https://doi.org/10.1073/pnas.1609707113
Sharlo K, Lvova I, Turtikova O, Tyganov S, Kalashnikov V, Shenkman B (2022) Plantar stimulation prevents the decreases in fatigue resistance and mitochondrial biogenesis in rat m soleus under 7 days of hindlimb suspension. Arch Biochem Biophys 718 (142): 109–150. https://doi.org/10.1016/j.abb.2022.109150
Lomonosova YN, Kalamkarov GR, Bugrova AE, Shevchenko TF, Kartashkina NL, Lysenko EA, Shvets VI, Nemirovskaya TL (2011) Protective effect of L-Arginine administration on proteins of unloaded m. soleus. Biochemistry (Mosc) 76 (5): 571–580. https://doi.org/10.1134/S0006297911050075
Agnetti G, Herrmann H, Cohen S (2022) New roles for desmin in the maintenance of muscle homeostasis. FEBS J.https://doi.org/10.1111/febs.15864
Milner DJ, Mavroidis M, Weisleder N, Capetanaki Y (2000) Desmin cytoskeleton linked to muscle mitochondrial distribution and respiratory function. J Cell Biol 150 (6): 1283–1298. https://doi.org/10.1083/jcb.150.6.1283
Petrova IO, Tyganov SA, Mirzoev TM, Tsaturyan AK, Kozlovskaya IB, Shenkman BS (2018) Early Desmall es, Cyrillicline in Rat Soleus Passive Tension with Hindlimb Unloading: Inactivation of Cross-bridges or Activation of Calpains? Dokl Biochem Biophys 481 (1): 205–207. https://doi.org/10.1134/S1607672918040075
Миpзоев ТМ, Веcелова ОМ, Лаpина ИМ, Шенкман БС, Огнева ИВ (2012) Паpаметpы клеточного дыxания волокон и cодеpжание деcмина в камбаловидной мышце кpыcы на pанниx этапаx гpавитационной pазгpузки. Биофизика 57 (3): 509–514. [Mirzoyev TM, Vecelova OM, Larina IM, Shenkman BS, Ogneva IV (2012) Parameters of cellular respiration of fibers and the content of desmin in the rat soleus muscle at the early stage of gravitational unloading. Biofizika 57 (3): 509–514. (In Russ)].
Hyatt HW, Ozdemir M, Yoshihara T, Nguyen BL, Deminice R, Powers SK (2021) Calpains play an essential role in mechanical ventilation-induced diaphragmatic weakness and mitochondrial dysfunction. Redox Biol 38 101802. https://doi.org/10.1016/j.redox.2020.101802
Herzig S, Shaw RJ (2018) AMPK: guardian of metabolism and mitochondrial homeostasis. Nat Rev Mol Cell Biol 19 (2): 121–135. https://doi.org/10.1038/nrm.2017.95
Adams GR, Haddad F, Baldwin KM (1994) Interaction of chronic creatine depletion and muscle unloading: effects on postural locomotor muscles. J Appl Physiol (1985) 77 (3): 1198–1205. https://doi.org/10.1152/jappl.1994.77.3.1198
Mirzoev T, Tyganov S, Vilchinskaya N, Lomonosova Y, Shenkman B (2016) Key Markers of mTORC1-Dependent and mTORC1-Independent Signaling Pathways Regulating Protein Synthesis in Rat Soleus Muscle During Early Stages of Hindlimb Unloading. Cell Physiol Biochem 39 (3): 1011–1020. https://doi.org/10.1159/000447808
Gupta RC, Misulis KE, Dettbarn WD (1989) Activity dependent characteristics of fast and slow muscle: biochemical and histochemical considerations. Neurochem Res 14 (7): 647–655. https://doi.org/10.1007/BF00964874
Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova II, Mirzoev TM, Shenkman BS (2019) Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Physiol 10: 1252. https://doi.org/10.3389/fphys.2019.01252
Rosa-Caldwell ME, Brown JL, Perry RA Jr, Shimkus KL, Shirazi-Fard Y, Brown LA, Hogan HA, Fluckey JD, Washington TA, Wiggs MP, Greene NP (2020) Regulation of mitochondrial quality following repeated bouts of hindlimb unloading. Appl Physiol Nutr Metab 45 (3): 264–274. https://doi.org/10.1139/apnm-2019-0218
Sharlo KA, Paramonova, II, Lvova ID, Vilchinskaya NA, Bugrova AE, Shevchenko TF, Kalamkarov GR, Shenkman BS (2020) NO-Dependent Mechanisms of Myosin Heavy Chain Transcription Regulation in Rat Soleus Muscle After 7-Days Hindlimb Unloading. Front Physiol 11: 814. https://doi.org/10.3389/fphys.2020.00814
Theilen NT, Jeremic N, Weber GJ, Tyagi SC (2018) Exercise preconditioning diminishes skeletal muscle atrophy after hindlimb suspension in mice. J Appl Physiol (1985) 125 (4): 999–1010. https://doi.org/10.1152/japplphysiol.00137.2018
Qi Z, Zhang Y, Guo W, Ji L, Ding S (2012) Increased insulin sensitivity and distorted mitochondrial adaptations during muscle unloading. Int J Mol Sci 13 (12): 16971–16985. https://doi.org/10.3390/ijms131216971
Kang C, Ji LL (2013) Muscle immobilization and remobilization downregulates PGC-1alpha signaling and the mitochondrial biogenesis pathway. J Appl Physiol (1985) 115 (11): 1618–1625. https://doi.org/10.1152/japplphysiol.01354.2012
Gambara G, Salanova M, Ciciliot S, Furlan S, Gutsmann M, Schiffl G, Ungethuem U, Volpe P, Gunga HC, Blottner D (2017) Gene Expression Profiling in Slow-Type Calf Soleus Muscle of 30 Days Space-Flown Mice. PLoS One 12 (1): e0169314. https://doi.org/10.1371/journal.pone.0169314
Buso A, Comelli M, Picco R, Isola M, Magnesa B, Pisot R, Rittweger J, Salvadego D, Simunic B, Grassi B, Mavelli I (2019) Mitochondrial Adaptations in Elderly and Young Men Skeletal Muscle Following 2 Weeks of Bed Rest and Rehabilitation. Front Physiol 10: 474. https://doi.org/10.3389/fphys.2019.00474
Fernandez-Gonzalo R, Irimia JM, Cusso R, Gustafsson T, Linne A, Tesch PA (2014) Flywheel resistance exercise to maintain muscle oxidative potential during unloading. Aviat Space Environ Med 85 (7): 694–699. https://doi.org/10.3357/asem.3856.2014
Rittweger J, Albracht K, Fluck M, Ruoss S, Brocca L, Longa E, Moriggi M, Seynnes O, Di Giulio I, Tenori L, Vig-noli A, Capri M, Gelfi C, Luchinat C, Francheschi C, Bottinelli R, Cerretelli P, Narici M (2018) Sarcolab pilot study into skeletal muscle’s adaptation to long-term spaceflight. NPJ Microgravity 4: 18. https://doi.org/10.1038/s41526-018-0052-1
Wagatsuma A, Kotake N, Kawachi T, Shiozuka M, Yamada S, Matsuda R (2011) Mitochondrial adaptations in skeletal muscle to hindlimb unloading. Mol Cell Biochem 350 (1–2): 1–11. https://doi.org/10.1007/s11010-010-0677-1
Kenny HC, Tascher G, Ziemianin A, Rudwill F, Zahariev A, Chery I, Gauquelin-Koch G, Barielle MP, Heer M, Blanc S, O’Gorman DJ, Bertile F (2020) Effectiveness of Resistive Vibration Exercise and Whey Protein Supplementation Plus Alkaline Salt on the Skeletal Muscle Proteome Following 21 Days of Bed Rest in Healthy Males. J Proteome Res 19 (8): 3438–3451. https://doi.org/10.1021/acs.jproteome.0c00256
Cho Y, Hazen BC, Gandra PG, Ward SR, Schenk S, Russell AP, Kralli A (2016) Perm1 enhances mitochondrial biogenesis, oxidative capacity, and fatigue resistance in adult skeletal muscle. FASEB J 30 (2): 674–687.https://doi.org/10.1096/fj.15-276360
Lvova ID, Sharlo KA, Rozhkov SV, Mirzoev TM, Shenkman BS (2021) The Role of Glycogen Synthase Kinase 3 Activity in the Regulation of Mitochondrial Biogenesis in Rat Postural Muscle under Hindlimb Unloading. Biochemistry (Moscow) Suppl SerA: Membr Cell Biol 16: 372–377.https://doi.org/10.31857/S0233475521060074
Lomonosova YN, Turtikova OV, Shenkman BS (2016) Reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway. J Muscle Res Cell Motil 37 (1–2): 7–16. https://doi.org/10.1007/s10974-015-9428-y
Leermakers PA, Kneppers AEM, Schols A, Kelders M, de Theije CC, Verdijk LB, van Loon LJC, Langen RCJ, Gosker HR (2019) Skeletal muscle unloading results in increased mitophagy and decreased mitochondrial biogenesis regulation. Muscle Nerve 60 (6): 769–778. https://doi.org/10.1002/mus.26702
Rosa-Caldwell ME, Lim S, Haynie WS, Brown JL, Lee DE, Dunlap KR, Jansen LT, Washington TA, Wiggs MP, Greene NP (2021) Mitochondrial aberrations during the progression of disuse atrophy differentially affect male and female mice. J Cachexia Sarcopenia Muscle 12 (6): 2056–2068. https://doi.org/10.1002/jcsm.12809
Kang C, Ji LL (2016) PGC-1alpha overexpression via local transfection attenuates mitophagy pathway in muscle disuse atrophy. Free Radic Biol Med 93: 32–40. https://doi.org/10.1016/j.freeradbiomed.2015.12.032
Drake JC, Wilson RJ, Laker RC, Guan Y, Spaulding HR, Nichenko AS, Shen W, Shang H, Dorn MV, Huang K, Zhang M, Bandara AB, Brisendine MH, Kashatus JA, Sharma PR, Young A, Gautam J, Cao R, Wallrabe H, Chang PA, Wong M, Desjardins EM, Hawley SA, Christ GJ, Kashatus DF, Miller CL, Wolf MJ, Periasamy A, Steinberg GR, Hardie DG, Yan Z (2021) Mitochondria-localized AMPK responds to local energetics and contributes to exercise and energetic stress-induced mitophagy. Proc Natl Acad Sci U S A 118 (37): e2025932118.https://doi.org/10.1073/pnas.2025932118
Kang C, Yeo D, Ji LL (2016) Muscle immobilization activates mitophagy and disrupts mitochondrial dynamics in mice. Acta Physiol (Oxf) 218 (3): 188–197. https://doi.org/10.1111/apha.12690
Standley RA, Distefano G, Pereira SL, Tian M, Kelly OJ, Coen PM, Deutz NEP, Wolfe RR, Goodpaster BH (2017) Effects of beta-hydroxy-beta-methylbutyrate on skeletal muscle mitochondrial content and dynamics, and lipids after 10 days of bed rest in older adults. J Appl Physiol (1985) 123 (5): 1092–1100. https://doi.org/10.1152/japplphysiol.00192.2017
Zorzano A (2009) Regulation of mitofusin-2 expression in skeletal muscle. Appl Physiol Nutr Metab 34 (3): 433–439. https://doi.org/10.1139/H09-049
Gowher H, Jeltsch A (2018) Mammalian DNA methyltransferases: new discoveries and open questions. Biochem Soc Trans 46 (5): 1191–1202. https://doi.org/10.1042/BST20170574
Tahiliani M, Koh KP, Shen Y, Pastor WA, Bandukwala H, Brudno Y, Agarwal S, Iyer LM, Liu DR, Aravind L, Rao A (2009) Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science 324 (5929): 930–935. https://doi.org/10.1126/science.1170116
Ito S, Shen L, Dai Q, Wu SC, Collins LB, Swenberg JA, He C, Zhang Y (2011) Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science 333 (6047): 1300–1303. https://doi.org/10.1126/science.1210597
An J, Rao A, Ko M (2017) TET family dioxygenases and DNA demethylation in stem cells and cancers. Exp Mol Med 49 (4): e323. https://doi.org/10.1038/emm.2017.5
Bird A, Taggart M, Frommer M, Miller OJ, Macleod D (1985) A fraction of the mouse genome that is derived from islands of nonmethylated, CpG-rich DNA. Cell 40 (1): 91–99. https://doi.org/10.1016/0092-8674(85)90312-5
Saxonov S, Berg P, Brutlag DL (2006) A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters. Proc Natl Acad Sci U S A 103 (5): 1412–1417. https://doi.org/10.1073/pnas.0510310103
Moore LD, Le T, Fan G (2013) DNA methylation and its basic function. Neuropsychopharmacology 38 (1): 23–38. https://doi.org/10.1038/npp.2012.112
Fuks F, Burgers WA, Brehm A, Hughes-Davies L, Kouzarides T (2000) DNA methyltransferase Dnmt1 associates with histone deacetylase activity. Nat Genet 24 (1): 88–91. https://doi.org/10.1038/71750
Titcombe P, Murray R, Hewitt M, Antoun E, Cooper C, Inskip HM, Holbrook JD, Godfrey KM, Lillycrop K, Hanson M, Barton SJ (2021) Human non-CpG methylation patterns display both tissue-specific and inter-individual differences suggestive of underlying function. Epigenetics 1–12. https://doi.org/10.1080/15592294.2021.1950990
Wu H, Coskun V, Tao J, Xie W, Ge W, Yoshikawa K, Li E, Zhang Y, Sun YE (2010) Dnmt3a-dependent nonpromoter DNA methylation facilitates transcription of neurogenic genes. Science 329 (5990): 444–448. https://doi.org/10.1126/science.1190485
A FCL (2020) Mitochondrial metabolism and DNA methylation: a review of the interaction between two genomes. Clin Epigenetics 12 (1): 182. https://doi.org/10.1186/s13148-020-00976-5
Salminen A, Kauppinen A, Hiltunen M, Kaarniranta K (2014) Krebs cycle intermediates regulate DNA and histone methylation: epigenetic impact on the aging process. Ageing Res Rev 16: 45–65. https://doi.org/10.1016/j.arr.2014.05.004
Yang Q, Liang X, Sun X, Zhang L, Fu X, Rogers CJ, Berim A, Zhang S, Wang S, Wang B, Foretz M, Viollet B, Gang DR, Rodgers BD, Zhu MJ, Du M (2016) AMPK/alpha-Ketoglutarate Axis Dynamically Mediates DNA Demethylation in the Prdm16 Promoter and Brown Adipogenesis. Cell Metab 24 (4): 542–554. https://doi.org/10.1016/j.cmet.2016.08.010
Wu D, Hu D, Chen H, Shi G, Fetahu IS, Wu F, Rabidou K, Fang R, Tan L, Xu S, Liu H, Argueta C, Zhang L, Mao F, Yan G, Chen J, Dong Z, Lv R, Xu Y, Wang M, Ye Y, Zhang S, Duquette D, Geng S, Yin C, Lian CG, Murphy GF, Adler GK, Garg R, Lynch L, Yang P, Li Y, Lan F, Fan J, Shi Y, Shi YG (2018) Glucose-regulated phosphorylation of TET2 by AMPK reveals a pathway linking diabetes to cancer. Nature 559 (7715): 637–641. https://doi.org/10.1038/s41586-018-0350-5
Zhang T, Guan X, Choi UL, Dong Q, Lam MMT, Zeng J, Xiong J, Wang X, Poon TCW, Zhang H, Zhang X, Wang H, Xie R, Zhu B, Li G (2019) Phosphorylation of TET2 by AMPK is indispensable in myogenic differentiation. Epigen Chromatin 12 (1): 32. https://doi.org/10.1186/s13072-019-0281-x
Matuleviciute R, Cunha PP, Johnson RS, Foskolou IP (2021) Oxygen regulation of TET enzymes. FEBS J 288 (24): 7143–7161. https://doi.org/10.1111/febs.15695
Zhong T, Men Y, Lu L, Geng T, Zhou J, Mitsuhashi A, Shozu M, Maihle NJ, Carmichael GG, Taylor HS, Huang Y (2017) Metformin alters DNA methylation genome-wide via the H19/SAHH axis. Oncogene 36 (17): 2345–2354. https://doi.org/10.1038/onc.2016.391
Marin TL, Gongol B, Zhang F, Martin M, Johnson DA, Xiao H, Wang Y, Subramaniam S, Chien S, Shyy JY (2017) AMPK promotes mitochondrial biogenesis and function by phosphorylating the epigenetic factors DNMT1, RBBP7, and HAT1. Sci Signal 10 (464): eaaf 7478. https://doi.org/10.1126/scisignal.aaf7478
Cao K, Lv W, Wang X, Dong S, Liu X, Yang T, Xu J, Zeng M, Zou X, Zhao D, Ma Q, Lin M, Long J, Zang W, Gao F, Feng Z, Liu J (2021) Hypermethylation of Hepatic Mitochondrial ND6 Provokes Systemic Insulin Resistance. Adv Sci (Weinh) 8 (11): 2004507. https://doi.org/10.1002/advs.202004507
Furukawa T, Tanimoto K, Fukazawa T, Imura T, Kawahara Y, Yuge L (2018) Simulated microgravity attenuates myogenic differentiation via epigenetic regulations. NPJ Microgravity 4: 11. https://doi.org/10.1038/s41526-018-0045-0
Tomiga Y, Ito A, Sudo M, Ando S, Eshima H, Sakai K, Nakashima S, Uehara Y, Tanaka H, Soejima H, Higaki Y (2019) One week, but not 12 hours, of cast immobilization alters promotor DNA methylation patterns in the nNOS gene in mouse skeletal muscle. J Physiol 597 (21): 5145–5159. https://doi.org/10.1113/JP277019
Alibegovic AC, Sonne MP, Hojbjerre L, Bork-Jensen J, Jacobsen S, Nilsson E, Faerch K, Hiscock N, Mortensen B, Friedrichsen M, Stallknecht B, Dela F, Vaag A (2010) Insulin resistance induced by physical inactivity is associated with multiple transcriptional changes in skeletal muscle in young men. Am J Physiol Endocrinol Metab 299 (5): E752-E763. https://doi.org/10.1152/ajpendo.00590.2009
Begue G, Raue U, Jemiolo B, Trappe S (2017) DNA methylation assessment from human slow- and fast-twitch skeletal muscle fibers. J Appl Physiol (1985) 122 (4): 952–967. https://doi.org/10.1152/japplphysiol.00867.2016
Rye PT, Frick LE, Ozbal CC, Lamarr WA (2011) Advances in label-free screening approaches for studying histone acetyltransferases. J Biomol Screen 16 (10): 1186–1195. https://doi.org/10.1177/1087057111418653
Graff J, Tsai LH (2013) Histone acetylation: molecular mnemonics on the chromatin. Nat Rev Neurosci 14 (2): 97–111. https://doi.org/10.1038/nrn3427
Sun XJ, Man N, Tan Y, Nimer SD, Wang L (2015) The Role of Histone Acetyltransferases in Normal and Malignant Hematopoiesis. Front Oncol 5: 108. https://doi.org/10.3389/fonc.2015.00108
Tian H, Liu S, Ren J, Lee JKW, Wang R, Chen P (2020) Role of Histone Deacetylases in Skeletal Muscle Physiology and Systemic Energy Homeostasis: Implications for Metabolic Diseases and Therapy. Front Physiol 11: 949. https://doi.org/10.3389/fphys.2020.00949
Liu Y, Randall WR, Schneider MF (2005) Activity-dependent and -independent nuclear fluxes of HDAC4 mediated by different kinases in adult skeletal muscle. J Cell Biol 168 (6): 887–897. https://doi.org/10.1083/jcb.200408128
McKinsey TA, Zhang CL, Olson EN (2001) Identification of a signal-responsive nuclear export sequence in class II histone deacetylases. Mol Cell Biol 21 (18): 6312–6321.
Shimazu T, Hirschey MD, Newman J, He W, Shirakawa K, Le Moan N, Grueter CA, Lim H, Saunders LR, Stevens RD, Newgard CB, Farese RV, Jr., de Cabo R, Ulrich S, Akassoglou K, Verdin E (2013) Suppression of oxidative stress by beta-hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science 339 (6116): 211–214. https://doi.org/10.1126/science.1227166
Ruderman NB, Xu XJ, Nelson L, Cacicedo JM, Saha AK, Lan F, Ido Y (2010) AMPK and SIRT1: a long-standing partnership? Am J Physiol Endocrinol Metab 298 (4): E751–E760. https://doi.org/10.1152/ajpendo.00745.2009
Chen J, Wang Y, Hamed M, Lacroix N, Li Q (2015) Molecular Basis for the Regulation of Transcriptional Coactivator p300 in Myogenic Differentiation. Sci Rep 5: 13727. https://doi.org/10.1038/srep13727
Poizat C, Puri PL, Bai Y, Kedes L (2005) Phosphorylation-dependent degradation of p300 by doxorubicin-activated p38 mitogen-activated protein kinase in cardiac cells. Mol Cell Biol 25 (7): 2673–2687. https://doi.org/10.1128/MCB.25.7.2673-2687.2005
Galdieri L, Gatla H, Vancurova I, Vancura A (2016) Activation of AMP-activated Protein Kinase by Metformin Induces Protein Acetylation in Prostate and Ovarian Cancer Cells. J Biol Chem 291 (48): 25154–25166. https://doi.org/10.1074/jbc.M116.742247
Paramonova II, Vilchinskaya NA, Shenkman BS (2021) HDAC4 Is Indispensable for Reduced Slow Myosin Expression at the Early Stage of Hindlimb Unloading in Rat Soleus Muscle. Pharmaceuticals (Basel) 14 (11): 1167.https://doi.org/10.3390/ph14111167
Yoshihara T, Machida S, Kurosaka Y, Kakigi R, Sugiura T, Naito H (2016) Immobilization induces nuclear accumulation of HDAC4 in rat skeletal muscle. J Physiol Sci 66 (4): 337–343. https://doi.org/10.1007/s12576-015-0432-1
Mochalova EP, Belova SP, Mirzoev TM, Shenkman BS, Nemirovskaya TL (2019) Atrogin-1/MAFbx mRNA expression is regulated by histone deacetylase 1 in rat soleus muscle under hindlimb unloading. Sci Rep 9 (1): 10263. https://doi.org/10.1038/s41598-019-46753-0
Sharlo KA, Paramonova, II, Lvova ID, Mochalova EP, Kalashnikov VE, Vilchinskaya NA, Tyganov SA, Konstantinova TS, Shevchenko TF, Kalamkarov GR, Shenkman BS (2021) Plantar Mechanical Stimulation Maintains Slow Myosin Expression in Disused Rat Soleus Muscle via NO-Dependent Signaling. Int J Mol Sci 22. (3): 1372.https://doi.org/10.3390/ijms22031372
Pandorf CE, Haddad F, Wright C, Bodell PW, Baldwin KM (2009) Differential epigenetic modifications of histones at the myosin heavy chain genes in fast and slow skeletal muscle fibers and in response to muscle unloading. Am J Physiol Cell Physiol 297 (1): C6–C16. https://doi.org/10.1152/ajpcell.00075.2009
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


