Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 3, стр. 188-195
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ВЛИЯНИЯ ЦЕСТОД, ОБИТАЮЩИХ В КИШЕЧНИКАХ РАЗЛИЧНЫХ ВИДОВ РЫБ, НА АКТИВНОСТЬ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
Т. В. Фролова 1, *, Г. И. Извекова 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
Ярославская область, Некоузский район, п. Борок, Россия
* E-mail: bianka28061981@gmail.com
Поступила в редакцию 20.01.2022
После доработки 16.02.2022
Принята к публикации 18.02.2022
- EDN: SHJEBJ
- DOI: 10.31857/S0044452922030032
Аннотация
Установлено, что шесть исследованных видов цестод (Proteocephalus torulosus (Batsch, 1786), P. sagittus (Grimm, 1872), P. cernuae (Gmelin, 1790), Eubothrium rugosum (Batsch, 1786), Triaenophorus nodulosus (Pallas, 1781), Caryophyllaeus laticeps (Pallas, 1781)), обитающих в кишечниках рыб (елец Leuciscus leuciscus L., голец Barbatula barbatula L., ерш Gymnocephalus cernuus L., синец Ballerus ballerus L., налим Lota lota L., щука Esox lucius Linnaeus, лещ Abramis brama L.), изменяют активность протеолитических ферментов слизистой оболочки кишечника хозяина. Независимо от направленности влияния цестод на протеолитическую активность слизистой оболочки кишечника их хозяев (снижение или повышение этой активности при заражении) важная составляющая влияния – способность всех исследованных цестод ингибировать протеолитическую активность хозяев и активность коммерческого препарата трипсина. Для некоторых видов цестод эффект ингибирующей способности сопоставим с аналогичным влиянием синтетического ингибитора сериновых протеиназ – PMSF.
Известно, что на активность ферментов, функционирующих в пищеварительном тракте позвоночных животных, в том числе рыб, влияет большое количество абиотических и биотических факторов [1, 2]. Одним из этих факторов может быть заражение паразитами, и в частности цестодами [3]. Для понимания природы паразитизма большое значение имеет знание механизмов, с помощью которых паразиты влияют на утилизацию питательных веществ хозяевами. Паразитирующие в кишечнике гельминты менее подвержены влиянию иммунных систем хозяина, но постоянно должны противостоять действию его пищеварительных ферментов. Для выживания в кишечнике хозяина паразитическим червям необходимо наличие специфических ингибиторов протеиназ, которые способны эффективно инактивировать протеиназы хозяина в их среде обитания, полости кишечника [4]. У гельминтов есть несколько механизмов защиты от протеиназ хозяина, один из которых связан с ингибированием его протеолитических ферментов [3, 4]. Существует большое количество белковых ингибиторов протеиназ паразитарного происхождения [5]. Большинство этих веществ – ингибиторы сериновых протеиназ [6], регулирующие их активность и контролирующие разнообразные процессы, связанные с этой активностью, в том числе защиту паразита от пищеварительных ферментов хозяина и, возможно, специфичность паразитирования [7–9].
Известно, что гельминты экскретируют или секретируют различные вещества в окружающую их среду обитания – кишечник хозяев. Взаимодействие между паразитом и его хозяином в основном осуществляется посредством секретируемых белков, в совокупности называемых “секретомом”. Белки, секретируемые паразитом, способны модифицировать окружающую среду хозяина и модулировать его иммунные реакции. Состав и функция этих белков варьируют в зависимости от экологии, образа жизни хозяина и окружающей среды [10]. Ингибиторы сериновых протеаз – важный компонент секреторных продуктов паразитов [9]. Кроме контроля за активностью протеиназ, экскреторно-секреторные продукты червей играют существенную роль в уклонении от иммунного ответа хозяина [11, 12]. Они также влияют на секрецию слизи в кишечнике [13] и продукцию антимикробных пептидов, что, в свою очередь, может сказываться на выживаемости бактерий и их пространственной организации [14]. Ингибиторы протеиназ, так же, как и сами протеиназы, играют важную роль в жизненном цикле паразитов, их вирулентности и патогенезе [15].
В настоящее время достигнуты значительные успехи в изучении генома, протеома и транскриптома гельминтов [16, 17], однако многие аспекты взаимодействия хозяин – паразит остаются неясными. По мнению некоторых авторов, для лучшего понимания эволюции ленточных червей и их влияния на организм хозяина необходимы обширные исследования, посвященные этой “низко патогенной и остающейся без внимания стадии развития” [18]. Представляется важным накопление фактического материала о продуцировании ингибиторов протеиназ разными видами цестод на различных стадиях жизненного цикла из хозяев, различающихся по типу питания и уровню обмена веществ. Эти данные необходимы для поиска общих закономерностей и отличительных особенностей взаимоотношений в системе паразит–хозяин на физиолого-биохимическом уровне.
В связи с этим цель работы – сравнить влияние различных видов цестод, обитающих в кишечниках семи пресноводных видов рыб, на активность протеолитических ферментов, функционирующих в кишечнике хозяев, и активность коммерческого препарата трипсина.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования
Объектами исследований служили цестоды из кишечников различных видов рыб Рыбинского водохранилища и слизистые оболочки кишечников их хозяев. Для исследований каждого вида рыб брали особей одной и той же размерно-возрастной группы (табл. 1).
Таблица 1.
Характеристики объектов исследования
| Хозяин | Паразит | Количество зараженных рыб, экз. | Стандартная длина (SL), см | Навеска червей, г |
|---|---|---|---|---|
| Елец Leuciscus leuciscus L. | Proteocephalus torulosus (Batsch, 1786) | 6 | 15.9 ± 0.8 | 0.33 ± 0.12 |
| Голец Barbatula barbatula L. | P. sagittus (Grimm, 1872) | 28 | 8.0 ± 0.1 | 0.27 ± 0.03 |
| Ерш Gymnocephalus cernuus L. | P. cernuae (Gmelin, 1790) | 24 | 7.5 ± 0.4 | 0.12 ± 0.01 |
| Синец Ballerus ballerus L. | P. torulosus | 8 | 27.4 ± 0.7 | 0.74 ± 0.02 |
| Налим Lota lota L. | Eubothrium rugosum (Batsch, 1786) | 14 | 42.2 ± 1.1 | 0.71 ± 0.06 |
| Щука Esox lucius Linnaeus | Triaenophorus nodulosus (Pallas, 1781) | 22 | 42.8 ± 1.9 | 0.51 ± 0.06 |
| Лещ Abramis brama L. | Caryophyllaeus laticeps (Pallas, 1781) | 15 | 34.4 ± 0.8 | 1.41 ± 0.1 |
Приготовление экстрактов червей
Вскрытие извлеченных из рыб кишечников и дальнейшее приготовление препаратов осуществляли на ледяной бане. Извлеченных из кишечника хозяина цестод 3 раза тщательно промывали в растворе Рингера для холоднокровных животных, рН 7.5 (6 г NaCl; 0.14 г KCl; 0.5 мл 10% CaCl2; 0.54 г Na2HPO4; 0.02 г KH2PO4; 0.16 г MgSO4-ного раствора в 1 л дистиллированной воды) с целью удаления ферментов хозяина, адсорбированных на их поверхности. Затем червей гомогенизировали с помощью стеклянного гомогенизатора фирмы Sartorius AG (Göttingen, Germany), и гомогенат разводили раствором Рингера в соотношении масса:объем 1:9. Гомогенаты червей центрифугировали при 5000 g в течение 5 мин при 4°C, для дальнейших исследований использовали супернатант (экстракт червей). Экстракты замораживали и хранили при –20°C для последующего определения ингибирующей способности.
В экстрактах червей определяли содержание белка методом Лоури [19].
Приготовление гомогенатов из слизистых оболочек кишечников рыб
Для определения протеолитической активности готовили гомогенаты слизистой оболочки кишечника рыб-хозяев. После извлечения червей и удаления химуса слизистую оболочку кишечника снимали скребком, гомогенизировали ее и разводили раствором Рингера, рН 7.5 для холоднокровных животных в соотношении масса:объем 1:49. Гомогенаты слизистой оболочки кишечника исследуемых видов рыб замораживали до дальнейшего использования.
Определение протеолитической активности
Суммарную активность протеиназ в гомогенате слизистой оболочки кишечника рыб и активность коммерческого препарата трипсина (MP Biomedicals, USA) определяли с использованием в качестве субстрата 0.3%-ного раствора азо-казеина в трис-буфере, рН 7.5 [20]. Результаты представлены в процентах от контроля. При оценке влияния заражения на протеолитическую активность слизистой оболочки кишечников рыб контролем служила активность, определенная в слизистых оболочках кишечников незараженных рыб.
Определение ингибирующей способности червей по отношению к протеиназам
Для исследования ингибирующей способности червей использовали их экстракт. Источником протеолитической активности служили гомогенат слизистой оболочки кишечника рыб и коммерческий препарат трипсина (T4799, Sigma) в концентрации 0.01 мг/мл в трис-буфере (рН 7.5). Ингибирующую способность червей определяли как описано ранее [21] и сравнивали ее с действием синтетического специфического ингибитора сериновых протеиназ PMSF (фенил-метил-сульфонил-флуорид) – в концентрации 100 мМ в DMSO (диметилсульфоксид). Результаты представлены в процентах от контроля. Контролем служила протеолитическая активность, определенная в слизистых оболочках кишечников незараженных рыб, и активность коммерческого трипсина.
Все биохимические измерения проводили в трех повторностях.
Статистическая обработка
Результаты представлены в виде средних и их стандартных ошибок. Обработка результатов выполнена с помощью статистических пакетов “Microsoft Excel 2010” и STATISTICA 8 (StatSoft Inc., Tulsa, OK). Проверка нормальности распределения данных и однородности дисперсии проводилась с использованием критериев Шапиро–Уилка и Левена соответственно. Ингибиторный эффект оценивали при помощи однофакторного дисперсионного анализа с использованием критерия Тьюки для множественного сравнения средних значений при p < 0.05. Для оценки связи между содержанием белка в пробах и их способностью подавлять активность протеиназ использовали непараметрический коэффициент корреляции Спирмена (r).
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по биоэтике Федерального государственного бюджетного учреждения науки Института биологии внутренних вод им. И.Д. Папанина Российской академии наук (Протокол № 4 от 02.04.2021 г.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
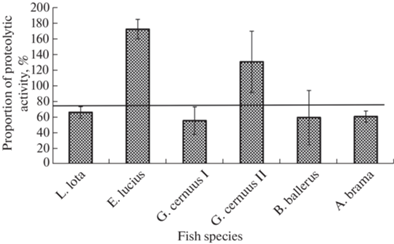
Сравнение влияния различных видов цестод на протеолитическую активность слизистой оболочки кишечников их хозяев показало, что у налима, синца, леща и ерша, зараженных мелкими червями, эта активность снижается на 34–61%, а у щуки и ерша, зараженных крупными цестодами, – повышается на 31–73% (рис. 1).
Рис. 1.
Влияние заражения цестодами на протеолитическую активность слизистой оболочки кишечника хозяев–рыб (%). 100% – протеолитическая активность незараженных рыб; G. cernuus I – ерши, зараженные цестодами с малой суммарной длиной, G. cernuus II – ерши, зараженные цестодами с большой суммарной длиной.
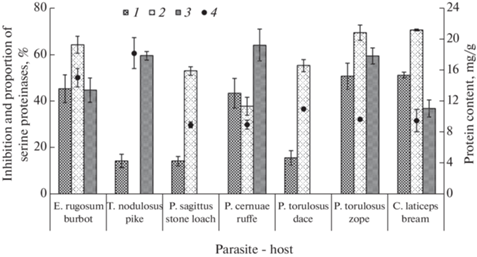
На рис. 2 приведены данные о процентном ингибировании экстрактами цестод протеолитической активности слизистых оболочек кишечника хозяев – рыб, и доле сериновых протеиназ в этой активности. Доля последних колеблется в зависимости от вида рыб от 36.9 ± 3.7 до 64.1 ± 6.8%. Экстракты всех исследованных цестод ингибируют активность протеолитических ферментов слизистой оболочки кишечника их хозяев. Степень ингибирования варьирует от 14.3 ± 1.9 до 51.2 ± 1.2% в зависимости от пары паразит–хозяин. Для сравнения приведены показатели ингибирования протеолитической активности слизистых оболочек ингибитором сериновых протеиназ – PMSF. Эти значения изменяются на величину от 37.8 ± 3.8 до 70.6 ± 0.4% в зависимости от вида рыб, свидетельствуя о существенной роли сериновых протеиназ в пищеварении последних. Установлены слабые отрицательные корреляции между долей сериновых протеиназ в слизистой оболочке кишечников рыб и долей ингибирования этой активности экстрактами цестод, а также долей ингибирования протеолитической активности слизистой оболочки экстрактами цестод и содержанием в этих экстрактах белка (r = –0.4 для первого и r = –0.3 для второго).
Рис. 2.
Доля ингибирования экстрактами цестод протеолитической активности слизистых оболочек хозяев–рыб, доля сериновых протеиназ в протеолитической активности слизистых оболочек кишечника хозяев–рыб и содержание белка в экстрактах червей. 1 – слизистая оболочка; 2 – PMSF; 3 – доля сериновых протеиназ в кишечнике рыб; 4 – содержание белка.
Экстракты всех исследованных видов цестод достоверно ингибировали активность коммерческого трипсина (p < 0.05), причем степень ингибирования этой активности у разных видов червей различается и колеблется от 19.6 ± 7.5 до 86.5 ± 4.5% (рис. 3). При этом доля ингибирования активности трипсина у большинства экстрактов исследованных цестод выше, чем таковая для слизистых оболочек кишечников их хозяев. Установлена достаточно сильная (r = 0.68) положительная корреляция между способностью экстрактов цестод ингибировать активность трипсина и содержанием в них белка. Для цестод Eubothrium rugosum и Triaenophorus nodulosus доля ингибирования активности трипсина сопоставима с таковой для специфического ингибитора сериновых протеиназ – PMSF (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
За последнее время нами накоплен довольно большой фактический материал о влиянии цестод на протеолитическую активность их окончательных хозяев – рыб, в том числе о способности гельминтов ингибировать эту активность [3, 21, 22]. При этом сравнение между собой абсолютных значений ингибирования протеиназ различными видами гельминтов в силу разных причин оказалось затруднительным. Так, хозяева изученных цестод различаются по своим физиологическим характеристикам, в частности по размеру и спектрам питания. Кроме того, в зависимости от цикла развития цестод различались сезоны отлова рыб. Например, налима и ерша отлавливали зимой, щуку – весной, остальных рыб – летом. Все эти факторы в значительной степени сказываются на активности пищеварительных ферментов, в том числе протеиназ [1, 2]. Исследованные цестоды также существенно различаются по своей морфологии и физиологии. Однако, учитывая, что ингибиторы протеиназ имеют белковое происхождение [5], в физиологических исследованиях можно до некоторой степени “уравновесить” эти различия, определяя содержание белка в экстрактах червей.
Мы попытались сравнить относительные эффекты влияния заражения червями, выраженные в процентах от контрольных значений протеолитической активности слизистой оболочки кишечников хозяев. Полученные данные свидетельствуют о том, что заражение цестодами влияет на протеолитическую активность слизистых оболочек кишечников окончательных хозяев – рыб. Однако это влияние у одних хозяев вызывает снижение протеолитической активности, а у других – ее повышение. Направление изменений зависит от различных факторов. Следует отметить, что значительная доля в протеолитической активности слизистых оболочек кишечников всех исследованных видов рыб приходится на сериновые протеиназы. Кроме того, ранее было установлено, что при заражении рыб цестодами изменяется спектр протеиназ, функционирующих в слизистой оболочке кишечника хозяина. В частности, уменьшается доля сериновых протеиназ [3, 22].
Снижение активности исследованных ферментов у зараженных цестодами рыб (налима, синца, леща и ерша, зараженного мелкими червями) может быть обусловлено несколькими причинами. Во-первых, снижение активности может происходить вследствие адсорбции части ферментов на тегументе цестод. Во-вторых, уменьшение активности протеолитических ферментов у зараженных рыб может быть связано с частичным их ингибированием на поверхности цестод, что рассматривается как один из механизмов защиты гельминтов от воздействия протеиназ хозяев [3].
Повышение активности протеолитических ферментов слизистой оболочки кишечника рыб при заражении цестодами в случае щуки и T. nodulosus, по всей видимости, связано с особенностями строения прикрепительного аппарата цестод [23]. Известно, что от строения прикрепительных образований червей зависит уровень патологических изменений в тканях кишечника [24]. В отличие от других исследованных нами видов гельминтов, цестоды T. nodulosus вооружены различными по размеру и количеству крючьями, которые могут вызывать повреждения слизистой оболочки кишечника и выход внутриклеточных протеиназ в просвет кишечника. Неслучайно при хронической инфекции T. nodulosus в слизистой оболочке кишечника щуки наблюдаются существенные структурные перестройки [25].
Как установлено ранее [22], в зависимости от своего размера цестоды Proteocephalus cernuae из кишечника ерша по-разному влияют на протеолитическую активность слизистой оболочки кишечника хозяина. В частности, при паразитировании крупных P. cernuae в кишечнике такой мелкой рыбы, как ерш, активность протеиназ хозяев повышается, что, вероятно, происходит в ответ на высокую паразитарную нагрузку, при которой включаются адаптационные механизмы хозяина и повышается активность его пищеварительных ферментов [22]. Это согласуется с высказанным ранее предположением о том, что зараженные хозяева компенсируют негативное воздействие кишечных паразитов увеличением пищевой активности [26], что, в свою очередь, сказывается на активности пищеварительных ферментов.
Тот факт, что экстракты цестод значительно эффективнее ингибируют активность трипсина, чем активность протеиназ, функционирующих в слизистых оболочках кишечника хозяина, свидетельствует о большей специфичности ингибиторов червей по отношению к трипсину. Довольно сильная положительная корреляция между способностью экстрактов цестод ингибировать активность трипсина и содержанием в этих экстрактах белка вполне объяснима, поскольку известно, что большинство ингибиторов протеиназ имеют белковую природу [5]. В то же время известно, что ингибиторы сериновых протеаз – один из ключевых компонентов секреторных продуктов паразитов. Они играют важную роль в выживании паразита за счет своей способности ингибировать ферменты хозяина и в норме присутствуют в микроокружении и/или секретируются иммунными эффекторными клетками [8]. Эти ингибиторы регулируют активность протеаз и контролируют разнообразные процессы, связанные с их активностью, а также играют существенную роль в защите паразита от пищеварительных ферментов хозяина и вносят вклад в специфичность паразитирования [7, 27]. Ингибиторы протеиназ – важный природный инструмент регуляции протеолитической активности, предотвращающий нежелательный гидролиз белков. Кроме того, большинство известных и охарактеризованных белковых ингибиторов относятся к группе ингибиторов сериновых протеиназ, к которым принадлежит трипсин [6].
В связи с вышесказанным мы предположили, что чем выше доля сериновых протеиназ в протеолитической активности слизистых оболочек кишечника, тем выше должна быть и доля ингибирования этой активности экстрактами цестод. Однако данное предположение не нашло подтверждения, что свидетельствует об отсутствии существенной связи между этими показателями и их влияния на взаимоотношения между паразитами и хозяевами–рыбами. Протеолитическая активность представлена в кишечнике активностью не только сериновых протеиназ, но и других протеиназ (цистеиновых, металлопротеиназ и прочих) [3]. Возможно, поэтому не удалось установить существенной связи между долей ингибирования активности коммерческого трипсина и долей ингибирования протеолитической активности слизистой оболочки кишечника хозяев.
Несмотря на существующие значительные различия в физиологических особенностях хозяев-рыб и паразитирующих в их кишечниках цестод найдено объединяющее этих червей свойство – присутствие в их экстрактах компонента, способного в значительной степени ингибировать активность протеолитических ферментов в кишечнике их хозяев. Это подтверждает высказанные ранее предположения о том, что эту способность можно рассматривать как один из механизмов защиты гельминтов от воздействия протеиназ хозяина [3]. В дальнейшем необходимо направить усилия на выделение и идентификацию компонентов, ответственных за ингибирующую способность цестод. Некоторые шаги в этом направлении уже предприняты [28].
Таким образом, паразитирование цестод в пищеварительном тракте рыб изменяет активность протеолитических ферментов слизистой оболочки кишечника. Независимо от направленности влияния цестод на протеолитическую активность слизистой оболочки (снижение или повышение этой активности при заражении) важную составляющую этого влияния представляет способность всех исследованных цестод ингибировать протеолитическую активность хозяев и активность коммерческого препарата трипсина. При этом эффект ингибирующей способности для некоторых видов цестод сопоставим по своей эффективности с синтетическим ингибитором сериновых протеиназ – PMSF, свидетельствуя о важности этого защитного механизма в жизнедеятельности червей.
Список литературы
Уголев АМ, Кузьмина ВВ (1993) Пищеварительные процессы и адаптации у рыб. С-П.: Гидрометеоиздат. 238 с. [Ugolev AM, Kuz’mina VV (1993) Digestive processes and adaptations in fish. S-P: Hydrometeoisdate. 238 p. (In Russ)].
Solovyev MM, Kashinskaya EN, Rogozhin EA, Moyano FJ (2021) Seasonal changes in kinetic parameters of trypsin in gastric and agastric fish. Fish Physiol Biochem 47: 381–391. https://doi.org/10.1007/s10695-020-00919-0
Izvekova GI, Solovyev MM (2016) Characteristics of the Effect of Cestodes Parasitizing the Fish Intestine on the Activity of the Host Proteinases. Biol Bulletin 43 (2): 146–151. https://doi.org/10.1134/S1062359016010076
Hawley JH, Peanasky AJ (1992) Ascaris suum: are trypsin inhibitors involved in species specificity of ascarid nematodes? Exp Parasitol 75 (1): 112–118. https://doi.org/10.1016/0014-4894(92)90126-U
Rawlings ND, Tolle DP, Barrett AJ (2004) Evolutionary families of peptidase inhibitors. Biochem J 378:705–716. https://doi.org/10.1042/BJ20031825
Molehin AJ, Gobert GN, McManus DP (2012) Serine protease inhibitors of parasitic helminthes. Parasitology 139 (6): 681–695. https://doi.org/10.1017/S0031182011002435
Morris SR, Sakanari JA (1994) Characterization of the serine protease and serine protease inhibitor from the tissue-penetrating nematode Anisakis simplex. J Biologic Chem 269 (44): 27650–27656.
Zang X, Maizels RM (2001) Serine proteinase inhibitors from nematodes and the arms race between host and pathogen. TRENDS Biochem Sci 26 (3): 191–197. https://doi.org/10.1016/S0968-0004(00)01761-8
Zhang Y, Guo J, He L, Zong H-Y, Cai G-B (2018) Isolation and characterization of a novel serine protease inhibitor, SjSPI, from Schistosoma japonicum. Parasitol Int 67: 415–424. https://doi.org/10.1016/j.parint.2018.04.002
Cuesta-Astroz Y, de Oliveira F, Nahum LA, Oliveira G (2017) Helminth secretomes reflect different lifestyles and parasitized hosts. Int J Parasitol 47: 529–544. https://doi.org/10.1016/j.ijpara.2017.01.007
Ranganathan S, Garg G (2009) Secretome: clues into pathogen infection and clinical applications. Genome Medicine 1: 113. https://doi.org/10.1186/gm113
Dezfuli BS, Bosi G, DePasquale JA, Manera M, Giari L (2016) Fish innate immunity against intestinal helminthes. Fish & Shellfish Immunol 50: 274–287. https://doi.org/10.1016/j.fsi.2016.02.002
Bosi G, Shinn AP, Giari L, Dezfuli BS (2015) Enteric neuromodulators and mucus discharge in a fish infected with the intestinal helminth Pomphorhynchus laevis. Parasites & Vectors 8: 359. https://doi.org/10.1186/s13071-015-0970-7
Dezfuli BS, Lui A, Giari L, Pironi F, Manera M, Lorenzoni M, Noga EJ (2013) Piscidins in the intestine of European perch, Perca fluviatilis, naturally infected with an enteric worm. Fish & Shellfish Immunol 35: 1539–1546. https://doi.org/10.1016/j.fsi.2013.08.023
Rascón Jr, McKerrow JH (2013) Synthetic and natural protease inhibitors provide insights into parasite development, virulence and pathogenesis. Curr Med Chem 20: 3078–3102. https://doi.org/10.1007/s00436-018-6169-z
Kochneva A, Drozdova P, Borvinskaya E (2020) The first transcriptomic resource for the flatworm Triaenophorus nodulosus (Cestoda: Bothriocephalidea), a common parasite of holarctic freshwater fish. Marine Genomics 51: 100702.https://doi.org/10.1016/j.margen.2019.100702
Xu J, Wu L, Sun Y, Wei Y, Zheng L, Zhang J, Pang Z, Yang Y, Lu Y (2020) Proteomics and bioinformatics analysis of Fasciola hepatica somatic proteome in different growth phases. Parasitol Res 119: 2837–2850. https://doi.org/10.1007/s00436-020-06833-x
Bień J, Sałamatin R, Sulima A, Savijoki K, Conn DB, Näreaho A, Młocicki D (2016) Mass spectrometry analysis of the excretory-secretory (E-S) products of the model cestode Hymenolepis diminuta reveals their immunogenic properties and the presence of new E-S proteins in cestodes. Acta Parasitol 61 (2): 429–442. https://doi.org/10.1515/ap-2016-0058
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ (1951) Protein measurement with the Folin phenol reagent. J Biol Chem 193: 265–275.
Alarcón FJ, Martínez TF, Barranco P, Cabello T, Díaz M, Moyano FJ (2002) Digestive proteases during development of larvae of red palm weevil, Rhynchophorus errugineus (Olivier, 1790) (Coleoptera: Curculionidae). Insect Biochem Mol Biol 32: 265–274. https://doi.org/10.1016/S0965-1748(01)00087-X
Izvekova GI, Frolova TV, Izvekov EI (2017) Inactivation of proteolytic enzymes by Eubothrium rugosum (Batsch, 1786) (Cestoda) from the gut of burbot Lota lota (Linnaeus). Folia Parasitol 64: 016. https://doi.org/10.14411/fp.2017.016
Izvekova GI, Frolova TV, Zhokhov AE (2018) Proteinase Activity in the Intestine of Ruff Gymnocephalus cernuus (L.) (Pisces) Depending on the Sum Length of Cestodes Proteocephalus cernuae (Gmelin) Parasitizing the Gut. Inland Water Biology 11 (1): 87–91. https://doi.org/10.1134/S1995082918010066
Извекова ГИ, Куклина ММ (2014) Заражение цестодами и активность пищеварительных гидролаз позвоночных хозяев. Успехи современной биологии 134(3): 304–315. [Izvekova GI, Kuklina MM (2014) Infection with cestodes and the activity of digestive hydrolases of vertebrate hosts. Successes of modern biology 134 (3): 304–315. (In Russ)].
Richards KS, Arme C (1981) The ultrastructure of the scolex-neck syncytium, neck cells and frontal gland cells of Caryophyllaeus laticeps (Caryophyllidea: Cestoda). J Parasitol 83: 477–487.
Давыдов ВГ (1986) Сравнительное изучение реакции тканей кишечника рыб при разных способах прикрепления ленточных червей. Биология и экология водных организмов. Л. Наука. [Davydov VG (1986) Comparative study of the reaction of fish intestinal tissues in various methods of attaching tapeworms. Biology and ecology of aquatic organisms. L. Science. (In Russ)].
Bosi G, Shinn AP, Giari L, Simoni E, Pironi F, Dezfuli BS (2005) Changes in the neuromodulators of the diffuse endocrine system of the alimentary canal of farmed rainbow trout, Oncorhynchus mykiss (Walbaum), naturally infected with Eubothrium crassum (Cestoda). J Fish Dis 28: 703–711. https://doi.org/10.1111/j.1365-2761.2005.00674.x
Huang SY, Yue DM, Hou JL et al. (2019) Proteomic analysis of Fasciola gigantica excretory and secretory products (FgESPs) interacting with buffalo serum of different infection periods by shotgun LC-MS/MS. Parasitol Res 118: 453–460. https://doi.org/10.1007/s00436-018-6169-z
Rogozhin E, Solovyev M, Frolova T, Izvekova G (2019) Isolation and partial structural characterization of new Kunitz-type trypsin inhibitors from the pike cestode Triaenophorus nodulosus. Molec & Biochem Parasitol 233 (111217): 1–4. https://doi.org/10.1016/j.molbiopara.2019.111217
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии



