Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 291-297
СЕНСОРНЫЙ ГЕЙТИНГ У МЫШЕЙ НОКАУТНЫХ ПО ГЕНУ РЕЦЕПТОРА СЛЕДОВЫХ АМИНОВ ПЕРВОГО ТИПА (TAAR1)
А. А. Александров 1, Е. С. Дмитриева 1, *, В. М. Князева 1, Ю. А. Симон 1, Н. В. Полякова 1, Л. Н. Станкевич 1, А. Ю. Александров 1
1 Кафедра ВНД и психофизиологии Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: e.s.dmitrieva@spbu.ru
Поступила в редакцию 29.03.2022
После доработки 26.04.2022
Принята к публикации 04.05.2022
- EDN: HIEHJZ
- DOI: 10.31857/S0044452922040027
Аннотация
Следовые амины (СА) представляют собой семейство эндогенных соединений, присутствующих в центральной нервной системе животных в крайне низких концентрациях и структурно схожих с классическими биогенными аминами. В настоящее время идентифицировано семейство так называемых рецепторов следовых аминов (TAARs), функциональное значение которых во многом неясно. Целью данного исследования явилось изучение слуховых вызванных потенциалов (ВП) и определение показателей сенсорного гейтинга (СГ) у мышей нокаутных по гену рецептора ТААR1 (KO TAAR1) в хроническом эксперименте. В результате было обнаружено значительное снижение амплитуды компонента N40 в слуховых ВП у мышей KO TAAR1 по сравнению с мышами дикого типа. Абсолютный показатель СГ также был значительно меньше у мышей KO TAAR1, чем показатель СГ у мышей дикого типа, при этом относительный показатель СГ оставался неизменным. Таким образом, полученные данные показывают, что выключение рецепторов TAAR1 заметно сказывается на генерации слуховых ВП, что говорит о потенциально возможном вовлечении системы следовых аминов в процесс дозирования и фильтрации сенсорной информации.
Следовые амины (СА) представляют собой семейство эндогенных соединений, структурно сходных с классическими биогенными аминами; следовые амины обнаруживаются в тканях млекопитающих в наномолярных концентрациях и могут рассматриваться в качестве потенциальных нейромодуляторов [1, 2]. В частности, было показано влияние СА на дофаминергическую [3, 4], серотонинергическую [3] и глутаматергическую передачу [5, 6].
Наиболее изученным членом семейства рецепторов TAAR (trace amines associated receptors (TAARs)) является TAAR1 рецептор, который обнаруживается в центральной нервной системе и в периферических тканях [7]. TAAR1 рецептор в основном экспрессируется в наиболее значимой концентрации: в месте наибольшей плотности дофаминергических нейронов, а именно в области вентральной покрышки (VTA) и черной субстанции (SNc), в ядре дорсального шва (DRN), где наиболее представлены серотонинергические нейроны, а также в гиппокампе и амигдале [8]. Кроме того, экспрессия TAAR1 рецептора была обнаружена преимущественно в пирамидных нейронах V слоя коры [5], подтверждая более ранние свидетельства присутствия мРНК TAAR1 рецептора во фронтальных отделах головного мозга мыши [9]. Рецепторы TAAR1 отвечают на воздействие ряда СА, таких как: β-фенилэтиламин, р-тирамин и октопамин (β-phenylethylamine, p-tyramine и octopamine).
На животных моделях [10] и в доклинических исследованиях [11] было продемонстрировано, что агонисты TAAR1 рецептора оказывают прокогнитивную [7], антипсихотическую и антидепрессивную активность [7], что позволяет рассматривать TAAR1 в качестве терапевтической мишени для лечения психических расстройств [2, 12].
В экспериментах in vivo было показано, что применение агонистов ТААR1 рецептора снижает гиперлокомоцию в фармакологических тестах с использованием кокаина и на нокаутных по транспортеру дофамина моделях гипердофаминергии, а также снижает частоту генерации потенциала действия в дофаминергических нейронах [3, 7]. Были получены доказательства гипочувствительности к амфетамину и базальной гиперактивности моноаминергических ядер на модели нокаутных мышей сверхэкспрессирующих TAAR1 в головном мозге [13]. Кроме того, избирательная активация TAAR1 рецептора как парциальными, так и полными агонистами снижала импульсивное поведение у мышей линии C57Bl/6J и у мышей нокаутов по NMDA рецептору [3, 5, 7, 13].
Несмотря на то, что функциональная значимость СА остается до конца не выясненной, было показано, что изменение их концентрации и/или нарушение функции рецепторов СА могут быть вовлечены в ряд нейропсихиатрических расстройств, связанных с моноаминергической дисфункцией, включая шизофрению, рекуррентное депрессивное расстройство, болезнь Паркинсона, синдром дефицита внимания и гиперактивности [2, 14]. Показано, что мыши, нокауты по TAAR1 рецептору, имеют сходные изменения поведения с наблюдаемыми при шизофрении: возрастание локомоторной активности при применении амфетамина и снижение стереотипных реакций, вызванных апоморфином [4], повышение плотности дофаминовых D2 рецепторов в полосатом теле [15], а также дефицит преимпульсного торможения стартл-реакции [16]. Мыши, нокауты по TAAR1 рецептору, демонстрируют нарушение регуляции синаптической функции, опосредованной NMDA рецептором в префронтальной коре, что выражалось в стереотипном и импульсивном поведении [5].
Сенсорный гейтинг (СГ) наряду с негативностью рассогласования (MMN) и преимпульсным торможением (PPI) является признанным нейрофизиологическим маркером шизофрении [17]. Сенсорный гейтинг (от англ. gate – ворота) – это процесс дозирования и фильтрации информации, поступающей из окружающей среды, при помощи которого мозг регулирует величину ответов на сенсорные стимулы [18]. СГ входит в группу процессов, предшествующих вниманию, которые осуществляют обработку сенсорной информации посредством соотнесения и/или отбора сенсорных стимулов, не вовлекая механизмы осознанного внимания [19]. Показано, что СГ нарушается при различных психоневрологических патологиях, включая шизофрению, биполярное расстройство, посттравматическое стрессовое расстройство и т.д. [18, 20–22]. Стандартная экспериментальная парадигма изучения СГ включает в себя предъявление последовательности одинаковых коротких звуковых стимулов, которые сгруппированы в пары с фиксированным межстимульным интервалом внутри пары стимулов и большим интервалом между парами стимулов [23]. После регистрации слуховых вызванных потенциалов анализируется амплитуда компонента P50 в исследованиях, проводимых на людях, и компонент N40 в исследованиях на грызунах. Сенсорный гейтинг проявляется в подавлении компонента вызванного потенциала P50/ N40 в ответе на второй стимул в паре.
Ранее было показано [24], что агонист TAAR1 рецептора (RO 5263397) в дозировке 1 мг/кг способствует улучшению сенсорного гейтинга. Улучшение показателя сенсорного гейтинга происходило за счет увеличения амплитуды компонента N40 в ответ на первый стимул в паре (C1), по сравнению с ответом на второй стимул в паре (С2).
Поскольку агонисты TAAR1 рецептора оказывают весомое влияние на параметры сенсорного гейтинга, было принято решение изучить изменение сенсорного гейтинга у мышей нокаутных по гену рецептора ТААR1.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовка животных
Исследование проводилось на 3–5-месячных самцах мышей нокаутных (knockout, KO) по гену рецептора TAAR1 (n = 11), в качестве контроля использовались самцы дикого типа WT (n = 11), которые были получены при выведении нокаутных животных, средняя масса животных составилa 28–30 г. Исходными линиями для получения мышей KO TAAR1 являлись 129S1/Sv и C57BL/6. Животные были получены из вивария Института трансляционной биомедицины (Санкт-Петербургский государственный университет, Санкт-Петербург, Россия). Все животные содержались в стандартных условиях при доступе к пище и воде ad libitum, в помещении поддерживался 12‑часовой цикл свет–темнота. Животные размещались в одиночных боксах (30 × 15 × 17 см). До начала проведения всех манипуляций с животными акклиматизация составляла 7 дней. Все опыты проводили в соответствии с международными нормами по проведению медико-биологических исследований с использованием животных (European Convention for the Protection of Vertebrate Animals Used for Experimentation and other Scientific Purposes, 1986). Протокол эксперимента был одобрен Этическим комитетом биологического факультета СПбГУ.
Операция
В качестве наркоза использовались Золетил (70 мг/кг в/м) и Ксилазин (0.2 мг/кг в/м). Регистрирующие электроды располагались билатерально симметрично (–6 mm posterior, 3.5 mm lateral to the bregma); референтный электрод размещался в левом полушарии (–2.5 mm posterior, 3.5 mm lateral to the bregma); заземляющий электрод размещался в правом полушарии (–2.5 mm posterior, 3.5 mm lateral to the bregma); электроды фиксировались в костях черепа с помощью стоматологического пластика холодной полимеризации Акродент (АТ Стома, Украина). Операционное поле обрабатывалось Baneocin ® порошком. Внутримышечные инъекции Bicillin-5 (benzathine benzylpenicillin 100 мг/кг в/м) делались по окончании операции для профилактики инфекционных осложнений. Регистрация ЭЭГ и ВП проводились не ранее 5 дней после операции.
Процедура эксперимента
Эксперимент проводился на хронических животных в условиях свободного поведения. Животные размещались в экспериментальных боксах из плексигласа (30 × 15 × 17 см). В ходе эксперимента предъявлялись пары звуковых стимулов, длительностью 10 мс, частота заполнения 3000 Гц, интенсивность 85 дБ. Интервал между стимулами в паре был фиксирован и составлял 300 мс. Всего предъявлялось 100 пар стимулов, интервал между парами варьировал случайным образом в пределах 3–5 с. Звуки генерировались и предъявлялись через звуковые колонки, расположенные возле боксов при помощи программы Psytask v.2.4 software (Mitsar Inc.).
Запись электроэнцефалограммы (ЭЭГ) для регистрации и построения ВП проводилась на цифровом электроэнцефалографе Mitsar-EEG-05/70–201 (Mitsar Inc., St. Petersburg, Russia) при помощи программы WINEEG v.2.4 software (Mitsar Inc.). Обработка данных ЭЭГ для выделения и построения ВП, полученных в ходе эксперимента, включала удаление артефактов, связанных с грумингом (частота 100–200 Гц; амплитуда, превышающая ±500 мкВ на любом из каналов) [25]. ЭЭГ сигнал был отфильтрован в полосе 10–100 Гц. Такая фильтрация рекомендована для наилучшего выявления компонента P50/N40 на фоне более высокоамплитудных волн [26]. После выделения и построения ВП подсчитывали амплитуду компонента N40, который в слуховых ВП грызунов является аналогом компонента P50, традиционно используемого для изучения СГ у людей [27]. Амплитуда компонента N40 измерялась как среднее значение амплитуды ВП на отрезке 20–40 мс от начала предъявления стимула. Параметры сенсорного гейтинга определялись при анализе соотношения амплитуд компонента N40 в ВП в ответах на первый и второй стимулы в паре. Показатель сенсорного гейтинга высчитывался двумя способами: абсолютный показатель СГ – определялся путем вычитания амплитуды компонента N40, полученного на второй стимул (С2) в паре из амплитуды компонента N40 полученного на первый стимул в паре (С1), и относительный показатель СГ – полученный методом деления амплитуды компонента N40 полученного в ответ на С2 на амплитуду компонента N40 полученного в ответ на С1 [28].
Статистический анализ
Все данные имели нормальное распределение согласно критерию Колмогорова–Смирнова. Статистическая оценка групповых ВП производилась с помощью методов дисперсионного анализа ANOVA по схеме повторных измерений с использованием программы IBM SPSS Statistic v. 21 (IBM Corporation, Нью-Йорк, США). Для общего анализа изменения амплитуд ответов на C1 и C2 был использован 2-факторный анализ с внутригрупповыми факторами: “группа” (WT и KO TAAR1) и “стимул” (C1 и C2). Если в результате анализа обнаруживалось значимое влияние фактора или взаимодействие факторов, то проводился апостериорный анализ с помощью парного t-теста Стьюдента.
РЕЗУЛЬТАТЫ
Полученные в результате исследования данные показывают, что амплитуда компонента N40 в ответ и на первый (C1), и на второй стимул в паре (C2) значительно меньше у мышей нокаутных по гену TAAR1. На рисунке 1 представлены слуховые ВП для мышей нокаутных по гену TAAR1, в сравнении с мышами дикого типа (контрольной группы). На рисунке 2 представлены результаты подсчета амплитуды компонента N40 слуховых ВП для обеих групп мышей. Показатели амплитуды компонента N40 рассчитывались как среднее значение амплитуды ВП на промежутке 20-40 мс от начала предъявления стимула, (амплитуда компонента представлена по модулю). Двухфакторный дисперсионный анализ (фактор 1: группа (TAAR1_KO и WT), фактор 2: стимул (C1 и C2)) показал достоверное отличие обоих факторов. Фактор “группа” (TAAR1_KO и WT) F(1, 10) = 11.28, р = 0.007. Фактор “стимул” (C1 и C2) F(1, 10) = 21.02, р < 0.001. Также было выявлено достоверное взаимодействие факторов “группа” (TAAR1_KO и WT) и “стимул” (C1 и C2) F(1, 10) = 7.28, р = 0.02. В связи с выявлением достоверного взаимодействия факторов было проведено попарное сравнение показателей амплитуды N40, полученных в ответ на первый (C1) и второй (C2) стимул в паре. Данное сравнение показало значимое отличие амплитуды компонента N40, полученного в ответ на первый стимул в паре (C1), у нокаутных животных и животных дикого типа (р = 0.009) и значимое отличие амплитуды компонента N40, полученного в ответ на второй стимул в паре (C2), у нокаутных животных и животных дикого типа (р = 0.02).
Рис. 1.
Слуховые ВП возникающие при предъявлении пар стимулов.
По горизонтальной оси представлено время в мс, по вертикальной оси амплитуда в мкВ. Серая линия – ВП для группы мышей нокаутных по гену TAAR1, черная линия указывает на ВП для группы мышей дикого типа. Пунктирная линия – момент предъявления стимула. S1 и S2 – первый и второй стимул в паре соответственно.

Результаты подсчета показателей СГ показаны на рис. 3. Абсолютный показатель СГ, который определялся путём вычитания амплитуды компонента N40, полученного на второй стимул (С2) в паре из амплитуды компонента N40, полученного на первый стимул в паре (С1), достоверно снижался у мышей нокаутных по TAAR1 – F (1, 10) = 7.3, р = 0.02. Относительный показатель СГ, подсчитанный путем деления амплитуды компонента N40 в ответ на С2 на амплитуду компонента N40 полученного в ответ на С1, достоверно не отличался между изученными группами животных F (1, 10) = = 0.08, р = 0.78.
Рис. 2.
Амплитуда компонента N40 слухового ВП полученного в ответ на первый (S1) и второй (S2) стимулы.
По горизонтальной оси – показатели в ответ на первый (S1) и на второй (S2) стимулы в паре, по вертикальной оси – усредненные значения амплитуды компонента N40 в мкВ. Черные столбики (± SEM) – показатели мышей дикого типа, серые столбики (± SEM) – показатели мышей KoTAAR1. * – Различия достоверны р ≤ 0.05.

Рис. 3.
Показатели сенсорного гейтинга.
а — абсолютное значение СГ (SG), посчитанное методом вычитания амплитуды компонента N40, полученного на второй стимул из амплитуды компонента N40 на первый стимул в паре (S1–S2); по вертикальной оси – значение разности амплитуд, компонента N40 в мкВ; b – коэффициент СГ, относительный показатель подавления величины компонента N40 в ответ на предъявление второго (S2) стимула в паре (S2/S1); серые столбики (± SEM) – показатель СГ у мышей KO TAAR1, чёрные столбики (± SEM) – показатель СГ у мышей дикого типа.
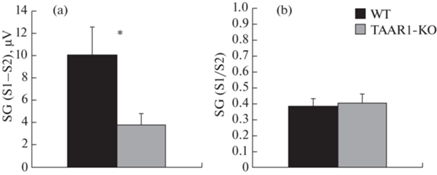
Обнаружено значительное снижение амплитуды компонента N40 у мышей KO TAAR1 по сравнению с мышами дикого типа. Кроме того, абсолютное значение СГ, посчитанное методом (С1–С2), также было снижено, однако относительный показатель СГ, посчитанный методом (С1/С2), оставался неизменным.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты настоящего исследования продемонстрировали значительное ослабление компонента N40 слухового ВП у мышей нокаутных по гену TAAR1 по сравнению с мышами дикого типа. Наблюдается снижение амплитуды N40 в ответ как на первый (С1), так и на второй (С2) стимул в паре. Это приводит к снижению абсолютных значений сенсорного гейтинга в группе мышей нокаутных по гену TAAR1. Однако коэффициент сенсорного гейтинга, показывающий относительную величину подавления ответа на второй стимул, остается неизменным.
Ранее было показано, что введение агониста TAAR1 рецептора значительно улучшает индекс сенсорного гейтинга [24]. Причем увеличение индекса СГ происходило за счет увеличения амплитуды компонента слухового ВП N40 в ответ на первый стимул в паре (С1). Таким образом получается, что стимуляция TAAR1 приводит к увеличению амплитуды компонента N40, тогда как отсутствие рецепторов TAAR1 сопровождается значительным снижением компонента N40 в слуховых ВП.
Сенсорный гейтинг наряду с негативностью рассогласования (MMN) и преимпульсным торможением (PPI) является признанным нейрофизиологическим маркером шизофрении [17]. Сенсорный гейтинг по компоненту N40 у мышей рассматривается в качестве аналога сенсорного гейтинга компонента Р50 у людей. Весьма интересно, что по данным ряда авторов ухудшение сенсорного гейтинга компонента Р50 при шизофрении в основном связано со снижением амплитуды ответа на первый стимул в паре [18]. Наши данные указывают на возможное вовлечение системы TAAR1 рецепторов при патологических изменениях сенсорного гейтинга при шизофрении. Следует отметить, что при этом данные по сенсорному гейтингу далеко не однородны. Наряду с этим имеются сведения об отсутствии зависимости коэффициента СГ от амплитуды первого стимула в паре (С1) [29], а классические экспериментальные работы Freedman и соавт. [23, 30, 31] связывали низкий коэффициент сенсорного гейтинга со слабой способностью к подавлению второго стимула в паре (С2).
Подавление ответа на второй стимул, с одной стороны, предположительно связывается с тормозными механизмами, лежащими в основе сенсорного гейтинга. В то же время снижение амплитуды может быть обусловлено увеличением рефрактерности нейрональных популяций, генерирующих соответствующие компоненты ВП. Поскольку в данной работе обнаружено заметное снижение электрогенеза компонента N40, окончательный вывод о природе изменения собственно сенсорного гейтинга при устранении рецепторов TAAR1 пока делать преждевременно.
Целый ряд исследований показывает, что функциональная роль TAAR1 может быть связана с модуляцией дофаминергической, серотонинергической и глутаматергической систем [3–5, 32]. Мыши нокаутные по гену, кодирующему TAAR1, показывают увеличение активности дофаминергических нейронов в вентральной области покрышки [4], повышенную чувствительность D2 рецепторов в стриатуме [33], увеличение частоты спонтанной активности нейронов дорсального ядра шва [3], а также сниженную функциональную активность рецептора N-метил-D-аспартата (NMDA) в префронтальной коре и стриатуме [5, 6]. Таким образом, у мышей линии TAAR1-KO наблюдается значительное изменение активности моноаминергических и глутаматергических нейронных систем, что, по всей вероятности, может оказать влияние на скорость и эффективность обработки сенсорной информации и сказаться на параметрах слуховых ВП.
Настоящее исследование показало, что рецепторы TAAR1 играют важную роль в механизмах генерации слуховых ВП, поскольку у генномодифицированных животных существенно падает амплитуда компонента N40 слуховых ВП. Исследование роли системы следовых аминов и TAAR1 в процессе дозирования и фильтрации информации представляет интерес для понимания патогенеза некоторых нейропсихиатрических расстройств.
Список литературы
Millan MJ, Rivet JM, Gobert A (2016) The frontal cortex as a network hub controlling mood and cognition: Probing its neurochemical substrates for improved therapy of psychiatric and neurological disorders. J Psychopharmacol 30: 1099–1128. https://doi.org/10.1177/0269881116672342
Berry MD, Gainetdinov RR, Hoener MC, Shahid M (2017) Pharmacology of human trace amine-associated receptors: Therapeutic opportunities and challenges. Pharmacol Ther 180: 161–180. https://doi.org/10.1016/j.pharmthera.2017.07.002
Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, Durkin S, Zbinden KG, Norcross R, Meyer CA, Metzler V, Chaboz S, Ozmen L, Trube G, Pouzet B, Bettler B, Caron MG, Wettstein JG, Hoener MC (2011) TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity. Proc Natl Acad Sci USA 108: 8485–8490. https://doi.org/10.1073/pnas.1103029108
Lindemann L, Meyer CA, Jeanneau K, Bradaia A, Ozmen L, Bluethmann H, Bettler B, Wettstein JG, Borroni E, Moreau JL, Hoener MC (2008) Trace amine-associated receptor 1 modulates dopaminergic activity. J Pharmacol Exp Ther 324: 948–956. https://doi.org/10.1124/jpet.107.132647
Espinoza S, Lignani G, Caffino L, Maggi S, Sukhanov I, Leo D, Mus L, Emanuele M, Ronzitti G, Harmeier A, Medrihan L, Sotnikova TD, Chieregatti E, Hoener MC, Benfenati F, Tucci V, Fumagalli F, Gainetdinov RR (2015) TAAR1 Modulates Cortical Glutamate NMDA Receptor Function. Neuropsychopharmacology 40: 2217–2227. https://doi.org/10.1038/npp.2015.65
Sukhanov I, Caffino L, Efimova E V., Espinoza S, Sotnikova TD, Cervo L, Fumagalli F, Gainetdinov RR (2016) Increased context-dependent conditioning to amphetamine in mice lacking TAAR1. Pharmacol Res 103: 206–214. https://doi.org/10.1016/j.phrs.2015.11.002
Revel FG, Moreau JL, Pouzet B, Mory R, Bradaia A, Buchy D, Metzler V, Chaboz S, Groebke Zbinden K, Galley G, Norcross RD, Tuerck D, Bruns A, Morairty SR, Kilduff TS, Wallace TL, Risterucci C, Wettstein JG, Hoener MC (2013) A new perspective for schizophrenia: TAAR1 agonists reveal antipsychotic- and antidepressant-like activity, improve cognition and control body weight. Mol Psychiatry 18: 543–556. https://doi.org/10.1038/mp.2012.57
John J, Kukshal P, Bhatia T, Chowdari K V., Nimgaonkar VL, Deshpande SN, Thelma BK (2017) Possible role of rare variants in Trace amine associated receptor 1 in schizophrenia. Schizophr Res 189: 190–195. https://doi.org/10.1016/j.schres.2017.02.020
di Cara B, Maggio R, Aloisi G, Rivet JM, Lundius EG, Yoshitake T, Svenningsson P, Brocco M, Gobert A, de Groote L, Cistarelli L, Veiga S, de Montrion CD, Rodriguez M, Galizzi JP, Lockhart BP, Cogé F, Boutin JA, Vayer P, Verdouw PM, Groenink L, Millan MJ (2011) Genetic deletion of trace amine 1 receptors reveals their role in auto-inhibiting the actions of ecstasy (MDMA). J Neurosci 31: 16928–16940. https://doi.org/10.1523/JNEUROSCI.2502-11.2011
Dedic N, Jones PG, Hopkins SC, Lew R, Shao L, Campbell JE, Spear KL, Large TH, Campbell UC, Hanania T, Leahy E, Koblan KS (2019) SEP-363856, a novel psychotropic agent with a unique, non-D2 receptor mechanism of action. J Pharmacol Exp Ther 371: 1–14. https://doi.org/10.1124/jpet.119.260281
Koblan KS, Kent J, Hopkins SC, Krystal JH, Cheng H, Goldman R, Loebel A (2020) A Non–D2-Receptor-Binding Drug for the Treatment of Schizophrenia. N Engl J Med 382: 1497–1506. https://doi.org/10.1056/nejmoa1911772
Gainetdinov RR, Hoener MC, Berry MD (2018) Trace amines and their receptors. Pharmacol Rev 70: 549–620. https://doi.org/10.1124/pr.117.015305
Revel FG, Meyer CA, Bradaia A, Jeanneau K, Calcagno E, André CB, Haenggi M, Miss MT, Galley G, Norcross RD, Invernizzi RW, Wettstein JG, Moreau JL, Hoener MC (2012) Brain-specific overexpression of trace amine-associated receptor 1 alters monoaminergic neurotransmission and decreases sensitivity to amphetamine. Neuropsychopharmacology 37: 2580–2592. https://doi.org/10.1038/npp.2012.109
Rutigliano G, Accorroni A, Zucchi R (2018) The case for TAAR1 as a modulator of central nervous system function. Front Pharmacol 8: 987. https://doi.org/10.3389/fphar.2017.00987
Corripio I, Escartí MJ, Portella MJ, Pérez V, Grasa E, Sauras RB, Alonso A, Safont G, Camacho MV, Dueñas R, Arranz B, San L, Catafau AM, Carrió I, Álvarez E (2011) Density of striatal D2 receptors in untreated first-episode psychosis: an I 123-IBZM SPECT study. Eur Neuropsychopharmacol 21:861–866. https://doi.org/10.1016/j.euroneuro.2011.03.004
Полякова НВ, Виноградова ЕП, Александров АА, Гайнетдинов РР Преимпульсное торможение у мышей-нокаутов по TAAR1 рецептору. Рос физиол журн им И.М. Сеченова. 104(9): 1098–1105. 2018. [Polyakova NV, Vinogradova EP, Aleksandrov AA, Gainetdinov RR (2018) Prepulse inhibition in the TAAR1 knockout mice. Russ J Puysiol 104: 1098–1105. (In Russ)]. https://doi.org/10.1016/j.brainres.2011.04.010
Xia L, Wang D, Wang J, Xu H, Huo L, Tian Y, Dai Q, Wei S, Wang W, Zhang G, Du X, Jia Q, Zhu X, Wang L, Tang W, Zhang XY (2020) Association of cognitive and P50 suppression deficits in chronic patients with schizophrenia. Clin Neurophysiol 131: 725–733. https://doi.org/10.1016/j.clinph.2019.12.405
Javitt DC, Freedman R (2015) Sensory processing dysfunction in the personal experience and neuronal machinery of schizophrenia. Am J Psychiatry 172: 17–31. https://doi.org/10.1176/appi.ajp.2014.13121691
Adler LE, Pachtman E, Franks RD, Pecevich M, Waldo MC, Freedman R (1982) Neurophysiological evidence for a defect in neuronal mechanisms involved in sensory gating in schizophrenia. Biol Psychiatry 17(6): 639–654.
Karkal R, Goyal N, Tikka SK, Khanande R V., Kakunje A, Khess CRJ (2018) Sensory gating deficits and their clinical correlates in drug-free/drug-naive patients with schizophrenia. Indian J Psychol Med 40: 247–256. https://doi.org/10.4103/IJPSYM.IJPSYM_53_18
Martin LF, Hall MH, Ross RG, Zerbe G, Freedman R, Olincy A (2007) Physiology of schizophrenia, bipolar disorder, and schizoaffective disorder. Am J Psychiatry 164(12): 1900–1996. https://doi.org/10.1176/appi.ajp.2007.06010017
Stewart LP, White PM (2008) Sensory filtering phenomenology in PTSD. Depress Anxiety 25(1): 38–45. https://doi.org/10.1002/da.20255
Freedman R, Waldo M, Bickford-Wimer P, Nagamoto H (1991) Elementary neuronal dysfunctions in schizophrenia. Schizophr Res 4:233–243. https://doi.org/10.1016/0920-9964(91)90035-P
Aleksandrov AA, Dmitrieva ES, Volnova AB, Knyazeva VM, Polyakova NV, Ptukha MA, Gainetdinov RR (2019) Effect of alpha-NETA on auditory event related potentials in sensory gating study paradigm in mice. Neurosci Lett 712: 134470. https://doi.org/10.1016/j.neulet.2019.134470
Roger C, Hasbroucq T, Rabat A, Vidal F, Burle B (2009) Neurophysics of temporal discrimination in the rat: A mismatch negativity study. Psychophysiology 46: 1028–1032. https://doi.org/10.1111/j.1469-8986.2009.00840.x
Rentzsch J, Jockers-Scherübl MC, Boutros NN, Gallinat J (2008) Test-retest reliability of P50, N100 and P200 auditory sensory gating in healthy subjects. Int J Psychophysiol 67: 81–90. https://doi.org/10.1016/j.ijpsycho.2007.10.006
Mears RP, Klein AC, Cromwell HC. (2006) Auditory inhibitory gating in medial pre-frontal cortex: Single unit and local field potential analysis. Neuroscience 141 (1): 47–65. https://doi.org/10.1016/j.neuroscience.2006.03.040
Boutros NN, Korzyukov O, Jansen B, Feingold A, Bell M (2004) Sensory gating deficits during the mid-latency phase of information processing in medicated schizophrenia patients. Psychiatry Res 126: 203–215. https://doi.org/10.1016/j.psychres.2004.01.007
Clementz BA, Blumenfeld LD, Cobb S (1997) The gamma band response may account for poor P50 suppression in schizophrenia. Neuroreport 8: 3889–3893. https://doi.org/10.1097/00001756-199712220-00010
Freedman R, Adler LE, Waldo MC, Pachtman E, Franks RD (1983). Neurophysiological evidence for a defect in inhibitory pathways in schizophrenia: comparison of medicated and drug-free patients. Biol Psychiatry 18 (5): 537–551.
Freedman R, Adler LE, Gerhardt GA, Waldo M, Baker N, Rose GM, Drebing C, Nagamoto H, Bickford-Wimer P, Franks R (1987) Neurobiological studies of sensory gating in schizophrenia. Schizophr Bull 13 (4): 669–678. https://doi.org/10.1093/schbul/13.4.669
Miller GM (2011) The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity. J Neurochem 116(2): 164–176. https://doi.org/10.1111/j.1471-4159.2010.07109.x
Espinoza S, Ghisi V, Emanuele M, Leo D, Sukhanov I, Sotnikova TD, Chieregatti E, Gainetdinov RR (2015) Postsynaptic D2 dopamine receptor supersensitivity in the striatum of mice lacking TAAR1. Neuropharmacology 93:308–313. https://doi.org/10.1016/j.neuropharm.2015.02.010
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


